Method Article
Изменение ролик трубки метод для точно локализованы и повторяющиеся прерывистый изображений во время долгосрочного культуры срезы мозга в замкнутой системе
* Эти авторы внесли равный вклад
В этой статье
Резюме
Представлены здесь метод трубки модифицированных ролика для культивирования и прерывистый с высоким разрешением изображений грызунов мозга ломтики в течение многих недель с точное перемещение на photoetched coverslips. Нейрональных жизнеспособность и морфология срез хорошо поддерживаются. Приложения полностью замкнутой системы с использованием вирусов для конкретного выражения типа клеток предоставляются.
Аннотация
Искусственный мозг грызунов фрагменты полезны для изучения поведения клеточном и молекулярном нейронов и глии в среде, которая поддерживает многие из их обычной в естественных условиях взаимодействия. Фрагментов, полученных от различных линий трансгенные мыши или использование вирусных векторов для выражения дневно тегами белки или Репортеры в срезах мозга дикого типа позволяют с высоким разрешением изображений по микроскопии флуоресцирования. Хотя несколько методов были разработаны для визуализации мозга ломтиками, объединяя культуры срез с возможностью выполнения повторяющихся с высоким разрешением изображений конкретных клеток в живых фрагменты течение длительного времени создает проблемы. Это особенно верно, когда вирусных векторов используются для выражения экзогенных белков, так как лучше всего это делается в замкнутой системе для защиты пользователей и предотвращения перекрестного загрязнения. Как сообщается, простые изменения, внесенные метод культуры фрагмента ролика трубки мозга, которые позволяют для повторяющихся с высоким разрешением изображения срезов в течение многих недель в замкнутой системе. Культивирование срезы на photoetched coverslips позволяет использовать величинам точно и быстро переместить на сцену, чтобы идентичные поле изображения со временем до и после различных методов лечения. Для использования этого метода в сочетании с специфического окрашивания нейронов и выражение наблюдать изменения в архитектуре гиппокампа срез, вирусный опосредованной нейрональных выражение флуоресцентных белков и развития Кофилин патологии, приводятся примеры которая ранее наблюдалось в гиппокампе болезни Альцгеймера (AD) в ответ на лечение срез с олигомеров пептида амилоид β (значения).
Введение
Первичной культуре диссоциированных нейронов из регионов грызунов мозга является важным инструментом, используемым исследователями наблюдать ответы на патологически замешан раздражителей. Однако такие исследования имеют недостаток глядя на нейроны в только 2D и без их глиальных системы поддержки. Кроме того если выросли в условиях очень высокой плотности (640 нейронов/мм2 или около 16% от площади поверхности), в которой она становится невозможным следовать случайных нарост дендритов или аксона для более чем на расстоянии короткой прогулки от его клетки тела, гиппокампа нейрональных жизнеспособность более 4 недель значительно снижается1, ограничивая использование диссоциированных культур для расширенного исследования возрастных патологий. Культивирование ломтиками, приготовленный из грызунов мозга является привлекательным вариантом, который преодолевает эти ограничения, поддерживая организованной клеток архитектуры и жизнеспособности для недель или месяцев. Условия для поддержания многих различных регионах грызунов мозга в ломтик культуры были описаны2.
Две основные методы широко используются для долгосрочных культуры срезы мозга: культивирования на мембраны на интерфейс воздуха жидкость3 или культивирования на coverslips в герметичных труб допускается для поворота в инкубаторе ролика предоставлять аэрации4. Ломтики, культивируемых на мембраны может быть непосредственно imaged с высоким разрешением флуоресцентной микроскопии с помощью вертикально микроскоп и воды погружение цели5. Кроме того фрагменты, культивируемых на мембраны были переданы стекла дно блюда для достижения хорошего разрешения с помощью инвертированного микроскопа6дендритных шипиков. Однако оба метода визуализации ломтиками, выращенных на мембраны являются открытые системы, которые требуют среднего изменения и часто используют антибиотики или противогрибковые для предотвращения или уменьшения загрязнения5,6. Ломтики на мембрану в воздушной среде интерфейса поддерживают отличные морфологии и выживания, но возвращение в строго определенные места во время повторяющихся изображений с высоким увеличением является чрезвычайно сложной, если эксперимент следит только небольшие группы клеток выражая флуоресцентных маркеров. Хотя ломтиками, выращенных на мембраны были использованы с вирусный опосредованной выражением трансгенов5,6, протоколы биобезопасности может потребовать систему закрытых культуры использоваться для некоторых вирусных векторов, которые используются для выражая дневно tagged белков и Репортеры физиологии клетки. Кроме того погружение цели требуют очистки между образцами, последовавших в культуре5. Один из основных приложений мембраны интерфейс культур является объединение с высоким разрешением изображения с электрофизиологии на один раз точки7.
Метод трубки ролик с coverslips внутри пластиковой трубки не разрешают любой электрофизиологии или высоким разрешением изображений без удаления coverslip. Таким образом этот метод чаще всего применяется для долгосрочных исследований, в которых после фиксации замечания были сделаны8. Описанные здесь является метод, который использует техника культура трубки ролика, но на пробуренных из трубы с кусочками на coverslips, которые могут быть многократно imaged для покуда культуры сохраняются. Замкнутые системы требует не среднего изменения для обработки изображений и использует photoetched coverslips предоставлять величинам, которые позволяют изображений с высоким увеличением, дней или недель, точные ранее отображаемого поля.
Мы применяем этот метод для изучения изменений в грызунов гиппокампа, основных мозга региона, участвующих в память и обучение. Грызунов гиппокампа часто рассматривается как модель для патологических или возрастные изменения, наблюдаемые в ходе развития когнитивных нарушений9, например те, которые происходят в AD. Наш метод особенно хорошо подходит для изучения патологические изменения, которые развиваются в один срез с течением времени в ответ на экологические изменения, такие как увеличение значения пептиды, который является характеристикой AD8. Один патологии, связанные с AD мозга человека и грызунов является наличие Кофилин актина агрегатов и стержней, последний содержащие пучки нитей в котором Кофилин и актина находятся в молярное соотношение 1:110,11, 12. стержни наблюдались в фиксированных срезах гиппокампа крысы, после Aβ лечения, а также в пределах кусочек живой грызунов мозга выразив Кофилин GFP подвержены гипоксии8, и они могут способствовать синаптических дисфункции, видели в AD и инсульта. Здесь мы используем этот новый метод культивирования соблюдать время курс и распределения в рамках ломтики выраженной экзогенных химерных флуоресцентных белков, представленный различных вирусов. Затем мы используем нейрональных конкретное выражение конструкцию репортер Кофилин следить за развитием Кофилин стержня и совокупных патологии в срезах гиппокампа в ответ на лечение с растворимых значения олигомеров (oAβ).
протокол
Использование животных следует утвержденным селекции и протоколы использования животных, которые соответствуют животное уход и использовать руководящие принципы из университета штата Колорадо.
Примечание: Ниже протокол описывает метод подготовки и культуры для долгосрочной инкубации и прерывистый изображений гиппокампа фрагментов. Один срез гиппокампа прикрепляется к специально подготовленные photoetched coverslip с помощью сгусток плазмы, и затем опечатаны coverslips на плоской стороне трубки пробуренных из ролика, который поддерживается в инкубаторе ролика. Сгустки плазмы растворяются с плазмин до вирусной инфекции для флуоресцентных белков и высоким разрешением изображений. Флуоресцентный нейрональных жизненно краска используется для изображения нейронов в ломтики.
1. Подготовка трубы стойки роликовые
- Использовать шаблон, показанный на рисунке 1A напечатаны на размер, показаны на панели шкалы. С гвоздем Пробейте небольшие отверстия (достаточно большой для маркера точки штраф) в шаблоне, сосредоточены на отверстия.
- Установить шаблон в нижней части ткани культуры блюдо 15 см (номинальный диаметр 14 см) и отметьте положение отверстий. Повторите эту процедуру на второе блюдо.
- С сверла предназначены для использования на пластик просверлите шесть отверстий диаметром 1,5 см на каждое блюдо в массив гексагональной (4,8 см-для центр) с центрами отверстия 2,5 см от края блюдо. Просверлите три (3 мм в диаметре) 12 мм от края, поместивший расстоянии между двумя из больших отверстий, как показано на рисунке 1A.
- С днища каждое блюдо лицом друг к другу, место 2,5 дюймовый длинный крепежный винт (диаметр 3/16 дюйма) с шайбу через один из маленьких отверстий, последовал второй шайбу, кусок полиэтилена трубы (распорка, 4,7 см), другой плоская шайба , второе блюдо культуры ткани, другой плоская шайба, стопорной шайбой и гайкой.
- Повторите шаг 1.4 на два крепежных винтов и ужесточение лишь условно, до тех пор, пока все машины винты находятся в месте. Затем надежно затяните гайки.
- Работа прокладки (5/16 дюйма толщиной, диаметр отверстия 5/8 дюйма) в отверстия нижней блюдо для получения окончательного ролик трубки стойки (Рисунок 1B; показано две трубы в месте). Поместите наклейку на каждой стойке с уникальным номером.
2. Подготовка прямошовных труб и Coverslips
- Создание джиг для отверстий в прямошовных труб
- Просверлите отверстие 1,5 см глубиной 8 см в сторону центра 2 x 4 x 5,5 дюйма деревянный блок под углом такие плоская сторона вала трубки будет быть почти параллельно с блока при вставке (рисA).
- Увеличить отверстие с помощью круглой древесины файла как расширить, так и конусность отверстия, чтобы позволить трубки вставки (прямошовных труб немного больше в диаметре в конце колпачок) (рис. 2B).
- Просверлить вертикальное отверстие диаметром 1,5 см, 5,5 см со стороны блока и по центру над отверстие сбоку (рис. 2C).
- Когда отверстие сбоку конические достаточно, вставьте ролик трубка, которая помечена на желаемом месте, в центре отверстие для фрагмента и Расположите трубку отмеченные места центрируется в вертикальное отверстие 1,5 см.
- Снять трубку и измерить расстояние от места до конца трубки. Марк это расстояние от центра отверстия в джиг и вставьте гвоздь предоставлять остановить, чтобы правильно расположить трубы для бурения (стрелка на рис. 2C).
- Используйте ножовку с обрезают вровень с поверхностью древесины блока для предотвращения травмы ногтей.
- Добавьте весной клипы на дно джиг, если есть что сверлильный с разъемами, которые позволяют ему быть якорь (Рисунок 2D черная стрелка). В противном случае используйте струбцины провести джиг надежно на буровых печати.
- С помощью Джига описанные выше держать и Расположите трубку пластиковые культуры плоские двухсторонние 11 см с плоской стороной вверх(рис. 2), просверлить отверстие диаметром 6 мм с центром 1,0 см от дна и по центру между сторонами трубки.
Примечание: Следует использовать сверло для пластика. - С поворота для снятия заусенцев инструментом, сгладить края отверстия (рис. 2E) и сделать 4 пазами на внутренней стороне края отверстия (рис. 2E, вставкой) для облегчения слива отверстия во время вращения.
- С отверстием 12 мм удар, отрезные диски диаметром 12 мм из нетоксичных двойной Двусторонняя клей кремния резиновые листы. Используя стандартный одной бумаги Дырокол (диаметром 6 мм), сделайте отверстие в центре каждого диска.
- Промойте просверленные трубки с 70% этиловом спирте, воздух сухой их в шкаф, биологической безопасности и стерилизации труб и кулаками клей диски для 40 мин под УФ-лампа (30 Вт в среднем расстоянии 70 см) в биологической безопасности кабинета.
- Переместите трубы и дисков после 20 мин, чтобы все поверхности подвергаются стерилизации. В стерильных условиях шелушиться белый, бэк от клей диск и прикреплять силиконовой резины к наружной трубки, совместив отверстия (рис. 2F).
Предупреждение: Чтобы избежать воздействия УФ, носить для защиты глаз и закрыть кабинет перед включением в УФ-лампе. - Очистите 12 мм диаметр photoetched (100 квадратов центр пронумерованы 1 мм) немецкий стекла coverslips. Аккуратно возьмите coverslips пинцетом и окунуться в абсолютного этанола, следуют водой, следуют абсолютного этанола снова и наконец падение coverslips в пламя, чтобы сжечь этанола. Разрешить coverslips остыть.
- Проведение coverslips пинцетом, окунуться в 2% 3-aminopropyltriethoxysilane в ацетон для 10 s. промыть coverslips с ультрачистая вода и дайте высохнуть на воздухе.
- Установите coverslips на стерильную фильтр-бумаги внутри биологической безопасности кабинета и включите УФ света. Предоставления каждой стороне coverslips на 20 мин.
Предупреждение: Чтобы избежать воздействия УФ, носить для защиты глаз и закрыть кабинет перед включением в УФ-лампе.
3. гиппокампа ломтик подготовка
- Перед началом рассечение, подготовьте половинки обоюдоострый лезвия для измельчителя ткани. Сложите лопасти вдоль тщательно с пальцами и оснастки в два раза.
- Промойте лезвие половинки с ацетоном, используя ватный тампон для их, следуют промывка в абсолютного этанола очистки и осушки воздуха.
Примечание: Протокол культуры срез мозга независима от мыши или крысы штамм или генотипа. Были использованы многие трансгенные мыши линии с генетическими различиями.
- Пинцетом прижмите подстриженные мозга задней стороной вверх и вентральной стороне стороне Петри для стабильности. Аккуратно дразнить прочь мозговых оболочек вокруг сагиттальной срединной и удаление ткани мозга с помощью тонкой наконечником щипцы Дюмон #5 (рис. 3C, пунктирной окружности).
- Сделайте два надреза вдоль стороны мозга для распространения его открытым (рис. 3C, пунктирные линии). После установки мозг дорсальной стороне вниз и спреда открытое, гиппокампа трещины должны быть видны (рис. 3D, стрелка).
- Передать кусок пластиковой пленки полихлортрифторэтилена открытых мозг спред и расположите его для нарезки на сцене измельчитель ткани. Мокрый лезвие с GBSS/глюкозы и нарезать ломтиками толщиной ~ 300 мкм гиппокампа.
- С передача пипетки флеш нарезанный мозга от пластиковой пленки в блюдо свежих 60 мм, содержащие GBSS/глюкозы (рис. 3E). Аккуратно щепотка покинуть и дразнить, с тонкой наконечником щипцы, оставшиеся мозговых оболочек и других не гиппокампа ткани (рис. 3F) от срезы (рис. 3G, H).
4. обшивка ломтиками
- После того, как были получены фрагменты, место 2 мкл плазмы курица на центре photoetched стороны готовы coverslip. Распространение плазмы слегка добиться пятно диаметром 3-4 мм.
Примечание: Photoetched сторона является верхней стороне coverslip при просмотре через микроскоп рассечение, таким образом, чтобы правильно ориентированы чисел. - Передача 1 ломтик мозга с стерильных УЗК наконечник шпателем (рис. 4A) плазмы место (рис. 4B). Используйте закрытый щипцы сохранить фрагмент на кончик шпатель во время подъема фрагмент из глюкозы GBSS.
- Touch шпатель для плазмы, пятно на coverslip и с закрытыми щипцами, вставьте фрагмент на coverslip.
- Mix 2.5 мкл плазмы с 2,5 мкл тромбина в отдельном трубку. Быстро место 2,5 мкл этой смеси над и вокруг фрагмента и пипетки вверх и вниз осторожно смешать его (рис. 4B).
Примечание: Плазма будет сгустка в течение 10-15 сек, так что это должно быть сделано быстро. Если срез адгезии является проблемой, смешать 5 мкл плазмы с 5 мкл тромбина и использовать 4-5 мкл на срез, удаление некоторых после смешивания так что срез лежит плашмя на coverslip. - Удаление прозрачного пластика, охватывающих со стороны подвергаются силиконовый резиновый клей, ранее прикреплены к трубке ролик и место coverslip с срез мозга на клей, совместив срез в отверстие (рис. 4C).
- Для обеспечения адгезии, давление мягкий, даже для coverslip пальцем, нажав coverslip равномерно и удерживая его для около 1 мин передачи его в биологической безопасности кабинета.
- В биологической безопасности кабинета добавьте 0,8 мл полного Neurobasal A питательной среды (Таблица материалов) к каждой трубе (рис. 4D).
- Поток 5% CO2/95% воздушной смеси через стерильную хлопок подключен Пастер пипеткой надежно удерживается на струбцине. Флеш ролик трубка с газовой смеси и быстро крышка трубки, как он снимается с вокруг пипеткой.
- Этикетке трубки с номер слайса и рейки номер. Вставьте трубки в роликовых стойки, гарантируя они геометрически сбалансированы. Если есть нечетное количество трубок, добавьте трубы для баланса.
- Место стойки в инкубаторе ролик 35 ° C с роликами, поворачивая стойки роликовые на о 10-13 RPH (Рисунок 4E). Чтобы средство в нижней части трубы, наклон инкубатора обратно примерно 5° путем повышения его фронта на доске.
- Введите номер фрагмента и трубка на электронную таблицу, которая используется для записи всей информации ломтик процедуры и сроки наблюдения.
- На приблизительно 6 день в культуре, добавить 1 мкл (0,002 U) активных плазмин каждой трубы.
- После растворения сгустков (обычно в течение нескольких часов), удалите среды и замените свежей среды без плазмин. При необходимости, ломтики можно инкубировали с плазмина на ночь и среднего изменено на следующий день.
- Ломтики инкубируют обычно по крайней мере 7-10 дней перед использованием в экспериментах. Аспирационная среднего и заменить его на день 3 или 4, снова на 7 день и раз в 7 дней.
5. Подготовка вирусных векторов выражения трансген
Примечание: Выражение трансгенов в нейронах ломтик культур достигается либо с помощью мозги от генетически грызунов или представляя трансген инфекции с рекомбинантным репликации вирусов и несовершенным.Аденовирусов (AV), аденоассоциированный вирусов (ААВ) и векторов рекомбинантных человека были использованы в наших культурах гиппокампа срез для выражения различных флуоресцентный белок химер в срезах головного мозга.
- Подготовка репликации, несовершенным AV для выражения РНК интерес согласно методов описанных в других13,14. Титр вирусов для инфекционных ед/мл методом последовательного разрежения с использованием антитела вирусно выраженной белка как описано14. Соблюдать Кофилин агрегатов и формирования стержень Кофилин актина, используют cDNA Кофилин R21Q-mRFP (плазмида #51279)16.
Примечание: Синапсин 1 промоутер является отличным выбором для нейронов конкретное выражение15, тогда как промоутер цитомегаловирус полезен для вождения уровни высокой выражения в много типов клетки13. - Подготовьте AAV, Сопредседатель трансфекции передачи плазмида, содержащие ген интереса и рэп/cap плазмида, с или без вспомогательной плазмида, в HEK293 упаковка клетки, которые поставляют вирусный E1 генов, как было описано выше17,18.
Примечание: Рекомбинантных AAV можно также для целевых вставки в геном клетки принимающей19. Для передачи плазмида мы используем человека Кофилин 1 тегом C-терминала mRFP1 флуоресценции белков (плазмида #50856) клонирован в Синапсин промоутер содержащих AAV плазмиду вниз по течению от датчика GCaMP5G кальция20. Кусок ДНК кодирования P2A последовательность самостоятельно расщепления пептидов вставляется методом ПЦР между GCaMP5G и Кофилин ППП в ходе подготовки передачи плазмида предоставлять выражение обоих белков из одного AAV Стенограмма21. - Подготовить рекомбинантных человека векторов, Сопредседатель трансфекции плазмида передачи, содержащие ген или cDNA сигналов интерес и интеграции, наряду с человека третьего поколения, упаковка смесь, которая делит вирусный кляп, ГСМ, rev и гены vsv-g на три отдельных плазмид22,23.
- Для передачи плазмида чтобы собрать Синапсин промоутер и cDNA Кофилин R21Q-mRFP (от плазмида #51279) в pLKO.1-GFP (плазмида #30323), с Синапсин промоутер и Кофилин R21Q-mRFP, заменив hPGK используйте один шаг клонирования системы24 промоутер и GFP cDNA, соответственно.
- Transfect окончательный плазмида в HEK293T клетки, фосфат кальция как описано23.
- Собирать среднего из четырех блюд 10 см, сосредоточиться на 500 мкл, используя 150K-среза Центробежные концентраторы и храните окончательный человека-80 ° c в небольших аликвоты после быстрое замораживание в жидком азоте. Оттепель аликвота только один раз для заражения клеток.
- Определите эмпирически, объем каждого типа вируса готовы достичь степени выражения желаемого путем создания ряда культур различных фрагментов следовать выражение трансгенов после инфекции с различными объемами вируса.
Примечание: Как правило, 1-10 мкл вируса используется на срез.
6. фрагмент лечения
- Заражение ломтики с вирусом
- Работая в биологической безопасности кабинет одобрил для работы вирус на уровне биологической безопасности для вектора, смешайте с 0,8 мл полной среды Алиготе вируса (обычно 1-10 мкл).
- Аспирационная среднего из фрагмента, используя стерильные пипетки Пастера в ловушку коллекции, содержащие отбеливатель. Вторичные ловушка всегда используется между Первая ловушка и источник вакуума.
- Замените этот носитель вируса содержащих Алиготе, подготовленный выше, возвращение культуры трубы к стойке и место в инкубаторе.
- После 2-5 дней инкубации срезов с вирусом в биологической безопасности кабинета удалить вирус содержащих среды с стерильных передачи пипетки и поместите его в бутылку, содержащий утвержденные противовирусное средство убить вирус.
- Пятнать нейронов жизненно краской
- Готовить и хранить аликвоты Люминесцентную краску нейрональных жизненно25 быстрого замораживания 4 мкл аликвоты в жидком азоте в концентрации 100 мкм и хранить эти при-20 ° C. Не замораживания/оттаивания краситель более одного раза.
- Для обозначения нейронов для визуализации по микроскопии флуоресцирования, размораживать один Алиготе нейрональных жизненно красителя и разбавляют до 4 мл в полной Neurobasal среднего (окончательный краситель концентрация составляет 100 Нм).
- Удалите носитель из кусочков аспирации (или с передачи пипетки, если среда содержит вирус) и заменить его с 0,8 мл среды, содержащие 100 Нм нейрональных жизненно красителя. Возвращение фрагментов в ролик аппарат в инкубаторе.
- После инкубации срезов для 2 h, аспирационная краситель содержащих среднего и заменить его с 0,8 мл свежего полной среды в биологической безопасности кабинета.
Примечание: Маркировки нейронов в ломтики с жизненно краска требует нескольких часов инкубации. Первые изображения обычно принимаются 24 часа после лечения красителя. Хотя специально помечены нейронов, есть фон флуоресценции, который отказывается дать лучше нейрональных изображений более чем 2-3 дней. Интенсивность жизненно краски падает после 72 ч. - Чтобы следовать изменения в морфологии фрагмент со временем, переименовали ломтики каждые 7 дней.
7. фрагмент изображения
- Просмотр фрагментов на инвертированным микроскопом. Для ярких изображений флуоресценции, на 24 ч до изображений, Обмен питательной среды с полной Neurobasal A средних без фенола Красного pH индикатор.
Примечание: Для экспериментов, сообщили здесь, фрагменты рассматриваются на Перевернутый спиннинг диск конфокальный флуоресценции микроскоп с линейной кодировке x, y сцену с пьезо z управления и чувствительной цифровой камеры с высоким разрешением. - Передать трубку с ломтик культуры к записи образа из ролика трубку аппарата для держателя на заказ трубки (рис. 5A), который находится в стадии адаптер (рис. 5B), чтобы сохранить coverslip перпендикулярно Цель и сохранить фрагмент в ту же ориентацию во время повторяющихся изображений сессий более длинные интервалы.
- Нажмите бегунок на стадии адаптер плотно против трубки держать трубку в положении (рис. 5B).
Примечание: Детали держателя трубки, этап адаптер, и нагреватель можно получить по адресу: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/.
Примечание: Эти позиции-набор из координатных Марк позволяют последовательно выявлением в том же месте coverslip когда imaged срез, даже несмотря на то, что оригинальный x, y параметра фидуциальный марки изменения когда адаптер трубки или стадии удаляются и вместо.
Примечание: Обычно плоскостей изображения получаются с интервалом 0,5 мкм до 2 мкм, в зависимости от размер и разрешение изображения функций. Строительство качество 3D изображение требует, чтобы функции изображения продлить на несколько плоскостей приобретения, и так визуализировать меньше функций, небольшие интервалы между плоскостями.
Примечание: Большинство тепловизионных сессий сообщили здесь под 18 мин/срез. Однако, мы imaged некоторые фрагменты десять или более раз и даже как долго как 40 мин в одной сессии, без явного вреда в долгосрочное выживание фрагмента.
Результаты
Чтобы определить, насколько точно могут быть использованы отсчета к reimage же клеток в тех же областях с течением времени, мы рассмотрели ломтиками, выращенных на photoetched coverslips(рис. 6). Нейроны были визуализированы пятнать с краской жизненно (100 Нм 2 h; не пятно не нейрональные клетки), которое исчезает из нейронов со временем не повреждая клетки25. Мы определили фидуциальный Марк в одной сетки (Рисунок 6A, B), нашел регионе жизненно важных краситель меченых нейронов 24 ч после маркировки, записанная x и y смещение позиции от фидуциальный Марк (Рисунок 6B) и собраны, Использование 60 X цели, стеки конфокальное изображение этого региона, повторяя изображений на 4 дней подряд. Максимальная проекции изображения 30 мкм стека изображений, принятых в том же месте показываются (C-Fрис. 6). Хотя некоторые морфологические изменения происходят в пределах региона за 4 дня, идентичных клеток, (некоторые из которых отмечены) может следовать со временем. Интенсивность флуоресценции жизненно краситель снизилась с течением времени, но нейроны были по-прежнему четко идентифицировать 4 дней после маркировки. Хотя большинство нейронов жизненно краситель флуоресценции диффузных в цитоплазме, некоторые пунктата пятнать всегда отмечалось, который стал более заметным как фон флуоресценции сократилось. В нездоровой ломтиками пунктата окрашивания не нейрональных клеток было также отмечено как ломтики ухудшилось. Эти результаты показывают, что определенные клетки в ломтики можно многократно образы с помощью отсчета, чтобы найти их.
Для изучения зависящих от времени изменения в нейрональных Организации и жизнеспособности в рамках фрагменты во время долгосрочного культуры, мы следовали же фрагменты более 5 недель, маркировка краской флуоресцентные нейрональных жизненно один раз в неделю 24 часа до изображений. Несколько раундов окрашивания с этой жизненно важной краску в течение нескольких недель увеличена накопления агрегатов. Нейронов в пределах свежезаваренным позолоченные фрагменты, которые были еще в сгустки плазмы были загружены с красителем и отражаться на один день в пробирке (1 DIV). Же фрагменты были образы снова неделю за 5 недель. Изображения, полученные с ломтиком одной с целью 4 x показываются (Рисунок 7A-E). Слои пирамидальной клетке CA и ГД регионов ярко помечены при возбуждении в 488 нм и флуоресценции выбросов, измеряемых в > 620 Нм. В течение 5-недельного наблюдения 19 ломтиками, три ломтика сошел coverslip и две другие потеряли их типичной морфологии и стало непрозрачным, указание их смерти. Таким образом должны рассматриваться выживаемость около 70% для экспериментов, и дополнительных фрагментов готовы обеспечить достаточное количество для анализа. Ломтики были подготовлены номинальная толщина параметр на измельчитель ткани 300 мкм. После 5 недель в культуре мы измерить толшины нейрональных изображений жизненно краситель витражи фрагменты от coverslip вверх через срез с 40 X нефти цель на вращающийся диск конфокального микроскопа. Потеря фокуса нейронов в среднем 257 Нм (n = 5 ломтиков с нескольких мест, используемых на ломтик), демонстрируя, что очень мало истончение срез имели место с момента обшивки. Мы могли бы не точно измерить толщину среза по микроскопии флуоресцирования во время покрытие потому что жизненно краситель, захваченного в сгусток плазмы дал диффузных флуоресценции, что делает его трудно точно оценить положение, в котором произошла потеря фокуса. Однако 3D изображения нейронов в ломтики легко получаются в ломтики после удаления сгусток плазмы. 21 DIV срез, показано на низкий масштаб изображения в Рисунок 7F, был образ с 60 X цель на конфокального микроскопа (шаги 1 мкм) 3 дня после загрузки с нейронов жизненно красителем. 3D изображения 60 мкм был построен в фокальной плоскости (рис. 7G). Нейронов и их neurite процессы, которые помечены с жизненно краситель может следовать в 3D. Морфология и 3D структура ломтики были ухоженный по крайней мере 3 месяцев, и длинный раз были использованы в рамках нынешнего исследования.
Также произошли крупные изменения в морфологии ранее образ позиции в некоторых фрагментов, предполагая, что движение на coverslip фрагмент может иметь место. Конечно через более длительные интервалы между изображений стало сложнее знать с уверенностью, что клетки в поле изображаемого были идентичны тем, что наблюдается в предыдущих сессиях изображений. Таким образом максимальная проекции изображения конфокальный стеков жизненно важных краска ярлык ломтиками, приобретенных в идентичных месте с целью 60 x недельные интервалы, охватывающих 4 недели (рис. 8) показывают, что нейрональных жизнеспособность хорошо поддерживается, но что это трудно определить конкретный нейрон со временем, когда изображения, полученные с длинные интервалы времени между сессиями. Предположительно шаблон клеток с несколькими флуорофоров бы более легко узнаваемый, как клетки в локализованных групп когда наблюдали scrolling через стек изображений.
Чтобы оценить полезность различных вирусных векторов для введения экзогенных генов в Нейроны гиппокампа ломтиками, мы сравнили инфективности фрагмента с помощью AV, Аав и рекомбинантного лентивирусные векторы, каждого выражения различных флуоресцентные метки или с помощью различные промоутеры диск выражение. AV (2 x 10-7 инфекционных U/ломтик) выражая Кофилин mRFP за сильный, -клеток конкретных ЦМВ промоутер был использован для заражения мыши гиппокампа срез, который был искусственный 9 недель на coverslips. Выражение Кофилин mRFP было найдено на протяжении срез на 5 дней после инфицирования, с выражением самых интенсивных по периметру срез, как заметил с целью 4 x (рис. 9А). Клетки внутри фрагмента, выражая Кофилин mRFP также наблюдались с 20 X цель (Рисунок 9B) с некоторыми яркими пунктата окрашивание и также диффузного выражение в нейронах и не нейрональные клетки. После 17 недель в культуре (8 недель после инфекции) спонтанное Кофилин стержни сформировали в некоторых клетках, предположительно обусловлен гиперэкспрессия дикого типа Кофилин mRFP (рис. 9C)26,27.
Мы также показали, что AAV (1010 частиц) могут быть использованы для выражения в форме долек.Изображения срезов, инфицированных в 9 недель в культуре с AAV, в котором нейронов конкретной промоутера Синапсин управляло выражение GCaMP5-Кофилин mRFP с самостоятельной расщепления P2A пептид последовательности в компоновщик перевод polyprotein21, были захваченных 8 недель после заражения (17 недель в культуре). В нейронах, выражая Кофилин mRFP и GCaMP5 некоторые Кофилин стержни/агрегаты сформирован (Рисунок 9D-F). Интенсивности флуоресценции агрегатов стержней было настолько сильным, что очень мало флуоресценции диффузных Кофилин mRFP могут соблюдаться без полного насыщения и цветущие Кофилин флуоресценции изображения стержней. Спонтанное Кофилин стержней появляются в нейроны, в которых одичал тип Кофилин флуоресцентный белок химер были чрезмерно выраженная26,27, а также подчеркнул нейронов10. На основании титры аденовирус, которые определяются на основе инфективности14 и отсчеты частиц, используемые для определения титра AAV, около 100 до 500 раз выше числа частиц AAV необходимы для получения примерно же инфективности / выражение в форме долек, по сравнению с AV.
Следовать рекомбинантных человека опосредованной выражение флуоресцентных белков в ломтики, ломтики были инфицированы на 6 DIV с 1, 3, 10 и 30 мкл аликвоты рекомбинантных человека для нейронов конкретное выражение (Синапсин промоутер) Кофилин R21Q-mRFP, разработан как живой клетки изображений зонд для Кофилин актина стержень формирования16. Фрагменты были помечены нейрональных жизненно красителя на 11 DIV и отражаться в отдельных регионах для красителя и выражение Кофилин R21Q-mRFP на 12 и 14 DIV. Кусочек, инфицированных с 30 мкл Алиготе вируса не выжить для воображения, но тройные ломтики относились с других томов вирус показал дозозависимый выражение mRFP. На рисунке 10 показано изображения срезов, инфицированных с 1 мкл и 10 мкл человека на 6 и 8 дней после инфицирования. Несколько областей двух различных фрагментов были количественно для совместного пятнать нейронов с жизненно краска и mRFP выражения. На срезах, инфицированных с 1 мкл человека около 28% нейронов выразил mRFP на 6 дней после инфекции, повышение до 85% на 8 дней после инфицирования. На срезах, инфицированных с 10 мкл человека около 58% нейронов выразил mRFP на 6 дней после инфекции, повышение до 86% на 8 дней после инфицирования. Таким образом 1 мкл человека было достаточно для обеспечения широкой срез инфективности и нейрональных выражение 8 дней после инфицирования.
Чтобы продемонстрировать, что эта система культуры является полезным в следующих развития Кофилин патологии, ломтиками, инфицированных человека для выражения Кофилин R21Q-mRFP в нейронах остались необработанных или обработанных в различных концентрациях (1 мкм, 333 Нм и 100 Нм) от синтетические человека значения белок, который претерпел инкубации в форме олигомеров28. Результаты предыдущих исследований показали что синтетические значенияo побудить Кофилин актина стержней в до 25% диссоциированных нейронов гиппокампа29,30,31. Все три ломтика, относились с 1 мкм концентрация значения пришли свободные от coverslip в первые 24 ч, тогда как все транспортное средство рассматривается ломтиками (контроль) и те относились с 333 Нм и 100 Нм концентрации значения выжили в течение двух недель, которые они впоследствии. Были же сотовой регионов (СА1, CA3 и ГД) в ломтик относились с 100 Нм значенияo образы (60 x цель) в течение нескольких дней. Ломтики управления, которые были инфицированы на 6 DIV с человека для выражения синапсины приводом cofilinR21Q-mRFP имел диффузных клеточных mRFP выражение 15 DIV (рисA). Ломтики подвергается 100 Нм значенияo на 14 DIV и отражаться на 15 DIV показали, что распределение Кофилин R21Q-mRFP стали пунктата, появляясь в обоих стержня в форме структуры и агрегатов (Рисунок 11B). Эти структуры стал еще более заметную 6 дней после Aβ-терапии (Рисунок 11C, которая является той же области клеток как Рисунок 11B). Во многих местах богатые невритов где СОСМ нейрональные клетки отсутствуют (Рисунок 11D), пунктата и род как массивы cofilinR21Q-mRFP разработана (стрелки на рисунке 11C), похож на распределение Кофилин актина стержни ранее сообщалось в рамках невритов обработанные значения нейронов в культуре29,30,31. Таким образом этот новый метод для культивирования и наблюдения гиппокампа ломтики позволит пользователям легко определить долгосрочную жизнеспособность клеток в котором Кофилин агрегатов и форме стержней и обратимости патологии на различных стадиях развития и выполнения измерений доза реакция на реагенты, которые могут блокировать или обратить вспять формирования Кофилин патологии в более в естественных условиях-как клеточной организации.

Рисунок 1: Подготовка трубы стойки роликовые. (A) шаблон для маркировки отверстие позиции для бурения, 15 см тканевой культуры блюдо дно. Если рисунок напечатан на размер линейки шкалы показано, он может вырезать и используется для обозначения позиции на 15 см культуры блюдо для сверления отверстий показано. (B) завершено ролик трубки стойку с двумя трубками вставлены. Каждая стойка нумеруется на наклейке, легко видимый на верхней части стойки. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Подготовка прямошовных труб культуры. (A) фронт Посмотреть ролик трубки вставляется в jig на сверлильный станок для бурения из 6 мм отверстие в трубе. Пунктирная линия показывает положение плоской двухсторонний роликовый трубки в джиг. (B) конец джиг с трубки вставляется и просверлите отверстие в соответствие. Вид сверху (C) в отверстие в кондуктор для бурения, прямошовных труб с сверла 6 мм.Белая стрелка показывает положение отсечения ногтей, вставляются в качестве остановки для позиционирования трубы, и черный двойной линии для выравнивания бит. (D) Весна клипов (черная стрелка) установлен на дно джиг, чтобы надежно удерживайте его в положении, при бурении трубки. (.E) после того, как бурение, отверстие, края сглаживаются с инструментом для снятия заусенцев и пазы нарезаются на внутренней стороне отверстия (врезные шоу отверстие Просмотрели через микроскоп рассечение) для повышения средних слив из отверстия во время вращения трубы. (F) культуры трубку с отверстием, увязанные с отверстием в силиконовый резиновый клей, к которому будет прикреплен coverslip. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
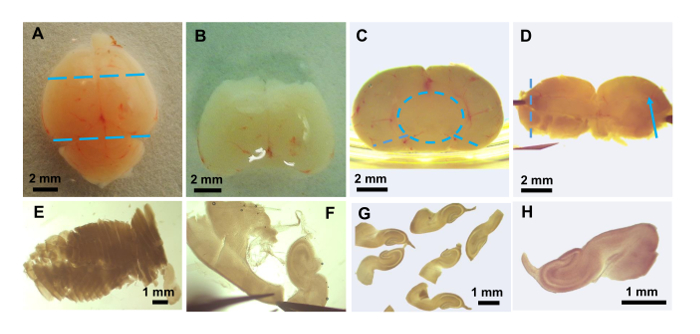
Рисунок 3: Подготовка фрагментов гиппокампа мозга. Фотографии, сделанные с показом рассечение микроскопа: (A) нетронутыми мыши мозга. Положение сокращений для удаления переднего мозга и мозжечке показываются как синие пунктирные линии. (B) после удаления переднего мозга и мозжечке. (C) часть мозга от B переворачивается 90 ° с задней региона (в сторону мозжечка) вверх. Позиционирование кусок рядом со стороны блюдо помогает с удалением мозга (синяя пунктирная круг), который может быть дразнили от оставшихся гиппокампа, таламуса и гипоталамуса. Два разреза с щипцами (синие пунктирные линии) позволяют оставшихся кусок, содержащие гиппокамп из обоих полушарий распространить плоской. (D) плоский мозга кусок показаны кровеносный сосуд, идущую вдоль гиппокампа трещина (синяя стрелка). Эта ткань на пленку и переданы ткани шинковка для нарезки в направлении пунктирной линии. (E) кусочки ткани, показаны чуть более половины гиппокампа после возвращения в GBSS/глюкозы. (F) окончательный рассечение гиппокампа и очистки из кусочков, чтобы удалить не гиппокампа материал. (G) несколько плавающие фрагменты после окончательной очистки. (H) расширенное фото один срез для передачи в coverslip. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Покрытие и инкубирования ломтиками. (A) A мыши гиппокампа фрагмент удаляется из культуры блюдо на кончике шпатель, используя кончик щипцы, чтобы помочь поднять его свободным от решения. (B) среза помещается квартиру в центре photoetched и лечение 12 мм coverslip по 2 мкл плазмы, курица и еще 2,5 мкл плазмы/тромбина 1:1 смесь добавляется для генерации сгусток. (.C) после установки сгусток (около 1-2 мин), покрытие удаляется из силиконовой резины клей круг на трубке ролик и coverslip позиционируется с сгусток, сосредоточены в отверстие; затем coverslip нажата в месте с пальца и удерживается в положении около 1 мин (D) добавить 0,8 мл полной питательной среды. (E) ролик трубки Держатели внутри большой ролик инкубатор с фронта, заданные для наклона 5 ° держать средства в нижней части трубы. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 5: Ролик Трубодержатель и стадии пластины инкубатор. (A) Трубодержатель, что позиции трубу таким образом, что coverslip поддерживается в позиции для воображения. (B) Трубодержатель монтируется в пластине адаптер Этап микроскопа. Ползунки на стороне провести трубка надежно для изображений. (C) этап адаптер с трубка держатель и боковые панели добавлены содержащие Отопление полоски, подключенных к контроллеру термоэлектрические. После того, как трубы монтируются и позиционируется, твердой верхней в поле можно добавить для поддержания температуры во время визуализации. Оранжевый провод является ведущим термопары. Планы на проектирование и строительство этап адаптер и нагреватель доступны на: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 6 : Использование точки отсчета для повторяющихся изображений же клеток. (A) гиппокампа слайс photoetched coverslip (квадрат 1 мм) с subiculum разворачивались (хвост) с 4 x объективной и светлые области освещения. Кривизны Трубы пластиковые роликовые помогает создать косой освещения, что повышает визуализации сетки. Поле показывает положение и размер 60 X поля. (B) представление же фрагмента с целью 20 x для нахождения фидуциальный Марк как подсказки в нижней части 4 от площади 34. Показано, что смещения x и y можно воспроизвести Найдите центр требуемое поле для выше увеличение конфокальная томография. (FC–) Ломтик помечены нейрональных жизненно краситель, который 13 DIV был воспроизведен образ с помощью 60 x цели и сделать 30 мкм проекция изображения на 4 дней подряд (14-17 DIV). Идентичные нейроны были образы каждый день. Положение ядра в каждой из трех нейронов помечен с другой символ. Они более легко идентифицируются по scrolling через стеки изображений как их 3D позиция изменяется незначительно. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
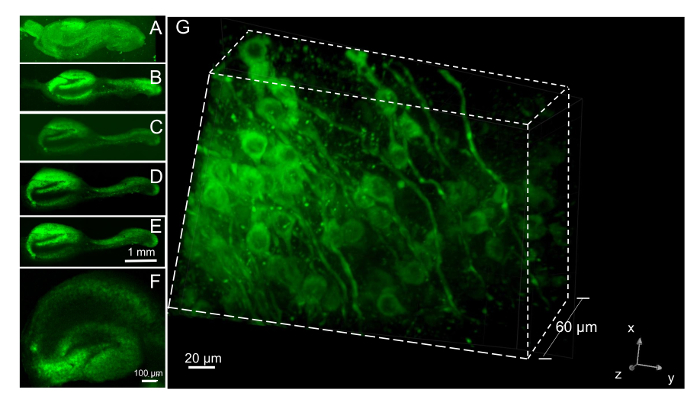
Рисунок 7 : Imaging нейронов в ломтики с нейронов жизненно красителя. (A) нейронов жизненно краситель, окрашенных срез в сгусток плазмы, принятых 24 ч после покрытия с 4 X цели. Краска (100 Нм) был добавлен, когда фрагмент впервые поместили в держатель шланга для ролика и промывают 2 ч позже.Subiculum свернувшись вокруг гиппокампа в сгусток. (EB–) После распада сгусток в плазмин, добавлен в 6 DIV срез был перезагружен 5 раз с жизненно красителем 24 ч до начала обработки изображений недельные интервалы. Изображения показаны были собраны в 8, 21, 28 и 35 DIV (B–E, соответственно). (F) гиппокампа ломтик культивировали в течение 3 недель и окрашенных краской нейрональных жизненно 24 ч до начала изображений с 4 X цели. (G) конфокальный стек изображений на же кусочек как F показаны 3D вид 61 самолетов, принятых интервалы 1 мкм. Нейрональных жизненно краситель ясно обозначает невритов и клетки тела, но она исключается из ядра. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
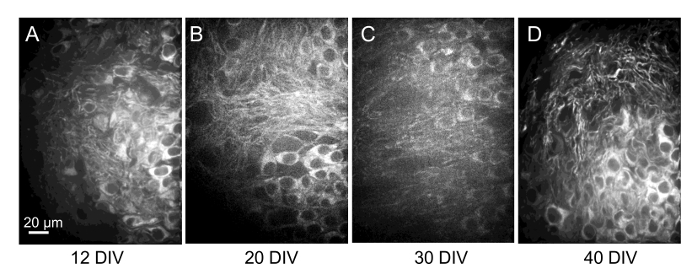
Рисунок 8 : Повторяющихся изображений нейронов в одном месте среза более 4 недель. Максимальная проекции изображения 30 мкм конфокальное изображение стеков же поля клеток (позиционирование) от жизненно краситель меченых ломтиками, принятых в 12, 20, 30 и 40 DIV (A–D, соответственно). Это трудно повторно определить отдельные клетки над более длительные сроки в проекции изображения. Однако даже эти длительные периоды времени, идентификации же клеток часто возможно при прокручивании стеки изображений или здание 3D изображения, которое может быть повернут, такие, как показано на рисунке 7G. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
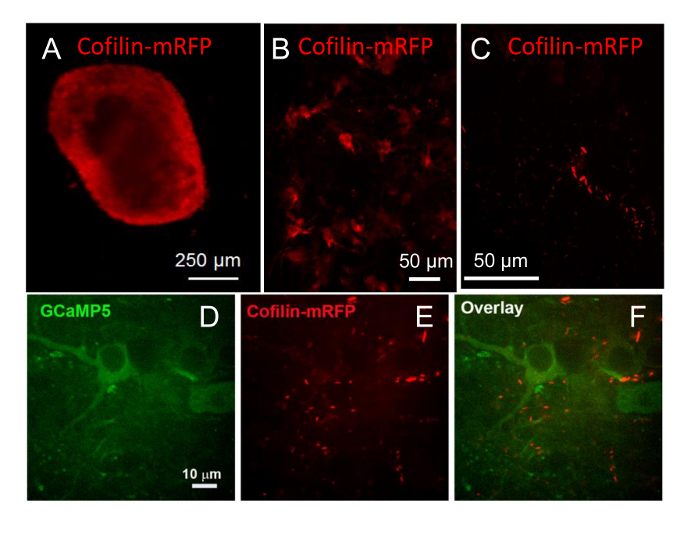
Рисунок 9 : Вирусные опосредованной выражение и изображения флуоресцентных белков. (A) гиппокампа срез культивировали в течение 9 недель и инфицированных аденовирус для выражения Кофилин mRFP за промоутера ЦМВ. Выражение было найдено на протяжении срез на 5 дней после заражения, но флуоресценции была яркая вблизи среза периферии. (B) же фрагмента показал выражение в клетках глубже внутри фрагмента при просмотре с 20 X цели. Изображение является проекцией из стека 20 изображений на расстоянии 2 мкм друг от друга. (C) же фрагмента был рассмотрен после 17 недель в культуре (8 недель после инфекции) и Кофилин mRFP наблюдалось в форме стержня агрегатов как видели в этой проекции изображения от 70 мкм стек 23 изображений, 3 мкм друг от друга, с 40 X цели. (FD–) Мышь гиппокампа кусочек, инфицированных AAV, выражая GCaMP5 - 9 недель в культуре (P2A) - Кофилин - mRFP за Синапсин промоутер. Флуоресценции в был виден красный и зеленый каналы после 10 дней. Один самолет изображения показаны выражение GCaMP5 (D), кальция чувствительных репортер, (E) многие содержащие Кофилин стержней и (F) накладываемое изображение фрагмента. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
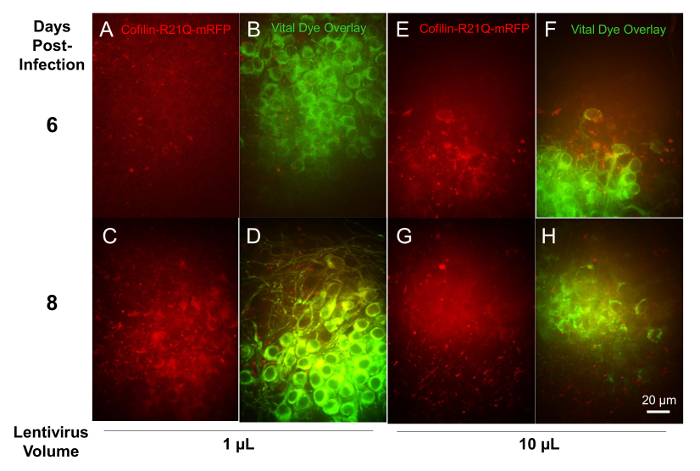
Рисунок 10 : Выражение Кофилин R21Q-mRFP, движимый Синапсин промоутер в нейронах, инфицированных рекомбинантного лентивирусные векторы. Обнаружение сигнала слабая флуоресценции впервые наблюдали о 3-4 дней после инфекции с использованием 10 мкл вируса и становится полезной, 5-6 дней, (E) как видно эти изображения, полученные с целью 60 x. Хотя это занимает больше времени для достижения такого же уровня выражения с 1 мкл вируса, 8 дней после инфицирования аналогичные высокий процент нейронов (помечены жизненно краситель) выражают Кофилин R21Q-mRFP. Только 27% нейронов были положительными для флуоресценции mRFP на 6 дней после инфекции с 1 мкл (A, B), но эта цифра возросла до 85% (C, D) на 8 дней. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
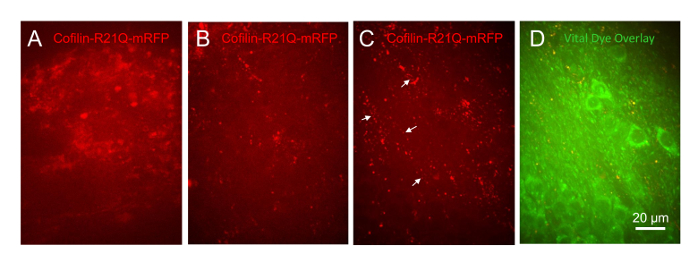
Рисунок 11 : Значения олигомер индуцированной Кофилин патологии в мыши срезах гиппокампа. Все изображения, принятые 30 мкм изображение стеки с 60 x цели и отображаются как максимальное проекции изображения. Ломтики были заражены Кофилин R21Q-mRFP на 6 DIV. DIV (A) 15 ломтик лечение на 14 DIV с транспортного средства (ДМСО/ОКОРОКА F12 средних используется для создания значенияo). (B) ломтик 15 DIV обрабатывают значения 100 Нмo. (C) же поле, как и B на 20 DIV и показано в (D) как оверлей с лейблом нейрональных жизненно красителя. Стрелки показывают линейные массивы Кофилин агрегатов и стержней в регионе фрагмент, содержащий невритов, но несколько клеток тела. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Ролик трубки метод, описанный здесь позволяет для долгосрочного культивирования и высоким разрешением живой изображений нарезанный мозговой ткани. Одной из основных проблем с техникой фрагмент как применяется здесь находится в монтаж и обслуживание ломтиками. Coverslip покрытия, которые поддерживают ломтик адгезии, содействовать ломтик истончение путем усиления нарост невритов и миграцию клеток из фрагмента; Таким образом мы избегали использования этих субстратов. Вставки аминогруппами на стекло, лечение с 3-aminopropyltriethoxysilane Улучшено прилипание ломтиков, но слишком мало или слишком много курица плазмы на coverslip также может вызывать проблемы соблюдения, приводя к потере срез. Объем плазмы, необходимые для правильного прилегания зависит размер среза искусственный мозг и таким образом больше крыса гиппокампа фрагментов, которые примерно в 4 раза больше в области чем срезы мозга мыши. Если слишком много плазмы сгустки под срез, клеточной адгезии к coverslip с дефектами зрения и лечения с плазмин отпустит срез, таким образом, чтобы он меняет положение или отсоединяет полностью. Однако слишком мало плазменный сгусток может привести к потере среза в течение первых нескольких дней вращения в инкубаторе. В недавних эксперимент с участием 39 ломтиками три были потеряны, но некоторые из погибших может быть результатом фрагмент повреждения, возникшего в процессе нарезки. Тем не менее мы обычно готовят около 50% больше фрагментов чем оценочное число необходимых для эксперимента. Второй по значимости причиной проблем культуры является утечка среды вокруг coverslip печатью. Эта проблема обостряется, когда coverslips не твердо проводятся в положении по крайней мере 1 мин после нанесения их на печать. Тепло от thumb используется для применения давления скорее помогает завершить адгезии. Утечки, которые происходят часто является через крошечные воздушные каналы под coverslip, которая может наблюдаться с микроскопом рассечение. Они обычно исчезают после использования продолжительного палец давление. Можно ожидать, что потеря около 2% культур из-за медленной утечки и таким образом рекомендуется подождать 10 дней после создания культур перед выполнением вирусных инфекций. Чрезмерная палец давление, особенно если производится неравномерно по всей coverslip, также может вызвать coverslip для того треснуть. Если проблемой является поломка, нажав трубы вниз квартиру на коврик для мыши резиновые утепленные в инкубаторе может помочь обеспечить более равномерное давление по всему coverslip.
Ранее описанные методы для культуры срез мозга на мембраны в интерфейсе воздуха жидкость (открытая система) или на coverslip стекла внутри закрытой пластиковой трубки (закрытая система) очень эффективны для долгосрочного выживания срез, но каждый метод имеет свои сильные стороны и недостатки. Срез культур на мембраны в интерфейсе жидкого воздуха выгодны для комбинированных электрофизиологических исследований с целями погружения для изображений с высоким разрешением7, но имеют недостатки в отношении поиска поле точный клеток для незагружаемые со временем и потенциального воздействия на пользователей и объективных загрязнения при использовании экспрессии генов вируса опосредованной. Использование вирусов для выражения трансгенов безопаснее и легче выполнять в закрытой системе где загрязнение Микроскоп целей не является проблемой. Наш метод трубки модифицированных ролик дает доступ фрагмента для изображений с высоким разрешением, хотя это не поддаются электрофизиологических исследований.
Срез культуры условия были созданы во многих регионах грызунов мозга2, но здесь мы используем только гиппокампа, потому что это один из наиболее широко изучены мозга регионов и изменения, которые происходят в гиппокампе представляют большой интерес в исследованиях когнитивные нарушения. Слои пирамидальной клетке CA и ГД регионов поддерживать их организации в течение нескольких недель в культуре и может быть легко наблюдается морфологически. Мы использовали недавно разработанных флуоресцентные жизнеспособности нейронов маркер25, который имеет флуоресценции свойства, которые позволяют ему быть использован для мониторинга нейрональных жизнеспособность и Организации в рамках гиппокампа ломтики течение дней до месяца, но также является совместим с использованием многих других флуоресцентных белков и журналистам. Хотя не оптимален для флуоресценции NeuO25, мы можем возбуждают в NeuO на 488 нм и измерения выбросов в > 617 Нм. Отсчета на photoetched coverslips помог найти те же клетки многократно в течение многих дней культуры и позволило нам идентичные области изображения срезов в течение многих недель. Практически не значительное истончение ломтики произошло изменение стекла coverslips в течение 5 недель в культуре, длинный время точкой, для которой мы получили измерения толщины среза.
AV, Аав и векторов рекомбинантных человека хорошо работать для выражения экзогенных генов в ломтики. Человека с нейронов конкретной промоутера особенно полезна для получения выражения в очень высокий процент (> 85%) нейронов в течение 8 дней после инфицирования. Кроме того мы показываем, что Кофилин актина стержень патологии, связанные с развитием познавательных дефицитов в человека AD10,11 и значения, экспрессирующих мыши объявление модели32 может контролироваться в ломтик культурах относились с относительно низкие концентрации (100 Нм) из синтетических человека значенияo. Мы предполагаем, что будущие приложения этого метода будет включать в себя характеристике новых терапии обратить вспять Кофилин актина стержень патологии и/или правильной дендритных позвоночника аномалии, которые происходят в многих неврологических расстройств33.
Материалы
| Name | Company | Catalog Number | Comments |
| Bottoms from 15 cm culture dishes | VWR Scientific | 25384-326 | |
| Phillips Head Machine Screws (#10-32) | Ace Hardware | 2.5" long and 3/16" in diameter | |
| Flat Washers #10 | ACE Hardware | ||
| Machine Screw Nuts (#10-32) | ACE Hardware | ||
| Rubber Grommets | ACE Hardware | 5/16", thick; 5/8", hole diameter; 1.125", OD | |
| Polyethylene tubing (5/16"; OD, 3/16"; ID) | ACE Hardware | Cut to 1.8" length | |
| Lock Washer #10 | ACE Hardware | ||
| Drill Press, 5 speed | Ace Hardware | ProTech Model 1201 | |
| Nunclon Delta Flat-Sided Tubes | VWR | 62407-076 | |
| Drill bits, 3 mm, 6 mm and 15 mm | Ace Hardware | Diablo freud brand | Drill bits for cutting plastic. |
| Drill bits for wood, 1.5 cm and 1 mm | Ace Hardware | ||
| Wood file, 1/4" round | Ace Harware | ||
| Spring clips, 16 mm snap holder | Ace Hardware | ||
| Swivel Head Deburring Tool, 5" | Ace Hardware | 26307 | |
| Adhesive Silicone Sheet (Secure Seal) | Grace Bio-Labs | 666581 | 0.5 mm Thickness |
| 6 mm hole punch | Office Max | ||
| 12 mm hole punch | thepunchbunch.com | ||
| 70% Ethanol | |||
| Phototeched Coverslips, 12 mm diameter | Bellco Glass, Inc. | 1916-91012 | |
| Bunsen Burner | |||
| Absolute Ethanol | |||
| Nanopure Water | |||
| 3-aminopropyltriethoxylane | Sigma-Aldrich | A3648 | |
| Acetone | Sigma-Aldrich | 179124 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| McIlwain Tissue Chopper | Ted Pella, Inc. | 10180 | |
| Double Edge Razor Blades | Ted Pella, Inc. | 121-6 | |
| Whatman Filter Paper | VWR | 28450-182 | Cut into 5.8 cm diameter circles |
| Poly-chloro-trifluoro-ethylene (Aclar) | Ted Pella, Inc. | 10501-10 | Cut into 5.8 cm diameter circles |
| #21 Surgical Blade | VWR Scientific | 25860-144 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| Spatula, stainless with tapered end | VWR | 82027-518 | |
| Gey's Balanced Salt Solution | Sigma-Aldrich | G9779 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Chicken Plasma | Cocalico Biologicals | 30-0300-5L | Rehydrate in sterile water, centrifuge at 2500 x g 30 min at 4 °C, quick freeze aliquots in liquid nitrogen and store at -80 °C. |
| Thrombin, Topical (Bovine) | Pfizer | Thrombin-JMI | Quick freeze aliquots in liquid nitrogen at 1,000 international units/mL in diluent provided and store at -80°C. Use at 250 units/mL. |
| Cell Roller System | Bellco Biotech | SciERA | |
| Roller Incubator | Forma | Model 3956 | |
| N21-MAX | ThermoFisher Scientific | AR008 | |
| Pen/Strep (100X) | ThermoFisher Scientific | 15140122 | |
| 200 mM Glutamine | ThermoFisher Scientific | 25030081 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Neurobasal A | ThermoFisher Scientific | 10888-022 | Complete Medium: 48 mL Neurobasal A, 1 mL N21-MAX, 0.625 mL 200 mM Glutamine, 0.180 mL 25% Glucose, 0.250 mL 100x pen/strep. |
| Third generation lentivirus packaging | Life Technologies | K4975-00 | |
| 159 K cutoff centrifugal filters (Centricon) | EMD Millipore | ||
| Lentiviral cloning system (InFusion) | Clonetech | ||
| Plasmids 30323, 50856, 51279 | Addgene | ||
| Neuronal cell viability dye (NeuO) | Stemcell technologies | 1801 | Thaw once and quick freeze in 4 µL aliquots. Store at -20 °C |
| Inverted microscope | Olympus | IX83 | |
| Microscope objectives | Olympus | air: 4X, 20; oil: 40X, 60X, | |
| Spinning disc confocal system | Yokagawa | CSU22 | |
| Microscope EMCCD camera | Photometrics | Cascade II | |
| Linear encoded (x,y), piezo z flat top stage | ASI | ||
| Microscope lasers and integration | Intelligent Imaging Innovations | ||
| HEK293T cells | American Type Culture Collection | CRL-3216 | |
| Human Plasmin | Sigma Aldrich | P1867 | 0.002 U/mL in 0.1% bovine serum albumin (0.2 mm filter sterilized), quick freeze in liquid nitrogen and store at -80 °C. |
Ссылки
- Brewer, G. J., Torricelli, J. R., Evage, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term imaging of neuronal circuits in organotypic hippocampal slice cultures. Nat Protoc. 1 (3), 1223-1226 (2006).
- Roo, M. D., Ribic, A. Analyzing structural plasticity of dendritic spines in organotypic slice culture. Methods Mol Biol. 1538, 277-289 (2017).
- Lee, K. F. H., Soares, C., Thivierge, J. -. P., Béīque, J. -. C. Correlated synaptic inputs drive dendritic calcium amplification and cooperative plasticity during clustered synapse development. Neuron. 89 (4), 784-799 (2016).
- Davis, R. C., Maloney, M. T., Minamide, L. S., Flynn, K. C., Stonebraker, M. A., Bamburg, J. R. Mapping cofilin-actin rods in stressed hippocampal slices and the role of cdc42 in amyloid-beta-induced rods. J Alzheimers Dis. 18 (1), 35-50 (2009).
- Clark, R. E., Squire, L. R. Similarity in form and function of the hippocampus in rodents, monkeys, and humans. Proc Natl Acad Sci U S A. 110, 10365-10370 (2013).
- Minamide, L. S., Striegl, A. M., Boyle, J. A., Meberg, P. J., Bamburg, J. R. Neurodegenerative stimuli induce persistent ADF/cofilin-actin rods that disrupt distal neurite function. Nature Cell Biol. 2 (9), 628-636 (2000).
- Rahman, T., et al. Cofilin rods and aggregates concur with tau pathology and the development of Alzheimer's disease. J Alzheimers Dis. 42 (4), 1443-1460 (2014).
- Bamburg, J. R., Bernstein, B. W. Actin dynamics and cofilin-actin rods in Alzheimer disease. Cytoskeleton(Hoboken). 73 (9), 477-497 (2016).
- He, T. C., Zhou, S., da Costa, L. T., Yu, J., Kinzler, K. W., Vogelstein, B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 95 (5), 2509-2514 (1998).
- Minamide, L. S., et al. Production and use of replication-deficient adenovirus for transgene expression in neurons. Methods Cell Biol. 71, 387-416 (2003).
- Kügler, S., Kilic, E., Bähr, M. Human synapsin 1 gene promoter confers highly neuron-specific long-term transgene expression from an adenoviral vector in the adult rat brain depending on the transduced area. Gene Ther. 10 (4), 337-347 (2003).
- Mi, J., et al. A genetically encoded reporter for real-time imaging of cofilin-actin rods in living neurons. PLOS ONE. 8 (12), 83609 (2013).
- Wang, L., Blouin, V., Brument, N., Bello-Roufal, M., Francois, A. Production and purification of recombinant adeno-associated vectors. Methods Mol Biol. 807, 361-404 (2011).
- Matsushita, T., et al. Adeno-associated virus vectors can be efficiently produced without helper virus. Gene Therapy. 5 (7), 938-945 (1998).
- Ward, P., Walsh, C. E. Targeted integration of rAAV vector into the AAVS1 region. Virology. 433 (2), 356-366 (2012).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 32 (40), 13819-13840 (2012).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PLOS ONE. 6 (4), 18556 (2011).
- Benskey, M. J., Manfredsson, F. P. Lentivirus production and purification. Methods Mol Biol. 1382, 107-114 (2016).
- Huang, L., Chen, C. Autoprocessing of human immunodeficiency virus type 1 protease miniprecursor fusions in mammalian cells. AIDS Res Ther. 7, 27 (2010).
- Bordat, A., Houvenaghel, M. C., German-Retana, S. Gibson assembly: an easy way to clone polyviral full-length infectious cDNA clones expressing an ectopic VPg. Virol J. 12, 89 (2015).
- Er, J. C., et al. NeuO: a fluorescent chemical probe for live neuron labeling. Angew Chem Int Ed Engl. 54 (8), 2242-2246 (2015).
- Bernstein, B. W., Chen, H., Boyle, J. A., Bamburg, J. R. Formation of actin-ADF/cofilin rods transiently retards decline of mitochondrial potential and ATP in stressed neurons. Am J Physiol Cell Physiol. 291 (5), 828-839 (2006).
- Cichon, J., et al. Cofilin aggregation blocks intracellular trafficking and induces synaptic loss in hippocampal neurons. J Biol Chem. 287 (6), 3929-3939 (2012).
- Stine, W. B., Dahlgren, K. N., Krafft, G. A., LaDu, M. J. In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis. J Biol Chem. 278 (13), 11612-11622 (2003).
- Maloney, M. T., Minamide, L. S., Kinley, A. W., Boyle, J. A., Bamburg, J. R. Beta-secretase-cleaved amyloid precursor protein accumulates at actin inclusions induced in neurons by stress or amyloid beta: a feedforward mechanisms for Alzheimer's disease. J Neurosci. 25 (49), 11313-11321 (2005).
- Davis, R. C., et al. Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin phosphorylation. Mol Neurodegener. 6, 10 (2011).
- Walsh, K. P., et al. Amyloid-β and proinflammatory cytokines utilize a prion protein-dependent pathway to activate NADPH oxidase and induce cofilin-actin rods in hippocampal neurons. PLOS ONE. 9 (4), 95995 (2014).
- Woo, J. A., et al. RanBP9 at the intersection between cofilin and Aβ pathologies: rescue of neurodegenerative changes by RanBP9 reduction. Cell Death Disease. , 6 (2015).
- Shaw, A. E., Bamburg, J. R. Peptide regulation of cofilin activity in the CNS: a novel therapeutic approach for treatment of multiple neurological disorders. Pharmacol Ther. 175, 17-27 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены