Method Article
Metodo del tubo rullo modificate per Imaging intermittente precisamente localizzata e ripetitivi durante la coltura a lungo termine delle fette di cervello in un sistema chiuso
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentato qui è un metodo di tubo rullo modificate per la coltura e fette di imaging ad alta risoluzione intermittente del cervello del roditore sopra molte settimane con riposizionamento preciso sulle lamelle di fotoincisioni. Vitalità neuronale e fetta morfologia sono ben tenute. Vengono fornite applicazioni di questo sistema completamente chiusa usando i virus per espressione specifica del tipo di cella.
Abstract
Fette del cervello del roditore coltivate sono utili per studiare il comportamento cellulare e molecolare dei neuroni e cellule gliali in un ambiente che conserva ancora molte delle loro interazioni normale in vivo . Fette ottenute da una varietà di linee di topi transgenici o uso di vettori virali per l'espressione di proteine fluorescente etichettate o reporter in fettine di cervello di tipo selvaggio consentono per imaging ad alta risoluzione da microscopia di fluorescenza. Sebbene diversi metodi sono stati sviluppati per l'imaging di fettine di cervello, che unisce la cultura fetta con la possibilità di eseguire ripetitivo imaging ad alta risoluzione di cellule specifiche a fette dal vivo nel corso di lunghi periodi di tempo ha posto problemi. Questo è particolarmente vero quando vettori virali sono usati per l'espressione di proteine esogene poiché questo è meglio farlo in un sistema chiuso per proteggere gli utenti e di evitare la contaminazione incrociata. Semplici modifiche apportate al metodo di coltura a rulli tubo cervello fetta che consentono per imaging ad alta risoluzione ripetitivo delle fette sopra molte settimane in un sistema chiuso sono segnalate. Coltura fette su vetrini coprioggetti fotoincisioni consente l'utilizzo dei marchi fiducial rapidamente e precisamente riposizionare il palco per il campo identico di immagine nel tempo prima e dopo i trattamenti differenti. Sono riportati alcuni esempi per l'utilizzo di questo metodo combinato con colorazione neuronale specifica espressione per osservare i cambiamenti nell'architettura di fettine di ippocampo, espressione di un neurone virale-mediata di proteine fluorescenti e lo sviluppo di patologia cofilina, che precedentemente è stata osservata nell'ippocampo del morbo di Alzheimer (annuncio) in risposta al trattamento della fetta con oligomeri del peptide amiloide-β (Aβ).
Introduzione
Colture primarie di neuroni dissociati dalle regioni del cervello del roditore sono un importante strumento usato dai ricercatori per osservare le risposte alla patologico implicato stimoli. Tuttavia, tali studi hanno lo svantaggio di guardando i neuroni in 2D solo e senza loro glial sistema di supporto. Inoltre, a meno che non coltivate in condizioni di densità molto alta (640 neuroni/mm2 o circa il 16% della superficie) in cui esso diventa impossibile seguire la conseguenza casuale di un dendrite o assone per più di una breve distanza dal suo corpo cellulare, hippocampal vitalità neuronale oltre 4 settimane diminuisce significativamente1, limitando l'uso di colture dissociate per gli studi estesi delle patologie età-correlate. Alla coltura delle fette preparati dal cervello del roditore è un'opzione attraente che supera queste limitazioni mantenendo un'architettura cellulare organizzata e vitalità per settimane o mesi. Condizioni per il mantenimento di molte regioni differenti del cervello del roditore nella fetta di cultura sono stati descritti2.
Due metodi principali sono ampiamente usati per la coltura a lungo termine di fette del cervello: coltura su membrane all' interfaccia aria-liquido3 o coltura sulle lamelle in provette sigillate permesso di ruotare in un incubatore a rullo per fornire aerazione4. Fette coltivate sulle membrane possono essere imaged direttamente con microscopia di fluorescenza ad alta risoluzione utilizzando un microscopio dritto e acqua immersione obiettivi5. In alternativa, fette coltivate sulle membrane sono stati trasferiti a piatti di fondo di vetro per ottenere una buona risoluzione delle spine dendritiche usando un microscopio invertito6. Tuttavia, entrambi i metodi di imaging fette coltivate sulle membrane sono sistemi aperti che richiedono modifiche medie e spesso utilizzano antimicotico e/o antibiotici per prevenire o ridurre la contaminazione5,6. Fette su una membrana all'interfaccia aria-medio mantengono eccellente morfologia e sopravvivenza, ma tornando a posizioni precise durante la formazione immagine ripetitiva ad alto ingrandimento è estremamente difficile a meno che l'esperimento è seguito solo piccoli gruppi di cellule esprimendo un marcatore fluorescente. Sebbene fette coltivate sulle membrane sono stati utilizzati con espressione virale-mediata di transgeni5,6, protocolli di biosicurezza potrebbero richiedere un sistema di coltura chiuso essere impiegato per alcuni vettori virali che sono utilizzati per esprimendo la fluorescente tagged proteine e reporter di fisiologia cellulare. Inoltre, obiettivi di immersione richiedono una decontaminazione tra i campioni che verranno seguite nella cultura5. Una delle principale applicazioni del culture interfaccia membrana sta combinando imaging ad alta risoluzione con elettrofisiologia a singola volta punti7.
Il metodo del tubo rullo con lamelle all'interno del tubo di plastica non consente alcun elettrofisiologia o imaging ad alta risoluzione senza rimuovere il vetrino coprioggetti. Pertanto, questo metodo è stato applicato più spesso a studi a lungo termine in cui sono state fatte osservazioni post-fissazione,8. Qui descritto è un metodo che utilizza la tecnica della coltura tubo rullo ma sui tubi forati-out con fette sulle lamelle che possono essere imaged in modo ripetitivo per finchè le culture vengono mantenuto. Il sistema chiuso non richiede alcun cambiamento medio per l'imaging e utilizza vetrini coprioggetti fotoincisioni per fornire fiducial marchi che consentono di imaging ad alto ingrandimento, dopo giorni o settimane, i precisi campi precedentemente imaged.
Applichiamo questo metodo per esaminare i cambiamenti nel roditore ippocampo, una regione del cervello più importanti coinvolta nella memoria e l'apprendimento. L'ippocampo roditore è spesso studiata come un modello per patologiche o età-correlate cambiamenti osservati durante lo sviluppo di danno conoscitivo9, come quelle che si verificano in annuncio. Il nostro metodo è particolarmente adatto per studiare i cambiamenti patologici che si sviluppano all'interno di una singola fetta nel tempo in risposta ai cambiamenti ambientali, come aumenti di peptidi Aβ, che è caratteristica della AD8. Una patologia connessa con il cervello umano e del roditore dell'annuncio è la presenza di aggregati cofilina-actina e le bacchette, quest'ultimi contiene fasci di filamenti in cui cofilina e actina sono presenti un 1:1 rapporto molare10,11, 12. canne sono state osservate in fisse fette dell'ippocampo del ratto dopo il trattamento di Aβ, così come all'interno di una fetta di cervello del roditore vivo esprimendo cofilina-GFP sottoposti ad ipossia8, e possono contribuire alla disfunzione sinaptica ad esempio ad e di colpo. Qui usiamo questo nuovo metodo di coltura per osservare il decorso e la distribuzione all'interno di fette di proteine fluorescenti chimeriche esogene espresse introdotte da virus diversi. Utilizziamo quindi l'espressione specifica di un neurone di un costrutto di reporter cofilina di seguire lo sviluppo della cofilina rod e aggregata patologia nelle fette hippocampal in risposta al trattamento con oligomeri solubili di Aβ (Aβo).
Protocollo
L'uso di animali segue approvato allevamento ed i protocolli di uso animale conformi alla cura degli animali e utilizzare le linee guida della Colorado State University.
Nota: Il protocollo sottostante descrive il metodo di preparazione e cultura per l'incubazione a lungo termine e intermittente imaging di fette hippocampal. Una sola fetta hippocampal è collegata a un vetrino coprioggetti fotoincisioni appositamente preparati utilizzando un coagulo di plasma, e poi le lamelle sono sigillate sul lato piatto di un tubo forato-out rullo, che viene mantenuto in un incubatore a rulli. I grumi del plasma sono dissolti con plasmina prima infezione virale per l'espressione della proteina fluorescente e imaging ad alta risoluzione. Un colorante vitale neuronale fluorescente viene utilizzato per i neuroni all'interno le fette di immagine.
1. preparazione del rullo portaprovette
- Utilizzare il modello illustrato nella Figura 1A stampato sulla dimensione indicata nella barra della scala. Con un chiodo, pugno piccoli fori (abbastanza grande per un marcatore punta fine) nel modello centrato sui fori.
- Impostare il modello sul fondo di un piatto di coltura del tessuto di 15 cm (diametro nominale di 14 cm) e segnare la posizione dei fori. Ripetere questa operazione su un secondo piatto.
- Con punte da trapano progettati per l'utilizzo su plastica, praticare sei fori di diametro di 1,5 cm su ogni piatto in una matrice esagonale (4,8 cm da centro a centro) con centri del foro 2,5 cm dal bordo del piatto. Eseguire tre fori (3 mm di diametro) 12 mm dal bordo che vengono inseriti equidistante tra due dei fori più grandi come mostrato in Figura 1A.
- Con i fondi di ogni piatto si fronteggiano, posizionare una vite di macchina lunga 2,5 pollici (3/16 di pollice di diametro) con una rondella piana attraverso uno dei fori piccoli seguiti da una seconda rondella piatta, un pezzo di polietilene tubi (distanziale, 4,7 cm), un'altra rondella piana , il secondo piatto di coltura del tessuto, un'altra rondella piana, una rondella e un dado.
- Ripetere il passaggio 1.4 sulle altre due viti di macchina e stringendo soltanto senza bloccare fino a quando tutte le viti di macchina sono a posto. Quindi serrare i dadi.
- Lavorare i gommini (5/16 pollici spessore, diametro foro 5/8 di pollice) nei fori del piatto inferiore per ottenere il tubo rullo finale rack (Figura 1B; indicato con due tubi in luogo). Collocare un adesivo su ogni rack con un numero univoco.
2. preparazione del rullo tubi e vetrini coprioggetti
- Rendendo la dima per la foratura in rullo tubi
- Praticare un foro di 1,5 cm profondità 8 cm sul lato del centro di un 2 x 4 x 5,5 pollici blocco di legno ad un angolo tale che il lato piatto del rullo tubo volontà essere quasi paralleli con il blocco quando inserito (Figura 2A).
- Allargare il foro utilizzando un file di legno tondo per ampliare sia il foro per consentire l'inserimento del tubo del cono (rullo tubi sono leggermente più grandi di diametro verso la fine di tappo) (Figura 2B).
- Praticare un foro verticale di diametro 1,5 cm, 5,5 cm dal lato del blocco e centrato sopra il foro laterale (Figura 2C).
- Quando il foro laterale è conico abbastanza, inserire un tubo del rullo che è segnato nel punto desiderato per centrare il foro per la fetta e posizionare il tubo così punto marcato è centrato nel foro verticale di 1,5 cm.
- Rimuovere il tubo e misurare la distanza dal posto all'estremità del tubo. Contrassegnare questa distanza dal centro del foro nell'attrezzatura e inserire un chiodo per fornire una fermata per posizionare correttamente il tubo per la perforazione (freccia in Figura 2C).
- Utilizzare un seghetto per tagliare l'unghia a filo con la superficie del blocco di legno per evitare lesioni.
- Aggiungere clip a molla sulla parte inferiore della dima se c'è una pressa di trivello con asole che permettono che sia ancorata (frecciaFigura 2D nero). In caso contrario, utilizzare C-morsetti per tenere la dima saldamente sulla pressa di trivello.
- Utilizzando la dima descritto sopra per tenere e posizionare un tubo di plastica cultura piatto parteggiato 11 cm con il lato piatto verso l'alto (Figura 2A), praticare un foro del diametro di 6 mm con il centro 1,0 cm dal fondo e centrato tra i lati del tubo.
Nota: Deve essere utilizzato un trapano progettato per plastica. - Con un utensile sbavatore girevole, smussare i bordi del foro (Figura 2E) e fare 4 scanalature all'interno bordo del foro (Figura 2E, inserto) per facilitare lo scarico del foro durante la rotazione.
- Con un foro di 12 mm punch, tagliare i dischi di diametro 12 mm da strati di gomma non tossico doppio ha parteggiato adesivo silicone. Utilizzando un pugno di carta un foro standard (6 mm di diametro), fare un buco al centro di ogni disco.
- Sciacquare i tubi forati con etanolo al 70%, aria asciugateli in un armadio, di sicurezza biologica e sterilizzare i tubi e i dischi adesivi punzonati per 40 minuti sotto la lampada UV (30 W a 70 cm di distanza media) in cappa di sicurezza biologica.
- Riposizionare i tubi e i dischi dopo 20 min, in modo che tutte le superfici esposte sono sterilizzate. In condizioni di sterilità, staccare la protezione bianca da un disco adesivo e apporre la gomma di silicone all'esterno di un tubo, allineando i fori (Figura 2F).
Attenzione: Per evitare l'esposizione ai raggi UV, indossare occhiali di protezione e chiude il gabinetto prima di accendere la lampada UV. - Pulire il vetro tedesco di lamelle di 12 mm diametro fotoincisioni (100 centro numerato 1 mm quadrati). Tenere i coprioggetti delicatamente con le pinzette e immergere in etanolo assoluto, seguita da acqua, seguita da etanolo assoluto nuovamente e infine immergere i vetrini coprioggetti in una fiamma di bruciare l'etanolo. Consentire le lamelle raffreddare.
- Tenendo i coprioggetti con il forcipe, immergere nel 2% 3-amminopropiltrietossisilano in acetone per 10 s. Sciacquare i vetrini coprioggetti con acqua ultrapura e lasciare asciugare all'aria.
- Impostare i coprioggetti su carta da filtro sterile all'interno di una sicurezza biologica cabinet e accendere il UV luce. Esporre ogni lato delle lamelle per 20 min.
Attenzione: Per evitare l'esposizione ai raggi UV, indossare occhiali di protezione e chiude il gabinetto prima di accendere la lampada UV.
3. hippocampal fetta preparazione
- Prima di iniziare la dissezione, preparare metà di lame a doppio taglio di rasoio per l'elicottero di tessuto. Piegare le lame longitudinalmente accuratamente con le dita e spezzare a metà.
- Sciacquare le metà di lama con acetone, utilizzando un tampone di cotone per pulirli, seguito da un risciacquo in etanolo assoluto ed essiccazione all'aria.
Nota: Il protocollo di cultura fetta di cervello è indipendente di topo o ratto ceppo o genotipo. Sono state utilizzate molte linee di topi transgenici con diverso background genetico.
- Con il forcipe, tenere il lato posteriore del profilato cervello fino e lato ventrale contro il lato del piatto Petri per la stabilità. Delicatamente prendere in giro lontano meninges intorno alla linea mediana sagittale e rimuovere il tessuto del midbrain utilizzando un forcipe Dumont #5 punta fine (Figura 3C, cerchio tratteggiato).
- Fare due tagli lungo il lato del cervello per la sua diffusione aperta (Figura 3C, linee tratteggiate). Una volta che il cervello è posto lato dorsale giù e diffusione aperta, la fessura hippocampal dovrebbe essere visibile (Figura 3D, freccia).
- Trasferire il cervello aperto di diffusione per un pezzo di pellicola plastica policlorotrifluoroetilene e posizionarlo per affettare sul palco di un elicottero di tessuto. Bagnate la lama con GBSS/glucosio e tritare l'ippocampo fette spesse ~ 300 µm.
- Con una pipetta di trasferimento, è necessario svuotare il cervello affettato fuori la pellicola di plastica in un piatto fresco 60 mm contenente GBSS/glucosio (Figura 3E). Delicatamente pizzico fuori e prendere in giro, con una pinzetta punta, le meningi rimanenti e altri tessuti non-ippocampale (Figura 3F) dalle fette (Figura 3G, H).
4. placcatura fette
- Fette di una volta sono stati ottenuti, porre al centro del lato di fotoincisioni di un vetrino coprioggetto preparato 2 µ l di plasma di pollo. Diffondere il plasma leggermente per ottenere un posto di diametro di 3-4 mm.
Nota: Il lato di fotoincisioni è il lato superiore del coprivetrino quando viene visto attraverso un microscopio di dissezione, tale che i numeri siano orientati correttamente. - Trasferire 1 fetta di cervello con una spatola stretta-punta sterile (Figura 4A) al posto del plasma (Figura 4B). Utilizzare pinze chiuse per mantenere la fetta sulla punta spatola mentre si solleva la fetta dal GBSS/glucosio.
- Toccare la spatola al plasma spot sul vetrino coprioggetto e con una pinza chiusa, spingere la fetta sul vetrino coprioggetti.
- Mix 2,5 µ l di plasma con 2,5 µ l di trombina in un tubo separato. Inserire rapidamente 2,5 µ l di questa miscela sopra e intorno la fetta e dispensare su e giù delicatamente di mescolarla (Figura 4B).
Nota: Il plasma sarà coagularsi entro 10-15 s, quindi questo deve essere fatto rapidamente. Se fetta adesione è un problema, mescolare 5 al plasma µ l con trombina di 5 µ l e usare 4-5 µ l sulla fetta, rimozione di alcuni dopo la miscelazione di modo che la fetta si trova pianamente sul vetrino coprioggetti. - Rimuovere la plastica trasparente che copre dal lato esposto dell'adesivo di gomma del silicone precedentemente fissato al rullo di avvolgimento e porre il coprivetrino con la fetta di cervello sull'adesivo allineando la fetta all'interno del foro (Figura 4C).
- Per assicurare una adesione, morbido, applicare una pressione uniforme per il coprioggetto con il pollice premendo uniformemente il vetrino coprioggetto e tenendolo premuto per circa 1 min durante il trasferimento e la cappa di sicurezza biologica.
- In una cappa di sicurezza biologica, aggiungere 0,8 mL di terreno di coltura Neurobasal A completa (Tabella materiali) ad ogni provetta (Figura 4D).
- Flusso di una miscela di 5% CO295% aria attraverso una sterile pipetta Pasteur cotone-collegato saldamente da un morsetto. Lavare il tubo rullo con la miscela di gas e rapidamente richiudere la provetta, come si è ritirato da intorno la pipetta.
- Etichettare le provette con il numero di slice e numero di rack. Inserire tubi in un rack di rullo, garantendo che geometricamente sono equilibrati. Se c'è un numero dispari di tubi, aggiungere tubi per bilanciare.
- Posizionare le cremagliere in un incubatore a 35 ° C a rulli con rulli girando rack rullo a circa 10-13 RPH (Figura 4E). Per mantenere il mezzo nella parte inferiore dei tubi, inclinare l'incubatrice indietro di circa 5° sollevando la relativa parte anteriore su una tavola.
- Immettere il numero di sezione e il tubo su un foglio di calcolo, che viene utilizzato per registrare tutte le informazioni di fetta trattamenti e date di osservazione.
- Su circa giorno 6 nella cultura, aggiungere 1 µ l (0.002 U) di plasmina attiva in ogni provetta.
- Dopo la formazione di coaguli sciogliere completamente (di solito entro poche ore), rimuovere il mezzo e sostituirlo con medium fresco senza plasmina. Se necessario, fette possono essere incubate con plasmina durante la notte e il mezzo ha cambiato il giorno successivo.
- Fette di solito vengono incubate per almeno 7-10 giorni prima dell'uso in esperimenti. Medio di aspirare e sostituirlo il giorno 3 o 4, ancora una volta il giorno 7 e successivamente ogni 7 giorni.
5. preparazione di vettori virali per l'espressione del Transgene
Nota: Espressione dei transgeni in neuroni di culture della fetta si ottiene utilizzando cervelli da roditori geneticamente o introducendo il transgene da infezione con virus carenti replica ricombinante.Gli adenovirus (AV), virus adeno-associato (AAV) e vettori lentivirus ricombinanti sono stati utilizzati nelle nostre culture hippocampal fetta per espressione di chimere differenti della proteina fluorescente nelle fette del cervello.
- Preparare la replica carenti AV per esprimere il RNA di interesse secondo i metodi descritti altrove13,14. Titolo i virus per infettive U/mL con il metodo di diluizione seriale utilizza un anticorpo ad una proteina virale espressa come descritto14. Per osservare cofilina aggregati e formazione di rod cofilina-actina, utilizzano la cofilina-R21Q-mRFP cDNA (plasmide #51279)16.
Nota: Il promotore della sinapsina 1 è una scelta eccellente per un neurone specifico espressione15, considerando che il promotore del citomegalovirus è utile per guidare i livelli di alta espressione in molti tipi di cella13. - Preparare AAV co-transfezione di trasferimento del plasmide contenente il gene di interesse e un plasmide rep/cap, con o senza un plasmide helper, in cellule HEK293 imballaggio, che forniscono il gene virale E1, come descritto in precedenza17,18.
Nota: AAV ricombinante realizzabile anche per l'inserimento mirato nel genoma delle cellule host19. Per il plasmide di trasferimento, usiamo umano cofilina 1 con un C-terminale mRFP1 fluorescenza della proteina tag (plasmide #50856) clonato in un sinapsina contenenti promotore AAV plasmide a valle dal calcio sensore GCaMP5G20. Un pezzo di DNA codificante la sequenza del peptide self-che fende P2A è inserito da PCR tra GCaMP5G e cofilina-RFP durante la preparazione del plasmide trasferimento per offrire un'espressività di entrambe le proteine da un singolo AAV trascrizione21. - Preparare i vettori ricombinanti lentivirus di co-trasfezione del plasmide di trasferimento contenente il gene o cDNA dei segnali di interesse e integrazione, insieme a un terza generazione dei lentivirus imballaggio miscela che divide il virali gag, pol, rev e geni vsv-g sul tre plasmidi separati22,23.
- Per il plasmide di trasferimento, utilizzare un solo passo clonazione sistema24 per assemblare il promotore della sinapsina e cofilina-R21Q-mRFP cDNA (dal plasmide #51279) in pLKO.1-GFP (plasmide #30323), con il promotore della sinapsina e cofilina-R21Q-mRFP sostituendo la hPGK promotore e cDNA GFP, rispettivamente.
- Transfect il plasmide finale nelle cellule HEK293T dal fosfato di calcio come descritto in precedenza23.
- Raccogliere medio da quattro piatti di 10cm, concentrarsi a 500 µ l utilizzando concentratori centrifughi 150K-cutoff e memorizzare il lentivirus finale a-80 ° C in piccole aliquote dopo il congelamento rapido in azoto liquido. Scongelare un'aliquota solo una volta per infettare altre cellule.
- Determinare empiricamente che il volume di ogni tipo di virus pronti a raggiungere il grado di espressione desiderato impostando un numero di sezione diversa culture per seguire l'espressione dei transgeni dopo l'infezione con i vari volumi del virus.
Nota: In genere, 1-10 µ l di virus viene utilizzato per fetta.
6. fetta trattamenti
- Fette d'infezione con virus
- Lavorando in una cappa di sicurezza biologica approvato per il lavoro di virus a livello di sicurezza biologica, appropriato per il vettore, mescolare una parte aliquota del virus (solitamente 1-10 µ l) di 0,8 mL di terreno completo.
- Aspirare il mezzo dalla sezione utilizzando una pipetta Pasteur sterile in una trappola di raccolta contenente candeggina. Una trappola secondaria viene sempre utilizzata tra la prima trappola e fonte di vuoto.
- Sostituire questo mezzo con l'aliquota contenenti virus preparato in precedenza, restituire le provette di coltura ad un rack e collocare nell'incubatrice.
- Dopo 2-5 giorni di incubazione le fette con il virus in cappa di sicurezza biologica, rimuovere il supporto contenente virus con una pipetta sterile e metterlo in una bottiglia contenente un agente antivirale approvato per uccidere il virus.
- La macchiatura dei neuroni con colorante vitale
- Preparare e conservare le aliquote di colorante vitale neuronale fluorescente25 µ l 4 congelamento rapido delle aliquote in azoto liquido ad una concentrazione di 100 µM e memorizzare questi a-20 ° C. Non congela/scongela il colorante più di una volta.
- Per etichettare i neuroni per la visualizzazione mediante microscopia a fluorescenza, scongelare un'aliquota del colorante vitale neuronale e diluire a 4 mL di terreno Neurobasal completo (concentrazione finale di tintura è di 100 nM).
- Rimuovere il mezzo da fette di aspirazione (o con una pipetta di trasferimento se il supporto contiene virus) e sostituirlo con 0,8 mL di terreno contenente colorante vitale neuronale di 100 nM. Restituire le fette all'apparato rullo nell'incubatrice.
- Dopo incubazione le fette per 2 h, aspirare il mezzo contenente colorante e sostituirlo con 0,8 mL di terreno nuovo completo in una cappa di sicurezza biologica.
Nota: Etichettatura dei neuroni a fette con colorante vitale richiede diverse ore di incubazione. Le prime immagini sono di solito prese 24 h dopo il trattamento colorante. Anche se i neuroni sono etichettati in modo specifico, non c'è fluorescenza di fondo che si declina in 2-3 giorni per dare il meglio di un neurone imaging. Intensità del colorante vitale declina dopo 72 h. - Per seguire i cambiamenti nella morfologia fetta nel corso del tempo, rietichettare le fette ogni 7 giorni.
7. fetta Imaging
- Mostra fette su un microscopio invertito. Per l'imaging di fluorescenza più brillanti, a 24 h prima di formazione immagine, cambio di terreno di coltura con terreno Neurobasal A completo senza l'indicatore di pH rosso fenolo.
Nota: Per gli esperimenti riferiti qui, fette vengono visualizzati su un microscopio a fluorescenza confocale invertito filatura disco dotato di un lineare codificato x, y fase con controllo z piezo e una fotocamera digitale ad alta risoluzione sensibile. - Trasferire il tubo con la fetta di cultura essere imaged dall'apparato di tubo a rulli per il supporto di tubo su misura (Figura 5A), che viene inserito nella scheda di fase (Figura 5B), per mantenere il coprioggetto perpendicolare alla L'obiettivo e mantenere la fetta nello stesso orientamento durante le sessioni di formazione immagine ripetitive per lunghi intervalli di tempo.
- Innestare il dispositivo di scorrimento sulla fase stretto contro il tubo per tenere il tubo in posizione (Figura 5B).
Nota: Dettagli di fissaggio del tubo, tappa adattatore e riscaldatore può essere letta in: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/.
Nota: Queste posizioni Disassata da mark fiducial consentono coerente individuazione della stessa posizione coprioggetto quando la fetta è immaginata, anche se l'originale x, y impostazione del marchio fiducial cambia quando l'adattatore tubo o fase sono rimossi e sostituiti.
Nota: Piani di immagine sono ottenuti solitamente a intervalli di 0,5 µm a 2 µm, secondo il formato e la risoluzione desiderata delle caratteristiche immagine. Creazione di un'immagine 3D di qualità richiede che caratteristiche dell'immagine si estendono su più piani di acquisizione, e quindi per visualizzare caratteristiche minori, intervalli più piccoli sono necessari tra i piani.
Nota: La maggior parte delle sessioni di formazione immagine segnalato qui erano sotto 18 min/fetta. Tuttavia, noi abbiamo ripreso alcune fette di dieci o più volte e anche come lungo come 40 min in un'unica sessione, senza apparente danno la sopravvivenza a lungo termine della fetta.
Risultati
Per determinare con precisione come fiducial contrassegni possono essere utilizzati per creare una nuova immagine delle stesse cellule all'interno dei campi stessi nel corso del tempo, abbiamo esaminato fette coltivate su vetrini coprioggetti fotoincisioni (Figura 6A). I neuroni sono stati visualizzati tramite colorazione con un colorante vitale (100 nM per 2 h; non macchia le cellule non neuronali), che scompare da neuroni nel tempo senza danneggiare le cellule25. Abbiamo identificato un fiducial registrato marchio in una singola griglia quadrata (Figura 6A, B), trova una regione di vitale tingere-contrassegnati neuroni 24 h dopo l'etichettatura, la x e y compensare posizioni dal marchio fiducial (Figura 6B) e raccolto, utilizzando un obiettivo 60x, serie di immagini confocal di questa regione, ripetendo l'imaging su 4 giorni consecutivi. Le immagini di proiezione massima di uno stack di immagine 30 µm presi nella stessa posizione sono indicate (Figura 6C-F). Anche se alcuni cambiamenti morfologici si verificano all'interno della regione oltre i 4 giorni, le cellule identiche (molti dei quali sono contrassegnati) possono essere seguite nel tempo. L'intensità di fluorescenza del colorante vitale è diminuito nel corso del tempo, ma i neuroni erano ancora chiaramente identificabili 4 giorni dopo l'etichettatura. Anche se la maggior parte della fluorescenza neuronale colorante vitale era diffusa all'interno del citoplasma, alcuni punctate macchiatura è stata sempre osservata, che è diventato più evidente come sfondo di fluorescenza è diminuito. A fette malsane, una colorazione punctate delle cellule non neuronali inoltre è stata osservata come sezioni si è deteriorate. Questi risultati dimostrano che cellule identificate a fette possono essere imaged ripetutamente utilizzando marchi fiducial per trovarli.
Per esaminare i cambiamenti di tempo-dipendente in organizzazione neuronale e redditività entro fette durante la coltura a lungo termine, abbiamo seguito le stesse fette oltre 5 settimane, etichettatura con colorante vitale neuronale fluorescente una volta alla settimana 24 h prima di formazione immagine. Più cicli di macchiatura con questo colorante vitale sopra parecchie settimane aumentato accumulo di aggregati. I neuroni all'interno appena placcati fette che erano ancora in plasma coaguli sono stati caricati con colorante ed imaged a un giorno in vitro (1 DIV). Le fette stesse erano imaged nuovo settimanale per 5 settimane. Immagini ottenute da una singola fetta con un obiettivo 4x sono mostrate (Figura 7A-E). Gli strati di cellule piramidali delle regioni CA e DG sono etichettati brillantemente quando eccitato a 488 nm e fluorescenza emissione misurata a > 620 nm. Su un periodo di 5 settimane di osservazione 19 fette, tre fette è venuto fuori il vetrino coprioggetto e altri due perso loro morfologia tipica ed è diventato opachi, un'indicazione della loro morte. Così, dovrebbe essere considerato un tasso di sopravvivenza di circa il 70% per gli esperimenti, e fette supplementari preparati assicurare un numero sufficiente per l'analisi. Fette sono stati preparati con un'impostazione di spessore nominale sull'elicottero del tessuto di 300 µm. Dopo 5 settimane in cultura, abbiamo misurato lo spessore di taglio da imaging neuronale fette macchiato di colorante vitale dal coprioggetto fino attraverso la fetta con un 40x di olio su un microscopio confocale del disco di filatura. Perdita di messa a fuoco di neuroni si è verificato a una media di 257 nm (n = 5 fette con più posizioni utilizzate per fetta), dimostrando che molto poco assottigliamento della fetta era accaduto dal momento della placcatura. Noi non potremmo misurare con precisione lo spessore di taglio mediante microscopia a fluorescenza al momento della placcatura perché il colorante vitale intrappolato nel coagulo di plasma dato diffuso fluorescenza rendendo difficile misurare con precisione la posizione in cui si è verificata perdita di messa a fuoco. Tuttavia, immagini 3D dei neuroni all'interno di fette sono facilmente ottenuti a fette dopo il coagulo di plasma è stato rimosso. La fetta DIV 21, mostrato a basso ingrandimento in Figura 7F, era imaged con un obiettivo 60x su un microscopio confocale (passi di 1 µm) 3 giorni dopo il carico con il colorante vitale neuronale. Un'immagine 3D di 60 µm è stata costruita da piani focali (Figura 7G). Neuroni e loro processi di neuriti che sono etichettati con il colorante vitale possono essere seguite in 3D. Morfologia e struttura 3D delle fette erano ben mantenuti per almeno 3 mesi, e i tempi più lunghi sono stati utilizzati nello studio corrente.
Importanti cambiamenti nella morfologia di una posizione precedentemente imaged avvenne anche in alcune fette, suggerendo quello movimento della fetta il coprivetrino può aver luogo. Certamente, negli intervalli più lunghi tra imaging è diventato più difficile sapere con certezza che le cellule nel campo essere imaged erano identiche a quelli osservati nelle sessioni precedenti di formazione immagine. Quindi, massima proiezione immagini delle pile confocal di vitale fette tingere-contrassegnati acquistati nella posizione identica con l'obiettivo di 60 x ad intervalli settimanali che misura 4 settimane (Figura 8) mostrano che la vitalità neuronale è ben tenuto, ma che è difficile identificare un neurone specifico nel tempo quando le immagini sono ottenute con lunghi intervalli di tempo tra le sessioni. Presumibilmente il modello delle cellule etichettati con fluorofori più sarebbe più facilmente riconoscibile, come sono le cellule in gruppi localizzati quando osservato mediante lo scorrimento attraverso una serie di immagini.
Per valutare l'utilità di diversi vettori virali per l'introduzione di geni esogeni in neuroni di fette hippocampal, abbiamo confrontato la fetta infettività utilizzando AV, AAV e vettori ricombinanti lentivirali, ogni espressione tag fluorescenti differenti, o utilizzando diversi promotori all'espressione di unità. AV (2 x 107 infettiva U/fetta) esprimendo cofilina-mRFP dietro un forte, non-cellula specifico promotore CMV è stato usato per infettare una fetta hippocampal del mouse che era stata colte 9 settimane sulle lamelle. Espressione di cofilina-mRFP è stato trovato in tutta la fetta a post-infezione 5 giorni, con l'espressione più intensa intorno alla periferia di fetta come osservato con un obiettivo 4x (Figura 9A). Le cellule all'interno della slice che esprimono cofilina-mRFP inoltre sono state osservate con un obiettivo X 20 (Figura 9B) con qualche brillante colorazione punctate e anche diffondono espressione in sia i neuroni e le cellule non neuronali. Dopo 17 settimane nella cultura (post-infezione 8 settimane), spontanee cofilina-canne avevano formato in alcune cellule, presumibilmente guidato da sovraespressione di tipo selvaggio cofilina-mRFP (Figura 9C)26,27.
Inoltre abbiamo dimostrato che AAV (1010 particelle) potrebbero essere utilizzate per l'espressione in fette.Immagini di fette infettati a 9 settimane di cultura con AAV, in cui un promotore della sinapsina specifico neuronale guidato espressione di GCaMP5-cofilina-mRFP con una sequenza del peptide P2A self-che fende nel linker della poliproteina tradotta21, sono stati catturati 8 settimane dopo l'infezione (17 settimane nella cultura). Nei neuroni che esprimono la GCaMP5 e la cofilina-mRFP, alcuni cofilina Rohi/aggregati formati (Figura 9D-F). L'intensità di fluorescenza dei coni retinici/aggregati era così forte che molto poco fluorescenza di una diffusa cofilina-mRFP ha potuto essere osservata senza saturazione completa e sbocciante dell'immagine cofilina fluorescenza di canne. Coni retinici cofilina spontanea appaiono in neuroni in cui chimere di selvaggio-tipo proteina cofilina-fluorescenti hanno stati sovraespressi26,27, così come in sottolineato neuroni10. Basato sui titoli dell'adenovirus, che sono determinati sulla base di infettività14 ed i conteggi di particelle utilizzati per determinare il titolo AAV, circa 100-500 volte più alti numeri di particella di AAV sono necessarie per ottenere circa l'infettività stesso / espressione in fette rispetto al AV
Per seguire espressione ricombinante mediata da lentivirus di proteine fluorescenti a fette, fette sono stati infettati alle 6 DIV con 1, 3, 10 e 30 aliquote µ l di un lentivirus ricombinanti per espressione specifica neuronale (promotore della sinapsina) di cofilina-R21Q-mRFP, sviluppato come una cellula viva sonda per cofilina-actina asta formazione16di imaging. Fette sono stati etichettati con un neurone colorante vitale alle 11 DIV ed imaged in regioni specifiche per la tintura e l'espressione cofilina-R21Q-mRFP su DIV. 12 e 14 La fetta infettata con l'aliquota di 30 µ l di virus non è sopravvissuto per imaging ma triplice copia fette trattati con gli altri volumi del virus ha mostrato un'espressione dipendente dalla dose di mRFP. Figura 10 Mostra le immagini delle fette infettati da 1 µ l e 10 µ l di lentivirus alle 6 e 8 giorni post-infezione. Le regioni multiple di due fette diverse sono state quantificate per la co-macchiatura dei neuroni con il colorante vitale e l'espressione mRFP. Per fette infettate da 1 µ l di lentivirus, circa il 28% dei neuroni espresso mRFP post-all'infezione 6 giorni, aumentando all'85% di post-infezione 8 giorni. Per fette infettate da 10 µ l di lentivirus, circa il 58% dei neuroni espresso mRFP post-all'infezione 6 giorni, aumentando all'86% di post-infezione 8 giorni. Così, 1 µ l del lentivirus era sufficiente a fornire espressione neuronale e la loro infettività fetta diffusa di post-infezione 8 giorni.
Per dimostrare che questo sistema di coltura è utile nel successivo sviluppo di patologia cofilina, fette infettati da lentivirus per esprimere cofilina-R21Q-mRFP nei neuroni sono stati lasciati non trattati o trattati con varie concentrazioni (1 µM, 333 nM e 100 nM) di sintetica proteina umana Aβ che aveva subito incubazione a forma oligomeri28. Risultati da studi precedenti hanno dimostrato che Aβ sinteticio indurre canne cofilina-actina in fino a 25% dei neuroni hippocampal dissociati29,30,31. Tutti i tre fette trattate con la concentrazione di 1 µM di Aβ si sono staccate dal coprioggetto nelle prime 24 ore, considerando che tutti i veicolo trattato fette (controllo) e quelli trattati con il 333 nM e 100 nM concentrazioni di Aβ è sopravvissuto per le due settimane che seguono. Le stesse regioni cellulari (CA1, CA3 e DG) in una fetta trattati con 100 nM Aβo erano imaged (obiettivo 60x) per diversi giorni. Fette di controllo che sono stati infettati sulla 6 DIV con lentivirus per esprimere la sinapsina guidato cofilinR21Q-mRFP avevano diffuso mRFP cellulare espressione di 15 DIV (Figura 11A). Fette esposto a 100 nM Aβo alle 14 DIV e ripreso a 15 DIV ha mostrato che la distribuzione di cofilina-R21Q-mRFP è diventato punctata, apparendo in entrambi asta a forma di strutture e funzioni di aggregazione (Figura 11B). Queste strutture sono diventato ancora più prominente 6 giorni dopo trattamento con Aβ (Figura 11C, che è lo stesso campo di cellule come Figura 11B). In molti luoghi ricchi di neurites dove somas di un neurone delle cellule sono assenti (Figura 11D), punctate e asta-come matrici di cofilinR21Q-mRFP sviluppato (frecce in Figura 11C), simile alla distribuzione di cofilina-actina coni retinici precedentemente segnalati entro i neurites di Aβ-trattati di neuroni in coltura29,30,31. Così, questo nuovo metodo di coltura e osservando fette hippocampal consentirà agli utenti di determinare facilmente la vitalità a lungo termine delle cellule in cui cofilina aggrega e forma di canne e la reversibilità della patologia nelle varie fasi di sviluppo e per effettuare misure di dose-risposta su reagenti che potrebbero bloccare o invertire la formazione di cofilina patologia in un altro in vivo-come organizzazione cellulare.

Figura 1: Preparazione della cremagliera del tubo rullo. (A) modello per marcare le posizioni dei fori per foratura fuori il coltura del tessuto piatto fondo 15 cm. Se la figura viene stampata per la dimensione della barra della scala indicata, può essere tagliato e utilizzato per contrassegnare le posizioni su una piastra di coltura 15cm per perforare i fori indicati. (B) completato portaprovette a rulli con due tubi inseriti. Ogni rack è numerata su un adesivo facilmente visibile sulla parte superiore del rack. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Preparazione delle provette di coltura a rulli. (A) la facciata del tubo rullo inserito in una giga su una pressa di trivello per trapanare il foro di 6 mm nel tubo. Linea tratteggiata indica la posizione del tubo rullo piatto parteggiato nell'attrezzatura. (B) End Mostra del jig con il tubo inserito e allineato sopra il foro di trapano. (C) vista dall'alto del foro nella dima per la foratura su rullo di tubi con una punta da 6 mm.Freccia bianca indica la posizione del chiodo cut-off inserito come una fermata per il posizionamento dei tubi e linee doppie nere sono per un po ' allineamento. Molla (D) clip (freccia nera) installata saldamente sul fondo jig per mantenerlo in posizione durante la foratura tubi. (E) dopo il foro di perforazione, i bordi levigati con un utensile di sbavatura e scanalature sono tagliate sul lato interno del foro (inserto spettacoli il buco visto attraverso un microscopio di dissezione) per migliorare il drenaggio medio dal foro durante la rotazione del tubo. Cultura (F) del tubo con il foro allineato ad un foro dell'adesivo di gomma in silicone, a cui verranno allegato il vetrino coprioggetti. Clicca qui per visualizzare una versione più grande di questa figura.
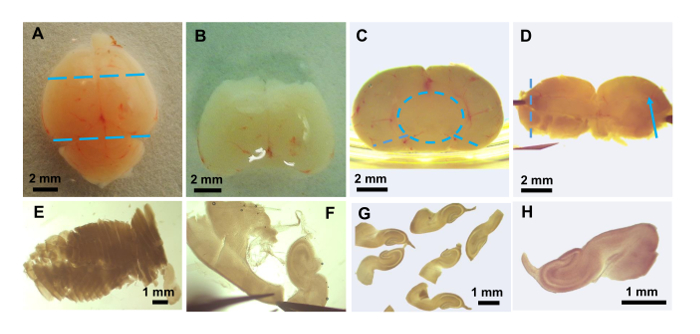
Figura 3: Preparazione di fette hippocampal del cervello. Foto scattate con una mostra di microscopio di dissezione: cervello di topo intatto (A). Posizione di tagli per rimuovere forebrain e nel cervelletto sono visualizzate come linee tratteggiate blue. (B) dopo la rimozione del forebrain e nel cervelletto. (C) pezzo di cervello da B viene girato di 90 ° con regione posteriore (verso il cervelletto) rivolto verso l'alto. Posizionamento del pezzo accanto al lato del piatto aiuta con la rimozione del mesencefalo (cerchio blu tratteggiata) che può essere preso in giro dal restante ippocampo, talamo e ipotalamo. Due tagli con il forcipe (linee tratteggiate blu) permettono la parte restante contenente l'ippocampo da entrambi gli emisferi per essere diffuso piatto. (D), il cervello appiattito pezzo Mostra il vaso sanguigno che corre lungo la fessura hippocampal (freccia blu). Questo tessuto è collocato su film plastico e trasferito all'elicottero di tessuto per affettare in direzione della linea tratteggiata. (E) tessuto risultati leggermente più di metà dell'ippocampo dopo essere ritornati a GBSS/glucosio a fette. (F) dissezione finale dell'ippocampo e la pulizia delle fette per rimuovere il materiale non-ippocampale. (G) galleggiante parecchie fette dopo pulizia finale. (H) foto ingrandita di una sola fetta per il trasferimento al vetrino coprioggetti. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Fette di placcatura e incubando. Fettine di ippocampo (A), A mouse viene rimosso dalla piastra di coltura sulla punta di una spatola con la punta di forcipe per aiutare ascensore gratuito dalla soluzione. (B) la fetta è posizionato appartamento nel centro di un fotoincisioni e trattati vetrino coprioggetti 12 mm su 2 µ l di plasma di pollo e un altro 2,5 µ l di una miscela 1:1 del plasma/trombina è aggiunto per generare un coagulo. (C) dopo aver impostato il coagulo (circa 1-2 min), il rivestimento viene rimosso dal circolo adesivo in silicone gomma su un rullo di avvolgimento e il coprioggetto è posizionato con il coagulo centrato nel foro; quindi il vetrino coprioggetto viene premuto in luogo con un pollice e tenuto in posizione per circa 1 minuto (D) Aggiungi 0,8 mL di terreno di coltura completa. (E) rullo tubo titolari all'interno di un incubatore di grande rullo con la parte anteriore sollevata per inclinazione di 5 ° per mantenere il mezzo nella parte inferiore dei tubi. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Supporto tubo rullo e fase piastra incubatore. (A) supporto del tubo che posiziona il tubo tale che il vetrino coprioggetto viene mantenuto in posizione per l'imaging. (B) supporto tubo montato in un piatto di adattatore fase di microscopio. Cursori sul lato tenere la provetta in modo sicuro per l'imaging. (C) fase adattatore con i pannelli di supporto e lato tubo aggiunto contenenti strisce di riscaldamento collegati ad un regolatore di temperatura termoelettrici. Una volta che i tubi sono montati e posizionati, top solido alla casella può essere aggiunto per aiutare a mantenere la temperatura durante la formazione immagine. Filo arancione è il cavo di termocoppia. Piani per la progettazione e la costruzione del adattatore di fase e del riscaldatore sono disponibili presso: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6 : Utilizzare marchi fiducial per formazione immagine ripetitiva delle stesse cellule. (A) Hippocampal Fetta su vetrino coprioggetti fotoincisioni (quadrati di 1 mm) con subiculum dispiegato (coda) hanno visualizzata con 4 x illuminazione in campo oggettivo e brillante. Curvatura del tubo rullo di plastica contribuisce a creare un'illuminazione obliqua che migliora la visualizzazione della griglia. La casella Mostra la posizione e la dimensione di un campo X 60. (B), una vista della stessa fetta con un obiettivo 20x per trovare il marchio fiducial come la punta della parte inferiore di 4 da Piazza 34. Gli offset x e y sono mostrati per riproducibile individuare il centro della casella desiderata per l'imaging confocale di ingrandimento superiore. (C–F) Una fetta etichettata con un neurone colorante vitale che 13 DIV era imaged utilizzando un obiettivo 60x e fare un'immagine di proiezione 30 µm su 4 giorni consecutivi (14-17 DIV). Neuroni identici erano imaged ogni giorno. La posizione del nucleo in ciascuno dei tre neuroni è contrassegnata con un simbolo diverso. Sono più facilmente identificabili mediante lo scorrimento attraverso le pile di immagine come loro posizione 3D cambia leggermente. Clicca qui per visualizzare una versione più grande di questa figura.
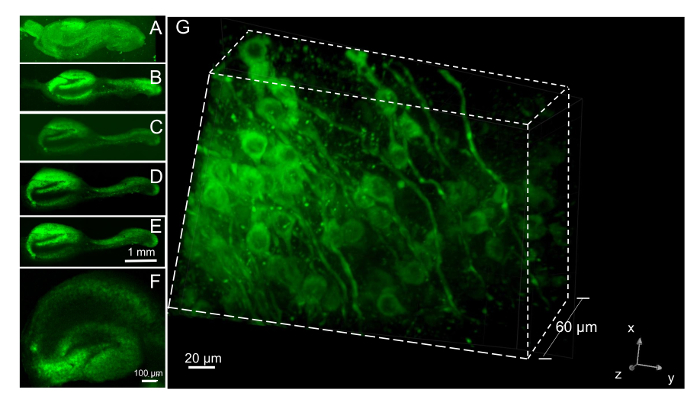
Figura 7 : Imaging neuroni a fette con un colorante vitale neuronale. (A) un neurone colorante vitale macchiato fetta nel coagulo di plasma preso 24 h dopo il placcaggio con obiettivo 4x. Tintura (100 nM) è stato aggiunto quando la fetta è stata collocata nel supporto del tubo rullo e lavata fuori 2 ore più tardi.Subiculum è arricciata intorno l'ippocampo nel coagulo. (B–E) Dopo la dissoluzione del grumo di plasmina aggiunta alle 6 DIV, la fetta è stata ricaricata 5 volte con il colorante vitale 24 ore in anticipo di formazione immagine ad intervalli settimanali. Le immagini sono stati raccolti a 8, 21, 28 e 35 DIV (B–E, rispettivamente). Fettine di ippocampo (F) coltivate per 3 settimane e colorate con il colorante vitale neuronale 24 ore in anticipo di imaging con obiettivo 4x. (G) pila Confocal di immagini sulla stessa fetta come in F mostrando una vista 3D di 61 aerei prelevati a intervalli di 1 µm. Un neurone colorante vitale etichette chiaramente sia i neurites e corpo cellulare, ma è escluso dal nucleo. Clicca qui per visualizzare una versione più grande di questa figura.
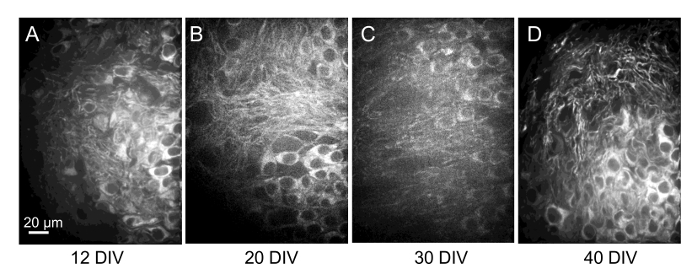
Figura 8 : Ripetitive di imaging dei neuroni in un'unica posizione della fetta più di 4 settimane. Immagini di proiezione massima di 30 serie di immagini confocal µm del campo stesso delle cellule (posizionando) da vitale tingere-contrassegnati fette prese a 12, 20, 30 e 40 DIV (A–D, rispettivamente). È difficile identificare in modo ripetitivo singole celle sopra i tempi più lunghi in proiezione immagini. Tuttavia, anche questi periodi lunghi, identificazione delle stesse cellule spesso è possibile mediante lo scorrimento attraverso le pile di immagine o creazione di immagini 3D che può essere ruotato, come illustrato nella Figura 7G. Clicca qui per visualizzare una versione più grande di questa figura.
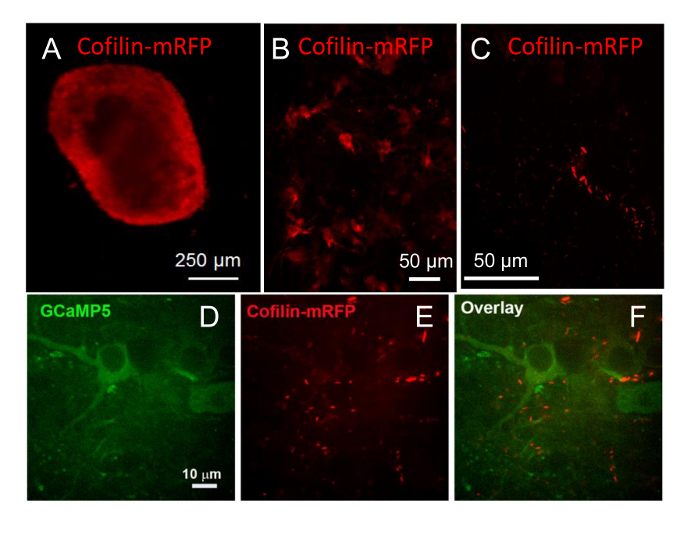
Figura 9 : Espressione virale-mediata e la formazione immagine di proteine fluorescenti. (A) fettine di ippocampo in coltura per 9 settimane e infettati con adenovirus per esprimere cofilina-mRFP dietro un promotore CMV. Espressione è stata trovata in tutta la fetta in 5 giorni post-infezione ma fluorescenza era più luminoso vicino alla periferia di fetta. (B) stessa fetta ha mostrato l'espressione in cellule più profonde all'interno della slice quando viene visualizzata con un obiettivo X 20. L'immagine è che una proiezione da una pila di 20 immagini distanziati di 2 µm apart. (C) la stessa fetta è stato esaminato dopo 17 settimane nella cultura (post-infezione 8 settimane) e cofilina mRFP è stata osservata in aggregati di asta a forma di, come si vede in questa immagine di proiezione da una pila di 70 µm di 23 immagini, 3 µm apart, scattate con un obiettivo 40x. (D–F) Fettine di ippocampo mouse infettati a 9 settimane nella cultura con un AAV esprimendo un GCaMP5-(P2A) - cofilina - mRFP dietro un promotore della sinapsina. Fluorescenza era visibile nei canali sia rossi che Verdi dopo 10 giorni. Un'immagine su un unico piano della fetta mostrando l'espressione di (D) GCaMP5, un giornalista sensibile di calcio, (E) molte canne contenenti cofilina ed (F) una sovrapposizione immagine. Clicca qui per visualizzare una versione più grande di questa figura.
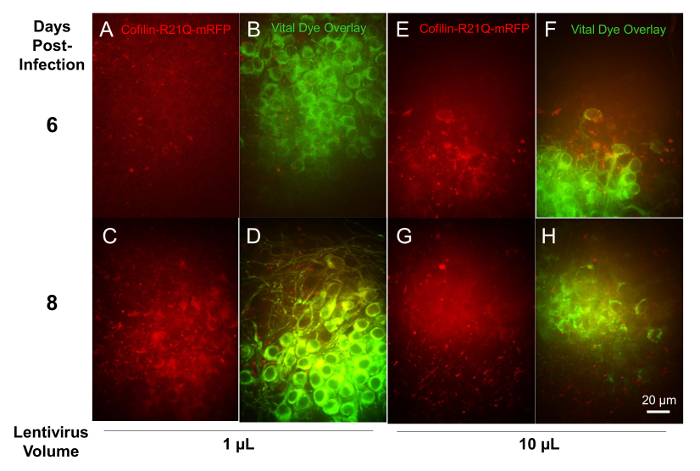
Figura 10 : Espressione di cofilina-R21Q-mRFP guidato da un promotore della sinapsina in neuroni infettati con vettori lentivirali ricombinanti. Rilevazione di un segnale di fluorescenza debole in primo luogo viene osservato da circa 3-4 giorni post-infezione utilizzando 10 µ l di virus e diventa utilizzabile da 5-6 giorni, (E) come si vede in queste immagini acquisite con un obiettivo 60x. Anche se ci vuole più tempo per raggiungere gli stessi livelli di espressione con 1 µ l di virus, di post-infezione 8 giorni una simile percentuale elevata di neuroni (colorante vitale etichettati) esprimevano cofilina-R21Q-mRFP. Solo il 27% dei neuroni erano positive per fluorescenza mRFP alle 6 giorni post-infezione con 1 µ l (A, B) ma questo aumentato all'85% (C, D) di 8 giorni. Clicca qui per visualizzare una versione più grande di questa figura.
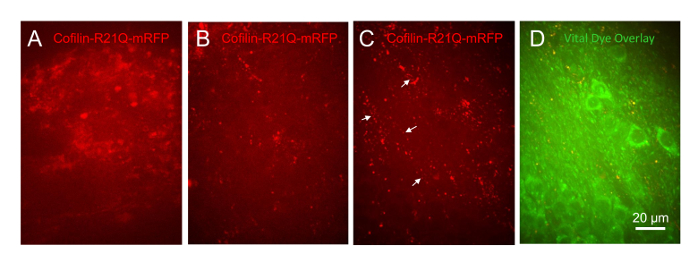
Figura 11 : La patologia indotta da oligomero cofilina Aβ in fette hippocampal del topo. Tutte le immagini scattate come 30 µm immagine stack con un obiettivo di 60 x e vengono visualizzati come immagini di proiezione massima. Fette sono stati infettati con cofilina-R21Q-mRFP alle 6 DIV. fetta (A) 15 DIV trattati su 14 DIV con veicolo (DMSO/prosciutti F12 mezzo utilizzato per generare Aβo). (B) fetta 15 DIV trattati con 100 nM Aβo. (C) stesso campo come in B preso alle 20 DIV e mostrato in (D) come una sovrapposizione con l'etichetta di un neurone colorante vitale. Le frecce indicano matrici lineari degli aggregati cofilina e coni retinici della regione della fetta contenente neurites ma pochi corpi cellulari. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo del tubo rullo descritto qui consente la coltura a lungo termine e di imaging ad alta risoluzione dal vivo del tessuto di cervello affettato. Un grosso problema con la tecnica di fetta come applicato qui è nel montaggio e manutenzione delle fette. Rivestimenti di vetrino coprioggetto che supportano fetta adesione, promuovere la fetta assottigliamento migliorando la conseguenza dei neurites e migrazione delle cellule fuori la fetta; così, abbiamo evitato l'uso di questi substrati. L'inserimento di gruppi amminici sul vetro di trattamento con 3-amminopropiltrietossisilano migliorata l'aderenza delle fette, ma troppo o troppo poco al plasma di pollo il coprivetrino può anche causare problemi di aderenza che portano alla perdita di fetta. Il volume di plasma necessario per una corretta adesione è dipendono dalla dimensione della fetta colta del cervello e così è maggiore per fette hippocampal del ratto, che sono circa 4 volte più grande nella zona di fette di cervello del topo. Se troppo al plasma coaguli sotto la fetta, adesione delle cellule per il coprioggetto è alterata e trattamento con plasmina allenterà la fetta in modo che cambia posizione o si stacca completamente. Tuttavia, troppo poco al plasma nel coagulo può portare a perdita di fetta durante i primi giorni di rotazione nell'incubatrice. In un recente esperimento che coinvolge 39 fette, tre sono stati persi, ma alcuni di quelli persi può derivare dalla fetta danni che si verificano durante il processo di tranciatura. Tuttavia, prepariamo generalmente circa il 50% più fette rispetto al numero stimato necessario per l'esperimento. La seconda causa principale di problemi di cultura è perdita del mezzo attorno alla guarnizione vetrino coprioggetti. Questo problema peggiora quando le lamelle non sono tenute saldamente in posizione per almeno 1 min dopo li apporre il sigillo. Calore da thumb utilizzato per applicare pressione probabilmente aiuta a completare l'adesione. Perdite che si verificano sono spesso attraverso canali aria piccoli sotto il vetrino coprioggetto che può essere osservata con un microscopio di dissezione. Questi di solito scompaiono al momento utilizzando una pressione prolungata del pollice. Perdita di circa il 2% delle colture dovuto perdita lenta può essere previsto e quindi si raccomanda di aspettare 10 giorni dopo aver impostato le culture prima di eseguire le infezioni virali. Pressione del pollice eccessivo, soprattutto se prodotta in modo non uniforme attraverso il vetrino coprioggetto, può anche causare il coprioggetto di crack. Se la rottura è un problema, premendo i tubi giù piatta su un tappetino di gomma riscaldato in un incubatore potrebbe aiutare a distribuire più uniformemente la pressione attraverso il vetrino coprioggetti.
Precedentemente descritto metodi per cultura di fetta di cervello sulle membrane all'interfaccia aria-liquido (sistema aperto) o su un vetrino coprioggetti all'interno di un tubo di plastica sigillato (sistema chiuso) sono molto efficaci per la sopravvivenza a lungo termine di fetta, ma ogni metodo ha i suoi punti di forza e punti di debolezza. Culture della fetta su membrane all'interfaccia liquido dell'aria sono vantaggiose per studi elettrofisiologici combinati con obiettivi di immersione per imaging ad alta risoluzione7, ma hanno inconvenienti per quanto riguarda trovare campo esatto delle cellule per re-imaging nel tempo e l'esposizione potenziale utente e contaminazione oggettivi quando si utilizza l'espressione genica virale. L'uso di virus per l'espressione dei transgeni è più sicuro e più facile da eseguire in un sistema chiuso dove la contaminazione degli obiettivi del microscopio non è un problema. Il nostro metodo di tubo rullo modificate dà accesso della fetta per imaging ad alta risoluzione, anche se non è assoggettabile a studi elettrofisiologici.
Fetta di condizioni di coltura sono state stabilite per molte regioni del cervello del roditore2, ma qui utilizziamo ippocampo solo perché è una delle regioni del cervello più ampiamente studiati e cambiamenti che si verificano nell'ippocampo sono di grande interesse negli studi di danno conoscitivo. Gli strati di cellule piramidali delle regioni CA e DG mantengono loro organizzazione sopra parecchie settimane in coltura e possono essere facilmente osservati morfologicamente. Abbiamo utilizzato una nuova concezione fluorescente vitalità neuronale marcatore25, che ha proprietà di fluorescenza che permettono di essere utilizzato per monitorare la vitalità neuronale e organizzazione all'interno di fette hippocampal per periodi di giorni a mesi, ma è anche compatibile con l'uso di molte altre proteine fluorescenti e giornalisti. Anche se non ottimale per Michele Leonardo Carmelo fluorescenza25, noi possiamo eccitare a Michele Leonardo Carmelo a 488 nm e misura di emissione alle > 617 nm. Fiduciali segni sulle lamelle fotoincisioni ha aiutato a trovare le stesse cellule ripetutamente sopra molti giorni di cultura e ci ha permesso alle regioni identica immagine delle fette sopra molte settimane. Praticamente nessun notevole assottigliamento delle fette si è verificato le lamelle di vetro modificate durante le 5 settimane nella cultura, il punto più lungo di tempo per il quale abbiamo ottenuto misure di spessore della fetta.
AV, AAV e vettori ricombinanti lentivirus funzionano bene per esprimere geni esogeni in fette. Lentivirus con un promotore di un neurone specifico è particolarmente utile per ottenere l'espressione in una percentuale molto alta (> 85%) dei neuroni all'interno di post-infezione 8 giorni. Inoltre, mostriamo che la patologia di rod cofilina-actina associata con lo sviluppo dei deficit conoscitivi nel umana AD10,11 e Aβ che overexpressing del mouse AD modelli32 può essere monitorata in fetta culture trattate con le concentrazioni relativamente basse (100 nM) di sintetico umano Aβo. Noi immaginiamo che le applicazioni future di questo metodo includerà che caratterizzano i nuovi protocolli terapeutici per invertire cofilina-actina asta patologia e/o anomalie di spine dendritiche corretta che si verificano in molti disordini neurologici33.
Materiali
| Name | Company | Catalog Number | Comments |
| Bottoms from 15 cm culture dishes | VWR Scientific | 25384-326 | |
| Phillips Head Machine Screws (#10-32) | Ace Hardware | 2.5" long and 3/16" in diameter | |
| Flat Washers #10 | ACE Hardware | ||
| Machine Screw Nuts (#10-32) | ACE Hardware | ||
| Rubber Grommets | ACE Hardware | 5/16", thick; 5/8", hole diameter; 1.125", OD | |
| Polyethylene tubing (5/16"; OD, 3/16"; ID) | ACE Hardware | Cut to 1.8" length | |
| Lock Washer #10 | ACE Hardware | ||
| Drill Press, 5 speed | Ace Hardware | ProTech Model 1201 | |
| Nunclon Delta Flat-Sided Tubes | VWR | 62407-076 | |
| Drill bits, 3 mm, 6 mm and 15 mm | Ace Hardware | Diablo freud brand | Drill bits for cutting plastic. |
| Drill bits for wood, 1.5 cm and 1 mm | Ace Hardware | ||
| Wood file, 1/4" round | Ace Harware | ||
| Spring clips, 16 mm snap holder | Ace Hardware | ||
| Swivel Head Deburring Tool, 5" | Ace Hardware | 26307 | |
| Adhesive Silicone Sheet (Secure Seal) | Grace Bio-Labs | 666581 | 0.5 mm Thickness |
| 6 mm hole punch | Office Max | ||
| 12 mm hole punch | thepunchbunch.com | ||
| 70% Ethanol | |||
| Phototeched Coverslips, 12 mm diameter | Bellco Glass, Inc. | 1916-91012 | |
| Bunsen Burner | |||
| Absolute Ethanol | |||
| Nanopure Water | |||
| 3-aminopropyltriethoxylane | Sigma-Aldrich | A3648 | |
| Acetone | Sigma-Aldrich | 179124 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| McIlwain Tissue Chopper | Ted Pella, Inc. | 10180 | |
| Double Edge Razor Blades | Ted Pella, Inc. | 121-6 | |
| Whatman Filter Paper | VWR | 28450-182 | Cut into 5.8 cm diameter circles |
| Poly-chloro-trifluoro-ethylene (Aclar) | Ted Pella, Inc. | 10501-10 | Cut into 5.8 cm diameter circles |
| #21 Surgical Blade | VWR Scientific | 25860-144 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| Spatula, stainless with tapered end | VWR | 82027-518 | |
| Gey's Balanced Salt Solution | Sigma-Aldrich | G9779 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Chicken Plasma | Cocalico Biologicals | 30-0300-5L | Rehydrate in sterile water, centrifuge at 2500 x g 30 min at 4 °C, quick freeze aliquots in liquid nitrogen and store at -80 °C. |
| Thrombin, Topical (Bovine) | Pfizer | Thrombin-JMI | Quick freeze aliquots in liquid nitrogen at 1,000 international units/mL in diluent provided and store at -80°C. Use at 250 units/mL. |
| Cell Roller System | Bellco Biotech | SciERA | |
| Roller Incubator | Forma | Model 3956 | |
| N21-MAX | ThermoFisher Scientific | AR008 | |
| Pen/Strep (100X) | ThermoFisher Scientific | 15140122 | |
| 200 mM Glutamine | ThermoFisher Scientific | 25030081 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Neurobasal A | ThermoFisher Scientific | 10888-022 | Complete Medium: 48 mL Neurobasal A, 1 mL N21-MAX, 0.625 mL 200 mM Glutamine, 0.180 mL 25% Glucose, 0.250 mL 100x pen/strep. |
| Third generation lentivirus packaging | Life Technologies | K4975-00 | |
| 159 K cutoff centrifugal filters (Centricon) | EMD Millipore | ||
| Lentiviral cloning system (InFusion) | Clonetech | ||
| Plasmids 30323, 50856, 51279 | Addgene | ||
| Neuronal cell viability dye (NeuO) | Stemcell technologies | 1801 | Thaw once and quick freeze in 4 µL aliquots. Store at -20 °C |
| Inverted microscope | Olympus | IX83 | |
| Microscope objectives | Olympus | air: 4X, 20; oil: 40X, 60X, | |
| Spinning disc confocal system | Yokagawa | CSU22 | |
| Microscope EMCCD camera | Photometrics | Cascade II | |
| Linear encoded (x,y), piezo z flat top stage | ASI | ||
| Microscope lasers and integration | Intelligent Imaging Innovations | ||
| HEK293T cells | American Type Culture Collection | CRL-3216 | |
| Human Plasmin | Sigma Aldrich | P1867 | 0.002 U/mL in 0.1% bovine serum albumin (0.2 mm filter sterilized), quick freeze in liquid nitrogen and store at -80 °C. |
Riferimenti
- Brewer, G. J., Torricelli, J. R., Evage, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term imaging of neuronal circuits in organotypic hippocampal slice cultures. Nat Protoc. 1 (3), 1223-1226 (2006).
- Roo, M. D., Ribic, A. Analyzing structural plasticity of dendritic spines in organotypic slice culture. Methods Mol Biol. 1538, 277-289 (2017).
- Lee, K. F. H., Soares, C., Thivierge, J. -P., Béīque, J. -C. Correlated synaptic inputs drive dendritic calcium amplification and cooperative plasticity during clustered synapse development. Neuron. 89 (4), 784-799 (2016).
- Davis, R. C., Maloney, M. T., Minamide, L. S., Flynn, K. C., Stonebraker, M. A., Bamburg, J. R. Mapping cofilin-actin rods in stressed hippocampal slices and the role of cdc42 in amyloid-beta-induced rods. J Alzheimers Dis. 18 (1), 35-50 (2009).
- Clark, R. E., Squire, L. R. Similarity in form and function of the hippocampus in rodents, monkeys, and humans. Proc Natl Acad Sci U S A. 110, Suppl 2 10365-10370 (2013).
- Minamide, L. S., Striegl, A. M., Boyle, J. A., Meberg, P. J., Bamburg, J. R. Neurodegenerative stimuli induce persistent ADF/cofilin-actin rods that disrupt distal neurite function. Nature Cell Biol. 2 (9), 628-636 (2000).
- Rahman, T., et al. Cofilin rods and aggregates concur with tau pathology and the development of Alzheimer's disease. J Alzheimers Dis. 42 (4), 1443-1460 (2014).
- Bamburg, J. R., Bernstein, B. W. Actin dynamics and cofilin-actin rods in Alzheimer disease. Cytoskeleton(Hoboken). 73 (9), 477-497 (2016).
- He, T. C., Zhou, S., da Costa, L. T., Yu, J., Kinzler, K. W., Vogelstein, B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 95 (5), 2509-2514 (1998).
- Minamide, L. S., et al. Production and use of replication-deficient adenovirus for transgene expression in neurons. Methods Cell Biol. 71, 387-416 (2003).
- Kügler, S., Kilic, E., Bähr, M. Human synapsin 1 gene promoter confers highly neuron-specific long-term transgene expression from an adenoviral vector in the adult rat brain depending on the transduced area. Gene Ther. 10 (4), 337-347 (2003).
- Mi, J., et al. A genetically encoded reporter for real-time imaging of cofilin-actin rods in living neurons. PLOS ONE. 8 (12), 83609(2013).
- Wang, L., Blouin, V., Brument, N., Bello-Roufal, M., Francois, A. Production and purification of recombinant adeno-associated vectors. Methods Mol Biol. 807, 361-404 (2011).
- Matsushita, T., et al. Adeno-associated virus vectors can be efficiently produced without helper virus. Gene Therapy. 5 (7), 938-945 (1998).
- Ward, P., Walsh, C. E. Targeted integration of rAAV vector into the AAVS1 region. Virology. 433 (2), 356-366 (2012).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 32 (40), 13819-13840 (2012).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PLOS ONE. 6 (4), 18556(2011).
- Benskey, M. J., Manfredsson, F. P. Lentivirus production and purification. Methods Mol Biol. 1382, 107-114 (2016).
- Huang, L., Chen, C. Autoprocessing of human immunodeficiency virus type 1 protease miniprecursor fusions in mammalian cells. AIDS Res Ther. 7, 27(2010).
- Bordat, A., Houvenaghel, M. C., German-Retana, S. Gibson assembly: an easy way to clone polyviral full-length infectious cDNA clones expressing an ectopic VPg. Virol J. 12, 89(2015).
- Er, J. C., et al. NeuO: a fluorescent chemical probe for live neuron labeling. Angew Chem Int Ed Engl. 54 (8), 2242-2246 (2015).
- Bernstein, B. W., Chen, H., Boyle, J. A., Bamburg, J. R. Formation of actin-ADF/cofilin rods transiently retards decline of mitochondrial potential and ATP in stressed neurons. Am J Physiol Cell Physiol. 291 (5), 828-839 (2006).
- Cichon, J., et al. Cofilin aggregation blocks intracellular trafficking and induces synaptic loss in hippocampal neurons. J Biol Chem. 287 (6), 3929-3939 (2012).
- Stine, W. B. Jr, Dahlgren, K. N., Krafft, G. A., LaDu, M. J. In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis. J Biol Chem. 278 (13), 11612-11622 (2003).
- Maloney, M. T., Minamide, L. S., Kinley, A. W., Boyle, J. A., Bamburg, J. R. Beta-secretase-cleaved amyloid precursor protein accumulates at actin inclusions induced in neurons by stress or amyloid beta: a feedforward mechanisms for Alzheimer's disease. J Neurosci. 25 (49), 11313-11321 (2005).
- Davis, R. C., et al. Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin phosphorylation. Mol Neurodegener. 6, 10(2011).
- Walsh, K. P., et al. Amyloid-β and proinflammatory cytokines utilize a prion protein-dependent pathway to activate NADPH oxidase and induce cofilin-actin rods in hippocampal neurons. PLOS ONE. 9 (4), 95995(2014).
- Woo, J. A., et al. RanBP9 at the intersection between cofilin and Aβ pathologies: rescue of neurodegenerative changes by RanBP9 reduction. Cell Death Disease. , 6(2015).
- Shaw, A. E., Bamburg, J. R. Peptide regulation of cofilin activity in the CNS: a novel therapeutic approach for treatment of multiple neurological disorders. Pharmacol Ther. 175, 17-27 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon