Method Article
أسلوب أنبوب الاسطوانة المعدلة لتصوير متقطعة الذات المترجمة ومتكررة خلال ثقافة طويلة الأجل من شرائح المخ في نظام مغلق
* These authors contributed equally
In This Article
Summary
قدم هنا طريقة أنبوب اسطوانة معدلة لاستزراع وتصوير عالي الدقة متقطعة من الدماغ القوارض شرائح الأسابيع كثيرة مع إعادة تنظيم دقيق في كوفيرسليبس فوتوتشيد. كذلك يتم الاحتفاظ بصلاحية الخلايا العصبية ومورفولوجيا شريحة. يتم توفير تطبيقات هذا النظام مغلق تماما استخدام الفيروسات للتعبير نوع من الخلايا المحددة.
Abstract
شرائح الدماغ القوارض مثقف مفيدة لدراسة سلوك الخلايا العصبية وإطلاق في بيئة التي يحتفظ العديد من تفاعلاتها طبيعية في فيفو الخلوية والجزيئية. الشرائح التي تم الحصول عليها من مجموعة متنوعة من خطوط الماوس المحورة وراثيا أو استخدام النواقل الفيروسية للتعبير عن البروتينات فلوريسسينتلي المعلمة أو الصحفيين في شرائح الدماغ نوع البرية السماح للتصوير عالي الدقة بالفحص المجهري الأسفار. على الرغم من أن قد وضعت عدة طرق لتصوير شرائح المخ، الجمع بين الثقافة شريحة مع القدرة على القيام بتصوير عالي الدقة المتكررة من خلايا معينة في شرائح حية على مدى فترات زمنية طويلة قد يطرح مشاكل. وهذا ينطبق بشكل خاص عند استخدام النواقل الفيروسية للتعبير عن البروتينات الخارجية حيث يتم ذلك أفضل في نظام مغلق حماية المستخدمين ومنع حدوث التلوث المنتقل. ويفاد بسيطة التعديلات التي أدخلت على أسلوب ثقافة شريحة الدماغ أنبوب الاسطوانة التي تسمح بتصوير عالي الدقة المتكررة لشرائح على مدى أسابيع عديدة في نظام مغلق. استزراع شرائح في كوفيرسليبس فوتوتشيد يسمح باستخدام علامات الاعتماد لسرعة ودقة تعيين موضع مرحلة الصورة الميدانية متطابقة مع مرور الوقت قبل وبعد العلاجات المختلفة. وترد أمثلة لاستخدام هذا الأسلوب جنبا إلى جنب مع تلطيخ الخلايا العصبية المحددة والتعبير لمراقبة التغييرات في بنية شريحة هيبوكامبال والفيروسية بوساطة التعبير العصبية من البروتينات الفلورية وتطوير علم الأمراض كوفيلين، سابقا الذي لوحظ في قرن آمون لمرض الزهايمر (AD) ردا على معاملة الشريحة مع ليغومرات الببتيد اميلويد-بيتا (Aβ).
Introduction
الثقافة الأولية من الخلايا العصبية معزولة من مناطق الدماغ القوارض هو أداة هامة يستخدمها الباحثون لمراقبة الردود على مرضية المتورطين المحفزات. غير أن هذه الدراسات قد عيب تبحث في الخلايا العصبية في 2D فقط ودون نظام الدعم لهم الدبقية. وعلاوة على ذلك، إلا إذا نمت في ظروف كثافة عالية جداً (640 الخلايا العصبية/مم2 أو حوالي 16% من المساحة السطحية) الذي يصبح من المستحيل متابعة ثمرة عشوائية تغصن أو إكسون لأكثر من مسافة قصيرة من جهازها الخليوي، هيبوكامبال صلاحية الخلايا العصبية أكثر من 4 أسابيع انخفاضات كبيرة1، الحد من استخدام الثقافات معزولة لإجراء دراسات موسعة للأمراض المرتبطة بالسن. استزراع شرائح أعدت من الدماغ القوارض هو خيار جذاب أن يتغلب على هذه القيود من خلال الحفاظ العمارة خلية المنظمة وقدرتها على البقاء لأسابيع أو أشهر. وكانت الظروف للحفاظ على العديد من مناطق مختلفة من الدماغ القوارض في ثقافة شريحة وصف2.
اثنين من الأساليب الرئيسية تستخدم على نطاق واسع لثقافة طويلة الأجل من شرائح المخ: يسمح لتدوير في حاضنة اسطوانة توفير تهوية4استزراع على الأغشية في واجهة الهواء السائل3 أو استزراع في كوفيرسليبس في أنابيب محكمة الإغلاق. يمكن تصويرها شرائح مثقف على الأغشية مباشرة مع الفحص المجهري الفلورية العالية الاستبانة استخدام مجهر تستقيم والماء الغمر الأهداف5. بدلاً من ذلك، تم نقل شرائح مثقف في الأغشية للزجاج أسفل الأطباق التوصل إلى حل جيد للعمود الفقري الجذعية استخدام مجهر مقلوب6. ومع ذلك، كلا أساليب التصوير شرائح نمت على الأغشية هي النظم المفتوحة التي تتطلب التغييرات متوسطة، وغالباً ما تستخدم مضاد و/أو المضادات الحيوية لمنع أو الحد من تلوث5،6. الشرائح في غشاء في الواجهة الجوية المتوسطة الحفاظ على مورفولوجيا ممتازة والبقاء على قيد الحياة، ولكن العودة إلى المواقع بدقة أثناء التصوير المتكرر في تضخم عالية من الصعوبة ما لم يتابع التجربة مجموعات صغيرة فقط من الخلايا وإذ تعرب عن علامة نيون. على الرغم من أن قد استخدمت شرائح نمت على الأغشية مع التعبير الفيروسية بوساطة من المتسلسلات5،6، بروتوكولات السلامة الأحيائية قد تتطلب ستستخدم نظام ثقافة مغلقة لبعض النواقل الفيروسية التي يتم استخدامها من أجل وإذ تعرب عن فلوريسسينتلي معلم البروتينات والصحفيين لفيزيولوجيا الخلية. وعلاوة على ذلك، تتطلب أهداف الغمر إزالة التلوث بين العينات التي سيتم اتباعها في الثقافة5. تطبيق الرئيسية واحد من الغشاء واجهة الثقافات هو الجمع بين التصوير عالي الدقة مع الكهربية في وقت واحد النقاط7.
لا يسمح الأسلوب أنبوب الاسطوانة مع كوفيرسليبس داخل أنبوب بلاستيكي أي الكهربية أو تصوير عالي الدقة دون إزالة ساترة. وهكذا طبق هذا الأسلوب في أغلب الأحيان للدراسات الطويلة الأجل التي جعلت الملاحظات التثبيت بعد8. الموصوفة هنا هو طريقة التي يستخدم تقنية الثقافة أنبوب الاسطوانة ولكن المحافظة على أنابيب حفر السحب مع شرائح في كوفيرسليبس التي يمكن تصويرها متكررة لطالما الثقافات. يتطلب أي تغيير متوسطة لتصوير نظام مغلق ويستخدم كوفيرسليبس فوتويتشيد لتقديم علامات الاعتماد التي تسمح للتصوير في تضخم عالية، بعد أيام أو أسابيع، حقول محددة سبق تصويرها.
نقوم بتطبيق هذا الأسلوب لدراسة التغيرات في الحصين القوارض، منطقة الدماغ رئيسية مشاركة في الذاكرة والتعلم. وكثيراً ما يتم دراستها الحصين القوارض كنموذج للتغيرات المرضية أو المرتبطة بالسن التي لوحظت أثناء التطوير من ضعف الإدراك9، مثل تلك التي تحدث في الإعلان. أسلوبنا مناسبة خاصة لدراسة التغييرات المرضية التي تضع ضمن شريحة واحدة على مر الزمن في الاستجابة للتغيرات البيئية، مثل الزيادات في الببتيدات Aβ، التي من سمات AD8. وهو أحد الأمراض المرتبطة بالإنسان والقوارض الدماغ الإعلانية وجود المجاميع كوفيلين-أكتين وقضبان، الحزم التي تحتوي على هذا الأخير من خيوط الأكتين وكوفيلين في 1:1 نسبة مولى10،11، 12-قضبان وقد لوحظت في الشرائح الثابتة الحصين الفئران بعد العلاج Aβ، وكذلك ضمن شريحة الدماغ القوارض يعيش معربا عن التعرض لنقص8كوفيلين-بروتينات فلورية خضراء، وأنها قد تسهم في اختلال وظيفي متشابك في الإعلان والسكتة الدماغية. هنا نستخدم هذا الأسلوب الجديد في تثقيف للالتزام بالوقت بالطبع والتوزيع داخل شرائح أعرب البروتينات الفلورية تشيميريك خارجية عشر أدخلت بأنواع مختلفة من الفيروسات. ثم نستخدم تعبيراً محدداً الخلايا العصبية لبناء كوفيلين مراسل لمتابعة وضع قضيب كوفيلين وأمراض الكلي في شرائح هيبوكامبال استجابة للعلاج مع ليغومرات Aβ القابلة للذوبان (Aβس).
Protocol
استخدام الحيوان يتبع تربية المعتمدة وبروتوكولات استخدام الحيوانات التي تتوافق مع "العناية بالحيوان" و "استخدام المبادئ التوجيهية من جامعة ولاية كولورادو".
ملاحظة: بروتوكول أدناه يصف طريقة إعداد والثقافة للحضانة الطويلة الأجل وتصوير متقطعة شرائح هيبوكامبال. شريحة هيبوكامبال واحدة موصولة إلى ساترة فوتوتشيد أعدت خصيصا استخدام تجلط بلازما، وثم مختومة كوفيرسليبس على الجانب المسطح من أنبوب حفر خارج الاسطوانة، التي يتم الاحتفاظ بها في حاضنة اسطوانة. يتم حل تجلط البلازما لازمين قبل العدوى الفيروسية لتعبير البروتينات الفلورية وتصوير عالي الدقة. يتم استخدام صبغة حيوية الخلايا العصبية فلورسنت الصورة في الخلايا العصبية داخل الشرائح.
1-إعداد الاسطوانة أنبوب حامل
- استخدام القالب هو مبين في الشكل 1 طباعة حجم سيظهر في شريط مقياس. مع مسمار، لكمه ثقوب صغيرة (كبيرة بما يكفي لعلامة نقطة غرامة) في قالب تتمحور حول الثقوب.
- تعيين القالب في أسفل طبق استنبات الأنسجة 15 سم (القطر الأسمى من 14 سم) ووضع علامة على موضع الثقوب. كرر هذا الإجراء في صحن ثاني.
- مع لقم الثقب مصمم للاستخدام على البلاستيك، حفر ثقوب قطرها 1.5 سم ستة في كل طبق في صفيف (4.8 سم مركز إلى مركز) سداسية مع مراكز هول 2.5 سم من حافة الطبق. حفر ثقوب ثلاثة (3 مم في القطر) 12 مم من الحافة التي توضع اكويديستانتلي بين اثنين من أكبر الثقوب كما هو مبين في الشكل 1ألف.
- مع القيعان من كل طبق في مواجهة بعضهما البعض، مكان المسمار آلة طويلة مقاس 2.5 بوصة (قطرها 3/16 بوصة) مع غسالة مسطح من خلال واحدة من الثقوب الصغيرة تليها غسالة شقة ثاني، قطعة من البولي إيثيلين الأنابيب (فاصل، 4.7 سم)، وآخر غسيل مسطح ، طبق استنبات الأنسجة الثانية وغسيل مسطح آخر وغسالة قفل والجوز.
- كرر الخطوة 1، 4 مسامير الجهاز اثنين آخرين، وتشديد فضفاضة فقط حتى يتم كل آلة مسامير في المكان. ثم تشديد المكسرات بشكل أمن.
- تعمل الحلقات (5/16 بوصة سميكة، 5/8 بوصة حفرة قطرها) في الثقوب للطبق السفلي للحصول على أنابيب الاسطوانة النهائية الحامل (الشكل 1ب؛ سيظهر مع اثنين من الأنابيب في مكان). وضع ملصق على كل رف برقم فريد.
2-إعداد أنابيب الرول وكوفيرسليبس
- مما يجعل الرقصة لحفر الحفرة في أنابيب الرول
- حفر حفرة 1.5 سم عمق 8 سم في الجانب مركز 2 × 4 × 5.5 بوصة كتلة خشبية في زاوية من هذا القبيل أن أنبوب الجانب المسطح من الاسطوانة سوف تكون تقريبا بالتوازي مع الكتلة عند إدراج (الشكل 2أ).
- تكبير الثقب باستخدام ملف خشب جولة إلى كل من الاتساع وتفتق حفرة للسماح بإدخال أنبوب (أنابيب الاسطوانة أكبر قليلاً في قطر بالقرب من نهاية عملية النداءات الموحدة) (الشكل 2ب).
- حفر ثقب عمودي قطرها 1.5 سم، سم 5.5 من الجانب من الكتلة، وتتوسط الحفرة الجانبية (الشكل 2-ج).
- عندما ثقب الجانب هو مدبب ما يكفي، إدراج أنبوب اسطوانة التي تم وضع علامة في المكان المطلوب لمركز الحفرة للشريحة ووضع الأنبوب حيث يتركز الفور ملحوظ في حفرة رأسية 1.5 سم.
- إزالة الأنبوب وقياس المسافة من النقطة إلى نهاية الأنبوب. وضع علامة على هذه المسافة من مركز الثقب في الرقصة وإدراج مسمار لتوفير حد لوضع الأنبوب للحفر (السهم في الشكل 2ج) بشكل صحيح.
- استخدم منشارا قطع الأظافر دافق مع سطح كتلة الخشب لمنع الإصابة.
- إضافة قصاصات الربيع في الجزء السفلي من الرقصة إذا كان هناك صحفي الحفر مع الفتحات التي تسمح لها بأن تكون رأسية (الشكل 2د الأسود السهم). خلاف ذلك، استخدام سي المشابك لعقد الرقصة بشكل أمن على الصحافة الحفر.
- استخدام الرقصة الموصوفة أعلاه عقد ووضع أنبوب بلاستيك ثقافة مسطحة الوجهين سم 11 مع الجانب مسطحة (الشكل 2أ)، وحفر حفرة قطرها 6 مم مع مركز 1.0 سم من الأسفل، وتركزت بين الجانبين من الأنبوب.
ملاحظة: يجب استخدام مثقاب مصممة للبلاستيك. - مع أداة deburring الدوران، وتجانس حواف الحفرة (الشكل 2ه) وجعل الأخاديد 4 داخل حافة الحفرة (الشكل 2ه، اقحم) تيسيرا لتجفيف الحفرة أثناء التناوب.
- مع وجود ثقب 12 مم لكمه، وقطع أقراص قطرها 12 مم من أوراق المطاط غير سامة مزدوج الوجهين لاصق السيليكون. استخدام لكمه ثقب واحد ورق قياسية (6 مم)، أحداث فجوة في وسط كل قرص.
- شطف أنابيب حفر مع الإيثانول 70%، والهواء الجاف لهم في سلامة بيولوجية مجلس الوزراء، وتعقيم الأنابيب وأقراص لاصقة لكمات لمدة 40 دقيقة تحت مصباح الأشعة فوق البنفسجية (30 ث على مسافة 70 سم ومتوسط) في السلامة البيولوجية مجلس الوزراء.
- تغيير موضع أنابيب وأقراص بعد 20 دقيقة حيث أن يجري تعقيم جميع الأسطح المكشوفة. تحت ظروف معقمة، تقشر الأبيض النسخ من قرص لاصق وإلصاق سيليكون المطاط إلى خارج الأنبوب، محاذاة الثقوب (الشكل 2و).
تنبيه: لتجنب التعرض للأشعة فوق البنفسجية، ارتداء العين حماية وإغلاق مجلس الوزراء قبل تشغيل مصباح الأشعة فوق البنفسجية. - تنظيف 12 ملم قطر فوتوتشيد (100 مركز مرقمة 1 مم المربعات) الزجاج الألماني كوفيرسليبس. اضغط كوفيرسليبس بلطف بالملقط وتراجع في الإيثانول المطلقة، متبوعاً بالماء، يليه الإيثانول المطلقة مرة أخرى، وأخيراً تراجع كوفيرسليبس في لهب لحرق الإيثانول. السماح كوفيرسليبس لتبرد.
- عقد في كوفيرسليبس بالملقط، تراجع في نسبة 2% 3-أمينوبروبيلتريثوكسيسيلاني في الأسيتون شطف س. 10 كوفيرسليبس مع الماء عالي النقاوة والسماح للهواء الجاف.
- تعيين كوفيرسليبس على ورق الترشيح العقيمة داخل سلامة بيولوجية مجلس الوزراء وتشغيل ضوء الأشعة فوق البنفسجية. يعرض كل جانب من كوفيرسليبس لمدة 20 دقيقة.
تنبيه: لتجنب التعرض للأشعة فوق البنفسجية، ارتداء العين حماية وإغلاق مجلس الوزراء قبل تشغيل مصباح الأشعة فوق البنفسجية.
3. إعداد شريحة هيبوكامبال
- قبل البدء التشريح، إعداد نصفين شفرات الحلاقة حدين للمروحية الأنسجة. أمثال الريش طوليا بعناية مع الأصابع والمفاجئة في نصف.
- شطف نصفي بليد مع الأسيتون باستخدام مسحه القطن لتنظيفها، تليها الشطف في الإيثانول المطلقة وهواء التجفيف.
ملاحظة: بروتوكول ثقافة شريحة الدماغ مستقل من سلالة الفئران أو ماوس أو الوراثي. وقد استخدمت العديد من خطوط الماوس المحورة وراثيا مع مختلف الخلفيات الوراثية.
- مع الملقط، عقد في الجانب الخلفي للدماغ المشذبة أعلى والجانب البطني ضد الجانب طبق بيتري للاستقرار. بلطف ندف السحايا بعيداً حول خط الوسط السهمي وإزالة الأنسجة midbrain استخدام ملقط دومون #5 مقلوب غرامة (الشكل 3جيم، دائرة متقطع).
- إجراء تخفيضات اثنين على طول الجانب من الدماغ لتنتشر مفتوحة (الشكل 3جيم، خطوط متقطعة). حالما يتم وضع الدماغ الظهرية الجانبية إلى أسفل وفتح انتشار، الشق هيبوكامبال يجب أن تكون مرئية (الشكل 3د، السهم).
- نقل انتشار المخ مفتوحة لقطعة من الفيلم بوليتشلوروتريفلوروثيليني البلاستيك ووضعه لتقطيع المرحلة من المروحية الأنسجة. الرطب بليد مع جبس/الجلوكوز وختم الحصين إلى ~ 300 ميكرون شرائح سميكة.
- مع ماصة نقل، مسح الدماغ شرائح إيقاف الفيلم البلاستيك إلى طبق جديد 60 ملم تحتوي على جبس/الجلوكوز (الشكل 3ه). بلطف قرصه قبالة وندف بعيداً، مع غرامة الملقط مقلوب والسحايا المتبقية والأنسجة الأخرى غير هيبوكامبال (الشكل 3و) من الشرائح (الشكل 3ز، ح).
4-طلاء الشرائح
- مرة واحدة وقد تم الحصول على شرائح، ضع 2 ميليلتر من البلازما الدجاج في مركز فوتويتشيد في الجانب ساترة استعداد. وانتشرت في البلازما قليلاً لتحقيق بقعة قطرها 3-4 ملم.
ملاحظة: أن الجانب فوتويتشيد على الجانب العلوي من ساترة عندما ينظر إليها من خلال مجهر تشريح أن الأرقام التي تتجه بشكل صحيح. - نقل شريحة الدماغ 1 مع ملعقة نصيحة الضيقة عقيمة (الشكل 4أ) على الفور البلازما (الشكل 4ب). استخدام الملقط مغلقة للحفاظ الشريحة على طرف الملعقة حين رفع الشريحة من جبس/الجلوكوز.
- تلمس الملعقة للبلازما بقعة ساترة، ومع الملقط مغلقة، ودفع الشريحة على ساترة.
- ميليلتر 2.5 مزيج من البلازما مع 2.5 ميليلتر من ثرومبين في أنبوب منفصل. بسرعة ضع ميليلتر 2.5 من هذا الخليط أكثر وحول شريحة وبيبيت صعودا وهبوطاً بلطف مزيج (الشكل 4ب).
ملاحظة: سوف تجلط البلازما داخل 10-15 ثانية، حيث يجب أن يتم ذلك بسرعة. إذا كان الالتصاق شريحة تمثل مشكلة، مزيج 5 ميليلتر البلازما مع 5 ميليلتر ثرومبين واستخدام 4-5 ميليلتر في الشريحة، إزالة بعض بعد خلط حيث أن الشريحة تقع الشقة على ساترة. - إزالة البلاستيك الشفاف الذي يغطي من الجهة المكشوفة من لاصق مطاط السيليكون سابقا الملصقة على أنبوب اسطوانة وساترة مع شريحة الدماغ على لاصق محاذاة الشريحة داخل الحفرة (الشكل 4ج).
- لضمان الالتصاق، تطبيق لينة، الضغط حتى إلى ساترة مع الإبهام بالضغط ساترة بالتساوي، وعقد لحوالي 1 دقيقة أثناء نقلها إلى السلامة البيولوجية مجلس الوزراء.
- في مجلس الوزراء سلامة بيولوجية، إضافة 0.8 مل من إكمال A نيوروباسال الثقافة المتوسطة (جدول المواد) لكل أنبوبة (الشكل 4د).
- تدفق مزيج هواء 5% CO295 في المائة عن طريق عقيمة الوتر القطن باستور ماصة عقدته المشبك بشكل أمن. تدفق أنبوب الاسطوانة مع خليط الغاز وسرعة في آب الأنبوب حيث يتم سحبه من حولها الماصة.
- تسمية الأنابيب مع رقم الشريحة ورقم الرف. إدراج أنابيب في حامل الرول، ضمان أنها متوازنة بشكل هندسي. إذا كان هناك عدد فردي من الأنابيب، إضافة أنابيب لتحقيق التوازن.
- وضع الرفوف في حاضنة اسطوانة 35 درجة مئوية مع تحول حامل الرول في حول بكرات الأستاذ 10-13 (الشكل 4ه). للحفاظ على المتوسط في الجزء السفلي من الأنابيب، يعود إمالة الحاضنة حوالي 5 درجة برفع به الجبهة في مجلس.
- أدخل رقم الشريحة وأنبوب على جدول بيانات، الذي يستخدم لتسجيل كافة المعلومات من العلاجات شريحة وتواريخ المراقبة.
- في حوالي يوم 6 في الثقافة، وإضافة 1 ميليلتر (0.002 يو) من النشطة لازمين لكل أنبوبة.
- بعد الجلطات تذوب تماما (عادة في غضون ساعات قليلة)، إزالة المتوسطة واستبدالها بالطازجة المتوسطة دون لازمين. إذا لزم الأمر، يمكن المحتضنة شرائح مع لازمين بين عشية وضحاها وتغير المتوسط في اليوم التالي.
- عادة ما يتم المحتضنة شرائح على الأقل 7-10 أيام قبل استخدامها في التجارب. نضح المتوسطة ويحل محله في يوم 3 أو 4، مرة أخرى في اليوم السابع، وبعد ذلك كل 7 أيام.
5-إعداد النواقل الفيروسية للتعبير التحوير
ملاحظة: التعبير عن المتسلسلات في الخلايا العصبية للثقافات شريحة يتحقق أما باستخدام العقول من القوارض المهندسة وراثيا، أو عن طريق إدخال التحوير بالإصابة بفيروسات النسخ المتماثل المؤتلف ناقصة.غدية (AV)، وفيروسات الغدد المرتبطة (إف)، وناقلات lentivirus المؤتلف جميعا قد استخدمت في ثقافاتنا شريحة هيبوكامبال للتعبير عن التركيبات بروتين فلوري مختلف شرائح المخ.
- إعداد النسخ المتماثل AV قاصرة للتعبير عن الحمض النووي الريبي للفائدة وفقا للأساليب الموصوفة في أماكن أخرى13،14. عيار الفيروسات المعدية يو/مل بطريقة التخفيف التسلسلي استخدام جسم مضاد لبروتين فيروسي أعرب كوصف14. لمراقبة كوفيلين المجاميع وتشكيل قضبان كوفيلين-أكتين، الاستفادة من كوفيلين-R21Q-مرفب كدنا (بلازميد #51279)16.
ملاحظة: المروج 1 سينابسين اختياراً ممتازا للخلايا العصبية تعبيراً محدداً15، بينما المروج الفيروس المضخم للخلايا مفيدة للقيادة مستويات عالية من التعبير في العديد من أنواع الخلايا13. - إعداد إف من تعداء المشارك لنقل بلازميد يحتوي على الجينات للفائدة وبلازميد rep/كاب، مع أو بدون بلازميد مساعد، في HEK293 تغليف الخلايا، التي تزود الجين E1 الفيروسية، كما هو موضح سابقا17،في الفترة من18.
ملاحظة: إف المؤتلف يمكن أيضا إجراء للإدراج المستهدفة إلى جينوم الخلية المضيفة19. بلازميد نقل، نستخدم كوفيلين البشرية 1 ج-محطة mRFP1 fluorescence بروتين علامة (بلازميد #50856) المستنسخة في سينابسين المحتوية على مروج إف بلازميد المصب من أجهزة الاستشعار GCaMP5G الكالسيوم20. يتم إدراج قطعة من الترميز الذاتي كليفينج P2A الببتيد تسلسل الحمض النووي بواسطة PCR بين GCaMP5G وكوفيلين--طلب تقديم العروض أثناء إعداد بلازميد نقل لتوفير تعبير البروتينات كلا من إف نسخة واحدة21. - إعداد ناقلات lentivirus المؤتلف من تعداء المشارك لنقل بلازميد يحتوي على الجينات أو كدنا إشارات الاهتمام والتكامل، جنبا إلى جنب مع لينتيفيروس الجيل الثالث تغليف الخليط الذي يقسم هفوة الفيروسية، وبول، والقس، والجينات منظمة-ز على ثلاثة منفصلة والبلازميدات22،23.
- بلازميد نقل، استخدام خطوة واحدة استنساخ النظام24 لتجميع سينابسين المروج وكدنا كوفيلين-R21Q-مرفب (من بلازميد #51279) في pLKO.1-التجارة والنقل (بلازميد #30323)، مع مروج سينابسين واستبدال في هبجك كوفيلين-R21Q-مرفب المروج وكدنا بروتينات فلورية خضراء، على التوالي.
- ترانسفيكت بلازميد النهائي إلى خلايا HEK293T بفوسفات الكالسيوم كما هو موضح سابقا23.
- جمع المتوسطة من أربعة أطباق 10 سم والتركيز إلى 500 ميليلتر استخدام مركزات الطرد المركزي 150 كقطع تخزين lentivirus النهائي في-80 درجة مئوية في مختبرين الصغيرة بعد التجميد السريع في نيتروجين سائل. ذوبان الجليد الكوة إلا مرة واحدة لإصابة الخلايا.
- تحديد تجريبيا حجم كل نوع من أنواع الفيروسات على استعداد لتحقيق درجة التعبير المنشود بإقامة عدد من ثقافات مختلفة من شريحة لتتبع التعبير عن المتسلسلات بعد الإصابة بأحجام مختلفة من الفيروس.
ملاحظة: عادة ما يستخدم 1-10 ميليلتر من الفيروس كل شريحة.
6-شريحة العلاجات
- شرائح إصابة بالفيروس
- تعمل في مجال سلامة بيولوجية مجلس الوزراء الموافقة على عمل الفيروس على مستوى السلامة البيولوجية المناسبة لمكافحة ناقلات، مزيج قاسمة الفيروس (عادة 1-10 ميليلتر) مع 0.8 مل متوسطة كاملة.
- نضح المتوسطة من شريحة باستخدام ماصة باستور معقمة في فخ مجموعة التي تحتوي على التبييض. يتم دائماً استخدام مصيدة ثانوية بين فخ الأولى ومصدر فراغ.
- استبدال هذه الوسيلة بقاسمه المحتوية على الفيروس أعد أعلاه والعودة أنابيب الثقافة برف، ووضع في الحاضنة.
- بعد 2-5 أيام من حضانة الشرائح مع الفيروس في السلامة البيولوجية مجلس الوزراء، إزالة المتوسطة المحتوية على الفيروس مع ماصة نقل عقيمة ووضعه في زجاجة تحتوي على عامل المضادة للفيروسات معتمدة لقتل الفيروس.
- تلوين الخلايا العصبية مع صبغ الحيوية
- تحضير وتخزين مختبرين لصبغ الحيوية العصبية الفلورسنت25 من ميليلتر 4 التجميد السريع لمختبرين في النتروجين السائل بتركيز 100 ميكرومتر وتخزين هذه في-20 درجة مئوية. عدم تجميد/ذوبان الصبغة أكثر من مرة.
- تسمية الخلايا العصبية للتصور بالفحص المجهري الأسفار وذوبان الجليد قاسمة واحد من صبغة حيوية الخلايا العصبية وتضعف إلى 4 مل في كامل نيوروباسال المتوسطة (تركيز الصبغ النهائي هو 100 nM).
- إزالة المتوسطة من شرائح بتطلع (أو مع ماصة نقل إذا المتوسط يحتوي على الفيروس) واستبدله 0.8 مل المتوسطة التي تحتوي على 100 نانومتر صبغ الخلايا العصبية الحيوية. العودة الشرائح إلى جهاز الاسطوانة في الحاضنة.
- بعد حضانة الشرائح من ح 2، نضح المتوسطة المحتوية على صبغ واستبدله 0.8 مل متوسطة كاملة جديدة في سلامة بيولوجية مجلس الوزراء.
ملاحظة: تسمية الخلايا العصبية في شرائح مع صبغ الحيوية يتطلب عدة ساعات للحضانة. عادة ما تؤخذ الصور الأولى ح 24 بعد العلاج صبغ. على الرغم من أن تتم تسمية الخلايا العصبية على وجه التحديد، هناك خلفية الأسفار أن ينخفض أكثر من 2-3 أيام لإعطاء أفضل تصوير الخلايا العصبية. انخفاض كثافة الصبغة الحيوية بعد 72 ساعة. - لمتابعة التغييرات في مورفولوجيا شريحة على مر الزمن، ريلابيل الشرائح كل 7 أيام.
7-شريحة التصوير
- عرض الشرائح على مجهر مقلوب. لتصوير fluorescence ألمع، في 24 ساعة قبل التصوير، وتبادل الثقافة المتوسطة مع المتوسط A نيوروباسال كاملة دون مؤشر الرقم الهيدروجيني الفينول الحمراء.
ملاحظة: للتجارب التي ذكرت هنا، شرائح يتم عرضها على مجهر الأسفار [كنفوكل] قرص مقلوب لغزل مزودة بخطى ترميز x، y المرحلة مع مراقبة z بيزو وكاميرا رقمية ذات دقة عالية حساسية. - نقل الأنبوب مع ثقافة شريحة تصويرها من الجهاز أنبوب الاسطوانة لصاحب الأنبوبة مصنوعة خصيصا (الشكل 5A)، التي وضعت في مرحلة محول (الشكل 5ب)، للحفاظ ساترة عمودي والهدف والحفاظ على الشريحة في نفس اتجاه خلال جلسات التصوير المتكرر على مدى فترات زمنية طويلة.
- دفع المنزلق على محول المرحلة مشددة ضد أنبوب لعقد الأنبوب في الموقف (الشكل 5ب).
ملاحظة: تفاصيل صاحب الأنبوبة، مرحلة محول، ويمكن الوصول إلى سخان في: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/.
ملاحظة: هذه المواقف المقاصة من علامة الاعتماد تسمح بإبراز متسقة من نفس الموقع ساترة عندما يتم تصويرها الشريحة، على الرغم من أن تغيير الإعداد y من علامة الاعتماد الأصلي x، عندما المحول أنبوب أو مرحلة إزالة واستبدال.
ملاحظة: صورة طائرات يتم عادة الحصول على فترات من 0.5 ميكرومتر إلى 2 ميكرومتر، تبعاً لحجم والقرار المطلوب من ملامح الصورة. ويتطلب بناء صورة ثلاثية الأبعاد ذات جودة أن ملامح الصورة تمتد عدة طائرات لاقتناء، وحتى لتصور ملامح أصغر، أصغر فترات مطلوبة بين الطائرات.
ملاحظة: ذكرت معظم دورات التصوير هنا كانت تحت 18 دقيقة/شريحة. بيد أننا قد تصويرها بعض شرائح عشرة أو أكثر الأوقات، وحتى كدام 40 دقيقة في جلسة واحدة، دون إلحاق أي ضرر واضح في بقاء على المدى الطويل من الشريحة.
النتائج
يمكن أن تستخدم لتحديد مدى دقة علامات الاعتماد reimage نفس الخلايا داخل نفس الحقول على مر الزمن، قمنا بدراسة الشرائح التي نمت في فوتوتشيد كوفيرسليبس (الشكل 6A). كانت تصور الخلايا العصبية بصبغة بصبغة حيوية (100 نانومتر ح 2؛ لا وصمة عار الخلايا غير العصبية)، الذي يختفي من الخلايا العصبية على مر الزمن دون إلحاق الأذى بالخلايا25. وقد حددنا الاعتماد علامة اختيار في مربع شبكة واحدة (الشكل 6أ، ب)، وجدت منطقة الخلايا العصبية الحيوية المسمى صبغ 24 ساعة بعد وضع العلامات، سجلت x وإزاحة مواقف من علامة الاعتماد (الشكل 6ب) y، وجمعها، استخدام هدفا س 60، رصات الصور [كنفوكل] لهذه المنطقة، وتكرار التصوير في 4 أيام متتالية. تظهر الصور الإسقاط الحد الأقصى من كومة صورة 30 ميكرومتر في نفس الموقع (الشكل 6ج-F). على الرغم من حدوث بعض التغيرات المورفولوجية داخل المنطقة على مدى 4 أيام، يمكن أن تتبع الخلايا متطابقة (العديد منها يتم وضع علامة) على مر الزمن. انخفضت كثافة fluorescence الصبغة الحيوية على مر الزمن ولكن الخلايا العصبية لا تزال واضحة المعالم 4 أيام بعد وضع العلامات. على الرغم من أن معظم الأسفار صبغ الحيوية العصبية منتشر داخل السيتوبلازم، بعض تلطيخ الشروريه دائماً لوحظ، التي أصبحت أكثر وضوحاً كخلفية الأسفار ورفض. شرائح غير صحية، تلطيخ الشروريه الخلايا غير العصبية لوحظ أيضا كشرائح تدهورت. وتبين هذه النتائج أن الخلايا التي تم تحديدها في شرائح يمكن تصويرها متكررة باستخدام علامات الاعتماد للعثور عليهم.
دراسة التغيرات تعتمد على الوقت في الخلايا العصبية المنظمة وقدرتها على البقاء ضمن الشرائح أثناء ثقافة طويلة الأجل، تابعنا الشرائح نفسها أكثر من 5 أسابيع، وضع العلامات مع نيون صبغ الحيوية العصبية مرة واحدة في الأسبوع 24 ساعة قبل التصوير. جولات متعددة من تلطيخ مع هذه الصبغة الحيوية على مدى عدة أسابيع زيادة تراكم المجاميع. كانت محملة بصبغ الخلايا العصبية داخل شرائح مطلي الطازجة التي كانت لا تزال في تجلط البلازما وتصويرها في يوم واحد في المختبر (الدرجة 1). تم تصويرها نفس الشرائح مرة أخرى أسبوعيا لمدة 5 أسابيع. تظهر الصور التي تم الحصول عليها من شريحة واحدة مع هدفا 4 x (الشكل 7ألف إلى هاء). طبقات الخلايا الهرمية في منطقتي CA والمديرية العامة المسماة الزاهية عندما متحمس في 488 نانومتر والأسفار الانبعاثات يقاس على > 620 نانومتر. على مدى فترة 5 أسابيع لمراقبة شرائح 19، خرج ثلاث شرائح ساترة واثنين آخرين فقدت التشكل نموذجي وأصبحت معتمة، مؤشرا على وفاتهم. وبالتالي، ينبغي النظر في معدل البقاء على قيد الحياة من حوالي 70% للتجارب، وإعداد شرائح إضافية لضمان وجود عدد كاف للتحليل. تم إعداد الشرائح في إعداد سمك اسمية على المروحية الأنسجة من 300 ميكرون. بعد 5 أسابيع في الثقافة، قمنا بقياس سمك الشريحة بتصوير الخلايا العصبية الحيوية الملطخة بصبغ شرائح من ساترة حتى عن طريق شريحة ذات هدف نفط 40 X على قرص غزل مجهر [كنفوكل]. حدث فقدان التركيز من الخلايا العصبية في متوسط 257 نانومتر (n = 5 شرائح مع مواقع متعددة تستخدم كل شريحة)، مما يدل على أن ترقق القليل جداً من الشريحة قد حدثت من وقت الطلاء. أننا يمكن أن لا قياس دقة سمك الشريحة بالفحص المجهري الأسفار وقت الطلاء لصبغ الحيوية أكمنة في تجلط البلازما أعطى منتشر الأسفار مما يجعل من الصعب قياس دقة الموقف الذي حدث فقدان التركيز. ومع ذلك، صور ثلاثية الأبعاد للخلايا العصبية داخل شرائح يتم الحصول عليها بسهولة في شرائح بعد إزالة تجلط البلازما. تم تصويرها شريحة DIV 21، سيظهر في التكبير المنخفض في الشكل 7و، مع هدف X 60 في مجهر [كنفوكل] (1 ميكرومتر الخطوات) 3 أيام بعد تحميل مع صبغ حيوية الخلايا العصبية. صورة 3D 60 ميكرومتر بنيت من الطائرات المحورية (الشكل 7ز). الخلايا العصبية وعمليات نورت المسماة بالصبغة الحيوية يمكن أن يتبع في 3D. مورفولوجيا وهيكل ثلاثي الأبعاد لشرائح عليها بشكل جيد على مدى 3 أشهر على الأقل، وكانت تستخدم في أوقات أطول في الدراسة الحالية.
تغييرات رئيسية في مورفولوجية موقفا سابقا المصورة كما حدث في بعض الشرائح، مما يوحي بأن حركة الشريحة على ساترة قد تأخذ مكان. بالتأكيد، على مدى فترات أطول بين التصوير أصبح أكثر صعوبة نعرف على وجه اليقين أن الخلايا الموجودة في الحقل يجري تصويرها كانت مماثلة لتلك التي لوحظت في دورات التصوير السابقة. وهكذا، صور الإسقاط الأقصى مكدسات [كنفوكل] من الشرائح الحيوية المسمى صبغ المكتسبة في الموقع متطابقة مع الهدف 60 x في فترات أسبوعية تمتد أربعة أسابيع (الشكل 8) تظهر أيضا المحافظة على بقاء الخلايا العصبية ولكن فإن من الصعب تحديد خلية معينة على مر الزمن عندما يتم الحصول على الصور بفترات زمنية طويلة بين الدورات. يفترض نمط الخلايا المسماة مع فلوروفوريس متعددة سيكون معترف بها بسهولة أكثر، كما الخلايا في مجموعات محلية عندما لاحظ بالتمرير من خلال رصة صور.
لتقييم فائدة النواقل الفيروسية مختلفة لإدخال الجينات الخارجية في الخلايا العصبية لشرائح هيبوكامبال، قارنا العدوى شريحة باستخدام مركبات، إف، وناقلات لينتيفيرال المؤتلف، كل الإعراب عن العلامات الفلورية مختلفة أو باستخدام مختلفة من المروجين للتعبير بالسيارة. مركبات (2 × 107 U/شريحة المعدية) معربا عن كوفيلين-مرفب وراء مروج CMV قوية، غير خلية محددة تم استخدامه لتصيب شريحة هيبوكامبال ماوس كان مثقف 9 أسابيع في كوفيرسليبس. تم العثور على التعبير عن كوفيلين-مرفب في جميع أنحاء الشريحة في العدوى بعد 5 أيام، مع التعبير الأكثر كثافة حول محيط شريحة كما لاحظ مع هدفا 4 x (الشكل 9ألف). ولوحظت أيضا مع هدف X 20 (الشكل 9ب) مع بعض تلطيخ الشروريه مشرق الخلايا ضمن شريحة معربا عن كوفيلين-مرفب ومنتشر أيضا التعبير في كل من الخلايا العصبية والخلايا غير العصبية. بعد 17 أسبوعا في الثقافة (8 أسابيع بعد العدوى)، شكلت قضبان كوفيلين عفوية في بعض الخلايا، ويفترض أن يقودها overexpression من نوع البرية26،كوفيلين-مرفب (الشكل 9ج)27.
كما أثبتنا أن إف (1010 جسيمات) يمكن أن يستخدم للتعبير في الشرائح.صور للشرائح المصابة في 9 أسابيع في الثقافة مع إف، الذي قاد مروج سينابسين محددة الخلايا العصبية التعبير عن GCaMP5-كوفيلين-مرفب مع تسلسل ببتيد P2A كليفينج ذاتيا في رابط بوليبروتين المترجمة21، تم القبض على 8 أسابيع بعد العدوى (17 أسبوعا في الثقافة). في التعبير عن GCaMP5 وكوفيلين-مرفب الخلايا العصبية، شكلت بعض قضبان كوفيلين/المجاميع (الشكل 9د-F). وكان شدة الأسفار من القضبان/المجاميع حتى قوي أنه يمكن ملاحظة الأسفار القليل جداً من كوفيلين-مرفب منتشر دون الإشباع الكامل وازدهار الصورة الفلورية كوفيلين قضبان. قضبان كوفيلين عفوية تظهر في الخلايا العصبية التي التركيبات البرية من نوع كوفيلين-فلوري البروتين قد تم الإفراط أعرب26،27، فضلا عن أكد في الخلايا العصبية10. استناداً إلى التتر إتش، التي تتحدد على أساس العدوى14 والتهم الجسيمات المستخدمة لتحديد عيار إف، حوالي 100 إلى 500 إضعاف ارتفاع إعداد الجسيمات إف هي اللازمة للحصول على تقريبا نفس العدوى/ التعبير في شرائح مقارنة بالمركبات.
اتباع المؤتلف التعبير لينتيفيروس بوساطة من البروتينات الفلورية في شرائح، شرائح كانت مصابة في الدرجة 6 مع 1، 3، 10، و 30 ميليلتر مختبرين lentivirus المؤتلف لتعبير محدد الخلايا العصبية (مروج سينابسين) كوفيلين-R21Q-مرفب، وضعت كخلية حية تصوير مسبار ل تشكيل رود كوفيلين-أكتين16. شرائح المسمى بصبغة حيوية الخلايا العصبية في الدرجة 11 وتصويرها في مناطق محددة لصبغ والتعبير كوفيلين-R21Q-مرفب على الدرجة 12 و 14 شريحة المصابين قاسمة 30 ميليلتر من الفيروسات لم ينج للتصوير ولكن ثلاث شرائح التعامل مع المجلدات الأخرى من الفيروس أظهرت تعبير تعتمد على جرعة من مرفب. يبين الشكل 10 الصور لشرائح المصابين ميليلتر 1 و 10 ميليلتر من لينتيفيروس في 6 و 8 أيام بعد الإصابة. مناطق متعددة من شرائح مختلفة اثنين كانوا كمياً لتلطيخ المشترك من الخلايا العصبية مع صبغ الحيوية والتعبير مرفب. لشرائح المصابين 1 ميليلتر من lentivirus، أعرب حوالي 28% من الخلايا العصبية مرفب في الإصابة بعد 6 أيام، زيادة بنسبة 85 في المائة خلال 8 أيام بعد الإصابة. لشرائح المصابين 10 ميليلتر من lentivirus، أعرب حوالي 58% من الخلايا العصبية مرفب في الإصابة بعد 6 أيام، زيادة 86 في المائة بحلول 8 أيام بعد الإصابة. وهكذا، 1 ميليلتر من لينتيفيروس كان كافياً لتقديم شريحة انتشار العدوى والتعبير العصبية قبل 8 أيام ما بعد الإصابة.
للبرهنة على أن هذا النظام ثقافة مفيدة في التنمية التالية من الأمراض كوفيلين، تركت شرائح المصابين لينتيفيروس للتعبير عن كوفيلين-R21Q-مرفب في الخلايا العصبية غير المعالجة أو المعالجة بتركيزات مختلفة (1 ميكرومتر، 333 شمال البحر الأبيض المتوسط، و 100 نانو متر) من البروتين الاصطناعية Aβ البشرية التي شهدتها الحضانة إلى نموذج ليغومرات28. أظهرت نتائج الدراسات السابقة أن Aβ الاصطناعيةس الحث على قضبان كوفيلين-أكتين في تصل إلى 25% من الخلايا العصبية هيبوكامبال منفصلان29،،من3031. كل ثلاث شرائح تعامل مع تركيز 1 ميكرومتر Aβ جاءت فضفاضة من ساترة في أول 24 ساعة، بينما تعامل جميع المركبات شرائح (تحكم) والذين يعالجون 333 نانومتر و 100 نانومتر تركيزات Aβ نجا لمدة أسبوعين أنها المتبعة. نفس المناطق الخلوية (CA1، CA3، والمديرية العامة لل) في شريحة تعامل مع 100 نانومتر Aβس تم تصويرها (60 x الهدف) على مدى عدة أيام. وكان شرائح التحكم التي كانت مصابة في الدرجة 6 مع لينتيفيروس للتعبير عن سينابسين مدفوعة cofilinR21Q-مرفب التعبير مرفب الخلوية منتشر بشعبة 15 (الشكل 11ألف). شرائح تتعرض إلى 100 نانومتر Aβس في 14 DIV وتصويرها في 15 DIV أظهرت أن توزيع كوفيلين-R21Q-مرفب أصبح الشروريه، التي تظهر في كل قضيب على شكل هياكل والمجاميع (الشكل 11ب). وهذه الهياكل أصبحت أكثر بروزا يوما Aβ-العلاج (الشكل 11ج، الذي هو نفس الحقل للخلايا ك رقم 11ب) 6. في العديد من الأماكن الغنية في نيوريتيس اتفاقات الخلايا العصبية فيها غائبة (الشكل 11د)، وضع صفائف cofilinR21Q-مرفب الشروريه وقضيب مثل (الأسهم في الشكل 11ج)، مماثلة لتوزيع كوفيلين-أكتين وأفادت قضبان سابقا داخل نيوريتيس Aβ تعامل الخلايا العصبية في الثقافة29،،من3031. وهكذا، هذه الطريقة الجديدة لاستزراع ومراقبة شرائح هيبوكامبال سوف تسمح للمستخدمين لتحديد استمرارية على المدى الطويل من الخلايا في شكل قضبان والمجاميع التي كوفيلين وإمكانية الرجوع لعلم الأمراض في مراحل مختلفة من التنمية، وأن بسهولة إجراء قياسات الاستجابة للجرعة على الكواشف التي يمكن منع أو عكس تشكيل الأمراض كوفيلين في أكثر في فيفو--مثل منظمة الخلوية.

رقم 1: إعداد الاسطوانة أنبوب حامل. (أ) قالب لوضع علامات على مواقع ثقب الحفر بقيعان طبق استنبات الأنسجة 15 سم. إذا كان يتم طباعة هذا الرقم لحجم شريط مقياس سيظهر، يمكن قطع ويستخدم لوسم مواقف على طبق ثقافة 15 سم لحفر ثقوب سيظهر. (ب) أكمل الاسطوانة أنبوب رف بأنبوبين إدراجها. يتم ترقيم كل رف على ملصق مرئية بسهولة على الرف العلوي. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 2 : إعداد أنابيب الثقافة الاسطوانة. عرض الجبهة (A) أنبوب الاسطوانة المدرجة في رقصة في مطبعة حفر الحفر خارج الحفرة 6 مم في الأنبوب. يظهر خط متقطع موضع الأنبوب الاسطوانة الوجهين شقة في الرقصة. نظراً للرقصة مع إدخال أنبوب نهاية (ب) وحفر بت الانحياز أكثر من ثقب. (ج) عرض أعلى من الثقب في الرقصة للحفر بأنابيب الرول بمثقاب 6 مم.السهم الأبيض يظهر موقف لوقف إنتاج المواد الانشطارية الأظافر إدراجها كمحطة لتحديد المواقع في الأنابيب، والخطوط السوداء مزدوجة للمحاذاة قليلاً. الربيع (د) مقاطع (السهم الأسود) مثبتة في أسفل الرقصة لأمن عقد في الموقف عند حفر أنابيب. (ه) بعد الحفر خارج الحفرة، الحواف هي ممهدة مع أداة deburring وهي قطع الأخاديد على الجانب الداخلي من الحفرة (يظهر اقحم الحفرة عرضها من خلال مجهر تشريح) لزيادة استنزاف المتوسطة من الثقب أثناء دوران الأنبوبة. (و) الثقافة أنبوب مع ثقب الانحياز إلى ثقب في لاصق مطاط السيليكون، الذي سيلحق ساترة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
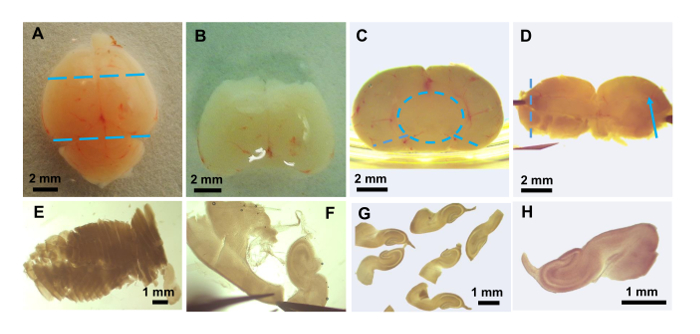
الشكل 3: إعداد شرائح المخ هيبوكامبال. الصور التي اتخذت مع عرض مجهر تشريح: الدماغ سليمة الماوس (A). موقف تخفيضات لإزالة فوريبرين والمخيخ تظهر كخطوط زرقاء متقطعة. (ب) بعد إزالة فوريبرين والمخيخ. (ج) قطعة من الدماغ من ب هو انقلبت 90 ° مع المنطقة الخلفية (نحو المخيخ) مواجهة. الموضع القطعة بجوار الجانب للطبق يساعد على إزالة midbrain (دائرة زرقاء متقطعة) التي يمكن أن تكون مثار بعيداً عن بقية الحصين والمهاد وتحت المهاد. تخفيضات اثنين بالملقط (خطوط زرقاء متقطعة) تسمح القطعة المتبقية المحتوية على الحصين من كلا نصفي الكرة الأرضية أن تنتشر شقة. (د) المخ مسطح قطعة عرض الأوعية الدموية تعمل على طول الشق هيبوكامبال (السهم الأزرق). هذا النسيج على الأفلام البلاستيكية ونقل إلى المروحية الأنسجة لتقطيع في اتجاه خط متقطع. (ﻫ) شرائح الأنسجة تظهر أكثر قليلاً من نصف قرن آمون بعد إعادته إلى جبس/السكر. (و) التشريح النهائي الحصين وتنظيف الشرائح لإزالة المواد غير هيبوكامبال. (ز) عائمة عدة شرائح بعد تنظيف نهائية. (ح) صور الموسع لشريحة واحدة لنقل إلى ساترة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الشكل 4 : شرائح الطلاء وتحضين- يتم إزالة (أ) بالماوس هيبوكامبال شريحة من الطبق الثقافة على طرف ملعقة استخدام طرف الملقط للمساعدة على رفعه حرة من الحل. (ب) الشريحة يوضع شقة في وسط فوتويتشيد ومعاملة ساترة 12 ملم على 2 ميليلتر من البلازما الدجاج وآخر ميليلتر 2.5 من خليط 1:1 بلازما/ثرومبين يضاف إلى تولد جلطة. (ج) بعد أن يتم تعيين الجلطة (حوالي 1-2 دقيقة)، تتم إزالة الغطاء من دائرة لاصقة المطاط سيليكون في أنبوب اسطوانة وهو المتمركزة في ساترة مع تجلط تركزت في الحفرة؛ ثم الضغط في المكان مع التجربة ساترة والمنعقد في الموقف لحوالي 1 دقيقة (د) إضافة 0.8 مل من إكمال الثقافة المتوسطة. الاسطوانة (ه) أنبوب أصحاب داخل حاضنة اسطوانة كبيرة مع الجبهة التي أثيرت لإمالة 5 º للحفاظ المتوسط في الجزء السفلي من الأنابيب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

5 الرقم: حامل أنبوب الاسطوانة وحاضنة لوحة المرحلة. (أ) حامل أنبوب أن المواقف الأنبوب حيث يتم الاحتفاظ ساترة في موقف للتصوير. (ب) شنت حامل أنبوب في لوحة محول مرحلة مجهر. منزلقات على الجانب أمسك الأنبوب بشكل أمن للتصوير. (ج) مرحلة إضافة محول مع أنبوب حامل والجانب اللوحات تحتوي على شرائط التدفئة متصل بوحدة تحكم درجة حرارة حرارية. حالما يتم تحميل أنابيب والمتمركزة، يمكن إضافة أعلى صلبة إلى المربع المساعدة في الحفاظ على درجة الحرارة أثناء التصوير. السلك البرتقالي هو الرائدة الحرارية. خطط لتصميم وبناء محول المرحلة وسخان متاحة في: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-

الرقم 6 : استخدام علامات الاعتماد للتصوير المتكرر لنفس الخلايا. (أ) هيبوكامبال شريحة في ساترة فوتوتشيد (المربعات 1 مم) مع سوبيكولوم تكشفت (الذيل) شوهدت مع 4 × إضاءة الحقل الهدف ومشرق. انحناء أنبوب الرول البلاستيك يساعد على خلق إضاءة مائلة التي يعزز تصور الشبكة. يظهر المربع موضع وحجم الحقل X 60. (ب) عرض الشريحة نفسها مع هدف 20 x لإيجاد علامة الاعتماد غيض من الجزء السفلي من 4 من ساحة 34. وترد للإزاحة y و x لتكاثر تحديد موقع مركز المربع المطلوب لأعلى التكبير [كنفوكل] التصوير. (ومنج–) شريحة المسمى بصبغة حيوية الخلايا العصبية تم تصويرها 13 DIV هدفا 60 x باستخدام وصنع صورة إسقاط 30 ميكرومتر في 4 أيام متتالية (DIV 14-17). الخلايا العصبية مماثلة تم تصويرها كل يوم. تم وضع علامة وضع النواة في كل من الخلايا العصبية الثلاثة مع رمز مختلف. يتم تعريف أكثر سهولة بالتمرير من خلال رصات الصور على تغير موقف 3D قليلاً. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
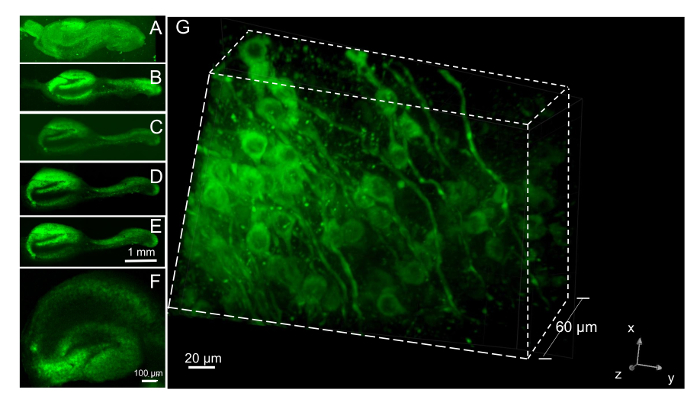
الشكل 7 : تصوير الخلايا العصبية في شرائح مع صبغة حيوية الخلايا العصبية. (أ) الخلايا العصبية الحيوية صبغ ملون شريحة في تجلط البلازما أخذ 24 ساعة بعد الطلاء مع 4 X الهدف. صبغ (100 nM) وأضاف عندما الشريحة أولاً وضعها في حامل أنبوب الاسطوانة وجرفت ح 2 في وقت لاحق.سوبيكولوم هو كرة لولبية حول الحصين في الجلطة. (ب–ه) في أعقاب انحلال جلطة قبل إضافة في الدرجة 6 لازمين، كان حصرياً الشريحة 5 مرات مع صبغ الحيوية 24 ساعة قبل التصوير على فترات أسبوعية. وجمعت الصور المعروضة في 8 و 21، 28 و 35 DIV (ب–ه، على التوالي). (و) شريحة هيبوكامبال مثقف لمدة 3 أسابيع وملطخة بصبغة حيوية الخلايا العصبية 24 ساعة قبل التصوير مع 4 X الهدف. (ز) [كنفوكل] كومة من الصور على الشريحة نفسها كما هو الحال في و عرض طريقة عرض ثلاثية الأبعاد من 61 طائرات تؤخذ على 1 ميكرومتر فترات. صبغة حيوية الخلايا العصبية وضوح تسميات نيوريتيس وجسم الخلية إلا أنه مستبعد من النواة. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
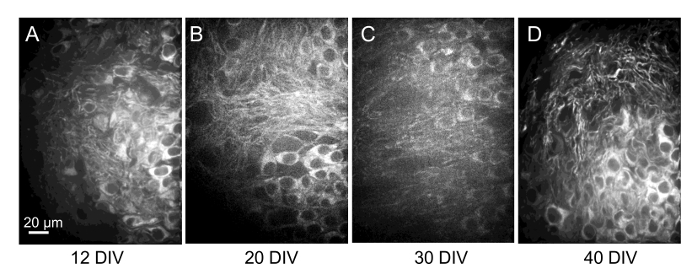
الشكل 8 : تكرار التصوير من الخلايا العصبية في مكان واحد من الشريحة أكثر من 4 أسابيع- صور الإسقاط الحد الأقصى من 30 رصات الصور [كنفوكل] ميكرون من نفس الحقل من الخلايا (بواسطة تحديد المواقع) من الشرائح الحيوية المسمى صبغ المتخذ في 12 و 20، 30 و 40 DIV (A–د، على التوالي). من الصعب تحديد خلايا فردية متكررة على أطر زمنية أطول في صور الإسقاط. ومع ذلك، حتى على مدى فترات طويلة، وهذه غالباً ما يتوفر تحديد نفس الخلايا بالتمرير من خلال رصات الصور أو بناء الصور الثلاثية الأبعاد التي يمكن تدويرها، ومثل كما هو موضح في الشكل 7ز. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
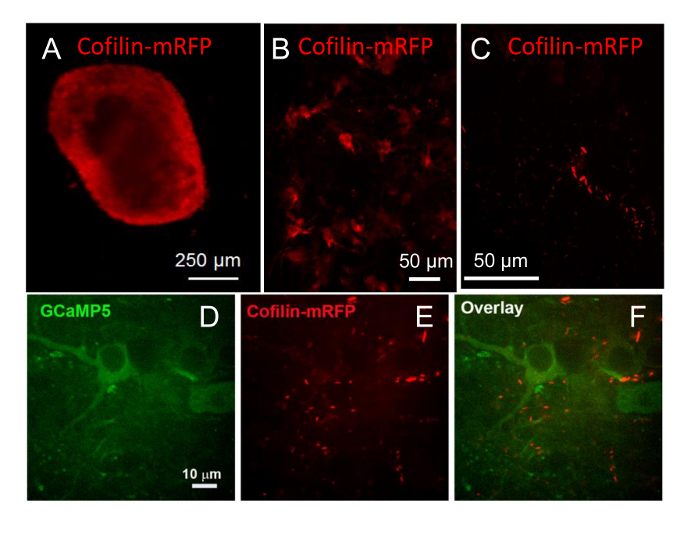
الرقم 9 : الفيروسية بوساطة التعبير والتصوير من البروتينات الفلورية. (أ) شريحة هيبوكامبال مثقف لمدة 9 أسابيع والمصابين إتش للتعبير عن كوفيلين-مرفب وراء مروج CMV. تم العثور على التعبير في جميع أنحاء الشريحة في العدوى بعد 5 أيام لكن الأسفار ألمع قرب أطراف الشريحة. وأظهر (ب) شريحة نفس التعبير في الخلايا أعمق داخل الشريحة عندما ينظر إليها مع 20 X الهدف. الصورة إسقاط من كومة من الصور 20 متباعدة عن بعضها 2 ميكرومتر. (ج) أن الشريحة نفس فحص بعد 17 أسبوعا في الثقافة (8 أسابيع بعد العدوى) ومرفب كوفيلين وقد لوحظ في قضيب على شكل مجاميع كما يتضح في هذه الصورة الإسقاط من 70 ميكرومتر كومة من الصور 23, 3 ميكرومتر وبصرف النظر، اتخذت مع 40 وهدف العاشر. (د–و) شريحة هيبوكامبال الماوس المصابين إف التعبير عن GCaMP5-في 9 أسابيع في الثقافة (P2A) مرفب-كوفيلين-خلف مروج سينابسين. الأسفار كان مرئياً في قنوات الأحمر والأخضر معا بعد 10 أيام. صورة طائرة واحدة من شريحة عرض التعبير عن GCaMP5 (د)، مراسل حساسة كالسيوم، (ه) العديد من قضبان المحتوية على كوفيلين، والصورة (و) تراكب. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
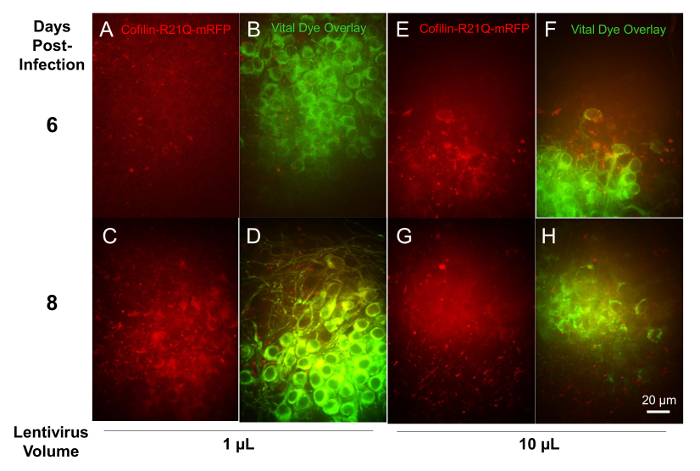
الرقم 10 : التعبير عن كوفيلين-R21Q-مرفب مدفوعا بمروج سينابسين في الخلايا العصبية المصابة مع المؤتلف ناقلات لينتيفيرال. هو لاحظها أولاً عن الإصابة بعد 3-4 أيام 10 ميليلتر من الفيروسات باستخدام الكشف عن إشارة ضعيفة الأسفار وتصبح صالحة للاستعمال من 5-6 أيام، (ه) كما يتضح في هذه الصور المكتسبة مع هدف 60 x. على الرغم من أن يستغرق وقتاً أطول لتحقيق نفس مستويات التعبير مع 1 ميليلتر من الفيروس، 8 أيام ما بعد الإصابة بنسبة عالية مماثلة من الخلايا العصبية (صبغ الحيوية المسمى) كانت معربا عن كوفيلين-R21Q-مرفب. 27 في المائة فقط من الخلايا العصبية كانت إيجابية بالنسبة للأسفار مرفب في الإصابة بعد 6 أيام مع 1 ميليلتر (أو ب) ولكن هذا زيادة بنسبة 85 في المائة (ج، د) قبل 8 أيام. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
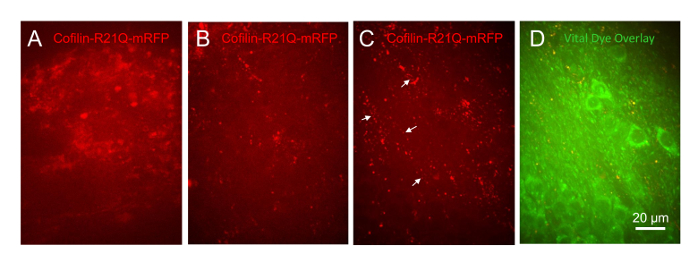
الرقم 11 : Aβ الناجم عن أوليجومير كوفيلين علم الأمراض في شرائح هيبوكامبال الماوس. جميع الصور التي اتخذت ك 30 ميكرومتر الصورة مداخن ذات هدف 60 x وتظهر كصور الإسقاط كحد أقصى. شرائح كانوا مصابين كوفيلين-R21Q-مرفب في 6 شعبة تعامل شريحة DIV (A) 15 على الدرجة 14 مع مركبة (F12 [دمس]/همس الوسيلة المستخدمة لتوليد Aβس). (ب) شريحة 15 DIV تعامل مع 100 نانومتر Aβس. (ج) نفس المجال كما هو الحال في ب المتخذة في الدرجة 20 وسيظهر في (د) كتراكب مع تسمية صبغة حيوية الخلايا العصبية. تظهر الأسهم المصفوفات الخطية من المجاميع كوفيلين وقضبان في منطقة الشريحة التي تحتوي على نيوريتيس ولكن القليل من الهيئات الخلية. الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم-
Discussion
الاسطوانة أنبوب الأسلوب الموصوفة هنا يسمح لاستزراع طويلة الأجل وعالية الدقة تصوير حية من أنسجة المخ شرائح. مسألة رئيسية واحدة مع تقنية شريحة المطبق هنا في التركيب والصيانة لشرائح. الطلاء ساترة التي تدعم انضمام شريحة، تشجيع شريحة رقيق بتعزيز ثمرة نيوريتيس والهجرة من الخلايا خارج الشريحة؛ وبالتالي، علينا تجنب استخدام هذه ركائز. إدراج المجموعات الأمينية على الزجاج بالمعاملة مع 3-أمينوبروبيلتريثوكسيسيلاني تحسن انضمام شرائح، لكن القليل أو الكثير من البلازما الدجاج على ساترة أيضا أن يسبب مشاكل الالتزام مما يؤدي إلى فقدان شريحة. حجم البلازما اللازمة للالتصاق السليم يعتمد على حجم شريحة الدماغ مثقف، وهكذا هي أكبر بالنسبة لشرائح هيبوكامبال الفئران، التي أكبر من حوالي 4 مرات في المنطقة من شرائح المخ الماوس. إذا يتخثر الكثير البلازما تحت الشريحة، التصاق الخلية إلى ساترة البصر والمعاملة مع لازمين سوف تخفف الشريحة حيث أن تغيير موقف أو يفصل تماما. ومع ذلك، البلازما القليل جداً في الجلطة قد يؤدي إلى فقدان شريحة خلال الأيام القليلة الأولى من التناوب في الحاضنة. في تجربة الأخيرة التي تشمل شرائح 39، ثلاثة قد فقدت ولكن بعض من تلك المفقودة قد يكون ناجماً عن شريحة الأضرار التي تحدث أثناء عملية تشريح. ومع ذلك، نحن نستعد عادة حوالي 50% من حاجة إلى شرائح أكثر من العدد المقدر للتجربة. السبب الرئيسي الثاني لمشاكل الثقافة تسرب المتوسطة حول ختم ساترة. هذه المشكلة تزداد سوءا عندما كوفيرسليبس لا تعقد بشدة في موقف لمدة 1 دقيقة على الأقل بعد لصق لهم للختم. الحرارة من الإبهام المستخدمة لتطبيق الضغط على الأرجح يساعد في إتمام الالتصاق. التسرب الذي يحدث غالباً عن طريق قنوات الهواء صغيرة تحت ساترة التي يمكن ملاحظتها مجهر تشريح. وهذه عادة ما تختفي عند استخدام ضغط الإبهام طويلة. يمكن توقع فقدان حوالي 2 في المائة من الثقافات بسبب تسرب بطيء وهكذا يوصي بالانتظار 10 أيام بعد إعداد الثقافات قبل القيام بالعدوى الفيروسية. ضغط الإبهام المفرط، لا سيما إذا ما أنتج موزعة عبر ساترة، يمكن أيضا أن يسبب ساترة للقضاء. إذا كان الكسر قضية، الضغط على الأنابيب أسفل مسطحة على لوحة ماوس مطاط ارتفعت درجة حرارة في حاضنة قد تساعد على توفير الضغط حتى أكثر عبر ساترة.
سبق وصف أساليب لثقافة شريحة الدماغ على الأغشية في واجهة الهواء السائل (نظام مفتوح) أو على ساترة زجاجية داخل أنبوب بلاستيكي مختومة (نظام مغلق) فعالة جداً لبقاء شريحة على المدى الطويل، ولكن كل أسلوب على قوتها و الضعف. شريحة الثقافات على الأغشية في واجهة الهواء السائل المفيد للدراسات الكهربية المجمعة مع أهداف الغمر ل التصوير عالي الدقة7، ولكن لها عيوب فيما يتعلق بإيجاد ميدان الدقيق للخلايا ريماجينج على مر الزمن والتعرض المحتمل للمستخدم والتلوث بموضوعية عند استخدام تعبير الجينات الفيروسية بوساطة. استخدام الفيروسات للتعبير عن المتسلسلات أكثر أماناً وأسهل لأداء في نظام مغلق حيث التلوث مجهر الأهداف ليست قضية. لدينا طريقة أنبوب الاسطوانة المعدلة يعطي الوصول إلى الشريحة لتصوير عالي الدقة، على الرغم من أنها ليست قابلة للدراسات الكهربية.
وضعت شروط ثقافة شريحة للعديد من المناطق في الدماغ القوارض2، ولكن هنا نستخدم الحصين فقط لأنها إحدى مناطق الدماغ درس على نطاق واسع والتغيرات التي تحدث في قرن آمون ذات أهمية كبيرة في الدراسات ضعف الإدراك. طبقات الخلايا الهرمية في منطقتي CA والمديرية العامة الحفاظ على هذه المنظمة على مدى عدة أسابيع في الثقافة، ويمكن ملاحظة سهولة شكلياً. ونحن قد استخدمت بقاء الخلايا العصبية فلورسنت المطورة حديثا علامة25، التي لديها خصائص الأسفار التي تسمح باستخدامها لرصد سلامة الخلايا العصبية ومنظمة داخل شرائح هيبوكامبال على مدى فترات من أيام لأشهر ولكن أيضا متوافق مع استخدام العديد من الصحفيين والبروتينات الفلورية الأخرى. على الرغم من أن ليس الأمثل ل الأسفار نيو25، نحن يمكن أن تثير في نيو في 488 نانومتر وقياس الانبعاثات في > 617 شمال البحر الأبيض المتوسط. علامات الاعتماد على كوفيرسليبس فوتوتشيد ساعد في تحديد موقع الخلايا نفسها متكررة على مدى عدة أيام للثقافة وسمحت لنا بالمناطق صورة متطابقة للشرائح على مدى أسابيع عديدة. تقريبا لا ترقق الشرائح كبيرة وقعت في كوفيرسليبس الزجاج المعدلة خلال 5 أسابيع في الثقافة، النقطة وقت أطول علينا الحصول على قياسات سمك الشريحة.
مركبات، إف، وناقلات lentivirus المؤتلف تعمل جيدا للتعبير عن الجينات الخارجية في شرائح. لينتيفيروس مع أحد المروجين محددة العصبية مفيد بشكل خاص للحصول على التعبير بنسبة مئوية عالية جداً (> 85%) من الخلايا العصبية داخل 8 أيام بعد الإصابة. وعلاوة على ذلك، نعرض أن رود كوفيلين-أكتين علم الأمراض المرتبطة بالتنمية العجز الإدراكي في10،الإعلانية البشرية11 و Aβ overexpressing الماوس الإعلانية نماذج32 يمكن رصدها في الثقافات شريحة تعامل مع تركيزات منخفضة نسبيا (100 nM) للبشرية الاصطناعية Aβس. ونحن نتصور أن تشمل التطبيقات المستقبلية لهذا الأسلوب الذي يتسم به علاجات جديدة لعكس كوفيلين-أكتين رود علم الأمراض و/أو تشوهات العمود الفقري الجذعية الصحيحة التي تحدث في العديد من الاضطرابات العصبية33.
Materials
| Name | Company | Catalog Number | Comments |
| Bottoms from 15 cm culture dishes | VWR Scientific | 25384-326 | |
| Phillips Head Machine Screws (#10-32) | Ace Hardware | 2.5" long and 3/16" in diameter | |
| Flat Washers #10 | ACE Hardware | ||
| Machine Screw Nuts (#10-32) | ACE Hardware | ||
| Rubber Grommets | ACE Hardware | 5/16", thick; 5/8", hole diameter; 1.125", OD | |
| Polyethylene tubing (5/16"; OD, 3/16"; ID) | ACE Hardware | Cut to 1.8" length | |
| Lock Washer #10 | ACE Hardware | ||
| Drill Press, 5 speed | Ace Hardware | ProTech Model 1201 | |
| Nunclon Delta Flat-Sided Tubes | VWR | 62407-076 | |
| Drill bits, 3 mm, 6 mm and 15 mm | Ace Hardware | Diablo freud brand | Drill bits for cutting plastic. |
| Drill bits for wood, 1.5 cm and 1 mm | Ace Hardware | ||
| Wood file, 1/4" round | Ace Harware | ||
| Spring clips, 16 mm snap holder | Ace Hardware | ||
| Swivel Head Deburring Tool, 5" | Ace Hardware | 26307 | |
| Adhesive Silicone Sheet (Secure Seal) | Grace Bio-Labs | 666581 | 0.5 mm Thickness |
| 6 mm hole punch | Office Max | ||
| 12 mm hole punch | thepunchbunch.com | ||
| 70% Ethanol | |||
| Phototeched Coverslips, 12 mm diameter | Bellco Glass, Inc. | 1916-91012 | |
| Bunsen Burner | |||
| Absolute Ethanol | |||
| Nanopure Water | |||
| 3-aminopropyltriethoxylane | Sigma-Aldrich | A3648 | |
| Acetone | Sigma-Aldrich | 179124 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| McIlwain Tissue Chopper | Ted Pella, Inc. | 10180 | |
| Double Edge Razor Blades | Ted Pella, Inc. | 121-6 | |
| Whatman Filter Paper | VWR | 28450-182 | Cut into 5.8 cm diameter circles |
| Poly-chloro-trifluoro-ethylene (Aclar) | Ted Pella, Inc. | 10501-10 | Cut into 5.8 cm diameter circles |
| #21 Surgical Blade | VWR Scientific | 25860-144 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| Spatula, stainless with tapered end | VWR | 82027-518 | |
| Gey's Balanced Salt Solution | Sigma-Aldrich | G9779 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Chicken Plasma | Cocalico Biologicals | 30-0300-5L | Rehydrate in sterile water, centrifuge at 2500 x g 30 min at 4 °C, quick freeze aliquots in liquid nitrogen and store at -80 °C. |
| Thrombin, Topical (Bovine) | Pfizer | Thrombin-JMI | Quick freeze aliquots in liquid nitrogen at 1,000 international units/mL in diluent provided and store at -80°C. Use at 250 units/mL. |
| Cell Roller System | Bellco Biotech | SciERA | |
| Roller Incubator | Forma | Model 3956 | |
| N21-MAX | ThermoFisher Scientific | AR008 | |
| Pen/Strep (100X) | ThermoFisher Scientific | 15140122 | |
| 200 mM Glutamine | ThermoFisher Scientific | 25030081 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Neurobasal A | ThermoFisher Scientific | 10888-022 | Complete Medium: 48 mL Neurobasal A, 1 mL N21-MAX, 0.625 mL 200 mM Glutamine, 0.180 mL 25% Glucose, 0.250 mL 100x pen/strep. |
| Third generation lentivirus packaging | Life Technologies | K4975-00 | |
| 159 K cutoff centrifugal filters (Centricon) | EMD Millipore | ||
| Lentiviral cloning system (InFusion) | Clonetech | ||
| Plasmids 30323, 50856, 51279 | Addgene | ||
| Neuronal cell viability dye (NeuO) | Stemcell technologies | 1801 | Thaw once and quick freeze in 4 µL aliquots. Store at -20 °C |
| Inverted microscope | Olympus | IX83 | |
| Microscope objectives | Olympus | air: 4X, 20; oil: 40X, 60X, | |
| Spinning disc confocal system | Yokagawa | CSU22 | |
| Microscope EMCCD camera | Photometrics | Cascade II | |
| Linear encoded (x,y), piezo z flat top stage | ASI | ||
| Microscope lasers and integration | Intelligent Imaging Innovations | ||
| HEK293T cells | American Type Culture Collection | CRL-3216 | |
| Human Plasmin | Sigma Aldrich | P1867 | 0.002 U/mL in 0.1% bovine serum albumin (0.2 mm filter sterilized), quick freeze in liquid nitrogen and store at -80 °C. |
References
- Brewer, G. J., Torricelli, J. R., Evage, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term imaging of neuronal circuits in organotypic hippocampal slice cultures. Nat Protoc. 1 (3), 1223-1226 (2006).
- Roo, M. D., Ribic, A. Analyzing structural plasticity of dendritic spines in organotypic slice culture. Methods Mol Biol. 1538, 277-289 (2017).
- Lee, K. F. H., Soares, C., Thivierge, J. -P., Béīque, J. -C. Correlated synaptic inputs drive dendritic calcium amplification and cooperative plasticity during clustered synapse development. Neuron. 89 (4), 784-799 (2016).
- Davis, R. C., Maloney, M. T., Minamide, L. S., Flynn, K. C., Stonebraker, M. A., Bamburg, J. R. Mapping cofilin-actin rods in stressed hippocampal slices and the role of cdc42 in amyloid-beta-induced rods. J Alzheimers Dis. 18 (1), 35-50 (2009).
- Clark, R. E., Squire, L. R. Similarity in form and function of the hippocampus in rodents, monkeys, and humans. Proc Natl Acad Sci U S A. 110, Suppl 2 10365-10370 (2013).
- Minamide, L. S., Striegl, A. M., Boyle, J. A., Meberg, P. J., Bamburg, J. R. Neurodegenerative stimuli induce persistent ADF/cofilin-actin rods that disrupt distal neurite function. Nature Cell Biol. 2 (9), 628-636 (2000).
- Rahman, T., et al. Cofilin rods and aggregates concur with tau pathology and the development of Alzheimer's disease. J Alzheimers Dis. 42 (4), 1443-1460 (2014).
- Bamburg, J. R., Bernstein, B. W. Actin dynamics and cofilin-actin rods in Alzheimer disease. Cytoskeleton(Hoboken). 73 (9), 477-497 (2016).
- He, T. C., Zhou, S., da Costa, L. T., Yu, J., Kinzler, K. W., Vogelstein, B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 95 (5), 2509-2514 (1998).
- Minamide, L. S., et al. Production and use of replication-deficient adenovirus for transgene expression in neurons. Methods Cell Biol. 71, 387-416 (2003).
- Kügler, S., Kilic, E., Bähr, M. Human synapsin 1 gene promoter confers highly neuron-specific long-term transgene expression from an adenoviral vector in the adult rat brain depending on the transduced area. Gene Ther. 10 (4), 337-347 (2003).
- Mi, J., et al. A genetically encoded reporter for real-time imaging of cofilin-actin rods in living neurons. PLOS ONE. 8 (12), 83609(2013).
- Wang, L., Blouin, V., Brument, N., Bello-Roufal, M., Francois, A. Production and purification of recombinant adeno-associated vectors. Methods Mol Biol. 807, 361-404 (2011).
- Matsushita, T., et al. Adeno-associated virus vectors can be efficiently produced without helper virus. Gene Therapy. 5 (7), 938-945 (1998).
- Ward, P., Walsh, C. E. Targeted integration of rAAV vector into the AAVS1 region. Virology. 433 (2), 356-366 (2012).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 32 (40), 13819-13840 (2012).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PLOS ONE. 6 (4), 18556(2011).
- Benskey, M. J., Manfredsson, F. P. Lentivirus production and purification. Methods Mol Biol. 1382, 107-114 (2016).
- Huang, L., Chen, C. Autoprocessing of human immunodeficiency virus type 1 protease miniprecursor fusions in mammalian cells. AIDS Res Ther. 7, 27(2010).
- Bordat, A., Houvenaghel, M. C., German-Retana, S. Gibson assembly: an easy way to clone polyviral full-length infectious cDNA clones expressing an ectopic VPg. Virol J. 12, 89(2015).
- Er, J. C., et al. NeuO: a fluorescent chemical probe for live neuron labeling. Angew Chem Int Ed Engl. 54 (8), 2242-2246 (2015).
- Bernstein, B. W., Chen, H., Boyle, J. A., Bamburg, J. R. Formation of actin-ADF/cofilin rods transiently retards decline of mitochondrial potential and ATP in stressed neurons. Am J Physiol Cell Physiol. 291 (5), 828-839 (2006).
- Cichon, J., et al. Cofilin aggregation blocks intracellular trafficking and induces synaptic loss in hippocampal neurons. J Biol Chem. 287 (6), 3929-3939 (2012).
- Stine, W. B. Jr, Dahlgren, K. N., Krafft, G. A., LaDu, M. J. In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis. J Biol Chem. 278 (13), 11612-11622 (2003).
- Maloney, M. T., Minamide, L. S., Kinley, A. W., Boyle, J. A., Bamburg, J. R. Beta-secretase-cleaved amyloid precursor protein accumulates at actin inclusions induced in neurons by stress or amyloid beta: a feedforward mechanisms for Alzheimer's disease. J Neurosci. 25 (49), 11313-11321 (2005).
- Davis, R. C., et al. Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin phosphorylation. Mol Neurodegener. 6, 10(2011).
- Walsh, K. P., et al. Amyloid-β and proinflammatory cytokines utilize a prion protein-dependent pathway to activate NADPH oxidase and induce cofilin-actin rods in hippocampal neurons. PLOS ONE. 9 (4), 95995(2014).
- Woo, J. A., et al. RanBP9 at the intersection between cofilin and Aβ pathologies: rescue of neurodegenerative changes by RanBP9 reduction. Cell Death Disease. , 6(2015).
- Shaw, A. E., Bamburg, J. R. Peptide regulation of cofilin activity in the CNS: a novel therapeutic approach for treatment of multiple neurological disorders. Pharmacol Ther. 175, 17-27 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved