Method Article
封闭系统中脑切片长期培养中精确定位和重复间歇成像的改进辊筒法
* 这些作者具有相同的贡献
摘要
本文介绍了一种改进的滚子管法培养和间歇高分辨率成像啮齿动物脑切片多周, 精确重新定位光刻片。神经元的生存能力和切片形态学保持良好。提供了这种完全封闭的系统使用病毒的细胞类型的特定表达的应用。
摘要
培养的啮齿动物脑切片有助于研究神经元和胶质细胞在维持许多正常的体内相互作用的环境中的分子行为。从各种转基因小鼠线获得的切片或使用病毒载体表达荧光标记蛋白质或记者在野生型脑切片允许高分辨率成像荧光显微镜。虽然有几种方法已经开发成像脑切片, 结合切片培养的能力, 以执行重复高分辨率成像的特定细胞在活片长期的时间已经提出了问题。当病毒载体被用于外源蛋白的表达时尤其如此, 因为这是最好的在一个封闭的系统, 以保护用户和防止交叉污染。简单的修改对辊筒管脑切片培养方法, 允许重复高分辨率成像的切片在一个封闭的系统多周。在光刻片上培养切片允许使用基准标记快速准确地将舞台重新定位到不同处理前后的同一域中。例示为使用此方法结合特定的神经元染色和表达观察海马切片结构的变化, 荧光蛋白的病毒介导的神经元表达, 以及 cofilin 病理的发展,这是先前观察到的阿尔茨海默氏病 (AD) 的海马反应的切片治疗与低聚体淀粉样β (a) 肽。
引言
从啮齿动物脑区分离神经元的原代培养是研究人员用来观察病理性牵连刺激反应的重要工具。然而, 这种研究的缺点是只在2D 和没有他们的神经胶质支持系统的情况下观察神经元。此外, 除非在非常高密度的条件下生长 (640 神经元/mm2或大约16% 的表面积), 在这种情况下, 它不可能跟随树枝状或轴突的随机突起, 而从其细胞体, 海马4周以上的神经元存活能力明显下降1, 限制了游离培养对年龄相关病症的扩展研究。从啮齿动物大脑中制备的切片是一种有吸引力的选择, 它通过维持一个有组织的细胞结构和存活数周或数月来克服这些限制。在切片培养中维持啮齿动物大脑许多不同区域的条件已被描述为2。
两种主要的方法被广泛应用于脑切片的长期培养: 在气界面的膜上培养3或在密封管上培养片, 允许在滚筒孵化器中旋转以提供曝气的4。在膜上培养的切片可以直接成像高分辨率荧光显微镜使用直立显微镜和水浸泡目标5。另外, 在膜上培养的切片也被转移到玻璃底盘, 用倒置显微镜6实现树突棘的良好分辨率。然而, 两种在膜上生长的成像切片方法都是开放系统, 需要进行中等程度的改变, 并且经常使用抗真菌和/或抗生素来防止或减少污染5,6。膜上的切片在 air-medium 界面保持优良的形态学和生存, 但返回到精确的位置在重复成像在高放大率是非常困难的, 除非实验只遵循小小组的细胞表示荧光标记。虽然在膜上生长的切片已使用与病毒介导的表达转基因5,6, 生物安全协议可能需要使用封闭的文化系统, 用于某些病毒载体表达荧光标记的蛋白质和细胞生理学记者。此外, 沉浸目标要求在培养5中遵循的样本之间进行净化。膜界面培养的一个主要应用是结合高分辨率成像与电生理学在单时间点7。
在塑料管内片的滚子管法不允许任何电生理学或高分辨率成像, 不排除片。因此, 这种方法最常被应用到长期研究中, post-fixation 观测已经被做为8。这里描述的是一种利用辊筒培养技术的方法, 但对片上的 drilled-out 管, 只要保持文化, 就可以反复成像。封闭的系统不需要介质变化的成像和利用光刻片提供的基准标记, 允许成像在高放大率, 几天或几周后, 精确的领域以前成像。
我们应用这种方法来检查啮齿动物海马的变化, 这是一个主要的大脑区域, 涉及记忆和学习。啮齿类动物的海马体通常被研究为在认知障碍发展过程中观察到的病理或年龄相关变化的模型9, 如 AD 中发生的那些。我们的方法特别适合于研究随着环境变化而在单个切片内发展的病理变化, 如 a 肽的增加, 这是 AD8的特征。一个病理与人类和啮齿动物 AD 脑是存在的 cofilin 肌动蛋白聚合体和棒, 后者含有束的花丝, 其中 cofilin 和肌动蛋白是在1:1 摩尔比10,11,12. 在 a 治疗后的大鼠海马固定切片上观察到了棒状体, 以及在表达 cofilin-GFP 受缺氧8的活鼠脑切片内, 它们可能会导致 AD 中出现的突触功能障碍。和中风。在这里, 我们用这种新的培养方法观察不同病毒引入的外源嵌合荧光蛋白切片中的时间过程和分布。然后利用 cofilin 记者构造的神经元特异性表达, 跟踪 cofilin 棒和海马切片的聚集病理, 以应对可溶性 a 寡聚体 (ao) 的治疗。
研究方案
动物使用遵循批准的育种和动物使用协议, 符合动物保育和使用的准则, 科罗拉多州立大学。
注: 下面的协议描述了长期孵化和间歇性海马切片成像的制备和培养方法。一个单一的海马切片是连接到一个专门准备光刻片使用等离子凝块, 然后片被密封在平坦的一侧的 drilled-out 辊管, 这是保持在滚筒孵化器。血浆凝块在病毒感染前以溶溶解, 用于荧光蛋白表达和高分辨率成像。一种荧光神经元生命染料被用来在切片中成像神经元。
1. 滚筒管架的制备
- 使用显示在图 1A中的模板打印到缩放栏上显示的大小。用钉子, 打孔小孔 (足够大的罚款点标记) 在模板为中心的洞。
- 将模板设置在 15 cm 组织培养皿的底部 (公称直径为14厘米), 并标记孔的位置。在第二道菜上重复这个。
- 钻头设计用于塑料, 钻六1.5 厘米直径孔在每个菜的六角阵列 (4.8 厘米中心) 与孔中心2.5 厘米从盘子的边缘。钻三孔 (直径3毫米) 12 mm 从等距的边缘放置在两个较大的孔之间, 如图 1A所示。
- 与每道菜的底部面对面, 放置一个2.5 英寸长的机器螺丝 (3/16 英寸直径) 与一个平垫圈通过一个小孔, 其次是第二个平垫圈, 一块聚乙烯管材 (间隔, 4.7 厘米), 另一个平垫圈, 第二个组织培养皿, 另一个平垫圈, 一个锁紧垫圈, 和一个螺母。
- 重复步骤1.4 对其他两个机器螺丝, 并收紧只是松散, 直到所有的机器螺丝到位。然后安全地拧紧螺母。
- 工作扣眼 (5/16 英寸厚, 5/8 英寸孔直径) 到底部盘孔获得最后的滚子管架 (图 1B; 显示为两个管到位)。在每个机架上放置一个带有唯一编号的标签。
2. 滚子管和片的制备
- 滚子管孔钻夹具的制作
- 在一个 2 x 4 x 5.5 英寸木块的中心一侧钻一个 1.5 cm 孔8厘米深, 这样, 当插入 (图 2a) 时, 滚子管的扁平侧将与该块几乎平行。
- 使用圆木文件扩大孔, 使孔扩大和锥度, 允许管插入 (滚柱管直径稍大, 靠近瓶盖) (图 2B)。
- 钻1.5 厘米直径的垂直孔, 从块的一侧5.5 厘米, 并以侧孔为中心 (图 2C)。
- 当侧面孔足够锥形时, 插入一个在所需位置标记的滚子管, 以使切片的孔居中, 并定位管, 以便在1.5 厘米的垂直孔中放置有标记的点。
- 取下管子, 测量从现场到管子末端的距离。从夹具中的孔的中心处标记此距离, 并插入一根钉子, 以提供停止正确定位钻杆的位置 (图 2C中的箭头)。
- 用钢锯将木块表面的钉子切掉, 防止受伤。
- 在跳汰机底部添加弹簧夹, 如果有带有允许锚定的槽的钻床 (图 2D黑色箭头)。否则, 使用 C 形夹具将夹具牢固地固定在钻床上。
- 使用上述夹具举行和定位一个平坦的 11 cm 塑料文化管与平坦的一面 (图 2a), 钻一个6毫米直径孔与中心 1.0 cm 从底部和中心之间的管两侧。
注: 应使用为塑料设计的钻头。 - 使用旋转的去毛刺工具, 平滑孔的边缘 (图 2E), 并在孔的内侧边缘 (图 2e, 嵌入) 上4凹槽, 以便在转动过程中使孔排出。
- 用 12 mm 孔冲床, 从无毒双面胶片中切割12毫米直径的圆盘。使用标准的一个孔纸冲床 (6 毫米直径), 使每个磁盘的中心孔。
- 用70% 乙醇冲洗钻孔管, 在生物安全柜中将空气烘干, 并在生物安全柜中将管子和穿孔的胶盘消毒40分钟, 在紫外线灯下 (30 W, 平均距离为70厘米)。
- 在20分钟后重新定位管子和圆盘, 使所有暴露的表面都被消毒。在无菌条件下, 剥离从粘附盘的白背, 并将硅橡胶粘贴到管外, 对准孔 (图 2F)。
注意: 为了避免紫外线照射, 在打开 uv 灯前要戴上眼睛保护和关闭机箱。 - 清洁12毫米直径光刻 (100 中心编号1毫米正方形) 德国玻璃片。用镊子轻轻握住片, 用绝对乙醇蘸水, 然后再用绝对乙醇, 最后将片在火焰中浸泡, 以燃烧乙醇。让片冷却。
- 用钳夹住片, 在丙酮中浸入 2% 3-aminopropyltriethoxysilane 十年代. 用超纯水冲洗片, 使空气干燥。
- 将片放在生物安全柜内的无菌滤纸上, 然后打开紫外线灯。将片的每一侧曝光20分钟。
注意: 为了避免紫外线照射, 在打开 uv 灯前要戴上眼睛保护和关闭机箱。
3. 海马切片的制备
- 在开始解剖前, 为组织斩波器准备一半双刃刀片。用手指小心地将刀片对折, 然后将其折断一半。
- 用棉签冲洗刀片的半部分, 用棉签清洗, 然后在绝对乙醇和空气干燥中漂洗。
注意: 脑切片培养协议独立于鼠或大鼠品系或基因型。许多转基因小鼠品系具有不同的遗传背景。
- 用镊子, 保持修剪脑后侧向上和腹侧对培养皿一侧的稳定。轻轻地把脑膜周围的矢状中线, 并删除的中脑组织使用罚款倾斜 #5 钳 (图 3C, 虚线圆圈)。
- 沿大脑一侧进行两次切口将其展开 (图 3C, 虚线)。一旦大脑被放置在背侧向下并张开, 海马的裂缝应该是可见的 (图 3D, 箭头)。
- 将分散开放的大脑转移到一块 polychlorotrifluoroethylene 的塑料薄膜上, 并将其放置在组织斩波器的舞台上进行切片。用决定/葡萄糖湿刀片, 将海马切成300µm 厚的切片。
- 与转移吸管, 冲洗切片的大脑从塑料薄膜成一个新鲜的60毫米碟含有决定/葡萄糖 (图 3E)。用细尖的镊子将剩余的脑膜和其他 non-hippocampal 组织 (图 3F) 从切片中轻轻捏开和逗走 (图 3G, H)。
4. 电镀片
- 一旦切片获得, 放置2µL 鸡血浆的中心光刻一侧的准备片。将等离子体稍微扩散, 以达到直径3-4 毫米的斑点。
注: 光刻侧是片的顶面, 当通过解剖显微镜观察到这些数字是正确定向的。 - 将1脑切片与不育的窄尖端刮刀 (图 4a) 转移到等离子点 (图 4B)。用闭合钳将切片从决定/葡萄糖上抬起。
- 触摸刮刀到片上的等离子点, 用闭合钳将切片推到片上。
- 混合2.5 µL 血浆与2.5 µL 凝血酶在一个单独的管。快速地将这种混合物的2.5 µL 放在切片的周围, 然后吸管上下轻轻地混合在一起 (图 4B)。
注: 血浆在10-15 秒内会凝结, 因此必须迅速完成。如果切片黏附性是一个问题, 混合5µL 血浆与5µL 凝血酶和使用4-5 µL 在切片上, 去除一些在混合以后, 以便切片说谎平在片。 - 从先前贴在滚筒管上的硅橡胶粘合剂的外露面上取下透明的塑料覆盖物, 并将片与脑切片放在孔内的粘合剂上 (图 4C)。
- 为了确保附着力, 应用软, 甚至压力的片与拇指通过按片下来均匀, 并持有约1分钟, 而转移到生物安全柜。
- 在生物安全柜中, 将0.8 毫升完全 Neurobasal 的培养基 (材料表) 添加到每个管中 (图 4D)。
- 流动一个 5% CO2/95% 空气混合物通过一个无菌棉塞的巴斯德吸管持有安全钳。用气体混合物冲洗滚筒管, 并迅速将管子从吸管周围抽出。
- 用切片号和机架编号对管进行标签。将管子插入滚筒架中, 确保其几何平衡。如果有一个奇怪的管数, 添加管平衡。
- 将机架放置在一个35° c 辊筒箱中, 滚轮在大约 10-13 RPH (图 4E) 上转动滚轮架。为了使培养基保持在管子的底部, 在板上抬高它的前部, 使孵化器向后倾斜大约5。
- 在电子表格上输入切片和管号, 用于记录切片处理和观察日期的所有信息。
- 在大约6天在文化, 增加1µL (0.002 U) 的活跃溶对每管。
- 血块完全溶解后 (通常在几个小时内), 取出培养基, 用新鲜培养基代替, 不溶。如有必要, 切片可在一夜之间用溶孵育, 第二天则改变培养基。
- 切片通常孵育至少7-10 天, 然后再用于实验。吸气培养基并在3或4天更换, 再在7天和此后每7天。
5. 基因表达的病毒载体的制备
注: 转基因在切片培养神经元中的表达是通过利用基因工程啮齿动物的大脑或通过感染重组复制缺陷病毒引入转基因的方法实现的。腺 (AV), 腺相关病毒 (AAV), 和重组慢载体都已被用于我们的海马切片培养不同的荧光蛋白合体在脑切片的表达。
- 根据其他地方13,14中描述的方法, 准备复制缺陷 AV 来表示感兴趣的 RNA。使用病毒表达蛋白抗体的串联稀释法对感染的 U/mL 病毒进行效价, 如所描述的14。为了观察 cofilin 聚集体和 cofilin 肌动蛋白棒的形成, 利用 cofilin-R21Q-mRFP cDNA (质粒 #51279)16。
注: 突1启动子是一个很好的选择神经元特定表达式15, 而巨细胞病毒启动子是非常有用的驱动高表达水平在许多细胞类型的13。 - 准备 AAV 由 co-transfection 的转移质粒含有感兴趣的基因和一个代表/cap 质粒, 有或没有辅助质粒, 进入 HEK293 包装细胞, 提供病毒 E1 基因, 如先前所描述的17,18。
注: 重组 AAV 也可用于定向插入宿主细胞基因组19。对于转移质粒, 我们使用人类 cofilin 1 与 C 终端 mRFP1 荧光蛋白标记 (质粒 #50856) 克隆成一个突启动子, 包含 AAV 质粒下游从钙传感器 GCaMP5G20。在转移质粒制备过程中, P2A self-cleaving 肽序列的 DNA 编码片段由 GCaMP5G 和 cofilin-RFP 之间的 PCR 插入, 以提供单 AAV 转录21的两种蛋白表达。 - 制备重组慢载体 co-transfection 的转移质粒含有基因或 cDNA 的兴趣和集成信号, 连同第三代慢包装混合物, 把病毒性的插科打诨, 政客, 转速, 和 vsv g 基因到三分离质粒22,23。
- 对于转移质粒, 使用单步克隆系统24将突启动子和 cofilin-R21Q-mRFP cDNA (从质粒 #51279) 组合成 pLKO. 1-GFP (质粒 #30323), 突启动子和 cofilin-R21Q-mRFP 取代 hPGK促进剂和 GFP cDNA 分别。
- 用磷酸钙染将最终质粒转化为 HEK293T 细胞, 如前所述23。
- 收集培养基从四10厘米的菜肴, 集中到500µL 使用 150 k 截止离心浓缩器, 并储存在-80 ° c 的最后慢在小等分后, 快速冷冻液氮。只为感染细胞解冻一次分。
- 根据经验确定每种病毒类型的体积, 以达到所需的表达程度, 通过设置多个不同的切片区域性来跟踪病毒感染后的转基因表达。
注意: 通常每切片使用1-10 µL 病毒。
6. 切片处理
- 感染切片与病毒
- 工作在生物安全内阁批准为病毒工作在生物安全水平适当为传染媒介, 混合病毒的分 (通常1-10 µL) 与0.8 毫升完全媒介。
- 用不育的巴斯德吸管将培养基从切片中抽出, 放入含有漂白剂的收集陷阱中。在第一个阱和真空源之间总是使用二次阱。
- 将此介质替换为上面准备的含有病毒的分, 将培养管返回到机架, 并放置在孵化器中。
- 在生物安全柜中孵育病毒切片2-5 天后, 用无菌转移吸管将含有病毒的培养基移除, 并将其放入含有经批准的抗病毒药物的瓶子中, 以杀死其毒株。
- 生命染料对神经元的染色
- 准备和储存荧光神经元生命染料的等分25快速冷冻4µL 的等分在液氮浓度为100µM 和存储这些在-20 ° c。不要多次冷冻/解冻染料。
- 通过荧光显微镜将神经元标记为可视化, 将神经元生命染料的一个分解冻, 在完全 Neurobasal 培养基中稀释为4毫升 (最终染料浓度为 100 nM)。
- 从切片中取出培养基 (如果培养基中含有病毒, 则用转移吸管), 用含有 100 nM 神经元生命染料的0.8 毫升培养基取代。将切片返回到孵化器中的滚筒装置。
- 在孵化2小时的切片后, 在生物安全柜中抽吸含有染料的培养基, 用0.8 毫升的新鲜完整培养基代替。
注: 用生命染料切片对神经元进行标记需要几个小时的潜伏期。第一个图像通常采取24小时后染料处理。虽然神经元是明确标记, 有背景荧光下降超过2-3 天, 以提供更好的神经元成像。72小时后, 重要染料的强度下降。 - 随着时间的推移切片形态学的变化, 每7天重新切片。
7. 切片成像
- 在倒置显微镜上查看切片。对于最明亮的荧光成像, 在24小时前成像, 交换培养基与完整的 Neurobasal 一个媒介没有酚红色 pH 值指示器。
注: 在这里报告的实验中, 切片在倒置旋转圆盘共焦荧光显微镜上查看, 配有线性编码的 x、y 阶段和压电 z 控制和灵敏的高分辨率数码相机。 - 将该管与切片培养图像从滚子管装置到 custom-made 管持有者 (图 5A), 它放置在舞台适配器 (图 5B) 中, 以使片垂直于目标和保持切片在相同的方向在重复成像会议上长时间间隔。
- 将舞台适配器上的滑块紧压在管上, 以保持管的位置 (图 5B)。
注: 管架、舞台适配器和加热器的详细信息可访问: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/。
注意: 这些抵消的位置从基准标记允许一致的精确定位的片位置时, 切片是成像, 即使原始 x, y 设置的基准标记改变时, 管或舞台适配器被删除和更换。
注意: 图像平面通常以0.5 µm 到2µm 的间隔获得, 具体取决于图像特征的大小和所需分辨率。构建高质量的3D 映像要求图像特征延伸到多个采集面, 因此, 为了可视化较小的特征, 飞机之间需要更小的间隔。
注: 这里报告的大多数成像会话低于18分钟/片。然而, 我们已经拍摄了一些切片十或更多次, 甚至只要40分钟, 在一个单一的会话, 没有明显的损害, 长期生存的切片。
结果
为了确定如何准确地使用基准标记来重新同一字段中的同一单元格, 我们检查了在光刻片 (图 6A) 上生长的切片。神经元被染色与一个重要染料 (100 nM 为2小时; 不染色神经细胞细胞), 它从神经元随着时间的推移而消失, 而不损害细胞25。我们在一个格子正方形中确定了一个基准标记 (图 6a, B), 在标记后发现了一个重要的染料标记神经元区域 24 h, 从基准标记 (图 6B) 中记录了 x 和 y 偏移位置, 并收集了使用该区域的60X 目标、共焦图像堆栈, 连续4天重复成像。显示在同一位置所拍摄的30µm 图像堆栈的最大投影图像 (图 6-f)。虽然在4天内该区域发生了一些形态学变化, 但相同的细胞 (其中几个被标记) 可以随时间推移。重要染料的荧光强度随着时间的推移而下降, 但在标记后4天内神经元仍能清晰识别。虽然大多数的神经元生命染料荧光是弥漫在细胞质内, 一些点状染色一直观察, 这变得更加明显的背景荧光下降。在不健康的切片, 神经细胞细胞的点状染色也观察到切片恶化。这些结果表明, 在切片中识别出的细胞可以通过使用基准标记来反复成像。
为了研究长期培养期间, 在切片中神经元组织和存活期的时间变化, 我们遵循了5周以上的相同切片, 在成像前每星期24小时用荧光神经活性染料标记一次。多轮染色与这一重要染料在几个星期内增加了聚集积累。在新镀的切片, 仍然在血浆凝块内的神经元被加载染料和图像在一天体外(1 DIV)。每周5周, 同样的切片被再次成像。将显示从带有4x 目标的单个切片中获得的图像 (图 7a-E)。当激发在 488 nm 和 #62 的荧光发射时, CA 和 DG 区域的锥体细胞层明亮地被标记; 620 nm。在5周的观察19切片, 三切片脱落的片和其他两个失去了他们的典型形态, 变得不透明, 表明他们的死亡。因此, 应考虑在实验中增加大约70% 的存活率, 并准备额外的切片, 以确保有足够的数量进行分析。切片是在300µm 的组织斩波器上以公称厚度设置的。经过5周的培养, 我们测量的切片厚度, 通过成像神经元重要染料染色切片从片向上通过切片与40X 油目标在旋转盘共聚焦显微镜。神经元的焦点损失发生在平均 257 nm (n = 5 切片, 每个切片使用多个位置), 这表明, 切片的细化很少发生在电镀的时间。在电镀时, 由于血浆中的重要染料在等离子体中的凝结, 使其难以准确测量病灶发生的位置, 因此我们无法用荧光显微镜准确地测量切片厚度。然而, 切片中神经元的3D 图像在去除等离子血块后很容易获得。在图 7F中以低放大率显示的 21 DIV 切片是用60X 目标在共聚焦显微镜 (1 µm 步骤) 上用神经元生命染料加载后3天拍摄的。60µm 3D 图像是从焦点平面 (图 7G) 生成的。神经元和他们的突起过程, 标记与重要染料可以遵循3D。对切片的形态和3D 结构进行了至少3月的维护, 在目前的研究中使用时间最长。
在一些切片中, 先前成像位置的形态学也发生了重大变化, 这意味着片上的切片的移动可能会发生。当然, 在影像之间的间隔时间越长, 就越难以确定被成像的磁场中的细胞与以前的成像会议中观察到的单元是相同的。因此, 在相同位置获得的、具有60x 目标的、每周间隔4周 (图 8) 的重要染料标记切片的共焦堆的最大投影图像表明, 神经元的生存能力得到了很好的维护, 但很难识别一个特定的神经元随着时间的推移, 当图像获得长时间间隔之间的会话。想必, 标记有多个荧光的单元格模式会更容易被识别, 当通过滚动图像堆栈观察到本地化组中的单元格时。
为了评估不同病毒载体在海马切片神经元中导入外源基因的效用, 我们比较了使用 AV、AAV 和重组慢载体的切片感染力, 每个表达不同的荧光标签或使用不同的启动子驱动表达式。AV (2 x 107感染 U/切片) 表达 cofilin mRFP 后, non-cell 特异性 CMV 启动子被用来感染在片上培养9周的小鼠海马切片。cofilin-mRFP 的表达在5天的感染中被发现, 在切片周围表现出最强烈的表达, 4x 目标 (图 9a)。在表达 cofilin-mRFP 的切片中, 也观察到了20X 目标 (图 9B), 带有一些明亮的点状染色, 并且在神经元和神经细胞细胞中也弥漫表达。经过17周的培养 (8 周感染), 自发的 cofilin 棒已形成在一些细胞, 推测驱动的过度表达的野生类型 cofilin-mRFP (图 9C)26,27。
我们还演示了 AAV (1010粒子) 可用于切片中的表达式。9周内感染 AAV 的切片图像, 其中一个神经元特异的突启动子在翻译的 P2A21的链接器中, 用 self-cleaving 蛋白肽序列驱动 GCaMP5-cofilin-mRFP 的表达式, 捕获了8星期感染 (17 星期在文化)。在表达 GCaMP5 和 cofilin mRFP 的神经元中, 形成了一些 cofilin 棒/聚合体 (图 9d-F)。棒/集料的荧光强度非常强, 在不完全饱和和 cofilin 荧光图像的情况下, 可以观察到极少的漫 cofilin-mRFP 的荧光。自发 cofilin 棒出现在神经元的野生型 cofilin 荧光蛋白合体已 gif126,27, 以及在压力神经元10。基于腺病毒的滴, 这是根据传染性的14和用于确定 AAV 效价的粒子计数确定的, 需要大约100到500倍以上的 AAV 的粒子数来获得近似相同的传染性/与 AV 相比, 切片中的表达式。
为了遵循重组慢介导的荧光蛋白在切片中的表达, 切片被感染在 6 DIV 1, 3, 10 和30µL 等分的重组慢神经元特异表达 (突启动) cofilin-R21Q-mRFP,为 cofilin 肌动蛋白棒形成的活细胞成像探针16。切片被标记为神经元生命染料在 11 div 和影像在特定地区的染料和 cofilin-R21Q-mRFP 表达在12和 14 div。感染了30µL 分病毒的切片无法生存, 但对其他病毒量进行三次切片处理, 显示出剂量依赖性的 mRFP 表达。图 10显示了在6和8天感染中感染了1µL 和10µL 慢的切片图像。两个不同切片的多个区域被量化为 co-staining 神经元的重要染料和 mRFP 表达。对于感染了1µL 的慢, 约28% 的神经元表达 mRFP 在6天感染, 增加到 85% 8 天感染。对于感染了10µL 的慢, 约58% 的神经元表达 mRFP 在6天感染, 增加到 86% 8 天感染。因此, 1 µL 的慢是足以提供广泛的切片传染性和神经元表达的8天感染。
为了证明这种培养体系在后续的 cofilin 病理学的发展中是有用的, 在神经元中感染慢表达 cofilin-R21Q-mRFP 的切片没有得到治疗, 或者被各种浓度 (1 µM、333 nm 和 100 nm) 的治疗。合成的人类 a 蛋白, 经过孵化形成寡聚物28。以往的研究结果表明, 合成 ao诱导 cofilin 肌动蛋白棒在25% 的离解海马神经元29,30,31。所有三切片处理1µM 浓度的 a 来松散从片在前24小时, 而所有车辆处理的切片 (控制) 和那些处理与 333 nm 和 100 nm 浓度的 a 存活了两周, 他们被跟踪。与 100 nM ao一起处理的切片中的同一蜂窝区域 (CA1、CA3 和 DG) 在几天内被成像 (60x 目标)。在 6 div 中感染了慢的控制切片, 用于表示突驱动的 cofilinR21Q-mRFP, 其扩散的蜂窝 mRFP 表达式为 15 div (图 11A)。100 nM ao在 14 div 上的切片和在 15 div 上的图像显示, cofilin-R21Q-mRFP 的分布呈点状, 出现在杆形结构和聚合体中 (图 11B)。这些结构在 a 处理后6天变得更加突出 (图 11C, 它与图 11B相同的单元格字段。在许多富含突起的地方, 神经元细胞协定不存在 (图 11D), 有点状和杆状的 cofilinR21Q-mRFP 阵列被开发 (箭头在图 11C中), 类似于 cofilin 肌动蛋白的分布在培养基中突起 a 处理过的神经元在培养29,30,31。因此, 这种培养和观察海马切片的新方法将使使用者能够确定 cofilin 聚合体和杆状细胞在不同发育阶段的长期生存能力以及病理的可逆性, 并容易对试剂进行剂量反应测量, 以阻止或逆转 cofilin 病理的形成, 在一个更体内样细胞组织。

图 1:滚筒管架的制备.(A) 用于打孔位置的模板, 用于钻出 15 cm 组织培养皿底部。如果数字被打印到显示的标尺的大小, 它可以被切开并且用于标记位置在 15 cm 文化盘为钻孔显示的孔。(B) 已完成双管插入的滚子管架。每个机架上都有一个在机架顶部容易看到的贴纸编号。请单击此处查看此图的较大版本.

图 2: 滚筒培养管的制备.(a) 在钻孔机上插入的滚柱管的前视图, 用于钻出管中的 6 mm 孔。虚线显示平面侧滚子管在夹具中的位置。(B) 与管插入和钻头对齐孔的夹具的端部视图。(C) 孔的顶部视图, 用于钻取带 6 mm 钻头的滚柱管。白色箭头显示的位置, 切断钉插入作为一个停止定位的管, 黑色双线是为位对齐。(D) 安装在跳汰机底部的弹簧夹 (黑色箭头), 以在钻管时将其牢固地固定到位。(E) 在钻出孔后, 边缘会用一个去毛刺工具平滑, 在孔的内侧切出凹槽 (插图显示通过解剖显微镜查看的孔), 以提高管道旋转时从孔中排出的介质。(F) 培养管与孔对准一个孔在硅橡胶胶黏剂, 片将附有。请单击此处查看此图的较大版本.
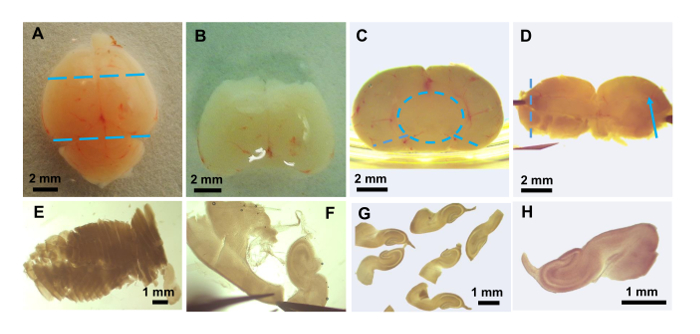
图 3:海马脑切片的制备.用解剖显微镜拍摄的照片显示: (a) 完整的鼠脑。切口的位置, 以消除前脑和小脑显示为蓝色虚线。(B) 切除前脑和小脑后。(C) 从B的大脑片断被翻转90°, 后部区域 (朝向小脑) 朝上。放置在盘子旁边的棋子有助于去除中脑 (蓝色虚线圆圈), 它可以从剩余的海马体、丘脑和下丘脑中被戏弄掉。两个切割钳 (蓝色虚线) 允许剩余的一块包含海马从两个半球的平展平坦。(D) 显示沿着海马裂隙 (蓝色箭头) 运行的血管的扁平脑片。该组织被放置在塑料薄膜上, 并转移到组织斩波器上, 以便在虚线的方向进行切片。(E) 切片组织在返回决定/葡萄糖后显示的海马体略多于一半。(F) 最后解剖海马体并清除切片以去除 non-hippocampal 材料。(G) 最后清理后的几个浮动切片。(H) 将单个切片的放大照片转换为片。请单击此处查看此图的较大版本.

图 4:电镀和孵化切片.(a) 使用镊子尖端将小鼠海马切片从刮刀尖端的培养皿中移除, 以帮助解除它从溶液中释放出来。(B) 切片放置在光刻的中心, 并在2µL 的鸡肉等离子体上处理 12 mm 片, 另外还增加了2.5 µL 的1:1 等离子/凝血酶混合物以产生血块。(C) 凝块设置后 (约1-2 分钟), 覆盖物被从硅胶胶圈上移开滚子管, 片的位置与凝固孔居中;然后片被按在到位与拇指和举行的位置约1分钟 (D) 添加0.8 毫升的完整培养基。(E) 滚子管夹在一个大的滚筒箱内, 前面凸起5以使介质位于管子底部。请单击此处查看此图的较大版本.

图 5:滚筒式管架和舞台板孵化器(A) 管架, 其定位管, 使片保持在位置以进行成像。(B) 管架安装在显微镜舞台适配器板上。侧面的滑块可安全地保持管的成像。(C) 舞台适配器, 其管架和侧面板添加了连接到热电温度控制器的发热条。一旦管道安装和定位, 一个坚实的顶部的方块可以增加, 以帮助保持在成像过程中的温度。橙色导线是热电偶导线。设计和建造舞台适配器和加热器的计划可在: https://vpr.colostate.edu/min/custom-machining/roller-tube-holder/。 请单击此处查看此图的较大版本.

图 6: 对相同单元格重复成像使用基准标记.(A) 在光刻片 (1 毫米平方) 上的海马切片, subiculum 展开 (尾部), 以4x 物镜和明亮的场光照观看。塑料辊筒的曲率有助于创建一个倾斜的照明, 增强了网格的可视化。该框显示60X 字段的位置和大小。(B) 与20x 目标相同的切片的视图, 用于查找基准标记作为4从正方形34的底部的尖端。y 和 x 偏移量显示为性定位所需框的中心, 以提高放大率的共焦成像。(C-F)一个切片标记与神经元重要染料 13 div 被成像使用60x 目标, 并使30µm 投影图像在4连续天 (14-17 DIV)。每天都有相同的神经元被成像。细胞核在三神经元中的位置以不同的符号标记。它们更容易通过滚动图像堆栈来识别, 因为它们的3D 位置略有变化。请单击此处查看此图的较大版本.
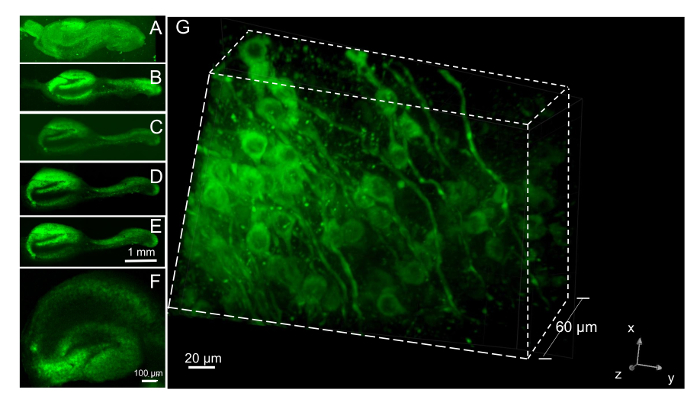
图 7: 在切片中使用神经元生命染料成像神经元.(A) 用4X 物镜镀后24小时, 在等离子熔凝块上染色的神经生命染料切片。染料 (100 nM) 加入时, 切片是第一次放置在滚筒管持有人, 并冲出2小时后。Subiculum 在血块周围的海马体上卷曲。(B-E)继血块溶解后, 溶增加在 6 DIV, 切片被重新加载5次与重要染料24小时前的成像每周间隔。显示的图像分别收集在8、21、28和 35 DIV (B-E中)。(F) 海马切片培养3周, 并在4X 目标成像之前, 用24小时的神经生命染料染色。(G) 在与F相同的切片上共聚焦的图像堆栈, 显示61平面的3D 视图, 以1µm 间隔拍摄。神经元生命染料清楚地标记突起和细胞体, 但它被排除在细胞核之外。请单击此处查看此图的较大版本.
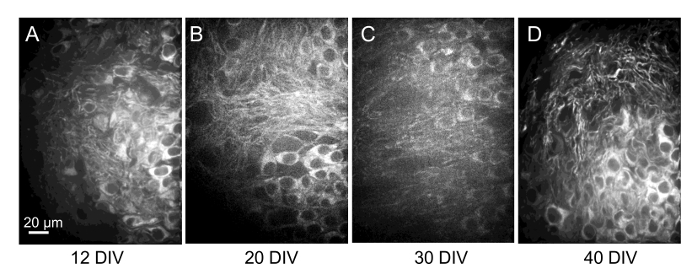
图 8:在4 周内, 切片的单个位置重复成像神经元.在12、20、30和 40 DIV (分别为A-D) 上, 与关键染料标记的切片相同的单元格区域 (通过定位) 的30µm 共聚焦图像堆栈的最大投影图像。在投影图像中, 在较长的时间帧内重复识别单个细胞是困难的。但是, 即使在这些长时间内, 通过滚动图像堆栈或生成可旋转的3D 图像 (如图 7G中所示), 通常也可以识别相同的单元格。请单击此处查看此图的较大版本.
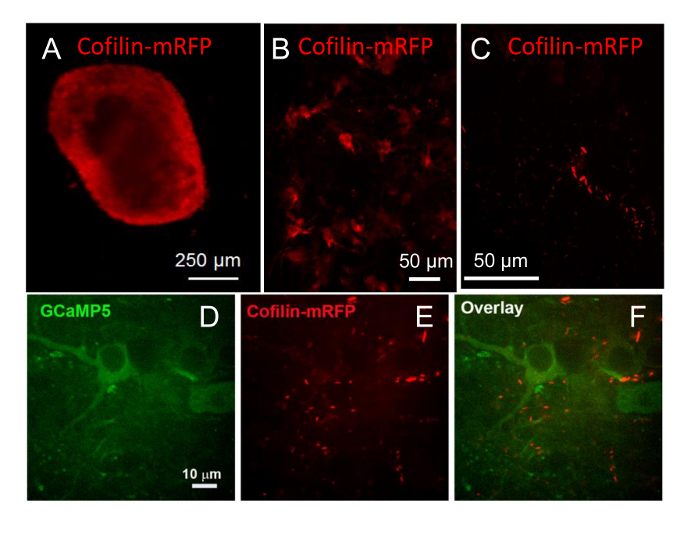
图 9:荧光蛋白的病毒介导的表达和成像。(a) 海马切片培养9周, 感染腺病毒表达 cofilin-mRFP 后的 CMV 启动子。在5天感染的切片中发现了表达, 但在切片周围的荧光最亮。(B) 与20X 目标一起查看时, 同一切片显示了切片中更深的单元格中的表达式。图像是一个投影从20图像的堆栈间距2µm 分开。(C) 在培养的17周后 (8 周感染) 和 cofilin mRFP 观察到了同一切片, 在这个投影图像中, 从70µm 堆栈23图像中看到, 3 µm 分离, 以40X 目标拍摄。(D-F)鼠海马切片感染9周的文化与 AAV 表达 GCaMP5-(P2A)-cofilin-mRFP 背后的突启动子。荧光在红色和绿色渠道在10天以后是可看见的。显示 (D) GCaMP5 的表达式的切片的单个平面图像, 一个钙敏感的记者, (E) 许多 cofilin 包含的棒, 和 (F) 一个叠加图像。请单击此处查看此图的较大版本.
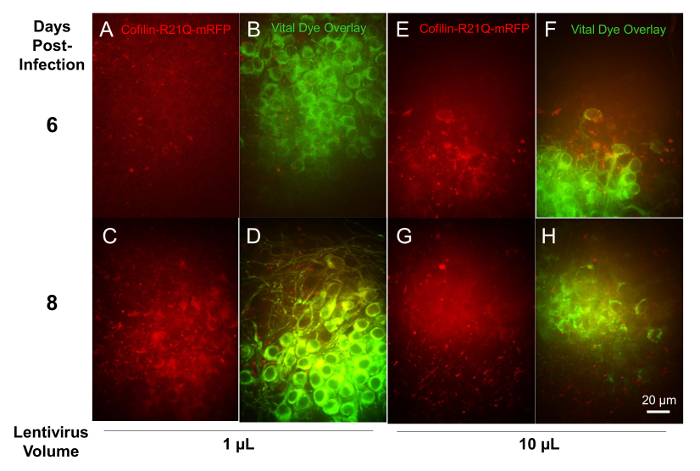
图 10: 由突启动子驱动的 cofilin-R21Q-mRFP 在重组慢载体中的表达。检测微弱的荧光信号, 首先观察到约3-4 天感染使用10µL 病毒, 并成为可用的5-6 天, (E), 因为在这些图像获得60x 目标。虽然需要更长的时间来达到相同的表达水平与1µL 的病毒, 由8天感染一个类似的高百分比的神经元 (生命染料标记) 表达的 cofilin-R21Q-mRFP。只有27% 的神经元是阳性的 mRFP 荧光在6天感染与1µL (A, B), 但这增加到 85% (C, D), 8 天。请单击此处查看此图的较大版本.
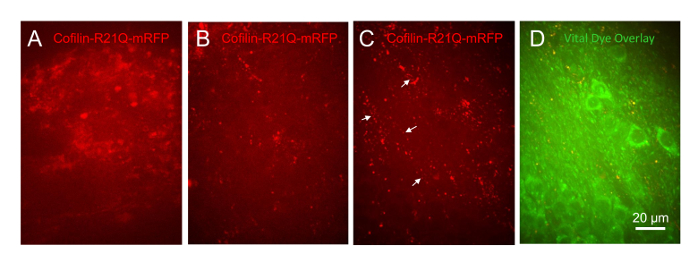
图 11:a 寡聚物诱导的小鼠海马切片 cofilin 病理.所有图像作为30µm 图像堆栈与一个60x 的目标, 并显示为最大的投影图像。切片被感染的 cofilin-R21Q-mRFP 在 6 div. (A) 15 div 切片处理在 14 div 与车辆 (亚砜/火腿 F12 培养基用于生成 ao)。(B) 切片 15 DIV 处理 100 nM ao。(C) 与B中的字段相同, 在 20 DIV 中显示, 在 (D中) 作为具有神经元重要染料标签的叠加。箭头显示 cofilin 聚合体和棒的线性阵列, 该切片包含突起但很少有细胞体。请单击此处查看此图的较大版本.
讨论
这里描述的滚子管法允许长期培养和高分辨率活体影像切片脑组织。切片技术所应用的一个主要问题是切片的安装和维护。片涂层, 支持切片粘附, 促进切片细化, 通过提高突起的生长和细胞迁移的切片;因此, 我们避免使用这些基板。通过 3-aminopropyltriethoxysilane 的治疗, 将氨基基团插入玻璃上, 提高了切片的粘附性, 但在片上太少或太多的鸡血浆也会导致粘附问题导致切片损失。适当的粘附所需的血浆体积取决于培养的脑切片的大小, 因而对大鼠海马切片的影响更大, 面积比小鼠脑切片大4倍。如果切片下过多的血浆凝块, 细胞粘附在片上就会受损, 溶的治疗会使切片松弛, 从而改变位置或完全分离。然而, 在孵化器的最初几天的旋转中, 血块中的血浆过少可能导致切片损失。在最近的一项涉及39切片的实验中, 有三条被丢失, 但部分丢失的可能是切片过程中发生的切片损伤造成的。然而, 我们通常准备比实验所需的估计数量多50% 片。文化问题的第二个主要原因是片海豹周围的介质渗漏。当片在贴上封条后, 至少1分钟内没有固定到位, 这个问题就会恶化。用拇指施加的热量最有可能帮助完成粘合。发生的渗漏通常是通过微片下的微小的空气通道, 可以用解剖显微镜观察。这些通常会在使用长时间拇指压力时消失。大约2% 的文化损失, 由于缓慢的泄漏可以预期, 因此, 建议等待10天后, 建立了文化, 然后再执行病毒感染。拇指压力过大, 尤其是在片的不均匀产生时, 也会导致片的破裂。如果破损是一个问题, 在恒温箱里加热的橡胶鼠标垫上压扁的管子可能有助于在片上提供更均匀的压力。
先前描述的方法的脑切片培养膜上的气界面 (开放系统) 或玻璃片内的密封塑料管 (封闭系统) 是非常有效的长期切片生存, 但每种方法有其优势和弱点.在空气液界面膜上的切片培养有利于综合电生理研究和浸润目标的高分辨率成像7, 但在查找精确的单元格字段方面有缺点重新随着时间的推移和潜在的用户暴露和客观的污染, 当使用病毒介导的基因表达。使用病毒表达的转基因是更安全, 更容易在一个封闭的系统, 其中显微镜目标的污染不是一个问题的执行。我们修改过的滚子管法提供了该切片的高分辨率成像, 虽然它不适于电生理学研究。
切片培养条件已经建立了许多地区的啮齿动物大脑2, 但这里我们只利用海马, 因为它是一个最广泛研究的脑区和变化发生在海马是非常感兴趣的研究认知障碍。CA 和 DG 区域的锥体细胞层在培养中维持了几个星期的组织, 并且可以在形态上很容易地观察到。我们利用了一种新开发的荧光神经元活性标记物25, 它具有荧光特性, 允许它用于监测海马切片内的神经元生存能力和组织的数天至几个月, 但也与许多其他荧光蛋白和记者的使用兼容。虽然不是最佳的为 NeuO 荧光25, 我们可以激发在 NeuO 在488毫微米并且测量放射在和 #62; 617 毫微米。光刻片上的基准标记帮助在许多天的文化中反复定位相同的细胞, 使我们能够在许多周内对切片的相同区域进行图像处理。在5周的培养过程中, 片的切片厚度几乎没有明显的细化, 这是我们获得切片测厚的最长时间点。
AV、AAV 和重组慢载体能很好地表达外源基因的切片。慢与神经元特异启动子是特别有用的获得在很高百分比 (和 #62; 85%) 神经元在8天内的感染。此外, 我们表明, cofilin 肌动蛋白杆病理与发展的认知缺陷在人类 ad10,11和 a 表达鼠标 ad 模型32可以在切片区域性中进行监视, 方法是合成人工 a 的相对低浓度 (100 nM)o。我们设想, 这种方法的未来应用将包括表征新的疗法, 以逆转 cofilin 肌动蛋白棒病理和/或纠正树突状脊柱异常发生在许多神经系统疾病33。
材料
| Name | Company | Catalog Number | Comments |
| Bottoms from 15 cm culture dishes | VWR Scientific | 25384-326 | |
| Phillips Head Machine Screws (#10-32) | Ace Hardware | 2.5" long and 3/16" in diameter | |
| Flat Washers #10 | ACE Hardware | ||
| Machine Screw Nuts (#10-32) | ACE Hardware | ||
| Rubber Grommets | ACE Hardware | 5/16", thick; 5/8", hole diameter; 1.125", OD | |
| Polyethylene tubing (5/16"; OD, 3/16"; ID) | ACE Hardware | Cut to 1.8" length | |
| Lock Washer #10 | ACE Hardware | ||
| Drill Press, 5 speed | Ace Hardware | ProTech Model 1201 | |
| Nunclon Delta Flat-Sided Tubes | VWR | 62407-076 | |
| Drill bits, 3 mm, 6 mm and 15 mm | Ace Hardware | Diablo freud brand | Drill bits for cutting plastic. |
| Drill bits for wood, 1.5 cm and 1 mm | Ace Hardware | ||
| Wood file, 1/4" round | Ace Harware | ||
| Spring clips, 16 mm snap holder | Ace Hardware | ||
| Swivel Head Deburring Tool, 5" | Ace Hardware | 26307 | |
| Adhesive Silicone Sheet (Secure Seal) | Grace Bio-Labs | 666581 | 0.5 mm Thickness |
| 6 mm hole punch | Office Max | ||
| 12 mm hole punch | thepunchbunch.com | ||
| 70% Ethanol | |||
| Phototeched Coverslips, 12 mm diameter | Bellco Glass, Inc. | 1916-91012 | |
| Bunsen Burner | |||
| Absolute Ethanol | |||
| Nanopure Water | |||
| 3-aminopropyltriethoxylane | Sigma-Aldrich | A3648 | |
| Acetone | Sigma-Aldrich | 179124 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| McIlwain Tissue Chopper | Ted Pella, Inc. | 10180 | |
| Double Edge Razor Blades | Ted Pella, Inc. | 121-6 | |
| Whatman Filter Paper | VWR | 28450-182 | Cut into 5.8 cm diameter circles |
| Poly-chloro-trifluoro-ethylene (Aclar) | Ted Pella, Inc. | 10501-10 | Cut into 5.8 cm diameter circles |
| #21 Surgical Blade | VWR Scientific | 25860-144 | |
| #5 Dumont Forceps | Fine Science Tools | 11251-30 | |
| Spatula, stainless with tapered end | VWR | 82027-518 | |
| Gey's Balanced Salt Solution | Sigma-Aldrich | G9779 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Chicken Plasma | Cocalico Biologicals | 30-0300-5L | Rehydrate in sterile water, centrifuge at 2500 x g 30 min at 4 °C, quick freeze aliquots in liquid nitrogen and store at -80 °C. |
| Thrombin, Topical (Bovine) | Pfizer | Thrombin-JMI | Quick freeze aliquots in liquid nitrogen at 1,000 international units/mL in diluent provided and store at -80°C. Use at 250 units/mL. |
| Cell Roller System | Bellco Biotech | SciERA | |
| Roller Incubator | Forma | Model 3956 | |
| N21-MAX | ThermoFisher Scientific | AR008 | |
| Pen/Strep (100X) | ThermoFisher Scientific | 15140122 | |
| 200 mM Glutamine | ThermoFisher Scientific | 25030081 | |
| Glucose | ThermoFisher Scientific | 15023-021 | 25% (w/v) Solution, 0.2 mm filter sterilized |
| Neurobasal A | ThermoFisher Scientific | 10888-022 | Complete Medium: 48 mL Neurobasal A, 1 mL N21-MAX, 0.625 mL 200 mM Glutamine, 0.180 mL 25% Glucose, 0.250 mL 100x pen/strep. |
| Third generation lentivirus packaging | Life Technologies | K4975-00 | |
| 159 K cutoff centrifugal filters (Centricon) | EMD Millipore | ||
| Lentiviral cloning system (InFusion) | Clonetech | ||
| Plasmids 30323, 50856, 51279 | Addgene | ||
| Neuronal cell viability dye (NeuO) | Stemcell technologies | 1801 | Thaw once and quick freeze in 4 µL aliquots. Store at -20 °C |
| Inverted microscope | Olympus | IX83 | |
| Microscope objectives | Olympus | air: 4X, 20; oil: 40X, 60X, | |
| Spinning disc confocal system | Yokagawa | CSU22 | |
| Microscope EMCCD camera | Photometrics | Cascade II | |
| Linear encoded (x,y), piezo z flat top stage | ASI | ||
| Microscope lasers and integration | Intelligent Imaging Innovations | ||
| HEK293T cells | American Type Culture Collection | CRL-3216 | |
| Human Plasmin | Sigma Aldrich | P1867 | 0.002 U/mL in 0.1% bovine serum albumin (0.2 mm filter sterilized), quick freeze in liquid nitrogen and store at -80 °C. |
参考文献
- Brewer, G. J., Torricelli, J. R., Evage, E. K., Price, P. J. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Humpel, C. Organotypic brain slice cultures: a review. Neuroscience. 305, 86-98 (2015).
- Stoppini, L., Buchs, P. A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Gähwiler, B. H. Organotypic monolayer cultures of nervous tissue. J Neurosci Methods. 4 (4), 329-342 (1981).
- Gogolla, N., Galimberti, I., DePaola, V., Caroni, P. Long-term imaging of neuronal circuits in organotypic hippocampal slice cultures. Nat Protoc. 1 (3), 1223-1226 (2006).
- Roo, M. D., Ribic, A. Analyzing structural plasticity of dendritic spines in organotypic slice culture. Methods Mol Biol. 1538, 277-289 (2017).
- Lee, K. F. H., Soares, C., Thivierge, J. -P., Béīque, J. -C. Correlated synaptic inputs drive dendritic calcium amplification and cooperative plasticity during clustered synapse development. Neuron. 89 (4), 784-799 (2016).
- Davis, R. C., Maloney, M. T., Minamide, L. S., Flynn, K. C., Stonebraker, M. A., Bamburg, J. R. Mapping cofilin-actin rods in stressed hippocampal slices and the role of cdc42 in amyloid-beta-induced rods. J Alzheimers Dis. 18 (1), 35-50 (2009).
- Clark, R. E., Squire, L. R. Similarity in form and function of the hippocampus in rodents, monkeys, and humans. Proc Natl Acad Sci U S A. 110, Suppl 2 10365-10370 (2013).
- Minamide, L. S., Striegl, A. M., Boyle, J. A., Meberg, P. J., Bamburg, J. R. Neurodegenerative stimuli induce persistent ADF/cofilin-actin rods that disrupt distal neurite function. Nature Cell Biol. 2 (9), 628-636 (2000).
- Rahman, T., et al. Cofilin rods and aggregates concur with tau pathology and the development of Alzheimer's disease. J Alzheimers Dis. 42 (4), 1443-1460 (2014).
- Bamburg, J. R., Bernstein, B. W. Actin dynamics and cofilin-actin rods in Alzheimer disease. Cytoskeleton(Hoboken). 73 (9), 477-497 (2016).
- He, T. C., Zhou, S., da Costa, L. T., Yu, J., Kinzler, K. W., Vogelstein, B. A simplified system for generating recombinant adenoviruses. Proc Natl Acad Sci U S A. 95 (5), 2509-2514 (1998).
- Minamide, L. S., et al. Production and use of replication-deficient adenovirus for transgene expression in neurons. Methods Cell Biol. 71, 387-416 (2003).
- Kügler, S., Kilic, E., Bähr, M. Human synapsin 1 gene promoter confers highly neuron-specific long-term transgene expression from an adenoviral vector in the adult rat brain depending on the transduced area. Gene Ther. 10 (4), 337-347 (2003).
- Mi, J., et al. A genetically encoded reporter for real-time imaging of cofilin-actin rods in living neurons. PLOS ONE. 8 (12), 83609(2013).
- Wang, L., Blouin, V., Brument, N., Bello-Roufal, M., Francois, A. Production and purification of recombinant adeno-associated vectors. Methods Mol Biol. 807, 361-404 (2011).
- Matsushita, T., et al. Adeno-associated virus vectors can be efficiently produced without helper virus. Gene Therapy. 5 (7), 938-945 (1998).
- Ward, P., Walsh, C. E. Targeted integration of rAAV vector into the AAVS1 region. Virology. 433 (2), 356-366 (2012).
- Akerboom, J., et al. Optimization of a GCaMP calcium indicator for neural activity imaging. J Neurosci. 32 (40), 13819-13840 (2012).
- Kim, J. H., et al. High cleavage efficiency of a 2A peptide derived from porcine teschovirus-1 in human cell lines, zebrafish and mice. PLOS ONE. 6 (4), 18556(2011).
- Benskey, M. J., Manfredsson, F. P. Lentivirus production and purification. Methods Mol Biol. 1382, 107-114 (2016).
- Huang, L., Chen, C. Autoprocessing of human immunodeficiency virus type 1 protease miniprecursor fusions in mammalian cells. AIDS Res Ther. 7, 27(2010).
- Bordat, A., Houvenaghel, M. C., German-Retana, S. Gibson assembly: an easy way to clone polyviral full-length infectious cDNA clones expressing an ectopic VPg. Virol J. 12, 89(2015).
- Er, J. C., et al. NeuO: a fluorescent chemical probe for live neuron labeling. Angew Chem Int Ed Engl. 54 (8), 2242-2246 (2015).
- Bernstein, B. W., Chen, H., Boyle, J. A., Bamburg, J. R. Formation of actin-ADF/cofilin rods transiently retards decline of mitochondrial potential and ATP in stressed neurons. Am J Physiol Cell Physiol. 291 (5), 828-839 (2006).
- Cichon, J., et al. Cofilin aggregation blocks intracellular trafficking and induces synaptic loss in hippocampal neurons. J Biol Chem. 287 (6), 3929-3939 (2012).
- Stine, W. B. Jr, Dahlgren, K. N., Krafft, G. A., LaDu, M. J. In vitro characterization of conditions for amyloid-beta peptide oligomerization and fibrillogenesis. J Biol Chem. 278 (13), 11612-11622 (2003).
- Maloney, M. T., Minamide, L. S., Kinley, A. W., Boyle, J. A., Bamburg, J. R. Beta-secretase-cleaved amyloid precursor protein accumulates at actin inclusions induced in neurons by stress or amyloid beta: a feedforward mechanisms for Alzheimer's disease. J Neurosci. 25 (49), 11313-11321 (2005).
- Davis, R. C., et al. Amyloid beta dimers/trimers potently induce cofilin-actin rods that are inhibited by maintaining cofilin phosphorylation. Mol Neurodegener. 6, 10(2011).
- Walsh, K. P., et al. Amyloid-β and proinflammatory cytokines utilize a prion protein-dependent pathway to activate NADPH oxidase and induce cofilin-actin rods in hippocampal neurons. PLOS ONE. 9 (4), 95995(2014).
- Woo, J. A., et al. RanBP9 at the intersection between cofilin and Aβ pathologies: rescue of neurodegenerative changes by RanBP9 reduction. Cell Death Disease. , 6(2015).
- Shaw, A. E., Bamburg, J. R. Peptide regulation of cofilin activity in the CNS: a novel therapeutic approach for treatment of multiple neurological disorders. Pharmacol Ther. 175, 17-27 (2017).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。