Method Article
Эффективное создание и редактирование фидер свободный IPSCs от человеческих клеток поджелудочной железы, с использованием системы ТРИФОСФАТЫ Cas9
В этой статье
Резюме
Протокол описывает подробно поколения след бесплатный индуцированных плюрипотентных стволовых клеток (iPSCs) от человеческих клеток поджелудочной железы в фидер свободных условиях, вслед за этим редактирования с помощью ТРИФОСФАТЫ/Cas9 ribonucleoproteins и характеристика изменение клоны одноклеточных.
Аннотация
Эмбриональные и индуцированных плюрипотентных стволовых клеток может самостоятельно обновить и дифференцироваться в несколько типов клеток тела. Плюрипотентных клеток таким образом желанной для исследований в регенеративной медицине и в настоящее время в клинических испытаниях для глазных заболеваний, диабета, заболеваний сердца и других расстройств. Потенциал, чтобы дифференцироваться в типы специализированных клеток в сочетании с последних достижений в геноме, редактирования технологий, включая системы ТРИФОСФАТЫ/Cas предоставили дополнительные возможности для пошива геном iPSC для разнообразных приложений включая моделирование, болезней генотерапии и стабилизатор пути дифференциации, чтобы назвать несколько. Среди доступных технологий редактирования ТРИФОСФАТЫ/Cas9 от Streptococcus pyogenes возникла как инструмент выбора для редактирования участкам генома эукариот. CRISPRs легко доступны, недорогих и высокоэффективных технических целевых изменения. Система требует Cas9 Нуклеаза и руководство последовательности (20-mer), относящиеся к genomic цели примыкающих 3-нуклеотид «НЭС» protospacer рядом мотив (PAM) для ориентации Cas9 желаемого геномной локус, наряду с трассирующими универсальная Cas9 связывания РНК ( Вместе они называются одной руководство РНК или sgRNA). Здесь мы представляем пошаговые протокол для эффективного поколения фидер независимых и свободных след iPSC и описания методологий для изменения генома в iPSC, используя комплексы рибонуклеопротеида (RNP) Cas9. Геном редактирования протокола является эффективным и может быть легко мультиплексируются по pre комплексообразования sgRNAs для более чем одной цели с Cas9 белками и одновременно доставлять в клетки. Наконец мы описываем упрощенный подход для идентификации и определения характеристик iPSCs с желаемых изменений. Взятые вместе, изложил стратегии предполагается упростить создание и редактирование iPSC для многочисленных приложений.
Введение
Перепрограммирование человека соматические клетки pluripotent государству, гиперэкспрессия перепрограммирования факторов революцию исследования стволовых клеток с приложениями моделирования заболевания, регенеративной медицины и разработки лекарственных средств. Несколько не вирусный перепрограммирования методы доступны для доставки перепрограммирования факторы и генерации iPSCs, но этот процесс является труда интенсивной и не очень эффективно1. Вирусные методы, хотя эффективное, связаны с проблемами вирус интеграции и tumorigenicity2,3,4. В этой рукописи мы сообщают об использовании цитоплазматических Сэндай вируса для доставки перепрограммирования факторы и создания свободных след iPSC линий, которые отсутствие интеграции любой вирусный вектор последовательности в их геном5. РНК вирус, который разводится из клеток цитоплазме ~ 10 ходов после инфекции и производит перепрограммирования факторов в изобилии, приводит к быстрой и эффективной перепрограммирования6,7является Сендай. Установленные iPSCs можно затем легко перешли на фидер свободный средних и избежать использования мыши эмбриональных фибробластов (MEFs) как фидер клетки8.
В этой публикации, наряду с изложением Сэндай вирус опосредованной перепрограммирования мы также описывают улучшение протокол для редактирования iPSCs, который имеет потенциал, чтобы предоставить неограниченное количество клеток человека с желаемой генетических модификаций для научных исследований. Мы использовали технологию ТРИФОСФАТЫ/Cas9 для модификации iPSCs, который в настоящее время используется для широкого спектра приложений, включая стук ins и нокауты, крупномасштабные геномной удаления, Объединенные библиотеки проверки для обнаружения гена, генная инженерия многочисленные модели организмов и генной терапии9,10,11. Этот метод предполагает формирование комплексов Streptococcus pyogenes-производные Cas9 Нуклеаза и 20-mer руководство РНК, обеспечивающие признание целевой через базу сопряжения с геномные последовательности прилегающих к 3' нуклеотидом protospacer соседними мотив (PAM) последовательности. Cas9 Нуклеаза индуцирует двойной мель перерыв ~ 3 нуклеотидов с PAM сайта, который впоследствии восстановленной преимущественно концу не гомологичных присоединения (NHEJ) путь, ведущий к вставки или удаления в рамках открытой чтении и тем самым функциональным нокаут гены12.
Наша Улучшенная протокол включает в себя сведения о культуре человеческих клеток поджелудочной железы, их перепрограммирования на mitotically инактивированная мыши эмбриональных фибробластов (MEFs) для достижения более высокой эффективности перепрограммирование, последующей адаптации к культуре фидер бесплатно на Matrigel, характеристика установленных iPSCs, ТРИФОСФАТЫ руководствоваться РНК дизайн и подготовка, Доставка в iPSCs как RNP комплексы, одну ячейку Сортировка для создания клоновых линий редактировать iPSCs, легко отбора и идентификации изменений и характеристика Одноячеистый клонов. Геномной удаления эффективно были созданы в этом исследовании путем введения Cas9 белка и два ТРИФОСФАТЫ sgRNA RNP комплексов побудить двойной мель перерывы (DSBs) и исключить вмешательство сегмента. Этот метод основывается на использовании двух руководств для генерации исключений в рамках открытой чтении, высокая эффективность NHEJ приводит к низкой количество клонов что необходимо охарактеризовать и легко предварительного отбора клонов, автоматизированных капилляров электрофорез блок, фрагмент анализатора. Эти эффективные генома, редактирование методы для создания модели на основе стволовых клеток заболеваний человека вскоре станет стандартной и обычные подход в любой лаборатории стволовых клеток. Наконец точное генома редактирования позволит выйти за рамки моделирования заболевания стволовых клеток и потенциально может помочь стимулировать клетки-терапии.
протокол
1. перепрограммирование протокол
- поколения человека iPSC от первичных человеческих клеток поджелудочной железы
- пальто 6-ну пластины с 1,5 мг/мл холодной коллагена и позволить ему гель при 37 ° C за 1 ч.
- Тарелка скорейшее прохождение человека первичных клеток поджелудочной железы в среде (~ 1-1,5 × 10 5 клеток) Prigrow III на коллаген покрытием 6-ну пластины на день -2 для достижения примерно 2,5 × 10 5 клеток или по крайней мере 60% confluency за хорошо на день трансдукция (день 0). Для первого исследования тарелка скважин по крайней мере 2-3 для получения одной скважиной с желаемой confluency на день 0. Использование по крайней мере один колодец как элемент управления для подсчета клеток.
- В день трансдукции (день 0), теплый 1 мл Prigrow III среды в ванне с водой для каждой скважины быть преобразованы. Урожай клетки от одного элемента управления в 1 мл 10% FBS среды с использованием 1 мл трипсина/ЭДТА для 5 минут или пока клетки отсоединить выполнить подсчет клеток. Чтобы сделать 10% Средний FBS, добавить DMEM, 10% FBS, 1% L-глютамином, 1% пируват натрия и 1% несущественные аминокислот.
- Фото и проверить жизнеспособность клеток, используя счетчик клеток и вычислить объем каждого вируса, необходимых для достижения цели, основанные на мобильный номер и вирус титр. Используйте кратности инфекции (МВД) Кос = 5, hc-Myc = 5 и hKlf4 = 3 для клеток поджелудочной железы.
- Один набор оттепель Сэндай вектор трубы в хранилище-80 ° C на льду и тщательно добавить вычисляемый томов каждого из трех труб вектор Сэндай в 1 мл Prigrow III среды, предварительно нагретой до 37 ° C. и очистка осторожно смешать раствор. Один хорошо в пластине 6-хорошо достаточно для преобразователя с Сендай вирусных векторов для создания перепрограммировать клетки.
- Аспирационная среднего Prigrow III от клеток и медленно добавить перепрограммирования смесь вирус скважин, содержащие клетки. Инкубировать клетки на ночь в инкубаторе 37 ° C с атмосферой увлажненные 5% CO 2.
- Тщательно удалить вирус смесь на клетки и заменить свежим Prigrow III среднего следующий день, 24 часа после трансдукции. Культура клетки для 5 d и изменения среды ежедневно альтернативный.
- На 5 день, подготовить MEFs на 0.1% желатина предварительно покрытием 10 см культуры блюда (1.3 x 10 6 клеток/блюдо). Расти MEFs в колбы T175 до дня 4 и затем на 5 день, разоблачить клетки 6000 заявках от γ-излучения источника перед посевом клетки 13 или использование коммерческих источников MEF.
- На 6 день, используйте 1 мл раствора отряд клеток для 10 мин отсоединить transduced клетки, пластина все из них на блюда MEF в среде Prigrow III с рок ингибитора (шток 5 мм, 10 мкм окончательный) и инкубировать на ночь в инкубаторе 37 ° C с увлажненной классическ Re 5% CO 2.
- Изменить среднего Prigrow III на средний Госкомсанэпиднадзором следующий день. Для изготовления 500 мл Госкомсанэпиднадзором среды, добавьте DMEM/F-12, 20% (v/v) нокаут сыворотки замена (KOSR), 5 нг/мл bFGF; 1 мм l глютамин; 100 мкм заменимые аминокислоты и 100 мкм 2-меркаптоэтанол. Измените средство мягко каждый день теперь.
- Наблюдать пластины регулярно для эмерджентности скопления клеток или колоний свидетельствует о перенесенной клеток. Трансформированных клеток образуют клоновых агрегатов с булыжником морфологии и большой ядро и ядрышками. Марк вероятной ' iPSC ' колоний регулярно проверяйте их роста и.
- Почти через четыре недели после трансдукции как колонии готовы для сбора или передачи, подготовить 24-ну MEF плит обшивки 1.3 x 10 6 клеток/желатин предварительно покрытых пластины как раньше для передачи одного колоний.
- Подготовить матрицы мембраны (например, Matrigel), aliquoting, что он основан на коэффициент разрежения в свидетельстве о анализа. Добавьте один Алиготе 25 мл DMEM/F-12 пальто четыре 6-ну плиты (1 мл/а) и инкубации при комнатной температуре (RT) для по крайней мере 1 час перед использованием. Вручную выбрать 12-24 колоний с помощью стерильной пипеткой подсказка аспирационная их и передавать на MEF пластин в 500 мкл Госкомсанэпиднадзором среды.
- Аспирационная СМИ в колодец аккуратно сорвать или разорвать на части колоний. Также выберите 24-48 колоний на матрицы мембраны покрытием 24-ну пластины. Для мембранных покрытием пластин используйте mTeSR1 (дополнена 10 мкм рок ингибитор) за 24 часа и изменить каждый день. В течение 6-10 d комплектации колоний, они готовы к переходу на новые пластины 24-Ну и/или 12-ну мембраны клоновых расширения.
- При необходимости отсоединить колоний на MEFs используя коллагеназы 1 мг/мл за 20 мин, мыть дважды с Госкомсанэпиднадзором/mTeSR1 и передать мембраны покрытием плиты 12 - или 24-хорошо. Если существует достаточно прочная колоний, растущих на матрицы мембраны из шага 1.1.12, заморозить колоний на MEFs с помощью iPSC замораживания средств массовой информации в соответствии с производителем ' s руководство.
- Отключить надежные колоний, покрытие на мембране в шаге 1.1.12, используя 500 мкл dispase для 20 мин и пластины снова на матрицы мембраны покрытием 12-ну пластины. Вручную соскрести любого дифференцированных клеток или загрязняющих клетки фидера MEF для обогащения для плюрипотентных клонов на мембране. После 6-8 d растущим на мембране покрытием пластин отделения раствором dispase как раньше и покрытие мелкоклеточный агрегатов на свежие мембраны покрытием 6 - или 12-ну пластины
- расширить клонов. Изменения mTeSR1 среднего ежедневно. Характеризуют перепрограммировать клоны, щелочной фосфатазы, окрашивание, иммуноокрашивания для плюрипотентности маркеры (OCT3/4 и NANOG), СУИМ анализа плюрипотентных поверхностных маркеров и дифференциации анализов. Расти и культура клонов на мембраны покрытием пластин для всех анализов, включая ТРИФОСФАТЫ редактирования, как описано выше, если другие покрытия решения конкретно упоминается.
- Характеристика человека iPSCs
- щелочной фосфатазы окрашивание
Примечание: коммерческий набор используется здесь. Смотрите таблицу материалов.- Пластина предполагаемого человека iPSCs на 24-ну пластины и культуре для 4-5 d с ежедневно средства массовой информации изменения.
- Чтобы начать окрашивание протокол, аспирационная питательной среды и вымыть клетки с 1 мл раствора 1 x PBS с 0,05% 20 анимации (PBST).
- Добавить 0,5 мл раствора исправить в комплект на клетки и Инкубируйте на RT на 2-5 мин аспирата решения и затем смывают фиксированные ячейки с PBST. Не позволяют скважин сушиться.
- Добавить 0,5 мл свежеприготовленного раствора субстрата AP за хорошо путем смешивания раствора A, B и C. инкубировать клетки в темноте (обернутые фольгой или в контейнере темный) при комнатной температуре на 5-15 мин
Примечание: Внимательно следить за изменением цвета и остановить реакции, когда цвет становится ярким, чтобы избежать неспецифичный пятнать. - Остановить реакции, аспирационных раствора субстрата AP и промывки скважин дважды с 2 мл ПБС.
- Наблюдать колонии под микроскопом и захвата изображения в 4 X или 10 крат, используя любые светлые области микроскоп с камерой или.
- Иммуноокрашивания
- пластина человека iPSCs в 24-ну пластины и культуре для 4-5 d с ежедневно средства массовой информации изменения.
- Мыть клетки один раз коротко с PBS и исправления для 20 мин с параформальдегида 4% (PFA) в PBS.
- Мыть три раза за 10 мин (3 x, 10 мин) с PBS на RT.
- Saturate неспецифической сайты с 10% нормальной коза или осла (NS, в зависимости от животных вторичное антитело был поднят в) в PBS сыворотки для кожи 40 мин на RT. Для только внутриклеточных epitopes, включают 0,3% TX-100 в PBS (TX/PBS) для разрушения.
- Вымойте 3 x 5 мин с PBS на RT.
- Развести OCT4, NANOG, TUJ1, NKX2-5 и SOX17 антител в свежий раствор 5% NS в PBS и проинкубируйте втечение 2 ч на RT или на ночь при 4 ° C.
- Вымойте 3 x 5 мин с PBS на RT.
- Развести соответствующие вторичные Alexa Fluor 488 или 568 антител в 5% NS/PBS и инкубировать клетки за 1 час на RT. и
- Вымойте 3 x 5 мин на RT.
- С DAPI в PBS Инкубируйте 10 мин и мыть 2 x 5 мин на RT. использовать флуоресцентный Микроскоп фотографировать.
- Флуоресценции активированный ячейку Сортировка (FACS)
- человека iPSCs пластину в 6-ну пластины и культуры до колонии стали 80% притока (по крайней мере 10 5 клетки /sample) с ежедневные изменения средних mTeSR1.
- В день эксперимента, изолировать клетки и отделить к приостановке одну ячейку, как объяснялось выше, в протоколе. Мыть с 10% среднего FBS.
- Для поверхностных маркеров, Ресуспензируйте в 0,5-1 мл 10% FBS средних и держать на льду
- Для внутриклеточных маркеров, Ресуспензируйте в 1 мл 4% PFA/PBS и проинкубируйте втечение 10 мин при комнатной температуре. Вымойте с 10% среднего FBS. Ресуспензируйте в 0,1% TX/PBS и Инкубируйте 15 мин на льду. Снова помойте с 10% среднего FBS. Ресуспензируйте в 0,5-1 мл 10% FBS средних и держать на льду
- Добавьте 50 мкл суспензии клеток до 50 мкл 10% FBS средних содержащие рекомендованная сумма TRA-1-60, TRA-1-81 или SSEA-4 антител и Инкубируйте 30 мин до 1 ч.
- Мыть дважды с 10% FBS.
- В 100 мкл 10% Ресуспензируйте FBS носитель, содержащий флуоресцентные вторичные антитела и Инкубируйте 30 мин мыть дважды с 10% FBS и Ресуспензируйте в соответствующий объем 10% FBS. Живые клетки могут быть продифференцированы от омертвевших клеток пропидий йодидом краситель добавил в < 1 мкг/мл для оценки апоптоза клеток во время процесса.
- Дифференциация Tri линии
- семя две 6-ну пластины с 1,5-2 х 10 6 iPSCs/хорошо в mTeSR1 среде с 10 мкм рок ингибитор.
- Позволяют клеткам расти на 2-3 d с ежедневно mTeSR1 среднего изменения пока скважин на 80-90% вырожденная.
- Для индукции эктодермы, добавить нейронной индукции среднего (NIM) согласно данным производителя ' s инструкции в 2-3 скважины плит, 6-а.
- Изменить носитель RPMI, содержащий 2% B27 дополнение минус инсулина и 12 мкм CHIR99021 мезодермы индукции в 2-3 скважины пластины 14. Добавить только RPMI, содержащий 2% B27 дополнение минус инсулина для следующих 24 h. добавить 5 мкм IWP4 в среду RPMI с 2% B27 дополнение минус инсулина для последующих 24 часов. После 72 ч, заменить СМИ RPMI, содержащий 2% B27 дополнение, ведущих к поколению избиение кардиомиоцитов в 2-3 д
- Для индукции энтодермы, изменить среднего в скважинах 6-ну пластин до MCDB 131 дополнены с бикарбонатом натрия 1,5 г/Л, 1 x Glutamax, глюкоза 10 мм, 0,5% BSA, 100 нг/мл GDF8 и 5µM CHIR99021 за 24 ч. в той же среде без CHIR99021 культуры для 2-3 d 15.
- Следовать протокол иммуноокрашивания шаг 2 для всех трех линий и проверьте для выражения соответствующих маркеров.
- щелочной фосфатазы окрашивание
2. IPSC редактирования человеческого генома используя ТРИФОСФАТЫ-Cas9
- белка подготовка Cas9 и sgRNA
- аликвота Cas9 белка в microcentrifuge трубы в стерильных условиях и хранить аликвоты путем замораживания труб на -80 ° C.
- Дизайн две ориентации руководство РНК за гена на основе программного обеспечения от MIT (http://www.genome-engineering.org/crispr/) или любой другой webtool дизайн руководство ТРИФОСФАТЫ. Цель первой или второй экзона гена (основанный на открытом чтения кадра) для создания нокауты. Выберите два руководства, так что они вырезать близко друг к другу (~ 30-100 bp врозь) и мы можем легко визуализировать удаления, используя тот же набор скрининг грунтовки. Выберите направляющие программного обеспечения производства на основе показатель качества и меньшее количество-целевые сайты. Дизайн, скрининг грунтовки с помощью программы грунтовка взрыва (https://www.ncbi.nlm.nih.gov/tools/primer-blast/). Скрининг грунтовки должны быть по крайней мере 100 ВР от Cas9 вырезать сайты и размер продукта ПЦР желательно между 400-700 bp для легче амплификации методом ПЦР.
- Дизайн два взаимодополняющих sgRNA oligo ННО (19-22 нуклеотидов в длину в зависимости от последовательности руководство) с Bsa1, вырезать сайта на каждом конце. Oligo DNAs может быть синтезирован коммерчески и отожженная сформировать двухручьевой ДНК. Для отжига, добавить 1 мкл 100 мкм гидов, 25 мкл отжига буфера (10 мм трис, pH7.5-8.0, 50 мм NaCl, 1 ЭДТА) и 23 мкл воды. Инкубировать в Термоциклер запрограммированы, чтобы начать на 95 ° C в течение 2 мин и затем постепенно охлаждения до 25 ° C более 45 мин
- Клон 2 мкл результирующий фрагмент в энзима ограничения Bsa1 переваривается 1 мкл доме T7 промоутер pCR2.1 вектора с Cas9 привязки сайта, с помощью T4 ДНК лигаза согласно производителя ' протокол s.
- Последовательность клонированных фрагментов ДНК и когда устанавливается верности, в пробирке транскрибировать клоны, используя T7 комплект для создания единого руководства РНК. Очистить sgRNAs с комплектом коммерческих и элюировать в РНКазы свободной воды. Проверка концентрации РНК.
- Transfection hiPSCs
- культура hiPSCs в mTeSR1 среде, как описано выше, до тех пор, пока клетки являются 40-50% притока.
- За два часа до nucleofection, заменить средство с 2 мл подогретую mTeSR1 среды, содержащие 10 мкм рок ингибитор.
- Один час позже, подготовить назначения скважин для nucleofected клеток, забирающие мембраны, как указано выше, подготовленных от 12-ну пластины и заменив подогретую 1 мл mTeSR1 среды с 10 мкм рок ингибитора. Хранить при 37 ° C для инкубации.
- Подготовка nucleofection Мастер микс (шкала надлежащим образом в зависимости от образцов) для каждого образца, добавив 16.4 мкл P3 главной ячейки дополнение; 3.6 мкл дополнение 1 из комплекта nucleofector; 0,5 мкг белка Cas9 и 0,5 мкг каждая sgRNA в 22 мкл на том реакции. pMAX GFP вектор был также nucleofected в соответствии с производителем ' s рекомендации в клетках примерно оценить эффективность трансфекции iPSC.
- Мыть каждый хорошо с 2 мл RT PBS после аспирационных носитель, содержащий ингибитор рок из скважин iPSC. Затем аспирационная PBS, добавить 1 мл раствора отряд клеток и инкубировать пластины при 37 ° C на 10 мин
- Ресуспензируйте клетки в 3 мл mTeSR1 среды и аккуратно Пипетка вверх и вниз для создания одной ячейки подвеска. Передачи в отрыве клетки в центрифугу 15 мл трубки содержащих среднего mTeSR1 5 мл.
- Подсчитать ячейки с счетчик соматических клеток и рассчитать общий объем, необходимый для 0,5 х 10 6 клеток/transfection. Желаемое количество клеток в 15 мл пластиковых пробирок, центрифуги на 200 x g 5 мин на RT и удалить супернатант.
- Ресуспензируйте каждую единицу 0,5 x 10 6 клеток в 22 мкл трансфекции мастер смеси подготовлен на шаге 4. Быстро перенесите клетки в Центральной палаты одной скважиной nucleocuvette полосы. Место полосы в nucleofector устройстве и nucleofect клетки, с помощью программы CB150.
- После nucleofection, быстро добавить 80 мкл подогретую mTESR1 среды, содержащие 10 мкм рок ингибитора для каждой скважины nucleofected клеток. Аккуратно перемешать, закупорить вверх и вниз.
- Осторожно передать клетки из газа скважин мембраны предварительно покрытых 12-ну пластины, содержащие mTeSR1 средний с рок ингибитор, подготовленную на этапе 3.
- После 1 d, изменить на свежие mTeSR1 средний без добавления ингибитора рок. Урожай клетки 2-3 d после nucleofection для сортировки одноклеточных.
- Одной ячейки изоляции целевых hiPSCs
- за один день до сортировки, подготовьте 96-луночных MEF пластины, посева 2 х 10 6 клеток/желатин покрытием плиты в среде FBS 10%. Примерно 70-80% из клонов выжить после nucleofection и 2-3 MEF пластины могут быть подготовлены для редактирования каждого эксперимента.
- После ночи инкубации, изменить средне Госкомсанэпиднадзором среднего (как описано ранее) дополняется 100 нг /bFGF мл, 1 x SMC4 (ингибиторы добавлен к средствам массовой информации для повышения жизнеспособности одной ячейки) и 5 мг/мл фибронектин содействовать адгезии.
- Заменить средство на hiPSCs в пластину 12-ну от mTeSR1 до среднего mTeSR1, с 1 x SMC4 по крайней мере 2 h до одну ячейку Сортировка.
- Аспирационная средство от hiPSCs и вымыть клетки мягко с PBS. Добавьте 500 мкл раствора отряд клеток в каждой скважине и инкубировать и при 37 ° C 10 мин после аспирационных PBS. Генерировать подвески одной ячейки, добавив 1 мл mTeSR1 (unsupplemented) для каждой скважины и закупорить вверх и вниз осторожно несколько раз.
- Место суспензию клеток в 15 мл конические и центрифуги для 5 минут при 200 x g на RT. аспирата супернатант и Ресуспензируйте клеток в 1 мл mTeSR1.
- Сортировка ячеек в отдельные ячейки, используя ячейку сортировщик с насадкой 100 мм в стерильных условиях с одной ячейки в отдельных хорошо 96-луночных плит, подготовленную на этапе 1.
- Через четыре дня после сортировки, на данный момент формирования колонии должна быть очевидной; заменить питательной среды с Госкомсанэпиднадзором среднего дополнен с 1 x SMC4.
- Через восемь дней после сортировки, заменить средний с Госкомсанэпиднадзором среднего и культуры для 2 d.
- Отсоедините колоний, с использованием коллагеназы 1 мг/мл за 20 мин и передать их мембраны 24-хорошо покрытием пластин в mTeSR1 с ингибитором рок. Позвольте одной ячейки клонов расти и извлекать их геномной ДНК после дублирования или расширяя их. Используйте конкретные грунтовки гена для того чтобы усилить целевой ДНК методом ПЦР.
- Использование фрагмента анализатор Комплект для первоначальный отбор ПЦР усиливается геномной регионом всех клонов, запустив их через гель/краситель смешать согласно производителя ' s инструкции. Оцените полученный размер фрагмента программного обеспечения PROSize, сравнивая его с соответствующим лестница, которая запускается с образцами. Последовательность ожидаемых ' редактировать ' клоны и анализировать последовательность данных для подтверждения редактирования или удаления элементов.
- Для дифференциации monoallelic и biallelic клонов, усиливают редактировать последовательность с ПЦР и клон pJET1.2 вектора. Отправьте по крайней мере 8-10 клонов для секвенирования и проверить последовательность для подтверждения редактирования в одну или обе аллели.
- После успешно целевых iPSC клоны были определены с помощью генотипирования, изучить подтвердить, что они не потеряли плюрипотентности или получили хромосомных нарушений через этот процесс.
Результаты
В этой публикации мы следим за простой, но эффективный протокол для поколения iPSC от человеческих клеток поджелудочной железы с помощью интеграции или след свободный вирус Сэндай векторов. Рисунок 1A показывает схематическое изображение этой перепрограммирования протокола. Поджелудочной железы клетки человека были приобретены коммерчески, культивируемых в среде Prigrow III и преобразованы с Сендай вирус, как описано выше. Transduced шпинделя формы клеток поджелудочной железы не показывают каких-либо морфологические изменения за ~ 5 дней после трансдукции Сэндай вирус на день 0, но затем стать округлены с больше ядру и ядрышками. Некоторые ранние колонии были замечены после недели после трансдукции, но они не были выбраны, как и наш опыт, эти колонии быстро отделить и, как правило, «раннего частично перепрограммировать клетки», не устанавливают надежные колоний. Примерно 10-15 дней после трансдукции, небольшие яркие колонии были замечены и были собраны после роста (рис. 1B, вверху справа). IPSC человеческие колонии компактны, плотно упакованные с четкие края (рассматривается как «полностью перепрограммировать клетки») (рис. 1B, день 23 внизу посередине) и «частично перепрограммировать клетки» свободно с пробелы в колонии (рис. 1B, день 23 внизу справа). Колонии перепрограммировать клетки поджелудочной железы были растущие на день 18 (рис. 1Bвнизу слева) и были достаточно большой, чтобы быть собраны вручную на день 23 (рис. 1B, средний нижний). Колонии были позолоченными на мембраны, покрытыми после выбора для получения свободной подачи iPSC в день 30-40 (слевана рисунке 2A, ). Некоторые из этих «надежный» фидер свободный колонии были расширены и характерны для выражения щелочной фосфатазы, плюрипотентности и поверхностных маркеров в фидер свободных условиях. Все клоны испытания оказались позитивными на щелочной фосфатазы, как они превратили ярко-красный после анализа (рисунок 2A, , справа). Маркеры плюрипотентности OCT4, NANOG, SSEA4, TRA-1-60 и тра-1-81 также наблюдались весьма выражаться во всех клонов иммуноокрашивания или анализ СУИМ (Рисунок 2B и рис. 3A).
Эти результаты показывают, что человека iPSC колоний, созданный из клеток поджелудочной железы выразил плюрипотентности маркеров в условиях свободной подачи. Плюрипотентности также оценивалась путем направленного дифференцирования человека iPSC три зародышевых: эктодермы, мезодермы и энтодермы. Клоны на мембране мощно продифференцировано TUJ1-положительных нейронов (эктодермы), NKX2-5-позитивных избиение кардиомиоцитов (мезодермы) и SOX17-положительных эндодермы клеток (рис. 3B).
После тщательного определения характеристик 3-надежные, фидер бесплатный iPSC клоновых линий были выбраны для редактирования исследования генома. Два руководства с BsaI отрезока сайтов на концах были разработаны для каждого гена вырезать близко друг к другу (то есть, n менее ~ 100 bp). На рисунке 4показана схема протокола. Эта стратегия удаления используется для целевых генов, позволило нам легко удалить часть первой или второй экзона гена. Эта стратегия была очень эффективной, и мы могли бы изолировать отредактированный клонов в каждой попытке. Направляющие клонированы в вектор BsaI усваивается и в пробирке транскрибируется как описано выше. Мы nucleofected направляющие (РНК) и белка Cas9 как RNP комплексов для быстрого и эффективного редактирования. Мы также сортировать клетки как одной клетки на MEFs как восстановление клеток выше по сравнению с клетки отсортированы поодиночке на мембраны, покрытыми. Геномная ДНК был изолирован от всех клонов, часть целевой был усиливается ПЦР и решен на фрагмент анализатор экран для изменения размеров целевых фрагментов по сравнению с элементами управления. Размер фрагмента был по сравнению с лестницы, работать с образцами для обнаружения клонов «редактировать» (рис. 4, внизу). Это сделало отбора клонов легко, как мы могли бы пройти через > 90 клонов в одной тарелке и результаты были получены с точностью ± 3 bp. Выбранный клоны были затем виртуализации для подтверждения одичал тип и мутировавших клонов. Wildtype клоны были не удаление или Добавление баз хотя мутировавших клоны добавления или удаления в последовательности по сравнению с wildtype. Вектор Расширенная и клонированных в pJET1.2 для определения monoallelic и biallelic клоны путем sequencing по крайней мере 8-10 колоний на клонирование клонов показывает удаление или добавление в последовательность. Monoallelic клоны были основания удалены или добавлены в один из аллелей и другой был неизменным и подобен аллеля wildtype. Biallelic клоны были удаления в обе аллели. Примерно триста клоны были экранированы для всех целевых генов, которые определены примерно 9 клоны удаления monoallelic и 3 biallelic удаления клонов в каждом конкретном случае. Это примерно соответствует вывозимому снижение частоты генерации biallelic клонов, по сравнению с monoallelic клонов. Гетерогенность в пределах удаления ампликонов отражение несовершенной и непоследовательных NHEJ ремонт. Выражение гена была наконец подтверждена путем извлечения РНК из клеток-мишеней и выполняя RT-PCR.

Рисунок 1: перепрограммирования человеческих клеток поджелудочной железы на фидер бесплатно плюрипотентных клеток (iPSC). Показана схема протокола (A) A для поколения iPSC от человеческих клеток поджелудочной железы. Поджелудочной железы клетки были выросли на коллаген, покрытыми и затем переданы MEFs после трансдукция с вирус человека Сэндай векторов. Полностью перепрограммированы колонии были затем переданы Госкомсанэпиднадзором квалифицированных мембраны и характерны. (B) морфологический изменяется после Сэндай вирус трансдукции. Перед трансдукции клеток поджелудочной железы показывают типичный шпинделя как морфология (слева вверху, день 0). Маленькие, плотные колонии появляются на MEFs день 12, напоминающие человеческих плюрипотентных клеток колонии. Обычно полностью перепрограммировать человеческий iPSC колонии имеют очень четкие границы и может быть подхвачена день 23-30. Диссоциированных колонии в день 23 показано внизу справа. Все изображения были захвачены на 100 крат (цель 10 X и 10 X окуляр). Шкалы бар = 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
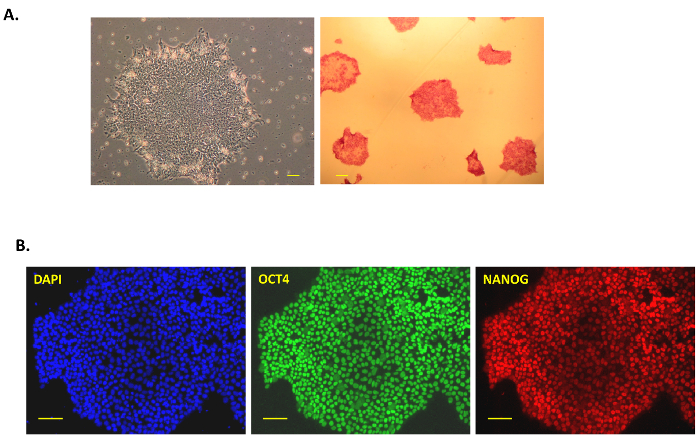
Рисунок 2: Характеристика человека iPSC. (A) A типичные фазы контраст изображения iPSC колонии после собирание и культуры в условиях свободной подачи (40 X, 4 X объектив и 10 X окуляр; слева) После перепрограммирования Сэндай вирусом клеток поджелудочной железы. Щелочная фосфатаза, окрашенные красные iPSC колонии находится на правой. Для окрашивания щелочной фосфатазы, iPSC колонии были исправлены и окрашенных красной после добавления раствора субстрата из комплекта. Изображения были захвачены на 40 X. (B) иммуноокрашивания для плюрипотентности маркеры NANOG и OCT3/4 в фидер свободного человека поджелудочной железы клетки производные iPSCs. DAPI использовался для пятно ядро синий как элемент управления. Все изображения были взяты на 100 крат. Шкалы бар = 100 мкм во всех изображениях. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Рисунок 3: характеристика плюрипотентности и дифференциации потенциал iPSC. (A) СУИМ анализ поверхностных маркеров SSEA4, TRA-1-60 и тра-1-81 в свободной подачи iPSCs. Клетки были отделены в одну ячейку подвеска и витражи для поверхностных маркеров SSEA-4, TRA-1-60 и тра-1-81. Фиолетовый пик содержит iPSC отрицательной (антитела управления) клетки и поджелудочной железы iPSC может быть визуализирована как зеленый пик. (B) Immunofluorescent изображения Слой семенозачатка маркерных генов. Выражение маркеры TUJ1 эктодермы (зеленый), NKX2-5 Мезодерма (красный) и эндодермы (красный) SOX17 в клетках после направленного дифференцирования поджелудочной железы iPSC. Соответствующие управления ядерной пятно DAPI синий. Все изображения были взяты на 100 крат. Масштаб баров = 100 µm. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4: схема стратегии удаления ТРИФОСФАТЫ/Cas9. Одна пара sgRNA был разработан (помеченные красным) с BsaI отрезока сайты в конце (показано как F и R) желательно ориентации первый экзона, отожженная, клонированные изменение вектора BsaI переваривается (pCR2.1, BsaI сайт выделены серым), последовательного и в пробирке перевод. Подчеркнутые последовательности вектора показывает часть удалены после BsaI пищеварение. Положение скрининг грунтовки указывается в синий. Cas9 и руководство РНК, были nucleofected в свободной подачи iPSC как комплекс для исключений геномную. iPSCs были затем одну ячейку Сортировка на 96-луночных MEF пластины, культурный, переданы мембраны, расширена и проверку анализатором фрагмент. Для запуска примеров на анализатор, геномной ДНК Cas9 и руководство transfected клонов на мембране извлекали и прошли через гель/краситель микс в анализаторе выбрать для потенциальных клоны «редактировать» (внизу в центре). Помечены соответствующим лестница маркеров, WT и потенциальных отредактированный клоны. Выражение гена было подтверждено путем извлечения РНК и анализа с Q-PCR. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Обсуждение
Перепрограммирование соматических клеток человека к iPSCs предоставила значительный импульс в области фундаментальной биологии исследований, персонализированной медицины, болезни моделирования, разработки лекарственных средств и регенеративной медицины16. Многие текущие и широко используемые методы человека iPSC поколения требуют использования вируса с риском интеграции хост геномов или episomal векторов с низкой перепрограммирования эффективности. Здесь мы представляем эффективный метод для создания свободной подачи iPSCs из человеческих клеток поджелудочной железы с Сэндай вирус, который приводит к «след бесплатно» и эффективной перепрограммирования. Результате человека iPSCs свободны от вирусных трансгенов, поддержания плюрипотентности и избежать использования неизвестных экзогенных факторов. Поколение iPSCs в условиях свободной подачи имеет низкую эффективность перепрограммирования, поэтому мы перепрограммировать первичных клеток поджелудочной железы на фидер клетки и затем переехал колоний в свободной подачи мембраны для расширения, культуры и характеристик. Сочетание этих методов обеспечивает стабильный, надежный и более эффективное программирование iPSC.
Мы также генерируется iPSCs фибробластов и другие главные ячейки с помощью этого метода, который свидетельствует о том, что Сэндай вирус может использоваться для перепрограммирования разнообразных клеток. Важными соображениями являются: для оптимального confluency Главные ячейки необходимо перепрограммировать как слишком мало или слишком много клеток воздействия перепрограммирования эффективности; ранее прохождения начальной клеток когда клетки по-прежнему оптимально деления; тщательное титрование вирусных векторов что приводит к минимальным клеток апоптоза и высокой эффективности, ведущих к легко подобрать надежный колоний; Проверка потери Сэндай вектора выражения трансген методом ПЦР на 10-15 проходы для обеспечения того, чтобы iPSCs «след свободный»; и строго стерильных условиях для культуры iPSC на мембране.
Мы использовали удобный и эффективный метод модификации генома ТРИФОСФАТЫ изменить геном iPSC. Этот метод сочетает в себе Cas9 белка и sgRNA, RNP комплексы признать и прилепится дополнительных последовательностей ДНК. Она может быть легко адаптирована к целевой геномные последовательности, просто изменив 20 bp руководство РНК. Наш метод обеспечивает простой протокол для эффективного и воспроизводимые редактирование человека iPSCs как они являются более трудоемкими, трудно передают и дорогими в обслуживании чем другие клетки. Мы разрабатываем по крайней мере два смежных, но non перекроя руководства для каждого целевого гена, так что один набор скрининг грунты могут использоваться для скрининга отредактированный клонов. Кроме того использование двух руководств ~ 30-100 bp врозь создает большой удаления, которая может быть легко визуализировать во время предварительной проверки и обеспечивает истощение белка. Направляющие можно протестировать в клетках ГЭС-293 первоначально для оценки эффективности перед началом анализа в iPSC. Кроме того важно, чтобы установить параметры для рутинной трансфекции реагентов в iPSC. С помощью pMAXGFP плазмиды, эффективность трансфекции > обычно достигается 80% и Джин ориентации/срывов эффективность 3-10% в iPSCs. Прямая поставка Cas9 RNP комплексов в клетки в нашем протокол обеспечивает быстрый оборот и быстрых действий и поддерживает высокий уровень целевых модификации. Наш подход использует одну ячейку Сортировка после nucleofection гидов и Cas9 белков, преодоление существенным препятствием гена таргетинга в смешанных iPSC населения и обеспечение clonality клеток. Этот «роман» общий подход является простым, легко мультиплекс, занимает всего несколько недель и не требует каких-либо антибиотиком выбора. Мы не наблюдали любые потери эффективности, последовательно вводя удаления CRISPRs в клеточной линии или iPSCs, хотя кариотип анализ потребностей в таких случаях для обеспечения геномная стабильность. Клоны также должны быть проверены для выражения плюрипотентности маркеров. Хотя, не в центре внимания этого издания, этот протокол может быть кооптирован побудить точные генетические модификации, включая ремонт шаблон в трансфекции коктейль17,18.
Наконец, основываясь на нашем опыте, важные соображения для iPSC редактирования протокола являются: рациональный дизайн руководств для сведения к минимуму или полностью избежать от целевой мутации, особенно в регионе «семена» или близко к PAM мотив изменяется; Оптимизация эффективности nucleofection в iPSCs для обеспечения доставки RNPs; Проверка качества подготовленных руководств; титрования руководства и концентрации белка Cas9 и проверка их деятельность в пробирке биохимических расщепления assays или как описано в этой статье в человека cellssuch как ГЭС клетки, проще в культуре и transfect; Использование раннего iPSCs проход, находятся в журнале фазе роста и достижения confluency ~ 50%; тщательной обработки клеток с нежным среднего изменения после одну ячейку Сортировка для обеспечения выживания клеток.
Мы считаем, что выше изложенные протокол, разделенное в надлежащей детализации будет оснащать читателей с дорожной карты для создания и редактирования iPSC в воспроизводимый моды.
Раскрытие информации
BT является членом-основателем отремонтировать Biosciences Inc.
Благодарности
Работа в лаборатории был поддержан докторской стипендии Грант доктор Анджали Nandal и исследовательский грант от Фонда исследований стволовых клеток Мэриленд для BT (ТЕДКО).
Материалы
| Name | Company | Catalog Number | Comments |
| Sendai viral vectors - CytoTune-iPS 2.0 Kit | Invitrogen | A16517 | Thaw on ice; S No: 1 |
| Trypsin EDTA | Gibco Life Tech | 25300-054 | 0.05%, 100 ml; S No: 2 |
| Rock inhibitor (Y-27632) | Milipore | SCM075 | Use 10 μM; S No: 3 |
| DMEM/F-12 medium | Invitrogen | 11330-032 | S No: 4 |
| Serum replacement (KSR) | Gibco | 10828028 | S No: 5 |
| DMEM | Invitrogen | 11960069 | 1X; S No: 6 |
| Fetal bovine serum | Thermo Scientific | SH30071.03 | Aliquot; S No: 7 |
| L-glutamine (Glutamax, 100X), liquid | Thermo Scientific | 35050061 | 1/100; S No: 8 |
| Non-Essential Amino Acids | Gibco | 11140-050 | 1/100; S No: 9 |
| 2-Mercaptoethanol | Gibco | 21985023 | 55 mM, 1/1,000; S No: 10 |
| Hausser Hemacytometers | Hausser Scientific | 02-671-54 | S No: 11 |
| 0.1% Gelatin Solution | STEMCELL Technologies | 7903 | Incubate at 37º C for 1 hour; S No: 12 |
| SSEA-4 antibody | Santacruz | sc-21704 | 1/100; S No: 13 |
| TRA-1-81 antibody | Cell Signaling | 4745S | 1/200; S No: 14 |
| OCT4 antibody | Santa Cruz | sc-5279 | 1/1,000; S No: 15 |
| Collagen I, Rat Tail | Life Technologies | A10483-01 | Keep cold; S No: 16 |
| Alexa Fluor fluorescent 488/ 568 (secondary antibodies) | Invitrogen | A21202/A10042 | 1/2,000; S No: 17 |
| DPBS | Hyclone | SH30028LS | 1X; S No: 18 |
| 100-mm tissue culture dish | Falcon | 353003 | S No: 20 |
| 96-well tissue culture plate | Falcon | 353078 | S No: 21 |
| 6-well tissue culture plate | Falcon | 353046 | S No: 22 |
| Dissecting scope | Nikon | SMZ745 | S No: 23 |
| Picking hood | NuAire | NU-301 | S No: 24 |
| 15 ml Centrifuge Tube | Greiner Bio-One | 188271 | S No: 25 |
| 50 ml Centrifuge Tube | Greiner Bio-One | 227261 | S No: 26 |
| Sodium pyruvate | Invitrogen | 11360 | S No: 28 |
| β-mercaptoethanol | Sigma | M7522 | S No: 29 |
| Prigrow III medium | ABM | TM003 | S No: 31 |
| Countess™ Cell Counter | Invitrogen | C10227 | S No: 32 |
| Faxitron X-ray system | Faxitron | CellRad | S No: 33 |
| Accutase | Innovative cell Technologies | AT-104 | S No: 34 |
| Collagenase | Life Technologies | 17104019 | 1mg/ml stock; S No: 35 |
| Dispase | STEMCELL Technologies | 7923 | S No: 36 |
| hESC qualified matrigel | BD Biosciences | 354277 | To dilute, use cold DMEM/F-12; S No: 37 |
| bFGF | R & D | 233-FB | Stock 10 ug/ml; S No: 38 |
| Paraformaldehyde | EMS | 15710 | 4% stock in PBS; S No: 39 |
| TRA-1-60 | Santa Cruz | sc-21705 | 1/100; S No: 40 |
| NANOG | ReproCELL | RCAB0004P-F | 1/100; S No: 41 |
| Tween 20 | Sigma | P9416-100ML | S No: 42 |
| Alkaline Phosphatase kit | Stemgent | 00-0055 | S No: 43 |
| Cas9 protein | PNA Bio | CP01-50 | Thaw and aliquot; S No: 44 |
| Goat or donkey serum | Sigma | D9663/G9023 | S No: 45 |
| Triton X-100 | Sigma | X100-100ML | S No: 46 |
| DAPI | Thermo Scientific | D1306 | S No: 47 |
| Tris | Sigma | 9285-100ML | S No: 48 |
| NaCL | Sigma | S7653-250G | S No: 49 |
| EDTA | Sigma | BP2482-500 | S No: 50 |
| T4 DNA ligase | NEB | M0202T | S No: 51 |
| Mega Shortscript T7 kit | Thermo Scientific | AM1354 | S No: 52 |
| Mega Clear kit | Thermo Scientific | AM1908 | S No: 53 |
| SMC4 | BD Biosciences | 354357 | S No: 54 |
| Fibronectin | STEMCELL Technologies | 7159 | S No: 55 |
| CloneJET cloning kit | Thermo Scientific | K1232 | S No: 56 |
| Fragment analyzerTM | Advanced Analytical | S No: 57 | |
| mTeSR1 medium kit | STEMCELL Technologies | 5850 | Warm to room temperature; S No: 58 |
| Freezing medium mFreSR™ | STEMCELL Technologies | 5855 | S No: 59 |
| Freezing medium CryoStor® | STEMCELL Technologies | 7930 | S No: 60 |
| MEFs | Globalstem | GSC-6301G | S No: 61 |
| L-glutamine | Invitrogen | 25030081 | S No: 62 |
| Human pancreatic cells | ABM | T0159 | S No: 63 |
| STEMdiff™ Neural Induction Medium | Stemcell Technologies | 5835 | S No: 64 |
| RPMI | Thermofisher | 11875-093 | S No: 65 |
| 2% B27-insulin | Thermofisher | A1895601 | S No: 66 |
| CHIR99021 | Stemcell Technologies | 72052 | S No: 67 |
| IWP4 | Stemcell Technologies | 72552 | S No: 68 |
| 2% B27 | Thermofisher | 17504044 | S No: 69 |
| MCDB 131 | Life Technologies | 10372019 | S No: 70 |
| Sodium bicarbonate | Sigma-Aldrich | S8761-100ML | S No: 71 |
| Glucose | Sigma-Aldrich | G8270-100G | S No: 72 |
| BSA | Proliant | 68700 | S No: 73 |
| GDF8 | Pepro-Tech | 120-00 | S No: 74 |
| TUJ1 antibody | EMD Milipore | AB9354 | S No: 75 |
| NKX2-5 antibody | Santa Cruz | Sc-14033 | S No: 76 |
| SOX17 antibody | R & D systems | AF1924 | S No: 77 |
| Propidium iodide | Thermo Scientific | P3566 | S No: 78 |
| Amaxa 4D-nucleofector™ | Lonza | AAF-1002 | S No: 79 |
| FACSAria II (cell sorter) | BD biosciences | SORP UV | S No: 80 |
Ссылки
- Malik, N., Rao, M. S. A review of the methods for human iPSC derivation. Methods Mol. Biol. 997, 23-33 (2013).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Sommer, C. A., et al. Induced pluripotent stem cell generation using a single lentiviral stem cell cassette. Stem cells. 27, 543-549 (2009).
- Macarthur, C. C., et al. Generation of human-induced pluripotent stem cells by a nonintegrating RNA Sendai virus vector in feeder-free or xeno-free conditions. Stem cells Int. , 564612(2012).
- Li, H. O., et al. A cytoplasmic RNA vector derived from nontransmissible Sendai virus with efficient gene transfer and expression. J Virol. 74, 6564-6569 (2000).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc. Jpn. Acad. Ser. B, PhysBiol. Sci. 85, 348-362 (2009).
- Nakagawa, M., et al. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci. Rep. 4, 3594(2014).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell stem cell. 18, 573-586 (2016).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 169, 559(2017).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 168, 20-36 (2017).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat. Biotech. 32, 347-355 (2014).
- McElroy, S. L., Reijo Pera, R. A. Preparation of mouse embryonic fibroblast feeder cells for human embryonic stem cell culture. CSH Protoc. 2008, (2008).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc. Natl. Acad. Sci. U.S.A. 109, E1848-E1857 (2012).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotech. 32, 1121-1133 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology: a decade of progress. Nat. Rev. Drug Discov. 16, 115-130 (2017).
- Wang, B., et al. Highly efficient CRISPR/HDR-mediated knock-in for mouse embryonic stem cells and zygotes. BioTechniques. 59, (2015).
- Liang, X., Potter, J., Kumar, S., Ravinder, N., Chesnut, J. D. Enhanced CRISPR/Cas9-mediated precise genome editing by improved design and delivery of gRNA, Cas9 nuclease, and donor DNA. J Biotech. 241, 136-146 (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены