Method Article
דור יעיל ועריכה של נטול מזין IPSCs מתאי הלבלב האנושי באמצעות מערכת CRISPR-Cas9
In This Article
Summary
זה הפרוטוקול מתאר בפירוט הדור של תאי גזע pluripotent המושרה ללא טביעת רגל (iPSCs) מתאי הלבלב האנושי בתנאים ללא מזין, ואחריו עריכה באמצעות ribonucleoproteins CRISPR/Cas9 ואפיון שונה תא בודד שיבוטים.
Abstract
תאי גזע עובריים, המושרה pluripotent ניתן לחדש את עצמי, להבדיל לתוך מספר סוגי תאים של הגוף. תאים pluripotent הם לפיכך חמד לחקר רפואה רגנרטיבית, נמצאים כיום ניסויים קליניים עבור מחלות עיניים, סוכרת, מחלות לב והפרעות אחרות. היכולת להתמיין סוגי תאים מיוחדים בשילוב עם ההתקדמות האחרונה הגנום עריכה טכנולוגיות כולל מערכת CRISPR/רשויות אישורים מספק הזדמנויות נוספות תפירת הגנום של iPSC ליישומים מגוונים כולל מחלת דוגמנות, טיפול, ממתח מסלולים של בידול, שם כמה. בין הטכנולוגיות העריכה זמינים, CRISPR/Cas9 מ הפישחה ינפל תומימת סטרפטוקוקוס התפתחה ככלי של בחירה עבור עריכת בייעודי לאתר של הגנום האיקריוטים. CRISPRs הינם נגישים בקלות, זול ויעיל מאוד של הנדסת עריכות יישוב. המערכת מחייבת של נוקלאז Cas9 מדריך רצף (20-mer) ספציפי אל המטרה גנומית סמוכים 3-נוקלאוטיד "הגולה" protospacer-צמוד-מוטיב (פאם) עבור המיקוד Cas9 מיקומה גנומית הרצוי, לצד מכשיר מעקב איגוד אוניברסלי Cas9 RNA ( יחד הנקראת RNA מדריך בודד או sgRNA). כאן אנו מציגים צעד אחר צעד פרוטוקול לדור יעיל של iPSC מזין-עצמאית, ללא טביעת רגל. ומתארות מתודולוגיות לעריכה הגנום של iPSC באמצעות את מתחמי ribonucleoprotein (RNP) Cas9. הגנום עריכת פרוטוקול יעיל, יכול להיות מרובב בקלות על-ידי sgRNAs טרום-complexing עבור יעד אחד או יותר עם החלבון Cas9 ואספקה בו זמנית לתוך התאים. לבסוף, אנו מתארים גישה פשוטה עבור זיהוי ואפיון של iPSCs בעריכה הרצוי. יחדיו, האסטרטגיות מחולקת לרמות צפויים כדי לייעל את הדור ועריכה של iPSC ליישומים סעפת.
Introduction
תכנות מחדש של תאים סומטיים האנושי המדינה pluripotent על ידי ביטוי של התכנות גורמים יש מהפכה מחקר תאי גזע עם יישומים מידול המחלה, רפואה רגנרטיבית ו פיתוח תרופות. מספר שיטות התיכנות נגיפי זמינים עבור משלוח של התכנות גורמים ותפיק iPSCs, אבל התהליך עבודה אינטנסיבית, לא יעיל מאוד1. השיטות ויראלי, אבל יעיל, הם קשורים לבעיות של נגיף אינטגרציה ו- tumorigenicity-2,-3,-4. כתב יד זה, אנו מדווחים על השימוש של וירוס סנדאי cytoplasmic התכנות גורמים מתן ו הקמת קווי ללא טביעת רגל iPSC חוסר אינטגרציה של כל רצפי וקטור ויראלי לתוך הגנום שלהם5. סנדאי וירוס הוא וירוס רנ א הוא מדולל מחוץ לתא הציטופלסמה ~ 10 קטעים לאחר הזיהום ומייצרת גורמים התיכנות בשפע, שמוביל מהיר ויעיל התכנות6,7. IPSCs הוקמה יכול ואז ניתן בקלות לקביעת נטולת מזין בינוני כדי למנוע את השימוש בעכבר מתחלקים fibroblasts (MEFs) כ מזין תאים8.
בפרסום זה, בנוסף חלוקה לרמות את הוירוס סנדאי מתווכת התכנות, אנו מתארים גם פרוטוקול משופרת עבור עריכת iPSCs, אשר יש הפוטנציאל לספק תאים אנושיים ללא הגבלה עם שינויים גנטיים הרצוי למחקר. השתמשנו בטכנולוגיה CRISPR/Cas9 עבור השינוי של iPSCs, אשר נמצא כעת בשימוש עבור מגוון רחב של יישומים כולל תוספות לדפוק על הדלת, הסתרה, מחיקות גנומית רחבת היקף, במאגר הספרייה הקרנת לגילוי גנים, הנדסה גנטית של מודל אורגניזמים רבים, ו ג'ין טיפול9,10,11. טכניקה זו כוללת הקמת מתחמי של סטרפטוקוקוס הפישחה ינפל תומימת-נגזר נוקלאז Cas9 20-מר מדריך RNAs להשיג זיהוי המטרה באמצעות בסיס תיאום עם רצף גנומית היעד הסמוכים סמוכים ב נוקלאוטיד protospacer 3' רצף מוטיב (פאם). נוקלאז Cas9 המניע של נוקלאוטידים הפסקה נטושים זוגי ~ 3 מאתר פאם, אשר לאחר מכן תוקן בעיקר עד סוף שאינם הומולוגיים להצטרף (NHEJ) לשביל המוביל שהתוספות או המחיקות מסגרת קריאה פתוחה, ובכך פונקציונלי הסתרה של הגנים12.
פרוטוקול משופר שלנו כוללת את הפרטים עבור התרבות של תאים בלבלב האנושי, שלהם התכנות על mitotically לא פעיל העכבר מתחלקים fibroblasts (MEFs) כדי להשיג יעילות גבוהה יותר של התכנות, עיבוד עוקבות לתרבות נטולת מזין על Matrigel, אפיון הוקמה iPSCs, CRISPR מודרכת RNA עיצוב ו הכנה, משלוח לתוך iPSCs כמו מתחמי RNP, תא בודד מיון כדי ליצור שורות המשובטים iPSCs הערוך, קל הקרנת זיהוי של עריכות, ואפיון של תא בודד שיבוטים. מחיקות גנומית נוצרו ביעילות במחקר זה המבוא של חלבונים Cas9, שני CRISPR sgRNA RNP מתחמי לזירוז מעברי זוגי נטוש (DSBs), מחיקה של ההתערבות קטע. שיטה זו הופך לרישית על השימוש של שני מדריכים ליצירת מחיקות מסגרת קריאה פתוחה, יעילות גבוהה של NHEJ שמוביל מספר נמוך של שיבוטים הזה צריך להתאפיין ולאחר סינון ראשוני קל של שיבוטים מאת נימי אוטומטית יחידת אלקטרופורזה, פרגמנט מנתח. אלה הגנום יעיל עריכה שיטות ליצירת מודלים מבוססי תאי גזע מחלות אנושיות תהפוך בקרוב גישה סטנדרטי, לא שגרתית במעבדה תאי גזע כלשהו. לבסוף הגנום מדויק עריכה יהפוך את זה אפשרי ללכת מעבר לתאי גזע המחלה דוגמנות, פוטנציאלי יכול לעזור לעודד טיפולים מבוססי תאים.
Protocol
1. פרוטוקול התכנות
- דור של iPSC אנושי מתאי הלבלב אנושי ראשוני
- מעיל 6-באר צלחת עם קולגן קר 1.5 mg/mL ולאפשר לו ג'ל ב 37 ° C עבור ה 1
- צלחת בתחילת המעבר האנושי בתאי הלבלב הראשי השלישי Prigrow בינוני (~ 1-1.5 × 10 5 תאים) על קולגן מצופה צלחת 6-טוב על יום-2 להשיג כ 2.5 × 10 5 תאים או לפחות 60% confluency לכל טוב ביום התמרה חושית (יום 0). לצורך המחקר הראשונה, צלחת לפחות 2-3 בארות להגיע באר אחת עם confluency הרצוי ביום 0. להשתמש לפחות טוב כמו פקד לספור את התאים.
- ביום של התמרה חושית (יום 0), לחמם 1 מ"ל של Prigrow השלישי בינוני באמבט מים עבור כל טוב להיות transduced. לקצור את התאים מפקד אחד לפקד טוב ב 1 מ"ל של 10% FBS מדיום באמצעות 1 מ"ל של טריפסין/EDTA במשך 5 דקות או עד לנתק התאים לבצע ספירת תאים. כדי להפוך את 10% FBS בינונית, להוסיף DMEM, 10% FBS, 1%-גלוטמין, 1% נתרן פירובט ו 1% חומצות אמינו שאינן הכרחיות.
- ספירה, לבדוק את הכדאיות של התאים באמצעות הדלפק תא, לחשב את הנפח של כל וירוס צריך להגיע ליעד בהתבסס על מספר ווירוסים כייל התא. השתמש ריבוי של זיהום (MOI) של קוס (kos) = 5, hc-Myc = 5 ו- hKlf4 = 3 עבור התאים בלבלב.
- סט אחד הפשרה סנדאי וקטור צינורות במחסן-80 ° C על קרח ולהוסיף בזהירות את נפחי מחושב כל אחד הצינורות וקטור סנדאי שלוש 1 מ"ל של Prigrow השלישי בינוני, מראש התחמם עד 37 ° ג פיפטה בעדינות כדי לערבב את הפתרון. באר אחת לתוך צלחת 6-ובכן מספיקה transducing עם וקטורים ויראלי סנדאי ליצירת תאים מחדש.
- תשאף המדיום Prigrow השלישי את התאים, ולהוסיף לאט את התערובת וירוס התיכנות הבארות המכילות את התאים. דגירה התאים לילה בחממה 37 ° C עם אווירה humidified של 5% CO 2.
- בקפידה למחוק את התערובת וירוס על תאים והחלף בינוני Prigrow השלישי טרי ביום המחרת, 24 שעות לאחר התמרה חושית. התרבות התאים עבור 5 d ולשנות את המדיום כל יום חלופי.
- ביום 5, להכין MEFs על 0.1% ג'לטין מצופה מראש 10 ס מ תרבות מנות (1.3 x 10 6 תאים/מאכל). לגדול MEFs ב T175 מבחנות עד ליום 4 ולחשוף ואז ביום 5, התאים 6,000 rads ממקור קרינה-γ לפני זריעה של תאים 13 או שימוש המקור MEF מסחרי.
- ביום 6, להשתמש 1 מ"ל של פתרון ניתוק התא עבור 10 דקות כדי לנתק את התאים transduced, לוחית רישוי כולן על מנות MEF השלישי Prigrow בינוני עם מעכב רוק (5 מ מ מניות, הסופי 10 מיקרומטר), דגירה בין לילה בחממה 37 ° C עם atmosphe humidified re של 5% CO 2.
- לשנות המדיום השלישי Prigrow בינוני hESC למחרת. להכנת 500 מ"ל של hESC בינונית, להוסיף DMEM/F-12, 20% (v/v) נוקאאוט סרום חלופי (KOSR), bFGF ng/mL 5; 1 מ מגלוטמין; 100 מיקרומטר חומצות אמינו שאינן חיוניות, 100 מיקרומטר מרקפטואתנול. מחליף המדיום בעדינות כל יום עכשיו.
- להתבונן הלוחות באופן קבוע על התפתחותה של התא גושים או מושבות מעידה על תאים מחדש. התאים טרנספורמציה טופס אגרגטים המשובטים עם מורפולוגיה המרוצף, גרעין גדול, nucleoli. לסמן את סבירות ' iPSC ' מושבות ולבדוק את אותם באופן קבוע לצמיחה.
- כמעט ארבעה שבועות לאחר התמרה חושית כמו מושבות מוכנים האיסוף או ההעברה, להכין 24-ובכן MEF צלחות על ידי ציפוי 1.3 x 10 6 תאים/ג'לטין לצלחת מצופה מראש כמו קודם להעברת מושבות יחיד.
- הכן מטריקס ממברנה (למשל, Matrigel) על ידי aliquoting שזה מבוסס על הגורם דילול שבאישור של ניתוח. להוסיף aliquot אחד מ 25 ל DMEM/F-12 את המעיל 6 4-טוב צלחות (1 מ"ל/טוב), תקופת דגירה בטמפרטורת החדר (RT) לפחות שעה לפני השימוש. לבחור באופן ידני 12-24 מושבות באמצעות פיפטה-טיפ סטרילי כדי תשאף אותם ולהעביר אל הצלחות MEF 500 µL בינוני hESC.
- תשאף התקשורת בתוך הבאר בעדינות לשבש או להפריד את המושבות. גם לבחור 24-48 המושבות של מטריקס מצופה קרום. ובכן 24 צלחות. עבור לוחות מצופה קרום, להשתמש mTeSR1 (בתוספת 10 מיקרומטר רוק מעכב) עבור 24 שעות ולהחליף כל יום. בתוך 6-10 ד' של איסוף מושבות, הם מוכנים להעביר את הצלחות ממברנה 24-ובכן ו/או 12-ובכן חדש עבור משובט הרחבה.
- במידת הצורך, נתק את המושבות על MEFs באמצעות 1 מ"ג/מ"ל collagenase למשך 20 דקות, לשטוף פעמיים עם hESC/mTeSR1, העברת ממברנה מצופה לוחות 12 או 24-ובכן. אם יש מספיק מושבות החזקה גוברת על קרום מטריקס מהשלב 1.1.12, להקפיא את המושבות על MEFs באמצעות iPSC קפוא המדיה לפי היצרן ' הנחיות s.
- לנתק את המושבות עמיד מצופה על הקרום בשלב 1.1.12 באמצעות µL 500 של dispase עבור 20 דקות, צלחת שוב על מטריצה ממברנה מצופה לוחות 12-. טוב. לגרד באופן ידני את כל תאים או מזהמים MEF מזין תאים להעשיר עבור pluripotent שיבוטים על הקרום.
- הרחב השיבוטים לאחר 6-8 d על ידי הגדלה על קרום מצופה לוחות מאת בריא עם פתרון dispase כמו לפני ציפוי אגרגטים תאים קטנים על קרום טרי מצופה צלחת 6 או 12-ובכן. שינוי mTeSR1 בינוני מדי יום. מאפיינים מהעותקים reprogrammed על ידי phosphatase אלקליין מכתים, immunostaining לניתוח pluripotency סמנים (OCT3/4 ו- NANOG), FACS של סמני פני pluripotent, מבחני בידול. לגדול ו תרבות השיבוטים על צלחות מצופה קרום עבור כל מבחני כולל CRISPR עריכה כפי שהוסבר לעיל, אלא אם כן פתרון ציפוי אחר מוזכר במפורש.
- IPSCs אפיון של זכויות
- מכתים Phosphatase אלקליין
הערה: ערכת מסחרי משמש כאן. עיין בטבלה חומרים.- צלחת בשם האדם iPSCs על צלחת 24-ובכן והתרבות במשך 4-5 d בשינוי מדיה מדי יום.
- להפעיל את פרוטוקול מוכתמים, תשאף המדיום תרבות ולשטוף את התאים עם 1 מ"ל של PBS 1 x עם 0.05% Tween 20 (PBST).
- להוסיף 0.5 מ של פתרון בערכה של התאים ואת תקופת דגירה-RT של 2-5 דקות לשאוב הפתרון ולאחר מכן לשטוף את התאים קבוע עם PBST. אל תאפשר הבארות להתייבש.
- להוסיף 0.5 מ ל שזה עתה הוכנו AP המצע פתרון לכל טוב על ידי ערבוב פתרון A, B ו- C. Incubate את התאים בחושך (עטוף בנייר כסף או במיכל חשוך) בטמפרטורת החדר במשך 5-15 דקות
הערה: מקרוב לפקח שינוי הצבע, לעצור את תגובת כאשר הצבע הופך בהיר כדי למנוע כתמים שאינם ספציפיים. - לעצור את התגובה על ידי כ רפה בעברית הפתרון המצע AP ושטיפת הבארות פעמיים עם 2 מ ל 1 x PBS.
- להתבונן המושבות מתחת למיקרוסקופ, ללכוד את התמונות 4 X או 10 X הגדלה באמצעות מיקרוסקופ שדה בהיר כלשהו עם מצלמה.
- Immunostaining
- צלחת iPSCs האנושי צלחת 24-ובכן ותרבות עבור 4-5 יח בשינוי מדיה מדי יום.
- לשטוף את התאים פעם בקצרה עם PBS, תיקון עבור 20 דקות עם 4% paraformaldehyde (PFA) ב- PBS.
- שלוש פעמים בשביל 10 דקות (3 x, 10 דקות) עם PBS ב RT.
- Saturate אתרים שאינם ספציפיים עם 10% נורמלי עז או חמור סרום (NS, בהתאם הנוגדן משני בעלי חיים גדלה ב) ב- PBS למשך 40 דקות ב- RT. עבור רק תאיים epitopes, לכלול 0.3% TX-100 ב- PBS (TX/PBS) כדי permeabilize.
- שטיפת 3 x 5 דקות עם PBS ב RT.
- לדלל את הנוגדנים OCT4, NANOG, TUJ1, NKX2-5, SOX17 בריכוז של 5% טרי NS ב- PBS דגירה עבור 2 h ב- RT או ללון ב- 4 מעלות צלזיוס
- לשטוף x 3 עבור חמש דקות עם PBS ב RT.
- לדלל המתאים משני אלקסה 488 עבור חיל הים או נוגדנים 568 ב- 5% NS/PBS דגירה תאים עבור 1 h RT.
- לשטוף x 3 עבור 5 דקות ב- RT.
- תקופת דגירה עם דאפי ב- PBS של 10 דקות ושטוף 2 x עבור 5 דקות RT. בשימוש במיקרוסקופ פלואורסצנטי כדי לצלם תמונות.
- לפעיל על-ידי קרינה פלואורסצנטית התא מיון (FACS)
- iPSCs האנושי צלחת צלחת 6-ובכן ותרבות עד המושבות להיות 80% confluent (לפחות 10 5 תאים /sample) בשינוי בינוני mTeSR1 היומי-
- ביום של הניסוי, לבודד את התאים ואת מביצועם כדי השעיה תא בודד, כפי שהוסבר לעיל בפרוטוקול. תשטוף עם 10% FBS בינונית.
- עבור סמני פני השטח, resuspend של 0.5-1 מ ל 10% FBS בינוני ולשמור על קרח
- עבור סמני תאיים, resuspend ב 1 מ"ל של 4% מחברים/PBS דגירה 10 דקות בטמפרטורת החדר. לשטוף עם 10% FBS בינוני. Resuspend 0.1% TX/PBS דגירה למשך 15 דקות על קרח. לשטוף שוב עם 10% FBS בינוני. Resuspend ב 0.5-1 מ ל 10% FBS בינוני ולשמור על קרח
- להוסיף 50 µL של התליה תא ל 50 µL של 10% FBS המכיל בינונית מומלץ כמות TRA-1-60, TRA-1-81 או נוגדנים SSEA-4, תקופת דגירה של 30 דקות לח' 1
- לשטוף פעמיים עם 10% FBS.
- Resuspend ב µL 100 10% FBS בינוני המכיל נוגדנים משניים פלורסנט, תקופת דגירה של 30 דקות לשטוף פעמיים עם 10% FBS ו resuspend נפח מתאים של 10% FBS. ניתן להבחין את התאים הפועלים של תאים מתים על ידי צבע יודיד propidium שמתווסף < 1 µg/mL כדי להעריך תא אפופטוזיס במהלך התהליך.
- בידול Tri-השושלת
- זרע שתי צלחות 6-ובכן עם 1.5-2 x 10 6 iPSCs/טוב mTeSR1 בינוני עם 10 מיקרומטר רוק מעכב.
- מאפשרים לתאים לגדול במשך 2-3 d בשינוי מדי יום mTeSR1 בינוני עד הבארות 80-90% confluent.
- האאקטודרם אינדוקציה, הוסיפו אינדוקציה עצבי בינוני (נים) על פי היצרן ' הוראות s ב- 2-3 בארות של הלוחות 6-ובכן.
- לשנות את המדיום RPMI המכיל 2% B27 תוספת פחות אינסולין ו- 12 מיקרומטר CHIR99021 עבור אינדוקציה והמזודרם ב 2-3 בארות של צלחות 14. הוסף RPMI היחיד המכיל 2% B27 תוספת פחות אינסולין עבור מיקרומטר להוסיף 5 הבא ה 24 IWP4 למדיום RPMI עם 2% B27 תוספת פחות אינסולין עבור ה 24 הבא. לאחר 72 h, להחליף את המדיה RPMI המכיל 2% B27 תוספת שמוביל הדור של מכה cardiomyocytes ד 2-3
- עבור אינדוקציה האנדודרם, לשנות את המדיום בבארות הלוחיות 6-טוב כדי MCDB 131 בתוספת 1.5 g/L סודיום ביקרבונט, 1 x Glutamax גלוקוז 10 מ מ, BSA 0.5%, 100 ננוגרם למ"ל GDF8, 5µM של CHIR99021 עבור ה 24 תרבות המדיום אותו מבלי CHIR99021 עבור 2-3 d 15.
- לעקוב אחר הפרוטוקול immunostaining מ שלב 2 עבור כל שושלות שלושה ולבדוק אם הביטוי של סמנים רלוונטיות.
- מכתים Phosphatase אלקליין
2. הגנום iPSC עריכה של האדם באמצעות CRISPR-Cas9
- חלבון הכנה של Cas9 ו sgRNA
- Aliquot Cas9 החלבון לתוך צינורות microcentrifuge בתנאים סטריליים ולאחסן את aliquots על ידי הקפאת הצינורות ב-80 מעלות צלזיוס
- עיצוב 2 מיקוד מדריך RNAs לכל הגן מבוססת על התוכנה מ- MIT (http://www.genome-engineering.org/crispr/) או כל אחרים CRISPR מדריך עיצוב webtool. יעד אקסון הראשון או השני של הגן (מבוסס על מסגרת קריאה פתוחה) כדי ליצור הסתרה. בחר שני מדריכים כך הם חתכו ביחד (~ 30-100 bp בנפרד), שאנו יכולים בקלות לדמיין את המחיקה באמצעות אותה קבוצה של הקרנת תחל. בחר המדריכים פלט התוכנה על בסיס ציון איכות גבוה יותר מספר נמוך יותר של חופש-יעד אתרים. עיצוב תחל ההקרנה באמצעות הפיצוץ תחל תוכנית (https://www.ncbi.nlm.nih.gov/tools/primer-blast/). הקרנת תחל צריך להיות לפחות 100 bp מן Cas9 אתרים גזורה גודל המוצר PCR צריך להיות רצוי בין 400-700 bp הגברה קלה יותר על-ידי ה-PCR-
- עיצוב oligo שני sgRNA משלימים את DNAs (19-22 נוקלאוטידים אורך בהתאם רצף מדריך) עם Bsa1 לחתוך את האתר בכל קצה. יכול להיות מסונתז באופן מסחרי, annealed כדי ליצור זוגיות-גדיל DNA oligo DNAs. עבור חישול, להוסיף 1 µL כל המדריכים 100 מיקרומטר, 25 µL של חישול מאגר (10 מ"מ טריס, pH7.5-8.0, 50 מ מ NaCl, 1 מ"מ EDTA) ו 23 µL של מים. דגירה ב thermocycler מתוכנתת להתחיל ב 95 ° C וקירור 2 דקות ואז בהדרגה עד 25 ° C מעל 45 דקות
- שיבוט µL 2 של קטע שנוצר לתוך באנזים הגבלה Bsa1 מתעכל µL 1 של וקטור pCR2.1 של יזם T7 פנימית עם אתר איגוד Cas9 באמצעות T4 DNA ליגאז לפי היצרן ' פרוטוקול s.
- רצף שברי DNA משובטים, כשנוצר נאמנות, במבחנה לתמלל שיבוטים באמצעות ערכת T7 ליצירת מדריך בודד RNAs. לטהר את sgRNAs עם ערכת מסחרי, elute במים נטולי RNase. בדוק את הריכוז רנ א.
- תרביות תאים של hiPSCs
- תרבות hiPSCs mTeSR1 בינוני, כפי שתואר לעיל, עד שהתאים confluent 40-50%.
- שעתיים לפני nucleofection, להחליף את המדיום 2 מ של prewarmed mTeSR1 בינוני המכיל 10 מיקרומטר רוק מעכב.
- שעה אחת מאוחר יותר, הכן בארות היעד עבור תאים nucleofected על ידי קרום שואבת, המוכן לעיל, 12-ובכן צלחת והחלפה עם prewarmed 1 מ"ל mTeSR1 בינוני עם 10 מיקרומטר רוק מעכב. לשמור על 37 ° C עבור הדגירה. תוספת
- הכנת nucleofection מאסטר מיקס (סולם כראוי בהתאם הדגימות) עבור כל דגימה על-ידי הוספת 16.4 µL של התא הראשי P3; µL 3.6 של תוספת 1 מתוך ערכת nucleofector; µg 0.5 Cas9 חלבון ו- 0.5 µg של כל sgRNA ב- µL 22 לכל אמצעי אחסון התגובה. pMAX GFP וקטור היה גם nucleofected לפי היצרן ' המלצות s בתאים כדי להעריך את היעילות של תרביות תאים iPSC בערך.
- לרחוץ כל טוב עם 2 מ של RT PBS לאחר כ רפה בעברית המדיום המכיל מעכבי רוק מן הבארות iPSC. אז תשאף PBS, להוסיף 1 מ"ל של פתרון ניתוק התא, דגירה את הצלחת ב 37 מעלות צלזיוס במשך 10 דקות
- Resuspend התאים 3 מ"ל של mTeSR1 בינוני, בעדינות פיפטה למעלה ולמטה כדי להפיק השעיה תא בודד. העברת הפומבית לתאים צנטריפוגה 15 מ"ל צינור המכיל 5 מ"ל mTeSR1 בינונית.
- לספור תאים עם מונה תא, לחשב את הנפח הכולל הנדרש 0.5 x 10 6 תאים/תקנים. למקם את הכמות הרצויה של תאים בצינור צנטריפוגה 15-mL, צנטריפוגה ב x 200 גרם במשך 5 דקות ב RT, תשאף תגובת שיקוע.
- Resuspend כל יחידה של 0.5 x 6 10, בתאים µL 22 של תרביות תאים לערבב מאסטר מוכן בשלב 4. במהירות העברת תאים אל החדר המרכזי של אחד טוב של רצועה nucleocuvette. למקם את הרצועה המכשיר nucleofector ותאי nucleofect באמצעות תוכנית CB150.
- לאחר nucleofection, להוסיף במהירות 80 µL prewarmed mTESR1 בינוני המכיל 10 מיקרומטר מעכב רוק מכל קידוח של תאי nucleofected. לערבב בעדינות על ידי pipetting למעלה ולמטה.
- בעדינות להעביר תאים מרצועת בארות של קרום מצופים מראש 12-ובכן צלחת המכיל mTeSR1 בינוני עם רוק המדכא מוכן בשלב 3.
- d לאחר 1, שנה לבינונית mTeSR1 טריים ללא רוק מעכב. קציר תאים 2-3 d לאחר nucleofection למיון החד-תאיים.
- תא בודד בידוד של יישוב hiPSCs
- יום אחד לפני המיון, להכין 96-ובכן MEF הצלחות על-ידי זריעת 2 x 10 6 תאים/ג'לטין-מצופה צלחת 10% FBS בינוני. כ- 70-80% של השיבוטים לשרוד לאחר nucleofection ו 2-3 MEF צלחות ניתן להכין עבור עריכת ניסוי.
- בעקבות הדגירה לילה, לשנות את המדיום לבינונית hESC (כמתואר לעיל) בתוספת 100 ng /mL bFGF, 1 x SMC4 (מעכבי הוסיף בכלי התקשורת כדי לשפר את יכולת הקיום של תא בודד), ו- 5 מ"ג/מ"ל fibronectin לקדם אדהזיה.
- להחליף את המדיום-hiPSCs בצלחת 12-ובכן מ mTeSR1 ל mTeSR1 בינונית בתוספת 1 x SMC4 כבר לפחות שעתיים לפני מיון יחיד תא.
- תשאף האמצעי hiPSCs ולשטוף את התאים בעדינות עם PBS. מוסיפים µL 500 בפתרון ניתוק התא מכל קידוח, דגירה ב 37 מעלות צלזיוס למשך 10 דקות לאחר כ רפה בעברית, טוב, מגניב. צור התליה תא בודד על-ידי הוספת 1 מ"ל של mTeSR1 (unsupplemented) מכל קידוח pipetting למעלה ולמטה בעדינות מספר פעמים.
- למקם את ההשעיה תא צינור חרוטי 15-mL, צנטריפוגה למשך 5 דקות ב- 200 x g בתגובת שיקוע RT. וביופסיה, resuspend תאי 1 מ"ל של mTeSR1.
- מיון תאי תאים בודדים באמצעות של סדרן התא עם זרבובית 100 מ מ בתנאים סטריליים עם תא אחד בבאר בודדים של הלוחות 96-ובכן מוכן בשלב 1-
- ארבעה ימים לאחר מיון, המושבה היווצרות בלאו; בשלב זה להחליף את המדיום תרבות בתוספת 1 בינוני hESC x SMC4.
- שמונה ימים לאחר מיון, להחליף בינוני בינוני hESC והתרבות 2 ד
- לנתק את המושבות באמצעות 1 מ"ג/מ"ל collagenase עבור 20 דקות ומעבירים אותם אל הצלחות מצופה קרום 24-טוב mTeSR1 עם רוק מעכב. תן שיבוטים תא בודד לגדול ולחלץ את הדנ א הגנומי שלהם לאחר שכפול או להרחיב אותם. השתמש תחל ספציפי ג'ין כדי להגביר את המטרה-DNA על ידי ה-PCR-
- שימוש פרגמנט מנתח עבור ערכת הקרנה הראשונית של ה-PCR היעד מוגבר באזור גנומית של שיבוטים כל על-ידי הפעלת אותם באמצעות הג'ל/לצבוע לערבב לפי היצרן ' s הוראות. לאמוד את גודל המקטע שנוצר בתוכנה PROSize על-ידי השוואתה עם הסולם המתאים, אשר מנוהל עם הדגימות. רצף את הצפוי ' נערך ' שיבוטים וניתוח רצפי הנתונים כדי לאשר את עריכת או המחיקות.
- עבור המבדילים שיבוטים monoallelic ו- biallelic, להגביר את רצף הערוך עם ה-PCR, שיבוט של וקטור pJET1.2. לשלוח לפחות 8-10 שיבוטים עבור רצף ולבדוק את הרצף לאשר עריכה של אחד או שני אללים.
- ברגע iPSC בהצלחה יישוב שיבוטים זוהו באמצעות genotyping, לבחון כדי לאשר כי הם לא איבד pluripotency או צבר העיוותים כרומוזומלית בתהליך.
תוצאות
בפרסום זה, אנו עוקבים אחריו פרוטוקול פשוט אך יעיל לדור של iPSC מתאי הלבלב האנושי באמצעות שילוב או ללא טביעת רגל וירוס סנדאי וקטורים. איור 1A מציג ייצוג סכמטי של פרוטוקול זה התיכנות. התאים בלבלב האנושי נרכשו מסחרית, תרבותי השלישי Prigrow בינוני, transduced עם וירוס סנדאי כפי שהוסבר לעיל. Transduced פלך בצורת בתאי הלבלב לא הראתה שינויים מורפולוגיים ~ 5 ימים לאחר התמרה חושית סנדאי וירוס ביום 0, אך אז להיות מעוגל עם גרעין גדול יותר, nucleoli. כמה מושבות הראשונים נראו לאחר התמרה חושית שלאחר שבוע אבל הם היו בחרו לא, כמו הניסיון שלנו, מושבות אלו במהירות מביצועם, הם בדרך כלל "תאים חלקית reprogrammed מוקדמת" זה לא להקים מושבות חזקים. כ 10-15 ימים לאחר התמרה חושית, מושבות בהיר קטן נצפו, היו אסף לאחר צמיחה (איור 1B, למעלה מימין). מושבות אנושיות iPSC הינם קומפקטיים, בצפיפות עם קצוות ברורים (נחשב 'במלואה מחדש תאים') (איור 1B, יום 23 התחתון באמצע) ו 'חלקית מחדש תאים' רופפים עם פערים במושבה (איור 1B, יום 23 הימנית התחתונה). המושבות היו תאי הלבלב צמחו ביום 18 (איור 1Bהשמאלית התחתונה), היו גדולים מספיק כדי לאסוף באופן ידני ביום 23 (איור 1B, האמצעי התחתון). המושבות היו מצופה על צלחות מצופה קרום לאחר קטיף כדי לקבל חינם מזין iPSC מאת יום 30-40 (איור 2 א, משמאל). חלק מושבות אלו ללא מזין 'חזקים' ' היו מורחבת, מאופיין עבור הביטוי של phosphatase אלקליין, pluripotency וסמנים משטח מזין ללא תנאי. השיכפולים שנבדקו היו חיוביות עבור phosphatase אלקליין כפי הם הפכו אדום בהיר לאחר וזמינותו (איור 2 א, מימין). הסמנים pluripotency OCT4, NANOG, SSEA4, טרה-1-60, TRA-1-81 נצפו גם להתבטא מאוד השיכפולים immunostaining או ניתוח FACS (2B איור , איור 3A).
תוצאות אלה מדגימים המושבות iPSC האנושי שנוצר מתאי הלבלב הביע סמנים pluripotency מזין ללא תנאי. Pluripotency היה גם לאומדן הבידול בבימויו של האדם iPSC שלוש שכבות נבט: האאקטודרם, והמזודרם והאנדודרם. שיבוטים על קרום הבדיל מנע בעוצמה הנוירונים TUJ1-חיוביות (האאקטודרם), NKX2-5-חיוביות מכות cardiomyocytes (והמזודרם), תאים endodermal SOX17-חיוביות (איור 3B).
לאחר אפיון מעמיק, שורות 3-חזקים, ללא מזין iPSC המשובטים נבחרו הגנום עריכת מחקרים. המדריכים שני עם BsaI אתרי חיתוך הקצוות תוכננו עבור כל הגן לחתוך קרובים זה לזה (קרי, n פחות מ 100 ~ bp). התרשים של הפרוטוקול מוצג באיור4. אסטרטגיה זו מחיקה משמש הגנים היעד אפשרה לנו בקלות למחוק חלק אקסון הראשון או השני של גנים. אסטרטגיה זו יעילה מאוד, יכולנו לבודד שיבוטים שנערכו ב כל נסיון. המדריכים היו משובטים לתוך BsaI מתעכל וקטוריים וגם במבחנה עיבד כמתואר לעיל. אנחנו מדריכים nucleofected (RNAs) וחלבון Cas9 כמו RNP מתחמי לעריכה מהירה ויעילה. אנחנו גם למיין את התאים כמו תאים בודדים על MEFs כמו שחזור של תאים הוא גבוה יותר לעומת תאים ממוינים ביחידים על צלחות מצופה קרום. דנ א גנומי הופרדה מרשת כל שיבוטים, החלק היעד היה מוגבר על ידי ה-PCR ותיפתר על פרגמנט מנתח עבור שינויים במידות של היעד קטעים לעומת הפקדים מסך. גודל הרסיס היה לעומת הסולם לרוץ עם הדגימות לאיתור שכפולים 'הערוך' (איור 4, למטה). זה גרם ההקרנה של שיבוטים קל כפי נלך > שיבוטים 90 ב לוח אחד ואת התוצאות התקבלו עם הדיוק של ± 3 bp. שיבוטים שנבחרו היו רציף ואז לאשר שיבוטים פראי-סוג של מוטציה. שיבוטים Wildtype היה אין מחיקה או תוספת של בסיסים בעוד מוטציה שיבוטים היו תוספת או מחיקה ברצף לעומת wildtype. מראה מחיקה או תוספת רצף היו pJET1.2 התרחב, משובטים לתוך וקטורית כדי לזהות שיבוטים monoallelic ו- biallelic על ידי רצף של פחות 8-10 מושבות לכל שיבוט השיבוטים. שיבוטים Monoallelic היה בסיסי למחוק או להוסיף אלל אחד והשני, שהודעה ודומה אלל wildtype. Biallelic שיבוטים היו מחיקות שני אללים. בערך שלוש מאות שיבוטים הוקרנו על כל הגנים היעד, אשר זיהו שיבוטים מחיקה monoallelic כ 9 ו- 3 שיבוטים מחיקה biallelic בכל מקרה ומקרה. זה בערך המתאים ירידה 3-fold שתדירותם של הדור של שיבוטים biallelic בהשוואה monoallelic שיבוטים. הטרוגניות תוך amplicons המחיקה לידי תיקון NHEJ לא מושלם ולא עקבית. הביטוי של הגן סוף סוף אושר על-ידי חילוץ RNA התאים היעד, על-ידי ביצוע RT-PCR.

איור 1: תכנות מחדש של תאים בלבלב האנושי תאים pluripotent נטולת מזין (iPSC). (א) א פרוטוקול סכמטית לדור של iPSC מתאי הלבלב האנושית מוצגת. תאי הלבלב היו גדל על צלחות מצופה קולגן, הועבר לאחר מכן MEFs לאחר התמרה חושית עם וירוס סנדאי האנושי וקטורים. המושבות היו לגמרי היו לאחר מכן הועבר hESC מוסמך ממברנה, מאופיין. Morphological (B) שינויים לאחר וירוס סנדאי התמרה חושית. לפני התמרה חושית, בתאי הלבלב להראות כמו ציר טיפוסי מורפולוגיה (למעלה שמאלה, יום 0). מושבות קטנות, חזק להופיע MEFs ביום 12, הדומה מושבות תאים pluripotent אנושי. בדרך כלל המושבות מלא מחדש iPSC האנושי יש גבולות ברורים, ניתן לאסוף על ידי יום 23-30. מושבה dissociated ביום 23 מוצג בתחתית הנכון. כל התמונות נלכדו בהגדלה X 100 (המטרה X 10 ו עינית X 10). סרגל קנה מידה = 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
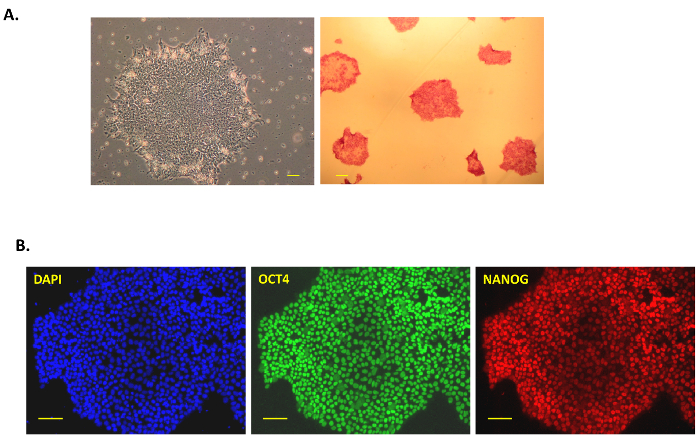
איור 2: אפיון iPSC אנושי. (א) א שלב טיפוסי חדות התמונה המושבה iPSC לאחר איסוף ותרבות בתנאים ללא מזין (40 X 4 X אובייקטיבי ו- 10 X העינית; משמאל) לאחר וירוס סנדאי התכנות של תאים בלבלב. אלקליין פוספטאז צבעונית iPSC אדום המושבה היא בצד הימין. ההכתמה phosphatase אלקליין, המושבות iPSC היו קבועים, צבעונית אדום לאחר התוספת של המצע פתרון הערכה. התמונות נלקחו בשבי בגיל 40 X. Immunostaining (B) עבור סמני pluripotency NANOG, OCT3/4 במזין ללא אנושיים iPSCs תא-derived הלבלב. דאפי שימש כתם גרעין כחולות כמו פקד. כל התמונות צולמו בהגדלה X 100. סרגל קנה מידה = 100 מיקרומטר בכל התמונות. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
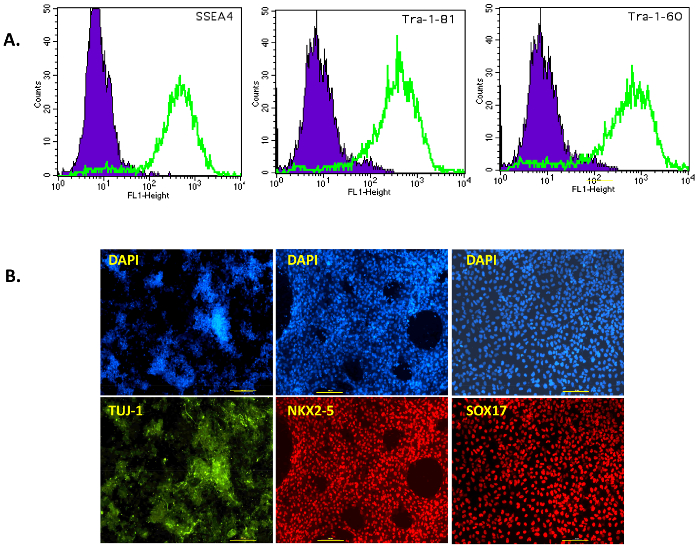
איור 3: אפיון pluripotency ובידול פוטנציאלי של iPSC. (א) FACS ניתוח של פני השטח סמני SSEA4, טרה-1-60, TRA-1-81 iPSCs נטולת מזין. התאים היו חלופה מועדפת על תא בודד ההשעיה, צבעונית עבור סמני פני השטח SSEA-4, טרה-1-60 ו- TRA-1-81. הפסגה סגול מכיל iPSC שלילי (נוגדן פקד) תאים, iPSC הלבלב יכול להיות ברוחי כמו הפסגה ירוק. הדמיה Immunofluorescent (B) של שכבת נבט סמן גנים. הביטוי של סמנים TUJ1 האאקטודרם (ירוק), NKX2-5 והמזודרם (אדום) ו SOX17 האנדודרם (אדום) בתאים לאחר הבידול בבימויו של iPSC הלבלב. הבקרה המתאימים גרעיני הכתם דאפי הוא כחול. כל התמונות צולמו בהגדלה X 100. גודל ברים = 100 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: סכימטי באסטרטגיית מחיקה CRISPR/Cas9. זוג sgRNA אחד היה מעוצב (מסומן אדום) עם BsaI אתרים לחתוך בסוף (מוצג נ ו- R) רצוי פילוח של אקסון הראשון, annealed, שיכפל ב BsaI מתעכל ששונה וקטור (pCR2.1, BsaI אתר מסומן גריי), וסודרו ותורגם במבחנה . רצף וקטור מסומן בקו תחתון מראה את החלק נמחק לאחר עיכול BsaI. המיקום של הקרנת תחל מסומן בכחול. Cas9 מדריך RNAs היו nucleofected iPSC נטולת מזין כמו מתחם על מחיקות גנומית. iPSCs היו אז תא בודד ממוינות על צלחות MEF 96-ובכן, תרבותי, הועבר ממברנה, מורחבת, הוקרן על ידי מנתח פרגמנט. עבור מפעיל את הדגימות במנתח, DNAs גנומית של Cas9 מדריך transfected שיבוטים על קרום היו חילוץ, עברו דרך לערבב ג'ל/לצבוע במנתח לבחירה שיבוטים פוטנציאליים 'הערוך' (בתחתית באמצע). הסולם הרלוונטי סמנים, WT ואת הפוטנציאל שיבוטים הערוך מסומנים. הביטוי של הגן אושר על-ידי חילוץ RNA וניתוח עם Q-PCR. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
Discussion
תכנות מחדש של תאים סומטיים האנושי iPSCs סיפקה דחיפה גדולה בתחומי מחקר בסיסי ביולוגיה, רפואה אישית, מידול המחלה, פיתוח תרופות, רפואה רגנרטיבית16. שיטות רבות הנוכחי והשימוש בהם נפוץ דור אנוש iPSC דורשים שימוש וירוס עם הסיכון של אינטגרציה לתוך הגנום מארח או וקטורים episomal עם נמוך התכנות יעילות. כאן, אנו מציגים דרך יעילה ליצירת iPSCs נטולת מזין מתאי הלבלב האנושי עם סנדאי-וירוס, מה שמוביל ' חינם ' וטביעת התכנות יעיל. IPSCs האנושית וכתוצאה מכך הן ללא transgenes ויראלי, לשמור על pluripotency, להימנע משימוש של גורמים אקסוגניים לא ידוע. הדור של iPSCs בתנאים ללא מזין יש יעילות התיכנות נמוך, כך אנחנו מחדש תאי הלבלב הראשי על מזין תאים ולאחר מכן ניסה המושבות מזין ללא קרום על הרחבה, תרבות ואפיון. היתוך גרעיני של טכניקות אלה מספק יציב, אמין, יעיל יותר iPSC תכנות.
אנו גם להפיק iPSCs של fibroblasts האנושי והתאים העיקרי בשיטה זו, שמצביע על כך שניתן להשתמש סנדאי-וירוס לתכנת מגוון רחב של תאים. חשוב שיקולים הם: צורך confluency אופטימלי של ראשי תאים כדי לתכנת כמו השפעות תאים מעט מדי או יותר מדי התכנות יעילות; מעבר תת קודמות של תאים הראשי כאשר התאים עדיין בצורה אופטימלית מחלקים; טיטור זהיר של נגיפי המומנט הזה תוצאות תא מינימלי אפופטוזיס, יעילות גבוהה שמוביל קל להרים של המושבות חזקים; מאמת את אובדן סנדאי וקטור ביטוי transgene על ידי ה-PCR-10-15 קטעים כדי להבטיח כי iPSCs 'טביעת רגל חופשית'; בתנאים סטריליים קפדנית לתרבות של iPSC על הממברנה.
השתמשנו שיטה נוחה ויעילה של השינוי הגנום CRISPR כדי לערוך את הגנום iPSC. טכניקה זו משלבת חלבון Cas9, sgRNA, RNP מתחמי מזהה, קליב רצפי דנ א משלים. זה ניתן בקלות להתאים למטרה רצף גנומית פשוט על ידי שינוי המדריך bp 20 RNA. השיטה שלנו מספק פרוטוקול קל עבור יעיל, עריכה של iPSCs האנושי כפי שהם יותר עתירי עבודה, קשה מגלי, הדירים ויקר יותר תאים אחרים. אנחנו עיצוב לפחות שני מדריכים סמוכים אך שאינם חופפים עבור ג'ין מטרה כל כך ניתן להשתמש ערכה אחת של הקרנת תחל ההקרנה שיבוטים הערוך. בנוסף, השימוש של שני מדריכים ~ 30-100 bp ביניהם יוצר מחיקה גדול, אשר ניתן לאבחן בקלות במהלך ההקרנה ראשוני ומבטיחה דלדול של חלבון. המדריכים יכול להיבדק בתאים HEK-293 בתחילה כדי להעריך את היעילות לפני החל וזמינותו iPSC. בנוסף, חיוני להקים פרמטרים עבור תקנים שגרתית של ריאגנטים לתוך iPSC. באמצעות פלסמיד pMAXGFP, תרביות תאים היעילות של > 80% וגן מיקוד/הפרעה היעילות של 3-10% iPSCs מושגות באופן שגרתי. מסירה ישירה של מתחמי Cas9 RNP לתוך תאים של התקנון שלנו מספק פעולה מהירה, תחלופת מהירה ושומר על שיעור גבוה של השינוי ממוקד. שלנו גישה מעסיקה תא בודד מיון בעקבות nucleofection של מדריכים, חלבון Cas9, התגברות על מכשול משמעותי של ג'ין פילוח מעורב iPSC האוכלוסייה ולהבטיח את clonality של התאים. זו הגישה הכללית 'רומן' הוא פשוט, קל מגה-פלקס, לוקח כמה שבועות בלבד, לא דורשת כל בחירה לאנטיביוטיקה. לא נתבונן כל אובדן יעילות על ידי החדרת ברצף מחיקות על-ידי CRISPRs לתוך תא קו או iPSCs, למרות קריוטיפ ניתוח צרכים להתבצע במקרים כאלה כדי להבטיח יציבות גנומית. השיבוטים צריך להיבדק גם עבור הביטוי של סמנים pluripotency. למרות, לא מוקד פרסום זה, פרוטוקול זה יכול להיות שותף opted לזירוז מדויקת שינוי גנטי על ידי הכללת את תבנית תיקון תרביות תאים קוקטייל17,18.
לבסוף, על סמך הניסיון שלנו, הם שיקולים חשובים עבור iPSC עריכת פרוטוקול: תכנון רציונלי של מדריכים לצמצם או למנוע לגמרי את המטרה מוטציות במיוחד באזור"זרע" או קרוב מוטיב פאם והידועה; אופטימיזציה של היעילות nucleofection iPSCs על מנת להבטיח משלוח של RNPs; מאמת את האיכות של מדריכים מוכן; טיטור מדריך ואת ריכוז חלבון Cas9 אימות מבחני הפעילות שלהם על-ידי פצילות ביוכימי בתוך חוץ גופית או כפי שמתואר במאמר זה cellssuch אנושי כמו HEK תאים אשר קלים יותר תרבות ו transfect; שימוש iPSCs מעבר מוקדם זה נמצאים בשלב יומן של גדילה, הגעה confluency ~ 50%; טיפול זהיר של תאים בינונית עדינה משתנה בעקבות מיון תא יחיד כדי להבטיח את הישרדותם של תאים.
אנו מאמינים כי הפרוטוקול מחולקת לרמות מעל התחום בפירוט נאותה יצייד את הקוראים עם מפת דרכים כדי יצירת ועריכת iPSC אופנה לשחזור.
Disclosures
BT הוא חבר מייסד של לשפץ החיים בע מ
Acknowledgements
העבודה במעבדה נתמך על ידי מענק בתר Nandal ד ר דני פחימה, וגראנט גישוש קרן מחקר תאי הגזע מרילנד ל BT (TEDCO).
Materials
| Name | Company | Catalog Number | Comments |
| Sendai viral vectors - CytoTune-iPS 2.0 Kit | Invitrogen | A16517 | Thaw on ice; S No: 1 |
| Trypsin EDTA | Gibco Life Tech | 25300-054 | 0.05%, 100 ml; S No: 2 |
| Rock inhibitor (Y-27632) | Milipore | SCM075 | Use 10 μM; S No: 3 |
| DMEM/F-12 medium | Invitrogen | 11330-032 | S No: 4 |
| Serum replacement (KSR) | Gibco | 10828028 | S No: 5 |
| DMEM | Invitrogen | 11960069 | 1X; S No: 6 |
| Fetal bovine serum | Thermo Scientific | SH30071.03 | Aliquot; S No: 7 |
| L-glutamine (Glutamax, 100X), liquid | Thermo Scientific | 35050061 | 1/100; S No: 8 |
| Non-Essential Amino Acids | Gibco | 11140-050 | 1/100; S No: 9 |
| 2-Mercaptoethanol | Gibco | 21985023 | 55 mM, 1/1,000; S No: 10 |
| Hausser Hemacytometers | Hausser Scientific | 02-671-54 | S No: 11 |
| 0.1% Gelatin Solution | STEMCELL Technologies | 7903 | Incubate at 37º C for 1 hour; S No: 12 |
| SSEA-4 antibody | Santacruz | sc-21704 | 1/100; S No: 13 |
| TRA-1-81 antibody | Cell Signaling | 4745S | 1/200; S No: 14 |
| OCT4 antibody | Santa Cruz | sc-5279 | 1/1,000; S No: 15 |
| Collagen I, Rat Tail | Life Technologies | A10483-01 | Keep cold; S No: 16 |
| Alexa Fluor fluorescent 488/ 568 (secondary antibodies) | Invitrogen | A21202/A10042 | 1/2,000; S No: 17 |
| DPBS | Hyclone | SH30028LS | 1X; S No: 18 |
| 100-mm tissue culture dish | Falcon | 353003 | S No: 20 |
| 96-well tissue culture plate | Falcon | 353078 | S No: 21 |
| 6-well tissue culture plate | Falcon | 353046 | S No: 22 |
| Dissecting scope | Nikon | SMZ745 | S No: 23 |
| Picking hood | NuAire | NU-301 | S No: 24 |
| 15 ml Centrifuge Tube | Greiner Bio-One | 188271 | S No: 25 |
| 50 ml Centrifuge Tube | Greiner Bio-One | 227261 | S No: 26 |
| Sodium pyruvate | Invitrogen | 11360 | S No: 28 |
| β-mercaptoethanol | Sigma | M7522 | S No: 29 |
| Prigrow III medium | ABM | TM003 | S No: 31 |
| Countess™ Cell Counter | Invitrogen | C10227 | S No: 32 |
| Faxitron X-ray system | Faxitron | CellRad | S No: 33 |
| Accutase | Innovative cell Technologies | AT-104 | S No: 34 |
| Collagenase | Life Technologies | 17104019 | 1mg/ml stock; S No: 35 |
| Dispase | STEMCELL Technologies | 7923 | S No: 36 |
| hESC qualified matrigel | BD Biosciences | 354277 | To dilute, use cold DMEM/F-12; S No: 37 |
| bFGF | R & D | 233-FB | Stock 10 ug/ml; S No: 38 |
| Paraformaldehyde | EMS | 15710 | 4% stock in PBS; S No: 39 |
| TRA-1-60 | Santa Cruz | sc-21705 | 1/100; S No: 40 |
| NANOG | ReproCELL | RCAB0004P-F | 1/100; S No: 41 |
| Tween 20 | Sigma | P9416-100ML | S No: 42 |
| Alkaline Phosphatase kit | Stemgent | 00-0055 | S No: 43 |
| Cas9 protein | PNA Bio | CP01-50 | Thaw and aliquot; S No: 44 |
| Goat or donkey serum | Sigma | D9663/G9023 | S No: 45 |
| Triton X-100 | Sigma | X100-100ML | S No: 46 |
| DAPI | Thermo Scientific | D1306 | S No: 47 |
| Tris | Sigma | 9285-100ML | S No: 48 |
| NaCL | Sigma | S7653-250G | S No: 49 |
| EDTA | Sigma | BP2482-500 | S No: 50 |
| T4 DNA ligase | NEB | M0202T | S No: 51 |
| Mega Shortscript T7 kit | Thermo Scientific | AM1354 | S No: 52 |
| Mega Clear kit | Thermo Scientific | AM1908 | S No: 53 |
| SMC4 | BD Biosciences | 354357 | S No: 54 |
| Fibronectin | STEMCELL Technologies | 7159 | S No: 55 |
| CloneJET cloning kit | Thermo Scientific | K1232 | S No: 56 |
| Fragment analyzerTM | Advanced Analytical | S No: 57 | |
| mTeSR1 medium kit | STEMCELL Technologies | 5850 | Warm to room temperature; S No: 58 |
| Freezing medium mFreSR™ | STEMCELL Technologies | 5855 | S No: 59 |
| Freezing medium CryoStor® | STEMCELL Technologies | 7930 | S No: 60 |
| MEFs | Globalstem | GSC-6301G | S No: 61 |
| L-glutamine | Invitrogen | 25030081 | S No: 62 |
| Human pancreatic cells | ABM | T0159 | S No: 63 |
| STEMdiff™ Neural Induction Medium | Stemcell Technologies | 5835 | S No: 64 |
| RPMI | Thermofisher | 11875-093 | S No: 65 |
| 2% B27-insulin | Thermofisher | A1895601 | S No: 66 |
| CHIR99021 | Stemcell Technologies | 72052 | S No: 67 |
| IWP4 | Stemcell Technologies | 72552 | S No: 68 |
| 2% B27 | Thermofisher | 17504044 | S No: 69 |
| MCDB 131 | Life Technologies | 10372019 | S No: 70 |
| Sodium bicarbonate | Sigma-Aldrich | S8761-100ML | S No: 71 |
| Glucose | Sigma-Aldrich | G8270-100G | S No: 72 |
| BSA | Proliant | 68700 | S No: 73 |
| GDF8 | Pepro-Tech | 120-00 | S No: 74 |
| TUJ1 antibody | EMD Milipore | AB9354 | S No: 75 |
| NKX2-5 antibody | Santa Cruz | Sc-14033 | S No: 76 |
| SOX17 antibody | R & D systems | AF1924 | S No: 77 |
| Propidium iodide | Thermo Scientific | P3566 | S No: 78 |
| Amaxa 4D-nucleofector™ | Lonza | AAF-1002 | S No: 79 |
| FACSAria II (cell sorter) | BD biosciences | SORP UV | S No: 80 |
References
- Malik, N., Rao, M. S. A review of the methods for human iPSC derivation. Methods Mol. Biol. 997, 23-33 (2013).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Sommer, C. A., et al. Induced pluripotent stem cell generation using a single lentiviral stem cell cassette. Stem cells. 27, 543-549 (2009).
- Macarthur, C. C., et al. Generation of human-induced pluripotent stem cells by a nonintegrating RNA Sendai virus vector in feeder-free or xeno-free conditions. Stem cells Int. , 564612(2012).
- Li, H. O., et al. A cytoplasmic RNA vector derived from nontransmissible Sendai virus with efficient gene transfer and expression. J Virol. 74, 6564-6569 (2000).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc. Jpn. Acad. Ser. B, PhysBiol. Sci. 85, 348-362 (2009).
- Nakagawa, M., et al. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci. Rep. 4, 3594(2014).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell stem cell. 18, 573-586 (2016).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 169, 559(2017).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 168, 20-36 (2017).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat. Biotech. 32, 347-355 (2014).
- McElroy, S. L., Reijo Pera, R. A. Preparation of mouse embryonic fibroblast feeder cells for human embryonic stem cell culture. CSH Protoc. 2008, (2008).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc. Natl. Acad. Sci. U.S.A. 109, E1848-E1857 (2012).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotech. 32, 1121-1133 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology: a decade of progress. Nat. Rev. Drug Discov. 16, 115-130 (2017).
- Wang, B., et al. Highly efficient CRISPR/HDR-mediated knock-in for mouse embryonic stem cells and zygotes. BioTechniques. 59, (2015).
- Liang, X., Potter, J., Kumar, S., Ravinder, N., Chesnut, J. D. Enhanced CRISPR/Cas9-mediated precise genome editing by improved design and delivery of gRNA, Cas9 nuclease, and donor DNA. J Biotech. 241, 136-146 (2017).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved