Method Article
効率的な生成および CRISPR Cas9 システムを用いた人間の膵臓細胞から Ips をフィーダー フリーの編集
要約
これは修正の CRISPR/Cas9 ribonucleoproteins を用いた編集が続いてプロトコル記述フィーダー無料条件で人間の膵臓の細胞からフット プリント無料誘導多能性幹細胞 (Ips) の世代を詳細単一細胞のクローンを作成します。
要約
胚性人工多能性幹細胞は自己更新でき、体の種類の細胞に分化します。多能性細胞は再生医療の研究のためこのように切望され、眼疾患、糖尿病、心臓病や他の疾患の臨床試験は、現在。ゲノム編集 CRISPR/Cas システムを含む技術の最近の進歩と相まって種類の専門にされた細胞に区別するために潜在的な様々 なアプリケーションの iPSC のゲノムを仕立ての追加の機会を提供しています。疾患モデル、遺伝子治療を含む、いくつかの名前への分化の経路をバイアスします。利用可能な編集技術の中で化膿連鎖球菌から CRISPR/Cas9 は、真核生物のゲノムのサイト固有の編集に最適なツールとして浮上しています。CRISPRs は、簡単にアクセスでき、安価で、ターゲットを絞った編集工学で非常に効率的です。Cas9 ヌクレアーゼとガイド シーケンス (20 mer) の 3 塩基"NGG"protospacer-隣接する-モチーフ (PAM) 普遍的な Cas9 バインド トレーサー RNA (と一緒に目的の genomic 位置に Cas9 をターゲットに隣接しているゲノムのターゲットに特定システムが必要です。一緒に呼ばれる 1 つのガイド RNA または sgRNA)。ここで提案するステップバイ ステップのフィーダーに依存しない、フット プリント無料 iPSC の効率的な生成のためのプロトコルし、iPSC Cas9 リボ核タンパク質 (RNP) 錯体を用いたゲノム編集の方法論を記述します。ゲノムのプロトコルを編集、効果的な Cas9 蛋白質と細胞に同時に提供する 1 つ以上のターゲットの前錯化 sgRNAs で簡単に多重化できます。最後に、必要な編集と Ips の同定と解析のためのシンプルなアプローチについて述べる。一緒に取られて、輪郭を描かれた戦略は、世代とマニホールド用 iPSC の編集を効率化する予定です。
概要
初期化因子の過剰発現による多能性の状態に人間の体細胞のリプログラミング病モデル ・再生医療・新薬開発のアプリケーションで幹細胞研究をもたらしました。いくつかの非ウイルス性リプログラミング手法は初期化因子の Ips を生成配信に利用できるが、プロセスは労働集約的な非常に効率的ではありません1。ウイルスの方法が効率的なウイルスの統合および腫瘍2,3,4の問題に関連付けられます。本稿では、初期化因子の彼らのゲノムの5に、ウイルスのベクトル シーケンスの統合が欠如してフット プリント無料 iPSC ラインの確立を提供する細胞質のセンダイ ウイルスの使用を報告します。センダイ ウイルスは RNA ウイルス感染後細胞細胞質 〜 10 通路を希薄化は、迅速かつ効率的な6、7のリプログラミングにつながる豊富に初期化因子を生成です。確立された Ips は、8フィーダー細胞としてマウス萌芽期の繊維芽細胞 (MEFs) の使用を避けるために送り装置自由な媒体に容易に移行することができます。
リプログラミング、センダイ ウイルス媒介のアウトラインだけでなく、文書内 Ips 研究に必要な遺伝的変更と無制限のひと細胞を供給する可能性を秘めているを編集するための改良されたプロトコルについて述べる。Ips は、プールされたライブラリの遺伝子工学、遺伝子発見のスクリーニング、大規模なゲノム削除、ノックアウト ノック アドインを含むアプリケーションの広い範囲が使用されている現在の変更の CRISPR/Cas9 技術を使用しています。多数のモデル生物と遺伝子療法9,10,11。この技法が化膿連鎖球菌の複合体の形成-派生 Cas9 ヌクレアーゼと 20 mer ガイド Rna 3' 隣接塩基配列 protospacer に隣接するゲノムのターゲット シーケンスと基本ペアリングを介してターゲット認識を達成します。モチーフ (PAM) のシーケンス。Cas9 ヌクレアーゼを二重鎖休憩 〜 3 ヌクレオチド非相同末端結合 (NHEJ) 経路を挿入または開いたリーディング ・ フレームの削除につながるによって主にその後修理されそれにより機能は、PAM のサイトから誘導します。12遺伝子のノックアウト。
私たちの改善されたプロトコルはヒト膵細胞の文化の詳細、マウス萌芽期の繊維芽細胞 (MEFs) リプログラミング、フィーダー フリー培養へのそれに続く適応の高効率化を達成するために、有糸分裂でリプログラミング不活化マトリゲル、確立された Ips の特性に CRISPR ガイド RNA の設計、準備、RNP 複合体、編集した Ips のクローンのラインを生成する単一のセルの並べ替え、簡単審査、編集の同定と解析として Ips に配信単一細胞のクローンを作成します。ゲノム削除は Cas9 蛋白質と二重鎖切断 (Dsb) を誘発する 2 つ CRISPR sgRNA RNP 複合体の導入によって、本研究では効率的に生成され、セグメントの介在の削除。このメソッドは開いたリーディング ・ フレームの削除を生成するための 2 つのガイドの使用を活用、高効率の低い数字につながる NHEJ の自動キャピラリーによって特徴付けられる必要、クローンの簡単な事前審査のクローンを作成電気泳動装置、フラグメント アナライザー。これらの効果的なゲノムのひと幹細胞を用いた疾患モデルを生成するメソッドの編集は、幹細胞の研究室で標準的なルーチンのアプローチにすぐになります。最後に、正確なゲノム編集幹細胞病モデルを超えて移動することが可能になるし、潜在的触媒作用で細胞ベースの治療を助けることができます。
プロトコル
1 プロトコルのリプログラミング
- 主な膵細胞から人間の iPSC の世代
- コート 6 ウェル 1.5 mg/mL 冷たいコラーゲン入りプレートと 37 ° C 1 時間でゲルを許可 。
- プレート Prigrow III 培地 (1 〜 1.5 × 10 5 セル) コラーゲンひと膵臓細胞被覆 6 ウェル プレートの日-2 約 2.5 × 10 5 セルまたは少なくとも 60% を達成するために早期の成立の日にもあたり合流伝達 (0 日目)。最初の調査では、0 日目に目的の confluency と 1 つの井戸を得るため、少なくとも 2-3 井戸をプレートします。セルの個数をコントロールとして、少なくとも 1 つの井戸を使用します 。
- 伝達 (0 日目) の日、暖かい Prigrow III に導入される各ウェルの水浴中の 1 mL。1 mL の 10 %fbs 培地 1 mL のトリプシン/EDTA を用いた 5 分で 1 つのコントロールからセルを収穫またはセルをセルの数を数えるためにデタッチまで。10 %fbs 媒体をするためには、DMEM、10% を追加売却、1 %l-グルタミン, 1% ピルビン酸ナトリウム、1% の非本質的なアミノ酸 。
- カウントし細胞カウンターを使用して細胞の生存率をチェックし、ウイルスごとにセル数、ウイルス抗体価に基づく目標を達成するために必要な量を計算します。コスの感染 (MOI) の多様性を使用して = 5、hc Myc = 5 と hKlf4 = 膵細胞の 3.
- 仙台の雪解け 1 セット氷上-80 ° C のストレージ管をベクトルし、Prigrow III 培地 1 mL に 3 つの仙台ベクトル チューブのそれぞれの計算されたボリュームを慎重に追加加温 37 ° C. ピペット優しくソリューションをミックスします。6 ウェル プレートの 1 つの井戸は十分にプログラムし直されたセルを生成する仙台のウイルスのベクトルを伝達します 。
- は細胞から Prigrow III 培地を吸引し、ゆっくりとセルを含む井戸にリプログラミングのウイルスの混合物を追加します。5% CO 2 の加湿雰囲気と 37 ° C のインキュベーターで一晩細胞をインキュベートします 。
- は慎重に細胞にウイルスの混合物を破棄、翌日、伝達後 24 h Prigrow III 培に置き換えます。5 d の細胞の培養し、代替毎日媒体を変更します 。
- 5 日 0.1% ゼラチン プレコート 10 cm 文化皿 (1.3 × 10 6 セル/皿) で MEFs を準備します。MEFs T175 フラスコ 4 日目までに成長し、5 日に播種細胞 13 または商業の MEF のソースを使用する前に γ 線源から 6,000 ラドに細胞を公開します 。
- 6 日細胞剥離液の 1 mL を 10 分間導入された細胞をデタッチし、rock 阻害剤 (5 mM の在庫、最後の 10 μ M) で中 Prigrow III MEF 皿にそれらのすべてをプレート、加湿 atmosphe で 37 ° C のインキュベーターで一晩インキュベートを使用5% CO 2 の日時 。
- は、Prigrow III 媒体 [hESC 中] に変更すると、次の日。作るために悪名高く媒体の 500 mL、5 ng/mL bFGF; 20% (v/v) ノックアウト血清交換 (KOSR)、DMEM/F-12 を追加します。1 mM l-グルタミン;100 μ M の非必須アミノ酸と 100 μ M 2-メルカプトエタノール。今も毎日優しく媒体を変更します 。
- は、リプログラミング細胞を示す細胞の塊やコロニーの出現のために定期的にプレートを観察します。変換されたセルは、石畳の形態と大きな核小体とクローンの集合体を形成します。可能性をマーク ' iPSC ' 植民地と成長を定期的に確認します 。
- 伝達後ほぼ 4 週間のコロニーは狩りや転送の準備ができて、24 ウェルプレート MEF シングル コロニーの転送のために前に 10 6 セル/ゼラチン プレコート板 x 1.3 をメッキすることによって準備します。
- 準備マトリックス膜 (例えば マトリゲル) 分析の証明書の希釈係数に基づくそれ早かった。4 6 ウェル プレート (1 mL/ウェル) と部屋の温度 (RT) で使用する前に少なくとも 1 時間インキュベートのコートに DMEM/F-12 25 mL に 1 つの因数を追加します。手動でそれらを吸引、悪名高く媒体の 500 μ L の MEF プレートに転送する滅菌ピペット チップを使用して 12-24 コロニーを拾う 。
- は、優しくを破壊または植民地を分割するよくメディアを吸い出しなさい。またマトリックス膜 24 ウェル プレート 24 48 コロニーを拾います。コーティング膜プレート (10 μ M rock 阻害剤を添加した) mTeSR1 を使用して、24 時間、毎日を変更します。コロニーを拾うの 6-10 d、内彼らはクローン性増殖の新しい 24 ウェル/12 よく膜プレートに転送する準備ができている 。
- 必要な MEFs 1 mg/mL コラゲナーゼを使用して 20 分のためのコロニーを分離する場合、洗浄 2 回 hESC/mTeSR1 と膜への転送 12 または 24 ウェル プレートをコーティングします。1.1. 12 のステップからマトリックス膜で育っている十分な堅牢なコロニーが存在する場合、凍結 MEFs iPSC 製造業者に従ってメディアを凍結を使用しての植民地 ' s ガイドライン 。
- は当期の 500 μ L を使用して 20 分間 1.1. 12 の手順で膜メッキ堅牢なコロニーを外し、プレート再びマトリックス膜コーティング 12 ウェルのプレート。手動で任意の分化した細胞や多能性の膜にクローンを豊かにする汚染 MEF の送り装置セルをこすりです 。
- は、膜の成長によって 6-8 d は前に、当期ソリューションとしての解離によって板をコーティングし、新鮮な膜に小さな細胞の集塊をメッキ コーティング 6 または 12 ウェル プレート後にクローンを展開します。MTeSR1 中毎日を変更します。アルカリホスファターゼ染色、染色の多能性表面マーカーと分化アッセイ多能性マーカー (OCT3/4、NANOG) FACS 解析によってプログラムし直されたクローンを特徴付けます。成長し、膜コーティング プレート CRISPR 編集他のコーティング液は特に記載しない限り、上記を含むすべての試金のためのクローンを培養します 。
- 特性の人間 Ips
- アルカリホスファターゼ染色
注: ここで市販のキットを使用します。材料表を参照してください。- 毎日メディア変更で 24 ウェル プレートと 4 5 d の文化と推定される人間 Ips をプレートします 。
- 染色プロトコルを起動し、培養培地を吸引洗浄 1 ml 0.05 %1 × PBS のセル トゥイーン 20 (pbst;).
- 修正液 0.5 mL を加えて細胞キット 2 に 5 分吸引修正プログラム ソリューション RT でインキュベートし、PBST と固定セルを洗います。乾燥する井戸はできません 。
- ソリューション A、B および c. 加温 (ラップ箔または暗いコンテナー) 5 に 15 分の室温で暗闇の中で細胞を混合することによってウェルあたりの作りたての AP 基板溶液 0.5 mL を追加
注: は密接に色の変更を監視し、反作用を停止し非特異的染色避けるために明るい色を回すとき 。
- AP 基板ソリューションを吸引し、2 mL の 1x PBS で 2 回井戸を洗浄によって反作用を停止します 。
- 顕微鏡下でコロニーを観察し、4 X または明視野顕微鏡を用いたカメラ 10 倍の倍率で画像をキャプチャします 。
- 免疫染色
- 毎日メディア変更で 24 ウェル プレートと 4 5 d の文化の人間の Ips をプレートします 。
- 洗浄セルを一度簡単に PBS と PBS で 4% パラホルムアルデヒド (PFA) と 20 分のための修正プログラム 。
- 室温 PBS で 10 分 (3 x, 10 分) 3 回洗浄 10% 通常ヤギやロバ血清 (で育った動物の二次抗体によって、NS) PBS で室温 40 分
- 飽和非固有のサイト細胞エピトープのみ 0.3% を含む PBS (TX/PBS) permeabilize でテキサス州 100 。
- 3 x 5 分室温 PBS で洗浄
- 5% の新鮮なソリューションで OCT4、NANOG、TUJ1、NKX2 5、SOX17 抗体を希釈 PBS で NS、2 h 4 RT または一晩インキュベート ° C
- PBS は室温で 5 分間 3 x を洗う
- 適切なセカンダリ Alexa Fluor 488 または 5 %568 抗体を希釈 NS/PBS セル室温 1 時間孵化させなさいと
- 3 x ルートで 5 分間を洗う
- は 1 の PBS の DAPI と孵化します。0 分と洗浄した使用蛍光顕微鏡写真を撮るための 5 分の 2 倍です 。
- 蛍光活性化セルの並べ替え (FACS)
- プレート 6 ウェル プレートと植民地まで文化人間 Ips になる 80% 合流 (少なくとも 10 5 セル/sample) 毎日 mTeSR1 中変更します 。
- 実験の日、セルを隔離し、プロトコルでは上記のように単一細胞懸濁液に分離します。10 %fbs 媒体洗浄 。
- 表面マーカーは、0.5-1 で再懸濁します 10 %fbs 媒体や氷の mL
- 4 %1 mL で再懸濁します細胞マーカーの PFA/PBS と室温で 10 分間インキュベートします。10 %fbs 媒体で洗ってください。0.1% で再懸濁しますテキサス州/PBS と氷で 15 分間インキュベートします。10 %fbs 媒体で再度洗ってください。0.5-1 で再懸濁します 10 %fbs 媒体や氷の mL
- 追加 50 μ L の 10 %fbs 含む 50 μ L に細胞懸濁液のトラ-1-60、トラ 1 81 または SSEA 4 抗体の量をお勧めし、1 h に 30 分間インキュベート
- 10% で二回洗う FBS 。
- FBS 培蛍光二次抗体 100 μ L の 10% で再懸濁し、インキュベートする 30 分洗浄 10 %fbs と 10% の適切なボリュームで再懸濁しますで二回 FBS。生きているセルに追加 propidium ヨウ化色素によって死んだ細胞から区別できます < プロセス中に細胞のアポトーシスを推定する 1 μ G/ml 。
- トライ系統分化
- 1.5 - 2 x 10 6 Ips/井戸 10 μ M rock 阻害剤と mTeSR1 培地で 2 つの 6 ウェル プレートをシードします 。
- の細胞は成長する中型の変更を毎日 mTeSR1 と 2-3 d の井戸は 80-90% まで合流 。
- 外胚葉誘導のため、メーカーによると神経誘導培地 (NIM) を追加 ' 6 ウェル プレートの 2-3 井戸の指示 。
- RPMI インスリン マイナス 2 %b27 サプリメントと 12 μ M を含む媒体を変更プレート 14 の 2-3 井戸における中胚葉誘導のための CHIR99021。次の 24 時間追加 5 μ M のインスリン マイナス 2 %b27 サプリメントを含む追加だけ RPMI 2% B27 RPMI 培地に IWP4 を次の 24 時間のためにインスリンを引いた補足します。2-3 d で心筋細胞を破っての世代につながる 2 %b27 サプリメントを含む RPMI でメディアを交換して 72 時間後
- 内胚葉誘導変更 MCDB 131 重炭酸ナトリウム 1.5 g/L、Glutamax、10 mM グルコース、0.5 %bsa、100 ng/mL、GDF8、24 時間 CHIR99021 なし同じ培地で文化の CHIR99021 の 5 μ m × 1 で補完する 6 ウェル プレートの井戸の中2-3 d 15 。
- 手順 2 すべての 3 つの系統から免疫染色プロトコルに従うし、関連するマーカーの発現を確認してください 。
- アルカリホスファターゼ染色
2。ゲノム人間の編集 iPSC 使用 CRISPR Cas9
- 準備の Cas9 タンパク質と sgRNA
- 無菌状態で遠心チューブに分注 Cas9 蛋白質-80 で管を凍結試料を保存と ° C
- をターゲットに MIT (http://www.genome-engineering.org/crispr/) からソフトウェアまたは任意他の CRISPR ガイド設計 webtool に基づいて per 遺伝子 Rna ガイド 2 デザインします。(開いたリーディング ・ フレームに基づく) 遺伝子の最初または 2 番目のエクソンをノックアウトを生成するターゲットします。彼らはすぐ一緒にカットして、2 つのガイドを選択 (30 ~ 100 bp 離れて) およびプライマーのスクリーニングの同じセットを使用して削除を簡単に視覚化できます。品質スコアが高いと低いオフのターゲット サイト数に基づいてソフトウェアの出力からガイドを選択します。スクリーニング プログラム プライマー爆発 (https://www.ncbi.nlm.nih.gov/tools/primer-blast/) を使用してプライマー デザイン。少なくとも 100 プライマーをスクリーニングする必要がありますサイトで切り取って、PCR の製品のサイズは、PCR によって容易に拡大の 400-700 bp の間が望ましい、Cas9 から bp 。
- は、2 つの相補的な sgRNA オリゴ Dna (ガイド シーケンスに応じて長さの 19-22 ヌクレオチド) Bsa1 の両端にサイトをカットとデザインします。オリゴ Dna は商業的に合成でき、二本鎖 DNA を形成する熱処理します。焼鈍、追加 100 μ M ガイドの 1 μ、25 μ L のアニーリング バッファー (10 mM トリス、pH7.5 8.0 50 mM NaCl、1 mM EDTA) と水の 23 μ L。2 分とし、徐々 に 25 ° C 以上 45 分に冷却のための 95 ° C で開始するようにプログラムたちで孵化させなさい
- クローン Bsa1 制限の酵素に結果のフラグメントの 2 μ L 消化社内 T7 プロモーター pCR2.1 ベクトルの 1 μ L 製造業者に従って T4 DNA リガーゼを使って Cas9 結合部位 ' s プロトコル 。
- クローンとして作られた DNA のフラグメントのシーケンスし、体外 T7 キットを使用して単一ガイド Rna を生成するクローンを転写の忠実度を確立すると。市販キットと sgRNAs を浄化し、RNase フリーの水に溶出します。RNA 濃度を確認してください 。
- HiPSCs の
- セルが 40-50% の合流になるまで上記のように mTeSR1 中 hiPSCs を文化します 。
- Nucleofection の前に 2 時間は 10 μ M rock 阻害剤を含む prewarmed mTeSR1 培地 2 mL に媒体を交換します 。
- 1 時間後、吸引膜、12 ウェル プレートから上記のように、準備し、prewarmed 1 ml の 10 μ M rock 阻害剤 mTeSR1 媒体の交換による nucleofected 細胞の先の井戸を準備します。インキュベーションの 37 ° C で維持します 。
- P3 一次電池の 16.4 μ L 追加で各サンプルの準備 nucleofection マスター ミックス (サンプルに応じて適切なスケール) 補足; nucleofector キット; Cas9 蛋白質の 0.5 μ g から 1 の補足の 3.6 μ L、各 sgRNA の 0.5 μ gで 22 μ L 反応体積/。pMAX GFP ベクトルはまた製造業者に従って nucleofected ' iPSC トランスフェクションの効率を概算する細胞における推奨値 。
- は、それぞれ洗って iPSC 井戸から rock 阻害剤を含む培地を吸引後 RT PBS の 2 mL でも。PBS を吸引し、細胞剥離液の 1 mL を追加し、37 ° C で 10 分間でプレートを孵化させなさい
- は、mTeSR1 培地 3 mL に細胞を再懸濁します、優しく上下に単一細胞懸濁液を生成するピペットします。転送解離細胞 15 mL 遠心チューブ含む 5 mL mTeSR1 中です 。
- 細胞カウンター付きのセルをカウントし、0.5 × 10 6 セル/導入に必要な容量を計算します。15 mL 遠心管に必要な数量のセルを配置、常温 5 分間 200 x g で遠心し、上清を吸引します 。
- は、手順 4 で準備トランスフェクション マスター ミックスの 22 μ L の 10 の 6 セル × 0.5 の各ユニットを再懸濁します。Nucleocuvette ストリップの 1 つの井戸の中央の部屋にセルをすばやく転送します。CB150 プログラムを使用して nucleofector デバイスおよび nucleofect 細胞にストリップを配置します 。
- Nucleofection 後、prewarmed mTESR1 培 nucleofected 細胞の各ウェルに 10 μ M の rock 阻害剤の 80 μ L をすばやく追加します。優しく上下にピペッティングしてミックスします 。
- 優しくストリップから手順 3 で準備 rock 阻害剤の mTeSR1 媒体を含んでいる膜塗装 12 ウェル プレートの井戸にセルを転送します 。
- 後 1 d は、rock 阻害剤なしの新鮮な mTeSR1 の中に変更します。収穫 nucleofection 単一細胞選別の後の 2-3 d のセルします 。
- 対象 hiPSCs の単一細胞分離
- 並べ替え、前日は 10 %fbs 中 2 x 10 6 セル/ゼラチン コーティング プレートを播くことによって 96 ウェルプレート MEF を準備します。クローンの約 70-80% が nucleofection 後生き残るし、各編集実験 2-3 MEF のプレートを準備できます 。
- 100 を添加した hESC 媒体 (前述) に媒体を変更次の一晩インキュベート ng/1 mL bFGF x SMC4 (単一の細胞生存率を高めるためにメディアに追加阻害剤) との接着を促進するために 5 mg/mL フィブロネクチン 。
- 1 mTeSR1 培に mTeSR1 から 12 ウェル プレートで hiPSCs の媒体を置き換える単一のセルを並べ替える前に少なくとも 2 時間の x SMC4 です 。
- は、hiPSCs から培地を吸引し、PBS で軽くセルを洗ってください。各ウェルの細胞剥離液 500 μ L を追加し、PBS を吸引後 10 分の 37 ° C で孵化させなさい。単一細胞懸濁液を各ウェルに mTeSR1 (何) の 1 つの mL を追加し、ピペッティング上下に軽く数回生成します 。
- 15 mL の円錐管で吸引した上澄みで 200 x g で 5 分間遠心分離細胞懸濁液を置き、mTeSR1 の 1 mL の細胞を再懸濁します 。
- ステップ 1 で準備 96 ウェル プレートの個々 のも 1 つのセルに無菌条件下で 100 mm ノズル、セルソーターを用いた単一細胞内のセルを並べ替えします 。
- 4 日後、コロニー形成を明らかにする必要があります 1 hESC 培培に置き換えるこの時点で x SMC4 です 。
- 8 日後、hESC 媒体と 2 の文化媒体を交換して d.
- は 20 分の 1 mg/mL コラゲナーゼを使用してコロニーを外し、rock 阻害剤の mTeSR1 で膜 24 ウェル プレートに転送しています。単一細胞のクローン成長し、複製またはそれらを拡大後、ゲノム DNA を抽出しなさいターゲット PCR によって DNA を増幅する遺伝子特異的プライマーを使用します 。
- ゲル/色素を介してそれらを実行して、すべてのクローンの PCR 増幅ターゲット ゲノム領域の最初のスクリーニングのフラグメント アナライザー キット ミックス製造業者に従って ' の指示。サンプルの実行は、適切な梯子と比較してソフトウェア PROSize で結果のフラグメント サイズを見積もります。予想されるシーケンス ' 編集 ' のクローンを作成、削除または編集内容の確認シーケンス データを分析します 。
- エピジェネティックとシュミレーションのクローンを区別する PCR pJET1.2 ベクトルでクローンと編集したシーケンスを増幅します。配列のための少なくとも 8 10 クローンを送信し、1 つまたは両方の対立遺伝子の編集を確認するシーケンスを確認します 。
- 正常にターゲットを絞った iPSC クローン遺伝子多型を特定したら、持っていない多能性を失ったまたはプロセスで染色体異常を得たことを確認する確認します 。
結果
この文書の統合またはフット プリント無料仙台のウイルスのベクトルを使用して人間の膵臓の細胞から iPSC の世代のシンプルで効率的なプロトコルを続いている我々。図 1 aは、この初期化プロトコルの概略を示しています。人間の膵臓の細胞は、Prigrow III 培地中で培養し、上述のセンダイ ウイルスで導入した商業的に、購入しました。導入された紡錘形膵細胞 〜 5 日日 0、センダイウイルスベクター伝達後の任意の形態学的変化を示さなかったが、大きな核小体と切り上げになります。週後伝達後見られたいくつかの初期のコロニーがいない、我々 の経験のように選ばれ、これらの植民地はすぐに切り離して、'初期部分的にプログラムし直されたセル' は、通常それは堅牢なコロニーを確立しないでください。約 10 〜 15 日後伝達、小さい明るいコロニーが観察され、成長 (右上図 1 b, ) の後で選ばれました。人間 iPSC のコロニーはコンパクトで、明確なエッジ ('完全にプログラムし直された細胞' と見なされる) を呈して (図 1 b, 23 日中央下)「部分的にプログラムし直された細胞」は植民地 (図 1 b,のギャップに緩いと23 日目右下)。プログラムし直された膵細胞群れ体 (図 1 b、左下) 18 日目にはだんだんと日 23 (図 1 b,下部中央) が手動で選択するのに十分な大きさでした。植民地は日 30-40 (左図 2 a, ) によってフィーダー無料 iPSC を取得するを選択した後膜コーティング プレートにメッキされました。これらの '堅牢な' 無料のフィーダーの植民地のいくつかは拡大し、アルカリ性ホスファターゼ、多能性、フィーダー無料条件の表面マーカーの発現の特徴とされました。テストのすべてのクローン分析 (図 2 a,右) 後真っ赤になって彼らとアルカリ性ホスファターゼ陽性であった。TRA-1-81、TRA-1-60 SSEA4 NANOG OCT4 多能性マーカーも免疫染色または FACS 解析 (図 2 b 図 3 a) によってすべてのクローンで高い表現観察。
これらの結果は、膵臓の細胞から生成される人間の iPSC コロニーがフィーダー無料条件で多能性マーカーを表現を示しています。多能性を人間の iPSC に 3 つの胚葉の分化によって評価した: 外胚葉、中胚葉、内胚葉。膜上のクローンは、強力 TUJ1 陽性ニューロン (外胚葉)、NKX2 5 陽性拍動心筋細胞 (中胚葉)、SOX17 陽性内皮細胞 (図 3 b) に区別されます。
徹底評価後 3 堅牢なフィーダー無料 iPSC 系統は、ゲノム研究を編集のため選ばれました。両端カット サイトは各遺伝子すぐ一緒にカットするために設計された BsaI を持つ 2 つのガイド (すなわち n未満 〜 100 bp)。プロトコルの概略図を図 4に示します。この削除戦略は用ができましたターゲット遺伝子、遺伝子の最初または 2 番目のエクソンの一部を簡単に削除するにはこの戦略は、非常に効率的だったし、すべての試みで編集されたクローンを分離できれば。ガイドは、消化 BsaI ベクトルとの in vitro転写前述のように複製しました。私たちの nucleofected ガイド (Rna) と迅速かつ効果的な編集の RNP 複合体として Cas9 タンパク質。MEFs 上の単一のセルとセルを並べ替えられても細胞の回復は細胞膜コーティング プレートで単独でソートと比較して高くなっています。ゲノム DNA はすべてのクローンから分離された、ターゲットの部分は PCR によって増幅されコントロールに比べてターゲット フラグメントのサイズの変更、画面をフラグメント解析で解決。フラグメント サイズは、'編集' クローン (下の図 4, ) を検出するためのサンプル実行はしごと比較しました。これ容易に作ったクローンのスクリーニングを進めることができる > ± 3 bp の精度で 1 つのプレートと結果 90 クローンが得られました。選択されたクローン、野生型と変異クローンを確認されました。野生型のクローンがなかった拠点の追加や削除変異クローン、野生型と比較してシーケンスで追加または削除のいずれかを持っていた。シーケンスの削除または追加を表示するクローンはクローン当たり少なくとも 8-10 植民地の配列によるエピジェネティックとシュミレーションのクローンを識別するために拡大しにクローンとして作られた pJET1.2 ベクトル.エピジェネティック クローンいた基地を削除または 1 つの対立遺伝子の追加し、他の不変および野生型対立遺伝子のようだった。シュミレーションのクローンは、両方の対立遺伝子の削除です。約 300 クローンは、すべてのターゲット遺伝子を約 9 エピジェネティック削除クローンおよび各場合 3 シュミレーション削除クローン識別のため上映されました。これは約 3 倍還元エピジェネティック クローンに比べてシュミレーション クローンの生成の周波数に対応します。削除 amplicons 内の不均一性は、不完全な矛盾の NHEJ 修理を反映されます。遺伝子の発現は標的細胞から RNA を抽出し、RT-PCR 法を実行することによって最終的に確認されました。

図 1: 無料のフィーダー多能性細胞 (iPSC) に人間の膵臓細胞のリプログラミングします。ヒト膵細胞から iPSC の世代の A (A) 回路図プロトコルが表示されます。膵臓の細胞は、コラーゲン コーティング プレートで栽培され、人間のセンダイ ウイルスのベクトルを用いた伝達後 MEFs に転送されます。完全に再植民地 hESC 修飾膜に転送され、特徴付けられます。センダイ ウイルス伝達後 (B) 形態に変更します。伝達、前に、膵臓の細胞は典型的なスピンドルのような形態 (左、0 日) を表示します。小さな、タイトな植民地は、12 日目でひと多能性細胞コロニーに似た MEFs に表示されます。通常完全にプログラムし直された人間 iPSC 植民地は非常に明確な境界を持っているし、日 23-30 によってピックアップすることができます。23 日目で解離のコロニーは、右下に表示されます。すべての画像は、100 倍の倍率 (10 倍の接眼レンズと対物レンズ 10 倍) で捕獲されました。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
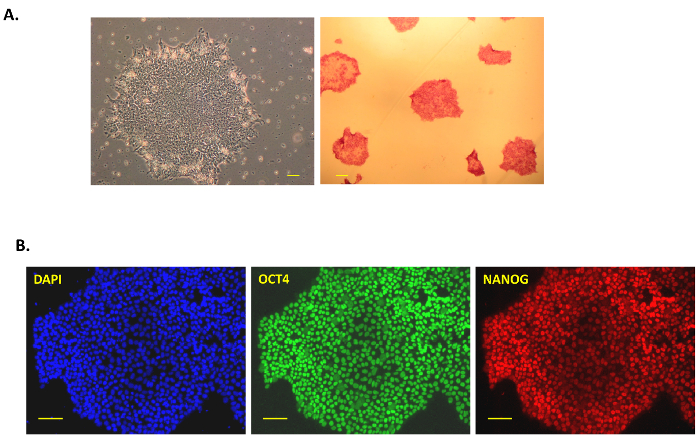
図 2: 人間の iPSC のキャラクタリゼーション。ピッキングとフィーダー無料条件で培養後 iPSC コロニーの (A) は典型的な位相コントラスト (40 X、4 X の目的および 10 X 接眼レンズ; 左) センダイ ウイルスの膵細胞のリプログラミング後。アルカリホスファターゼ赤 iPSC コロニーをステンド グラスは右側に。アルカリホスファターゼ染色 iPSC コロニーは修正され、キットの基板の解決の付加の後で赤を染色します。画像は、40 X で捕獲されました。多能性マーカー NANOG、(B) 免疫染色、OCT3/4 フィーダー無料人間の膵臓細胞由来の Ips で。DAPI は、コントロールとして青い核を染色に使用されました。すべての画像は、100 倍の倍率で撮影されました。スケール バーすべての画像で 100 μ m を =。この図の拡大版を表示するのにはここをクリックしてください。
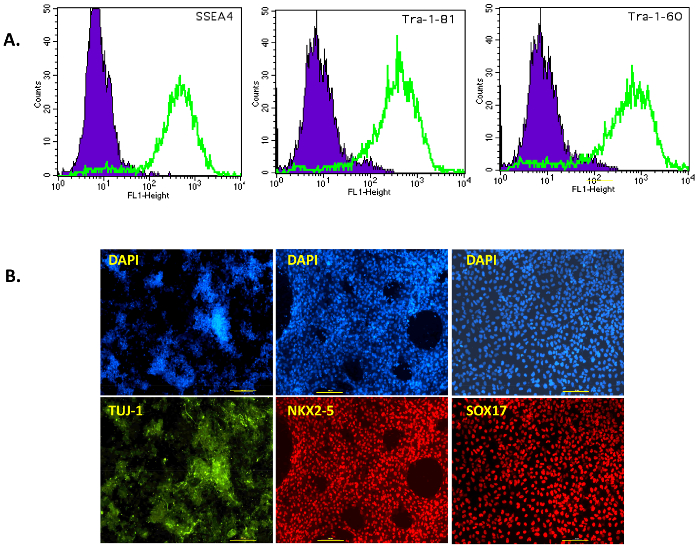
図 3: 多能性と分化の特性 iPSC の潜在的な。(A) FACS 解析フィーダー フリー Ips の表面マーカー SSEA4、トラ 1 60 および TRA-1-81。細胞が解離単一細胞懸濁液をトラ-1-81、TRA-1-60 SSEA 4 表面のマーカーの染色します。紫峰 iPSC 陰性 (抗体コントロール) 細胞と膵 iPSC は緑のピークとして視覚化することができます。(B) 細菌層マーカー遺伝子の蛍光イメージング。後膵 iPSC の分化マーカー TUJ1 外胚葉 (緑)、NKX2 5 中胚葉 (赤) および細胞 SOX17 内胚葉 (赤) の式です。対応する制御核染色 DAPI は青色です。すべての画像は、100 倍の倍率で撮影されました。スケール バー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 4: CRISPR/Cas9 削除戦略の概略図。1 つの sgRNA のペアは設計 (マーク赤) 端 (F と R として表示) 好ましくでサイトを切った最初のエクソンをターゲット熱処理した BsaI で消化 BsaI 変更されたベクトル (pCR2.1、BsaI サイト ハイライト グレー), シーケンスの複製し、の in vitro翻訳します。ベクトルの下線付きのシーケンスは BsaI 消化後削除された部分を示します。プライマーのスクリーニングの位置は青で示されます。Cas9 とガイド Rna ゲノムを削除するための複合体として nucleofected、iPSC のフィーダー無料します。Ips は当時 96 ウェル MEF プレート、培養、に基づいて並べ替えられて単一のセル膜に転送、拡大、フラグメント アナライザーによって上映します。アナライザーでサンプルを実行する、ため Cas9 ゲノム Dna と膜上の導入ガイドのクローンが抽出され、アナライザーの潜在的な '編集' クローン (下部中央) を選択するにゲル ・染料混合物を通過しました。関連するラダー マーカー、WT と潜在的な編集したクローンがマークされます。遺伝子の発現は、RNA を抽出し、Q PCR による分析によって確認されました。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
Ips にひと体細胞のリプログラミングは基礎生物学研究、個別化医療、疾患モデル作製、医薬品開発、再生医療16の分野に大きな後押しを提供しています。人間 iPSC 世代の多くの現在、広く使用されている方法、ウイルスが宿主ゲノムに統合のリスクを使用するまたは episomal ベクトルの低効率をプログラムし直します。センダイ ウイルス、'無料フット プリント' や効率的なリプログラミングにつながるヒト膵細胞から Ips のフィーダー フリーを生成するための効率的な方法を紹介します。結果人間 Ips、ウイルス遺伝子の自由、多能性を維持し、不明な外因性の要因の使用を避けます。フィーダー無料条件で Ips の世代は、フィーダー細胞の主な膵細胞を再プログラムし、フィーダー無料膜拡大、文化そして性格描写のために植民地を移動にリプログラミング効率が低い。これらの技術の融合では、安定した、信頼性の高いより効率的な iPSC のプログラミングを提供しています。
線維芽細胞および他の主細胞から Ips を生成されますもこの方法で、さまざまな細胞を再プログラムするセンダイ ウイルスを使用ことができることを示唆しています。重要な考慮事項です: 一次電池の最適密度のリプログラミング効率数が少なすぎる、またはあまりにも多くの細胞影響として再プログラムする必要性一次電池セルは分割まだ最適; するときの以前の通路ウイルスの慎重な滴定ベクトルの最小細胞のアポトーシスの結果と簡単な堅牢なコロニーのピックアップにつながる高効率仙台ベクターによる遺伝子発現 PCR、Ips が 'フット プリント無料' であることを確認する 10-15 通路での損失の確認そして、膜上 iPSC の文化に厳しい滅菌条件。
IPSC ゲノムの編集に CRISPR ゲノム修正の便利で効率的なメソッドを使いました。この手法を組み合わせた Cas9 タンパク質と sgRNA、RNP 複合体を認識し、相補的な dna を切断します。それは 20 bp ガイド RNA を単に変えることによってゲノム配列をターゲットに容易に適応することができます。本手法は、効率的な彼らはより手間がかかり、ヘッジホッグ、困難、人間 Ips の編集再現性とその他の細胞よりも維持するために高価なのため簡単なプロトコルを提供します。我々 は、編集済みのクローンをスクリーニングするためのプライマーのスクリーニングの単一のセットを使用ことができます各ターゲット遺伝子の少なくとも 2 つの隣接するが、非重複ガイドをデザインします。さらに、離れて 2 つのガイド 〜 30 100 bp の使用は、事前審査時に簡単に視覚化できるタンパク質の枯渇を保証し大規模な削除を生成します。ガイドは、当初 iPSC で分析を開始する前に効率を推定する HEK 293 細胞でテストできます。また、iPSC に試薬のルーチン transfection のためのパラメーターを確立する重要です。トランスフェクションの効率の pMAXGFP プラスミドを用いた > 80% と Ips の 3-10% の遺伝子ターゲティング/破壊効率を日常的に達成。我々 のプロトコルのセルに Cas9 RNP 複合体の直接配信は、迅速な行動、高速回転を提供し、ターゲット変更の率が高いを維持します。私たちアプローチ採用単一細胞選別ガイドと Cas9 蛋白質の nucleofection に続いて、遺伝子の重要な障害を克服する iPSC 人口を混合し、細胞のクローナリティ。この '新しい' の全体的なアプローチは簡単です、簡単に多重化だけは数週間かかります、抗生物質の選択を必要としません。我々 を観察しなかった損失効率で細胞や Ips に CRISPRs によって削除を順次導入によるがゲノムの安定性を確保するためこのような場合で実行される分析のニーズを核型します。クローンは、多能性マーカーの発現のもチェックする必要があります。ただし、この文書では、このプロトコルのフォーカスではないは、トランスフェクション カクテル17,18修理テンプレートを含む正確な遺伝子組換えを誘導するために任命することができます。
最後に、私たちの経験に基づいて、iPSC プロトコルを編集に関する重要な考慮事項は、: 全体で特に「種子地域」や PAM モチーフ変更される; 近くターゲットの突然変異を回避または最小限にガイドの合理的設計結合; を配信する Ips で nucleofection 効率の最適化準備ガイド; の品質検証ガイドと Cas9 蛋白質濃度と体外生化学的な胸の谷間で彼らの活動を試金または HEK として人間の cellssuch のこの資料に記載されているセル範囲が検証の滴定が文化に簡単transfect; とログ相成長と 〜 50% の confluency に達するは、初期の通路 Ips の使用します。穏やかな培地で細胞の慎重な取り扱いは、単一細胞選別細胞の生存を確保するため、次を変更します。
我々 は十分な詳細に区切られた上記の輪郭を描かれたプロトコルが生成し、再現可能な方法で iPSC を編集するためのロードマップを持つ読者を装備すると考えています。
開示事項
BT は改修サイエンス株式会社の創立メンバーです。
謝辞
ラボで作業員グラント博士アンジャリ Nandal して探索的助成金によって支持されたメリーランド州の幹細胞研究基金に BT (テッドコー) から。
資料
| Name | Company | Catalog Number | Comments |
| Sendai viral vectors - CytoTune-iPS 2.0 Kit | Invitrogen | A16517 | Thaw on ice; S No: 1 |
| Trypsin EDTA | Gibco Life Tech | 25300-054 | 0.05%, 100 ml; S No: 2 |
| Rock inhibitor (Y-27632) | Milipore | SCM075 | Use 10 μM; S No: 3 |
| DMEM/F-12 medium | Invitrogen | 11330-032 | S No: 4 |
| Serum replacement (KSR) | Gibco | 10828028 | S No: 5 |
| DMEM | Invitrogen | 11960069 | 1X; S No: 6 |
| Fetal bovine serum | Thermo Scientific | SH30071.03 | Aliquot; S No: 7 |
| L-glutamine (Glutamax, 100X), liquid | Thermo Scientific | 35050061 | 1/100; S No: 8 |
| Non-Essential Amino Acids | Gibco | 11140-050 | 1/100; S No: 9 |
| 2-Mercaptoethanol | Gibco | 21985023 | 55 mM, 1/1,000; S No: 10 |
| Hausser Hemacytometers | Hausser Scientific | 02-671-54 | S No: 11 |
| 0.1% Gelatin Solution | STEMCELL Technologies | 7903 | Incubate at 37º C for 1 hour; S No: 12 |
| SSEA-4 antibody | Santacruz | sc-21704 | 1/100; S No: 13 |
| TRA-1-81 antibody | Cell Signaling | 4745S | 1/200; S No: 14 |
| OCT4 antibody | Santa Cruz | sc-5279 | 1/1,000; S No: 15 |
| Collagen I, Rat Tail | Life Technologies | A10483-01 | Keep cold; S No: 16 |
| Alexa Fluor fluorescent 488/ 568 (secondary antibodies) | Invitrogen | A21202/A10042 | 1/2,000; S No: 17 |
| DPBS | Hyclone | SH30028LS | 1X; S No: 18 |
| 100-mm tissue culture dish | Falcon | 353003 | S No: 20 |
| 96-well tissue culture plate | Falcon | 353078 | S No: 21 |
| 6-well tissue culture plate | Falcon | 353046 | S No: 22 |
| Dissecting scope | Nikon | SMZ745 | S No: 23 |
| Picking hood | NuAire | NU-301 | S No: 24 |
| 15 ml Centrifuge Tube | Greiner Bio-One | 188271 | S No: 25 |
| 50 ml Centrifuge Tube | Greiner Bio-One | 227261 | S No: 26 |
| Sodium pyruvate | Invitrogen | 11360 | S No: 28 |
| β-mercaptoethanol | Sigma | M7522 | S No: 29 |
| Prigrow III medium | ABM | TM003 | S No: 31 |
| Countess™ Cell Counter | Invitrogen | C10227 | S No: 32 |
| Faxitron X-ray system | Faxitron | CellRad | S No: 33 |
| Accutase | Innovative cell Technologies | AT-104 | S No: 34 |
| Collagenase | Life Technologies | 17104019 | 1mg/ml stock; S No: 35 |
| Dispase | STEMCELL Technologies | 7923 | S No: 36 |
| hESC qualified matrigel | BD Biosciences | 354277 | To dilute, use cold DMEM/F-12; S No: 37 |
| bFGF | R & D | 233-FB | Stock 10 ug/ml; S No: 38 |
| Paraformaldehyde | EMS | 15710 | 4% stock in PBS; S No: 39 |
| TRA-1-60 | Santa Cruz | sc-21705 | 1/100; S No: 40 |
| NANOG | ReproCELL | RCAB0004P-F | 1/100; S No: 41 |
| Tween 20 | Sigma | P9416-100ML | S No: 42 |
| Alkaline Phosphatase kit | Stemgent | 00-0055 | S No: 43 |
| Cas9 protein | PNA Bio | CP01-50 | Thaw and aliquot; S No: 44 |
| Goat or donkey serum | Sigma | D9663/G9023 | S No: 45 |
| Triton X-100 | Sigma | X100-100ML | S No: 46 |
| DAPI | Thermo Scientific | D1306 | S No: 47 |
| Tris | Sigma | 9285-100ML | S No: 48 |
| NaCL | Sigma | S7653-250G | S No: 49 |
| EDTA | Sigma | BP2482-500 | S No: 50 |
| T4 DNA ligase | NEB | M0202T | S No: 51 |
| Mega Shortscript T7 kit | Thermo Scientific | AM1354 | S No: 52 |
| Mega Clear kit | Thermo Scientific | AM1908 | S No: 53 |
| SMC4 | BD Biosciences | 354357 | S No: 54 |
| Fibronectin | STEMCELL Technologies | 7159 | S No: 55 |
| CloneJET cloning kit | Thermo Scientific | K1232 | S No: 56 |
| Fragment analyzerTM | Advanced Analytical | S No: 57 | |
| mTeSR1 medium kit | STEMCELL Technologies | 5850 | Warm to room temperature; S No: 58 |
| Freezing medium mFreSR™ | STEMCELL Technologies | 5855 | S No: 59 |
| Freezing medium CryoStor® | STEMCELL Technologies | 7930 | S No: 60 |
| MEFs | Globalstem | GSC-6301G | S No: 61 |
| L-glutamine | Invitrogen | 25030081 | S No: 62 |
| Human pancreatic cells | ABM | T0159 | S No: 63 |
| STEMdiff™ Neural Induction Medium | Stemcell Technologies | 5835 | S No: 64 |
| RPMI | Thermofisher | 11875-093 | S No: 65 |
| 2% B27-insulin | Thermofisher | A1895601 | S No: 66 |
| CHIR99021 | Stemcell Technologies | 72052 | S No: 67 |
| IWP4 | Stemcell Technologies | 72552 | S No: 68 |
| 2% B27 | Thermofisher | 17504044 | S No: 69 |
| MCDB 131 | Life Technologies | 10372019 | S No: 70 |
| Sodium bicarbonate | Sigma-Aldrich | S8761-100ML | S No: 71 |
| Glucose | Sigma-Aldrich | G8270-100G | S No: 72 |
| BSA | Proliant | 68700 | S No: 73 |
| GDF8 | Pepro-Tech | 120-00 | S No: 74 |
| TUJ1 antibody | EMD Milipore | AB9354 | S No: 75 |
| NKX2-5 antibody | Santa Cruz | Sc-14033 | S No: 76 |
| SOX17 antibody | R & D systems | AF1924 | S No: 77 |
| Propidium iodide | Thermo Scientific | P3566 | S No: 78 |
| Amaxa 4D-nucleofector™ | Lonza | AAF-1002 | S No: 79 |
| FACSAria II (cell sorter) | BD biosciences | SORP UV | S No: 80 |
参考文献
- Malik, N., Rao, M. S. A review of the methods for human iPSC derivation. Methods Mol. Biol. 997, 23-33 (2013).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Sommer, C. A., et al. Induced pluripotent stem cell generation using a single lentiviral stem cell cassette. Stem cells. 27, 543-549 (2009).
- Macarthur, C. C., et al. Generation of human-induced pluripotent stem cells by a nonintegrating RNA Sendai virus vector in feeder-free or xeno-free conditions. Stem cells Int. , 564612(2012).
- Li, H. O., et al. A cytoplasmic RNA vector derived from nontransmissible Sendai virus with efficient gene transfer and expression. J Virol. 74, 6564-6569 (2000).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc. Jpn. Acad. Ser. B, PhysBiol. Sci. 85, 348-362 (2009).
- Nakagawa, M., et al. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci. Rep. 4, 3594(2014).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell stem cell. 18, 573-586 (2016).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 169, 559(2017).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 168, 20-36 (2017).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat. Biotech. 32, 347-355 (2014).
- McElroy, S. L., Reijo Pera, R. A. Preparation of mouse embryonic fibroblast feeder cells for human embryonic stem cell culture. CSH Protoc. 2008, (2008).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc. Natl. Acad. Sci. U.S.A. 109, E1848-E1857 (2012).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotech. 32, 1121-1133 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology: a decade of progress. Nat. Rev. Drug Discov. 16, 115-130 (2017).
- Wang, B., et al. Highly efficient CRISPR/HDR-mediated knock-in for mouse embryonic stem cells and zygotes. BioTechniques. 59, (2015).
- Liang, X., Potter, J., Kumar, S., Ravinder, N., Chesnut, J. D. Enhanced CRISPR/Cas9-mediated precise genome editing by improved design and delivery of gRNA, Cas9 nuclease, and donor DNA. J Biotech. 241, 136-146 (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved