Method Article
Efficiente generazione e la modifica di IPSCs privo di alimentatore da cellule pancreatiche umane utilizzando il sistema di CRISPR-Cas9
In questo articolo
Riepilogo
Questo protocollo descrive in dettaglio la generazione di cellule staminali pluripotenti indotte privo di impronta (iPSCs) da cellule pancreatiche umane in condizioni prive di alimentatore, seguito da editing con CRISPR/Cas9 ribonucleoproteine e caratterizzazione del modificati cloni unicellulari.
Abstract
Cellule staminali pluripotenti embrionali e indotto può auto-rinnovarsi e differenziarsi in più tipi di cellule del corpo. Le cellule pluripotenti sono così ambite per la ricerca in medicina rigenerativa e sono attualmente nei test clinici per le malattie dell'occhio, diabete, malattie cardiache e altri disturbi. La capacità di differenziarsi in tipi cellulari specializzati accoppiati con i recenti progressi nel genoma tecnologie compreso il sistema CRISPR/Cas hanno fornito ulteriori opportunità per la sartoria il genoma di iPSC per svariate applicazioni compreso la malattia di modellazione, terapia genica e la differenziazione dei percorsi di differenziazione, per citarne alcuni. Tra le tecnologie di modifica disponibili, il CRISPR/Cas9 da Streptococcus pyogenes è emerso come uno strumento di scelta per l'editing site-specific del genoma eucariotico. Il CRISPRs sono facilmente accessibile, economico e altamente efficiente in ingegneria modifiche mirate. Il sistema richiede una nucleasi Cas9 e una sequenza di guida (20-mer) specifica per la destinazione genomica adiacente con un 3-nucleotide "NGG" protospacer-adiacente-motivo (PAM) per il targeting Cas9 al locus genomico desiderato, a fianco di un tracciante universale di associazione Cas9 (RNA insieme chiamato RNA guida singola o sgRNA). Qui vi presentiamo un passo-passo il protocollo per generazione efficiente di iPSC alimentatore indipendente e privo di impronta e descrivere metodologie per l'editing genomico di iPSC utilizzando i complessi della ribonucleoproteina (RNP) Cas9. Il genoma protocollo di modifica è efficace e può essere facilmente multiplexed di sgRNAs pre-complessanti per più di una destinazione con la proteina Cas9 e contemporaneamente fornire nelle cellule. Infine, descriviamo un approccio semplificato per l'identificazione e caratterizzazione di iPSCs con modifiche desiderate. Presi insieme, le strategie descritte dovrebbero semplificare la generazione e la modifica di iPSC per molteplici applicazioni.
Introduzione
La riprogrammazione di cellule somatiche umane allo stato pluripotent da sovraespressione di fattori di riprogrammazione ha rivoluzionato la ricerca sulle cellule staminali con applicazioni nella modellazione di malattia, la medicina rigenerativa e lo sviluppo di farmaci. Sono disponibili per la consegna dei fattori di riprogrammazione e generando iPSCs diversi metodi di riprogrammazione non-virale, ma il processo è lavoro intensivo e non molto efficiente1. I metodi virali, anche se efficiente, sono associati a problemi di integrazione del virus e carcinogenicità2,3,4. In questo manoscritto, segnaliamo l'uso di citoplasmico Sendai virus per fornire fattori di riprogrammazione e stabilire linee di iPSC privo di impronta che la mancanza di integrazione di tutte le sequenze di vettori virali in loro genomi5. Sendai virus è un virus a RNA che è diluito su passaggi di citoplasma ~ 10 cella dopo l'infezione e produce fattori di riprogrammazione in abbondanza, portando a rapida ed efficiente riprogrammazione6,7. Le iPSCs stabilito poi può essere aumentato facilmente al medium senza alimentatore per evitare l'uso di fibroblasti embrionali del mouse (MEFs) come alimentatore cellule8.
In questa pubblicazione, oltre a delineare il virus Sendai mediato riprogrammazione, descriviamo anche un protocollo migliorato per l'editing iPSCs, che ha il potenziale per la fornitura di cellule umane illimitate con modificazioni genetiche desiderate per la ricerca. Abbiamo utilizzato la tecnologia CRISPR/Cas9 per la modifica delle iPSCs, che ora viene utilizzato per una vasta gamma di applicazioni tra cui bussare-ins e Ko, delezioni genomiche su larga scala, libreria in pool di screening per l'individuazione del gene, ingegneria genetica di numerosi organismi di modello e gene terapia9,10,11. Questa tecnica comporta la formazione di complessi di Streptococcus pyogenes-derivata Cas9 nucleasi e 20-mer guida RNAs che ottenere il riconoscimento di destinazione tramite appaiamento con sequenza genomica target adiacente al 3' del nucleotide protospacer adiacente sequenza di motivo (PAM). Le nucleasi Cas9 induce un nucleotidi doppia interruzione incagliato ~ 3 dal sito PAM, che è successivamente riparato prevalentemente da non-omologo fine entrare via (NHEJ) che conduce gli inserimenti o eliminazioni nell'open reading frame e quindi funzionale Ko di geni12.
Il nostro protocollo migliorato include i dettagli per la coltura di cellule pancreatiche umane, loro riprogrammazione su mitotically inattivato fibroblasti embrionali del mouse (MEFs) per raggiungere una maggiore efficienza della riprogrammazione, successivo adattamento alla cultura senza alimentatore il Matrigel, caratterizzazione delle iPSCs stabilito, CRISPR guidato RNA progettazione e preparazione, consegna in iPSCs come complessi di RNP, singola cella ordinamento per generare linee clonali di iPSCs modificato, facile screening e identificazione di modifiche e la caratterizzazione di singola cella cloni. Delezioni genomiche in modo efficiente sono stati generati in questo studio tramite l'introduzione di proteine Cas9 e due CRISPR sgRNA RNP complessi per indurre interruzioni incagliate doppie (DSBs) e l'eliminazione dell'intervento del segmento. Questo metodo sfrutta l'uso di due guide per la generazione le eliminazioni nell'open reading frame, ad alta efficienza di NHEJ portando a basso numero di cloni che necessità di essere caratterizzato e facile screening preliminare di cloni di capillare automatizzata unità di elettroforesi, analizzatore di frammento. Questi genoma efficaci metodi per generare modelli di malattia umana basata su cellule staminali di editing diventerà presto un approccio standard e di routine in qualsiasi laboratorio di cellule staminali. Infine, editing genomico preciso renderà possibile andare di là di modellazione di malattia delle cellule staminali e potenzialmente potrebbe contribuire a catalizzare le terapie basate sulle cellule.
Protocollo
1. protocollo di riprogrammazione
- generazione di iPSC umano da cellule pancreatiche umane primarie
- cappotto un 6-pozzetti piastra con collagene freddo 1,5 mg/mL e consentirle di gel a 37 ° C per 1 h.
- Piastra passaggio precoce primarie cellule pancreatiche umane nel mezzo di Prigrow III (~ 1-1.5 × 10 5 cellule) su un collagene rivestito piastra a 6 pozzetti il giorno -2 a raggiungere circa 2,5 × 10 5 celle o almeno il 60% confluenza per bene il giorno della trasduzione (giorno 0). Per il primo studio, piastra almeno 2-3 pozzi per ottenere un pozzetto con confluency di desiderato il giorno 0. Utilizzare almeno un bene come un controllo per contare le celle.
- Il giorno di trasduzione (giorno 0), caldo 1 mL di terreno di Prigrow III in un bagno d'acqua per ciascun pozzetto essere transduced. Raccogliere le cellule da un controllo bene in 1 mL di terreno FBS 10% con 1 mL di tripsina/EDTA per 5 minuti o fino a staccano le cellule per eseguire un conteggio delle cellule. Per rendere medio di 10% FBS, aggiungere DMEM, 10% FBS, 1% L-Glutammina, 1%, sodio piruvato e l'1% non essenziali aminoacidi.
- Conteggio e verifica l'attuabilità delle cellule utilizzando il contatore di cellule e calcolare il volume di ogni virus necessario per raggiungere il target in base il titolo di virus e numero di cellulare. Utilizzare la molteplicità di infezione (MOI) di KOS = 5, hc-Myc = 5 e hKlf4 = 3 per le cellule pancreatiche.
- Un set di disgelo di Sendai vector tubi nella memoria di-80 ° C sul ghiaccio e aggiungere con cautela i volumi calcolati di ciascuna delle tre provette di vettore di Sendai a 1 mL di mezzo di Prigrow III, pre-riscaldato a 37 ° C. pipetta delicatamente per mescolare la soluzione. Un pozzetto di una piastra a 6 pozzetti è abbastanza per trasdurre con vettori virali di Sendai per generare cellule riprogrammate.
- Aspirare il mezzo di Prigrow III dalle cellule e aggiungere lentamente la miscela di virus riprogrammazione dei pozzetti contenenti le celle. Incubare le cellule durante la notte in un incubatore a 37 ° C con un'atmosfera umidificata di 5% CO 2.
- Attentamente scartare la miscela di virus sulle cellule e sostituire con medium fresco Prigrow III il giorno successivo, 24 h dopo la trasduzione. Coltura delle cellule per 5D e cambiare il mezzo ogni giorno alterno.
- Il giorno 5, preparare MEFs su 0,1% gelatina prepatinato 10cm cultura piatti (1,3 x 10 6 cellule/piatto). Crescere MEFs in boccette T175 fino al giorno 4 e poi il giorno 5, esporre le cellule a 6.000 rads da una sorgente di γ-radiazione prima di seminare le cellule 13 o uso la fonte commerciale di MEF.
- Il giorno 6, utilizzare 1 mL di soluzione di distacco delle cellule per 10 min per staccare le cellule trasdotte, tutti su piatti MEF nel mezzo di Prigrow III piastra con inibitore di roccia (stock di 5 mM, 10 µM finali) e incubare per una notte in un incubatore a 37 ° C con un atmosfera umidificata Re di 5% CO 2.
- Cambiare il mezzo di Prigrow III su hESC medio il giorno successivo. Per fare 500 mL di terreno hESC, aggiungere DMEM/F-12, sostituzione di 20% (v/v) ad eliminazione diretta del siero (KOSR), 5 ng/mL bFGF; 1 mM l-glutammina; Aminoacidi non essenziali 100 µM e 100 µM 2-mercaptoetanolo. Modificare il mezzo delicatamente ogni giorno ora.
- Osservare le piastre regolarmente per l'emersione dei cespi di cella o colonie indicativo di cellule riprogrammate. Le cellule trasformate formano aggregati clonali con morfologia di ciottoli e grande nucleo ed i nucleoli. Contrassegnare la probabile ' iPSC ' colonie e controllarli regolarmente per crescita.
- Quasi quattro settimane dopo la trasduzione come colonie sono pronti per la raccolta o trasferimento, preparare piatti MEF 24 pozzetti di placcatura 1.3 x 10 prepatinato piastra di 6 cellule/gelatina come prima per il trasferimento delle singole colonie.
- Membrana matrice preparare (ad es., Matrigel) di aliquotare che e basato sul fattore di diluizione sul certificato di analisi. Aggiungere un'aliquota a 25 mL di DMEM/F-12 al cappotto 6-ben quattro piastre (1 mL/pozzetto) e incubare a temperatura ambiente (TA) per almeno 1 h prima dell'uso. Selezionare manualmente il 12-24 colonie utilizzando una pipetta sterile per aspirare li e trasferire su piastre MEF in 500 µ l di terreno di hESC.
- Aspirare i media nel pozzo a delicatamente turbare o spezzare le colonie. Anche prendere 24-48 colonie sulla matrice della membrana rivestita 24 pozzetti. Per le piastre a membrana rivestita, utilizzare mTeSR1 (completati con inibitore di roccia 10 µM) per 24 h e cambiano ogni giorno. Entro 6-10 d di picking colonie, sono pronti per essere trasferito alle nuove piastre a membrana 24 pozzetti e/o 12-pozzetti per espansione clonale.
- Se necessario, staccare le colonie su MEFs utilizzando collagenasi di 1 mg/mL per 20 min, lavare due volte con hESC/mTeSR1 e trasferimento a membrana 12 o 24 pozzetti piastre rivestite. Se ci sono abbastanza robuste colonie crescente sulla membrana matrice dal passaggio 1.1.12, congelare le colonie su MEFs usando iPSC media secondo il produttore di congelamento ' linee guida s.
- Staccare le colonie robuste placcate sulla membrana nel passaggio 1.1.12 utilizzando 500 µ l di dispase per 20 min e piastra nuovamente sulla membrana di matrice 12-pozzetti piastre rivestite. Raschiare manualmente eventuali cellule differenziate o contaminanti le cellule di alimentatore MEF per arricchire per pluripotenti cloni sulla membrana.
- Espandere i cloni dopo 6-8 d da una crescente sulla membrana rivestito di piastre dissociando con soluzione dispase come prima e placcatura aggregati di piccole cellule sulla membrana fresco 6 o 12 pozzetti piatto rivestito. Medio-mTeSR1 cambia ogni giorno. Caratterizzano i cloni riprogrammati da fosfatasi alcalina macchiatura, immunostaining per l'analisi di FACS pluripotenza marcatori (OCT3/4 e NANOG), di marcatori di superficie pluripotenti e saggi di differenziazione. Crescere e cultura i cloni su piastre rivestite con membrana per tutte le analisi compreso CRISPR di editing come spiegato sopra, a meno che altre soluzioni di rivestimento sono specificamente menzionata.
- IPSCs caratterizzazione di umana
- fosfatasi alcalina colorazione
Nota: un kit commerciale è usato qui. Vedere la tabella materiali.- Piastra putativo iPSCs umane su piastra a 24 pozzetti e cultura per 4-5 d con cambio giornaliero media.
- Per avviare il protocollo di colorazione, aspirare il terreno di coltura e lavare le cellule con 1 mL di PBS 1x con 0.05% Tween 20 (PBST).
- Aggiungere 0,5 mL di soluzione di correzione nel kit sulle cellule e incubare a RT per un minimo di 2 a 5 aspirare la soluzione di correzione e quindi lavare le cellule fisse con PBST. Non lasciare asciugare i pozzetti.
- Aggiungere 0,5 mL di soluzione di substrato AP preparata per pozzetto di miscelazione soluzione A, B e C. Incubare le cellule al buio (avvolto con un foglio o in un contenitore scuro) a temperatura ambiente per 5-15 min.
Nota: Strettamente monitorare il cambiamento di colore e interrompere la reazione quando il colore diventa luminoso per evitare colorazione aspecifica. - Interrompere la reazione di aspirare la soluzione di substrato di AP e il lavaggio dei pozzetti due volte con 2 mL di PBS 1X.
- Osservare le colonie al microscopio e catturare le immagini a 4 X o 10 ingrandimenti utilizzando qualsiasi microscopio a campo chiaro con una macchina fotografica.
- Immunostaining
- piastra iPSCs umane in piastra a 24 pozzetti e cultura per 4-5 d con cambio giornaliero media.
- Lavare le cellule una volta brevemente con PBS e correzione per 20 min con paraformaldeide al 4% (PFA) in PBS.
- Lavare tre volte per 10 min (3 x, 10 min) con PBS a TA. Siti aspecifici
- saturare con 10% capra o asino siero normale (NS, a seconda dell'animale anticorpo secondario è stato alzato dentro) in PBS per 40 minuti a TA. Per solo gli epitopi intracellulari, sono 0.3% TX-100 in PBS (TX/PBS) per permeabilize.
- Lavare 3 x 5 min con PBS a TA.
- Diluire gli anticorpi OCT4, NANOG, TUJ1, NKX2-5 e SOX17 in una soluzione fresca di 5% NS in PBS e incubare per 2 h a RT o durante la notte a 4 ° C.
- Lavare 3 volte per 5 min con PBS a TA.
- Diluire appropriato secondaria Alexa Fluor 488 o 568 anticorpi in 5% NS/PBS e incubare le cellule per 1 h a RT.
- Lavare 3 volte per 5 min a RT.
- Incubare con DAPI in PBS per 10 min e lavare 2 volte per 5 min a RT. uso un microscopio a fluorescenza per scattare foto.
- Fluorescenza-attivato delle cellule ordinamento (FACS)
- piastra iPSCs umane in una piastra a 6 pozzetti e cultura fino alle colonie diventano 80% confluenti (almeno 10 5 celle /sample) con cambio medio giornaliero di mTeSR1.
- Il giorno dell'esperimento, isolare le cellule e dissociare una sospensione unicellulare come spiegato sopra nel protocollo. Lavare con medie di 10% FBS.
- Per gli indicatori di superficie, risospendere in 0,5-1 mL di 10% FBS medio e tenere il ghiaccio
- Per gli indicatori intracellulari, risospendere in 1 mL di 4% PFA/PBS e incubare per 10 minuti a temperatura ambiente. Lavare con medie di 10% FBS. Risospendere in 0,1% TX/PBS e incubare per 15 minuti sul ghiaccio. Lavare nuovamente con il mezzo di 10% FBS. Risospendere in 0,5-1 mL di 10% FBS medio e tenere il ghiaccio
- Aggiungere 50 µ l della sospensione delle cellule a 50 µ l di 10% FBS Media contenente quantità raccomandata di TRA-1-60, TRA-1-81 o SSEA-4 anticorpi ed incubare per 30 min a 1 h.
- Lavare due volte con 10% FBS.
- Risospendere in 100 µ l di 10% medio FBS contenente anticorpi secondari fluorescenti ed incubare per 30 min. lavare due volte con 10% FBS e risospendere in volume appropriato di 10% FBS. Cellule vive possono essere differenziate dalle cellule morte con propidio ioduro colorante aggiunto al < 1 µ g/mL per stimare gli apoptosi delle cellule durante il processo di.
- Tri-stirpe differenziazione
- seme due 6-pozzetti con 1,5-2 x 10 6 iPSCs/pozzetto in mezzo mTeSR1 con inibitore di roccia 10 µM.
- Permettono alle cellule di crescere per 2-3 d con cambio medio giornaliero mTeSR1 fino a quando i pozzi sono 80-90% confluenti.
- Per l'induzione di ectoderma, aggiungere mezzo di induzione neurale (NIM) secondo il produttore ' s istruzioni in 2-3 pozzetti delle piastre 6 pozzetti.
- Modificare il medium RPMI contenente supplemento del 2% B27 meno insulina e 12 µM CHIR99021 per induzione del mesoderma in 2-3 pozzetti delle piastre 14. Aggiungi solo RPMI contenente 2% B27 supplemento meno insulina per il prossimo 24 h. aggiungere 5 µM IWP4 al medium RPMI con 2% B27 supplemento meno insulina per il prossimo 24 h. Dopo 72 h, sostituire il supporto con RPMI contenente 2% B27 supplemento che conduce alla generazione di battendo cardiomiociti in 2-3 d.
- Per induzione endoderma, cambiare il mezzo nei pozzetti delle piastre 6 pozzetti a 131 MCDB completati con bicarbonato di sodio di 1,5 g/L, 1 x Glutamax, glucosio di 10 mM, 0,5% BSA, 100 ng/mL GDF8 e 5 µm di CHIR99021 per 24 h. cultura sullo stesso supporto senza CHIR99021 per 2-3 d 15.
- Seguire il protocollo di immunostaining dal punto 2 per tutti i tre lignaggi e verifica per l'espressione degli indicatori rilevanti.
- fosfatasi alcalina colorazione
2. IPSC Editing di Human Genome usando CRISPR-Cas9
- sgRNA e preparazione di Cas9 proteina
- Aliquot Cas9 proteina in provette microcentrifuga in condizioni sterili e conservare le aliquote congelando le provette a -80 ° C.
- Design due guida RNAs al gene basata sul software del MIT (http://www.genome-engineering.org/crispr/) o qualsiasi altro CRISPR guida progettazione webtool di targeting. Obiettivo primo o il secondo esone del gene (basato sul telaio di lettura aperto) per generare Ko. Scegliere le due guide in modo che tagliano ravvicinati (~ 30-100 bp apart) e possiamo facilmente visualizzare l'eliminazione utilizzando lo stesso set di primer di screening. Scegliere le guide dall'output del software sulla base del Punteggio di qualità superiore e più basso numero di siti fuori bersaglio. Disegnare primers di screening utilizzando il programma primer blast (https://www.ncbi.nlm.nih.gov/tools/primer-blast/). Primer di screening dovrebbe essere almeno 100 bp lontano il Cas9 tagliare siti e la dimensione del prodotto PCR deve essere preferibilmente tra 400-700 bp per più facile amplificazione mediante PCR.
- Design i due complementari sgRNA oligo DNAs (19-22 nucleotidi di lunghezza a seconda della sequenza di guida) con una Bsa1 tagliare sito ad ogni estremità. L'oligo DNAs può essere sintetizzato in commercio e ricotto per formare doppio filamento DNA. Per ricottura, aggiungere 1 µ l di 100 µM guide, 25 µ l di tampone (10 mM Tris, pH7.5-8.0, 50 mM NaCl, 1 mM EDTA) di ricottura e 23 µ l di acqua. Incubare in un termociclatore programmato per iniziare a 95 ° C per 2 min e poi gradualmente raffreddamento a 25 ° C oltre 45 min.
- Clone il 2 µ l di frammento risultante in un enzima di restrizione Bsa1 digerito 1 µ l di in-House vettoriale di pCR2.1 promotore T7 con un sito di legame di Cas9 utilizzando ligasi del DNA T4 secondo il produttore ' protocollo s.
- Sequenza i frammenti di DNA clonati e quando viene stabilita la fedeltà, in vitro trascrivere i cloni utilizzando un kit di T7 per generare guida singola RNAs. Purificare il sgRNAs con un kit commerciale ed eluire in acqua RNAsi-libera. Controllare la concentrazione di RNA.
- Transfezione di hiPSCs
- hiPSCs nel mezzo di mTeSR1 della coltura come sopra descritto, fino a quando le cellule sono 40-50% confluenti.
- Due ore prima il nucleofection, sostituire il mezzo con 2 mL di terreno preriscaldato mTeSR1 contenente 10 µM roccia inibitore.
- Un'ora più tardi, preparare pozzetti di destinazione per le cellule nucleofected da membrana aspirante, preparato come sopra, da 12-pozzetti e sostituendo con preriscaldati 1 mL di terreno di mTeSR1 con inibitore di roccia 10 µM. Mantenere a 37 ° C per l'incubazione.
- Preparare il nucleofection mix master (bilancia in modo appropriato a seconda dei campioni) per ogni campione aggiungendo 16,4 µ l della cellula primaria P3 supplemento; 3,6 µ l di 1 per integrare il kit Nucleofactor; 0,5 µ g di proteina Cas9 e 0,5 µ g di ogni sgRNA in 22 µ l in ogni volume di reazione. vettore GFP pMAX era anche nucleofected secondo il produttore ' consigli s in cellule per stimare approssimativamente l'efficienza di trasfezione iPSC.
- Lavare ogni bene con 2 mL di PBS RT dopo avere aspirato il supporto contenente l'inibitore di roccia dai pozzetti iPSC. Quindi aspirare PBS, aggiungere 1 mL di soluzione di distacco delle cellule e incubare la piastra a 37 ° C per 10 min.
- Risospendere le cellule in 3 mL di terreno di mTeSR1 e pipettare delicatamente su e giù per generare una sospensione unicellulare. Cellule di trasferimento dissociato a una centrifuga da 15 mL provetta contenente il mezzo 5ml mTeSR1.
- Contare le celle con contatore di cellule e calcolare il volume totale richiesto per 0,5 x 10 6 cellule/transfezione. Inserire la quantità desiderata di cellule in provetta per centrifuga 15 mL, centrifugare a 200 x g per 5 min a RT e aspirare il supernatante.
- Risospendere ogni unità di 0,5 x 10 6 cellule in 22 µ l di mix master transfezione preparato nel passaggio 4. Trasferire rapidamente le cellule nella camera centrale di un pozzetto di una striscia di nucleocuvette. Posizionare la striscia in un Nucleofactor dispositivo e nucleofect celle utilizzando programma CB150.
- Dopo il nucleofection, rapidamente aggiungere 80 µ l di terreno di mTESR1 preriscaldati contenente 10 µM roccia inibitore ad ogni pozzetto delle cellule nucleofected. Mescolare delicatamente pipettando su e giù.
- Trasferire delicatamente le cellule dalla striscia ai pozzetti della piastra membrana prepatinato 12-pozzetti contenenti mTeSR1 mezzo con inibitore di roccia preparato nel passaggio 3.
- Dopo 1 d, modificare mTeSR1 fresco mezzo senza inibitore di roccia. Vendemmia celle 2-3 d dopo il nucleofection per cella singola ordinamento.
- Single-Cell isolamento di hiPSCs mirato
- un giorno prima l'ordinamento, preparare piastre da 96 pozzetti MEF da semina 2 x 10 6 cellule/gelatina-rivestito piastra in media di 10% FBS. Circa il 70-80% dei cloni sopravvivere dopo il nucleofection e 2-3 piatti MEF possono essere preparate per ogni esperimento editing.
- Dopo l'incubazione durante la notte, cambiare il mezzo al mezzo hESC (come descritto in precedenza) completato con 100 ng /mL bFGF, 1 x SMC4 (inibitori aggiunti ai media per migliorare la vitalità delle cellule singole), 5 mg/mL fibronectin per promuovere l'adesione e.
- Sostituire il mezzo su hiPSCs nella piastra 12-pozzetti da mTeSR1 a mTeSR1 supplementato con 1 x SMC4 per almeno 2 h prima dell'ordinamento unicellulare.
- Il mezzo da hiPSCs di aspirare e lavare le cellule delicatamente con PBS. Aggiungere 500 µ l di soluzione di distacco delle cellule in ogni pozzetto e incubare a 37 ° C per 10 min dopo avere aspirato il PBS. Generare la sospensione unicellulare aggiungendo 1 mL di mTeSR1 (senza aggiunte) in ciascun pozzetto e pipettaggio su e giù delicatamente più volte.
- Posto di sospensione cellulare in una provetta conica da 15 mL e centrifugare per 5 min a 200 x g a RT. aspirare il surnatante e risospendere le cellule in 1 mL di mTeSR1.
- Ordinare le celle in singole celle utilizzando un sorter delle cellule con 100 mm ugello in condizioni sterili con una cella nel pozzo individuo delle piastre da 96 pozzetti preparate nel passaggio 1.
- Quattro giorni dopo l'ordinamento, formazione della Colonia dovrebbe essere evidente; a questo punto sostituire il terreno di coltura con hESC supplementato con 1 x SMC4.
- Otto giorni dopo la cernita, sostituire medio con medium hESC e cultura per 2 d.
- Staccare le colonie con collagenasi di 1 mg/mL per 20 min e trasferirli a piastre a membrana 24 pozzetti rivestita in mTeSR1 con inibitore di roccia. Lasciate che i cloni unicellulari crescere ed estrarre loro DNA genomic dopo la duplicazione o la loro espansione. Utilizzare primers specifici del gene per amplificare il DNA mediante PCR bersaglio.
- Kit di analizzatore di frammento di uso per lo screening iniziale della regione genomica del target amplificati di PCR del tutti i cloni di farle passare attraverso il gel/colorante mescolare secondo il produttore ' s istruzioni. Stimare la dimensione del frammento risultante nel software PROSize confrontandolo con la scala appropriata, che viene eseguita con i campioni. Sequenza del previsto ' modificato ' cloni e analizzare dati di sequenziamento per confermare la modifica o delezioni.
- Per la differenziazione monoallelica e biallelica cloni, amplificare la sequenza montata con PCR e clone nel vettore pJET1.2. Inviare almeno 8-10 cloni per il sequenziamento e controllare la sequenza per confermare la modifica in uno o entrambi gli alleli.
- Una volta con successo mirati iPSC cloni sono stati identificati mediante genotipizzazione, esaminare per confermare che non hanno perso la pluripotenza o guadagnato anomalie cromosomiche attraverso il processo.
Risultati
In questa pubblicazione, abbiamo seguito un protocollo semplice ma efficace per la generazione di iPSC da cellule pancreatiche umane mediante integrazione o privo di impronta Sendai virus vettori. Figura 1A Mostra una rappresentazione schematica del presente protocollo di riprogrammazione. Le cellule pancreatiche umane sono state acquistate commercialmente, coltivate in medium Prigrow III e trasdotte con il virus Sendai come spiegato sopra. Trasdotte fusiformi in cellule pancreatiche non hanno mostrato cambiamenti morfologici per ~ 5 giorni dopo la trasduzione di Sendai virus il giorno 0, ma poi diventano arrotondati con nucleoli e nucleo più grande. Alcune colonie in anticipo sono stati veduti dopo un post-traduzionali settimana ma non sono stati raccolti, come nella nostra esperienza, queste colonie dissociano rapidamente e di solito sono le 'cellule parzialmente riprogrammate prime' che non stabilire colonie robusti. Post-trasduzione di circa 10-15 giorni, piccole colonie luminose sono stati osservati e sono stati raccolti dopo la crescita (Figura 1B, in alto a destra). IPSC umano colonie sono compatti, serrato con margini netti (considerati come 'completamente riprogrammate cellule') (Figura 1B, giorno 23 in basso al centro) e 'parzialmente riprogrammate cellule' sono sciolti con lacune nella Colonia (Figura 1B, giorno 23 in basso a destra). Le colonie di cellule pancreatiche riprogrammate stavano crescendo il giorno 18 (Figura 1Bin basso a sinistra) ed erano abbastanza grandi per essere raccolte manualmente dal giorno 23 (Figura 1B, in basso al centro). Le colonie erano cromate sulle piastre rivestite con membrana dopo la raccolta per ottenere iPSC privo di alimentatore del giorno 30-40 (a sinistranella Figura 2A, ). Alcune di queste colonie 'robuste' privo di alimentatore erano espansi e caratterizzati per l'espressione di marcatori di superficie in condizioni prive di alimentatore, pluripotenza e della fosfatasi alcalina. Tutti i cloni testati erano positivi per la fosfatasi alcalina come hanno girato rosso brillante dopo il dosaggio (Figura 2A, a destra). I marcatori di pluripotenza OCT4, NANOG, SSEA4, TRA-1-60 e TRA-1-81 inoltre sono stati osservati per essere altamente espresso in tutti i cloni di immunostaining o analisi FACS (Figura 2B e Figura 3A).
Questi risultati dimostrano che le colonie umane iPSC generate dalle cellule pancreatiche espresso marcatori di pluripotenza in condizioni prive di alimentatore. La pluripotenza inoltre è stata valutata di differenziazione diretto di iPSC umana a tre strati di germe: ectoderma, mesoderma ed endoderma. Cloni su membrana potentemente differenziano ai neuroni TUJ1-positivi (ectoderma), NKX2-5-positiva battendo cardiomiociti (mesoderma) e cellule endodermiche SOX17-positive (Figura 3B).
Dopo approfondita caratterizzazione, linee clonali iPSC 3-robusto, privo di alimentatore sono stati scelti per il genoma studi di editing. Le due guide con BsaI siti di taglio alle estremità sono stati progettati per ogni gene di tagliare vicino insieme (cioè, n meno di ~ 100 bp). Lo schema del protocollo è illustrato nella Figura 4. Questa strategia di eliminazione utilizzati per i geni bersaglio ci ha permessi facilmente eliminare una porzione dell'essone prima o la seconda di un gene. Questa strategia era molto efficiente e abbiamo potuto isolare cloni modificati in ogni tentativo. Le guide sono state clonate nel vettore BsaI digerito e in vitro trascritto come descritto sopra. Abbiamo nucleofected Guide (RNAs) e proteina di Cas9 come complessi di RNP per editing rapido ed efficace. Abbiamo anche ordinato le cellule come cellule singole su MEFs come recupero di cellule è più alto rispetto alle cellule ordinate singolarmente sulle piastre rivestite con membrana. Il DNA di Genomic è stato isolato da tutti i cloni, la parte di destinazione è stata amplificata dalla PCR e risolto su analizzatore di frammento alla schermata per cambiamenti nelle dimensioni dei frammenti bersaglio rispetto ai comandi. La dimensione del frammento è stato confrontato con la scala eseguita con i campioni per rilevare 'modificati' cloni (Figura 4, in basso). Questo fatto lo screening di cloni facile come potremmo andare > 90 cloni in un piatto e i risultati sono stati ottenuti con la precisione di ± 3 bp. I cloni selezionati sono stati quindi sequenziati per confermare cloni wild-type e mutati. Wildtype cloni non avevano nessuna eliminazione o aggiunta di basi mentre cloni mutati hanno avuti sia aggiunta o eliminazione nella sequenza rispetto il wildtype. I cloni mostrando eliminazione o aggiunta nel sequenziamento erano pJET1.2 espanso e clonato nel vettore per identificare cloni monoallelica e biallelica di sequenziamento di almeno 8-10 colonie per clonazione. Monoallelica cloni avevano basi cancellato o aggiunto in un allele e l'altro era inalterato e simile all'allele wildtype. Biallelica cloni avevano le eliminazioni in entrambi gli alleli. Circa trecento cloni sono stati schermati per tutti i geni bersaglio, che ha identificato circa 9 cloni di omissione monoallelic e 3 cloni di delezione biallelica in ogni caso. Questo corrisponde approssimativamente ad una riduzione di 3 volte in frequenza di generazione di cloni biallelica rispetto ai cloni monoallelica. Eterogeneità all'interno gli ampliconi di eliminazione riflesso riparazione NHEJ imperfetta e incoerente. L'espressione del gene è stata infine confermata tramite l'estrazione di RNA da cellule bersaglio ed eseguendo RT-PCR.

Figura 1: riprogrammazione di cellule pancreatiche umane di cellule pluripotenti senza alimentatore (iPSC). (A) A protocollo schematico per la generazione di iPSC da cellule pancreatiche umane è mostrato. Le cellule pancreatiche sono state coltivate su piastre rivestite con collagene e trasferite MEFs dopo trasduzione con vettori di virus umano di Sendai. Le colonie completamente riprogrammato sono stati poi trasferite alla membrana hESC qualificato e caratterizzate. (B) morfologiche cambia dopo trasduzione del virus Sendai. Prima la trasduzione, cellule pancreatiche mostrano tipici dell'alberino-come la morfologia (in alto a sinistra, giorno 0). Appaiono in piccole colonie su MEFs di giorno 12, colonie delle cellule pluripotenti umane di somiglianza. Normalmente le colonie di iPSC umano completamente riprogrammato hanno confini molto chiari e possono essere ritirate dal giorno 23-30. Una colonia dissociata al giorno 23 viene visualizzata nella parte inferiore destra. Tutte le immagini sono state catturate a 100 ingrandimenti (obiettivo 10x e oculare 10x). Barra della scala = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.
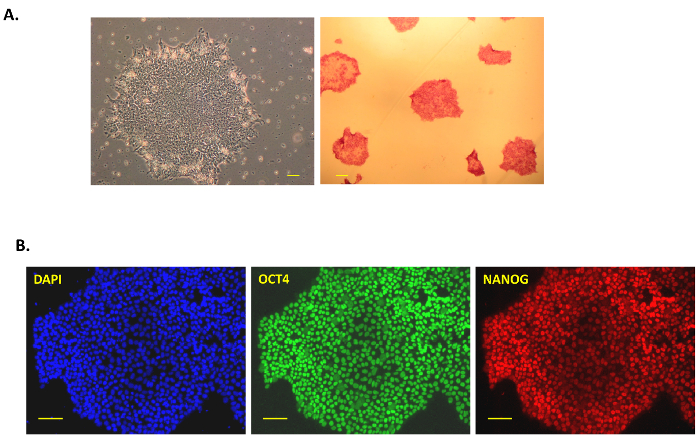
Figura 2: caratterizzazione di umano iPSC. (A), A immagine di contrasto di fase tipica di una colonia di iPSC dopo prelievo e coltura in condizioni prive di alimentatore (40 X, 4 X obiettivo e oculare 10x; sinistra) dopo Sendai virus riprogrammazione delle cellule del pancreas. Fosfatasi alcalina macchiata rosso iPSC Colonia si trova sulla destra. Per la colorazione di fosfatasi alcalina, le colonie di iPSC sono stati corretti e macchiata di rosso dopo l'aggiunta della soluzione di substrato dal kit. Le immagini sono state catturate a 40 X. (B) Immunostaining per marcatori di pluripotenza NANOG e OCT3/4 in iPSCs derivati da cellule del pancreas umano privo di alimentatore. DAPI è stato utilizzato per macchiare il nucleo blu come un controllo. Tutte le immagini sono state scattate a 100 ingrandimenti. Barra della scala = 100 µm in tutte le immagini. Clicca qui per visualizzare una versione più grande di questa figura.
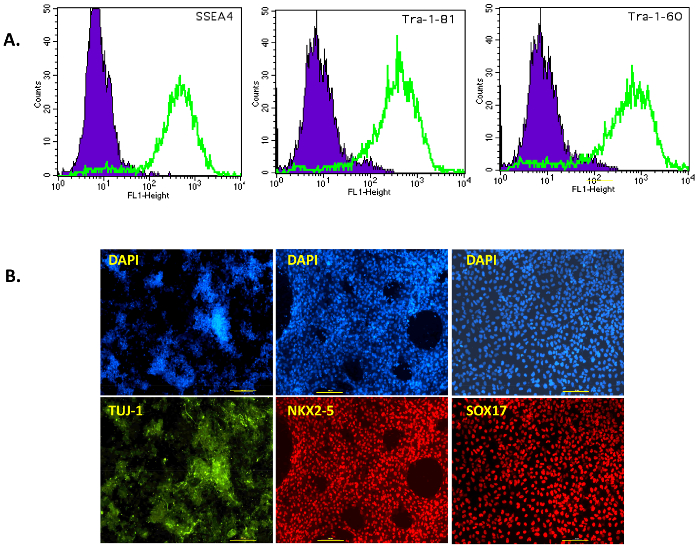
Figura 3: caratterizzazione di pluripotenza e differenziazione potenziali di iPSC. (A), FACS analisi di marcatori di superficie SSEA4, TRA-1-60 e TRA-1-81 in iPSCs privo di alimentatore. Le cellule erano dissociate a sospensione unicellulare e macchiate per gli indicatori di superficie SSEA-4, 1-TRA-60 e TRA-1-81. Il picco viola contiene cellule negative (controllo dell'anticorpo) iPSC e iPSC del pancreas può essere visualizzato come il picco verde. (B) la formazione immagine immunofluorescente dei geni marcatori di strato del germe. L'espressione di ectoderma marcatori TUJ1 (verde), mesoderma NKX2-5 (rosso) e SOX17 endoderma (rosso) in cellule dopo differenziazione diretto di iPSC pancreatico. Corrispondente controllo nucleare macchia DAPI è blu. Tutte le immagini sono state scattate a 100 ingrandimenti. Scala bar = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: schema di strategia di eliminazione CRISPR/Cas9. Una coppia di sgRNA è stato progettato (contrassegnato rosso) con BsaI tagliati siti alla fine (mostrata come F e R) preferibilmente targeting il primo esone, ricotto, clonato in BsaI digerito modificate vettore (pCR2.1, BsaI sito evidenziato grigio), sequenziato e in vitro tradotto. La sequenza di sottolineato del vettore Mostra la parte eliminata dopo BsaI digestione. La posizione di screening degli iniettori è indicata in blu. Cas9 e guida RNAs erano nucleofected in iPSC alimentatore-libero come un complesso per delezioni genomiche. iPSCs erano poi singola cella ordinato in piastre da 96 pozzetti MEF, coltivate, trasferito alla membrana, ampliato e proiettato dall'analizzatore di frammento. Per eseguire gli esempi sull'analizzatore, DNAs genomic di Cas9 e cloni di guida transfettata sulla membrana sono stati estratti e passati attraverso la miscela di gel/colorante nell'analizzatore per selezionare per potenziali cloni 'modificati' (in basso al centro). I marcatori di scala rilevanti, WT e potenziali cloni modificati sono contrassegnati. L'espressione del gene è stata confermata da estrazione di RNA e l'analisi con Q-PCR. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Riprogrammazione di cellule somatiche umane per iPSCs ha fornito una spinta importante ai campi di ricerca di base di biologia, medicina personalizzata, modellazione di malattia, lo sviluppo di farmaci e medicina rigenerativa16. Molti metodi attuali e ampiamente usati di iPSC umana generazione richiedono l'uso di virus con il rischio di integrazione nel genoma ospite o episomal vettori con bassa efficienza di riprogrammazione. Qui, presentiamo un metodo efficiente per la generazione iPSCs privo di alimentatore da cellule pancreatiche umane con virus di Sendai, che conduce a 'impronta gratis' e riprogrammazione efficiente. La risultante iPSCs umane sono liberi di transgeni virale, mantenere la pluripotenza ed evitare l'uso di fattori esogeni sconosciuti. La generazione di iPSCs in condizioni prive di alimentatore ha bassa efficienza riprogramma, così abbiamo riprogrammato le cellule pancreatiche primarie su cellule di alimentatore e quindi spostato le colonie alla membrana senza alimentatore per espansione, la cultura e la caratterizzazione. La fusione di queste tecniche fornisce stabile, affidabile e più efficiente programmazione iPSC.
Abbiamo anche generato iPSCs da fibroblasti umani e di altre cellule primarie con questo metodo, che suggerisce che il virus di Sendai può essere utilizzato per riprogrammare l'ampia varietà di cellule. Importanti considerazioni sono: la necessità di confluenza ottima di cellule primarie per essere riprogrammato come troppi o troppo pochi impatti di cellule riprogrammazione efficienza; un precedente passaggio di cellule primarie quando le cellule si dividono ancora in modo ottimale; un'attenta titolazione del virale vettori che risultati nell'apoptosi delle cellule minimo e un'alta efficienza portando a facile prelevamento delle colonie robuste; Verifica la perdita di espressione del transgene vettoriale Sendai dalla PCR a 10-15 passaggi affinché le iPSCs siano 'impronta gratis'; e rigorose condizioni sterili per coltura di iPSC sulla membrana.
Abbiamo usato un metodo conveniente ed efficiente di modificazione del genoma CRISPR di modificare il genoma di iPSC. Questa tecnica combina proteine Cas9 e sgRNA, RNP complessi a riconoscere e a fendere le sequenze di DNA complementare. Può essere facilmente adattato a una sequenza genomica di destinazione semplicemente cambiando la guida bp 20 RNA. Il nostro metodo fornisce un semplice protocollo per efficiente ed editing di iPSCs umana in quanto sono più laboriosi, difficile trasduce riproducibile e costoso da mantenere rispetto alle altre cellule. Progettiamo guide adiacenti ma non sovrapposte almeno due per ogni gene di destinazione affinché un singolo set di primer di screening può essere utilizzato per lo screening di cloni modificati. Inoltre, l'utilizzo di due guide ~ 30-100 bp apart genera una grande omissione, che possa essere facilmente visualizzata durante la selezione preliminare e garantisce lo svuotamento della proteina. Le guide possono essere testate in cellule HEK-293 inizialmente per stimare l'efficienza prima di iniziare l'analisi in iPSC. Inoltre, è fondamentale per stabilire i parametri per la transfezione routine di reagenti in iPSC. Utilizzando pMAXGFP plasmide, l'efficienza di trasfezione di > 80% e gene targeting/disgreganti efficienze di 3-10% in iPSCs sono regolarmente raggiunto. La consegna diretta di complessi Cas9 RNP nelle cellule nel nostro protocollo fornisce un'azione rapida e veloce turnover e mantiene alti tassi di modificazione mirata. Il nostro approccio impiega singola cella ordinamento seguito nucleofection delle guide e della proteina Cas9, superare un ostacolo significativo di gene targeting in iPSC popolazione mista e garantendo il clonality delle cellule. Questo approccio globale 'romanzo' è semplice, facile da multiplex, prende solo un paio di settimane e non richiede alcuna selezione antibiotica. Non abbiamo osservato alcuna perdita in termini di efficienza introducendo in sequenza le eliminazioni eseguite da CRISPRs in una linea cellulare o iPSCs, sebbene analisi deve essere eseguita in tali casi per garantire stabilità genomica del cariotipo. I cloni dovrebbero anche essere controllati per l'espressione di marcatori di pluripotenza. Anche se, non un focus di questa pubblicazione, questo protocollo può essere cooptato per indurre la modificazione genetica precisa includendo il modello di riparazione nella transfezione cocktail17,18.
Infine, basandoci sulla nostra esperienza, sono considerazioni importanti per iPSC protocollo di editing: progettazione razionale di guide per minimizzare o evitare del tutto off mutazioni di destinazione soprattutto nella regione dei"semi" o vicino motivo PAM viene modificato; ottimizzare l'efficienza di nucleofection in iPSCs per garantire la consegna della RNP; Verifica della qualità dei preparati guide; titolazione di guida e le concentrazioni di proteina Cas9 e convalida la loro attività tramite fenditura biochimici in vitro dosaggi o come descritto in questo articolo in cellssuch umano come HEK cellule che sono più facili da cultura e transfect; utilizzare dei primi iPSCs di passaggio che sono in ritardo di fase di crescita e di raggiungere confluency di ~ 50%; attenta gestione delle cellule con il mezzo di dolce si modifica in seguito a singola cella ordinamento per garantire la sopravvivenza delle cellule.
Noi crediamo che il protocollo descritto sopra delineato in maniera sufficientemente dettagliata equipaggerà i lettori con una tabella di marcia alla generazione e alla modifica di iPSC in modo riproducibile.
Divulgazioni
BT è dei membri fondatori di ristrutturare Biosciences Inc.
Riconoscimenti
Lavoro in laboratorio è stato sostenuto da postdoctoral fellowship grant a Dr. Anjali Nandal e grant esplorativo da Maryland Stem Cell Research Fund a BT (TEDCO).
Materiali
| Name | Company | Catalog Number | Comments |
| Sendai viral vectors - CytoTune-iPS 2.0 Kit | Invitrogen | A16517 | Thaw on ice; S No: 1 |
| Trypsin EDTA | Gibco Life Tech | 25300-054 | 0.05%, 100 ml; S No: 2 |
| Rock inhibitor (Y-27632) | Milipore | SCM075 | Use 10 μM; S No: 3 |
| DMEM/F-12 medium | Invitrogen | 11330-032 | S No: 4 |
| Serum replacement (KSR) | Gibco | 10828028 | S No: 5 |
| DMEM | Invitrogen | 11960069 | 1X; S No: 6 |
| Fetal bovine serum | Thermo Scientific | SH30071.03 | Aliquot; S No: 7 |
| L-glutamine (Glutamax, 100X), liquid | Thermo Scientific | 35050061 | 1/100; S No: 8 |
| Non-Essential Amino Acids | Gibco | 11140-050 | 1/100; S No: 9 |
| 2-Mercaptoethanol | Gibco | 21985023 | 55 mM, 1/1,000; S No: 10 |
| Hausser Hemacytometers | Hausser Scientific | 02-671-54 | S No: 11 |
| 0.1% Gelatin Solution | STEMCELL Technologies | 7903 | Incubate at 37º C for 1 hour; S No: 12 |
| SSEA-4 antibody | Santacruz | sc-21704 | 1/100; S No: 13 |
| TRA-1-81 antibody | Cell Signaling | 4745S | 1/200; S No: 14 |
| OCT4 antibody | Santa Cruz | sc-5279 | 1/1,000; S No: 15 |
| Collagen I, Rat Tail | Life Technologies | A10483-01 | Keep cold; S No: 16 |
| Alexa Fluor fluorescent 488/ 568 (secondary antibodies) | Invitrogen | A21202/A10042 | 1/2,000; S No: 17 |
| DPBS | Hyclone | SH30028LS | 1X; S No: 18 |
| 100-mm tissue culture dish | Falcon | 353003 | S No: 20 |
| 96-well tissue culture plate | Falcon | 353078 | S No: 21 |
| 6-well tissue culture plate | Falcon | 353046 | S No: 22 |
| Dissecting scope | Nikon | SMZ745 | S No: 23 |
| Picking hood | NuAire | NU-301 | S No: 24 |
| 15 ml Centrifuge Tube | Greiner Bio-One | 188271 | S No: 25 |
| 50 ml Centrifuge Tube | Greiner Bio-One | 227261 | S No: 26 |
| Sodium pyruvate | Invitrogen | 11360 | S No: 28 |
| β-mercaptoethanol | Sigma | M7522 | S No: 29 |
| Prigrow III medium | ABM | TM003 | S No: 31 |
| Countess™ Cell Counter | Invitrogen | C10227 | S No: 32 |
| Faxitron X-ray system | Faxitron | CellRad | S No: 33 |
| Accutase | Innovative cell Technologies | AT-104 | S No: 34 |
| Collagenase | Life Technologies | 17104019 | 1mg/ml stock; S No: 35 |
| Dispase | STEMCELL Technologies | 7923 | S No: 36 |
| hESC qualified matrigel | BD Biosciences | 354277 | To dilute, use cold DMEM/F-12; S No: 37 |
| bFGF | R & D | 233-FB | Stock 10 ug/ml; S No: 38 |
| Paraformaldehyde | EMS | 15710 | 4% stock in PBS; S No: 39 |
| TRA-1-60 | Santa Cruz | sc-21705 | 1/100; S No: 40 |
| NANOG | ReproCELL | RCAB0004P-F | 1/100; S No: 41 |
| Tween 20 | Sigma | P9416-100ML | S No: 42 |
| Alkaline Phosphatase kit | Stemgent | 00-0055 | S No: 43 |
| Cas9 protein | PNA Bio | CP01-50 | Thaw and aliquot; S No: 44 |
| Goat or donkey serum | Sigma | D9663/G9023 | S No: 45 |
| Triton X-100 | Sigma | X100-100ML | S No: 46 |
| DAPI | Thermo Scientific | D1306 | S No: 47 |
| Tris | Sigma | 9285-100ML | S No: 48 |
| NaCL | Sigma | S7653-250G | S No: 49 |
| EDTA | Sigma | BP2482-500 | S No: 50 |
| T4 DNA ligase | NEB | M0202T | S No: 51 |
| Mega Shortscript T7 kit | Thermo Scientific | AM1354 | S No: 52 |
| Mega Clear kit | Thermo Scientific | AM1908 | S No: 53 |
| SMC4 | BD Biosciences | 354357 | S No: 54 |
| Fibronectin | STEMCELL Technologies | 7159 | S No: 55 |
| CloneJET cloning kit | Thermo Scientific | K1232 | S No: 56 |
| Fragment analyzerTM | Advanced Analytical | S No: 57 | |
| mTeSR1 medium kit | STEMCELL Technologies | 5850 | Warm to room temperature; S No: 58 |
| Freezing medium mFreSR™ | STEMCELL Technologies | 5855 | S No: 59 |
| Freezing medium CryoStor® | STEMCELL Technologies | 7930 | S No: 60 |
| MEFs | Globalstem | GSC-6301G | S No: 61 |
| L-glutamine | Invitrogen | 25030081 | S No: 62 |
| Human pancreatic cells | ABM | T0159 | S No: 63 |
| STEMdiff™ Neural Induction Medium | Stemcell Technologies | 5835 | S No: 64 |
| RPMI | Thermofisher | 11875-093 | S No: 65 |
| 2% B27-insulin | Thermofisher | A1895601 | S No: 66 |
| CHIR99021 | Stemcell Technologies | 72052 | S No: 67 |
| IWP4 | Stemcell Technologies | 72552 | S No: 68 |
| 2% B27 | Thermofisher | 17504044 | S No: 69 |
| MCDB 131 | Life Technologies | 10372019 | S No: 70 |
| Sodium bicarbonate | Sigma-Aldrich | S8761-100ML | S No: 71 |
| Glucose | Sigma-Aldrich | G8270-100G | S No: 72 |
| BSA | Proliant | 68700 | S No: 73 |
| GDF8 | Pepro-Tech | 120-00 | S No: 74 |
| TUJ1 antibody | EMD Milipore | AB9354 | S No: 75 |
| NKX2-5 antibody | Santa Cruz | Sc-14033 | S No: 76 |
| SOX17 antibody | R & D systems | AF1924 | S No: 77 |
| Propidium iodide | Thermo Scientific | P3566 | S No: 78 |
| Amaxa 4D-nucleofector™ | Lonza | AAF-1002 | S No: 79 |
| FACSAria II (cell sorter) | BD biosciences | SORP UV | S No: 80 |
Riferimenti
- Malik, N., Rao, M. S. A review of the methods for human iPSC derivation. Methods Mol. Biol. 997, 23-33 (2013).
- Yu, J., et al. Induced pluripotent stem cell lines derived from human somatic cells. Science. 318, 1917-1920 (2007).
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Sommer, C. A., et al. Induced pluripotent stem cell generation using a single lentiviral stem cell cassette. Stem cells. 27, 543-549 (2009).
- Macarthur, C. C., et al. Generation of human-induced pluripotent stem cells by a nonintegrating RNA Sendai virus vector in feeder-free or xeno-free conditions. Stem cells Int. , 564612(2012).
- Li, H. O., et al. A cytoplasmic RNA vector derived from nontransmissible Sendai virus with efficient gene transfer and expression. J Virol. 74, 6564-6569 (2000).
- Fusaki, N., Ban, H., Nishiyama, A., Saeki, K., Hasegawa, M. Efficient induction of transgene-free human pluripotent stem cells using a vector based on Sendai virus, an RNA virus that does not integrate into the host genome. Proc. Jpn. Acad. Ser. B, PhysBiol. Sci. 85, 348-362 (2009).
- Nakagawa, M., et al. A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells. Sci. Rep. 4, 3594(2014).
- Hockemeyer, D., Jaenisch, R. Induced Pluripotent Stem Cells Meet Genome Editing. Cell stem cell. 18, 573-586 (2016).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 169, 559(2017).
- Komor, A. C., Badran, A. H., Liu, D. R. CRISPR-Based Technologies for the Manipulation of Eukaryotic Genomes. Cell. 168, 20-36 (2017).
- Sander, J. D., Joung, J. K. CRISPR-Cas systems for editing, regulating and targeting genomes. Nat. Biotech. 32, 347-355 (2014).
- McElroy, S. L., Reijo Pera, R. A. Preparation of mouse embryonic fibroblast feeder cells for human embryonic stem cell culture. CSH Protoc. 2008, (2008).
- Lian, X., et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling. Proc. Natl. Acad. Sci. U.S.A. 109, E1848-E1857 (2012).
- Rezania, A., et al. Reversal of diabetes with insulin-producing cells derived in vitro from human pluripotent stem cells. Nat. Biotech. 32, 1121-1133 (2014).
- Shi, Y., Inoue, H., Wu, J. C., Yamanaka, S. Induced pluripotent stem cell technology: a decade of progress. Nat. Rev. Drug Discov. 16, 115-130 (2017).
- Wang, B., et al. Highly efficient CRISPR/HDR-mediated knock-in for mouse embryonic stem cells and zygotes. BioTechniques. 59, (2015).
- Liang, X., Potter, J., Kumar, S., Ravinder, N., Chesnut, J. D. Enhanced CRISPR/Cas9-mediated precise genome editing by improved design and delivery of gRNA, Cas9 nuclease, and donor DNA. J Biotech. 241, 136-146 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon