Method Article
C. elegans кишечника как модель для межклеточных люмен морфогенеза и In Vivo поляризованной мембраны биогенеза на уровне одной ячейки: маркировка Пятнать антитела, RNAi потери функции анализа и обработки изображений
В этой статье
Резюме
Прозрачный C. elegans кишечника может служить в качестве «в vivo ткани палата» для изучения apicobasal мембраны и Люмене биогенеза на одну ячейку и субклеточном уровне во время многоклеточных tubulogenesis. Этот протокол описывает, как сочетать стандартные маркировки, потеря функции генетических/RNAi и микроскопических подходов к вскрыть этих процессов на молекулярном уровне.
Аннотация
Мультиклеточные трубы, базовых единиц всех внутренних органов, состоят из поляризованные эпителия или эндотелиальных клеток, верхушечный мембран подкладки люмен и базолатеральной мембраны, связавшись с друг друга и/или внеклеточного матрикса. Как эта асимметрия отличительные мембрана создана и поддерживается в течении морфогенеза орган все еще нерешенный вопрос о клеточной биологии. Этот протокол описывает C. elegans кишечника как модель для анализа биогенеза поляризованной мембраны при морфогенеза трубки, с упором на апикальной мембраны и Люмене биогенеза. C. elegans однослойные двадцать клеток кишечного эпителия аранжирован в простой на двусторонней основе симметричных трубки, позволяющих анализ на уровне одной ячейки. Поляризацию мембраны происходит одновременно с поляризованными деление клеток и миграции в раннем эмбриогенезе, но de novo поляризованных мембраны биогенеза продолжается в течение всего роста, когда клетки больше не размножаются и двигаться. Последняя настройка позволяет отделить субцеллюлярные изменения, которые одновременно посредником эти различные поляризационные процессы, трудно отличить в большинстве моделей полярности. Верхушечный, базолатеральной мембраны-, соединительной-, цитоскелета- и endomembrane компонентов может быть помечены и отслеживается GFP синтез белков на протяжении развития или оценены в situ Пятнать антитела. Вместе с организма генетических универсальность C. elegans кишечника таким образом обеспечивает уникальный в vivo модель для визуального, развития и молекулярно генетический анализ поляризованной мембраны и биогенеза трубки. Конкретные методы (все стандартные) описанные здесь включают как: этикетка кишечных субцеллюлярные компоненты путем пятнать антитела; анализ генов, участвующих в поляризованной мембраны биогенеза исследования потери функции адаптированы к обычно основные tubulogenesis генов; оценить полярности дефектов на разных этапах развития; интерпретировать фенотипов эпифлуоресцентного, дифференциальной помехи контраст (ОПК) и confocal микроскопии; определить дефекты. Этот протокол может быть адаптирована для анализа любого из зачастую весьма сохранены молекул, участвующих в эпителиальных полярности, мембраны биогенеза, трубки и Люмене морфогенеза.
Введение
Поколение клеточном и субклеточном асимметрии, таких как формирование поляризованной мембраны доменов, имеет решающее значение для морфогенеза и функции клеток, тканей и органов1. Исследования на поляризованной мембраны биогенеза в эпителия остаются технической проблемой, поскольку направленного изменения в распределении субцеллюлярные компоненты зависят от нескольких подряд и совпадающих внеклеточные и внутриклеточных сигналов, которые трудно отделить в большинстве моделей и сильно зависят от модели системы. Модели представленные здесь - однослойная Caenorhabditis elegans кишечника - это ткани изысканная простота. Вместе с одной ячейкой C. elegans выделительной канал (см. сопроводительный документ на поляризованной мембраны биогенеза в C. elegans выделительной канал)2, он предоставляет несколько уникальных преимуществ для идентификации и характеристика молекулы, необходимые для биогенеза поляризованной мембраны. Сохранению молекулярных полярности сигналы от дрожжей человеку сделать этот простой беспозвоночных орган отлично «в vivo ткани палата» на вопросы об эпителиальных полярности которые имеют непосредственное отношение к системе человека, который до сих пор слишком комплекс для обеспечения визуального рассечение этих событий на сингл ячейки уровня в естественных условиях.
Хотя несколько сохранившихся полярности сигналы от матрица (1 extracelluar, (2 плазматической мембраны и его узлов и (3) внутриклеточных везикулярного людьми были определены3, основополагающие принципы их интеграции в процессе Поляризованные эпителиальных мембраны и ткани биогенеза является плохо понимали4. Модели классических одноклеточных в vivo (e.g.S. cerevisiae и C. elegans зиготы) играют важную роль в определении принципов поляризованные деление клеток и передней задней полярности и определили критических связанный мембранами полярности детерминанты (небольшой GTPases/CDC-42, разметка дефектных PARs)5,6, но они зависят от уникальных симметрии сигналы (бутон шрам, спермы запись) и отсутствие безопасного соединения apicobasal мембраны домены и, предположительно, соответствующий внутриклеточных apicobasal, сортировка машин. Наши текущие знания о организации поляризованные оборота эпителия, однако, главным образом опирается на млекопитающих 2D монокультур7, которых недостает физиологических внеклеточные и развития сигналы, которые могут изменить позиции мембраны домены и направления торговли людьми траекторий (переход от 2D к 3D в vitro системах культуры только достаточно поменять полярность мембраны в клетках MDCK (Мадин-Дарби собак почек))8. В естественных условиях развития исследования по эпителиальных полярности в беспозвоночных модельных организмов первоначально проводились в плоского эпителия, например в эпидермисе Drosophila melanogaster , где они выявили решающий вклад Джанкшен динамики миграции поляризованные ячейки и ячейки листа движения9и endocytic торговли полярности обслуживания10. 3D в пробирке и в естественных условиях анализа люмен морфогенеза в трубчатых эпителия в MDCK клетках и в C. elegans ЖКТ, соответственно, недавно определили требования внутриклеточных людьми для де Нову (верхушечно) домен и биогенеза люмен и позиционирования11,12,13. Толщина от трубчатые (по сравнению с плоским) эпителиальных клеток является преимуществом для 3D анализа субцеллюлярные асимметрии так как он позволяет улучшенные визуальные различия верхушечно lumenal мембрану, apico боковое развязок, боковые мембраны и позиции внутриклеточных органелл. Эти визуальные преимущества, в C. elegans модель добавляет параметр в vivo , развития оси, прозрачность, простота план тела, инвариантные и определенных клеток линии, аналитический (генетических) и дополнительные преимущества, описанные ниже.
C. elegans сам является аскариды трубчатой структуры, чьи прозрачности и простая архитектура сделать его также трубчатые внутренних органов непосредственно доступными для визуального анализа трубки и Люмене морфогенеза. Двадцать клетки его кишечника (по случаю 21 или 22 клетки)14 являются производными от одного прародителя ячейки (E) и развиваются из эпителия двуслойная путем интеркаляции шаг в двустороннем симметричные трубку девяти INT колец (четыре клетки в первое кольцо; Рис.1 схема)14,,1516. Кишечника тканей и линии анализ, первоначально определяется Номарски оптики через ядерных тождества17и впоследствии микроскопии флуоресцирования через обозначенные мембран, оказывает критическое понимание его морфогенеза, в частности клеток автономной и клеток неавтономной требования к его направленного клеточных делений и движений (например, интеркаляции, справа слева асимметрии, передняя и задняя труба вращения)14,18 . Ранние эндодермы клеток спецификации и гена регулирования сети, контроль развития этого органа клоновых модели являются хорошо характеризуется19,20. В центре внимания здесь, однако, находится на анализе поляризованной мембраны и биогенеза Люмене в одиночных клетках трубчатых и внутриклеточных асимметрий endomembranes, цитоскелета структур и органеллы, которые сопровождают этот процесс. Анализ способствует простота этой трубки, где все апикальной мембраны (на ультраструктурные уровне отличается микроворсинки) сталкиваются просвета и все базальной мембраны торцевые поверхности наружной трубы, с боковой мембраны связаться друг с другом, отделенный от апикального мембраны развязок (схемарис 1 ; см. ссылки (2116,) для C. elegans-конкретной организации туго и adherens соединения компонентов). Апикальном мембрана биогенеза таким образом совпало с люмен морфогенеза. Кроме того размер взрослых клеток кишечника - крупнейший клетки этот зверек (с исключением выделительной ячейки) - примерный размер клеток млекопитающих, позволяющие в vivo визуального отслеживания субцеллюлярные элементов, например везикул траектории, которые обычно является попытка в пробирке в культуры блюдо.
Для целей данного анализа клеточном и субклеточном соответствующие маркировки имеет решающее значение. Кишечные Эндо - или плазматической мембраны домены, перекрестки, цитоскелетаструктуры, ядер и других внутриклеточных органелл могут быть визуализированы, снабдив их конкретные молекулярные компоненты. Многие такие компоненты были и продолжают быть обнаружены (Таблица 1 дает несколько примеров и относится к ресурсам). Например различные молекулы, отличающие трубчатых или везикулярного отсеков кишечных endomembrane системы, от ER Гольджи через пост Гольджи везикулы в плазматической мембране, были определены22. Конкретные белки (а также липиды и сахара) может либо быть помечены прямо или косвенно через привязки белков. Этот протокол посвящен в situ антитело пятная фиксированной образцов, один из двух стандартных методов маркировки (см сопроводительный документ на выделительную канал tubulogenesis для описания других техника2 - в естественных условиях маркировки через флуоресцентный протеин сплавливания - которые непосредственно применимо к кишечника; Таблица 2 примеры кишечника конкретных промоутеров, которые могут использоваться для привода выражение такого синтеза белков в кишечнике). Двух - или несколько маркировки с любой подход, или сочетанием обоих плюс дополнительные химические окраски, позволяет более углубленного визуальные резолюции и изучение пространственных и временных изменений в совместно локализации и набор конкретных молекулы или внутриклеточных компонентов (Рисунок 2). Фиксации и окраски процедуры, описанные в этом протокол поддержки сохранения зеленого флуоресцентного белка (ГПУП) маркировки во время процедуры иммуноокрашивания. Для изображений, ключевые точки обнаружения и характеристика tubulogenesis фенотипов через микроскопические стандартных процедур (рассечения и конфокальной микроскопии флуоресцирования), описалРисунок 3, 4 (). Это может распространяться на более высокое разрешение изображений подходы, для экземпляра сверхразрешение микроскопии и передачи электронной микроскопии (здесь не описывается).
Сила ключа этой системы является способность анализировать полярности в отдельных ячейках на разных этапах своего развития, от эмбриогенеза до зрелого возраста. Например домен и Люмене биогенеза апикальном мембрана может отслеживаться на протяжении развития на уровне одной ячейки через маркировки с ERM-1, высоко сохранены мембраны актина компоновщика Эзрин-Radixin-Moesin семьи23,24 . ERM-1 визуализирует биогенеза апикальной мембраны (1) во время эмбрионального трубки морфогенеза, когда это происходит параллельно с поляризованными деление клеток и миграции (клетки передвигаться вершине люмен во время интеркаляции)15; (2) во время позднего эмбриональных и личинок трубки расширение, которое продолжается в отсутствие деления клеток или миграции; и (3) в кишечнике взрослых, где поляризованной мембраны домены поддерживаются (рис. 1). В эпителии расширения после митотическая личиночной de novo поляризованной мембраны биогенеза таким образом может быть отделена от поляризации ткани морфогенеза, что невозможно в большинстве моделей эпителиальных полярности в vivo и in vitro , числе с одной ячейкой резолюции (например 3D MDCK кисты модель8). С маркировка для других компонентов, этот параметр обеспечивает возможность (особенно на L1 личиночной стадии, когда клетки имеют более высокий коэффициент цитоплазме/ядро) отличить эти внутриклеточные изменения, которые являются специфическими для поляризованной мембраны биогенеза ( например переориентации торговли людьми траекторий) от тех сопутствующе обстоятельств необходимых для поляризованные деление клеток и миграции.
Генетическая универсальность C. elegans хорошо известно25и делает его мощная модель системы для молекулярного анализа любых биологических вопрос. Исследование на морфогенеза, например, можно начать с одичал тип деформации, трансгенных штамм, где структура интереса (например мембраны) помечается с флуоресцентных маркеров, или потеря получить из функции или мутант с дефектом в этом структура. Типичный обратный генетическое исследование может генерировать мутант, где удаляется гена интереса в микрофлорой (например , целевых удаления), изменена мутагенез (обычно производит точечные мутации с последующей потерей, сокращение или увеличение функции гена) или где его транскрипт уменьшается на РНК-интерференции. Простота RNAi кормления в C. elegans26 также поддается разработке целенаправленных экранов, которые изучить более крупной группы генов интерес. Возможно сильной генетической модели организма является способность поведения в естественных условиях вперед экраны (например мутагенеза, систематических или геном общесистемной RNAi экраны), разрешающие расследование беспристрастной молекулярных причина фенотип интерес. К примеру, беспристрастной visual C. elegans RNAi tubulogenesis экран, начиная с трансгенных животных с ERM-1-меченых апикальной мембраны, обнаружили интригующий реверсивные кишечных полярности преобразования и внематочная люмен фенотип, используемые Здесь в качестве примера для этого типа анализа. Этот экран истощение гликосфинголипиды (GSLs; облигатные мембранных липидов, выявленных через их GLS-биосинтетических ферментов) и компоненты Клатрин пальто везикул и его AP-1 адаптер названы конкретные молекулярные дефекты, вызывая этом полярность фенотип преобразования, тем самым характеризуя эти людьми молекул как в естественных условиях Кии апикальном мембрана полярности и Люмене позиционирования12,13. Когда начиная с конкретных генетических мутаций/морфогенеза фенотип, такие экраны (или одной генетической/RNAi взаимодействия эксперименты) можно также проанализировать функционального взаимодействия между двумя или несколькими генов интерес (см. сопроводительный документ на выделительную 2канала в качестве примера такого анализа). Этот протокол фокусируется на РНК-интерференции, который, в дополнение к его способности напрямую идентифицировать ген, потеря которых причины фенотипа вперед экранах, предоставляет особые преимущества для анализа морфогенеза. Поскольку продукты гена, направляя морфогенеза часто работают в зависимости от дозы моды, RNAi обычно успешно в генерации спектр фенотипов. Способность создавать информативные частичной потери функции фенотипов также помогает для решения этой проблемы, что большинство важных tubulogenesis генов имеют важнейшее значение и что их потери вызывают бесплодие и ранних эмбриональных летальность. Этот протокол включает условное RNAi стратегии для преодоления этой трудности и предлагает способы оптимизации поколения широкого спектра фенотипы, например аллельные серии, производимые мутагенеза.
протокол
1. Маркировка в C. elegans кишечнике
Примечание: увидеть сопроводительный документ авторами на анализе выделительной канал tubulogenesis 2 для строительства конкретных флуоресцентные маркер ткани плазмиды и создания трансгенных животных, в том числе обсуждение транскрипционный анализ и трансляционная фьюжн белков (последний для субцеллюлярные локализации молекулы интерес). Эти процедуры могут быть адаптированы с помощью конкретных промоутеров для привода молекулы интерес в кишечник. Таблица 1 примеры молекул, доказано полезным для визуализации кишечные нематоды Caenorhabditis elegans эндо - и плазменных мембран и их соединениях, Таблица 2 примеры промоутеров для вождения выражение в кишечник, см и Таблица 3 ресурсов для более всеобъемлющей коллекции кишечные маркеров и промоутеров.
- Антитело пятная C. elegans кишечника
- 27 , 28
- фиксации
- взять на чистой стеклянное скольжение и использовать поли L-лизин в генерировать тонкой пленки для червей держаться на. Место 30 мкл 0,1-0,2% поли L-лизин на слайд и место второго слайда на поли L-лизин падение сделать " сэндвич ". Затем руб слайды плавно несколько раз намочить всю поверхность обоих и пусть воздух сухой для 30 мин Label стороне матового слайды с карандашом.
Примечание: 0,2% поли L-лизин аликвоты 200 мкл были сделаны путем растворения порошка в dH 2 O; Это может храниться при-20 ° C. Использование высокомолекулярного поли L-лизин, для улучшения, торчащие из червей. Важно также концентрация поли L-лизин. Слишком низких концентрациях не допустит червей на палку, но слишком высоких концентрациях может генерировать флуоресценции фонового сигнала. Слишком толстый фильм может ослабить во всей его полноте. - Место плоский металлический блок твердо стоит на нижней части контейнера (например полистирола контейнеров), заполнены с жидким азотом.
Примечание: Можно использовать вместо сухого льда, но жидкого азота держит блок металла более стабильной на дне контейнера и озноб хорошо. - Собрать червей либо путем мыть их покинуть их пластины с M9 29 или выбрать различные стадии червей (либо яйца, L1, L2, L3 и L4 личиночной стадии черви) на каждый слайд. Как правило выберите ~ 100 личинок и эмбрионы или ~ 20 взрослых к каждому слайду. Место 10 мкл смывается червей на середине слайда или забрать яйца/червей в 10 мкл M9 или 1 x 10 мкл PBS 27 (-фосфатный буфер).
- Использование пипетки разложить большое количество червей во избежание слипания.
Примечание: Смешанных популяций смывается червей, из-за скученности и различные толщины этапов, не прилипают также и являются менее эффективного замораживания трещины (см. ниже), поэтому комплектации стадии конкретных червей (или синхронизированные населения) дает превосходные результаты. Личинки палку лучше, чем взрослые и более животных могут быть размещены на слайд. - , Прежде чем собирание червей на слайды, перевести их на пластине среднего роста нематода (НГМ) 29 без ОР50 бактерий. Избыток бактерий приверженцем черви могут также столкнуться с прилипания. Заботиться, что черви не сухим из.
- Использование пипетки разложить большое количество червей во избежание слипания.
- Мягко место (капля) 22 × 22 мм coverslip кросс пути на вершине собранные червей, таким образом, чтобы его края свисать на по крайней мере одной стороне слайда. Нажмите прямо вниз нежно но твердо с одним или двумя пальцами на coverslip. Избегайте резки, что нанесет ущерб целостности тканей.
- Сразу и осторожно передача слайд на металлических блок в жидком азоте и пусть сидят около 5 минут для замораживания. Затем " Флик от " coverslip в одном swift перемещение с помощью нависающие края.
Примечание: Этот шаг необходимо решительно и хотя слайд замораживается до достижения " крекинг " кутикулы. Предупреждение: Пожалуйста, следуйте СИЗ (средства индивидуальной защиты) руководящие принципы при работе с жидким азотом. - Погружать замораживания трещины слайды в метанол-заполнены Coplin Стеклянна банка для 5 мин при-20 ° C. Затем перенесите ацетон-заполнены Coplin Стеклянна банка для еще 5 мин при -20 ° C.
Примечание: Метанол и ацетон должны храниться в-20 ° C для по крайней мере 30 минут перед использованием. После фиксации, слайды могут храниться при -20 ° C. Осторожно: метанол и ацетон токсичны. - Удалить слайды из jar и дайте им высохнуть при комнатной температуре (RT) перед использованием на воздухе.
- взять на чистой стеклянное скольжение и использовать поли L-лизин в генерировать тонкой пленки для червей держаться на. Место 30 мкл 0,1-0,2% поли L-лизин на слайд и место второго слайда на поли L-лизин падение сделать " сэндвич ". Затем руб слайды плавно несколько раз намочить всю поверхность обоих и пусть воздух сухой для 30 мин Label стороне матового слайды с карандашом.
- Окрашивания
- окружают области фиксированной червей с тонким слоем вазелина на слайде. Нарисуйте круг вокруг этой области в нижней части слайда, чтобы отметить место.
Примечание: Очень важно, что круг желе остается неизменным на протяжении окрашивание процедуры для предотвращения утечки окрашивания растворов. - Подготовка " влажной камере " в пластичный ящик с крышкой, поместив влажные бумажные полотенца в него. Поместите слайд на решетку в этом " влажной камере " для предотвращения высыхания слайды во время окрашивания.
Примечание: Слайды не должно быть при соприкосновении с водой или друг с другом. - Нежно Пипетка примерно 50 мкл ПБС в круг желе, достаточно для покрытия области. Закрыть " влажной камере " с крышкой. Инкубируйте на RT на 5 мин
Примечание: Чтобы избежать потери червей на этом шаге, не Пипетка PBS непосредственно на червей. Осторожно поместите наконечник пипетки на краю круга и позволяют жидкости разойтись плавно над червей. - Наклона слайд и медленно аспирационная PBS с пипеткой. Поместите слайд назад плоский на стойку и добавьте 50 мкл (или необходимой суммы для покрытия месте) блокирование решения тщательно. Инкубируйте это в зале мокрый в РТ за 15 мин. Во время ожидания, разбавить первичных антител в блокировании решение (см. Таблицу материалов для примеров первичных антител и концентрации).
Примечание: Свеже Подготовьте блокирования решения с помощью 1 x PBS (10 мл), 10% анимации (50 мкл) и сухого молока (0,2 грамма). Количество моющего средства и концентрация молока может варьироваться в зависимости от антитела, которые используются и может потребоваться определяется эмпирически. Аспирации жидкости из слайд является еще одним шагом к легко потерять червей. Проверить прогресс путем изучения слайд под рассечения, но будьте осторожны, что слайд не сухим из. - Наклона слайд и аспирационная от блокирования решения, используя те же меры предосторожности, как описано выше. Место слайд обратно на стойку и медленно добавьте 50 мкл разбавленного основное антитело, используя те же меры предосторожности. Закрыть " влажной камере " и Инкубируйте на 4 ° C на ночь или на более короткие периоды на RT.
Примечание: Время инкубации может потребоваться определяется эмпирически для специфического антитела. - Аспирата от основного антитела решения как для других решений. Затем вымойте слайды с блокировки решение для 10 мин, 3 раза, Добавление и удаление решения таким же образом, как описано выше.
- Добавить вторичные антитела (дневно меченых) разводят в блокирующие решение, инкубировать в РТ за 1 ч. Смотрите Таблицу материалов для примеров вторичных антител и концентрации.
- Удаление вторичных антител и мыть, как указано выше, с блокировкой решение 2 раза и погасить блокирования решения с ПБС втечение 10 мин.
- Прочь аспирационная столько PBS как можно без разрешения образца высохнуть и тщательно удалить желе вокруг образца.
- Добавить одну каплю монтажа средних на образец, и Осторожно поместите coverslip на вершине. Уплотнение края coverslip с ногтей. Место слайды в коробке темный слайд для сохранения окрашивание и хранить в 4 ° C.
Примечание: Хранить слайды в темноте из-за светочувствительность (флюоресценции может исчезать с течением времени) и предотвращения воздействия воздуха, сохраняя их опечатаны, по той же причине. Слайды можно хранить в течение продолжительных периодов времени при 4 ° С или -20 ° с.
- окружают области фиксированной червей с тонким слоем вазелина на слайде. Нарисуйте круг вокруг этой области в нижней части слайда, чтобы отметить место.
- фиксации
2. Вмешательство с помощью функции основных tubulogenesis генов в C. elegans intestine. Пример: RNAi.
Примечание: штаммы C. elegans культивированный на ОР50 бактерии посеян на тарелках NGM согласно стандартных протоколов 29. Для RNAi, C. elegans питаются HT115 интерференции бактерий на RNAi пластины, дополненная 25 мкг/мл carbenicillin и 2 мм ИПТГ (изопропиловый бета D-1-тиогалактопиранозид) для индукции бактериальных промоутер, который генерирует двойной мель РНК (dsRNA) из интродуцированных C. elegans гена. Антибиотики и IPTG концентрации могут варьироваться в зависимости от интерференции клон/библиотека и требуемой прочности интерференции, отв конкретных RNAi клоны могут быть получены из коммерчески доступных генома общесистемной RNAi кормления библиотек (см ( 26 , 30 , 31) для фоновой на кормлении RNAi в C. elegans и Таблица материалов для RNAi библиотек и материалы/реагенты).
- Стандартный RNAi кормления 26 , 31 вывезти RNAi библиотека пластины от-80 ° C и положил его на сухой лед. Удаление Уплотнительная лента и использовать стерильные пипетки подсказка для передачи адэрентных бактерии клон интерес плиты агара фунтов (бульоне Лурия) 29 дополнена 100 мкг/мл Ампициллин и тетрациклин 15 мкг/мл. Полоса бактерий на агаре пластину. Уплотнение пластину библиотеки РНК-интерференции с новой Уплотнительная лента. Расти бактерий на ночь при 37 ° с.
Примечание: Эти плиты агара может храниться при температуре 4 ° C на несколько недель. Новые бактерии могут быть культивировали непосредственно от них, чтобы защитить исходной библиотеки RNAi. - Следующий день, прививать RNAi бактерий от LB агар пластины в 1 мл жидкой среды LB 29 содержащие 50 мкг/мл Ампициллин и встряхнуть для 14 h (8-18) или на ночь на 37 ° C.
Примечание: Для оптимальных результатов используйте свежие бактерии каждый раз. Посмотреть справочник ( 30) для сравнения различных культуры условий (например, сроки культуры). - Следующий день, семян 200 мкл на клон культивировали RNAi бактерий на отдельных плит RNAi. Пусть пластины сухой и оставить на RT на ночь для индукции бактериальный промотор.
- Передачи 4-6 L4-стадии личинки на каждой пластине RNAi. Инкубировать посеян RNAi пластины на RT или 22 ° C для 3-5 дней.
Примечание: Сначала выберите L4 личинок на NGM пластину без бактерий, чтобы удалить сторонник ОР50, которые будут мешать интерференции, или серийно перенести их в новую пластину NGM без ОР50 три раза. Убедитесь, что не загрязнены штаммов, как загрязняющие бактерий - как ОР50 предпочитают пищу для червей - также будет мешать RNAi. При необходимости измените температуру: например, развитие разгона с высокой температурой; штаммы могут быть чувствительна к температуре. - Для развития исследований, проверить фенотипов потомства F1 начиная с дня 2.
Примечание: Важно, чтобы проверить животных часто, чтобы избежать отсутствует внешний вид или прогрессирование фенотип (например маркер перемещения) при оценке поляризованной мембраны биогенеза во время разработки. Обогащение населения F2 для сильной фенотипов (например, выбирая гермафродитки родителя к новой плите RNAi на день 2, чтобы выбрать для наиболее сильно затрагиваемых середине часть их потомства) требуется редко, поскольку спектр от легкой до сильного желательно фенотипов.
- Стандартный RNAi кормления 26 , 31 вывезти RNAi библиотека пластины от-80 ° C и положил его на сухой лед. Удаление Уплотнительная лента и использовать стерильные пипетки подсказка для передачи адэрентных бактерии клон интерес плиты агара фунтов (бульоне Лурия) 29 дополнена 100 мкг/мл Ампициллин и тетрациклин 15 мкг/мл. Полоса бактерий на агаре пластину. Уплотнение пластину библиотеки РНК-интерференции с новой Уплотнительная лента. Расти бактерий на ночь при 37 ° с.
- Условного RNAi
Примечание: RNAi условия могут быть изменены сократить тяжелой, или увеличить мягкие эффекты, или вмешиваться в стадии специально; изменения полезны для полной оценки фенотипические эффекты часто Смертельное tubulogenesis генов.- Личинок RNAi - оценки RNAi эффекты же поколения (мягкий, зависящие от стадии RNAi)
Примечание: для преодоления бесплодия или эмбриональных летальность, или нарушить функции гена на определенной стадии эмбриогенеза пост, RNAi индуцируется в личинки, пост embryonically. Место без лечения яйца (2.2.1.1), беременных взрослых (2.2.1.2) и синхронизированы L1 (либо, при необходимости, позднее этап) личинки (2.2.1.3) на RNAi пластины; Оцените эффекты интерференции в том же поколении, например два дня спустя и далее, в личинок и взрослых.- Забрать 30-50 беременных взрослых в одно падение, Отбеливание решение (раствор 1: 4 10 M NaOH и бытовые гипохлорита натрия) размещены на краю пластины RNAi. Пусть сухой и позволяют Л1С люк и двигаться в бактериальных газон.
Примечание: Решения, как правило, используется для очистки, отбеливания убьет все но эмбрионов в их яичную скорлупу. Таким образом, не ставьте отбеливающий раствор на или вблизи бактерий RNAi. - Выбрать семян ~ 20 молодых беременных взрослых на пластине RNAi и пусть они откладывают яйца на 2-3 ч или до тех пор, пока существует около 300 яиц на пластину, затем обрывать взрослых.
Примечание: Этот метод может вызвать загрязнение RNAi бактерий к ОР50. Чтобы уменьшить этот риск, перевести взрослых на NGM пластину без бактерий для удаления ОР50 приверженцем червей. Заботиться, что взрослые не слишком долго оставаться на RNAi пластины, чтобы избежать эффекта RNAi на эмбрионах. - Выбрать или место L1 стадии червей непосредственно на RNAi пластины (см. ссылку ( 29)-для синхронизации протоколов).
Примечание: Можно использовать сокращенный синхронизации протокол (например для умеренно крупных масштабах set-up) путем промывания червей из густонаселенных пластины с M9 на несколько раз, до тех пор, пока остаются только яйца. После 2-3 ч, инкубационные Л1С затем могут быть собраны в M9 из этих плит, очищены от дополнительных смывки для удаления бактерий (3 x в M9) и посеян на плиты RNAi.
- Забрать 30-50 беременных взрослых в одно падение, Отбеливание решение (раствор 1: 4 10 M NaOH и бытовые гипохлорита натрия) размещены на краю пластины RNAi. Пусть сухой и позволяют Л1С люк и двигаться в бактериальных газон.
- Разрежения RNAi бактерий с пустой вектор RNAi бактерий (мягкий RNAi)
Примечание: сокращение количества двуцепочечной ДНК путем разбавления количество бактерий РНК-интерференции может быть достаточно, чтобы побудить мягкий эффект и может также уменьшить эмбриональных летальность без отмены всех эмбриональных эффектов. Разбавление RNAi бактерий используется также для двойной RNAi экспериментов и титровать условия для взаимодействия генетических экспериментов (например для создания мягкой для оценки повышения и сильные последствия для оценки подавления).- Расти вверх RNAi и emPTY вектор HT115 интерференции бактерий в 1 мл LB среде с 50 мкг/мл ампициллин, как это сделано для стандартных условий RNAi.
- Развести RNAi бактерий с пустой вектор RNAi бактерий для достижения диапазон различных концентраций, например, 5%, 15%, 30%, 50%, 70%. Смешайте бактерии хорошо закупорить вверх и вниз. Пипетка 200 мкл смешанные бактерий на пластину RNAi.
- Выбрать 4-6 L4 личинок на каждой табличке RNAi. Проверьте фенотипа от 2 день вперед.
- Интерференции чувствительных штаммов (сильной интерференции)
- использовать имеющиеся RNAi чувствительных штаммов, например, Эри-1 (mg366), СБР-3 (pk1426) или Эри-1 (mg366) Лин 15Б (n744) (последняя supersensitive) и следуйте стандартные процедуры интерференции, описанные в 2.1 31 , , 32 33.
Примечание: RNAi чувствительных штаммов (например, СБР-3 и Эри-1) возможно ниже выводок размеров, чем одичал тип животных и быть стерильной при 25 ° C. Они также могут иметь низкий фоне собственных фенотипов, например низкий капиллярный эмбриональных летальность, который должен приниматься во внимание при оценке специфические эффекты интерференции.
- использовать имеющиеся RNAi чувствительных штаммов, например, Эри-1 (mg366), СБР-3 (pk1426) или Эри-1 (mg366) Лин 15Б (n744) (последняя supersensitive) и следуйте стандартные процедуры интерференции, описанные в 2.1 31 , , 32 33.
- Личинок RNAi - оценки RNAi эффекты же поколения (мягкий, зависящие от стадии RNAi)
3. В естественных условиях изображений C. elegans кишечника путем рассечения микроскопии флуоресцирования
- до визуализации животных под светом флуоресцирования, проверить RNAi пластины под яркий свет на любой рассечения микроскопа. Оценить (и потенциально записи) фенотипов, видимой в условиях яркого света, которые могут повлиять на анализ, такие как смертоносность, бесплодие (Нижняя количество потомства), развития (например, личинок арест) и другие видимые фенотипов, которые могут помочь характеризуют функции генов, участвующих в поляризованной мембраны биогенеза и Люмене морфогенеза.
Примечание: Только оценка пластины, которые имеют достаточно потомства для оценки (по крайней мере, 50), в противном случае попробуйте альтернативные условия RNAi. Для количественной оценки убедитесь, что пластины не загрязнены или расти ОР50 (что мешает RNAi). - Для визуализации животных под люминесцентные лампы дневного света, снимите крышку и установите пластину RNAi непосредственно под рассечения флуоресцентным микроскопом.
Примечание: Чтобы обнаружить тонкого кишечника фенотипов потребуется рассечения микроскопа с более высокой мощности стерео флуоресценции вложение, которое позволяет достаточно диапазон увеличения. Этот протокол описывает использование область с 1.5 и 10 x цель и масштаб диапазоне от 3,5 до 45. - Сначала найти животных при ярком свете сосредоточиться. Далее, изучение животных под флуоресцентный свет при низком увеличении (например под 1,5 x цель), используя соответствующий фильтр. Изучить пластины систематически от верхнего левого до нижнего правого сканировать весь пластина для фенотипов.
- Выберите животное интерес и измените на 10 x цели. Сосредоточиться на ЖКТ и использовать зум для оценки tubulogenesis/люмен морфогенеза фенотип. В разделе 5 очков фенотипов. Во-первых принимать изображения в низком увеличении. Затем переключиться с большим увеличением.
Примечание: Поскольку здоровых животных двигаться быстро, работает быстро, с одной стороны, на компьютерной мыши для захвата изображений уделяя микроскоп с другой стороны. Замедление животных (например, размещение переходных пластин до 4 ° C) могут не потребоваться при работе с tubulogenesis фенотипов в основном арестован эмбрионов и начале личинки. Изображения могут быть захвачен микроскопа монтируется ПЗС-камеры и программное обеспечение для захвата изображений.
4. Визуализации C. elegans intestine с высоким разрешением, лазерного сканирования конфокальная микроскопия 34 , 35
- монтаж и иммобилизации
- использования пальца тонко распространять небольшое количество жиром или вазелином в круг на слайде стекла (~ 6-8 мм в диаметре).
Примечание: Толщина жира круга имеет решающее значение для монтажа. Для лучших изображений результаты, изображение только один или несколько личинок в то время и использовать ультратонких смазка круг с как мало жидкости как можно скорее таким образом, что животное непосредственно застрял между стеклянное скольжение и крышка выскальзования (если сделано идеально, животное будет быть иммобилизованным без цистит). Монтаж из яиц и старых животных требуют несколько толще круг, чтобы избежать разрушения образца при добавлении крышка выскальзования. - Добавить каплю обычно 3.5 мкл 10 мм раствор азид натрия в середину круга и выбрать червей в нее под микроскопом рассечения.
Примечание: Подготовка запасов раствором азид натрия 1 М путем растворения 65.01 мг NaN3 в 1 мл dH 2 O; Добавьте 200 мкл этой 1 М раствора в 20 мл M9 буфер. Выберите черви быстро в каплю решение азид натрия, чтобы избежать решения сушиться. Выберите этапы отдельно для оптимального монтажа, направленный на около 50 эмбрионов на слайд и около 20 личинок, при рассмотрении крупных групп населения. M9 можно использовать вместо решения азид натрия при выборе эмбрионов. При использовании азид натрия, животные должны отражаться в течение 30 мин, чтобы избежать повреждения тканей этой токсичных химических.
Предупреждение: азид натрия является токсичным. - Осторожно поместите 22 × 22 мм coverslip на слайде. Будьте осторожны, чтобы не подавить червей. Используйте мягкое давление и проверьте под рассекает микроскопом, чтобы убедиться, что черви являются фиксированными хорошо между слайд и крышка выскальзования. Метка слайда.
Примечание: Правильное количество давления важно избежать повреждения образца (слишком много давления) и не хорошо его крепления (слишком мало давление: Животные плавать вместо прилипания к слайду). Плавающие животных по существу исключает соответствующих изображений.
- использования пальца тонко распространять небольшое количество жиром или вазелином в круг на слайде стекла (~ 6-8 мм в диаметре).
- Imaging
- место слайд под конфокального микроскопа. Поиск для червей с 10 x цели и направленности.
Примечание: Используйте яркий свет сосредоточиться, где это возможно избежать Фотообесцвечивание. - Изменения в 60 x или 100 x цель и сосредоточиться на кишечнике.
Примечание: Кишечника может быть легко идентифицирован при ярком свете ее просвета, проходящей через середину животного, от глотки в анус возле кончика хвоста. Будьте осторожны при применении масла для 60 x или 100 x нефти цель. Смешивание различных видов масел может мешать дальнейшей обработки изображений. Место небольшой капли масла на слайд при вертикальном положении микроскопа или на цель при использовании Перевернутый область, стараясь не заражать других целей или части микроскопа. - Установить Колер DIC/Номарски освещение для достижения цели, которые будут использоваться для сканирования 36. Осмотрите животное под люминесцентные лампы дневного света с соответствующим каналом для проверки маркировки кишечника и/или проверить фенотип, чтобы выбрать подходящий образец для изображений. Работа быстро, чтобы избежать отбеливания.
- Переключатель для лазерного сканирования для ограничения перспективные изображения в кишечник, установив сканирования границ на его дорсальной и вентральной стороне.
Примечание: Брекетинга кишечника таким образом имеет решающее значение, если Флюорофор также этикетки структуры вне intestine. Во время этой экспериментальной проверки работаете с быстрой проверки условий для avOID Фотообесцвечивание. - Остановка сканирования для выбора параметров сканирования для эксперимента. Набор 6-20 секций для кишечных сканирования вдоль оси z, например интервалом 0.2 мкм, в зависимости от запроса, этап животных и/или технических соображений. Задайте усреднение за изображения в зависимости от сложности маркировки и требуется разрешение, чтобы уменьшить шум.
Примечание: Установка детали варьируются в зависимости от Микроскоп и экспериментировать. Может понадобиться уменьшить количество секций во избежание обесцвечивания если выполняет последовательное сканирование трех различных флуорофоров. Отрегулируйте количество кадров на количество секций (должно быть меньше, чем количество разделов, чтобы избежать искажения изображения; также весят в увеличение Фотообесцвечивание). обычно достаточно кадры 4-6. - Вернуться к сканирование с окончательным (медленно) лазерного сканирования условия и настройки: яркость (использование минимального прибыль для уменьшения фона); лазерной энергии (как требуется, как низко как можно - увеличивает Фотообесцвечивание выше; обычно минимальное значение адекватного); отверстие (избежать открытия, если не требуется, чтобы поддерживать резолюцию).
Примечание: Сканирование условия зависят от образца и должны определяться эмпирически в начале сеанса сканирования. Убедитесь, что яркость не превышает насыщения (ограничит возможность впоследствии изменить изображения, изображения программное обеспечение). При задании сканирования условий, также считают, что должны использоваться одинаковые условия для всех изображений в экспериментах, которые сравнивают экспериментальных животных с элементами управления. - Захвата изображения серии. Объединение изображений в одной проекции изображения.
Примечание: Может потребоваться сохранить проекции изображения и/или наложения отдельно в зависимости от Микроскоп. - При принятии многоканальные изображения использовать последовательное сканирование чтобы избежать кровотечения через между каналами (критических исследований совместно локализации).
Примечание: Параметры изображения может потребоваться быть изменены с учетом повышенной Фотообесцвечивание, подключенных к больше время сканирования. - Всегда приобрести соответствующие изображения DIC/Номарски (секции) достопримечательности и общее состояние морфология отсканированных животного.
- место слайд под конфокального микроскопа. Поиск для червей с 10 x цели и направленности.
5. Количественная оценка поляризованной мембраны биогенеза дефекты в C. elegans кишечника
Примечание: пример: базолатеральной перемещения апикальной ERM-1::GFP и формирования внематочная боковых люмен индуцированных пусть-767 и APS-1 RNAi.
- , Забив фенотипов под микроскопом рассечения ( рис. 5 A, D, E)
- определить категории для скоринга. Пример: (i) одичал тип (WT), (ii) базолатеральной перемещения формирования МВК 1::GFP (полярности дефект) и (iii) внематочная люмен (развивается после перемещения базолатеральной).
Примечание: Малое увеличение визуального анализа поддается забил количество животных, с или без конкретных фенотип. Здесь мы выбрали пример трех качественно фенотипические категорий, которые находятся на же время свидетельствует о ухудшение фенотип полярности, который анализируется. Однако, множество различных количественных и качественных фенотипов может быть забит, например люмен морфогенеза дефекты, отсутствие присутствия (или номера) GFP позитивные цитоплазменные вакуоли, люмен диаметр и размер или количество intralumenal кисты (см < сильный класс = «xfig» > рисунок 3 для примеров). - В зависимости от величины ожидаемых различий, оценка примерно 100 живут черви на тарелках агар под микроскопом рассечения в двойные или тройные набор экспериментов.
Примечание: Один необходимо Оценка каждое животное, которое приходит в поле зрения при сканировании пластины систематически, например от левого верхнего угла в нижний правый пластины (убедитесь, что черви населяли пластины равномерно). - Повторить это для 3 независимых наборов экспериментов. Создание гистограммы и оценить значимость результатов.
- определить категории для скоринга. Пример: (i) одичал тип (WT), (ii) базолатеральной перемещения формирования МВК 1::GFP (полярности дефект) и (iii) внематочная люмен (развивается после перемещения базолатеральной).
- Скоринга фенотипов под конфокального микроскопа ( рис. 5 B)
- определить категории для озвучивания, например количество внематочная люменов на животных
Примечание: увеличение визуальный анализ поддается скоринга количественно маркер или фенотип за животное и позволяет скоринга внутриклеточных маркеров, которые не могут быть различимы путем рассечения микроскопии. Настоящий пример подсчета внематочная люменов на животных в подмножестве червей же эксперимента, ранее оцениваются путем рассечения микроскопии (5.1.1, Категория 3) уточняет оценку ухудшения фенотип полярности, что рассматривается здесь. Однако, различные другие фенотипы или параметров может быть забит, например количество пузырьков, наличие/отсутствие или количество субцеллюлярные компоненты, которые совместно локализации, интенсивности флуоресценции (последний количественно, ImageJ; см. сопроводительный документ на выделительной канал)- 2. - В зависимости от величины ожидаемых различий, количественно фенотипических маркеров (здесь, внематочная люмен) в приблизительно 20 животных в двойные или тройные набор экспериментов под конфокального микроскопа.
- Повтора для 3 независимые наборы экспериментов. Графов Бар и оценить значимость результатов.
- определить категории для озвучивания, например количество внематочная люменов на животных
Результаты
Этот протокол описывает молекулярно анализировать и визуализировать поляризованной мембраны биогенеза и Люмене морфогенеза в C. elegans ЖКТ, на одну ячейку и субклеточном уровне. Двадцать клетки однослойная C. elegans кишечника образуется режиссер деление клеток и миграции во время середины эмбриогенеза. На этот раз, поляризованной мембраны, стать созданные домены, но de novo поляризованной мембраны биогенеза продолжается в зрелые, но расширение эпителия на протяжении четырех личиночной стадии до совершеннолетия, позволяя сосредоточиться на анализе поляризованные биогенеза мембраны (рис. 1A).
Чтобы визуализировать C. elegans клеточном и субклеточном компоненты, обычно используются две стратегии: иммунофлюоресценции (подробно в настоящем Протоколе, раздел 1; Рисунок 2 , Рисунок 4 d -F) и выражение флуоресценции синтез белков (подробно в сопроводительный документ на выделительную канал поляризованной мембраны биогенеза2; Рисунок 1B, рис. 2, рис. 4, рис. 5 c). Двойные и несколько маркировки, сочетая различные этикетки каждого или обоих методов, можно разрешить мембраны асимметрии такие как верхушечный и базолатеральной мембраны домены и отношения различных внутриклеточных компонентов друг с другом (рис. 2, Рисунок 4 d-E). Мембраны цитоскелета компоновщика ERM-1::GFP показано здесь как Индикатор апикального мембраны биогенеза, что совпадает с люмен морфогенеза в этом однослойного эпителия. С помощью этого маркера, массив кишечных апикальной мембраны/люмен биогенеза дефектов и дефектов их причинных генов может быть идентифицирован в исследованиях потери функции, например беспристрастной генома общесистемной экраны с помощью РНК-интерференции (RNAi подходы к поколения таких фенотипов описаны в разделе 2 настоящего Протокола). Рис. 3 и рис. 4 показаны примеры низкого до умеренного увеличения изображения апикальной мембраны/просвета биогенеза фенотипов, приобретенного путем рассечения флуоресценции микроскоп оснащен высокой мощности цели; и выше увеличения изображения, полученные путем конфокальный лазерный сканирующий микроскоп (этих микроскопических подходов описаны в разделах 3 и 4). В качестве примера количественного поляризованной мембраны биогенеза дефектов, эффекты интерференции с пусть-767 (кодирование стероидных дегидрогеназа/3-ketoacyl КоА-редуктазы) и aps-1 (кодирование Сигма Субблок Клатрин AP-1 адаптер) на ERM–1::GFP локализация и позиционирования люмен показано на рисунке 5.
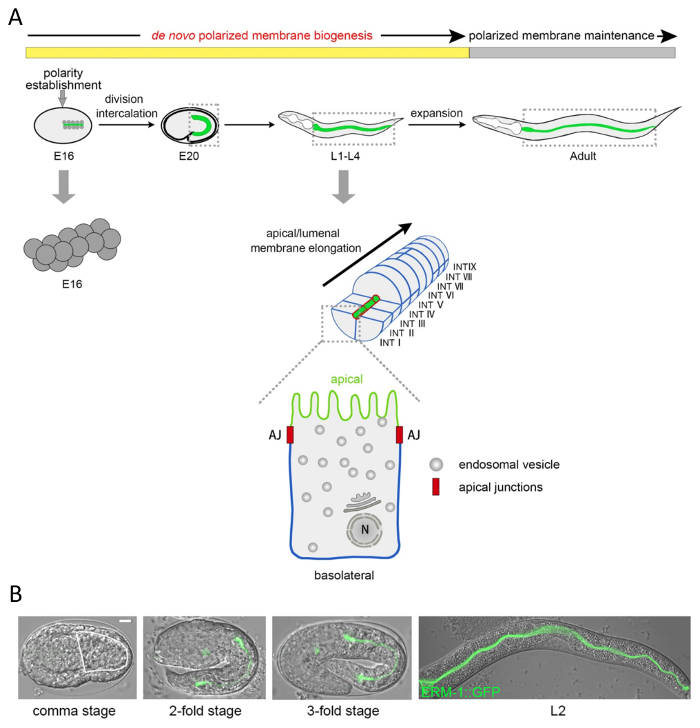
Рисунок 1 : Клеточном и субклеточном структура и морфогенез одичал типа C. elegans кишечника. (A) Схема развития кишечные нематоды Caenorhabditis elegans , клеточный состав и эндо - и плазменных мембран. C. elegans кишечника генерируется клонально от E бластомера, родился на этапе 8-секционная. После четырех раундов деления клеток его 16 клеток (E16 этап) форма язычковые симметричные удвоилось слоистых эпителия15. На данном этапе поляризовывает цитоплазме каждой ячейки, с ядрами, переезда в будущих апикальной и цитоплазматических компонентов, переход к противоположной (будущее базальную), мембраны доменов. В одном шаге интеркаляции левой и правой брюшной клеток переместить (параллельно) в слой спинной клеток сформировать на двусторонней основе симметричных трубки 9 INT колец. Каждая ячейка сталкивается и строит люмен с ее апикальной/lumenal мембраны (зеленый; структурно отличается конкретных мембраны microdomains, микроворсинки) и соседних клеток или полости тела с его базолатеральной мембраны (синий), за исключением первых контактов INT-кольцо, которое формируется четыре клетки. Верхушечный развязок (красный) отдельных апикальной и базолатеральной мембраны доменов. После интеркаляции de novo мембраны биогенеза продолжает вместе с ростом кишечника во время позднего эмбриогенеза и четыре личиночной стадии в зрелом возрасте, где только минимальные дальнейший рост происходит (фаза поддержания поляризованной мембраны ). Увеличенное одноклеточного указывает системе endomembrane с ER и Гольджи выше ядро (N) и везикулы от англ. (B) DIC/Номарски и конфокальный перекрытия микроскопии развивающихся C. elegans кишечника, помечены апикальном мембрана цитоскелета маркер ERM-1::GFP. Кишечника в стадии запятая изложена белой линией (ERM-1::GFP уже слабо выражена в апикальном мембрана в начале интеркаляции, но не могут быть оценены в этом изображении). Животные здесь и ниже являются показано с передней (руководитель) слева, задняя (хвост) право, спинной вверх, вентральной вниз. Линейки: 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 2 : Примеры двойной и тройной маркировки развивающихся одичал тип C. elegans кишки с использованием антител и синтез белков. (А, Б) Эмбрионы. (A) запятая этап. PAR-6::GFP (зеленый; компонент апикальной PAR полярности комплекс), НОМИНАЛЬНОЙ-3 антитела (красный/TRITC (тетраметилсвинца родамин Изотиоцианаты); другой компонент апикальной PAR полярности комплекс) и MH33 (голубой/Cy5 (Cyanine5); анти ИФБ-2/средний накаливания). PAR-6::GFP и антитела PAR-3 ярлык апикальной мембраны C. elegans кишечника (скобки). IFB-2, еще один апикальной маркер на более поздних этапах, является panmembraneously, локализованных на этой ранней стадии. PAR-6::GFP и НОМИНАЛЬНОЙ-3 также ярлык глотки (слева); просвета кишечника обозначается их совпадения с ИФБ-2 (бирюза) и кишечной трубки предложенный синий анти ИФБ-2 (справа). (B) этап 2 раза. Предложившем 1::GFP (зеленый; компонент соединения), ICB4 антитела (красный/Alexa, ICB4 обнаруживает неизвестное мембранных кишечных антигена). Предложившем 1::GFP этикетки апикальной развязок C. elegans кишечника, видимых как Пери lumenal лестница шаблон (он также этикетки гиподермального узлы не видна с изображения сосредоточено на кишечнике; см. раздел 4, конфокальная томография). ICB4 пятна все мембраны C. elegans кишечника. Стрелки указывают базолатеральной мембраны запятнана анти ICB4. (C, D) L2 личинки. (C) пусть 413::GFP (зеленый), Фаллоидин (красный/Техас красный, phallotoxin, привязка к F-миозина) и MH33 (синий/Cyanine5, анти ИФБ-2). Пусть-413/Scribble является компонентом базальной полярности комплекс и локализует базолатеральной мембраны C. elegans кишечника (скобки). Фаллоидин и антитела ИФБ-2 этикетка апикальной submembraneous цитоскелета C. elegans кишечника (фиолетовый). Фаллоидин также решительно пятна мышц стенки тела, подавляющим кишечных окрашивания. Врезные показывает увеличение площади в штучной упаковке. (E) личинки L3. SLCF-1::GFP (зеленый; неотъемлемой трехчленноетранспортер Rane компонент/сахара), МВК 1::mCherry (красный) и MH27 антител (синий/Cyanine5, анти Предложившем-1). SLCF-1::GFP этикетки базолатеральной мембрану, в то время как ERM-1::mCherry этикетки апикальном мембрана C. elegans кишечника (скобки); Предложившем-1 этикетка апикальной развязок. (F-F''') Личинка L2. (F, F') Один цвет изображения. SLCF-1::GFP (зеленый) этикетки базолатеральной мембраны (обозначается тонкие белые стрелки боковой мембраны). MH27 (синий/Cyanine5) этикетки апикальной развязок (короткие Желтые стрелки). (F"F''') Наложение изображений с и без актина. Вставками показывают увеличение в штучной упаковке районов. Примечание четкое различие угол apicolateral кишечных клеток этих различных мембраны/Джанкшн маркеры, которые появляются внешне похож на один цвет изображения (F, F'). Толстые белые стрелки в F'''указывают на апикальной/lumenal актина цитоскелета, обозначены Фаллоидин (в противном случае перегружены актина мышц). Все изображения являются конфокальные прогнозы (z стеки 0.2 мкм), приобретенного путем последовательного сканирования, чтобы избежать кровотечения через между каналами. Масштаб баров (A-e, F-F'' ' и все вставки): 5 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
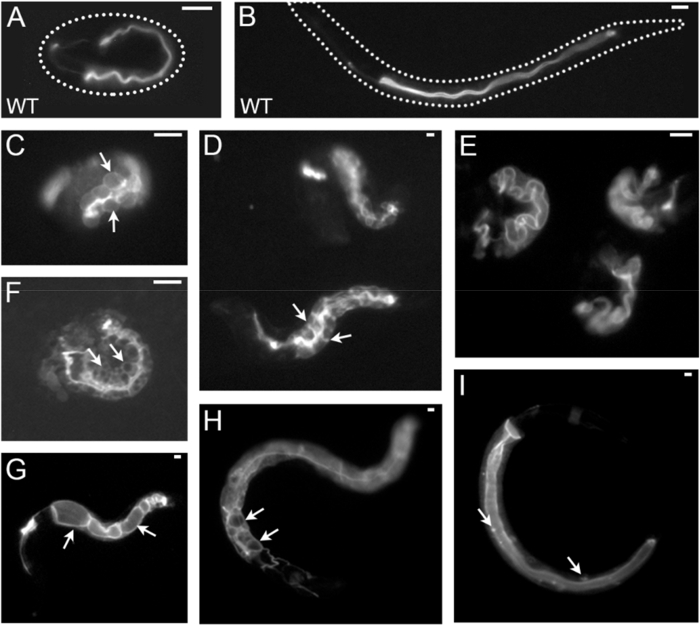
Рисунок 3 : Примеры C. elegans кишечных поляризованной мембраны и Люмене морфогенеза дефектов с низким и средним увеличением (рассекающий микроскопии флуоресцирования). Все фотографии приобретаются путем рассечения флуоресцентный микроскоп оснащен насадкой на заказ мощные стерео флуоресцирования (Таблица материалов). Показаны различные увеличениях. Все фенотипов были получены путем интерференции с различных генов в штамм, помечены МВК 1::GFP (локализованные в апикальной/lumenal мембраны кишечного и выделительной канал личиночной стадии эмбриона и начале, показанный здесь). Кишечные люмен и полярности фенотипов являются: (A, B) дикого типа эмбриона (A) и личинки (B); (C, D) базолатеральной перемещение ERM-1::GFP; кишечные клетки увеличены и появляются раздутой в этом эмбриона (C, стрелки указывают отдельные клетки кишечника), но одичал тип размер и расположение в эти личинки (D, стрелка указывает на боковых мембраны между INT II и III); (E) расширены и запутанные Люмене в трех эмбрионов; (F) ERM-1::GFP расширения в области боковой Джанкшен (зигзаг люмен) и в кишечных цитоплазмы, содержащий GFP-отрицательных вакуолей (стрелки); (G) lumenal кисты inbetween intralumenal спаек (стрелки точка для двух кисты). (H) Эндоплазматический и базолатеральной ERM-1::GFP перемещения с внематочной люменов (стрелки); (я) ERM-1::GFP перемещение GFP-положительных puncta (стрелки) в цитоплазме. Выделительной каналов и выделительной канал фенотипы не описано здесь (канал показан в левом, кишечник направо во всех изображениях). Масштаб бары: 10 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.

Рисунок 4 : Примеры C. elegans кишечных поляризованной мембраны люмен морфогенеза дефекты и на увеличение (конфокальный изображения). (A, C, E, G, I, K) Эмбрионы. (B, D, F, H, J, L) Личинки. Все фенотипов были получены путем интерференции с различных генов в штамм, помечены МВК 1::GFP (зеленый во всех изображениях). Визуализация ориентирован на кишечнике. Изображения эмбрионов также показывают выделительной каналов (левая сторона изображения), включая канал фенотипов (не описано). (A, B) Дикого типа эмбриона (A) и личинки (B). (C) базолатеральной перемещение апикальной МВК 1::GFP (запятая стадии; конце интеркаляции). (D) полярности преобразование: перемещение базолатеральной апикальной ERM-1::GFP и апикального накопления базолатеральной ICB4, показал двойной маркировки. F-актина (обозначены Фаллоидин TRITC) излагаются животных путем пятнать продольных мышц связок (животное является тройной меткой). (E) перемещение базолатеральной ERM-1::GFP в конце вывозимому эмбриона. Верхушечный антитела ИФБ-2 (синий/Cyanine5) указывает нетронутыми люмен и пери lumenal промежуточные филаменты. (F) внематочная люмен помечены анти ИФБ-2 (синий/Cyanine5). (G) ERM-1::GFP отрицательные вакуоли в цитоплазме кишечника. (H) позитивные вакуолей ERM-1::GFP в цитоплазме кишечника. (I, J) Отсутствие люмен эмбриона и личинки, соответственно. (K) широкий кишечник. Муковисцидоз (L) и запутанные кишки. (A, D, H, I, J, K, L) являются конфокальные прогнозов. (B, C, E, F) конфокальная секции. Яркость была увеличена в G подчеркнуть цитоплазменные вакуоли GFP-отрицательные. Масштаб бары: 10 мкм (то же самое для всех эмбрионов и личинки, соответственно). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
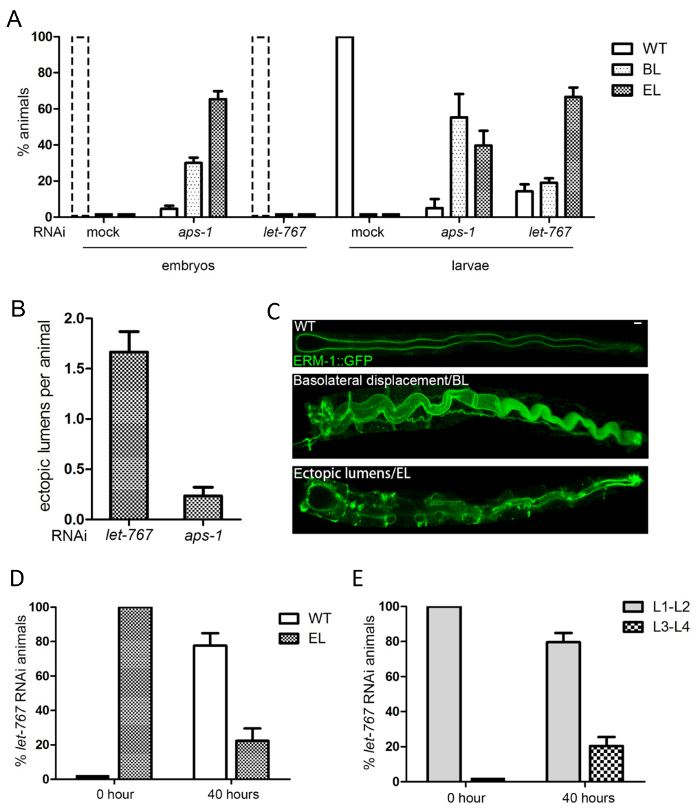
Рисунок 5 : Кишечные полярности преобразования и возврат: пример для количественной оценки поляризованной мембраны и Люмене дефектов биогенеза. (A, B, C) пусть-767и aps-1RNAi оба причиной перемещения базолатеральной МВК 1::GFP (BL) и формирования внематочная люмен (EL), но на разных этапах своего развития. (A) количественная оценка, рассекает микроскопом: подсчет эмбрионов (слева) и личинки (справа) с полярности фенотипов 2 дней после посева червей на тарелках RNAi. Примечание: все макет и let-767(RNAi) животных вылупились на данный момент (таким образом, есть без эмбрионов, которые, однако, все одичал тип полярности; сломанной линии столбцов). APS-1 RNAi индуцирует полярности дефекты уже эмбрионов, то пусть-767RNAi побуждает их в личинки. Более высокий процент внематочной люменов (против базолатеральной перемещения) эмбрионов RNAi aps-1против личинок из-за ареста эмбрионов с внематочной люмен. Количественное определение (B) на confocal микроскопии: подсчет внематочная люменов на животных в начале развития внематочной Люмене в личинки. пусть-767 RNAi индуцирует более эктопических люмен в личинок чем aps-1(aps-1RNAi личинки являются «беглецов», которые имеют не Аррези RNAiТед как эмбрионы). (C) конфокальный изображений для личинок одичал тип и личинки с ERM-1::GFP базолатеральной перемещения (BL) и внематочной люменов (EL); линейки: 5µm. возврат (D, E) полярности в пусть-767RNAi животных (подсчета животных с и без полярности дефекта [BL/EL] рассекает микроскопом). 20 let-767(RNAi) животных с мягким внематочная люмен фенотипов были переданы ОР50 пластины на 4 день от интерференции пластины и оцениваются после 40 часов. (D) более чем 50% личинок вернулись к одичал тип полярности (ERM-1 в апикальном мембрана). (E) 20% животных растут за пределы L1 личиночной стадии (let-767(RNAi) результаты в L1 ареста). Все данные отображаются как средство + / SEM, n = 3. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Таблица 1: Примеры маркеров для C. elegans личинок и взрослых кишечных мембранной системы1. | ||||
| Имя белка | Локализация внутриклеточных | Структура белка/функции | Коммерчески доступных C. elegans специфические антитела (2DSHB) | Примеры штаммов на CGC |
| ОПТ-2/PEPT-1 | верхушечный трансмембранный белок | пальмитоила транспортер | KWN246 (pha-1(e2123) III, rnyEx133[opt-2(aa1-412):: GFP) + pha-1(+)]) | |
| AQP-4 | верхушечный трансмембранный белок | водный канал | ||
| ERM-1 | апикальной brushborder | мембрана – цитоскелета компоновщика | ERM1 | |
| АКТ-5 | апикальной brushborder | цитоплазматическая актина | (3) | |
| IFB-2 | апикальной brushborder | компонент промежуточного накаливания | MH33 | |
| EPS-8 | апикальной brushborder | Human-Epidermal-growth-factor-receptor-kinase-Substrate-8 ortholog | ||
| ПАР-6 | апикальном мембрана | сложный компонент апикальной полярности | ||
| SLCF-1 | базолатеральной трансмембранный белок | monocarboxylate транспортер | ||
| AQP-1 | базолатеральной трансмембранный белок | водный канал | ||
| ПУСТЬ-413 | базолатеральной мембраны | Писанина гомолог, адаптер и определитель полярности | LET413 | |
| ГМЗ-1 | верхушечный перекрёстка (4CCC) | Α-катенина, сложный компонент Кадгерины Катенин | FT1609 (unc-119(ed3) III; xnIs528 [ГМЗ 1p::hmp-1:: Зелёный флуоресцентный белок + unc-119(+)]) | |
| МУЗ-1 | верхушечный Джанкшен (СТС) | E-Кадгерины, сложный компонент Кадгерины Катенин | HMR1 | |
| ПРЕДЛОЖИВШЕМ-1 | верхушечный Джанкшен (КСР-5) | Джанкшен целостности молекулы, DLG-1/Предложившем 1complex компонент | MH27 | SU159 (jcEx44 [предложившем 1::GFP + rol-6(su1006)]) |
| DLG-1 | верхушечный соединения (DAC) | Диски большой гомолог, MAGUK белков, DLG-1/Предложившем 1complex компонент | DLG1 | |
| РАБ-11 | везикулы от англ | торговли людьми6 | RT311 (III unc-119 (ed3); pwIs69 [vha6p::gfp::rab-11, Cbunc-119(+)]) | |
| РАБ-5 | везикулы от англ | торговля | RT327 (III unc-119 (ed3); pwIs72 [pvha6::gfp::rab-5, Cbunc-119(+)]) | |
| РАБ-7 | везикулы от англ | торговля | RT476 (III unc-119 (ed3); pwIs170 [vha6p::gfp::rab-7, Cbunc-119(+)]) | |
| РАБ-10 | везикулы от англ | торговля | RT525 (III unc-119 (ed3); pwIs206 [pvha6::gfp::rab-10 Cbunc-119(+)) | |
| МАН | Гольджи | Α-mannosidase II | RT1315 (III unc-119 (ed3); pwIs503 [pvha6::mans::gfp Cbunc-119(+)]) | |
| 1 Примеры выбираются из ресурсов, перечисленных в Таблица3. | ||||
| 2 Развития исследований гибридомной банка. | ||||
| 3 Антитела против позвоночных актина cross-react. | ||||
| 4 CCC: Кадгерины катенина комплекс; локализует апикальной части апикальной Джанкшн; соответствующий adherens Джанкшен (AJ). | ||||
| 5 КСР: DLG-1/Предложившем 1complex; локализует базальной части апикальной Джанкшн; соответствует жесткой перехода (TJ). | ||||
| 6 Для дополнительных везикул связанных молекул, выраженные в кишечнике увидеть ref (22). | ||||
| Примечание: не все молекулы были протестированы как синтез белков под их собственных промоутеров или антитела. | ||||
| Таблица 2 : Примеры C. elegans кишечника конкретных промоутеров и время выражения1. | |||
| Промоутеры | Выражение этап | ||
| АПП-2 | выражение начинается на этапе 2 E клеток и сохраняется в зрелом возрасте | ||
| VHA-6 | выражение начинается в конце эмбриона и сохраняется в зрелом возрасте | ||
| ГЭС-1 | выражение начинается примерно на стадии клетки 4E и сохраняется в зрелом возрасте | ||
| конец-1 | выражение начинается после этапа клетки 1E и падает во время эмбриогенеза позже | ||
| 1 Примеры выбираются из ресурсов, перечисленных в таблице 3. | |||
| Таблица 3: Ресурсы, чтобы найти C. elegans кишечника специфические молекулы, маркировки реагенты/напряжений и антител. | |||
| 1. Caenorhabditis центр генетики (CGC)42 для доступных реагентов и штаммов | |||
| 2. Wormbase43 сведения о кишечника специфические молекулы, штаммы и антител | |||
| 3. Informa |
Обсуждение
Этот протокол описывает как объединить Стандартная функция потерь генетических/RNAi и обработки изображений (маркировка и микроскопических) подходы к воспользоваться C. elegans кишечного эпителия как модель для визуального и молекулярных рассечение в естественных условиях поляризованной мембраны и Люмене биогенеза.
Маркировка
Этот протокол посвящен Пятнать антитела. В situ обозначать антителами является весьма специфическим альтернативный подход к маркировке флуоресцентные синтез белков (описанный в сопроводительном документе выделительной канал мембраны биогенеза)2. Хотя Пятнать антитела не позволяют жить изображения, он может предоставить подтверждение для локализации протеина интереса (ни обозначая метод без сбоев). Кроме того вопросы, касающиеся морфогенеза и/или субцеллюлярные локализация протеина часто может оцениваться в фиксированных животных. Иммуноокрашивания полезен для двойных и несколько маркировки и могут быть объединены с маркировки флуоресцентные синтез белков, если они могут быть сохранены через требуемых процедур фиксации и permeabilization. Здесь указывается протокол обычно разрешает этот (рис. 2). В situ обозначать фиксированной животных антитела или химические пятна могут также предоставлять преимущества для сверхразрешение микроскопические методы, такие как шторм (стохастических оптических реконструкции микроскопия). Иммунофлюоресценции обнаруживает эндогенного антигена и может быть адаптирована, например, чтобы отличить изменения конкретных Посттрансляционная белка. Он может производить быстрые результаты, если антитела доступны, один раз в situ методы окраски - не как простой в C. elegans были установлены образцы как в культуре клеток.
Поколение новых антител (не описано здесь), однако, много времени. К сожалению, выбор из коммерчески доступных C. elegans первичного антитела остается довольно небольшим, и не все способны обнаруживать антиген в situ (см. таблицу 1 продемонстрированы примеры антител обнаружения кишечных антигенов на местеи Таблица 3 дополнительных ресурсов). Большинство созданных против позвоночных антигенов антитела не будет cross-react с их гомолог C. elegans . Выбор вторичные антитела должны принимать во внимание виды первым антителом, (рассматривается в общем иммунофлюоресценции протоколы27,28). Большой выбор коммерчески доступны с непрерывно совершенствует Краски люминесцентные, флуоресцентные (например Alexa-Fluor красители). Для оптимизированного окрашивание, красители могут быть выбраны для их способности соответствовать Микроскоп, используемых для обработки изображений, например лазерного конфокального микроскопа, или, если микроскопии сверхвысокого разрешения также планируется, за их способность «мигание»37. Прямо обозначенные первичного антитела или химического пятна (например дневно помечены Фаллоидин) также доступны и особенно полезны для двойной пятнать.
Сложности в situ антитело пятная в C. elegans является непроницаемости эмбриона яичной скорлупы и кутикулы личинок/взрослый, что оба требуют химического или механического нарушения доступа антитела к ткани. Хотя сложные жидкого антитело пятная протоколы были разработаны для преодоления этой проблемы27,28, большинство включают в себя коллагеназы для permeabilization, который стремится повредить ткани-мишени. В отличие от замораживания треск метод, описанный здесь это простой способ, чтобы открыть червя кутикулу или яичной скорлупы. Она выполняется непосредственно на стекло слайд, где собраны образцы (и где также выполняется остальная часть окрашивание), и особенно хорошо работает для яиц и личинок, лучше всего придерживаться стекла слайды (т.е. преимущественно рассмотрены этапы tubulogenesis исследования). Он также не вмешиваться с сохранением Флюорофор меченых синтеза белков. Метод требует некоторых ловкость, как правильное давление на coverslip (перед стряхивая) и во избежание сдвига давления имеют решающее значение для сохранения образца (как это Деликатное обращение и закупорить во время всей процедуры окрашивания).
Фиксация условий может потребоваться эмпирически установлено и скорректирована для антигена структура, которая должна быть окрашены (обсуждается в27). Более мягкие методы фиксации (например на основе формальдегида) лучше сохранить антигенностью, хотя это должно сочетаться с необходимостью поддержания тканей морфологии, решающее значение для анализа морфогенеза. Мягкой фиксации условия также помогают сохранить флуоресцентные синтез белков в двойной маркировки экспериментов. Аналогичным образом количество блокирования агент (например , молока или бычьего сывороточного альбумина/BSA) и моющих средств в промывочный раствор требует эмпирических сбалансировать фон с специфического окрашивания. Подробная информация о общие аспекты методы иммунофлуоресценции, например обсуждение различные методы окраски, Дизайн надлежащего контроля и советы по оптимизации этих процедур для червя кишечника (например минимизации кишечника аутофлюоресценция) можно найти в целом и C. elegans конкретных иммунофлюоресценции протоколы, как указано во всем.
Вмешательство с функции гена и оценки tubulogenesis фенотипов
Этот протокол освещаются конкретные RNAi подходы, которые являются полезными при оценке генов с раннего, необходимым и вездесущие функций, потеря которых частично (а не полный) наиболее информативным, как в случае большинства tubulogenesis генов (наш геном широкий экран на ERM-1::GFP-помечены кишечника предложил, что вмешательство с такими причинами генов > 90% всех фенотипов информативный tubulogenesis в этой конкретной установки12). Многие преимущества, которые предлагает C. elegans для генетических манипуляций (например свое время коротких поколения) и различные подходы к возмущают функции гена путем вперед (начиная с фенотипом функции) и обратного (начиная с Джин) генетические подходы рассматриваются в общем C. elegans литературы31,38. Наличие коммерчески доступных генома общесистемной RNAi кормления библиотеки также позволяет использовать этот обратный генетический метод как инструмент вперед генетического скрининга (см. Таблицу материалы для ресурсов). Особые преимущества РНК-интерференции для анализа tubulogenesis включают в себя способность: для создания ряда фенотипов эквивалентна мутант аллельные серии (это, как правило, работает хорошо для дозозависимый морфогенеза генов); чтобы удалить материнской РНК (обычно участвует в начале морфогенеза/tubulogenesis); этап специально вмешиваться (полезно для оценки воздействия на поляризованной мембраны биогенеза во время Постмитотические роста).
Детали по общим аспектам RNAi процедуры обсуждаются в РЭС (26,s = «внешней» > 31). Ключ для анализа смертоносных tubulogenesis фенотипов является возможность модулировать RNAi условия для увеличения спектра фенотипов. Информационные tubulogenesis фенотипов обычно могут быть созданы в фоне дикого типа без необходимости для кишечника специфичные РНК-интерференции штаммов39. Однако такие штаммы доступны, если этот сбой и может также использоваться для различения клеток автономных от неавтономной эффектов. Были представлены различные подходы для плавного сила RNAi, например титрование IPTG концентрации для индукции двуцепочечной ДНК, подход, который может производить наиболее воспроизводимые результаты30. Однако количественно точные титрование не может быть необходимым при наведении на генерации спектр разных фенотипов. В целом, успех этого анализа не столько зависит от максимального эффекта RNAi как это на определении условий интерференции, которые генерируют информативные спектр фенотипов (которые могут часто быть результатом неоптимальной (например мягче) РНК-интерференции условия).
Для визуальной оценки tubulogenesis фенотипов, индуцированной интерференции важно определить оптимальный окна для фенотипического оценки. Лучше, чтобы начать оценку пластины в начале (например, через два дня после выбора животных для их RNAi пластин при стандартных условиях интерференции) и следовать за ними достаточно долго, для возможного конца эффектов. Например, курс развития время ухудшение полярности дефекта, должен охватывать 3-7 дней в обычно арестованных личинки. Условия для анализа поляризованной мембраны биогенеза постмитотических клеток деления личиночной кишечника можно усовершенствовать при использовании мутанты или RNAi животных с замедление роста (как, например, let-767(RNAi) или мутанта животных 12, рис. 5). Любое время курс должен быть прервана, если F2 животных появляются (можно удалить L4s в экспериментах, где большинство, но не все животные арест как личинки). Каждый эксперимент требует сопутствующего оценки соответствующие позитивные и негативные элементы управления (например , бактериальной интерференции клоны, вызвать определенный tubulogenesis фенотип и пустой вектор или омлет RNAi клонов, соответственно). Еще одно требование для оценки является достаточной выводок размер (по крайней мере, 50). Если не выполнены, другие условия (например условное) РНК-интерференции может быть судим. Наконец некоторые особенно интересно tubulogenesis фенотипов происходят на низкой пенетрантностью, таким образом достаточное количество животных должны быть оценены.
Микроскопия
Низким и средним увеличением рассекает флуоресцентной микроскопии и высокое увеличение confocal микроскопии, два стандартных изображений описанные здесь, обычно достаточно, чтобы охарактеризовать основные аспекты трубу или Люмене фенотип в C.elegans кишечника и может также использоваться для визуально экран большие наборы животных в вперед экраны. Позволяет секционный микроскопии флуоресцирования: в vivo изображений животных на тарелках (Однако, живые животные, временно изъятые из обращения, анестетиков, также может быть восстановлен из крепления после конфокальный или DIC изображений); скрининга больших наборов животных; развития событий отслеживания (например перемещение и замена маркера поляризованные во время расширения мембраны); отслеживание определенных выражений шаблонов (некоторые модели и асимметрии лучше различают на нижней увеличение); Выбор и сбор флуоресцентные червей подходит для дальнейшего анализа (например , конфокальная микроскопия) или для поддержания нехромосомной трансгенов. Визуализация с высоким увеличением, конфокальная микроскопия позволяет характеризовать фенотипа на одну ячейку и субклеточном уровне. Этот протокол описывает изображений с лазерного сканирования Конфокальный микроскоп, который предлагает лучшие confocality альтернативы, такие как вращающийся диск конфокального микроскопа. Вращающийся диск конфокального микроскопа является, однако, Микроскоп выбор динамичных и промежуток времени исследований, поскольку это вызывает меньше фототоксичности (см РЭС (3534,) для дальнейшего обсуждения низкого и высокого увеличения микроскопия в C. elegans). Роман, а также обычных микроскопические методы обеспечивают дополнительные преимущества и разрешение изображений с высоким разрешением в диапазоне наноразмерных (например передачи электронов и суперразрешением микроскопии; обсуждавшиеся в37, 40).
При визуализации C. elegans кишечника под конфокального микроскопа, монтаж и иммобилизации имеет решающее значение. Среди различных химических веществ для иммобилизации азид натрия - хотя токсичных - наиболее надёжно работает если сканирование производится немедленно. Левамизол, хотя не токсичен, производит hypercontraction, что иногда мешает с оценкой морфогенеза фенотипов. Некоторые анестетиков может мешать связанный мембранами флуоресцентных белков и может производить артефакты, которые могут выглядеть как полярности дефектов. C. elegans является толстым и таким образом 3D анализ (секционирование) важно воспользоваться удельная прочность трубчатых кишечного эпителия, что позволяет отлично визуализации апикальной развязок и боковые мембраны (не легко доступные в плоского эпителия). Конфокальный параметры должны быть скорректированы для каждого слайда и цели для получения изображения хорошего качества, включая параметры как брекетинг, усреднение, мощность лазера, усиление, обскуры и яркость. Одна конкретная проблема кишечных изображений является содержание этого органа зеленый/желтый autofluorescent гранул (Лизосома связанных органеллы (LROs)), могут мешать интерпретацию результатов, особенно при оценке перемещения GFP-меченых эндо - и плазматической мембране связанные компоненты. Эта проблема хорошо известны в области и может решаться различные подходы (в зависимости от микроскопа), включая исключения DAPI, спектральные дактилоскопии и эмпирические сканера параметры13,41.
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Мы благодарим Марио де Боно (MRC лаборатории молекулярной биологии, Кембридж, Великобритания), Кеннет Джей Kemphues (Корнельский университет, Итака, США), Мишель Labouesse (Institut de Biologie Париж Сена, Université Пьер и Мари Кюри, Париж, Франция), Grégoire Мишо (Université deRennes 1, Ренн, Франция) и CGC, финансируемых Управлением NIH инфраструктуры научно-исследовательских программ (P40 OD010440), штаммов и антител. Эта работа была поддержана грантов низ GM078653, MGH является 224570 и 223809 SAA в в.г.
Материалы
| Name | Company | Catalog Number | Comments |
| Antibody staining | |||
| poly-L-lysine | Sigma | P5899 | |
| Methanol | Fisher Scientific | A452-4 | |
| Acetone | Fisher Scientific | A949SK-4 | |
| Tween | Fisher Scientific | 50-213-612 | |
| Permount | Fisher Scientific | SP15-100 | |
| Powdered milk | Sigma | MT409-1BTL | |
| Primary antibodies | |||
| MH27 (mouse) | Concentration: 1:20 Resources: Developmental Studies Hybridoma Bank. | ||
| MH33 (mouse) | Concentration: 1:10 Resources: Developmental Studies Hybridoma Bank. | ||
| anti-ICB4 (rabbit) | Concentration: 1:5 Resources: A gift from Mario de Bono (Medical Research Council, England) | ||
| anti-PAR-3 (rabbit) | Concentration: 1:50 Resources: A gift from Kenneth J. Kemphues (Cornell University) | ||
| Secondary antibodies | |||
| Alexa Floor 568 (anti-rabbit) | ABCam | AB175471 | Concentration: 1:200 |
| Cy5 (anti-mouse) | Life technologies | A10524 | Concentration: 1:200 |
| TRITC (anti-rabbit) | Invitrogen | T2769 | Concentration: 1:200 |
| FITC (anti-mouse) | Sigma | F9006 | Concentration: 1:100 |
| Labeled chemicals | |||
| Texas Red-Phalloidin | Concentration: 1:100 Resources: Molecular Probes-T7471 | ||
| Materials | |||
| Vacuum Grease Silicone | Beckman | 335148 | |
| Microscope slides | Fisher Scientific | 4448 | |
| Microscope coverslips (22x22-1) | Fisher Scientific | 12-542-B | |
| C. elegans related | see reference29 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates | see reference29 for protocols. | ||
| Tryptone | Acros Organics | 611845000 | |
| Yeast Extract | BD Biosciences | 212750 | |
| NaCl | Sigma | S7653 | |
| Bacto Agar | BD Biosciences | 214040 | |
| Ampicillin | Sigma | A0116 | |
| Tetracycline | Fisher Scientific | BP912 | |
| M9 Medium | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| KH2PO4 | Sigma | P0662 | |
| Na2HPO4 | Sigma | S7907 | |
| MgSO4 | Sigma | M2773 | |
| NGM plates | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| RNAi plates | see reference30 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| IPTG | US Biological | I8500 | |
| Carbenicillin | Fisher Scientific | BP2648 | |
| NaOH | Fisher Scientific | SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries Ahringer genome-wide RNAi feeding library (ref 30,49,50) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref51) | Source BioScience | ||
| Imaging related | |||
| Sodium azide | Fisher Scientific | BP9221-500 | |
| Equipment | |||
| dissecting microscope | Nikon | SMZ-U | |
| dissecting microscope equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions) | Olympus | SZX12 | |
| Laser-scanning confocal microscope | Leica Microsystem | TCS SL | |
| laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope | Nikon | C2 |
Ссылки
- Bryant, D. M., Mostov, K. E. From cells to organs: building polarized tissue. Nat. Rev. Mol. Cell Biol. 9 (11), 887-901 (2008).
- Zhang, N., Membreno, E., Raj, S., Zhang, H., Khan, L. A., Gobel, V. The C. elegans excretory canal as a model for intracellular lumen morphogenesis and in vivo polarized membrane biogenesis in a single cell. JoVE. , (2017).
- Rodriguez-Boulan, E., Macara, I. G. Organization and execution of the epithelial polarity programme. Nat. Rev. Mol. Cell Biol. 15 (4), 225-242 (2014).
- Mellman, I., Nelson, W. J. Coordinated protein sorting, targeting and distribution in polarized cells. Nat. Rev. Mol. Cell Biol. 9 (11), 833-845 (2008).
- Nelson, W. J. Adaptation of core mechanisms to generate cell polarity. Nature. 422, 766-774 (2003).
- Goldstein, B., Macara, I. G. The PAR Proteins: Fundamental Players in Animal Cell Polarization. Dev. Cell. 13 (5), 609-622 (2007).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. Organization of vesicular trafficking in epithelia. Nat. Rev. Mol. Cell Biol. 6 (3), 233-247 (2005).
- Zegers, M. M., O'Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends Cell Biol. 13 (4), 169-176 (2003).
- Tepass, U. The apical polarity protein network in Drosophila epithelial cells: regulation of polarity, junctions, morphogenesis, cell growth, and survival. Annu. Rev. Cell Dev. Biol. 28, 655-685 (2012).
- Shivas, J. M., Morrison, H. A., Bilder, D., Skop, A. R. Polarity and endocytosis: reciprocal regulation. Trends Cell Biol. 20 (8), 445-452 (2010).
- Bryant, D. M. A molecular network for de novo generation of the apical surface and lumen. Nat. Cell Biol. 12 (11), 1035-1045 (2010).
- Zhang, H. Apicobasal domain identities of expanding tubular membranes depend on glycosphingolipid biosynthesis. Nat. Cell Biol. 13 (10), 1189-1201 (2011).
- Zhang, H. Clathrin and AP-1 regulate apical polarity and lumen formation during C. elegans tubulogenesis. Development. 139 (11), 2071-2083 (2012).
- Asan, A., Raiders, S. A., Priess, J. R. Morphogenesis of the C. elegans Intestine Involves Axon Guidance Genes. PLoS Genet. 12 (4), e1005950(2016).
- Leung, B., Hermann, G. J., Priess, J. R. Organogenesis of the Caenorhabditis elegans intestine. Dev. Biol. 216 (1), 114-134 (1999).
- Altun, Z. F., Hall, D. H. Alimentary system, intestine. WormAtlas. , (2009).
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Dev. Biol. 56 (1), 110-156 (1977).
- Rasmussen, J. P., English, K., Tenlen, J. R., Priess, J. R. Notch signaling and morphogenesis of single-cell tubes in the C. elegans digestive tract. Dev. Cell. 14 (4), 559-569 (2008).
- Maduro, M. F. Gut development in C. elegans. Seminars in cell & developmental biology. , (2017).
- McGhee, J. D. The Caenorhabditis elegans intestine. Wiley Interdiscip. Rev. Dev. Biol. 2 (3), 347-367 (2013).
- Pásti, G., Labouesse, M. Epithelial junctions, cytoskeleton, and polarity. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Sato, K., et al. C. elegans as a model for membrane traffic. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Shakes, D. C., Miller, D. M. 3rd, Nonet, M. L. Immunofluorescence microscopy. Methods Cell Biol. 107, 35-66 (2012).
- JS, D. uerr Immunohistochemistry. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- T, S. tiernagle Maintenance of C. elegans. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Ahringer, J. Reverse genetics. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Simmer, F. Loss of the Putative RNA-Directed RNA Polymerase RRF-3 Makes C. elegans Hypersensitive to RNAi. Curr. Biol. 12 (15), 1317-1319 (2002).
- Kennedy, S., Wang, D., Ruvkun, G. A conserved siRNA-degrading RNase negatively regulates RNA interference in C. elegans. Nature. 427 (6975), 645-649 (2004).
- Shaham, S. Methods in Cell Biology. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Maddox, A. S., Maddox, P. S. High-resolution imaging of cellular processes in Caenorhabditis elegans. Methods Cell Biol. 107, 1-34 (2012).
- Netherlands, S. Nomarski Differential Interference Contrast Microscopy. , Springer. Netherlands. (2008).
- Bates, M., Jones, S. A., Zhuang, X. Stochastic optical reconstruction microscopy (STORM): a method for superresolution fluorescence imaging. Cold Spring Harb. Protoc. 6, 498-520 (2013).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3, 356-369 (2002).
- Lee, Y. U., Son, M., Kim, J., Shim, Y. H., Kawasaki, I. CDC-25.2, a C. elegans ortholog of cdc25, is essential for the progression of intestinal divisions. Cell Cycle. 15 (5), 654-666 (2016).
- Hall, D. H., Hartwieg, E., Nguyen, K. Modern electron microscopy methods for C. elegans. Methods Cell Biol. 107, 93-149 (2012).
- Shi, A., Grant, B. D. In vivo analysis of recycling endosomes in Caenorhabditis elegans. Methods Cell Biol. 130, 181-198 (2015).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- McGhee, J. The C. elegans intestine. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2007).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Developmental Studies Hybridoma Bank (DSHB). , http://dshb.biology.uiowa.edu (2017).
- Kamath, R. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены