Method Article
Il c. elegans intestino come un modello per intercellulare Lumen morfogenesi e biogenesi di membrana polarizzata In Vivo a livello di singola cellula: etichettatura da macchiatura dell'anticorpo, RNAi Loss-of-function Analysis and Imaging
In questo articolo
Riepilogo
Il trasparente c. elegans intestino può servire come una"nel vivo del tessuto camera" per lo studio della biogenesi di membrana e lume di apicobasal a livello di singola cellula e subcellulare durante tubulogenesis multicellulari. Questo protocollo viene descritto come combinare etichettatura standard, perdita di funzione genetica/RNAi e approcci al microscopio dissezionare questi processi a livello molecolare.
Abstract
Multicellulari tubi, unità fondamentali degli organi interni, sono composti da cellule endoteliali o epiteliali polarizzate, con membrane apicali che rivestono le membrane lumen e basolaterale contattando reciprocamente e/o la matrice extracellulare. Come questa asimmetria di membrana distintivo è stabilita e mantenuta durante la morfogenesi dell'organo è ancora una questione irrisolta della biologia delle cellule. Questo protocollo descrive l'intestino di c. elegans come un modello per l'analisi della biogenesi della membrana polarizzata durante la morfogenesi del tubo, con enfasi sulla biogenesi di lumen e membrana apicale. C. elegans venti celle singolo-stratificato epitelio intestinale è organizzato in un semplice tubo bilateralmente simmetrico, permettendo l'analisi a livello di singola cellula. Polarizzazione di membrana si verifica in concomitanza con polarizzato la divisione cellulare e la migrazione durante l'embriogenesi precoce, ma de novo polarizzati biogenesi della membrana continua in tutto la crescita larvale, quando le cellule non proliferano e spostare. L'impostazione di quest'ultimo consente di separare cambiamenti sottocellulari che contemporaneamente mediano questi diversi processi di polarizzazione, difficili distinguere nella maggior parte dei modelli di polarità. Apicale-, basolaterale della membrana-, giunzionale-, del citoscheletro- ed endomembrane componenti possono essere etichettati e monitorati durante lo sviluppo di proteine di fusione di GFP o valutati da in situ dell'anticorpo che macchia. Insieme versatilità genetica dell'organismo, l'intestino di c. elegans fornisce così un modello unico in vivo per l'oggetto visual, inerente allo sviluppo e l'analisi genetica molecolare della membrana polarizzata e biogenesi di tubo. I metodi specifici (tutti gli standard) descritti qui includono come: etichetta componenti sottocellulari intestinale dalla macchiatura dell'anticorpo; analizzare i geni coinvolti nella biogenesi della membrana polarizzata da studi di perdita-de-funzione adattati ai geni essenziali in genere tubulogenesis; valutare i difetti di polarità durante varie fasi di sviluppo; interpretare i fenotipi di epifluorescenza, contrasto differenziale di interferenza (DIC) e microscopia confocale; quantificare i difetti visivi. Questo protocollo può essere adattato per analizzare qualsiasi delle molecole coinvolte spesso altamente conservate in polarità epiteliale, la biogenesi della membrana, morfogenesi tubo e lume.
Introduzione
La generazione delle asimmetrie cellulare e subcellulare, quali la formazione di domini di membrana polarizzata, è cruciale per la morfogenesi e la funzione di cellule, tessuti ed organi1. Gli studi sulla biogenesi della membrana polarizzata negli epiteli rimangono una sfida tecnica, dato che i cambi di direzione nella ripartizione dei componenti sottocellulari dipendono più consecutivi e coincidenti segnali extracellulari ed intracellulari che sono difficili da separare nella maggior parte dei modelli e dipendono fortemente dal sistema modello. Il modello presentato qui - singolo-stratificato Caenorhabditis elegans intestino - è un tessuto di squisita semplicità. Insieme con la singola cellula c. elegans escretore canal (Vedi carta di accompagnamento sulla biogenesi della membrana polarizzata nel canale escretore c. elegans )2, offre diversi vantaggi unici per l'identificazione e caratterizzazione di molecole necessarie per la biogenesi della membrana polarizzata. La conservazione delle stecche di polarità molecolare dal lievito all'uomo rendono questo semplice organo invertebrati marini un eccellente"in vivo camera tessuto" per rispondere alle domande sulla polarità epiteliale che hanno rilevanza diretta per il sistema umano, che è ancora troppo complesso per permettere la dissezione visiva di questi eventi presso il singolo livello in vivodi cellule.
Anche se più segnali di polarità conservate da (1) la matrice di extracelluar, (2) la membrana plasmatica e suoi incroci e traffico vescicolare dei suini (3) intracellulare sono stati identificati3, i principi della loro integrazione nel processo di polarizzata biogenesi della membrana ed il tessuto epiteliale è capita male4. I modelli di cella singola classica in vivo (e.g.s. cerevisiae e lo zigote di c. elegans ) sono stati strumentali nel definire i principi di divisione delle cellule polarizzata e polarità antero-posteriore e hanno identificato critici membrana-collegato polarità determinanti (piccole GTPasi/CDC-42, la PARs di partizionamento difettosi)5,6, ma essi dipendono dalla rottura cues (bud cicatrice, voce di sperma) unico di simmetria e mancanza di giunzione-assicurato domini di membrana apicobasal e, presumibilmente, il corrispondente apicobasal intracellulare ordinamento macchinari. Nostre conoscenze attuali circa l'organizzazione del traffico polarizzato di epiteli, tuttavia, si basa principalmente su mammiferi monocolture 2D7, che mancano spunti extracellulare ed inerenti allo sviluppo fisiologici che possono cambiare le posizioni della membrana domini e le direzioni di traffico traiettorie (passaggio dal 2D al 3D in vitro sistemi di coltura da solo è sufficiente per invertire la polarità della membrana in cellule MDCK (rene canino Madin-Darby))8. In vivo studi evolutivi sulla polarità epiteliale in organismi invertebrati marini modello inizialmente sono stati condotti negli epiteli piatti, per esempio nell'epidermide Drosophila melanogaster , dove hanno identificato il contributo critico delle dinamiche di giunzione per migrazione delle cellule polarizzate e cella foglio movimento9e del traffico endocitico per polarità manutenzione10. Il 3D in vitro e in vivo l'analisi della morfogenesi lumen in epiteli tubolare in cellule MDCK e nell'intestino di c. elegans , rispettivamente, hanno recentemente identificato il requisito del traffico intracellulare per de Novo dominio (apicale) e biogenesi di lumen e posizionamento11,12,13. Lo spessore del tubolare (rispetto al piatto) cellule epiteliali è un vantaggio per l'analisi 3D delle asimmetrie subcellulare poiché consente una distinzione visiva superiore della membrana apicale lumenal, giunzioni apico-laterale, la membrana laterale e la posizioni di organelli intracellulari. A questi vantaggi di visual, il modello di c. elegans aggiunge l'impostazione in vivo , asse inerente allo sviluppo, trasparenza, semplicità del piano corporeo, stirpe delle cellule invarianti e definito, analitica (genetica) e ulteriori vantaggi descritti di seguito.
C. elegans stessa è un verme di struttura tubolare cui trasparenza e semplice architettura fanno gli organi interni allo stesso modo tubolari direttamente accessibile all'analisi visiva della morfogenesi tubo e lume. Le venti cellule del suo intestino (21 o 22 cellule in occasione)14 sono derivate da una cellula progenitrice singola (E) e si sviluppano da un epitelio a doppio strato da un passo di intercalazione in una provetta bilateralmente simmetrico di nove anelli di INT (quattro cellule nella primo anello; Figura 1 schema)14,15,16. Analisi di lignaggio e tessuto dell'intestino, inizialmente determinata dall'ottica di Nomarski via nucleare identità17e successivamente da microscopia di fluorescenza tramite membrane con etichettate, ha fornito le comprensioni critiche nella sua morfogenesi, in particolare i requisiti autonoma delle cellule e cellula-non autonomi per le sue divisioni cellulari direzionale e movimenti (ad esempio, intercalazione, asimmetrie destra-sinistra, rotazione tubo anteriore e posteriore)14,18 . La rete di regolamentazione gene controllo dello sviluppo di questo organo di modello clonale e precoce delle cellule endodermiche specifiche sono ben caratterizzati19,20. Il fuoco qui, tuttavia, è l'analisi della membrana polarizzata e biogenesi lumen in singole cellule tubolari e delle asimmetrie intracellulare di livello delle endomembrane, strutture citoscheletriche e organelli che accompagnano questo processo. L'analisi è facilitata dalla semplicità di questo tubo, dove tutte le membrane apicali (il livello ultrastrutturale distinto da microvilli) affrontano il lume e tutte le membrane basali faccia la superficie del tubo esterno, con membrane laterali tocchino, separati dalla membrana apicale dalle giunzioni (Figura 1 schema; Vedi riferimenti (16,21) per il c. elegans-specifica organizzazione di stretto e componenti di giunzione dei adherens). Biogenesi della membrana apicale è così coincida con la morfogenesi di lumen. Inoltre, la dimensione delle cellule intestinali adulte - le cellule più grande di questo piccolo animale (con eccezione della cella escretore) - approssimativa di una cellula di mammiferi, permettendo il tracking visivo in vivo degli elementi subcellulari, ad es. traiettorie della vescicola, che in genere è tentarono in vitro in una piastra di coltura.
Ai fini di questa analisi cellulare e subcellulare, etichettatura appropriata è fondamentale. Domini di membrana di endo intestinale o di plasma, giunzioni, del citoscheletrostrutture, nuclei e altri organelli subcellulari possono essere visualizzate da loro componenti molecolari specifiche di etichettatura. Molti tali componenti sono stati caratterizzati e continuano ad essere scoperti (tabella 1 dà alcuni esempi e si riferisce alle risorse). Per esempio, varie molecole distinguendo i compartimenti vescicolari e/o tubolari del sistema di endomembrane intestinale, da ER Golgi via vescicole post-Golgi alla membrana del plasma, sono state individuate22. Le specifiche proteine (così come lipidi e zuccheri) possono essere etichettati o direttamente, o indirettamente tramite proteine leganti. Questo protocollo si concentra su in situ macchiatura dell'anticorpo di campioni fissati, una delle due tecniche di etichettatura standard (Vedi il documento di accompagnamento il canale escretore tubulogenesis per una descrizione degli altri tecnica2 - etichettatura in vivo tramite fusioni di proteina fluorescente - che è direttamente applicabile all'intestino; Tabella 2 fornisce esempi di promotori specifici dell'intestino che possono essere utilizzati per guidare l'espressione di queste proteine di fusione nell'intestino). Doppio - o più etichettatura con entrambi gli approcci, o con una combinazione di entrambi plus aggiuntivi chimici macchiatura, permette una maggiore risoluzione visiva approfondita e l'esame delle variazioni spaziali e temporali in co-localizzazione e assunzione di specifici molecole o dei componenti subcellulari (Figura 2). La fissazione e la macchiatura le procedure descritte in questa conservazione del supporto di protocollo della proteina fluorescente verde (GFP) etichettatura durante le procedure di immunostaining. Per l'imaging, i punti di rilevamento chiave e caratterizzazione di tubulogenesis fenotipi tramite procedure standard microscopiche (dissezione e confocale microscopia a fluorescenza) sono descritti (Figura 3, 4). Questi può essere esteso a risoluzione più alta imaging approcci, per istanza superresolution microscopia e trasmissione microscopia elettronica (non descritto qui).
Un punto di forza di questo sistema è la capacità di analizzare la polarità in singole cellule a diversi stadi di sviluppo, da embriogenesi fino all'età adulta. Per esempio, biogenesi di dominio e lume di membrana apicale può essere rintracciata nel corso dello sviluppo a livello di singola cellula tramite etichettatura con ERM-1, un linker membrana altamente conservato-actina della famiglia di ezrina-radixina-moesina23,24 . ERM-1 Visualizza la biogenesi della membrana apicale (1) durante la morfogenesi embrionale tubo, quando essa si verifica in concomitanza con polarizzata divisione cellulare e la migrazione (cellule mossa apically intorno il lume durante intercalazione)15; (2) durante il tardo embrionale e larvale tubo di prolunga che procede in assenza di divisione cellulare o migrazione; e (3) nell'intestino adulto, dove domini di membrana polarizzata sono mantenuti (Figura 1). Nell'espansione post-mitotico epitelio larvale, de novo polarizzati membrana biogenesi così può essere separata dalla morfogenesi del tessuto polarizzati, che non è possibile nella maggior parte dei modelli di polarità epiteliale in vivo e in vitro , compresi quelli con cella singola ad alta risoluzione (ad esempio il 3D MDCK ciste modello8). Con l'etichettatura per altri componenti, questa impostazione fornisce la possibilità (soprattutto allo stadio larvale L1 quando le cellule hanno un più alto rapporto nucleo/citoplasma) per distinguere quei cambiamenti intracellulari che sono specifici per polarizzati (biogenesi della membrana per esempio il riorientamento delle traiettorie traffico) da quelli richiesti simultaneamente per divisione delle cellule polarizzata e migrazione.
La versatilità genetica dei elegans del c. è ben noto25e lo rende un sistema potente modello per l'analisi molecolare di qualsiasi domanda biologica. Uno studio sulla morfogenesi, per esempio, puoi iniziare con un ceppo selvaggio-tipo, un ceppo transgenico dove la struttura di interesse (ad es. una membrana) è etichettata con un marcatore fluorescente, o con un mutante di perdita o guadagno di funzione con un difetto in questo struttura. Un tipico studio di genetico inverso potrebbe generare un mutante dove viene eliminato il gene di interesse in linea germinale (ad es. tramite un'omissione mirata), modificata da mutagenesi (che in genere producono mutazioni puntiformi con conseguente perdita, riduzione o aumento di funzione del gene), o dove la sua trascrizione è ridotto di RNAi. La facilità di RNAi di alimentazione in c. elegans26 si presta anche alla progettazione di schermi mirati che esaminano un gruppo più numeroso di geni di interesse. Senza dubbio più grande forza dell'organismo un modello genetico è la capacità di condurre in vivo avanti schermi (ad es. mutagenesi, schermi RNAi sistematici o genoma) che consentono un'inchiesta imparziale la causa molecolare per un fenotipo di interesse. Per esempio, un imparziale visual c. elegans RNAi tubulogenesis schermo, a partire con un animale transgenico con membrane apicali ERM-1-labeled, scoperto un intrigante polarità intestinale reversibile conversione e fenotipo ectopico lumen, usato qui come esempio per questo tipo di analisi. Questa schermata identificato lo svuotamento di glicosfingolipidi (GSLs; lipidi di membrana obbligano, identificati tramite loro enzimi biosintetici GLS) e componenti della vescicola cappotto clatrina e relativo adattatore AP-1 come i difetti molecolari specifici che causano questa polarità fenotipo di conversione, quindi che caratterizzano questi traffici molecole come in vivo spunti per la polarità della membrana apicale e lume posizionamento12,13. Quando si inizia con un fenotipo specifico mutazione genetica/morfogenesi, tali schermi (o esperimenti di singola interazione genetica/RNAi) possono essere analizzati anche interazioni funzionali tra due o più geni di interesse (Vedi che accompagna il libro sull'escretore canale per un esempio di tale analisi)2. Questo protocollo si concentra su RNAi che, oltre alla sua capacità di identificare direttamente il gene cui perdita causa il fenotipo in avanti schermi, offre vantaggi specifici per l'analisi della morfogenesi. Poiché prodotti genici dirigere morfogenesi spesso funzionano ad un modo dipendente dalla dose, RNAi è solito successo nel generare uno spettro di fenotipi. La capacità di generare informativi parziale-perdita-de-funzione fenotipi aiuta anche ad per affrontare il problema che la maggior parte dei geni importanti tubulogenesis è essenziale e che le loro perdite causano sterilità e mortalità embrionale precoce. Questo protocollo comprende condizionale RNAi strategie per superare questa difficoltà e suggerisce modi per ottimizzare la generazione di un più ampio spettro di fenotipi, come ad esempio una serie allelica prodotta mediante mutagenesi.
Protocollo
1. Etichettatura l'intestino di c. elegans
Nota: vedere il documento dagli autori sull'analisi di canale escretore tubulogenesis 2 per la costruzione di indicatore fluorescente specifico del tessuto plasmidi e la generazione di animali transgenici, comprese le discussioni su proteine di fusione trascrizionale e traslazionale (quest'ultime necessaria per la localizzazione subcellulare di una molecola di interesse). Queste procedure possono essere adattate mediante promotori specifici per guidare la molecola di interesse verso l'intestino. Vedere la tabella 1 per esempi di molecole dimostrati utile per la visualizzazione di c. elegans intestinale endo - e membrane plasmatiche e loro incroci, tabella 2 per esempi dei promotori per la Guida di espressione all'intestino, e tabella 3 per le risorse per collezioni più complete di marcatori intestinali e promotori.
- Macchiatura dell'anticorpo dell'intestino c. elegans 27 , 28
- fissazione
- prendere un vetrino pulito e utilizzare poli-L-lisina per generare un film sottile per i vermi a bastone su. Posto 30 µ l 0.1-0.2% poli-L-lisina sulla diapositiva e posto una seconda diapositiva sulla goccia di poli-L-lisina per fare un " panino ". Poi strofinare le diapositive delicatamente un paio di volte per bagnare le intere superfici di entrambi e lasciarli asciugare per 30 min. Label lato smerigliato delle diapositive con la matita.
Nota: le aliquote di poli-L-lisina di 0,2% di 200 µ l sono state fatte da dissoluzione della polvere nel dH 2 O; Questo può essere conservato a-20 ° C. uso ad alto peso molecolare poli-L-lisina per una migliore aderenza dei vermi. La concentrazione di poli-L-lisina è anche critica. Concentrazioni troppo basse non permetterà vermi attaccare ma troppo alte concentrazioni possono generare il segnale di fondo di fluorescenza. Un film troppo spesso può sciogliersi nella sua interezza. - Inserire un blocco di metallo piatto saldamente sul fondo di un contenitore (ad esempio un contenitore di polistirolo) riempito con azoto liquido.
Nota: Si può usare il ghiaccio secco invece, ma mantiene un blocco di metallo più stabile sul fondo del contenitore di azoto liquido e brividi ben. - Raccogliere vermi sia a lavarli fuori loro piatti con M9 29 o prendono diverse fase vermi (o uova, L1, L2, L3 o L4 stadio larvale vermi) in ogni diapositiva. In genere, pick ~ 100 larve ed embrioni o ~ 20 adulti per ogni diapositiva. Posto 10 µ l lavato fuori vermi in mezzo della diapositiva o pick uova/worm in 10 µ l M9 o 10 µ l 1x PBS 27 (tamponato fosfato salino).
- Uso una pipetta per stendere un numero elevato di vermi per evitare l'agglutinamento.
Nota: Popolazioni di miste lavato fuori vermi, a causa di affollamento e diverso spessore delle fasi, non si attaccano bene e sono meno efficacemente freeze-cracking (Vedi sotto), quindi raccolta fase-specifici vermi (o popolazioni sincronizzati) dà risultati superiori. Le larve attaccare meglio rispetto agli adulti e altri animali possono essere posizionati per ogni diapositiva. - Prima pennata vermi sui vetrini, trasferirli a un piatto medio di crescita del Nematode (NGM) 29 senza OP50 batteri. Aderente di batteri in eccesso ai vermi può anche interferire con attaccare. Fare attenzione che i vermi non asciugarsi.
- Uso una pipetta per stendere un numero elevato di vermi per evitare l'agglutinamento.
- Delicatamente posto (goccia) un croce-modi di 22 mm × 22 vetrino coprioggetti sopra il raccolto vermi tale che i suoi bordi Penda su almeno un lato della diapositiva. Premere verso il basso delicatamente ma fermamente con uno o due dita sul vetrino coprioggetti. Evitare di tosatura che danneggiano l'integrità del tessuto.
- Immediatamente e delicatamente la diapositiva di trasferimento per il blocco di metallo in azoto liquido e lasciate riposare per circa 5 min a congelare. Quindi " flick fuori " il coprioggetto in uno swift spostare utilizzando il bordo sporgente.
Nota: Questo passaggio deve essere eseguita con decisione e mentre la diapositiva è congelata per ottenere " cracking " della cuticola. Attenzione: Si prega di seguire le linee guida di dpi (dispositivi di protezione individuale) quando si lavora con l'azoto liquido. - Immergere i vetrini freeze-incrinato in un metanolo-riempito vetro di Coplin per 5 min a-20 ° C. Poi il trasferimento a un acetone-riempito vetro di Coplin per un altro 5 min a -20 ° C.
Nota: Acetone e metanolo devono essere conservati a-20 ° C per almeno 30 min prima dell'uso. Dopo la fissazione, diapositive possono essere conservati a -20 ° C. attenzione: acetone e metanolo sono tossici. - Togliere i vetrini dal vaso e lasciarli asciugare a temperatura ambiente (TA) prima dell'uso.
- prendere un vetrino pulito e utilizzare poli-L-lisina per generare un film sottile per i vermi a bastone su. Posto 30 µ l 0.1-0.2% poli-L-lisina sulla diapositiva e posto una seconda diapositiva sulla goccia di poli-L-lisina per fare un " panino ". Poi strofinare le diapositive delicatamente un paio di volte per bagnare le intere superfici di entrambi e lasciarli asciugare per 30 min. Label lato smerigliato delle diapositive con la matita.
- Colorazione
- circondano la zona di vermi fissi con un sottile strato di vaselina sulla diapositiva. Disegnare un cerchio intorno a questa zona sulla parte inferiore della diapositiva per segnare il punto.
Nota: È fondamentale che il cerchio di gelatina rimane intatto in tutta la procedura di colorazione per impedire la fuoriuscita delle soluzioni colorazione. - Preparare un " camera bagnata " in un recipiente di plastica con coperchio inserendo carta asciugamani bagnati in esso. Porre il vetrino su un rack in questo " camera bagnata " per evitare l'essiccazione delle diapositive durante la colorazione.
Nota: Diapositive non devono essere a contatto con acqua o con l'altro. - Pipetta delicatamente circa 50 µ l 1X PBS nel cerchio gelatina, abbastanza per coprire l'area. Chiudi la " camera bagnata " con il coperchio. Incubare a temperatura ambiente per 5 min.
Nota: Per evitare di perdere i vermi in questa fase, non pipettare PBS direttamente i vermi. Delicatamente, inserire la punta della pipetta al bordo del cerchio e consentire al fluido di disperdere uniformemente sopra i vermi. - Inclinare la diapositiva e aspirare lentamente il PBS con una pipetta. Porre il vetrino torna piatto sulla cremagliera e aggiungere 50 µ l (o la quantità necessaria per coprire il posto) soluzione di blocco con attenzione. Questo Incubare nella camera bagnata a RT per 15 min. Durante l'attesa, diluire gli anticorpi primari nella soluzione di blocco (Vedi Tabella materiali per esempi di anticorpi primari e concentrazioni).
Nota: Appena preparare soluzione bloccante utilizzando 1X PBS (10ml), 10% tween (50 µ l) e latte in polvere (0,2 g). La quantità di detersivo e la concentrazione di latte può variare a seconda di anticorpi utilizzati e potrebbe essere necessario essere determinata empiricamente. Aspirazione di liquido dalla diapositiva è un altro passo facilmente perdere vermi. Controllare i progressi esaminando il vetrino al microscopio per dissezione, ma fate attenzione che la diapositiva non si asciughi. - La diapositiva di inclinazione e distanza aspirare la soluzione di blocco, utilizzando le stesse precauzioni come descritto sopra. Porre il vetrino torna piatto su rack e lentamente aggiungere 50 µ l il diluito anticorpo primario, utilizzando le stesse precauzioni. Chiudi la " camera bagnata " e incubare a 4 ° C durante la notte o per periodi più brevi a RT.
Nota: Il tempo di incubazione potrebbe essere necessario essere determinata empiricamente per un anticorpo specifico. - Aspirare la soluzione di anticorpo primario come fatto per le altre soluzioni. Quindi lavare i vetrini con soluzione bloccante per 10 min, 3 volte, aggiungendo e rimuovendo la soluzione nello stesso modo come sopra descritto.
- Aggiungi anticorpo secondario (etichettato fluorescente) diluito in soluzione bloccante, Incubare 1h a RT. Vedi Tabella materiali per esempi delle concentrazioni di anticorpi secondari e.
- Rimuovere l'anticorpo secondario e lavarlo, come sopra, con soluzione di blocco 2 volte e, per sgombrare la soluzione bloccante, con PBS 1X, per 10 minuti ogni.
- Aspirare via tanto PBS come possibile senza permettendo l'esemplare ad asciugarsi e rimuovere con cautela la gelatina attorno al campione.
- Aggiungere una goccia di mezzo di montaggio sul campione, e porre un coprivetrino delicatamente sulla parte superiore. Sigillare i bordi del coprivetrino con smalto. Mettere i vetrini in una scatola scorrevole scuro per preservare la macchiatura e conservare a 4 ° C.
Nota: Tenere diapositive al buio a causa della sensibilità alla luce (fluorescenza può scomparire col tempo) ed evitare l'esposizione all'aria mantenendoli sigillati, per lo stesso motivo. I vetrini possono essere conservati per lunghi periodi di tempo a 4 ° C o -20 ° C.
- circondano la zona di vermi fissi con un sottile strato di vaselina sulla diapositiva. Disegnare un cerchio intorno a questa zona sulla parte inferiore della diapositiva per segnare il punto.
- fissazione
2. Interferenza con la funzione di geni essenziali tubulogenesis nell'intestino di c. elegans. Esempio: RNAi.
Nota: ceppi di c. elegans sono coltivate sui batteri OP50 seminati su piastre di NGM secondo protocolli standard 29. Per RNAi, c. elegans nutrono HT115 RNAi batteri sui piatti di RNAi completati con 25 carbenicillina µ g/mL e 2 mM IPTG (isopropyl beta-D-1-thiogalactopyranoside) per induzione del promotore batterico che genera la doppio incagliato RNA (dsRNA) da Introdotto gene c. elegans. Antibiotici e IPTG concentrazione possono variare secondo clone/libreria di RNAi e resistenza voluta di RNAi, resp RNAi specifici cloni possono essere ottenuti da commercialmente disponibili genoma RNAi alimentazione librerie (Vedi ( 26 , 30 , 31) per sfondo sull'alimentazione di RNAi in c. elegans e Tabella materiali per materiali/reagenti e librerie di RNAi).
- Standard RNAi alimentando 26 , 31
- togliere la piastra di biblioteca di RNAi da-80 ° C e metterlo sul ghiaccio secco. Rimuovere il nastro di sigillamento e utilizzare punta sterile per trasferire batteri aderenti del clone di interesse in piastre di agar LB (brodo di Luria) 29 completati con 100 µ g/mL ampicillina e tetraciclina 15 µ g/mL. Striscia fuori batteri sulla piastra di agar. Sigillare la piastra di RNAi libreria con un nuovo nastro di sigillamento. Crescere i batteri durante la notte a 37 ° C.
Nota: Queste piastre di agar possono essere memorizzate a 4 ° C per diverse settimane. Nuovi batteri possono essere coltivati direttamente da loro per proteggere la libreria originale di RNAi. - Giorno successivo, inoculare batteri RNAi da LB agarizzato in 1 mL di terreno liquido LB 29 contenente 50 ampicillina µ g/mL ciascuna e agitare per 14 h (8-18) o durante la notte a 37 ° C.
Nota: Per risultati ottimali utilizzare batteri freschi ogni volta. Vedere riferimento ( 30) per il confronto delle differenti condizioni di coltura (ad es. tempistica della cultura). - Avanti giorno, seme 200 µ l per clone dei batteri RNAi coltivati su piastre separate di RNAi. Lasciate che le piastre a secco e lasciano a temperatura ambiente durante la notte per induzione del promotore batterico.
- Trasferire le larve L4-fase 4-6 su ogni piatto di RNAi. Incubare le piastre di RNAi seminate a RT o 22 ° C per 3-5 giorni.
Nota: Scegliere le larve L4 prima su un piatto NGM senza batteri per rimuovere aderente OP50 che interferiscano con RNAi, o trasferirli in serie in una nuova piastra NGM senza OP50 tre volte. Assicurarsi di ceppi non sono contaminati, come i batteri contaminanti - come OP50 preferito il cibo per i vermi - interferirà anche con RNAi. Regolare la temperatura secondo le necessità: ad esempio sviluppo accelera con alta temperatura; ceppi possono essere sensibili alla temperatura. - Per studi evolutivi, verifica fenotipi della progenie F1 dal 2 ° giorno in poi.
Nota: È fondamentale per controllare animali frequentemente per evitare di perdere l'aspetto o la progressione di un fenotipo (es. spostamento di marcatore) quando valutare la biogenesi della membrana polarizzata durante lo sviluppo. Arricchimento della popolazione F2 per forte fenotipi (ad es. con la scelta di ermafroditi padre per una nuova piastra di RNAi il giorno 2 per selezionare per la maggior parte fortemente influenzata metà porzione della loro progenie) è raramente necessario, da uno spettro da lieve a forte fenotipi è desiderabile.
- togliere la piastra di biblioteca di RNAi da-80 ° C e metterlo sul ghiaccio secco. Rimuovere il nastro di sigillamento e utilizzare punta sterile per trasferire batteri aderenti del clone di interesse in piastre di agar LB (brodo di Luria) 29 completati con 100 µ g/mL ampicillina e tetraciclina 15 µ g/mL. Striscia fuori batteri sulla piastra di agar. Sigillare la piastra di RNAi libreria con un nuovo nastro di sigillamento. Crescere i batteri durante la notte a 37 ° C.
- Condizionale RNAi
Nota: RNAi condizioni possono essere modificate per ridurre grave, o aumentare gli effetti delicati, o interferire in fase-specificamente; modifiche sono utili per la valutazione completa degli effetti fenotipici della spesso geni letali tubulogenesis.- Larvale RNAi - valutazione del RNAi effetti nella stessa generazione (neutro, fase-specifici RNAi)
Nota: per superare sterilità o mortalità embrionale o per interrompere la funzione genica presso l'embriogenesi di post una fase specifica, RNAi è indotto le larve, postare embrionalmente. O mettere uova non trattate (2.2.1.1), gravid adulti (2.2.1.2) o sincronizzati L1 (o, se lo si desidera, poi tappa) larve (2.2.1.3) sulle piastre di RNAi; valutare gli effetti di RNAi nella stessa generazione, ad esempio due giorni più tardi e in poi, in larve e/o adulti.- Pick 30-50 adulti gravid in una goccia sbiancamento soluzione (una soluzione di 1: 4 di NaOH 10 M e della famiglia ipoclorito di sodio) collocato a bordo di una piastra di RNAi. Lasciate asciugare e consentire L1s a schiudersi e spostare nel prato batterico.
Nota: Lo sbiancamento soluzione, generalmente utilizzato per la decontaminazione, ucciderà tutto ma gli embrioni nei loro gusci d'uovo. Pertanto, non lasciare mai la soluzione sbiancante su o vicino i batteri di RNAi. - Scegliere o seme ~ 20 giovani adulti gravid su RNAi piatto e lasciate che li depongono le uova per 2-3 h o fino a quando ci sono circa 300 uova sulla piastra, quindi fuori gli adulti.
Nota: Questo metodo può causare la contaminazione dei batteri da OP50 RNAi. Per ridurre questo rischio, prima di trasferire gli adulti su una piastra di NGM senza batteri per rimuovere OP50 aderente ai vermi. Fare attenzione che gli adulti non rimanere troppo a lungo su piastre di RNAi per evitare l'effetto sugli embrioni RNAi. - Pick o posizionare vermi fase L1 direttamente sulle piastre di RNAi (vedere riferimento ( 29)-per i protocolli di sincronizzazione).
Nota: Si può utilizzare un protocollo di sincronizzazione abbreviato (ad es. per un set-up moderatamente larga scala) lavando i vermi da piastre densamente popolate con M9 per diverse volte fino a quando rimangono sola uova. Dopo 2-3h da cova L1s possono poi essere raccolti in M9 da queste lastre, puliti da ulteriori lavaggi per rimuovere i batteri (3x in M9) e seminate su piastre di RNAi.
- Pick 30-50 adulti gravid in una goccia sbiancamento soluzione (una soluzione di 1: 4 di NaOH 10 M e della famiglia ipoclorito di sodio) collocato a bordo di una piastra di RNAi. Lasciate asciugare e consentire L1s a schiudersi e spostare nel prato batterico.
- Diluizione di RNAi batteri con batteri di RNAi vettore vuoto (lieve RNAi)
Nota: riduzione della quantità di dsRNA diluendo la quantità di batteri di RNAi può essere sufficiente per indurre gli effetti più lievi e possono anche ridurre la letalità embrionale senza abolire tutti gli effetti embrionali. Diluizione di RNAi batteri è anche utilizzato per esperimenti di RNAi doppi e a titolare condizioni per esperimenti di interazione genetica (ad esempio per generare gli effetti delicati per la valutazione del potenziamento e forti effetti per la valutazione della soppressione).- Grow up RNAi ed emPTY vector HT115 RNAi batteri nel terreno di 1 mL LB con ampicillina 50 di µ g/mL, come fatto per le condizioni standard di RNAi.
- Diluire i batteri di RNAi con batteri di RNAi vettore vuoto per ottenere una gamma di concentrazioni differenti, per esempio, di 5%, 15%, 30%, 50%, 70%. Miscelare i batteri ben pipettando su e giù. Dispensare 200 µ l misto batteri su un piatto di RNAi.
- Pick larve L4 4-6 su ogni piatto di RNAi. Verifica il fenotipo da giorno 2.
- RNAi ceppi sensibili (forte RNAi)
- utilizzare ceppi di RNAi-sensibile disponibile, ad esempio, eri-1 (mg366), rrf-3 (pk1426) o eri-1 (mg366) lin-15B (n744) (l'ipersensibilità di quest'ultimo) e seguire le procedure standard di RNAi descritte in 2,1 31 , 32 , 33.
Nota: RNAi ceppi sensibili (ad es. rrf-3 ed eri-1) possono avere dimensioni coulors inferiore rispetto agli animali wild type ed essere sterile a 25 ° C. Essi possono anche avere un basso fondo di fenotipi propri, ad es. bassa letalità embrionale con liquidi penetranti, che deve essere presa in considerazione quando si valutano gli effetti specifici di RNAi.
- utilizzare ceppi di RNAi-sensibile disponibile, ad esempio, eri-1 (mg366), rrf-3 (pk1426) o eri-1 (mg366) lin-15B (n744) (l'ipersensibilità di quest'ultimo) e seguire le procedure standard di RNAi descritte in 2,1 31 , 32 , 33.
- Larvale RNAi - valutazione del RNAi effetti nella stessa generazione (neutro, fase-specifici RNAi)
3. In vivo imaging dell'intestino c. elegans di dissezione microscopia di fluorescenza
- prima visualizzazione animali sotto la luce di fluorescenza, verifica RNAi piastre sotto una luce intensa su qualsiasi microscopio per dissezione. Valutare (e potenzialmente registrare) fenotipi visibili sotto la luce brillante che può influenzare l'analisi, ad esempio di letalità, sterilità (basso numero di progenie), inerente allo sviluppo (per esempio arresto larvale) e altri fenotipi visibili che possono aiutare caratterizzare la funzione di un gene coinvolto nella morfogenesi di biogenesi e lume di membrana polarizzata.
Nota: Solo piatti di punteggio che hanno sufficiente progenie per la valutazione (almeno 50), altrimenti prova condizioni alternative di RNAi. Per la valutazione quantitativa assicurarsi che le piastre non sono contaminati o crescere OP50 (che interferiscono con RNAi). - Di visualizzare gli animali sotto la luce fluorescente, togliere il coperchio e posizionare la piastra di RNAi direttamente sotto il microscopio di fluorescenza per dissezione.
Nota: Per rilevare sottili fenotipi intestinali uno avrà bisogno di un microscopio per dissezione con un allegato di fluorescenza stereo potenza superiore che permette una gamma sufficiente di ingrandimento. Questo protocollo descrive l'uso di un ambito con un 1.5 e 10x obiettivo e una gamma di zoom da 3,5 a 45. - In primo luogo trovare animali sotto una luce intensa per mettere a fuoco. Successivamente, esaminare gli animali sotto la luce fluorescente a basso ingrandimento (per es. nell'ambito dell'obiettivo 1, 5x), utilizzando il filtro appropriato. Esaminare la piastra sistematicamente dall'angolo superiore sinistro all'angolo inferiore destro per eseguire la scansione intera piastra per fenotipi.
- Animale di interesse di selezionare e modificare in obiettivo 10x. Concentrarsi sull'intestino e utilizzare lo zoom per valutare il fenotipo di morfogenesi tubulogenesis/lumen. Vedere la sezione 5 per la segnatura dei fenotipi. In primo luogo, prendere immagini a basso ingrandimento. Quindi passare a forte ingrandimento.
Nota: Poiché gli animali sani spostarsi velocemente, lavorare rapidamente, con una mano sul mouse del calcolatore per acquisizione di immagini durante la messa a fuoco il microscopio con l'altra mano. Rallentamento di animali (ad es. tramite la disposizione transitoria delle piastre a 4 ° C) potrebbe non essere richiesto quando lavorando con i fenotipi di tubulogenesis in gran parte arrestati embrioni e le larve precoce. Le immagini possono essere catturate da una telecamera CCD microscopio-montato e software di acquisizione immagini.
4. L'intestino di c. elegans a risoluzione superiore di imaging da laser a scansione confocale 34 , 35
- montaggio e immobilizzazione
- uso punta delle dita per sottilmente stendere una piccola quantità di grasso o vaselina in un cerchio su un vetrino (~ 6-8 mm di diametro).
Nota: Lo spessore del cerchio di grasso è fondamentale per il montaggio. Per migliori risultati di formazione immagine, immagine larve di uno o più alla volta e utilizzare un cerchio di grasso ultrasottile con come poco liquido possibile, tale che l'animale è attaccato direttamente tra il vetrino e il coprioggetto (se fatto perfettamente, animale sarà essere immobilizzato senza anestetico). Montaggio di uova e di più vecchi animali richiedono un cerchio un po' più spesso per evitare la distruzione del campione durante l'aggiunta di vetrini coprioggetto. - Aggiungere una goccia di tipicamente 3,5 µ l 10 mM di soluzione di sodio azide in mezzo al cerchio e prendono vermi in esso sotto il microscopio per dissezione.
Nota: Preparare una soluzione stock di sodio azide 1 M sciogliendo 65,01 mg NaN3 in 1ml dH 2 O; aggiungere 200 µ l di questa soluzione 1M in 20 mL di tampone di M9. Prendono i vermi rapidamente nella goccia di soluzione di sodio azide per evitare soluzione ad asciugare. Scegliere fasi separatamente per il montaggio ottima, che mira a circa 50 embrioni per diapositiva e circa 20 larve quando si esaminano le più grandi popolazioni. Quando la raccolta di embrioni, uno può usare M9 invece di soluzione di sodio azide. Se si utilizza sodio azide, gli animali devono essere imaged entro 30 min per evitare danni ai tessuti di questo prodotto chimico tossico.
Attenzione: la sodio azide è tossica. - Posizionare delicatamente un coprioggetto di 22 mm × 22 sulla diapositiva. Fare attenzione a non schiacciare i vermi. Esercitare una pressione lieve e controllare sotto microscopio per assicurarsi che i vermi sono fissati bene tra la diapositiva e coprioggetto per dissezione. Etichetta diapositiva.
Nota: La quantità corretta di pressione è fondamentale per evitare di danneggiare l'esemplare (troppa pressione) e non fissandola bene (troppo poca pressione: animali galleggiano invece di attaccare alla diapositiva). Animali galleggianti essenzialmente esclude la formazione immagine adatta.
- uso punta delle dita per sottilmente stendere una piccola quantità di grasso o vaselina in un cerchio su un vetrino (~ 6-8 mm di diametro).
- Imaging
- vetrino posto sotto il microscopio confocale. Ricerca per i vermi con 10x obiettivo e messa a fuoco.
Nota: Utilizzare la luce per mettere a fuoco ove possibile per evitare il photobleaching. - Cambiamento di x 60 o 100 x obiettivo e messa a fuoco sull'intestino.
Nota: L'intestino può essere facilmente identificato sotto la luce brillante di relativo lumen che attraversa il centro dell'animale, dalla faringe all'ano vicino alla punta della coda. Prestare attenzione durante l'applicazione di olio per il x 60 o 100 x olio obiettivo. Miscelazione di diversi tipi di oli possono interferire con ulteriore imaging. Piccola goccia posto di olio sulla diapositiva quando si utilizza un microscopio verticale o sull'obiettivo quando si utilizza un ambito invertito, facendo attenzione a non per contaminare altri obiettivi o parti del microscopio. - Stabilire Kohler DIC/Nomarski illuminazione per l'obiettivo di essere utilizzato per la scansione di 36. Ispezionare l'animale sotto una luce fluorescente con canale appropriato per controllare etichettatura dell'intestino e/o controllare il fenotipo, al fine di selezionare dei campioni adatti per l'imaging. Lavoro rapidamente per evitare di candeggio.
- Interruttore a scansione per limitare futuri immagine all'intestino impostando limiti sul relativo lato dorsale e ventrale di scansione laser.
Nota: Bracketing l'intestino in questo modo è fondamentale se fluoroforo etichette anche strutture di fuori dell'intestino. Durante questa scansione pilota, lavorare con condizioni di scansione rapida per avOID photobleaching. - Interrompere la scansione per selezionare i parametri di scansione per l'esperimento. Impostare 6-20 sezioni per scansione intestinale lungo l'asse z, ad esempio intervalli di 0,2 µm, a seconda della tua richiesta, fase di considerazioni tecniche e/o animale. Set telaio in media per ogni immagine a seconda della complessità di etichettatura e necessaria risoluzione per ridurre il rumore.
Nota: L'impostazione dettagli variano a seconda del microscopio e sperimentare. Uno potrebbe essere necessario ridurre la quantità di sezioni per evitare lo sbiancamento se si esegue la scansione in sequenza di tre diversi fluorofori. Regolare il numero di fotogrammi per numero di sezioni (dovrebbe essere inferiore a numero di sezioni per evitare la distorsione dell'immagine; anche pesare nell'aumento in photobleaching). 4-6 fotogrammi sono in genere sufficienti. - Torna alla scansione con condizioni di scansione definitivo laser (lento) e regolare: luminosità (uso minimo guadagno per ridurre di fondo); laser di potenza (più in alto possibile richiesto, più basso - aumenti photobleaching; solitamente impostazione minima è adeguata); pinhole (evitare l'apertura se non necessario, per mantenere la risoluzione).
Nota: Condizioni di scansione dipendono dal campione e bisogno di essere empiricamente determinato all'inizio della sessione di scansione. Assicurarsi che la luminosità non superi saturazione (limiterà la possibilità di modificare successivamente immagine dal software di imaging). Quando si impostano le condizioni di scansione, considera anche che identiche condizioni devono essere utilizzate per l'imaging di tutti negli esperimenti che confrontano animali da esperimento con controlli. - Acquisizione di serie di immagini. Unire immagini in un'immagine singola proiezione.
Nota: Potrebbe essere necessario salvare immagini di proiezione e/o sovrapposizioni separatamente a seconda del microscopio. - Quando si scattano immagini multicanale utilizzare la scansione sequenziale per evitare trapasso tra i canali (fondamentale per gli studi di co-localizzazione).
Nota: Le impostazioni di immagine potrebbe essere necessario essere cambiato dato maggiore photobleaching connesso a più tempo di scansione. - Sempre acquisire immagini corrispondenti DIC/Nomarski (sezioni) per monumenti e stato generale della morfologia dell'animale scansionati.
- vetrino posto sotto il microscopio confocale. Ricerca per i vermi con 10x obiettivo e messa a fuoco.
5. Quantificazione della biogenesi della membrana polarizzata difetti nell'intestino di c. elegans
Nota: esempio: cilindrata basolaterale apicale ERM-1::GFP e formazione ectopica di lumen laterale indotta da let-767 e APS-1 RNAi.
- Segnando fenotipi sotto il microscopio per dissezione ( Figura 5 A, D, E)
- definire categorie per il punteggio. Esempio: (i) wild-type (WT), (ii) basolaterale cilindrata di ERM-1::GFP (difetto di polarità) e (iii) formazione ectopica di lumen (si sviluppa a seguito di spostamento basolaterale).
Nota: Un'analisi visiva di basso ingrandimento si presta a segnare i numeri degli animali con o senza un fenotipo specifico. Qui, abbiamo scelto un esempio di tre qualitativamente diverse categorie fenotipiche che sono presso lo stesso indicativo di tempo di un peggioramento del fenotipo polarità che è analizzato. Tuttavia, una varietà di diversi fenotipi qualitative e quantitative possa essere segnata, come diametro del lume lume morfogenesi difetti, presenza/assenza (o numeri) di vacuoli citoplasmici positivi di GFP e dimensione o numeri di presenza cisti (vedere < forte classe = "xfig" > figura 3 per esempi). - Depending sulla grandezza delle differenze previste, Punteggio ottenuto circa 100 vermi vivi sul loro piastre di agar al microscopio per dissezione in una serie di doppi o triplo di esperimenti.
Nota: Uno deve segnare ogni animale che entra in vista durante la scansione piastre sistematicamente, per esempio dall'angolo superiore sinistro all'angolo inferiore destro della piastra (assicurarsi di vermi hanno popolato le piastre uniformemente). - Ripetere questa operazione per 3 set di esperimenti indipendenti. Generare il grafico a barre e valutare il significato dei risultati.
- definire categorie per il punteggio. Esempio: (i) wild-type (WT), (ii) basolaterale cilindrata di ERM-1::GFP (difetto di polarità) e (iii) formazione ectopica di lumen (si sviluppa a seguito di spostamento basolaterale).
- Scoring fenotipi al microscopio confocale ( Figura 5 B)
- definire le categorie per il punteggio, ad esempio il numero di lumen ectopico per animale
Nota: un ingrandimento superiore analisi visiva si presta a segnando un marcatore quantificabili o fenotipo per animale e permette segnando dei marcatori sottocellulari che potrebbero non essere distinguibili da microscopia di dissezione. Il presente esempio di conteggio ectopico lumen per animale in un sottoinsieme dei vermi dell'esperimento stesso precedentemente valutate dissecando microscopia (5.1.1, categoria 3) affina la valutazione del fenotipo peggioramento della polarità che è esaminato qui. Tuttavia, può essere segnata una varietà di altri fenotipi o parametri, ad esempio numero di vescicole, presenza/assenza o il numero di componenti sottocellulari che co-localizzano, l'intensità di fluorescenza (quest'ultimo quantificato di ImageJ; veda che accompagna il libro sulla canale escretore) 2. - a seconda della grandezza delle differenze previste, quantificare marcatore fenotipico (qui, Lumen ectopico) in circa 20 animali in una serie di doppi o triplo di esperimenti al microscopio confocale.
- Ripetere per 3 set di esperimenti indipendenti. Generare grafici a barre e valutare il significato dei risultati.
- definire le categorie per il punteggio, ad esempio il numero di lumen ectopico per animale
Risultati
Questo protocollo descrive come molecolarmente analizzare e visualizzare la morfogenesi di biogenesi e lume di membrana polarizzata nell'intestino di c. elegans , a singola cella e a livello subcellulare. Il singolo-stratificato venti-cella c. elegans intestino è formata da diretto la divisione cellulare e la migrazione durante l'embriogenesi metà. A questa tempo, polarizzata membrana domini affermate, ancora de novo biogenesi della membrana polarizzata continua con il maturo ma espansione epitelio in tutto quattro stadi larvali fino all'età adulta, permettendo di focalizzare l'analisi polarizzata biogenesi della membrana (Figura 1A).
Per visualizzare i componenti di cellulare e subcellulare di c. elegans , due strategie sono comunemente usate: immunofluorescenza (dettagliata nel presente protocollo, sezione 1; Figura 2 , Figura 4 -F) e l'espressione di proteine di fusione di fluorescenza (dettagliato nel libro d'accompagnamento sul canale escretore polarizzato membrana biogenesi2; Figura 4, di Figura 1B, Figura 2, Figura 5). Doppie e multiple etichettatura, combinando diverse etichette di ogni o entrambi i metodi, può risolvere le asimmetrie di membrana come apicale e basolaterale domini di membrana e la relazione di diversi componenti subcellulari a vicenda (Figura 2, Figura 4-E). Il linker di membrana-citoscheletro ERM-1::GFP è indicato qui come un indicatore della biogenesi della membrana apicale che coincide con la morfogenesi di lume in questo epitelio singolo-stratificato. Utilizzando questo marcatore, matrice di membrana/lume intestinale apicale biogenesi difetti e loro difetti del gene causativo possa essere identificata dagli studi di perdita di funzione, per esempio da imparziali schermi di genoma usando RNAi (RNAi approcci adottati per la generazione di tali fenotipi sono descritti nella sezione 2 del presente protocollo). Figura 3 e Figura 4 sono riportati esempi di immagini di basso a moderato ingrandimento della membrana apicale/lume fenotipi di biogenesi acquistati da un microscopio a fluorescenza per dissezione equipaggiato con un obiettivo di alta potenza; e di maggiore ingrandimento immagini acquisite da un laser confocale scansione microscopio (questi approcci al microscopio sono descritte nelle sezioni 3 e 4). Come esempio di quantificazione membrana polarizzata biogenesi difetti, gli effetti di RNAi con let-767 (codifica un steroide deidrogenasi/3-ketoacil-CoA reduttasi) e aps-1 (codifica per la subunità sigma della clatrina AP-1 adattatore) su ERM–1::GFP localizzazione e posizionamento di lumen sono mostrati nella Figura 5.
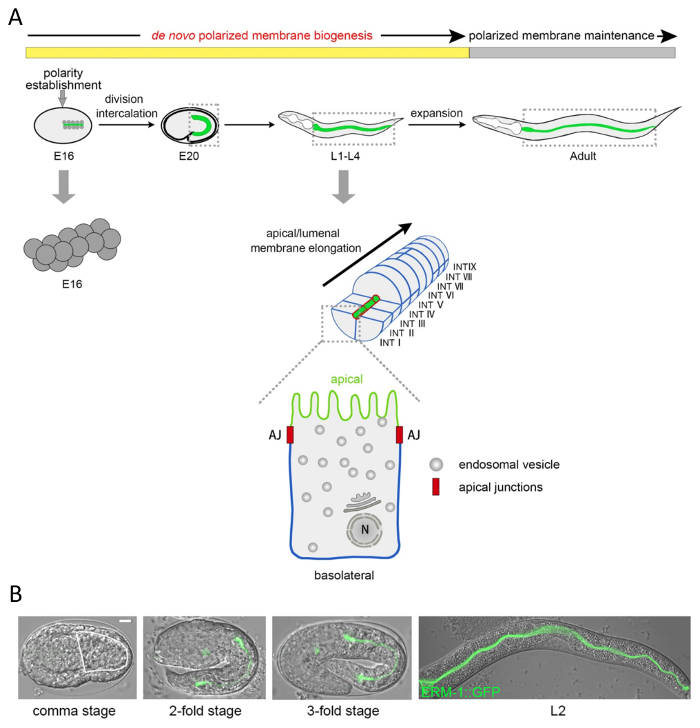
Figura 1 : Struttura cellulare e subcellulare e morfogenesi del selvaggio-tipo C. elegans intestino. (A) Schematica dello sviluppo intestinale di c. elegans , composizione cellulare ed endo - e membrane plasmatiche. L'intestino di c. elegans è generato clonally dal blastomero E Nato presso la stadio di 8 cellule. Dopo quattro cicli di divisione cellulare, suoi 16 cellule forma (fase E16) un epitelio stratificato raddoppiato radialmente simmetrico15. In questa fase il citoplasma di ogni cellula polarizza, con nuclei trasferirsi i futuri componenti apicali e citoplasmici muovendo verso l'opposto (futuro basale), domini di membrana. In un unico passaggio di intercalazione cellule sinistra e destra ventrale spostare (in parallelo) nello strato dorsale delle cellule per formare il tubo bilateralmente simmetrico di 9 anelli di INT. Ogni cella deve affrontare e costruisce il lume con la sua membrana apicale/lumenal (verde; strutturalmente distinto da microdomini di membrana specifico, i microvilli) e contatti vicine cellule o cavità del corpo con sue membrane basolateral (blu), tranne il primo Anello INT che è formata da quattro cellule. Giunzioni apicale (rosso) separano i domini di membrana apicali e basolaterale. Dopo intercalazione, de novo la biogenesi della membrana continua insieme la crescita dell'intestino durante l'embriogenesi tardiva e i quattro stadi larvali nell'età adulta, dove solo un minimo ulteriore crescita si verifica (fase di manutenzione membrana polarizzata ). La singola cella ingrandita indica il sistema di endomembrane con ER e Golgi sopra il nucleo (N) e vescicole endosomal. (B) DIC/Nomarski e confocale sovrapposizione micrografie dell'intestino c. elegans in via di sviluppo con l'etichetta con il marcatore di membrana apicale-citoscheletro ERM-1::GFP. L'intestino nella fase di virgola è delineato da una linea bianca (ERM-1::GFP già vagamente è espressa sulla membrana apicale all'inizio di intercalazione, ma non può essere apprezzato in questa immagine). Gli animali qui e sotto sono mostrato con anteriore (testa) a sinistra, posteriore (coda) in, up dorsali, ventrali giù. Barra della scala: 5 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2 : Esempi di doppie e triple etichettatura dello sviluppo selvaggio-tipo C. elegans intestino utilizzando anticorpi e proteine di fusione. (A, B) Embrioni. (A) fase di virgola. PAR-6::GFP (verde, componente della polarità PAR apicale complesse), l'anticorpo anti-PAR-3 (rosso/TRITC (tetrametil rodamina isotiocianato); un altro componente della polarità PAR apicale complessi) e MH33 (blu/Cy5 (Cyanine5); anti-IFB-2/intermedio filamento). PAR-6::GFP e l'anticorpo di PAR-3 etichetta sulla membrana apicale dell'intestino c. elegans (tra parentesi). IFB-2, un altro marcatore apicale in fasi successive, è panmembraneously localizzato in questa fase iniziale. PAR-6::GFP e anti-PAR-3 anche etichettare la faringe (sinistra); il lume intestinale è indicato da loro sovrapposizione con IFB-2 (turchese) e il tubo intestinale è delineato da blu anti-IFB-2 (a destra). (B) fase 2 volte. AJM-1::GFP (verde, componente di giunzione), ICB4 anticorpo (rosso/Alexa, ICB4 rileva un antigene intestinale membranose sconosciuto). AJM-1::GFP etichette le giunzioni apicale dell'intestino c. elegans , visibile come reticolo peri-lumenal scaletta (etichetta anche giunzioni hypodermal; non visibile dall'immagine è focalizzata sull'intestino; vedere la sezione 4, imaging confocale). ICB4 macchie di tutte le membrane dell'intestino c. elegans . Frecce puntano alle membrane basolateral macchiate di anti-ICB4. (C, D) Larve di L2. (C) LET-413::GFP (verde), phalloidin (rosso/Texas-rosso, un phallotoxin vincolante al F-actina) e MH33 (blu/Cyanine5, anti-IFB-2). LET-413/Scribble è un componente della polarità basale complesse e si localizza basolateral membrane dell'intestino c. elegans (tra parentesi). Falloidina e l'anticorpo di IFB-2 etichetta il citoscheletro submembraneous apicale dell'intestino c. elegans (viola). Falloidina macchie anche fortemente i muscoli della parete del corpo, la macchiatura intestinale in modo schiacciante. Inserto Mostra maggiore ingrandimento dell'area circoscritta. (E) della larva L3. SLCF-1::GFP (verde; integrale membtrasportatore di componente/zucchero rane), ERM-1::mCherry (rosso) e MH27 anticorpo (blu/Cyanine5, anti-AJM-1). SLCF-1::GFP etichette la membrana basolaterale, mentre ERM-1::mCherry etichette sulla membrana apicale dell'intestino c. elegans (tra parentesi); AJM-1 etichette sue giunzioni apicale. (F-F' ') Larva di L2. (F, F') Immagini di singolo colore. SLCF-1::GFP (verde) etichette la membrana basolaterale (membrane laterale indicate da frecce bianche sottili). MH27 giunzioni apicale (frecce gialle breve) di etichette (blu/Cyanine5). (F"F' ') Sovrapposizione di immagini con e senza l'actina. Inserti in mostrano maggiore ingrandimento delle zone "in box". Nota distinzione netta dell'angolo di apicolateral delle cellule intestinali di questi marcatori di membrana/giunzione diversi che appaiono superficialmente simili nelle immagini a colori singolo (F, F'). Frecce bianche spesse in F' 'scegliere il citoscheletro di actina apicale/lumenal etichettato da falloidina (altrimenti sopraffatto dall'actina del muscolo). Tutte le immagini sono proiezioni confocale (z-pile di 0,2 µm), acquisite da scansione sequenziale per evitare trapasso tra i canali. Scala bar (per A-E, F-F ' ' e tutti gli inserti): 5 µm. Clicca qui per visualizzare una versione più grande di questa figura.
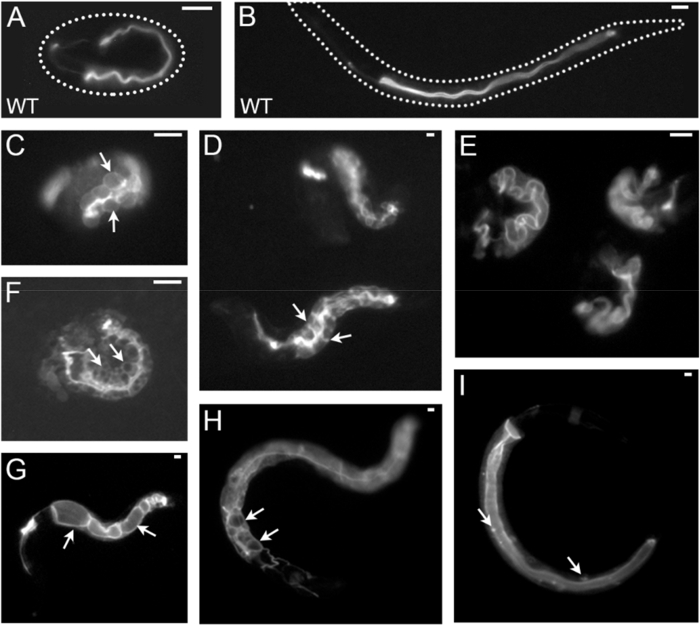
Figura 3 : Esempi di C. elegans intestinale morfogenesi lumen e membrana polarizzata difetti a basso a moderato ingrandimento (dissezione micrografi di fluorescenza). Tutte le immagini sono acquisite da un microscopio a fluorescenza per dissezione con un allegato di fluorescenza stereo ad alta potenza su misura (Tabella materiali). Sono mostrati diversi ingrandimenti. Tutti i fenotipi sono stati ottenuti da RNAi con diversi geni in un ceppo etichettati con ERM-1::GFP (localizzata alle membrane apicali/lumenal canale intestinale ed escretori alle embrionali e primi stadi larvali, mostrati qui). I fenotipi di polarità e lumen intestinali sono: embrione Wild-type (A, B) (A) e larva (B); (C, D) cilindrata basolateral di ERM-1::GFP; le cellule intestinali sono ingrandite e apparire gonfiore in questo embrione (C, frecce scegliere singole cellule intestinali), ma sono di dimensione di selvaggio-tipo e disposizione in queste larve (D, punti di freccia laterale delle membrane tra INT II e III); (E) ha allargato e contorto lumen in tre embrioni; (F) ERM-1::GFP ampliamento nella zona di giunzione laterale (zig-zag lumen) e nelle intestinale citoplasma contenente vacuoli GFP-negativi (frecce); (G) cisti lumenal inbetween intralumenal le adesioni (punto di frecce per due cisti). (H) citoplasmatici e basolaterale ERM-1::GFP cilindrata con lumen ectopico (frecce); (io) ERM-1::GFP spostamento da GFP-positive puncta (frecce) nel citoplasma. Canali escretori e canale escretore fenotipi non sono qui descritti (canal è indicata per l'intestino di sinistra, a destra in tutte le immagini). Scala bar: 10 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 : Esempi di C. elegans intestinale polarizzati morfogenesi difetti della membrana e lume a maggiore ingrandimento (immagini confocal). (A, C, E, G, I, K) Embrioni. (B, D, F, H, J, L) Larve. Tutti i fenotipi sono stati ottenuti da RNAi con diversi geni in un ceppo etichettati con ERM-1::GFP (verde in tutte le immagini). La formazione immagine è focalizzata sull'intestino. Immagini di embrioni mostrano anche canali escretori (a sinistra dell'immagine), tra cui fenotipi di canale (non descritti). (A, B) Embrione di tipo selvaggio (A) e larva (B). (C) cilindrata Basolateral di ERM-1::GFP apicale (fase di virgola; fine intercalazione). (D) conversione di polarità: cilindrata basolaterale apicale ERM-1::GFP e accumulo apicale di basolateral ICB4, rivelato da doppia etichettatura. F-actina (etichettato da falloidina-TRITC) delinea gli animali dalla macchiatura fasci muscolari longitudinali (animale è tripla etichettato). (E) spostamento Basolateral di ERM-1::GFP in ritardo 3 volte embrione. L'anticorpo di IFB-2 apicale (blu/Cyanine5) indica lume intatto e peri-lumenal filamenti intermedi. (F) Lumen ectopico etichettati da anti-IFB-2 (blu/Cyanine5). (G) ERM-1::GFP negativo vacuoli nel citoplasma intestinale. (H) ERM-1::GFP positivi vacuoli nel citoplasma intestinale. (I, J) Assenza di lumen nell'embrione e larve, rispettivamente. (K) ampia gut. Cistica (L) e intestino contorto. (A, D, H, I, J, K, L) sono proiezioni confocale. (B, C, E, F) sono sezioni confocale. Luminosità è stata aumentata di G per evidenziare i vacuoli citoplasmici GFP-negativo. Scala bar: 10 µm (lo stesso per tutti gli embrioni e le larve, rispettivamente). Clicca qui per visualizzare una versione più grande di questa figura.
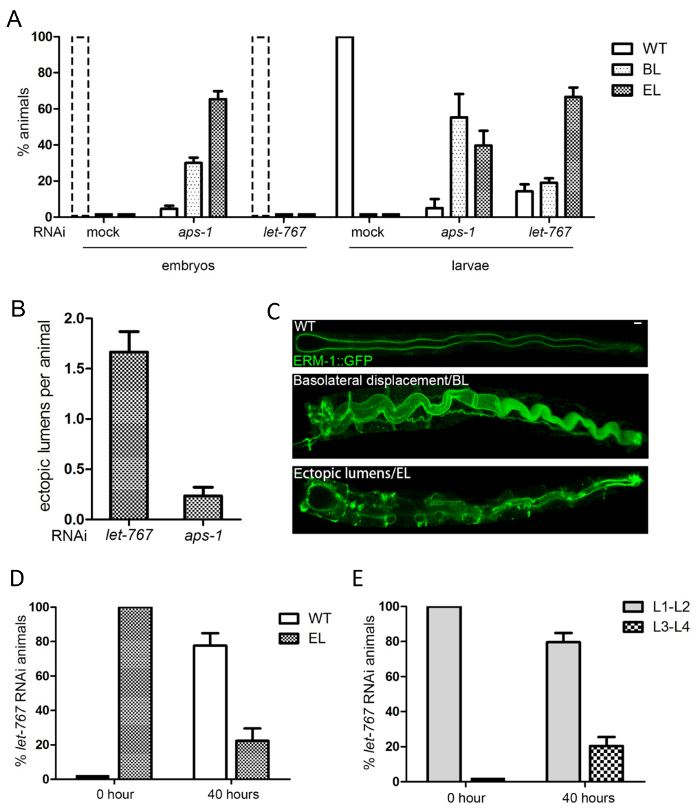
Figura 5 : Conversione di polarità intestinale e reversione: un esempio per la quantificazione dei difetti di biogenesi lumen e membrana polarizzati. (A, B, C) Let-767e aps-1RNAi entrambi provocano ERM-1::GFP basolaterale spostamento (BL) e formazione ectopica di lumen (EL), ma a diversi stadi di sviluppo. (A) quantificazione di microscopio per dissezione: conteggio degli embrioni (sinistra) e larve (adestra) con i fenotipi di polarità 2 giorni dopo la semina vermi sulle piastre di RNAi. Nota: tutti gli animali di derisione e let-767(RNAi) hanno covato in questo momento (quindi non ci sono nessun embrioni, che ha avuto, tuttavia, tutte le polarità di selvaggio-tipo; rotto colonne line). APS-1 RNAi induce difetti di polarità già negli embrioni, mentre let-767RNAi li induce nelle larve. La percentuale più alta di lumen ectopico (vs basolaterale cilindrata) in embrioni RNAi aps-1contro le larve è dovuta ad arresto degli embrioni con lumen ectopico. (B) quantificazione mediante microscopia confocale: conteggio ectopico lumen per animali all'inizio dello sviluppo ectopico lume nelle larve. Let-767 RNAi induce lumen più ectopico in larve di aps-1RNAi (aps-1RNAi larve sono "escapers" che hanno non arresTed come embrioni). (C) immagini Confocal di selvaggio-tipo larve e larve con cilindrata di ERM-1::GFP basolaterale (BL) e Lumen ectopico (EL); barra della scala: 5 µm. inversione di polarità (D, E) negli animali di RNAi let-767(conteggio degli animali con e senza difetto di polarità [BL/EL] Dissezionando microscopio). 20 let-767(RNAi) animali con i fenotipi di lieve lume ectopico sono stati trasferiti da una piastra di RNAi ad una piastra del OP50 il giorno 4 e valutati dopo 40 ore. (D) più di 50% larve sono ritornati alla polarità di selvaggio-tipo (ERM-1 alla membrana apicale). (E) 20% di gli animali crescono oltre la fase larvale L1 (let-767(RNAi) risultati nell'arresto di L1). Tutti i dati vengono visualizzati come media + /-SEM, n = 3. Clicca qui per visualizzare una versione più grande di questa figura.
| Tabella 1: Esempi di indicatori per il sistema di membrana intestinale larvale e adulto di c. elegans 1. | ||||
| Nome della proteina | Localizzazione subcellulare | Struttura/funzione delle proteine | Commercialmente disponibili anticorpi specifici di c. elegans (DSHB2) | Esempi di ceppi disponibili presso le CGC |
| OPT-2/PEPT-1 | proteina del transmembrane apicale | Oligopeptide transporter | KWN246 (pha-1(e2123) III, rnyEx133[opt-2(aa1-412):: GFP) + pha-1(+)]) | |
| AQP-4 | proteina del transmembrane apicale | canale d'acqua | ||
| ERM-1 | brushborder apicale | linker membrana – citoscheletro | ERM1 | |
| ACT-5 | brushborder apicale | actina citoplasmatica | (3) | |
| IFB-2 | brushborder apicale | componente di filamenti intermedi | MH33 | |
| EPS-8 | brushborder apicale | Human-epidermal-growth-factor-receptor-kinase-substrate-8 ortholog | ||
| PAR-6 | membrana apicale | componente complesso apicale polarità | ||
| SLCF-1 | proteina transmembrana basolaterale | monocarboxylate transporter | ||
| AQP-1 | proteina transmembrana basolaterale | canale d'acqua | ||
| LET-413 | membrana basolateral | Scribble omologo, adattatore e determinante di polarità | LET413 | |
| HMP-1 | svincolo apicale (CCC4) | Α-catenina, componente complesso caderina-catenina | FT1609 (unc-119(ed3) III; xnIs528 [hmp-1p::hmp-1:: GFP + unc-119(+)]) | |
| HMR-1 | giunzione apicale (CCC) | E-caderina, componente complesso caderina-catenina | HMR1 | |
| AJM-1 | giunzione apicale (DAC5) | molecola di giunzione integrità, DLG-1/AJM-1complex componente | MH27 | SU159 (jcEx44 [ajm-1::GFP + rol-6(su1006)]) |
| DLG-1 | giunzione apicale (DAC) | Dischi-grande omologo, proteine MAGUK, DLG-1/AJM-1complex componente | DLG1 | |
| RAB-11 | endosomal vescicole | traffico6 | RT311 (unc-119 (ed3) III; pwIs69 [vha6p::gfp::rab-11, Cbunc-119(+)]) | |
| RAB-5 | endosomal vescicole | tratta di esseri | RT327 (unc-119 (ed3) III; pwIs72 [pvha6::gfp::rab-5, Cbunc-119(+)]) | |
| RAB-7 | endosomal vescicole | tratta di esseri | RT476 (unc-119 (ed3) III; pwIs170 [vha6p::gfp::rab-7, Cbunc-119(+)]) | |
| RAB-10 | endosomal vescicole | tratta di esseri | RT525 (unc-119 (ed3) III; pwIs206 [pvha6::gfp::rab-Cbunc-119(+) 10) | |
| MANS | Golgi | Α-mannosidase II | RT1315 (unc-119 (ed3) III; pwIs503 [pvha6::mans::gfp Cbunc-119(+)]) | |
| 1 Esempi sono selezionati da risorse elencate nella tabella3. | ||||
| 2 Developmental Studies Hybridoma Bank. | ||||
| 3 Gli anticorpi contro l'actina vertebrato cross-reagiscono. | ||||
| 4 CCC: complesso caderina-catenina; si localizza nella parte apicale della giunzione apicale; corrispondente alla giunzione dei adherens (AJ). | ||||
| 5 DAC: DLG-1/AJM-1complex; si localizza la parte basale della giunzione apicale; corrispondente alla stretta della giunzione (TJ). | ||||
| 6 Per ulteriori molecole di vescicola-associate espressi nell'intestino vedere ref (22). | ||||
| Nota: non tutte le molecole sono state testate come proteine di fusione sotto i propri promotori o dagli anticorpi. | ||||
| Tabella 2 : Esempi di C. elegans intestino specifici promotori e tempo di espressione1. | |||
| Promotori | Stage di espressione | ||
| ELT-2 | espressione inizia durante la fase di cella E 2 e persiste nell'età adulta | ||
| VHA-6 | espressione inizia nell'embrione tardivo e persiste nell'età adulta | ||
| GES-1 | espressione inizia circa dalla fase 4E cella e persiste nell'età adulta | ||
| fine-1 | espressione comincia dopo la fase delle cellule 1E e diminuisce durante l'embriogenesi successiva | ||
| 1 Esempi sono selezionati da risorse elencate nella tabella 3. | |||
| Tabella 3: Risorse per trovare C. elegans intestino specifiche molecole, etichettatura di reagenti/ceppi e gli anticorpi. | |||
| 1. Caenorhabditis Genetics Center (CGC)42 per reagenti disponibili e ceppi | |||
| 2. Wormbase43 per informazioni intestino specifiche molecole, ceppi e anticorpi | |||
| 3. Informa |
Discussione
Questo protocollo viene descritto come combinare standard perdita di funzione genetica/RNAi e imaging (etichettatura e microscopici) approcci per sfruttare l'epitelio intestinale di c. elegans come un modello per l'analisi visiva e molecolare della in vivo polarizzata biogenesi della membrana e lume.
Etichettatura
Questo protocollo si concentra sulla macchiatura dell'anticorpo. In situ etichettatura dagli anticorpi è un approccio alternativo altamente specifico per etichettatura da fusione fluorescente proteine (descritti nel documento di accompagnamento sulla biogenesi della membrana canale escretore)2. Anche se la macchiatura dell'anticorpo non permette la formazione immagine diretta, può fornire conferma per la localizzazione di una proteina di interesse (nessun metodo di etichettatura è senza fallire). Inoltre, domande per quanto riguarda la morfogenesi e/o la localizzazione subcellulare di una proteina possono essere valutate spesso negli animali fissi. Immunostaining è utile per matrimoniale ed etichettatura multipli e può essere combinato con etichettatura da proteine di fusione fluorescenti se questi può essere conservati attraverso le necessarie procedure di fissazione e permeabilizzazione. Il protocollo descritto qui consente in genere questo (Figura 2). In situ etichettatura degli animali fissi di anticorpi o macchie chimiche può anche fornire vantaggi per superresolution tecniche microscopiche come tempesta (microscopia stocastico ricostruzione ottico). Immunofluorescenza rileva l'antigene endogeno e può essere adattato, per esempio, per distinguere le modifiche di posttranslational specifica proteina. Può produrre risultati in tempi rapidi se gli anticorpi sono disponibili, una volta in situ tecniche di colorazione - non come semplice in c. elegans esemplari come in coltura cellulare - sono state stabilite.
La generazione di un nuovo anticorpo (non descritta qui) è, tuttavia, richiede molto tempo. Purtroppo, la selezione di commercialmente disponibile c. elegans anticorpi primari rimane piuttosto piccola, e non tutti sono in grado di rilevare l'antigene in situ (Vedi tabella 1 per esempi di anticorpi ha dimostrato di rilevare gli antigeni intestinali in situe tabella 3 per risorse aggiuntive). La maggior parte degli anticorpi generati contro antigeni vertebrati saranno non cross-reagiscono con loro omologhi di c. elegans . La selezione di anticorpi secondari deve prendere in considerazione le specie del primo anticorpo (discusso in generale immunofluorescenza protocolli27,28). Selezioni di grandi dimensioni sono disponibili in commercio con coloranti fluorescenti (per esempio Alexa Fluor coloranti) in continuo miglioramento. Per ottimizzare la macchiatura, coloranti possono essere selezionati per la loro capacità di abbinare il microscopio utilizzato per l'imaging, ad esempio il laser del microscopio confocale, o, se super risoluzione microscopia prevede inoltre, per la loro capacità di "blink"37. Marcata direttamente gli anticorpi primari o chimico macchie (per esempio fluorescente etichettati falloidina) sono inoltre disponibili e sono particolarmente utili per la doppia colorazione.
La difficoltà per in situ anticorpo che macchia in c. elegans è l'impermeabilità delle coperture dell'uovo dell'embrione e la cuticola larvale/adulto che entrambi richiedono di disgregazione chimica e/o meccanici per consentire l'accesso dell'anticorpo al tessuto. Anche se sono stati sviluppati protocolli di colorazione anticorpo complesso liquido per superare questo problema27,28, la maggior parte includono collagenasi per permeabilizzazione, che tende a danneggiare il tessuto dell'obiettivo. Al contrario, il metodo di congelamento-crack qui descritto è un modo semplice per aprire il worm cuticole o gusci d'uovo. Viene eseguita direttamente sul vetro slide dove i campioni sono raccolti (e dove il resto della colorazione viene eseguito anche), e funziona particolarmente bene per le uova e le larve che bastone migliore per vetrini (cioè le fasi prevalentemente esaminate in studi di tubulogenesis). Inoltre non interferisce con la conservazione delle proteine di fusione fluoroforo. La tecnica richiede qualche destrezza manuale, come la corretta pressione sul coprioggetto (prima sfogliando) ed evitare la pressione di taglio sono fondamentali per preservare l'esemplare (come è una manipolazione delicata e pipettaggio durante l'intera procedura di colorazione).
Condizioni di fissazione potrebbero essere necessario essere empiricamente determinato e regolato per l'antigene di struttura che deve essere macchiato (discusso in27). Tecniche di fissazione più delicati (ad es. formaldeide-basato) possono conservare meglio antigenicità, anche se ciò deve essere bilanciata con la necessità di mantenere la morfologia del tessuto, critico per l'analisi della morfogenesi. Fissazione più mite condizioni anche contribuire a preservare le proteine di fusione fluorescenti in doppi etichettatura esperimenti. Allo stesso modo, la quantità di blocco agente (es. latte o siero albumina bovina/BSA) e detersivo nella soluzione di lavaggio richiede regolazione empirica per bilanciare sfondo con colorazione specifica. Dettagli su aspetti generali delle tecniche di immunofluorescenza, ad es. discussione di diverse tecniche di colorazione, la progettazione di controlli appropriati e suggerimenti per l'ottimizzazione di queste procedure per intestini di vite senza fine (ad es. riducendo al minimo intestinale autofluorescenza) può essere trovato in generale e protocolli di immunofluorescenza specifica c. elegans , a cui fa riferimento in tutto.
Interferenza con la funzione del gene e valutazione dei fenotipi di tubulogenesis
Questo protocollo evidenzia specifici approcci di RNAi che sono utili durante la valutazione di geni con funzioni precoce, essenziale e onnipresente, la cui perdita parziale (piuttosto che completa) è più informativo, come è il caso per la maggior parte dei geni tubulogenesis (il nostro genoma schermo su ERM-1::GFP-intestini con etichettati ha suggerito che l'interferenza con tali cause di geni > 90% di tutti i fenotipi di tubulogenesis informativo in questa particolare impostazione12). I numerosi vantaggi che offre c. elegans per manipolazioni genetiche (ad esempio relativo tempo breve generazione) e i diversi approcci per perturbare la funzione del gene da avanti (a partire con il funzione/fenotipo) e inversa (a partire con il approcci genetici gene) sono discussi in generale c. elegans letteratura31,38. La disponibilità di RNAi di genoma commercialmente disponibili librerie di alimentazione anche permette di utilizzare questa tecnica di genetica inversa come uno strumento di screening genetico in avanti (Vedi Tabella materiali per le risorse). I vantaggi specifici di RNAi per l'analisi di tubulogenesis includono la capacità: per generare una gamma di fenotipi equivalente ad una serie allelica mutante (questo di solito funziona bene per i geni di morfogenesi dose-dipendente); per rimuovere materna RNAs (in genere coinvolti nella morfogenesi precoce/tubulogenesis); fase-specificamente interferire (utile per la valutazione degli effetti sulla biogenesi della membrana polarizzata durante lo sviluppo larvale postmitotic).
Dettagli sugli aspetti generali delle procedure di RNAi sono discussi in refs (26,s = "xrif" > 31). Chiave per l'analisi dei fenotipi tubulogenesis letale è la capacità di modulare le condizioni di RNAi per aumentare la gamma di fenotipi. Tubulogenesis informativo fenotipi solitamente possono essere generati in uno sfondo di selvaggio-tipo senza la necessità di intestino specifici ceppi del RNAi,39. Tuttavia, tali ceppi sono disponibili se questo ha esito negativo e possono anche essere utilizzati per distinguere cellule autonome da effetti non autonomi. Sono stati segnalati diversi approcci che consentono di modulare la forza di RNAi, ad es. la titolazione delle concentrazioni di IPTG per induzione di dsRNA, un approccio che può produrre i risultati più riproducibili30. Tuttavia, titolazione quantitativamente esatta non può essere necessaria quando si mira a generare uno spettro di fenotipi diversi. Nel complesso, il successo di questa analisi non è tanto dipendente da massimizzare l'effetto di RNAi, come è il determinare condizioni di RNAi che generano uno spettro informativo dei fenotipi (che spesso può essere il risultato di non ottimale (per esempio più mite) RNAi condizioni).
Per la valutazione visiva dei fenotipi tubulogenesis indotti da RNAi è importante determinare la finestra ottima per la valutazione fenotipica. Si consiglia di iniziare a valutare le piastre presto (ad es. due giorni dopo la raccolta degli animali alle loro piastre di RNAi in condizioni standard di RNAi) e di seguire loro abbastanza a lungo per possibili effetti tardivi. Un corso di tempo dello sviluppo di un difetto di polarità peggioramento, ad esempio, dovrebbe coprire in larve in genere arrestate 3-7 giorni. Condizioni per l'analisi della biogenesi della membrana polarizzata in cellule di divisione postmitotic dell'intestino larvale possono essere ulteriormente migliorate quando si utilizza mutanti o RNAi animali con crescita rallentata (come, per esempio, let-767(RNAi) o mutante animali 12, Figura 5). Qualsiasi corso di tempo deve essere interrotta se compaiono esemplari di F2 (possibile rimuovere L4s negli esperimenti dove la maggior parte ma non tutti gli animali arrestare come larve). Ogni esperimento richiede la valutazione concomitante di adeguati controlli positivi e negativi (es. cloni batterici RNAi che inducono un fenotipo definito tubulogenesis e svuotare vettoriale o strapazzate RNAi cloni, rispettivamente). Un altro requisito per la valutazione è una dimensione di covata sufficiente (almeno 50). Se non soddisfatti, altre condizioni (ad es. condizionale) RNAi possono essere provati. Infine, alcuni fenotipi di tubulogenesis particolarmente interessante si verificano a bassa penetranza, così un numero sufficiente di animali dovrà essere valutato.
Microscopia
Basso a moderato ingrandimento dissezione microscopia di fluorescenza e microscopia confocale di alto ingrandimento, le due procedure di imaging standard descritte qui, sono in genere sufficienti per caratterizzare gli aspetti di un fenotipo tubo o lume in base alla C. elegans intestino e può essere utilizzato anche per visivamente schermo set più grandi degli animali nelle schermate in avanti. Permessi di microscopia di fluorescenza di dissezione: imaging in vivo degli animali nei loro piatti (Tuttavia, animali vivi, transitoriamente immobilizzati da anestetici, possono anche essere recuperati dai Monti dopo confocale o DIC imaging); lo screening di grandi insiemi di animali; monitoraggio eventi dello sviluppo (ad esempio lo spostamento e sostituzione di un marcatore polarizzato durante l'espansione della membrana); rilevamento dei pattern di espressione specifici (alcuni modelli e asimmetrie meglio si distinguono a basso ingrandimento); selezione e raccolta fluorescente vermi adatti per ulteriori analisi (ad es. microscopia confocale) o per la manutenzione dei transgeni extracromosomico. Visualizzazione ad alto ingrandimento mediante microscopia confocale permette di caratterizzare il fenotipo a singola cella e a livello subcellulare. Questo protocollo descrive la formazione immagine con un microscopio confocale che offre il confocality migliore rispetto alle alternative come un microscopio confocale del disco di filatura di scansione laser. Un microscopio confocale del disco di filatura è, tuttavia, il microscopio di scelta per gli studi dinamici e time-lapse poiché induce minore fototossicità (vedi refs (34,35) per ulteriore discussione di basso e alto ingrandimento microscopia in c. elegans). Romanzo, nonché tecniche microscopiche convenzionali offrono ulteriori vantaggi e permettono la formazione immagine a risoluzione superiore nella gamma su scala nanometrica (ad es. microscopia dell'elettrone e super-risoluzione di trasmissione; discusso in37, 40).
Quando la formazione immagine di c. elegans intestini sotto un microscopio confocale, montaggio e immobilizzazione è fondamentale. Tra diverse sostanze chimiche per l'immobilizzazione, sodio azide - pur essendo tossiche - funziona più in modo affidabile se l'analisi viene eseguita immediatamente. Levamisole, pur non essendo tossiche, produce hypercontraction che talvolta interferisce con la valutazione dei fenotipi di morfogenesi. Alcuni anestetici possono interferire con proteine fluorescenti membrana-collegato e possono produrre artefatti che possono apparire come difetti di polarità. C. elegans è un esemplare di spesso e quindi analisi 3D (sezionamento) sono essenziale per sfruttare la forza specifica dell'epitelio intestinale tubolare che permette una visualizzazione eccellente di giunzioni apicale e della membrana laterale (non facilmente accessibile in epiteli piatti). Confocale impostazioni devono essere regolate per ogni diapositiva e l'obiettivo di ottenere immagini di buona qualità, inclusi i parametri come bracketing, in media, potenza laser, guadagno, pinhole e luminosità. Un particolare problema di imaging intestinale è il contenuto di questo organo di granelli autofluorescent verde/giallo (lisosoma relativo organelli (LROs)) che possono interferire con l'interpretazione dei risultati, in particolare nel valutare lo spostamento del GFP-etichettato endo-plasma-membrana e componenti associati. Questo problema è ben riconosciuto nel settore e può essere affrontato con approcci diversi (a seconda di microscopio), tra cui esclusione DAPI, spettrale fingerprinting e impostazioni scanner empirica13,41.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Si ringrazia Mario de Bono (MRC Laboratory of Molecular Biology, Cambridge, UK), Kenneth J. Kemphues (Cornell University, Ithaca, USA), Michel Labouesse (Institut de Biologie Paris Seine, Université Pierre et Marie Curie, Parigi, Francia), Grégoire Michaux (Université deRennes 1, Rennes, Francia) e le CGC, finanziato dall'ufficio di NIH di programmi di ricerca dell'infrastruttura (P40 OD010440), per i ceppi e gli anticorpi. Quest'opera è stata sostenuta da sovvenzioni NIH GM078653, MGH è 224570 e SAA 223809 a V.G.
Materiali
| Name | Company | Catalog Number | Comments |
| Antibody staining | |||
| poly-L-lysine | Sigma | P5899 | |
| Methanol | Fisher Scientific | A452-4 | |
| Acetone | Fisher Scientific | A949SK-4 | |
| Tween | Fisher Scientific | 50-213-612 | |
| Permount | Fisher Scientific | SP15-100 | |
| Powdered milk | Sigma | MT409-1BTL | |
| Primary antibodies | |||
| MH27 (mouse) | Concentration: 1:20 Resources: Developmental Studies Hybridoma Bank. | ||
| MH33 (mouse) | Concentration: 1:10 Resources: Developmental Studies Hybridoma Bank. | ||
| anti-ICB4 (rabbit) | Concentration: 1:5 Resources: A gift from Mario de Bono (Medical Research Council, England) | ||
| anti-PAR-3 (rabbit) | Concentration: 1:50 Resources: A gift from Kenneth J. Kemphues (Cornell University) | ||
| Secondary antibodies | |||
| Alexa Floor 568 (anti-rabbit) | ABCam | AB175471 | Concentration: 1:200 |
| Cy5 (anti-mouse) | Life technologies | A10524 | Concentration: 1:200 |
| TRITC (anti-rabbit) | Invitrogen | T2769 | Concentration: 1:200 |
| FITC (anti-mouse) | Sigma | F9006 | Concentration: 1:100 |
| Labeled chemicals | |||
| Texas Red-Phalloidin | Concentration: 1:100 Resources: Molecular Probes-T7471 | ||
| Materials | |||
| Vacuum Grease Silicone | Beckman | 335148 | |
| Microscope slides | Fisher Scientific | 4448 | |
| Microscope coverslips (22x22-1) | Fisher Scientific | 12-542-B | |
| C. elegans related | see reference29 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates | see reference29 for protocols. | ||
| Tryptone | Acros Organics | 611845000 | |
| Yeast Extract | BD Biosciences | 212750 | |
| NaCl | Sigma | S7653 | |
| Bacto Agar | BD Biosciences | 214040 | |
| Ampicillin | Sigma | A0116 | |
| Tetracycline | Fisher Scientific | BP912 | |
| M9 Medium | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| KH2PO4 | Sigma | P0662 | |
| Na2HPO4 | Sigma | S7907 | |
| MgSO4 | Sigma | M2773 | |
| NGM plates | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| RNAi plates | see reference30 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| IPTG | US Biological | I8500 | |
| Carbenicillin | Fisher Scientific | BP2648 | |
| NaOH | Fisher Scientific | SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries Ahringer genome-wide RNAi feeding library (ref 30,49,50) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref51) | Source BioScience | ||
| Imaging related | |||
| Sodium azide | Fisher Scientific | BP9221-500 | |
| Equipment | |||
| dissecting microscope | Nikon | SMZ-U | |
| dissecting microscope equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions) | Olympus | SZX12 | |
| Laser-scanning confocal microscope | Leica Microsystem | TCS SL | |
| laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope | Nikon | C2 |
Riferimenti
- Bryant, D. M., Mostov, K. E. From cells to organs: building polarized tissue. Nat. Rev. Mol. Cell Biol. 9 (11), 887-901 (2008).
- Zhang, N., Membreno, E., Raj, S., Zhang, H., Khan, L. A., Gobel, V. The C. elegans excretory canal as a model for intracellular lumen morphogenesis and in vivo polarized membrane biogenesis in a single cell. JoVE. , (2017).
- Rodriguez-Boulan, E., Macara, I. G. Organization and execution of the epithelial polarity programme. Nat. Rev. Mol. Cell Biol. 15 (4), 225-242 (2014).
- Mellman, I., Nelson, W. J. Coordinated protein sorting, targeting and distribution in polarized cells. Nat. Rev. Mol. Cell Biol. 9 (11), 833-845 (2008).
- Nelson, W. J. Adaptation of core mechanisms to generate cell polarity. Nature. 422, 766-774 (2003).
- Goldstein, B., Macara, I. G. The PAR Proteins: Fundamental Players in Animal Cell Polarization. Dev. Cell. 13 (5), 609-622 (2007).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. Organization of vesicular trafficking in epithelia. Nat. Rev. Mol. Cell Biol. 6 (3), 233-247 (2005).
- Zegers, M. M., O'Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends Cell Biol. 13 (4), 169-176 (2003).
- Tepass, U. The apical polarity protein network in Drosophila epithelial cells: regulation of polarity, junctions, morphogenesis, cell growth, and survival. Annu. Rev. Cell Dev. Biol. 28, 655-685 (2012).
- Shivas, J. M., Morrison, H. A., Bilder, D., Skop, A. R. Polarity and endocytosis: reciprocal regulation. Trends Cell Biol. 20 (8), 445-452 (2010).
- Bryant, D. M. A molecular network for de novo generation of the apical surface and lumen. Nat. Cell Biol. 12 (11), 1035-1045 (2010).
- Zhang, H. Apicobasal domain identities of expanding tubular membranes depend on glycosphingolipid biosynthesis. Nat. Cell Biol. 13 (10), 1189-1201 (2011).
- Zhang, H. Clathrin and AP-1 regulate apical polarity and lumen formation during C. elegans tubulogenesis. Development. 139 (11), 2071-2083 (2012).
- Asan, A., Raiders, S. A., Priess, J. R. Morphogenesis of the C. elegans Intestine Involves Axon Guidance Genes. PLoS Genet. 12 (4), e1005950(2016).
- Leung, B., Hermann, G. J., Priess, J. R. Organogenesis of the Caenorhabditis elegans intestine. Dev. Biol. 216 (1), 114-134 (1999).
- Altun, Z. F., Hall, D. H. Alimentary system, intestine. WormAtlas. , (2009).
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Dev. Biol. 56 (1), 110-156 (1977).
- Rasmussen, J. P., English, K., Tenlen, J. R., Priess, J. R. Notch signaling and morphogenesis of single-cell tubes in the C. elegans digestive tract. Dev. Cell. 14 (4), 559-569 (2008).
- Maduro, M. F. Gut development in C. elegans. Seminars in cell & developmental biology. , (2017).
- McGhee, J. D. The Caenorhabditis elegans intestine. Wiley Interdiscip. Rev. Dev. Biol. 2 (3), 347-367 (2013).
- Pásti, G., Labouesse, M. Epithelial junctions, cytoskeleton, and polarity. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Sato, K., et al. C. elegans as a model for membrane traffic. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Shakes, D. C., Miller, D. M. 3rd, Nonet, M. L. Immunofluorescence microscopy. Methods Cell Biol. 107, 35-66 (2012).
- JS, D. uerr Immunohistochemistry. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- T, S. tiernagle Maintenance of C. elegans. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Ahringer, J. Reverse genetics. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Simmer, F. Loss of the Putative RNA-Directed RNA Polymerase RRF-3 Makes C. elegans Hypersensitive to RNAi. Curr. Biol. 12 (15), 1317-1319 (2002).
- Kennedy, S., Wang, D., Ruvkun, G. A conserved siRNA-degrading RNase negatively regulates RNA interference in C. elegans. Nature. 427 (6975), 645-649 (2004).
- Shaham, S. Methods in Cell Biology. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Maddox, A. S., Maddox, P. S. High-resolution imaging of cellular processes in Caenorhabditis elegans. Methods Cell Biol. 107, 1-34 (2012).
- Netherlands, S. Nomarski Differential Interference Contrast Microscopy. , Springer. Netherlands. (2008).
- Bates, M., Jones, S. A., Zhuang, X. Stochastic optical reconstruction microscopy (STORM): a method for superresolution fluorescence imaging. Cold Spring Harb. Protoc. 6, 498-520 (2013).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3, 356-369 (2002).
- Lee, Y. U., Son, M., Kim, J., Shim, Y. H., Kawasaki, I. CDC-25.2, a C. elegans ortholog of cdc25, is essential for the progression of intestinal divisions. Cell Cycle. 15 (5), 654-666 (2016).
- Hall, D. H., Hartwieg, E., Nguyen, K. Modern electron microscopy methods for C. elegans. Methods Cell Biol. 107, 93-149 (2012).
- Shi, A., Grant, B. D. In vivo analysis of recycling endosomes in Caenorhabditis elegans. Methods Cell Biol. 130, 181-198 (2015).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- McGhee, J. The C. elegans intestine. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2007).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Developmental Studies Hybridoma Bank (DSHB). , http://dshb.biology.uiowa.edu (2017).
- Kamath, R. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon