Method Article
C. elegans המעי כמו המודל עבור המערכת לומן מורפוגנזה ו Vivo ב מקוטב ממברנה להן ברמה תא בודד: תיוג על ידי נוגדנים מכתים, ניתוח אובדן RNAi-של-פונקציה והדמיה
In This Article
Summary
שקופים C. elegans המעי יכול לשמש"ויוו הרקמה תא" ללמוד apicobasal להן קרום ו לומן ברמה תא בודד, subcellular במהלך multicellular tubulogenesis. פרוטוקול זה מתאר כיצד לשלב תיוג סטנדרטי, אובדן-של-פונקציה גנטית/RNAi וגישות מיקרוסקופיים לנתח תהליכים אלה ברמה המולקולרית.
Abstract
צינורות multicellular, יחידות היסוד של האיברים הפנימיים הכל, מורכבים של תאי אפיתל או אנדותל מקוטב, עם ממברנות הפסגה רירית בקרום לומן, basolateral קשר עם אחד את השני ו/או של מטריצה חוץ-תאית. איך אסימטריה ממברנה הייחודי הזה הוא הוקם ומתוחזק במהלך מורפוגנזה איברים היא עדיין שאלה לא פתורות של ביולוגיה של התא. פרוטוקול זה מתאר את המעי C. elegans כמודל לניתוח של קרום מקוטב להן במהלך מורפוגנזה שפופרת, תוך שימת דגש על הפסגה להן קרום של לומן. C. elegans עשרים תאים הכוללים שכבה אחת מעיים האפיתל מסודר לתוך צינור נשימה סימטרית פשוטה, המתיר ניתוח ברמה תא בודד. ממברנה קיטוב מתרחשת/ת עם חלוקת התא מקוטב והעברה במהלך מופרה מוקדם, אבל דה נובו מקוטב להן קרום ממשיך לאורך כל התפתחות הזחל, כאשר התאים כבר לא להתרבות ולהעביר. ההגדרה השנייה מאפשרת להפריד subcellular שינויים בו-זמנית המתווכות שונים מהפכנית תהליכים אלה, קשה להבחין רוב הדגמים קוטביות. הפסגה, basolateral ממברנה-, מהחיבור-, cytoskeletal- ו endomembrane רכיבים שניתן שכותרתו, רחבי פיתוח על ידי GFP פיוז'ן חלבונים או לאומדן בחיי עיר מכתים נוגדן. יחד עם צדדיות הגנטי של האורגניזם, המעי C. elegans ובכך מספקת מודל ייחודי ויוו על ההמחשה, התפתחותית, ניתוח גנטי מולקולרי של קרום מקוטב, שפופרת להן. שיטות ספציפיות (הכל רגיל) המתוארים כאן כוללים כיצד: תווית מעיים רכיבים subcellular על ידי נוגדנים מכתימה; לנתח את הגנים המעורבים ממברנה מקוטב להן על ידי מחקרים אובדן-של-פונקציה מותאמת הגנים tubulogenesis בדרך כלל חיוני; להעריך את הקוטביות ליקויים בשלבים התפתחותיים שונים; לפרש פנוטיפים epifluorescence, התערבות דיפרנציאלית ניגודיות (DIC), מיקרוסקופיה קונפוקלית; לכמת לקות. פרוטוקול זה ניתן להתאים כדי לנתח כל של מולקולות שנשמרת לעיתים קרובות מאוד מעורב קוטביות אפיתל, להן קרום, מורפוגנזה ובשעות לומן.
Introduction
הדור של הסלולר, subcellular asymmetries, כגון היווצרות קרום מקוטב תחומים, חיונית מורפוגנזה והתפקוד של תאים, רקמות ואיברים1. מחקרים על קרום מקוטב להן ב- epithelia להישאר אתגר טכני, מאז כיוונית שינויים בחלוקת רכיבי subcellular תלויים מרובות רצופות, וצירוף חוץ-תאית, תאיים אותות? קשה להפריד בין רוב הדגמים ותלויות חריפה במערכת מודל. המודל המוצג כאן - את הכוללים שכבה אחת Caenorhabditis elegans המעי - הוא רקמה של פשטות משובח. יחד עם החד-תאיים C. elegans excretory תעלה (ראה המלווה נייר על קרום מקוטב להן בתוך התעלה excretory C. elegans )2, הוא מספק מספר יתרונות ייחודיים לצורך הזיהוי ו אפיון של מולקולות הדרושות להן קרום מקוטב. שימור רמזים קוטביות מולקולרית של שמרים לאדם להפוך איבר הגעה פשוטה זה מצוין"ויוו רקמות הקאמרית" שאלות לגבי אפיתל קוטביות שאינן רלוונטיות ישירות למערכת האנושית, שהיא עדיין יותר מדי מתחם כדי לאפשר את הקרע חזותי של אירועים אלה על הסינגל תא רמה בתוך vivo.
למרות מספר רמזים שנשמרת קוטביות מטריצה extracelluar (1), (2) קרום פלזמה, צמתי, והאטרקציות (3) vesicular וגדילת היה להיות מזוהה3, עקרונות היסוד של שילובם בתהליך של מקוטב להן קרום של רקמת אפיתל הוא ממעטים להבין4. קלאסית תא בודד ויוו הדגמים (e.g.S. cerevisiae וגם את הזיגוטה C. elegans ) סייעו בהגדרת עקרונות מקוטב חלוקת התא הקדמי-אחוריים קוטביות, זיהו קריטי ממברנה-הקשורים קוטביות גורמים (קטן GTPases/CDC-42, את PARs תקינה למחיצות)5,6, אבל הם תלויים סימטריה ייחודי שבירת רמזים (ניצן הצלקת, הזנת הזרע) וחסרי מאובטחת-צומת apicobasal ממברנה תחומים, ככל הנראה, את apicobasal תאיים המתאימים מיון מכונות. הידע הנוכחי שלנו אודות ארגון מקוטב בבני אדם epithelia, עם זאת, בעיקר מסתמך על monocultures 2D בתרבית של7, אשר חסרים פיזיולוגיים רמזים חוץ-תאית והפיתוחים שיכולים לשנות עמדות של קרום תחומים וכיוונים של מסלולי הסחר בבני אדם (מתג ועד לכרטיסי תלת-ממד in vitro לקשרי תרבות מערכות לבד מספיק כדי היפוך קוטביות הממברנה בתאי MDCK (מדין טומי הכלבי הכליה))8. In vivo מחקרים התפתחותיים על קוטביות אפיתל דגם הגעה אורגניזמים נערכו תחילה epithelia שטוח, למשל באפידרמיס דרוזופילה melanogaster , איפה הם זיהו את התרומה קריטי צומת dynamics נדידת תאים מקוטב, תנועה לתא גליון9, ואת endocytic סחר קוטביות תחזוקה10. תלת-ממד במבחנה וניתוח ויוו של לומן מורפוגנזה ב epithelia צינורי בתאים MDCK ו במעי C. elegans , בהתאמה, לאחרונה זיהו את הדרישה של וגדילת עבור דה נובו תחום (הפסגה) ו לומן להן והמיקום11,12,13. העובי של הכרישים (לעומת שטוח) לתאי האפיתל היא יתרון לניתוח 3D של subcellular asymmetries מאז היא מתירה הבחנה חזותית מעולה של קרום הפסגה-lumenal, apico-לרוחב צמתי, ממברנה לרוחב, ו עמדות organelles תאיים. יתרונות אלו חזותי, דגם C. elegans מוסיף vivo בתוך ההגדרה, ציר התפתחותית, שקיפות, הפשטות של תוכנית גוף, שושלת היוחסין של תאי קבוע ומוגדר, אנליטי (גנטית) ויתרונות נוספים המתוארים להלן.
C. elegans עצמו הוא התולעת העגולה של מבנה צינורי שקיפות של מי ואדריכלות פשוטה להפוך את האיברים הפנימיים בדומה צינורי נגישים ישירות לניתוח חזותי של לומן ובשעות מורפוגנזה. תאי עשרים שלו המעי (21 או 22 תאים מדי פעם)14 נגזרים מתוך תאים ובתאים יחיד (E) ולפתח של האפיתל שכבות כפול על ידי העיבור צעד לתוך צינור נשימה סימטרית של תשע טבעות INT (ארבעה תאי הטבעת הראשונה; איור 1 סכמטי)14,15,16. ניתוח שושלת היוחסין ורקמות של המעי, בתחילה נקבע על-ידי Nomarski אופטיקה באמצעות זהויות גרעיני17ולאחר מכן על-ידי קרינה פלואורסצנטית מיקרוסקופ דרך ממברנות שכותרתו, סיפקה קריטי תובנות מורפוגנזה שלה, ב מסוים הדרישות תא-אוטונומי, תא-שאינם-אוטונומי שלו חלוקות תאים כיוונית, תנועות (למשל, העיבור, מימין asymmetries, סיבוב התחתית anterior ואת אחורי)14,18 . בתחילת תא endodermal מפרט את רשת גנטית שליטה על התפתחות איבר המשובטים מודל זה טוב מאופיין19,20בקרב אנשי עסקים ותיירים כאחד. במוקד הדיון כאן, זאת, על הניתוח של קרום מקוטב ושל לומן להן בתאים צינורי יחיד, ושל את asymmetries תאיים של endomembranes, מבנים cytoskeletal organelles המלוות תהליך זה. הניתוח בהנחייתם של הפשטות של הרכבת התחתית, איפה כל הפסגה ממברנות (ברמה ultrastructural מכובד על-ידי microvilli) מול לומן עם ממברנות הבזליים כל הפנים השטח צינור חיצוני, עם ממברנות לרוחב פנייה אל אחד את השני, הופרדו קרום הפסגה על-ידי צמתים (מפרטים טכנייםאיור 1 ; ראה הפניות (16,21) עבור C. elegans-ארגון ספציפי חזק ורכיבים צומת adherens). ממברנה הפסגה להן היא לפיכך חופפת מורפוגנזה לומן. יתר על כן, גודל תאי המעי למבוגרים - התאים הגדול של חיה קטנה זו (עם חריג של התא excretory) - אומדן גודל תא יונקים, המתיר ויוו חזותי המעקב של אלמנטים subcellular, למשל מסלולים שלפוחית, זה בדרך כלל ניסיון במבחנה בקערה תרבות.
למטרת ניתוח זה הסלולר, subcellular, תיוג מתאים הוא קריטי. מעיים אנדו - או -קרום פלזמה תחומים, צמתים, cytoskeletalעל-ידי תיוג ומרכיביהם מולקולרי מסוים, ניתן לאבחן מבנים, גרעינים, organelles subcellular אחרים. רכיבים רבים כאלה כבר שאפיינו וממשיכים להתגלות (טבלה 1 נותן כמה דוגמאות, מתייחס משאבים). למשל, מולקולות שונים הבחנה התאים צינורי ו/או vesicular של המערכת endomembrane מעיים, מחדר המיון גולג'י דרך פוסט-גולג'י שלפוחית על קרום פלזמה, היה מזוהה22. ספציפי חלבונים (כמו גם שומנים, סוכרים) יכול גם להיקרא במישרין, או בעקיפין באמצעות איגוד חלבונים. פרוטוקול זה מתמקד בחיי עיר נוגדן מכתים של דגימות קבוע, אחד של שתי טכניקות תיוג סטנדרטי (לראות את הנייר הנלווה על תעלת excretory tubulogenesis לקבלת תיאור של אחרים בטכניקת2 - ויוו תיוג באמצעות חלבון פלואורסצנטי fusions - אשר חל ישירות המעי; טבלה 2 מספק דוגמאות של היזמים המעי ספציפי שיכול לשמש לנסוע ביטוי של חלבונים היתוך כזה המעי). זוגי - או תיוג מרובים עם גישה או, או עם שילוב של שניהם פלוס נוספים כימי מכתים, מאפשר יותר מעמיק רזולוציה ויזואלית, בחינת שינויים יכולות בלוקליזציה שיתוף בגיוס ספציפי מולקולות או מרכיבים subcellular (איור 2). את הקיבעון, צביעת בהליכים המתוארים תחת תמיכה בפרוטוקול שימור חלבון פלואורסצנטי ירוק (GFP) תיוג במהלך הליכי immunostaining. עבור הדמיה, מפתח נקודות הזיהוי ותיאר אפיון tubulogenesis פנוטיפים באמצעות הליכים סטנדרטיים מיקרוסקופיים (קרינה פלואורסצנטית ויבתר ו קונאפוקלית מיקרוסקופ) הם (איור 3, 4). אלה ניתן להרחיב ברזולוציה גבוהה יותר הדמיה גישות, עבור מופע superresolution מיקרוסקופ ושידור מיקרוסקופ אלקטרונים (לא המתוארים כאן).
בחוזק המפתח של מערכת זו הוא היכולת לנתח קוטביות בתאים בודדים בשלבים התפתחותיים שונים, מן מופרה דרך לבגרות. למשל, ממברנה הפסגה לומן והתחום להן ניתן לעקוב במהלך פיתוח ברמה תא בודד באמצעות תיוג עם ממברנה שנשמרת מאוד-אקטין מקשר של אזרין-Radixin-Moesin משפחה23,24, ERM-1 . ERM-1 מדמיין להן קרום הפסגה (1) במהלך מורפוגנזה צינור עובריים, כאשר היא מתרחשת יחד עם חלוקת התא מקוטב, העברה (להעביר תאים apically סביב לומן בזמן העיבור)15; (2) במהלך מאוחר שלוחה שפופרת של זחל ממשיך בהיעדרו של חלוקת התא או ההעברה; (3) במעי למבוגרים, שבו קרום מקוטב תחומים נשמרות (איור 1). בתוך האפיתל זחל שלאחר mitotic מתרחבת, דה נובו מקוטב ממברנה להן ובכך ניתן להפריד מן מורפוגנזה רקמות מקוטב, שאינו אפשרי רוב הדגמים ב- vivo ו- in vitro לקשרי קוטביות אפיתל, כולל עם רזולוציה תא בודד (למשל 3D MDCK ציסטה דגם8). עם תיוג עבור רכיבים אחרים, הגדרה זו מספקת את ההזדמנות (במיוחד ב- L1 הזחל כאשר התאים יש יחס ציטופלזמה/גרעין גבוה יותר) כדי להבחין בין שינויים תאיים אלה שהינם ספציפיים מקוטב (להן קרום למשל ולהתפכחות של מסלולי הסחר בבני אדם) אלה/ת הנדרשים עבור חלוקת התא מקוטב והעברה.
צדדיות גנטי של C. elegans הוא ידוע25והופכת אותו מערכת מודל רב עוצמה לניתוח מולקולרית של כל שאלה ביולוגית. מחקר על מורפוגנזה, למשל, יכול להתחיל עם זן פראי-סוג, זן מהונדס שבו המבנה של הריבית (למשל קרום) נקראת עם סמן פלורסנט, או עם מוטציה הפסד או רווח-של-פונקציה עם פגם בזה מבנה. מחקר גנטי הפוכה טיפוסי עשוי ליצור מוטציה איפה הגן עניין נמחק ב germline (למשל על ידי מחיקה יישוב), השתנה על-ידי מוטגנזה מכוונת (בדרך כלל לייצר מוטציות נקודה עם אובדן הסוגר, הפחתה או הגברה בפונקציה של הגן), או איפה התעתיק שלו הוא מופחת על ידי RNAi. הקלות של RNAi מאכילים ב- C. elegans26 גם משאיל את עצמו בעיצוב של מסכי יישוב לבחון קבוצה גדולה יותר של הגנים של עניין. הכוח החזק ביותר ניתן לטעון של אורגניזם מודל גנטי הוא היכולת לנהל ויוו קדימה המסכים (למשל מוטגנזה מכוונת, מסכי שיטתית או ברמת הגנום RNAi) כי היתר חקירה לא משוחדת על הסיבה מולקולרית הפנוטיפ של ריבית. למשל, לא משוחדת visual C. elegans RNAi tubulogenesis מסך, החל חיה הטרנסגניים עם ממברנות הפסגה ERM 1-שכותרתו, גילו של המרה קוטביות מעיים הפיך מסקרן פנוטיפ לומן חוץ רחמי, המשמש כאן כדוגמה עבור סוג זה של ניתוח. מסך זה זוהה דלדול של glycosphingolipids (GSLs; ממברנה גידול שומנים, מזוהה באמצעות אנזימים biosynthetic הוחלף נגזר GLS שלהם) ורכיבים של clathrin המעיל של שלפוחית, מתאם AP-1 שלו הליקויים מולקולרי מסוים גורם קוטביות זו פנוטיפ ההמרה, ובכך אפיון אלה סחר מולקולות כמו ויוו רמזים עבור ממברנה הפסגה קוטביות ו לומן מיצוב12,13. כאשר החל הפנוטיפ מוטציה גנטית ספציפית/מורפוגנזה, מסכי כזה (או ניסויים יחיד האינטראקציה הגנטית/RNAi) ניתן גם לבחון פונקציונלי האינטראקציות בין גנים מרובים או עניין (ראה המלווה נייר על excretory תעלת לקבלת דוגמה של ניתוח כזה)2. פרוטוקול זה מתמקד RNAi אשר, בנוסף היכולת שלה ישירות לזהות את הגן אובדן אשר גורמת פנוטיפ של המסכים הקדמיים, מספק יתרונות ספציפיים לניתוח של מורפוגנזה. מאז הגן מוצרים בימוי מורפוגנזה לעיתים קרובות עובדים באופן תלוי מינון, RNAi הוא מצליח בדרך כלל יוצר קשת של פנוטיפים. היכולת להפיק פנוטיפים חלקית-אובדן-של-פונקציה אינפורמטיבי מסייעת גם לטפל בבעיה כי הרוב המכריע של גנים tubulogenesis חשוב הם חיוניים, כי ההפסדים שלהם לגרום עקרות, lethality עובריים מוקדם. פרוטוקול זה כולל אסטרטגיות RNAi מותנה כדי להתגבר על הקושי הזה, מציע דרכים כדי למטב את הדור של קשת רחבה של הפנוטיפים, כגון סדרות allelic המיוצר על ידי מוטגנזה מכוונת.
Protocol
1. תיוג המעי C. elegans
הערה: ראית את העיתון המלווה על ידי המחברים על הניתוח של תעלת excretory tubulogenesis 2 לבנייה של רקמות ספציפיות סמן פלורסנט פלסמידים, הדור של בעלי חיים מהונדס, כולל דיונים על גנים ברמת השעתוק והתרגום פיוז'ן חלבונים (האחרון נדרש עבור ההתאמה subcellular של מולקולה עניין). הליכים אלה ניתן להתאים באמצעות היזמים ספציפיים כדי להסיע את המולקולה עניין אל המעי. ראו טבלה 1 לדוגמאות של מולקולות הוכח שימושית ליצירת אפקטים של C. elegans מעיים אנדו - ו ממברנות פלזמה והצמתים שלהם, בטבלה 2 לדוגמאות של היזמים על נהיגה הביטוי אל המעי, טבלה 3 עבור משאבים עבור אוספים מקיף יותר של סמנים מעיים היזמים.
27 ,- נוגדנים מכתים של המעי C. elegans 28
- קיבוע
- קח זכוכית נקייה ולהשתמש פולי-L-ליזין ל הפקת סרט דק תולעים לתקוע. מקום 30 µL 0.1-0.2% פולי-L-ליזין על שקופית ומניחים שקופית שנייה על המסירה פולי-L-ליזין כדי להפוך " כריך ". ואז לשפשף את השקופיות בעדינות מספר פעמים רטוב משטחים כולו של שניהם ולתת להם אויר יבש במשך 30 דקות תווית שבתוכי השקופיות עם עיפרון.
הערה: 0.2% פולי-L-ליזין aliquots של 200 µL נעשו על ידי המסת אבקה dH 2 O; זה ניתן לאחסן ב-20 מעלות צלזיוס. שימוש משקל מולקולרי גבוה פולי-L-ליזין עבור שיפור דבק של התולעים. הריכוז של פולי-L-ליזין גם היא קריטית. ריכוזים נמוכים יותר מדי לא תאפשר תולעים להישאר אבל ריכוז גבוה מדי עשוי ליצור אות רקע זריחה. סרט עבה מדי עלולה להשתחרר בשלמותו. - מקום גוש המתכת השטוחים בחוזקה בתחתית מיכל (למשל מיכל פוליסטירן) מלא עם חנקן נוזלי.
הערה: ניתן יהיה להשתמש בקרח יבש במקום, אך חנקן נוזלי ממשיך גוש מתכת יציבה יותר בתחתית המיכל, מקפיא טוב. - תולעים לאסוף גם באופן שוטף בעזרת M9 29 או לבחור במה שונים תולעים (גם ביצים, L1, L2, L3 L4 או הפרפרים והעשים תולעים) על כל שקופית. בדרך כלל, לבחור ~ 100 הזחלים של העוברים או מבוגרים ~ 20 לכל שקופית. מקום 10 µL נשטף תולעים אל האמצע של השקופית או לאסוף ביצים/תולעים לתוך 10 µL M9 או µL 10 1 x PBS 27 (buffered פוספט תמיסת מלח).
- שימוש פיפטה ץיפהל מספרים גדולים של תולעים כדי להימנע clumping.
הערה: מעורב אוכלוסיות של נשטף תולעים, בשל הצפיפות ושונה עובי של שלבים, לא מקל טוב והם פחות ביעילות ההקפאה-סדוק (ראה להלן), לכן תולעים ספציפיות שלב האיסוף (או אוכלוסיות מסונכרן) נותן תוצאות משופרות. הזחלים מקל יותר טוב מאשר מבוגרים, בעלי החיים ניתן להציב לכל שקופית. - לפני האיסוף תולעים על שקופיות, להעביר אותם צלחת בינונית צמיחה תולעים נימיות (NGM) 29 ללא חיידקים OP50. עודף חיידקים ו"היסטוריון התולעים יכול גם להפריע דבק. . שמור על עצמך כי תולעים לא יתייבש.
- שימוש פיפטה ץיפהל מספרים גדולים של תולעים כדי להימנע clumping.
- בעדינות המקום (טיפה) 22 מ"מ × 22 מ"מ coverslip קרוס-דרכים על גבי שנאספו תולעים כזו הקצוות שלה התפחמלות בצד אחד לפחות של השקופית. ממשיכים ישר למטה בעדינות אך בחוזקה עם אצבע אחת או שתיים coverslip למנוע הטיה זה יגרום נזק רקמות תקינות.
- מיידית ובעדינות להעביר את השקופית גוש המתכת בחנקן נוזלי ולתת לו לשבת במשך כ- 5 דקות כדי להקפיא. ואז " קפיצי את " coverslip של סוויפט אחד להעביר באמצעות את קצה התלויים.
הערה: שלב זה חייב להיעשות באופן מוחלט, ובזמן השקופית קפוא כדי להשיג " פיצוח " של הקוטיקולה. התראה: אנא פעל בהתאם להנחיות עיקרון השוויון הפוליטי (ציוד הגנה אישי) בעת עבודה עם חנקן נוזלי. - לטבול את ההקפאה היא רגילה מחליק לתוך מתנול-מילוי רקע צנצנת זכוכית Coplin 5 דקות ב-20 ° C. ואז להעביר אצטון-מילוי רקע צנצנת זכוכית Coplin עוד 5 דקות ב-20 מעלות צלזיוס
הערה: מתנול אצטון צריך להיות מאוחסנים ב-20 ° C במשך לפחות 30 דקות לפני השימוש. לאחר קיבוע, ניתן לאחסן שקופיות ב-20 ° C. זהירות: מתנול, אצטון רעילים. - להסיר את השקופיות הצנצנת ולתת להם אויר יבש בטמפרטורת החדר (RT) לפני השימוש.
- קח זכוכית נקייה ולהשתמש פולי-L-ליזין ל הפקת סרט דק תולעים לתקוע. מקום 30 µL 0.1-0.2% פולי-L-ליזין על שקופית ומניחים שקופית שנייה על המסירה פולי-L-ליזין כדי להפוך " כריך ". ואז לשפשף את השקופיות בעדינות מספר פעמים רטוב משטחים כולו של שניהם ולתת להם אויר יבש במשך 30 דקות תווית שבתוכי השקופיות עם עיפרון.
- Staining
- להקיף שטח של תולעים קבוע עם שכבה דקה של ריבה נפט בשקופית. צייר עיגול מסביב לאזור זה על החלק התחתון של השקופית כדי לסמן את המקום.
הערה: זה קריטי כי המעגל ג'לי נשאר שלם לאורך כל ההליך מכתימים כדי למנוע דליפה של פתרונות מכתימים. - הכן " קאמרית רטוב " בתוך סל פלסטיק עם מכסה על ידי הנחת נייר רטובות לתוך זה. למקם את השקופית לתוך ארון זה " קאמרית רטוב " כדי למנוע את התייבשות של השקופיות במהלך צביעת.
הערה: שקופיות לא צריך להיות במגע עם מים או עם אחד את השני. - בעדינות פיפטה כ PBS 1 x µL 50 למעגל ג'לי, מספיק כדי לכסות את האזור. סגור " קאמרית רטוב " עם המכסה. תקופת דגירה-RT של 5 דק
הערה: כדי למנוע איבוד תולעים בשלב זה, לא פיפטה PBS ישירות על גבי התולעים. בעדינות למקם פיפטה עצה בקצה העיגול ולאפשר נוזל להתפזר בצורה חלקה על התולעים. - להטות את השקופית, לאט מחוק לגמרי מגניב עם פיפטה. מקם את השקופית שטוח בחזרה על המדף ולהוסיף 50 µL (או את הסכום הנדרש כדי לכסות את המקום) חוסם הפתרון בקפידה. דגירה זה בבית הבליעה רטוב-RT למשך 15 דקות. תוך כדי המתנה, לדלל את הנוגדנים העיקרי בחסימה פתרון (ראה טבלה של חומרים לדוגמאות של נוגדנים העיקרי וריכוזי).
הערה: טרי להכין פתרון חסימה באמצעות x 1 PBS (10 מ"ל), 10% tween (50 µL) אבקת חלב (0.2 גרם). כמות אבקת וריכוז של חלב עשוי להשתנות בהתאם נוגדנים בשימוש, אולי צריך להיקבע מדעית. השאיפה של נוזל מתוך השקופית היא צעד נוסף לאבד בקלות תולעים. לבדוק את התקדמות על-ידי בדיקת השקופית מתחת למיקרוסקופ ויבתר, אבל תשמור על עצמך כי השקופית לא יתייבש. - להטות את השקופית, תשאף משם את הפתרון חסימה, באמצעות אותם כפי שתואר לעיל. המקום שקופית במול לדרך מתלה ולהוסיף לאט 50 µL מדולל העיקרי נוגדן, באמצעות אותם. סגור " קאמרית רטוב " דגירה ב 4 מעלות צלזיוס למשך הלילה או לתקופות קצרות יותר-RT.
הערה: זמן הדגירה ייתכן שתצטרך להיות מדעית שנקבע של נוגדנים ספציפיים. - לשאוב את הפתרון נוגדן ראשוני כמו פתרונות אחרים. לאחר מכן לשטוף את השקופיות עם פתרון חסימה למשך 10 דקות, 3 פעמים, הוספה והסרה של הפתרון באותו אופן כפי שתואר לעיל.
- הוסף נוגדנים משניים (fluorescently עם התווית) מדולל בפתרון חסימה, דגירה-RT לשעה. ראה טבלה של חומרים לדוגמאות של נוגדנים משניים וריכוזי.
- להסיר את נוגדנים משניים ואת שטיפת, כאמור לעיל, עם חסימת פתרון 2 פעמים, כדי לנקות את הפתרון חסימה, עם PBS 1 x, למשך 10 דקות כל אחד.
- תשאף משם כמה שיותר PBS ככל האפשר מבלי לאפשר את הדגימה להתייבש, הסר בזהירות את הג'לי סביב הדגימה.
- הוסף טיפה אחת הרכבה בינונית על גבי הדגימה, ו הנח coverslip בעדינות על העליונה. לאטום את הקצוות של coverslip עם לק. מקום שקופיות בתוך קופסה שקופית כהה לשמר מכתים ולאחסן 4 ° C.
הערה: שומרים שקופיות בחושך בגלל רגישות לאור (קרינה פלואורסצנטית עלולה לדעוך עם הזמן) ולמנוע חשיפה אוויר על-ידי שמירתן אטום, מאותה סיבה. ניתן לאחסן שקופיות לתקופות ממושכות של זמן 4 ° C או-20 ° C.
- להקיף שטח של תולעים קבוע עם שכבה דקה של ריבה נפט בשקופית. צייר עיגול מסביב לאזור זה על החלק התחתון של השקופית כדי לסמן את המקום.
- קיבוע
2. הפרעות עם הפונקציה של גנים חיוניים tubulogenesis במעי C. elegans. דוגמה: RNAi.
הערה: C. elegans זנים מתורבתים על חיידקים OP50 נזרע על צלחות NGM לפי פרוטוקולים סטנדרטיים 29. עבור RNAi, C. elegans ניזונים HT115 RNAi חיידקים על צלחות RNAi בתוספת 25 carbenicillin µg/mL ו- 2 מ מ IPTG (איזופרופיל beta-D-1-thiogalactopyranoside) עבור אינדוקציה של האמרגן חיידקי שיוצר כפול תקועים RNA (dsRNA) מהציג הגן C. elegans. אנטיביוטיקה, ריכוז IPTG עשויים להשתנות, בהתאם RNAi שיבוט/ספריית וכוח הרצוי RNAi, ו ספציפיים RNAi שיבוטים ניתן להשיג זמינים מסחרית ברחבי הגנום RNAi האכלה ספריות (ראה ( 26 , 30 , 31) על רקע על האכלה RNAi ב C. elegans ו לטבלה של חומרים עבור חומרים/ריאגנטים וספריות RNAi).
- RNAi סטנדרטי על ידי האכלת 26 , 31
- תוציא צלחת ספריית RNAi מ-80 מעלות צלזיוס, שים את זה על קרח יבש. הוצא את הקלטת איטום ולהשתמש פיפטה סטרילי עצה להעביר חיידקים חסיד של שיבוט של האינטרס פלטות אגר ליברות (מרק לוריא) 29 בתוספת 100 אמפיצילין µg/mL ו- µg/mL 15 טטרציקלין. פס החוצה חיידקים על גבי צלחת אגר. חותם RNAi ספריית לצלחת עם קלטת איטום חדשה. לגדל את החיידקים בין לילה-37 מעלות צלזיוס.
הערה: פלטות אגר אלה ניתן לאחסן ב 4 מעלות צלזיוס למשך מספר שבועות. חיידקים חדשים יכולים להיות בתרבית ישירות מהם להגן על הספרייה המקורי RNAi. - ביום למחרת, לחסן RNAi חיידקים מן צלחת אגר LB לתוך 1 מ"ל בינוני נוזלי LB 29 המכיל 50 אמפיצילין µg/mL, כל אחד, לנער 14 h (8-18) או למשך הלילה ב- 37 מעלות צלזיוס.
הערה: לקבלת תוצאות מיטביות, השתמש חיידקים טריים בכל פעם. ראה התייחסות ( 30) להשוואה מהתנאים תרבות אחרת (למשל התזמון של תרבות).
יום - הבא, µL זרע 200 לכל שיבוט של החיידק RNAi בתרבית על צלחות RNAi נפרדות. תן הצלחות יבש ולהשאיר RT ללילה עבור אינדוקציה של האמרגן חיידקי.
- להעביר את הזחלים L4-שלב 4-6 על כל צלחת RNAi. תקופת דגירה הלוחות RNAi הזריעה RT או 22 ° C של 3-5 ימים.
הערה: תבחרו L4 הזחלים קודם על גבי צלחת NGM ללא חיידקים כדי להסיר מחסידי OP50 להתערב עם RNAi, או באופן סדרתי להעביר אותם ל צלחת NGM חדשה ללא OP50 שלוש פעמים. ודא זנים לא מזוהמים, כמו חיידקים מזהמים - כמו OP50 העדיפו מזון לתולעים - יפריע גם RNAi. להתאים את הטמפרטורה כנדרש: למשל פיתוח מאיצה עם הטמפרטורה גבוהה יותר; זני עשוי להיות רגיש לטמפרטורה. - ללימודים התפתחותית, בדוק פנוטיפים צאצאים F1 מיום 2 ואילך.
הערה: חשוב לבדוק חיות לעתים קרובות כדי להימנע חסר את המראה או התקדמות של הפנוטיפ (למשל סמן הזחה) כאשר הערכת להן קרום מקוטב במהלך הפיתוח. העשרה של האוכלוסייה F2 בשביל פנוטיפים חזקה (למשל על-ידי בחירת אנדרוגינוסים האב אל צלחת RNAi חדשה ביום 2 כדי לבחור עבור ביותר בחום מושפע באמצע החלק של הצאצאים שלהם) הוא לעיתים רחוקות נחוץ, מאז קשת בין מתון כדי חזק פנוטיפים רצוי.
- תוציא צלחת ספריית RNAi מ-80 מעלות צלזיוס, שים את זה על קרח יבש. הוצא את הקלטת איטום ולהשתמש פיפטה סטרילי עצה להעביר חיידקים חסיד של שיבוט של האינטרס פלטות אגר ליברות (מרק לוריא) 29 בתוספת 100 אמפיצילין µg/mL ו- µg/mL 15 טטרציקלין. פס החוצה חיידקים על גבי צלחת אגר. חותם RNAi ספריית לצלחת עם קלטת איטום חדשה. לגדל את החיידקים בין לילה-37 מעלות צלזיוס.
- RNAi מותנה
הערה: RNAi תנאים שניתן לשנותם כדי להפחית חמורה, או להגביר תופעות לוואי מתונות או להתערב במה-במיוחד; שינויים מועילים על הערכה מלאה של השפעות פנוטיפי לעיתים קרובות גנים tubulogenesis קטלני.- RNAi זחל - הערכה של RNAi אפקטים באותו דור (מתון, שלב ספציפי RNAi)
הערה: להתגבר על עקרות או עובריים קטלני, או כדי לשבש את תפקוד הגן-מופרה פוסט בשלב מסוים, RNAi מושרה ב הזחלים, פוסט embryonically. מניחים ביצים ללא טיפול (2.2.1.1), מבוגרים gravid (2.2.1.2) או מסונכרן L1 (או, אם רצונך בכך, בשלב מאוחר יותר) הזחלים (2.2.1.3) על צלחות RNAi; להעריך את ההשפעות RNAi בדור זהה, למשל יומיים מאוחר יותר, השהיות הזחלים ו/או מבוגרים.- פיק 30-50 מבוגרים gravid לתוך אחד ירידה הלבנת פתרון (פתרון 1: 4 של 10 M NaOH, משק הבית נתרן תת-כלורי) ממוקם מימין לקצה צלחת RNAi. תן יבש ולאפשר L1s בוקעים ולעבור אל הדשא חיידקי.
הערה: הלבנת פתרון, בדרך כלל בשימוש לטיהור, יהרוג הכל חוץ עוברי ב מקליפתם ביצה. לכן, אל תמקם את הפתרון הלבנת אל או קרוב החיידק RNAi. - לבחור או זרע ~ 20 gravid צעירים ללא צלחת RNAi ולתת להם להטיל ביצים במשך 2-3 שעות, או עד ישנם בסביבות 300 ביצים בצלחת, ואז תבחר את המבוגרים.
הערה: שיטה זו עלולה לגרום זיהום של החיידק RNAi על-ידי OP50. כדי להפחית סיכון זה, קודם להעביר מבוגרים לצלחת NGM ללא חיידקים כדי להסיר מחסידי OP50 את התולעים. . שמור על עצמך כי מבוגרים ולא נשארים זמן רב מדי על צלחות RNAi להימנע RNAi השפעה על עוברי. - לבחור או למקם L1 הבמה תולעים ישירות על צלחות RNAi (ראה חומר עזר ( 29)-עבור סינכרון פרוטוקולים).
הערה: אחד תוכל להשתמש פרוטוקול סינכרון מקוצר (למשל עבור מלכודת בקנה מידה בינוני גדול) ע י שטיפת תולעים של צלחות מיושבים בצפיפות עם M9 עבור מספר פעמים עד ביצים היחידה להישאר. לאחר 2-3h הבקיעה L1s ואז ניתן לאסוף ב- M9 של הצלחות האלה, על-ידי שוטף נוספים כדי להסיר חיידקים (3 x ב- M9), יש לנקות נזרע על גבי לוחות RNAi.
- פיק 30-50 מבוגרים gravid לתוך אחד ירידה הלבנת פתרון (פתרון 1: 4 של 10 M NaOH, משק הבית נתרן תת-כלורי) ממוקם מימין לקצה צלחת RNAi. תן יבש ולאפשר L1s בוקעים ולעבור אל הדשא חיידקי.
- דילול של RNAi חיידקים עם וקטור ריק RNAi חיידקים (מתון RNAi)
הערה: הפחתה בסכום של dsRNA על ידי דילול כמות החיידקים RNAi עשוי להספיק כדי לגרום מתונה יותר תופעות, ייתכן שתצמצם lethality עובריים בלי המבטלת כל האפקטים עובריים. דילול של חיידקים RNAi משמש גם לניסויים RNAi כפול וכדי titrate תנאים לניסויים גנטיים אינטראקציה (למשל כדי ליצור תופעות לוואי מתונות להערכה של שיפור ואפקטים חזק על ההערכה של דיכוי).- לגדול RNAi, empty וקטור HT115 RNAi חיידקים בינוני 1 מ"ל ליברות עם 50 אמפיצילין µg/mL, כפי שנעשה עבור תנאים סטנדרטיים RNAi.
- לדלל את החיידקים RNAi בחיידקים RNAi וקטור ריק כדי להשיג מגוון של ריכוזים שונים, לדוגמה, של 5%, 15%, 30%, 50%, 70%. מערבבים את החיידקים על ידי pipetting למעלה ולמטה. פיפטה µL 200 מעורב חיידקים על גבי צלחת RNAi.
- לבחור 4-6 L4 הזחלים שהלוח RNAi. בדוק את פנוטיפ מיום 2 ואילך.
- RNAi זנים רגישים (RNAi חזק)
- להשתמש זנים רגישים RNAi זמין, לדוגמה, ערי-1 (mg366), rrf-3 (pk1426) או ערי-1 (mg366) לין-15 ב (n744) (supersensitive האחרון) ובצע נהלי RNAi שמתואר 31 , 2.1 32 , 33.
הערה: זנים רגישים RNAi (למשל rrf-3 וערי-1) ייתכן התחתון גדלים שבוחרים מבהמות פראי-סוג, יהיה עקר ב 25 º C. הם יכולים גם להיות רקע נמוך של פנוטיפים עצמו, למשל נמוך penetrant הקטלניות עובריים, חייב להילקח בחשבון בעת הערכת השפעות ספציפיות RNAi.
- להשתמש זנים רגישים RNAi זמין, לדוגמה, ערי-1 (mg366), rrf-3 (pk1426) או ערי-1 (mg366) לין-15 ב (n744) (supersensitive האחרון) ובצע נהלי RNAi שמתואר 31 , 2.1 32 , 33.
- RNAi זחל - הערכה של RNAi אפקטים באותו דור (מתון, שלב ספציפי RNAi)
3. In vivo הדמיה של המעי C. elegans על-ידי קרינה פלואורסצנטית לנתח מיקרוסקופ
- לפני להמחיש חיות תחת אור זריחה, בדוק RNAi צלחות תחת אור בוהק על כל מיקרוסקופ ויבתר. להעריך (ואת פוטנציאל להקליט) פנוטיפים לעין תחת אור בהיר שעשויים להשפיע על הניתוח, כגון הקטלניות, עקרות (מספר נמוך יותר של רומא), התפתחותיים (למשל מעצר הזחל) ו פנוטיפים גלויים אחרים שעשויים לעזור לאפיין את הפונקציה של גנים המעורבים מורפוגנזה להן, לומן ממברנה מקוטב.
הערה: הצלחות הציון היחידות שיש מספיק רומא להערכה (לפחות 50), נסה אחרת תנאים RNAi חלופי. עבור הערכה כמותית לוודא כי הצלחות לא מזוהמים או לגדול OP50 (המפריעות RNAi). - להמחיש חיות תחת אור ניאון, להסיר את המכסה ומניחים את הצלחת RNAi ישירות תחת המיקרוסקופ פלורסצנטיות ויבתר.
הערה: כדי לזהות פנוטיפים מעיים עדין אחד יהיה עליך מיקרוסקופ ויבתר עם צרופת פלורסצנטיות סטריאו גבוהה יותר כוח המאפשר מגוון מספיק ההגדלה. פרוטוקול זה מתאר את השימוש טווח עם 1.5 ו- 10 x אובייקטיבית, טווח זום מ 3.5 קמ ש.
קודם כל - למצוא חיות תחת אור בהיר להתמקד. בשלב הבא, לבחון חיות תחת אור ניאון בהגדלה נמוכה (למשל תחת המטרה 1.5 x), תוך שימוש במסנן המתאים. לבחון באופן שיטתי מן השמאלית העליונה הימנית התחתונה כדי לסרוק את כל הצלחת. בשביל פנוטיפים את לוחית.
- בחר בעל חיים עניין ושנה אובייקטיבית x 10. להתמקד המעי ולהשתמש זום כדי להעריך tubulogenesis/לומן מורפוגנזה פנוטיפ. ראה סעיף 5 עבור ניקוד של פנוטיפים. קודם כל, קחי תמונות בהגדלה נמוכה. ואז תעבור בהגדלה.
הערה: מאז בעלי חיים בריא לזוז מהר, יפעלו במהירות, עם יד אחת על עכבר המחשב עבור ייבוא תמונות תוך מיקוד המיקרוסקופ עם היד השנייה. האטה חיות (למשל הנחה ארעית של הלוחות עד 4 ° C ע) לא ייתכן שתידרש בעת עבודה עם tubulogenesis פנוטיפים ב בעיקר נעצר עוברי וזחלים מוקדם. ניתן ללכוד מצלמת CCD רכוב מיקרוסקופ ותמונות התמונה תוכנה ללכידת.
4. הדמיה המעי C. elegans ברזולוציה גבוהה יותר על ידי לייזר סורק מיקרוסקופיה קונפוקלית 34 , 35
- וביטול הנייח
- שימוש קצה האצבע להפיץ דק כמות קטנה של שומן או וזלין במעגל על משטח זכוכית (~ 6-8 מ מ בקוטר).
הערה: עובי מעגל גריז הוא קריטי עבור הרכבה. לטוב הדמיה תוצאות, תמונה אחד או במספר הזחלים במועד ועושים שימוש עיגול גריז ודק במיוחד עם נוזלי קטן ככל האפשר כך החיה ישירות תקוע בין שקופיות זכוכית מכסה (אם נעשה בצורה מושלמת, חיה להיות מרותק למיטה בלי הרדמה). הרכבה של ביצים, של בוגרים בעלי החיים דורשים מעגל מעט עבה יותר כדי למנוע הרס מדגם בעת הוספת מכסה. - להוסיף טיפה של µL בדרך כלל 3.5 מ מ 10 פתרון אזיד הנתרן לאמצע המעגל ולבחור תולעים לתוכו תחת המיקרוסקופ ויבתר.
הערה: להכין 1 מ' נתרן אזיד מניות פתרון על ידי המסת מ"ג 65.01 NaN3 1 מ"ל dH 2 O; להוסיף 200 µL של פתרון 1 מ' זה לתוך מאגר M9 20 מ. לבחור תולעים במהירות לתוך טיפה של פתרון אזיד הנתרן כדי למנוע פתרון להתייבש. לבחור שלבים בנפרד להרכבת אופטימלית, מכוון העוברים על 50 לכל שקופית וזחלים כ-20 כשבוחנים אוכלוסיות גדולות יותר. אחד באפשרותך להשתמש M9 במקום פתרון אזיד הנתרן בבחירת עוברי. אם משתמש אזיד הנתרן, חיות חייב לדימות בתוך 30 דקות כדי למנוע נזק לרקמות של זה חומר כימי רעיל.
התראה: אזיד הנתרן הוא רעיל. - הנח בעדינות coverslip 22 מ"מ × 22 מ"מ בשקופית. יש להיזהר לא לרסק את התולעים. הפעלת לחץ מתון, לבדוק תחת מיקרוסקופ כדי לוודא שהתולעים קבועים היטב בין שקופיות מכסה לנתח. תווית השקופית.
הערה: הסכום הנכון של לחץ הוא קריטי כדי למנוע פגיעה הדגימה (מדי לחץ), לא מתקן אותו היטב (לחץ קטן מדי: חיות לצוף במקום נדבקות השקופית). חיות צף בעיקרו למנוע הדמיה המתאימה.
- שימוש קצה האצבע להפיץ דק כמות קטנה של שומן או וזלין במעגל על משטח זכוכית (~ 6-8 מ מ בקוטר).
- הדמיה
- המקום שקופיות תחת מיקרוסקופ קונפוקלי. חיפוש של תולעים עם 10 x אובייקטיבית, מיקוד-
הערה: השתמש אור בהיר להתמקד במידת האפשר להימנע photobleaching. - שינוי 60 x או 100 x אובייקטיבית, דגש על המעי.
הערה: המעי ניתן לזהות בקלות תחת אור בהיר על ידי שלה לומן העובר באמצע של החיה, מן הלוע עד פי הטבעת סמוך לקצה הזנב. היה זהיר בעת החלת שמן עבור 60 x או 100 x שמן אובייקטיבי. ערבוב סוגים שונים של שמנים עלולים להפריע הדמיה נוספות. המקום קטן טיפה של שמן על גבי השקופית בעת שימוש במיקרוסקופ זקופה או אל המטרה בעת שימוש טווח הפוכה, מקפיד לא לזהם אחרים מטרות או חלקי המיקרוסקופ. - להקים קולר DIC/Nomarski תאורה עבור המטרה כדי לשמש לסריקה 36. לבדוק את חיה תחת אור ניאון עם הערוץ המתאים לבדיקת תיוג של המעי ו/או לבדוק פנוטיפ, לשם בחירת הדגימה המתאימה עבור הדמיה. עבודה במהירות כדי למנוע הלבנת.
- מתג לייזר סורק כדי להגביל את התמונה פוטנציאליים אל המעי על-ידי הגדרת סריקה גבולות בצד הגבי של הגחון שלו.
הערה: תיחום המעי בדרך זו היא קריטית, אם fluorophore גם תוויות מבנים מחוץ המעי. במהלך זו סריקה פיילוט, עבודה עם תנאים סריקה מהירה כדי למנמזהה האובייקט photobleaching. - עוצרים סריקה כדי לבחור פרמטרים סריקה עבור הניסוי. הגדר 6-20 מקטעים עבור סריקה מעיים לאורך ציר z, למשל במרווחי זמן 0.2 µm, בהתאם חקירה, שלב של שיקולים בעלי חיים ו/או טכני. הגדרת מסגרת בממוצע לכל תמונה בהתאם למורכבות תיוג ו נדרש פתרון כדי להפחית את הרעש.
הערה: הגדרת פרטים משתנים בהתאם מיקרוסקופ ולהתנסות. אחד ייתכן שיהיה עליך להקטין את המקטעים כדי למנוע הלבנת אם מבצע סריקה רציפה של שלוש fluorophores שונים. התאם מספר המסגרות למספר סעיפים (צריך להיות נמוכה יותר מספר קטעים כדי למנוע עיוות תמונה; גם שוקל בעליה ב- photobleaching). 4-6 מסגרות הן בדרך כלל מספקות. - לחזור סריקה עם סריקת תנאים לייזר (איטי) סופי ולהתאים: בהירות (שימוש מינימלי רווח כדי להפחית את הרקע); לייזר כוח (גבוה ככל האפשר נדרש, המתחילים - עליות photobleaching; בדרך כלל הגדרת המינימום היא נאותה); נקב (למנוע פתיחה אם לא נדרש, כדי לשמור על רזולוציית).
הערה: סריקת תנאים תלויים הדגימה ויש צורך מדעית להיקבע בתחילת הפעלת סריקה. ודא כי הבהירות לא תחרוג רוויה (יהיה להגביל את היכולת לשנות את התמונה לאחר מכן על ידי הדמיה תוכנה). בעת הגדרת סריקה תנאים, גם לשקול כי יש להשתמש בתנאים זהים עבור כל הדמיה בניסויים המשווים חיות ניסוי עם פקדים. - לכידת התמונה סדרות. מיזוג תמונות לתמונה הקרנה בודד.
הערה: ייתכן שיהיה עליך לשמור תמונות הקרנת ו/או כיסויי בנפרד בהתאם מיקרוסקופ. - בעת לקיחת תמונות רב ערוצית להשתמש סריקה רציפה כדי למנוע דימום-דרך בין ערוצים (קריטי ללימודי הסבת שיתוף).
הערה: הגדרות תמונה אולי צריך להשתנות בהתחשב photobleaching מוגבר קשור עוד סריקה זמן. - תמיד לרכוש תמונות DIC/Nomarski המקביל (סעיפים) ציוני דרך, הכוללת מדינת מורפולוגיה של חיה סרוקה.
- המקום שקופיות תחת מיקרוסקופ קונפוקלי. חיפוש של תולעים עם 10 x אובייקטיבית, מיקוד-
5. כימות של קרום מקוטב להן פגמים במעי C. elegans
הערה: דוגמה: Basolateral תזוזה של ERM הפסגה-1::GFP חוץ רחמי לומן לרוחב היווצרות שנגזרות לתת-767 ו aps-1 RNAi.
- הבקיע פנוטיפים תחת המיקרוסקופ ויבתר ( איור 5 A, D, E)
- הגדר קטגוריות עבור מניה. דוגמה: (i) פראי-סוג (WT), (ii) basolateral תזוזה של היווצרות לומן חוץ רחמי ERM-1::GFP (קוטביות פגם), וכן (iii) (מפתחת מיד לאחר העקירה basolateral).
הערה: ניתוח חזותי הגדלה נמוכה משאיל את עצמו ניקוד מספרים של חיות עם או בלי פנוטיפ ספציפי. כאן בחרנו דוגמא לשלוש קטגוריות פנוטיפי שונה הנמצאות באותו הזמן אבל הראשון להחמרה של פנוטיפ קוטביות זה ניתוח. עם זאת, מגוון פנוטיפים שונים כמותיים can be הבקיע, כמו למשל לומן מורפוגנזה פגמים, היעדרות/נוכחות (או מספרים) של וקואלות cytoplasmic חיובי GFP, לומן קוטר, גודל או מספר ציסטות intralumenal (ראה < מחלקה חזקה = "xfig" > איור 3 לדוגמאות). - Depending על סדר הגודל של ההבדלים הצפויים, ציון כ 100 תולעים בשידור חי על פלטות אגר שלהם תחת המיקרוסקופ ויבתר סט כפול או triplicate של ניסויים.
הערה: אחד חייב ציון כל חיה שעולה תצוגה בעת סריקת הלוחות באופן שיטתי, למשל מפינה שמאלית להוריד נכון של הצלחת (ודא תולעים יש מאוכלס לוחות אחיד). - חזור על הפעולה עבור 3 קבוצות עצמאית של ניסויים. ליצור גרף, להעריך את המשמעות של התוצאות.
- הגדר קטגוריות עבור מניה. דוגמה: (i) פראי-סוג (WT), (ii) basolateral תזוזה של היווצרות לומן חוץ רחמי ERM-1::GFP (קוטביות פגם), וכן (iii) (מפתחת מיד לאחר העקירה basolateral).
- רישום נקודות פנוטיפים תחת מיקרוסקופ קונפוקלי ( איור 5 B)
- להגדיר קטגוריות עבור ניקוד, למשל מספר של לומן חוץ רחמי לכל חיה
הערה: הגדלה גבוהה יותר ניתוח ויזואלי משאיל את עצמו ניקוד של סמן לכימות או פנוטיפ לכל חיה ומאפשר בדיקה נוספת של סמנים subcellular לא עשוי להיות ניכרת על ידי לנתח מיקרוסקופ. הדוגמה הנוכחית של ספירת לומן חוץ רחמי לכל חיה בקבוצת משנה של תולעים של הניסוי אותו בעבר שהוערכו לנתח מיקרוסקופ (5.1.1, קטגוריה 3) מזקק את ההערכה של פנוטיפ קוטביות הרעה, זה נבדק כאן. עם זאת, מגוון פנוטיפים או פרמטרים אחרים can be הבקיע, למשל מספר של שלפוחית, נוכחות/היעדרות או מספר רכיבים subcellular להתאים לשפה משותפת, עוצמת קרינה פלואורסצנטית (לכמת האחרון מאת ImageJ; לראות ליווי נייר על תעלת excretory) 2- - תלוי בעוצמה של הבדלים הצפוי, לכמת סמן פנוטיפי (כאן, חוץ רחמי לומן) בבעלי חיים כ-20 סט כפול או triplicate של ניסויים תחת מיקרוסקופ קונפוקלי.
- אני חוזר ל- 3 קבוצות עצמאית של ניסויים. ליצור גרפים בר, להעריך את המשמעות של התוצאות.
- להגדיר קטגוריות עבור ניקוד, למשל מספר של לומן חוץ רחמי לכל חיה
תוצאות
פרוטוקול זה מתאר כיצד מולקולרי נתח והמחש להן קרום מקוטב מורפוגנזה לומן במעי C. elegans , תא בודד, רמת subcellular. עשרים תאים הכוללים שכבה אחת. C. elegans המעי נוצרת על ידי חלוקת התא מכוונת והעברה במהלך אמצע מופרה. זה הזמן, מקוטב קרום תחומים להפוך הוקמה, אך דה נובו להן קרום מקוטב ממשיכה בוגרת אך הרחבת אפיתל ברחבי ארבעה שלבים זחל עד לבגרות, ומאפשר להתמקד בניתוח מקוטב ממברנה להן (איור 1 א').
כדי להמחיש רכיבי הסלולר ואת subcellular C. elegans , שתי אסטרטגיות משמשות: immunofluorescence (מפורט של פרוטוקול זה, סעיף 1; איור 2 , איור 4D -F) וביטוי חלבונים פיוז'ן קרינה פלואורסצנטית (מפורט בעיתון הנלווה על תעלת excretory מקוטב ממברנה להן2; איור 1B, איור 2, איור 4, דמות 5C). כפול ולקרוא מרובים, שילוב של תוויות שונות מהשיטות כל או שניהם, באפשרותך לפתור ממברנה asymmetries כגון הפסגה basolateral ממברנה תחומים ואת היחס של מרכיבים שונים subcellular אחד לשני (איור 2, איור 4D-E). מקשר קרום-שלד התא ERM-1::GFP מוצג כאן כמחוון של להן קרום הפסגה אשר עולה בקנה אחד עם לומן מורפוגנזה ב הזה אפיתל חד שכבתי. באמצעות סמן זה, מערך של פגמים להן קרום/לומן הפסגה מעיים ואת החסרונות שלהם ג'ין סיבתי ניתן לזהות על ידי אובדן של תפקוד לימודי, למשל באמצעות מוטים מסכי הגנום כולו באמצעות RNAi (RNAi גישות לאמץ דור של פנוטיפים כל כך מתוארים בסעיף 2 של פרוטוקול זה). איור 3 ו- 4 איור להראות דוגמאות של תמונות הגדלה נמוכה עד בינונית של קרום הפסגה/לומן פנוטיפים להן על ידי מיקרוסקופ פלורסצנטיות ויבתר מצויד עם מטרה מתח גבוה; וסריקה של הגדלה גבוהה יותר תמונות נרכשה על ידי לייזר קונפוקלי מיקרוסקופ (גישות מיקרוסקופית אלו מתוארים בסעיפים 3 ו- 4). כדוגמה לכימות ממברנה מקוטב להן פגמים, ההשפעות של RNAi עם לתת-767 (קידוד של סטרואידים רדוקטאז דהידרוגנאז/3-ketoacyl-CoA) ו- aps-1 (קידוד של יחידת משנה של סיגמא של clathrin AP-1 מתאם) על ERM–1::GFP ללוקליזציה והמיקום לומן מוצגים באיור5.
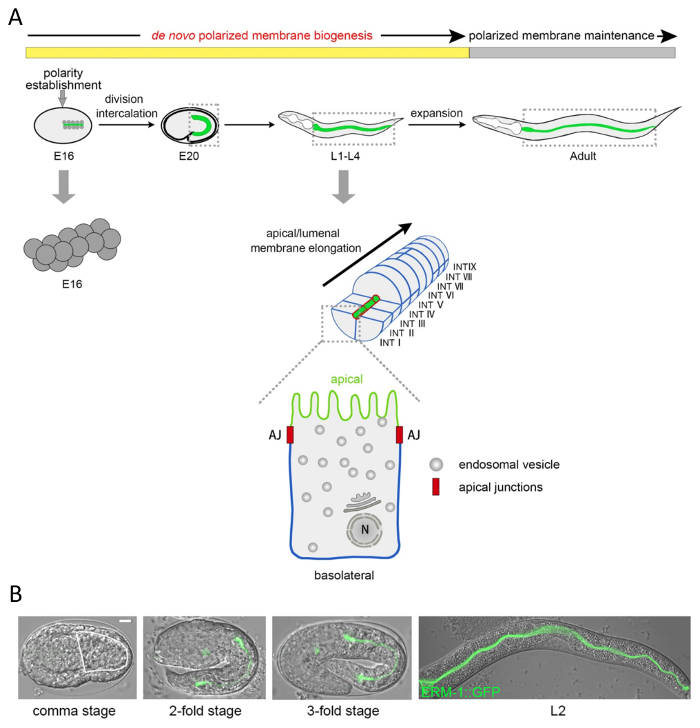
איור 1 : מורפוגנזה הפראי-סוג ומבנה הסלולר, subcellular C. elegans המעי. (א) סכמטי של פיתוח מעיים C. elegans , הרכב הסלולר, ואת אנדו - ממברנות פלזמה. המעי C. elegans מופק clonally blastomere E נולד בשלב 8 תאים. לאחר ארבעה סיבובים של חלוקת התא, שלה 16 תאים (שלב E16) טופס אפיתל הוכפל שכבות radially סימטרי15. בשלב זה הציטופלסמה של כל תא קוטביות (ניגודים), עם גרעינים העברת הרכיבים הפסגה, cytoplasmic בעתיד נע לכיוון ההפוך (העתיד הבסיס), קרום תחומים. בשלב העיבור אחד להעביר תאים הגחון ישר ושמאלה (במקביל) אל שכבת תאים הגבי כדי ליצור את הצינור סימטרית בשני הצדדים של טבעות INT 9. כל תא פונה ובונה לומן עם הממברנה הפסגה/lumenal שלו (ירוק; מבנית מכובד על ידי קרום מסוימים microdomains, microvilli) ואנשי קשר שכנות תאים או לתוך חלל הגוף עם ממברנות basolateral שלה (כחול), למעט הראשון הטבעת INT נוצרת על ידי ארבעה תאים. צמתי הפסגה (אדום) להפריד בין תחומים ממברנה הפסגה, basolateral. לאחר העיבור, להן קרום דה נובו ממשיך יחד עם הגידול של המעי במהלך מופרה מאוחר, הזחל ארבע לבגרות, שבו מתרחשת צמיחה נוספת מזערי (שלב של קרום מקוטב תחזוקה ). התא הבודד המוגדל מציין את המערכת endomembrane עם ER, גולג'י מעל גרעין (N) ושלפוחיות endosomal. (B) DIC/Nomarski, micrographs החפיפה קונאפוקלית המעי C. elegans המתפתח שכותרתו עם הסמן הקרום הפסגה-שלד התא ERM-1::GFP. המעי בשלב פסיק תחומה על-ידי פס לבן (ERM-1::GFP מבוטא באופן עמום כבר ב קרום הפסגה בתחילת שנות העיבור אבל לא יכול להיות מוערך בתמונה זו). בעלי חיים כאן, מתחת הם שמוצג עם הקדמי (ראש) שמאלה, אחורי (זנב) נכון, להמציא הגבי, הגחוני / למטה. סרגל קנה מידה: 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2 : דוגמאות כפולים ומשולשים תיוג בפיתוח פראי-סוג C. elegans המעי באמצעות נוגדנים וחלבונים פיוז'ן. (A, B) עוברי. (א) שלב באמצעות פסיק. PAR-6::GFP (green; רכיב של הקוטביות PAR הפסגה מורכבים), נוגדנים אנטי-PAR-3 (אדום/TRITC (tetramethyl rhodamine isothiocyanate); רכיב נוסף של הקוטביות PAR הפסגה מורכבים), MH33 (כחול/Cy5 (Cyanine5); אנטי-IFB-2/ביניים פילמנט). PAR-6::GFP והנוגדן נקוב-3 תווית קרום הפסגה של המעי C. elegans (סגרו). IFB-2, עוד סמן הפסגה בשלבים מאוחרים יותר, הוא panmembraneously מקומי בשלב מוקדם זה. PAR-6::GFP ואנטי-PAR-3 גם תווית הלוע (משמאל). לומן מעיים שציין שלהם חפיפה עם IFB-2 (טורקיז), צינור העיכול תחומה על-ידי כחול אנטי-IFB-2 (מימין). (B) שלב 2-fold. ליאורה מאור-1::GFP (green; צומת רכיב), נוגדנים ICB4 (אדום/אלקסה, ICB4 מזהה אנטיגן מעיים membraneous לא ידוע). ליאורה מאור-1::GFP תוויות של צמתי הפסגה של המעי C. elegans , לעין כתבנית הסולם פרי-lumenal (הוא גם תוויות צמתי hypodermal; לא גלוי מאז התמונה מתמקדת המעי; ראה סעיף 4, הדמיה קונאפוקלית). ICB4 מכתים כל ריריות המעי C. elegans . חצים הצבע ממברנות basolateral מוכתמת אנטי-ICB4. (C, D) הזחלים L2. (ג) לתת-413::GFP (ירוק), phalloidin (אדום/טקסס-אדום, phallotoxin מחייב את F-אקטין) ו MH33 (כחול/Cyanine5, אנטי-IFB-2). לתת-413/שרבוט הוא רכיב של הקוטביות הבזליים מורכבת, רגישה לממברנות basolateral של המעי C. elegans (סגרו). Phalloidin והנוגדן IFB-2 תווית של שלד התא submembraneous הפסגה של המעי C. elegans (סגול). Phalloidin כתמים גם שרירי הגוף קיר, מוחץ ההכתמה מעיים. שיבוץ מראה הגדלה גבוהה יותר באזור ממוסגר. (E) זחל L3. SLCF-1::GFP (ירוק; נפרד membראן רכיב/סוכר טרנספורטר), ERM-1::mCherry (אדום) ו- MH27 נוגדנים (כחול/Cyanine5, אנטי-ליאורה מאור-1). SLCF-1::GFP תוויות ממברנה basolateral, בעוד ERM-1::mCherry תוויות קרום הפסגה של המעי C. elegans (סגרו); ליאורה מאור-1 מתייגת את צמתי הפסגה. (F-F' ') זחל L2. (F, F') תמונות צבע יחיד. SLCF-1::GFP (ירוק) תוויות קרום basolateral (לרוחב ממברנות המסומנים על ידי חצים לבנים דקים). MH27 (כחול/Cyanine5) תוויות צמתי הפסגה (חיצים צהובים קצר). (F"F' ') כיסוי תמונות עם ובלי אקטין. כניסות להראות הגדלה גבוהה יותר של התחומים. הערה אבחנה ברורה של זווית apicolateral של תאי המעי על ידי אלה סמנים ממברנה שונים/צומת שנראים דומים באופן שטחי בתמונות צבע בודד (F, F'). החצים הלבנים עבה בפה' 'הצבע על שלד התא אקטין הפסגה/lumenal המתויגים באמצעות phalloidin (אחרת והוכרעה על ידי שרירים אקטין). כל התמונות הן הקרנות קונאפוקלית (z-ערימות של 0.2 µm), שנרכשה על-ידי סריקת רציפים כדי למנוע דימום-דרך בין ערוצים. גודל ברים (עבור A-E, F-F ' ' ואת כל כניסות): 5 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
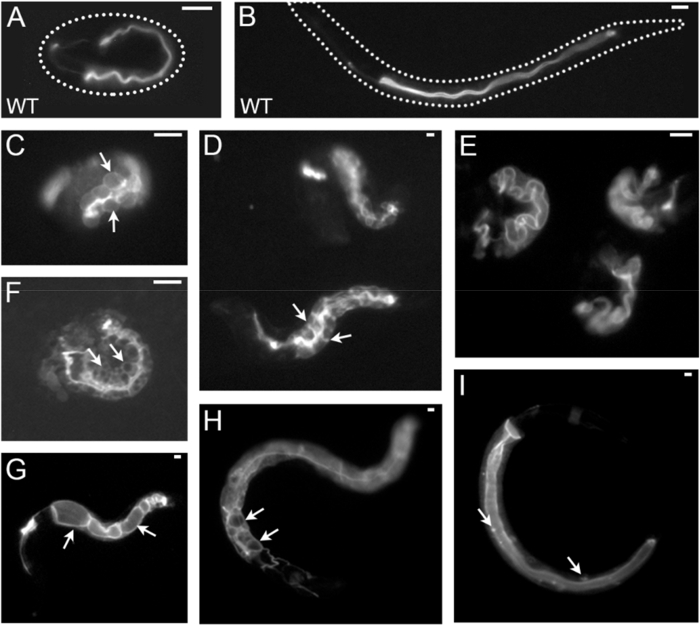
איור 3 : דוגמאות C. elegans מעיים מקוטב מורפוגנזה ממברנה ו לומן פגמים בהגדלה נמוכה עד בינונית (לנתח זריחה micrographs). כל התמונות נרכשים על ידי מיקרוסקופ פלואורסצנטי ויבתר מצויד עם קובץ מצורף מחוייט ובעוצמת פלורסצנטיות סטריאו (טבלה של חומרים). הגדלה שונים מוצגים. פנוטיפים כל התקבלו על ידי RNAi עם גנים שונים בזן המסומנת ERM-1::GFP (מקומי-ממברנות הפסגה/lumenal תעלת המעי ו excretory בשלבים עובריים ותחילת זחל, המוצגת כאן). הפנוטיפים מעיים של לומן, קוטביות הן: העובר פראי סוג (A, B) (A) וזחל (B); תזוזה basolateral (C, D) של אמ-1::GFP; תאים מעיים מוגדלות ומופיעים מנופח ב העובר הזה (C, חצים הצבע על תאים בודדים מעיים), אך הן של פראי-סוג וגודל סידור לרוות כאלה (ד, החץ מצביע לממברנות לרוחב בין INT II ו- III); (E) התרחבו, מפותל לומן ב שלושה עוברי; ERM (F)-הרחבת לאזור צומת לרוחב (זיגזג לומן) ואל תוך הציטופלסמה מעיים המכיל וקואלות GFP-שלילי (חיצים); 1::GFP (G) ציסטות lumenal שביניהם intralumenal הידבקויות (הצבע חצים על שתי ציסטות). Cytoplasmic (H), basolateral ERM-1::GFP הזחה עם חוץ רחמי לומן (חיצים); (אני) ERM-1::GFP הזחה ל GFP-חיוביות puncta (חיצים) בציטופלסמה. תעלות excretory, תעלת excretory פנוטיפים כאן לא מתוארים (תעלת מוצג אל המעי משמאל, מימין עם כל התמונות). גודל ברים: 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4 : דוגמאות C. elegans מעיים מקוטב ממברנה ו לומן מורפוגנזה פגמים בהגדלה גבוהה יותר (קונאפוקלית תמונות). (A, C, E, G, K) עוברי. (B, D, F, H, J, L) הזחלים. פנוטיפים כל התקבלו על ידי RNAi עם גנים שונים בזן המסומנת ERM-1::GFP (ירוק בתוך כל התמונות). הדמיה מתמקדת המעי. תמונות של העוברים גם מראים excretory תעלות (בצד של תמונת שמאל), כולל תעלת פנוטיפים (לא יפורט). (A, B) פראי סוג העובר (A), פגית (B). (ג) Basolateral תזוזה של ERM הפסגה-1::GFP (שלב פסיק; העיבור מאוחר). (ד) המרה קוטביות: basolateral תזוזה של ERM הפסגה-1::GFP הצטברות הפסגה של basolateral ICB4, התגלה על-ידי תיוג כפול. F-אקטין (הנקראת על-ידי-phalloidin-TRITC) מתאר את בעלי החיים על ידי צביעת חבילות שרירים אורכיים (חיה היא משולשת עם התווית). (E) תזוזה Basolateral של ERM-1::GFP ב העובר מאוחר 3-fold. הנוגדן IFB-2 הפסגה (כחול/Cyanine5) מציין לומן ללא פגע, חוטים ביניים פרי-lumenal. (F) לומן חוץ רחמי עליהם תווית באמצעות אנטי-IFB-2 (כחול/Cyanine5). (G) ERM-1::GFP שליליות וקואלות בתוך הציטופלסמה מעיים. (H) ERM 1::GFP וקואלות חיובית בתוך הציטופלסמה מעיים. (אני, J) היעדר לומן העובר, הזחלים, בהתאמה. הבטן רחב (K). פיברוזיס (L), בטן מפותל. (A, D, H, J, K, L) והקרנות קונפוקלי. (B, C, E, F) הם קטעי וידאו. בהירות היה גדל G כדי לסמן cytoplasmic וקואלות GFP-שלילי. גודל ברים: 10 מיקרומטר (זהה עבור כל העוברים, הזחלים, בהתאמה). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
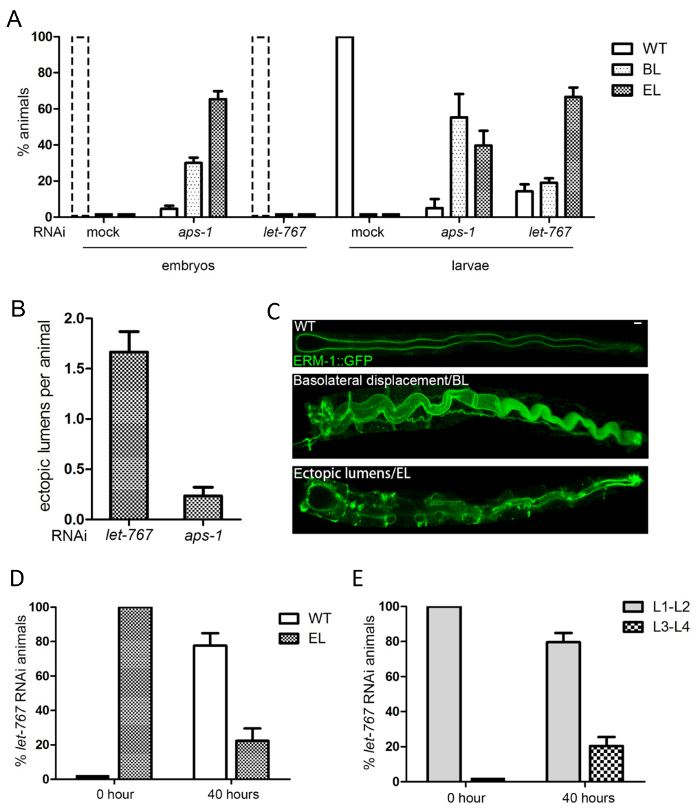
איור 5 : קוטביות מעיים ההמרה, השחזור: דוגמא עבור כימות של פגמים להן מקוטב של הממברנה, לומן. (A, B, C) לתת-767ו aps-1RNAi הן גורמות ERM-1::GFP basolateral הזחה (BL) ואת היווצרות חוץ רחמי לומן (EL), אבל בשלבים התפתחותיים שונים. (א) כמת על ידי לנתח מיקרוסקופ: ספירה של עוברי (שמאל) וזחלים (ימינה) עם קוטביות פנוטיפים 2 ימים לאחר זריעה תולעים על צלחות RNAi. הערה: כל בעלי החיים מעושה, let-767(RNAi) נמצאו בזמן הזה (ובכך ישנם אין עוברי, אשר היו, עם זאת, כל פראי-סוג קוטביות; שבור קו עמודות). aps-1 RNAi גורם פגמים קוטביות כבר עוברי, ואילו לתת-767RNAi המניע אותם בהזחלים. האחוז גבוה יותר של לומן חוץ רחמי (לעומת basolateral הזחה) ב- aps-1עוברי RNAi נגד הזחלים היא בשל מעצרו של העוברים עם לומן חוץ רחמי. (B) כמת על ידי מיקרוסקופיה קונפוקלית: ספירת לומן חוץ רחמי לכל חיה בתחילת פיתוח חוץ רחמי לומן הזחלים. לתת-767 RNAi המניע לומן יותר חוץ רחמי ב הזחלים מ- aps-1RNAi (aps-1RNAi הזחלים הם "escapers" שיש לא במקום כליאתוטד בתור עוברי) (ג) תמונות קונאפוקלית עבור הזחלים פראי-סוג וזחלים עם הזחה basolateral ERM-1::GFP (BL), חוץ רחמי לומן (EL); סרגל קנה מידה: 5µm. קוטביות (D, E) לדוגמות בבעלי RNAi לתת-767(ספירה של חיות עם וללא פגם קוטביות [BL/EL] מאת לנתח מיקרוסקופ). let-767(RNAi) 20, בעלי לומן חוץ רחמי קלה פנוטיפים היו הועבר מצלחת RNAi צלחת OP50 ביום 4 וההערכה לאחר 40 שעות. (ד) יותר מ-50% הזחלים יש לקדמותם פראי-סוג קוטביות (ERM-1-קרום הפסגה). (E) 20% בעלי חיים גדלים מעבר לשלב זחל L1 (let-767(RNAi) תוצאות במעצר L1). כל הנתונים מוצגים אומר + /-SEM, n = 3. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| טבלה 1: דוגמאות לסמני עבור מערכת קרום המעי זחל ומבוגרים C. elegans 1. | ||||
| חלבון שם | לוקליזציה subcellular | מבנה/פונקציה של חלבונים | זמינים מסחרית C. elegans נוגדנים ספציפיים (DSHB2) | דוגמאות של זנים לרשותכם CGC |
| OPT-2/PEPT-1 | חלבון טראנסממברנלי הפסגה | oligopeptide טרנספורטר | KWN246 (pha-1(e2123) III, rnyEx133[opt-2(aa1-412):: GFP) + pha-1(+)]) | |
| AQP-4 | חלבון טראנסממברנלי הפסגה | תעלת המים | ||
| ERM-1 | brushborder הפסגה | מקשר של קרום – שלד התא | ERM1 | |
| מעשה-5 | brushborder הפסגה | אקטין cytoplasmic | (3) | |
| IFB-2 | brushborder הפסגה | רכיב פילמנט ביניים | MH33 | |
| EPS-8 | brushborder הפסגה | human-epidermal-growth-factor-receptor-kinase-substrate-8 ortholog | ||
| PAR-6 | ממברנה הפסגה | רכיבים מורכבים קוטביות הפסגה | ||
| SLCF-1 | basolateral חלבון טראנסממברנלי | monocarboxylate טרנספורטר | ||
| AQP-1 | basolateral חלבון טראנסממברנלי | תעלת המים | ||
| לתת-413 | קרום basolateral | שרבוט homologue, מתאם, קוטביות דטרמיננטה | LET413 | |
| העברה-1 | הפסגה צומת (קכ ק4) | Α-catenin, רכיב מורכבים קדהרין-catenin | FT1609 (unc-119(ed3) III; xnIs528 [העברה-1p::hmp-1:: GFP + unc-119(+)]) | |
| HMR-1 | הפסגה צומת (קכ ק) | E-קדהרין, רכיבים מורכבים קדהרין-catenin | HMR1 | |
| ליאורה מאור-1 | הפסגה צומת (DAC5) | צומת שלמות מולקולה, רכיב תיבות דו-שיח-1/ליאורה מאור-1complex | MH27 | SU159 (jcEx44 [ליאורה מאור-1::GFP + rol-6(su1006)]) |
| תיבות דו-שיח-1 | הפסגה צומת (DAC) | Homologue דיסקים-large, חלבון מאגוק, רכיב תיבות דו-שיח-1/ליאורה מאור-1complex | DLG1 | |
| ראב-11 | שלפוחית endosomal | סחר6 | RT311 (unc-119 (ed3) III; pwIs69 [vha6p::gfp::rab-11 Cbunc-119(+)]) | |
| ראב-5 | שלפוחית endosomal | סחר בבני אדם | RT327 (unc-119 (ed3) III; pwIs72 [pvha6::gfp::rab-Cbunc-119(+) 5,]) | |
| ראב-7 | שלפוחית endosomal | סחר בבני אדם | RT476 (unc-119 (ed3) III; pwIs170 [vha6p::gfp::rab-7, Cbunc-119(+)]) | |
| ראב-10 | שלפוחית endosomal | סחר בבני אדם | RT525 (unc-119 (ed3) III; pwIs206 [pvha6::gfp::rab-10 Cbunc-119(+)) | |
| מאן | גולג'י | Α-mannosidase II | RT1315 (unc-119 (ed3) III; pwIs503 [pvha6::mans::gfp Cbunc-119(+)]) | |
| 1 דוגמאות נבחרות מן המשאבים המפורטים ב- Table3. | ||||
| 2 מחקרים התפתחותיים ליפידים הבנק. | ||||
| 3 נוגדנים נגד חוליות אקטין cross-react. | ||||
| 4 CCC: מתחם קדהרין-catenin; . רגישה לחלק הפסגה של הצומת הפסגה; המתאימים לצומת adherens (AJ). | ||||
| 5 DAC: תיבות דו-שיח-1/ליאורה מאור-1complex; . רגישה לחלק הבזליים של הצומת הפסגה; המתאימים צמוד לצומת (TJ). | ||||
| 6 לקבלת מולקולות נוספות הקשורות שלפוחית, הביע במעי ראה שופט (22). | ||||
| הערה: לא כל מולקולות נבדקו כמו חלבונים פיוז'ן תחת משלהם היזמים או באמצעות נוגדנים. | ||||
| בטבלה 2 : דוגמאות C. elegans היזמים המעי ספציפי וזמן לביטוי1. | |||
| היזמים | הביטוי הבמה | ||
| elt-2 | הביטוי מתחילה במהלך שלב 2 של התא E, נמשכת לבגרות | ||
| vha-6 | הביטוי מתחילה בהעובר מאוחר, נמשכת לבגרות | ||
| ges-1 | הביטוי מתחילה אצל כ השלב תא 4E, נמשכת לבגרות | ||
| סיום-1 | הביטוי מתחילה לאחר שלב התא 1E, מסרב במהלך מופרה מאוחר יותר | ||
| 1 דוגמאות נבחרות מן המשאבים המפורטים בטבלה 3. | |||
| טבלה 3: משאבים כדי למצוא C. elegans מולקולות ספציפיות המעי, תיוג ריאגנטים/זנים, נוגדנים. | |||
| 1. Caenorhabditis גנטיקה מרכז (CGC)42 עבור ריאגנטים זמין וללחצים | |||
| 2. Wormbase43 לקבלת מידע על מולקולות ספציפיות המעי, זנים של נוגדנים | |||
| 3. עיתוי קבלת המידע |
Discussion
פרוטוקול זה מתאר כיצד לשלב גישות (תיוג ו מיקרוסקופיים) כדי לנצל אפיתל המעי של C. elegans כמודל עבור visual ומולקולרית ניתוח ויוו רגיל אובדן-של-פונקציה גנטית/RNAi והדמיה להן קרום ו לומן מקוטב.
תיוג
פרוטוקול זה מתמקד נוגדן מכתים. בחיי עיר תיוג באמצעות נוגדנים היא גישה חלופית ספציפי מאוד כדי תיוג פלורסנט פיוז'ן חלבונים (שמתואר הנייר הנלווה על תעלת excretory ממברנה להן)2. למרות נוגדן מכתים אינו מאפשר הדמיה בשידור חי, זה עשוי לספק אישור עבור ההתאמה של חלבון של עניין (גם שיטת תיוג היא ללא יוצא מן הכלל). יתר על כן, שאלות הנוגעות מורפוגנזה ו/או לוקליזציה subcellular של חלבון יכול להידרש לעיתים קרובות בבעלי חיים קבוע. Immunostaining כפול של תיוג מרובים, ניתן לשלבו עם תיוג על ידי היתוך פלורסנט חלבונים אם אלה יכולים להישמר באמצעות ההליכים הנדרשים קיבוע ו- permeabilization. פרוטוקול מחולקת לרמות כאן מתיר בדרך כלל זו (איור 2). בחיי עיר תיוג של בעלי חיים קבוע על ידי נוגדנים או כתמים כימי יכול גם לספק יתרונות superresolution מיקרוסקופיים טכניקות כגון סערה (שחזור אופטי סטוכסטי מיקרוסקופ). Immunofluorescence מזהה אנטיגן אנדוגני, ניתן להתאים, למשל, כדי להבחין בין שינויים ספציפיים חלבון posttranslational. הוא יכול לייצר תוצאות מהירות אם נוגדנים זמינים, פעם אחת בחיי עיר טכניקות צביעת - לא כמו פשוטה C . elegans דגימות כמו תרבית תאים - הוקמו.
הדור של נוגדן חדש (לא המתוארים כאן) עם זאת, זמן רב. למרבה הצער, את הבחירה של זמינים מסחרית C. elegans נוגדנים ראשי נשאר קטן למדי, לא כולם הם מסוגלים לזהות את אנטיגן בחיי עיר (ראה טבלה 1 עבור דוגמאות של נוגדנים הדגים לזהות אנטיגנים מעיים בחיי עיר, טבלה 3 עבור משאבים נוספים). רוב נוגדנים שנוצרו נגד אנטיגנים חוליות לא cross-react עם homologs C. elegans שלהם. הבחירה של נוגדנים המשני חייב לקחת בחשבון המינים של הנוגדן הראשון (שעלון immunofluorescence כללי פרוטוקולים27,28). מבחר גדול זמינים מסחרית עם שיפור מתמיד של צבעי פלורסנט (למשל אלקסה-עבור חיל הים צבע). עבור אופטימיזציה מכתים, ניתן לבחור צבעים עבור היכולת שלהם להתאים את המיקרוסקופ משמש הדמיה, למשל הלייזר של מיקרוסקופ קונפוקלי, או אם מיקרוסקופ ברזולוציה סופר מתוכנן גם, על היכולת שלהם "מצמוץ"37. נוגדנים ראשי ישירות עם תוויות או כימי כתמים (למשל fluorescently הנקרא phalloidin) הינם גם זמינים, הם שימושיים במיוחד מכתים כפול.
הקושי עבור בחיי עיר נוגדן מכתים C . elegans הוא אטימות של מעטפת הביצית של העובר, את הקוטיקולה זחל/מבוגר כי שניהם דורשים הפרעה כימי או מכני כדי לאפשר גישה של הנוגדן אל הרקמה. למרות הפרוטוקולים מכתימים נוגדן נוזלי מורכבים פותחו כדי להתגבר על27,זו הבעיה28, לרוב כוללת את collagenase עבור permeabilization, אשר נוטה לגרום נזק את רקמת המטרה. לעומת זאת, שיטת ההקפאה-קראק המתוארים כאן היא דרך פשוטה לפתוח של התולעת ציפורנייך או קליפות ביצים. זה מבוצע ישירות על הכוס החלק היכן הדגימות שנאספו (וגם איפה מבוצע גם שאר ההכתמה) ולאחר עובד טוב במיוחד עבור הביצים והזחלים זה לדבוק הטוב שקופיות זכוכית (כלומר השלבים השונים בעיקר מחקרים tubulogenesis). זה גם לא מפריע השימור של פיוז'ן התווית על-ידי fluorophore חלבונים. הטכניקה דורש קצת מיומנות ידנית, כמו הלחץ הנכון על coverslip (לפני מצליף), ההתרחקות הטיה לחץ הם קריטיים עבור שימור הדגימה (כמו טיפול עדין, pipetting במהלך כל תהליך צביעת).
קיבוע התנאים ייתכן שתצטרך להיות נחוש מדעית, מותאם המבנה/אנטיגן זה כדי להיות צבעונית (שנדונו27). מתון יותר (למשל מבוסס-פורמלדהיד) קיבעון טכניקות אולי כדאי לשמר את antigenicity, למרות זאת צריכה להיות מאוזנת עם הצורך לשמר את רקמת מורפולוגיה, קריטי לניתוח של מורפוגנזה. קיבוע מתון יותר תנאים גם עזרה כדי לשמר פיוז'ן פלורסנט חלבונים בניסויים תיוג כפול. באופן דומה, הכמות של חסימת הסוכן (למשל חלב או שור אלבומין/BSA), דטרגנט בפתרון שטיפת דורש התאמה אמפיריים כדי לאזן את הרקע עם צביעת ספציפיים. פרטים על היבטים כלליים של טכניקות immunofluorescence, למשל הדיון טכניקות צביעת שונים, עיצוב של הפקדים המתאימים ועצות לאופטימיזציה הליכים אלה של תולעת מעיים (לדוגמא מזעור מעיים autofluorescence) ניתן למצוא גנרל, פרוטוקולים ספציפיים immunofluorescence C. elegans , כמו המופנה ברחבי.
הפרעה עם ג'ין פונקציה והערכה של פנוטיפים tubulogenesis
פרוטוקול זה מדגיש גישות RNAi שימושיות בעת הערכת גנים עם פונקציות מוקדם, חיוניות, בכל מקום, אשר אובדן חלקי (במקום השלם) הוא המקיף ביותר, כמו במקרה של tubulogenesis רוב הגנים (שלנו הגנום כולו המסך על ERM-1::GFP-המעיים שכותרתו הציע את ההפרעה הזו עם כזה גורם גנים > 90% של פנוטיפים כל tubulogenesis אינפורמטיבי זו הגדרה מסוימת12). היתרונות הרבים הטמונים המציעה C. elegans מניפולציות גנטיות (למשל זמן דור קצר שלו) ואת הגישות השונות perturb ג'ין פונקציה על ידי קדימה (החל הפונקציה/גן # מושגים בסיסיים), הפוכה (החל גישות גנטיות ג'ין) הם דנו בבחירות הכלליות C. elegans ספרות31,38. הזמינות של זמינים מסחרית ברמת הגנום RNAi האכלה ספריות גם מאפשרת להשתמש בטכניקה גנטי הפוכה זו ככלי הקרנה גנטי קדמי (ראה טבלה של חומרים עבור משאבים). יתרונות ספציפיים RNAi לניתוח של tubulogenesis כוללים את יכולתו: כדי ליצור מגוון פנוטיפים שקול לסדרה allelic מוטציה (בדרך כלל עובד היטב עבור גנים מורפוגנזה תלוי במינון); כדי להסיר אימהי RNAs (בדרך כלל מעורב מורפוגנזה מוקדם/tubulogenesis); להתערב במה-במיוחד (שימושי עבור הערכת ההשפעות על קרום מקוטב להן במהלך צמיחה זחל postmitotic).
פרטים על היבטים כלליים של RNAi הליכים נידונות השופט (26,s = "xref" > 31). מפתח עבור הניתוח של פנוטיפים tubulogenesis קטלני היא היכולת לווסת RNAi תנאים כדי להגדיל את הספקטרום של פנוטיפים. Tubulogenesis אינפורמטיבי פנוטיפים יכול להיווצר בדרך כלל על רקע פראי-סוג ללא צורך ספציפי המעי RNAi זנים39. עם זאת, זנים כאלה הם זמינים אם זה נכשל, יכול לשמש גם כדי להבחין בין התא האוטונומי מתופעות שאינה אוטונומית. גישות שונות עבור הכוח ויסות של RNAi דווחו, למשל טיטרציה של ריכוז IPTG עבור אינדוקציה של dsRNA, גישה העשויות להניב תוצאות ביותר לשחזור30. עם זאת, באופן כמותי מדויק טיטור ייתכן שלא יהיה צורך כאשר מכוון יוצר קשת של פנוטיפים שונים. בסך הכל, ההצלחה של ניתוח זה אינו כל כך הרבה תלוי למקסם את האפקט RNAi כפי שהוא על קביעת תנאים RNAi היוצרים של ספקטרום מקיף של פנוטיפים (אשר ייתכן לעתים קרובות התוצאה של שיוצרת (למשל מתון יותר) RNAi תנאים).
להערכה ויזואלית של פנוטיפים tubulogenesis המושרה על ידי RNAi חשוב לקבוע את החלון האופטימלי להערכה פנוטיפי. עדיף להתחיל להעריך את הצלחות מוקדם (למשל יומיים אחרי החיות ללוחות RNAi שלהם בתנאים סטנדרטיים RNAi) ו לציית להם מספיק זמן תופעות אפשריות מאוחר. קורס זמן התפתחותית של פגם קוטביות המידרדרת, לדוגמה, אמור לכסות את 3-7 ימים בהזחלים נעצר בדרך כלל. תנאי לניתוח קרום מקוטב להן postmitotic ללא חלוקת תאים של המעי זחל ניתן עוד לשפר בעת השימוש מוטציות או RNAi חיות עם האטת הצמיחה (כמו, למשל, let-767(RNAi) או מוטציה חיות 12, איור 5). כל מסלול הזמן יש לביטול אם מופיע F2 חיות (ניתן להסיר L4s בניסויים איפה לעצור אבל לא כל החיות כמו הזחלים). בכל ניסוי מחייב הערכת והמצוות חיוביים ושליליים הפקדים המתאימים (למשל RNAi חיידקי שיבוטים זירוז הפנוטיפ מוגדרים tubulogenesis, ריק וקטוריים או שיבוטים RNAi מקושקשות, בהתאמה). דרישה נוספת עבור הערכה הוא בגודל שבוחרים מספיק (לפחות 50). אם לא פגשתי, תנאים אחרים (למשל מותנה) RNAi יכול להישפט. סוף סוף, קצת פנוטיפים tubulogenesis מעניין במיוחד מתרחשים penetrance נמוך, ובכך מספר מספיק של חיות שחובה להעריך.
מיקרוסקופ
הגדלה נמוכה עד בינונית לנתח מיקרוסקופ פלואורסצנטי, מיקרוסקופיה קונפוקלית בהגדלה, הדמיה שני רגיל ההליכים המתוארים כאן, הן בדרך כלל מספקות לאפיין את ההיבטים הבסיסיים של הפנוטיפ צינור או לומן ב C.elegans המעי יכול לשמש גם למסך באופן חזותי קבוצות גדולות של חיות במסכים קדימה. לנתח פלורסצנטיות מיקרוסקופ היתרים: ויוו הדמיה של חיות על צלחות שלהם (עם זאת, בעלי חיים, transiently. מרותק למיטה על ידי הרדמה, יכול גם להיות התאושש מן טעינות לאחר קונפוקלי או הדמיה DIC); הקרנת קבוצות גדולות של חיות; מעקב אחר אירועים התפתחותיים (למשל העקירה והחלפה של סמן מקוטב במהלך התרחבות קרום); מעקב אחר דפוסי ביטוי ספציפי (כמה דפוסים, asymmetries כדאי נבדלים בהגדלה נמוכה); בחירת ובחירת מתאים ניתוח נוסף (למשל קונפוקלית) או באחזקה של extrachromosomal transgenes פלורסנט תולעים. ויזואליזציה בהגדלה גדולה על ידי מיקרוסקופיה קונפוקלית מאפשרת לאפיין את פנוטיפ תא בודד, וברמה subcellular. פרוטוקול זה מתאר הדמיה עם מיקרוסקופ קונפוקלי המציעה את confocality הטוב ביותר על פני חלופות כגון מיקרוסקופ קונפוקלי של הדיסק מסתובב סורק לייזר. מיקרוסקופ קונפוקלי של הדיסק מסתובב, אולם הוא המיקרוסקופ של בחירה ללימודי דינמי, בצילום מואץ מאז מביאה פחות phototoxicity (ראה את השופט (34,35) להרחבה של ההגדלה נמוך וגבוה מיקרוסקופ C. elegans). הרומן, כמו גם טכניקות מיקרוסקופיים שגרתיות להציע יתרונות נוספים ורשיון דימות ברזולוציה גבוהה יותר בכל מגוון ננו (למשל שידור אלקטרון והרזולוציה סופר-מיקרוסקופיה; נדונה ב37, 40).
כאשר הדמיה C. elegans המעיים תחת מיקרוסקופ קונפוקלי, וביטול הנייח היא קריטית. בין כימיקלים שונים על קיבעון, אזיד הנתרן - למרות רעיל - עובד הכי אמין אם הסריקה מתבצעת באופן מיידי. Levamisole, אמנם לא רעיל, מייצרת hypercontraction המפריעה לעיתים עם הערכת מורפוגנזה פנוטיפים. הרדמה מסוימים עלולים להפריע ממברנה-הקשורים חלבונים פלורסנט והוא יכול לייצר חפצים זה אולי נראה כמו פגמים קוטביות. C. elegans הוא דוגמא עבה, ולכן ניתוח תלת-ממד (חלוקתה) הוא חיוני כדי לנצל הכוח ספציפי של האפיתל במעי צינורי המאפשרת הדמיה מצוינת של צמתים הפסגה וכן קרום לרוחב (לא בקלות נגיש epithelia שטוח). הגדרות וידאו שתישמר עבור כל שקופית, המטרה להשיג תמונות באיכות טובה, כולל פרמטרים כמו תיחום, בממוצע, עוצמת הלייזר, רווח, חריר ובהירות. בעיה מסוימת אחת הדמיה מעיים היא של איבר זה התוכן של גרגרי autofluorescent ירוק/צהוב (ליזוזום קשורים organelles (LROs)) אשר עלולים להפריע הפרשנות של תוצאות, במיוחד כאשר הערכת תזוזה של GFP שכותרתו אנדו - וקרום פלזמה רכיבים המשויכים. בעיה זו הוא הכיר היטב בתחום, יכול להיות מטופלת על ידי גישות שונות (תלוי מיקרוסקופ), כולל דאפי הדרה, טביעת אצבע ספקטרלי של הסורק אמפירי-הגדרות-13,-41.
Disclosures
המחברים מצהירים כי יש להם אינטרסים כלכליים אין מתחרים.
Acknowledgements
אנו מודים מריו דה בונו (MRC מעבדה לביולוגיה מולקולרית, קיימברידג ', בריטניה), קנת ג'יי Kemphues (אוניברסיטת קורנל, איתקה, ארה ב), מישל Labouesse (Institut de Seine בפריז Biologie, אוניברסיטת פייר et מארי קירי, פריז, צרפת), מישו Grégoire (אוניברסיטת deRennes 1, רנה, צרפת), CGC, במימון משרד NIH תוכניות תשתית מחקר (P40 OD010440), זנים, נוגדנים. עבודה זו נתמכה על ידי מענקים NIH GM078653, 224570 הוא MGH, SAA 223809 כדי כלל
Materials
| Name | Company | Catalog Number | Comments |
| Antibody staining | |||
| poly-L-lysine | Sigma | P5899 | |
| Methanol | Fisher Scientific | A452-4 | |
| Acetone | Fisher Scientific | A949SK-4 | |
| Tween | Fisher Scientific | 50-213-612 | |
| Permount | Fisher Scientific | SP15-100 | |
| Powdered milk | Sigma | MT409-1BTL | |
| Primary antibodies | |||
| MH27 (mouse) | Concentration: 1:20 Resources: Developmental Studies Hybridoma Bank. | ||
| MH33 (mouse) | Concentration: 1:10 Resources: Developmental Studies Hybridoma Bank. | ||
| anti-ICB4 (rabbit) | Concentration: 1:5 Resources: A gift from Mario de Bono (Medical Research Council, England) | ||
| anti-PAR-3 (rabbit) | Concentration: 1:50 Resources: A gift from Kenneth J. Kemphues (Cornell University) | ||
| Secondary antibodies | |||
| Alexa Floor 568 (anti-rabbit) | ABCam | AB175471 | Concentration: 1:200 |
| Cy5 (anti-mouse) | Life technologies | A10524 | Concentration: 1:200 |
| TRITC (anti-rabbit) | Invitrogen | T2769 | Concentration: 1:200 |
| FITC (anti-mouse) | Sigma | F9006 | Concentration: 1:100 |
| Labeled chemicals | |||
| Texas Red-Phalloidin | Concentration: 1:100 Resources: Molecular Probes-T7471 | ||
| Materials | |||
| Vacuum Grease Silicone | Beckman | 335148 | |
| Microscope slides | Fisher Scientific | 4448 | |
| Microscope coverslips (22x22-1) | Fisher Scientific | 12-542-B | |
| C. elegans related | see reference29 for standard C. elegans culture and maintenance procedures. | ||
| LB Medium and plates | see reference29 for protocols. | ||
| Tryptone | Acros Organics | 611845000 | |
| Yeast Extract | BD Biosciences | 212750 | |
| NaCl | Sigma | S7653 | |
| Bacto Agar | BD Biosciences | 214040 | |
| Ampicillin | Sigma | A0116 | |
| Tetracycline | Fisher Scientific | BP912 | |
| M9 Medium | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| KH2PO4 | Sigma | P0662 | |
| Na2HPO4 | Sigma | S7907 | |
| MgSO4 | Sigma | M2773 | |
| NGM plates | see reference29 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| RNAi plates | see reference30 for protocols. | ||
| NaCl | Sigma | S7653 | |
| Peptone | BD Biosciences | 211677 | |
| Tryptone | Acros Organics | 611845000 | |
| Bacto Agar | BD Biosciences | 214040 | |
| MgSO4 | Sigma | M2773 | |
| CaCl2 | Sigma | C3881 | |
| Cholesterol | Sigma | C8667 | |
| K2HPO4 | Sigma | P3786 | |
| KH2PO4 | Sigma | P0662 | |
| IPTG | US Biological | I8500 | |
| Carbenicillin | Fisher Scientific | BP2648 | |
| NaOH | Fisher Scientific | SS266-1 | |
| Sodium hypochlorite | Fisher Scientific | 50371500 | |
| Bacteria | |||
| OP50 bacteria | CGC | ||
| HT115 bacteria | CGC | ||
| Genome-wide RNAi libraries Ahringer genome-wide RNAi feeding library (ref 30,49,50) | Source BioScience | ||
| C. elegans ORF-RNAi feeding library (ref51) | Source BioScience | ||
| Imaging related | |||
| Sodium azide | Fisher Scientific | BP9221-500 | |
| Equipment | |||
| dissecting microscope | Nikon | SMZ-U | |
| dissecting microscope equipped with a high-power stereo fluorescence attachment (Kramer Scientific), CCD camera with Q capture software and X-Cite fluorescent lamp (Photonic Solutions) | Olympus | SZX12 | |
| Laser-scanning confocal microscope | Leica Microsystem | TCS SL | |
| laser-scanning confocal mounted on an ECLIPSE Ti-E inverted microscope | Nikon | C2 |
References
- Bryant, D. M., Mostov, K. E. From cells to organs: building polarized tissue. Nat. Rev. Mol. Cell Biol. 9 (11), 887-901 (2008).
- Zhang, N., Membreno, E., Raj, S., Zhang, H., Khan, L. A., Gobel, V. The C. elegans excretory canal as a model for intracellular lumen morphogenesis and in vivo polarized membrane biogenesis in a single cell. JoVE. , (2017).
- Rodriguez-Boulan, E., Macara, I. G. Organization and execution of the epithelial polarity programme. Nat. Rev. Mol. Cell Biol. 15 (4), 225-242 (2014).
- Mellman, I., Nelson, W. J. Coordinated protein sorting, targeting and distribution in polarized cells. Nat. Rev. Mol. Cell Biol. 9 (11), 833-845 (2008).
- Nelson, W. J. Adaptation of core mechanisms to generate cell polarity. Nature. 422, 766-774 (2003).
- Goldstein, B., Macara, I. G. The PAR Proteins: Fundamental Players in Animal Cell Polarization. Dev. Cell. 13 (5), 609-622 (2007).
- Rodriguez-Boulan, E., Kreitzer, G., Musch, A. Organization of vesicular trafficking in epithelia. Nat. Rev. Mol. Cell Biol. 6 (3), 233-247 (2005).
- Zegers, M. M., O'Brien, L. E., Yu, W., Datta, A., Mostov, K. E. Epithelial polarity and tubulogenesis in vitro. Trends Cell Biol. 13 (4), 169-176 (2003).
- Tepass, U. The apical polarity protein network in Drosophila epithelial cells: regulation of polarity, junctions, morphogenesis, cell growth, and survival. Annu. Rev. Cell Dev. Biol. 28, 655-685 (2012).
- Shivas, J. M., Morrison, H. A., Bilder, D., Skop, A. R. Polarity and endocytosis: reciprocal regulation. Trends Cell Biol. 20 (8), 445-452 (2010).
- Bryant, D. M. A molecular network for de novo generation of the apical surface and lumen. Nat. Cell Biol. 12 (11), 1035-1045 (2010).
- Zhang, H. Apicobasal domain identities of expanding tubular membranes depend on glycosphingolipid biosynthesis. Nat. Cell Biol. 13 (10), 1189-1201 (2011).
- Zhang, H. Clathrin and AP-1 regulate apical polarity and lumen formation during C. elegans tubulogenesis. Development. 139 (11), 2071-2083 (2012).
- Asan, A., Raiders, S. A., Priess, J. R. Morphogenesis of the C. elegans Intestine Involves Axon Guidance Genes. PLoS Genet. 12 (4), e1005950(2016).
- Leung, B., Hermann, G. J., Priess, J. R. Organogenesis of the Caenorhabditis elegans intestine. Dev. Biol. 216 (1), 114-134 (1999).
- Altun, Z. F., Hall, D. H. Alimentary system, intestine. WormAtlas. , (2009).
- Sulston, J. E., Horvitz, H. R. Post-embryonic cell lineages of the nematode, Caenorhabditis elegans. Dev. Biol. 56 (1), 110-156 (1977).
- Rasmussen, J. P., English, K., Tenlen, J. R., Priess, J. R. Notch signaling and morphogenesis of single-cell tubes in the C. elegans digestive tract. Dev. Cell. 14 (4), 559-569 (2008).
- Maduro, M. F. Gut development in C. elegans. Seminars in cell & developmental biology. , (2017).
- McGhee, J. D. The Caenorhabditis elegans intestine. Wiley Interdiscip. Rev. Dev. Biol. 2 (3), 347-367 (2013).
- Pásti, G., Labouesse, M. Epithelial junctions, cytoskeleton, and polarity. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Sato, K., et al. C. elegans as a model for membrane traffic. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2014).
- Gobel, V., Barrett, P. L., Hall, D. H., Fleming, J. T. Lumen morphogenesis in C. elegans requires the membrane-cytoskeleton linker erm-1. Dev. Cell. 6 (6), 865-873 (2004).
- Fehon, R. G., McClatchey, A. I., Bretscher, A. Organizing the cell cortex: the role of ERM proteins. Nat. Rev. Mol. Cell Biol. 11 (4), 276-287 (2010).
- Brenner, S. The genetics of Caenorhabditis elegans. Genetics. 77, 71-94 (1974).
- Timmons, L., Court, D. L., Fire, A. Ingestion of bacterially expressed dsRNAs can produce specific and potent genetic interference in Caenorhabditis elegans. Gene. 263 (1-2), 103-112 (2001).
- Shakes, D. C., Miller, D. M. 3rd, Nonet, M. L. Immunofluorescence microscopy. Methods Cell Biol. 107, 35-66 (2012).
- JS, D. uerr Immunohistochemistry. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- T, S. tiernagle Maintenance of C. elegans. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Kamath, R. S., Martinezcampos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome Biol. 2 (1), RESEARCH0002(2001).
- Ahringer, J. Reverse genetics. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Simmer, F. Loss of the Putative RNA-Directed RNA Polymerase RRF-3 Makes C. elegans Hypersensitive to RNAi. Curr. Biol. 12 (15), 1317-1319 (2002).
- Kennedy, S., Wang, D., Ruvkun, G. A conserved siRNA-degrading RNase negatively regulates RNA interference in C. elegans. Nature. 427 (6975), 645-649 (2004).
- Shaham, S. Methods in Cell Biology. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2006).
- Maddox, A. S., Maddox, P. S. High-resolution imaging of cellular processes in Caenorhabditis elegans. Methods Cell Biol. 107, 1-34 (2012).
- Netherlands, S. Nomarski Differential Interference Contrast Microscopy. , Springer. Netherlands. (2008).
- Bates, M., Jones, S. A., Zhuang, X. Stochastic optical reconstruction microscopy (STORM): a method for superresolution fluorescence imaging. Cold Spring Harb. Protoc. 6, 498-520 (2013).
- Jorgensen, E. M., Mango, S. E. The art and design of genetic screens: caenorhabditis elegans. Nat. Rev. Genet. 3, 356-369 (2002).
- Lee, Y. U., Son, M., Kim, J., Shim, Y. H., Kawasaki, I. CDC-25.2, a C. elegans ortholog of cdc25, is essential for the progression of intestinal divisions. Cell Cycle. 15 (5), 654-666 (2016).
- Hall, D. H., Hartwieg, E., Nguyen, K. Modern electron microscopy methods for C. elegans. Methods Cell Biol. 107, 93-149 (2012).
- Shi, A., Grant, B. D. In vivo analysis of recycling endosomes in Caenorhabditis elegans. Methods Cell Biol. 130, 181-198 (2015).
- Caenorhabditis Genetics Center (CGC). , http://cbs.umn.edu/cgc/home (2017).
- Wormbase. , http://www.wormbase.org/ (2017).
- McGhee, J. The C. elegans intestine. WormBook. , The C. elegans Research Community. WormBook: http://www.wormbook.org. (2007).
- Transgeneome website. , https://transgeneome.mpi-cbg.de/transgeneomics/index.html (2017).
- C. elegans expression pattern. , http://gfpworm.org/ (2017).
- National BioResource Project (NBRP)::C. elegans. , https://shigen.nig.ac.jp/c.elegans/ (2017).
- Developmental Studies Hybridoma Bank (DSHB). , http://dshb.biology.uiowa.edu (2017).
- Kamath, R. Genome-wide RNAi screening in Caenorhabditis elegans. Methods. 30 (4), 313-321 (2003).
- Kamath, R. S. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421 (6920), 231-237 (2003).
- Rual, J. F. Toward improving Caenorhabditis elegans phenome mapping with an ORFeome-based RNAi library. Genome Res. 14 (10B), 2162-2168 (2004).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved