Method Article
Изоляция и культура нейронов спинного мозга от неонатальных мышей
В этой статье
Резюме
В этом исследовании представлен метод выделения нейронов у неонатальных мышей WT. Это требует тщательной диссекции спинного мозга от неонатальной мыши с последующим отделением нейронов от ткани спинного мозга путем механического и ферментативного расщепления.
Аннотация
Мы представляем протокол для изоляции и культуры нейронов спинного мозга. Нейроны получают от неонатальных мышей C57BL / 6 и выделяют в послеродовой день 1-3. В одном эксперименте собирают мышь, обычно 4-10 щенков, рожденных из одной размножающейся пары, и спинальные шнуры собираются индивидуально от каждой мыши после эвтаназии с изофлураном. Позвоночник расщепляется, а затем спинной мозг высвобождается из колонки. Затем спинальные шнуры измельчают для увеличения площади поверхности доставки для ферментативной протеазы, которая позволяет высвобождать нейроны и другие клетки из ткани. Затем растирание происходит в растворе. Этот раствор затем фракционируют в градиенте плотности для отделения различных клеток в растворе, позволяя выделить нейроны. Приблизительно 1-2,5 × 10 6 нейронов можно выделить из одной группы подстилок. Затем нейроны высевают на лунки, покрытые клеем factoКоторые обеспечивают правильный рост и созревание. Нейроны занимают приблизительно 7 дней для достижения зрелости в среде роста и культивирования и могут быть использованы после этого для лечения и анализа.
Введение
Понимание патологии спинного мозга требует использования различных моделей, как на макроскопическом, так и на микроскопическом уровнях. Крупные и мелкие животные модели 1 , 2 , 3 используются для исследований in vivo заболеваний и травм спинного мозга. При изучении этих проблем in vivo имеет свои достоинства, анализ спинного мозга ограничен гомогенатом всего спинного мозга или секциями тканей 4 . Это создает некоторую двусмысленность при попытке изолировать конкретные ответы и цели в спинном мозге среди его резидентных нейронов и окружающих глии. Увеличение доступности генетически управляемых мышей позволяет более детально исследовать биологию на клеточном и молекулярном уровнях. Таким образом, здесь используется неонатальная модель мыши, позволяющая изучать уникальные свойства и биологию нейронов спинного мозга in vitro .
Изоляция и поддержание нейронов in vitro не особенно прямолинейны. Существует относительное изобилие методов изоляции нейронов от кортикальной ткани взрослых грызунов, которые, как представляется, приводят к значительному количеству изолированных нейронов ( т. Е. Миллионов) 5 , 6 , 7. Напротив, выход нейронов из ткани спинного мозга ниже 8 , 9 , 10 , частично из-за меньшей массы ткани. Кроме того, у мышей наблюдается относительная малочисленность методов изоляции неонатальных Нейроны спинного мозга и существующие методы ограничены более низкими выходами нейронов ( т. Е. Сотнями) 9 или трудоемкими и ресурсоемкими методами, требующими выделения эмбриональных мышей 10 .В этом протоколе мыИспользуйте методику, позволяющую экономически выгодную изоляцию значительного числа нейронов из спинальных клеток неонатальных мышей. Как обычно в ранее опубликованных методах, мы используем папаин в качестве ферментативной протеазы, позволяя высвобождать нейроны из ткани спинного мозга 5 , 6 . Кроме того, мы используем градиент плотности для рафинированного разделения клеток, который ранее считался эффективным 6 , 10 . В то время как среда, в которой клетки инкубируются, может различаться, по нашему опыту и, как было опубликовано ранее 11 , добавка с добавлением новой питательной среды B27 оказалась критической для долголетия нейронов. Нейроны обычно жизнеспособны на срок до 10 дней, что позволяет проводить лечение.
протокол
Уход и лечение животных в этой процедуре проводились в соответствии с руководящими принципами Комитета по институциональному уходу и использованию животных в Университете Колорадо.
1. Подготовка решений
- Подготовьте и храните все растворы при соответствующих температурах, как показано в таблице 1 .
2. Покрывающие скважины и слайды
ПРИМЕЧАНИЕ. Нейроны плохо прилипают к пластиковым или стеклянным поверхностям.
- За один день до выделения нейронов покрывают лунки стерильной 24-луночной культуральной тарелки 0,5 мл Poly-D-лизина (PDL, таблица 2 ) и оставляют его в ламинарном вытяжном шкафу O / N.
ПРИМЕЧАНИЕ. Предпочтительным методом является использование 24-луночных планшетов и покрытие только центральных скважин, поскольку испарение из периферийных скважин имеет тенденцию к более ускоренному и приводит к несогласованным результатам. Кроме того, стеклянные слайды могут быть размещены внутри колодцев до tO покрытие. Нейроны будут прикрепляться к покрытым стеклом слайдам и могут быть удалены позже для дальнейшей микроскопической визуализации . - В день изоляции удалите PDL из колодцев. Промыть стерильной водой в течение нескольких минут, прежде чем удалить оставшуюся воду и дать ей высохнуть в течение 1 часа (см. Ниже).
- После высыхания покрывают слайды ламинином ( табл. 2 ).
ПРИМЕЧАНИЕ. Приблизительно 10 мкл ламинина (10 мкг / мкл) достаточно для покрытия каждой лунки стерильной 24-луночной планшеты. Его смешивают с 340 мкл среды (общий объем: 350 мкл), чтобы покрыть всю лунку. Пусть это сидит в течение 2 часов при комнатной температуре в культуральной капоте, а затем аспирирует до покрытия клеток.
3. Уборка лезвий
ПРИМЕЧАНИЕ. Все приборы должны быть подвергнуты автоклавированию (135 ° C и 30 фунтов на квадратный дюйм для циклов 4 × 7 минут) для стерильности.
- Усыпьте 1-3-дневных щенков мыши C57BL / 6 в камере с изофлураном. Подождите30 с после прекращения движения и ущипнуть ногу, чтобы подтвердить отсутствие ответа.
- Отделите голову от тела, используя ножницы, с щенком в положении лежа.
- Стабилизируйте задние лапы или хвост и руки на столе процедуры, со спинной стороной к пользователю.
- Вырежьте кожу, используя изогнутые ножницы для ирисовой диафрагмы.
- Отрежьте спинной мозг от поясничной области чуть выше бедер и продолжайте срезать обе стороны грудной клетки, чтобы отделить ее от тела.
ПРИМЕЧАНИЕ. Для этого требуется тщательное рассечение спинного мозга из висцеральных органов, чтобы избежать непреднамеренного повреждения других органов ( рис. 1а ). - Промывают последовательно в течение 10 с в чашках Петри размером 3 х 10 см, содержащих 5 мл 0,2 мкм фильтрационно-стерилизованного фосфат-буферного солевого раствора (PBS) для удаления избыточной ткани.
- Вставьте иглу 22 г и шприц, заполненный 5 мл стерилизуемого фильтром PBS в хвостовой конец позвоночного столба и промывайте краниально, позволяя шнуру tO выход в четвертую чашку Петри ( рис. 1b ).
- Соберите спинной мозг в 15-миллилитровой пробирке с 5 мл HABG ( таблица 1 ) на льду. Используйте осторожность, чтобы избежать дробления спинного мозга.
- Повторите шаги 3.1-3.8 для каждого щенка в подстилке.
ПРИМЕЧАНИЕ. В идеале для обеспечения здоровой изоляции нейронов этот процесс должен занимать менее 30 минут на спинной мозг.
4. Изолирующие нейроны
ПРИМЕЧАНИЕ. Следующий этап должен выполняться в вытяжном шкафу с ламинарным потоком. Ожидается знакомство с базовой стерильной техникой.
- Тканевое молоко
- Возьмите трубку, содержащую спинные шнуры, и слегка встряхните, чтобы приостановить ткань.
- Вылейте ткань из трубки в чашку Петри 60 мм и кубики с лезвием бритвы, чтобы создать мелкие кусочки размером ~ 0,5 мм.
- Перенесите ткань с помощью пипетки с широким отверстием в пробирку объемом 15 мл, содержащую 5 мл HABG.
- Поместите его в30 ° C в течение 30 минут, чтобы позволить клеткам уравновешиваться при этой температуре. Держите клетки на шейкере достаточно, чтобы их можно было подвешивать в жидкости.
ПРИМЕЧАНИЕ. Этот шаг делается для того, чтобы избежать шокирования клеток при переносе из льда в среду для пищеварения. Хранение клеток при 30 ° C помогает уменьшить гибель клеток, связанную с другим повышенным метаболизмом при 37 ° C.
- Подготовьте среду для переваривания ( таблица 1 ).
- Подготовьте градиент плотности (таблица 1).
- Подготовьте каждый из 4 слоев в 4 отдельных 15-мл пробирках, как указано в таблице 1 .
- Добавьте 1 мл каждого слоя в новую пробирку объемом 15 мл. Начните с слоя 1 внизу и последовательно добавьте до достижения слоя 4 вверху. Избегайте нарушения слоев при добавлении.
- Промыть пластины, покрытые PDL, с этапа 2.2. Промыть стерильной водой в течение нескольких минут перед удалением оставшейся воды иПозволяя им высохнуть в течение 1 часа.
- Перенесите ткань в среду для переваривания.
- Удалите ткань, содержащую пробирку, из шейкерной водяной бани при 30 ° C и дайте ей остыть в течение нескольких минут.
- Удалите пробирку с пищеварением из 37 ° C водяной бани и впрысните ее в шприц с левым замком.
- Аспирируйте избыток HABG из ткани, содержащей пробирку.
- Используйте фильтр на 0,2 мкм на шприце, чтобы добавить среду для переваривания в ткань, содержащую пробирку.
- Поместите трубку в водяную баню с температурой 30 ° C в течение 30 минут. Держите клетки встряхивая достаточно, чтобы их можно было подвешивать в жидкости.
ПРИМЕЧАНИЕ. Важно не слишком долго удерживать клетки в пищеварительной среде или позволить слишком высокой температуре, что может привести к чрезмерному пищеварению и привести к суспендированию ткани в студенистой смеси.
- В течение этого периода покрывают ламинин, как на этапе 2.3.
- Выполнять растирание ( т.е. отделение клеток от ткани).
- Удалите трубку со встряхивающей водяной бани на 30 ° C и дайте ей остыть в течение нескольких минут.
- Аспирируйте избыток пищеварения.
- Суспендируйте ткань в 2 мл HABG.
- Используя пипетку с узким отверстием, тритурат 10 раз в течение 45 с.
ПРИМЕЧАНИЕ. Это, пожалуй, самый важный шаг и может значительно снизить выход, если он не выполнен правильно.- Аспирируйте ткань в пипетку и немедленно опустите содержимое обратно.
- Избегайте попадания воздуха, так как это значительно снизит жизнеспособный урожай.
ПРИМЕЧАНИЕ: Идеальная пипетка представляет собой 9-дюймовую стеклянную пипетку. Наконечник пипетки должен быть отполирован на огне, чтобы сгладить шероховатые поверхности. Затем его следует силифицировать путем размещения в растворе дихлордиметилсилана (DMDCS) 1:20 в хлороформе и оставить О / N. Пипетку следует удалить и дать высохнуть на воздухе.Может быть автоклавирован для стерилизации.
Внимание: DMDCS и хлороформ являются легковоспламеняющимися, а силицирование должно проводиться в вытяжном шкафу.
- Аспирируют верхние 2 мл супернатанта и помещают его в новую 15-миллилитровую пробирку с надписью «коллекция».
- Повторите шаги 4.7.3-4.7.5 два дополнительных раза (к концу трубки для сбора клеток должно быть 6 мл).
- Медленно переносите содержимое сборной трубки в градиентную трубку, приготовленную на этапе 4.2, избегая нарушения градиента.
- На этом этапе удалите предварительно приготовленную нейробазальную среду ( таблица 1 ) из холодильника и дайте ей нагреться в бане с температурой 37 ° C.
- Очистите нейроны.
- Центрифугируйте градиентную трубку в течение 15 минут при 800 xg и 22 ° C.
- Соберите желаемый слой (ы) с помощью пипетки ( рис. 2 ) и поместите в новую пробирку объемом 15 мл. Для высшей чистоты нейро( Т.е. > 90%), собирайте слой 3. Для получения большей урожайности с меньшей чистотой ( т.е. > 70-80%) собирайте слои 2 и 3.
- Разбавьте градиент плотности, добавив 5 мл HABG к вновь собранным слоям.
- Центрифугируют при 200 мкг в течение 2 мин при 22 ° С.
- Отменить супернатант, повторно суспендировать в 5 мл HABG и щелкнуть гранулой, чтобы суспендировать клетки.
- Центрифугируют в течение 2 мин 200 × g при 22 ° C.
- Отбросьте супернатант, ресуспендируют в 3 мл нейробазальной среды и пролистывают осадок для ресуспендирования клеток.
- Подсчитайте ячейки.
- Возьмите 10 мкл раствора, теперь с клетками в нейробазальной среде, и смешайте с 10 мкл трипанового синего.
- Поместите 10 мкл этой смеси в стеклянную счетную камеру.
- Используя стандартную стеклянную счетную камеру, подсчитайте количество ячеек в каждом из четырех квадрантов 4 х 4. Добавьте все подсчитанные ячейки (n), multiНа 2 (коэффициент разведения), делить на 4 (количество квадрантов подсчитывается), умножать на 3 (объем нейробазальной среды) и умножать на 10 4 для получения концентрации клеток в клетках / мл.

- Посеять клетки на культуральных планшетах
- Разбавьте клеточную суспензию до 300 000 клеток в 1 мл нейробазальной среды.
ПРИМЕЧАНИЕ. На основании концентрации клеток, полученных на вышеуказанных стадиях, добавляют дополнительную нейробазальную среду для получения конечной концентрации 3 · 10 5 клеток / мл. Уравнение C 1 V 1 = C 2 V 2 , где C 1 - начальная концентрация клеток, полученных из урожая; V 1 составляет 3 мл; И C 2 представляет собой 3 * 10 5 клеток / мл, как обсуждалось выше. Уравнение решается для V 2 . Добавьте объем нейробазальной среды, необходимый для того, чтобы общий объем клеток в растворе равнялсяV 2 . - Встряхните осторожно, чтобы распределить клетки в растворе и добавить 1 мл в каждую лунку в 24-луночные планшеты с покрытием.
- Разбавьте клеточную суспензию до 300 000 клеток в 1 мл нейробазальной среды.
Результаты
Используя этот метод, один подстилок (4-10 щенков) позволяет выделить 1-2,5 10 6 нейронов, подходящих для посева на культуральные планшеты. Обычно 4-8 лунок высевают при указанной выше концентрации ( т.е. 300 000 клеток / мл). Рисунок 3 демонстрирует появление нейронов при этой концентрации через неделю в культуре при низкой ( а ) и высокой ( б ) световой микроскопии увеличения. Тем не менее, мы также смогли культивировать клетки при концентрациях до 500 000 клеток / лунку и до 100 000 клеток / лунку. Использование более высоких концентраций требует более среднего и пристального внимания к условиям окружающей среды, так как питательные вещества могут быстро истощаться, что приводит к токсической кислотной среде для клеток. При более низких концентрациях клетки, как правило, не достигают полной зрелости, а разрастание поддерживающих клеток ( то есть олигодендроцитов, миCroglia и астроциты).
Клетки обычно начинают прилипать к поверхности в течение первых двух часов ( рис. 4а ). Аксоны начнут прорастать в течение первых 24-48 часов ( рис. 4b -4c ). Соединения между различными нейронами в культуре обычно достигают зрелости через 7 дней ( рис. 4d ), при этом эксперименты обычно проводятся на нейронах.
Нейроны идентифицируются под световой микроскопией, так как они имеют различные аксонные проекции. Наши выделения с использованием слоя 3 ( рис. 2 ) дают ~ 80-90% нейронов в культуре. Это подтвердили с использованием иммунофлюоресцентного окрашивания нейроспецифических маркеров. На фиг. 5с нейроновый цитоскелетный белок, связанный с микротрубочками, протеин 2 (MAP2) представляет собойС указанием контуров и аксонных проекций нейронов через неделю в культуре. Аналогично, на рис. 6в нейрон-специфический ядерный маркер NeuN окрашивается, показывая ядра нейронов. Эти нейронные маркеры объединены с изображениями ядра (DAPI, рис. 5a , 6a ) и цитоплазмы (GFP, рис. 5b , 6b ), и полученные изображения объединяются ( рис. 5d , 6d ), где подробно описывается относительное количество нейронов в другие клетки в культура. При использовании слоев 2 и 3 выход нейронов несколько выше; Однако, как правило, в чистом растворе меньше нейронов (~ 70%).

Рисунок 1: Просеивание позвоночного столба и спинного мозга, выпущенного из 3-дневной неонатальной мыши.Стрелка в ( а ) указывает на хвостовой конец позвоночника, где вставляется игла для освобождения спинного мозга. Выпущенный спинной мозг ( b ) показан погруженным в PBS. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Градиент плотности, с добавлением клеток после центрифугирования. Слои изложены и лучше визуализированы в изображении мультфильма. Самый поверхностный слой (0) обычно является обломком ткани спинного мозга. Слой 1 богат олигодендроцитами и астроцитами. Слои 2 и 3 содержат большинство нейронов. Хотя слой 3 содержит нейроны с наивысшей чистотой, некоторые поддерживающие клетки ( то есть астроциты и олигодендроциты) находятся в слое 2. PeЛак на дне в основном содержит микроглиальные клетки. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Световая микроскопия нейронных клеточных культур после 7 дней изоляции. При 10-кратном увеличении ( а ) можно видеть аксональные соединения между различными конгломератами нейронов. При увеличении 40х ( б ) нейроны можно более точно визуализировать с их аксоновскими проекциями. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
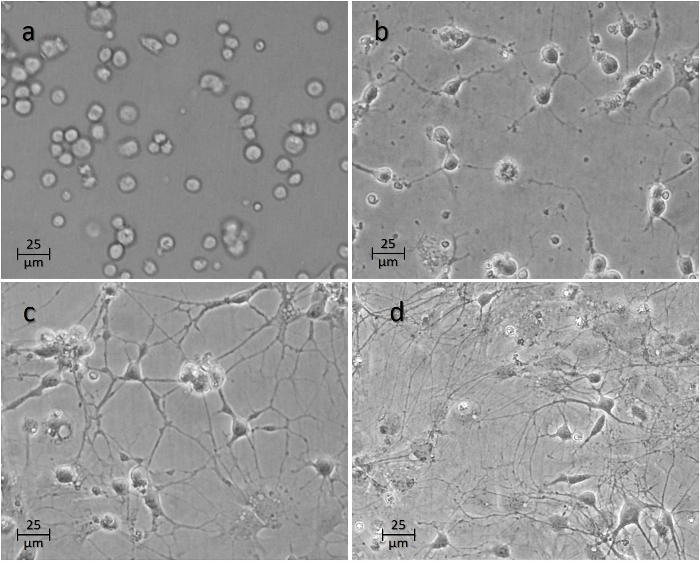
> Рисунок 4: Временной курс нейронов после посева на лунках. Изображение ( а ) показывает клетки 1 ч, ( б ) 24 ч, ( в ) 48 ч и ( г ) через 1 неделю после посева. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Иммунофлуоресцентное пятно нейронов с использованием нейронного цитоскелетного маркера MAP2. Ядерное окрашивание (DAPI) показано синим цветом ( a ) с цитоплазматическим окрашиванием (GFP) в зеленом ( b ) и белком цитоскелета нейрона (MAP2) в красном ( c ). Объединенные изображения ( d ) объединяются, показывая относительное обилие нейронов.Target = "_ blank"> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Иммунофлуоресцентное пятно нейронов с использованием нейронного ядерного маркера NeuN. Ядерное окрашивание (DAPI) показано синим цветом ( a ), с цитоплазматическим окрашиванием (GFP) в зеленом ( b ) и нейронном ядрах (NeuN) в красном ( c ). Объединенные изображения ( d ) объединяются, показывая относительное обилие нейронов. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| СМИ | Место хранения | Ингредиенты | подготовка | ||
| HABG | 4 ° C / 24 часа | 100 мл | - Оттепель B27 в холодильнике 4 ° C O / N - Фильтровать стерилизацию (0,22 мкм) | ||
| Hibernate A | 97,8 мл | ||||
| B27 [2%] | 2 мл | ||||
| GlutaMAX [0,5 мМ] | 0,25 мл | ||||
| Нейробазальная медицина | 4 ° C / 1 неделя | 100 мл | - Оттепель B27 в холодильнике 4 ° C O / N - Фильтровать стерилизацию (0,22 мкм) - Аликвот 50 мл порций в 50 мл пробирки (хранить при 4 ° С) | ||
| Нейробазальный А | 97 мл | ||||
| B27 [2%] | 2 мл | ||||
| GlutaMAX [0,5 мМ] | 0,25 мл | ||||
| Pen / Strep [1%] | 1 мл | ||||
| Пищеварение | День изоляции | 10 мл | - Энергично встряхивать - Дайте ему посидеть в ванне с температурой 37 ° C в течение 30 минут (в идеале приготовлено за 30 минут до использования) - Фильтровать стерилизацию (0,22 мкм) | ||
| HA-Са | 10 мл | ||||
| Папаин | 25 мг | ||||
| GlutaMAX [0,5 мМ] | 0,025 мл | ||||
| Градиент плотности | День изоляции | 1 градиент | |||
| Слой | OptiPrep | НАВг | |||
| (0,13 мл) | (5,29 мл) | ||||
| 1 Нижняя часть | 0,26 мл | 1,24 мл | |||
| 2 | 0,19 мл | 1,31 мл | |||
| 3 | 0,15 мл | 1,35 мл | |||
| 4 Вверх | 0,11 мл | 1,39 мл | |||
Таблица 1: Подготовка медиа и решений, используемых в настоящем Протоколе.
| Покрывающий субстрат | Место хранения | Ингредиенты | подготовка | |
| PDL | - 20 ° C Замораживание-оттепель | Полигидро-гидразид поли-D-лизина | 5 мг | - Аликвоту 4 мл в 15 мл пробирки и немедленно хранить при -20 ° C - 0,5 мл / лунку (24-луночный планшет) |
| Стерильная вода | 50 мл | |||
| Laminin | День покрытия | Ламинин (1 мг / мл) | 80 мкл | - Достаточно для 8 лунок в 24-луночном планшете - 0,35 мл / лунку (24-луночный планшет) |
| Нейробазальная среда | 2,72 мл | |||
Таблица 2: Подготовка покрывающих субстратов, используемых для покрытия скважин, на которых культивируются нейроны.
Обсуждение
Этот метод позволяет обеспечить надежную культуру нейронов спинного мозга. Как только уровень владения техникой будет достигнут, для завершения потребуется приблизительно 3,5 часа. Мы смогли провести изоляцию нейронов от 2 отдельных пометов (всего 16 мышей) примерно через 4 часа. Ключевым шагом в осуществимости является способность эффективно извлекать спинальные шнуры от мышей. Выход позволяет наносить несколько колодцев и на способность тестировать нейроны при различных условиях. Мы смогли обработать нейроны после зрелости и надежно оценить экспрессию белка с использованием Вестерн-блот-анализа. Кроме того, использование стеклянных слайдов внутри лунок для прикреплений нейронов позволяет провести дальнейший анализ окраски нейронов.
Эта процедура выгодна тем, что она не требует эмбриональной ткани и связанной с ней интенсивности труда. Кроме того, нет необходимости использовать взрослые спинальные шнуры для сбора достаточной ткани для адекватногоE нейронов. Это предотвращает фактор возрастной рецептуры поведения в физиологии нейронов, как это видно у взрослых мышей. Однако этот метод не без ограничений. Как упоминалось ранее, возрастные нейроны исключаются с помощью неонатальных мышей, и это может быть ограничение, если возрастное поведение и биология являются сферой исследования. В процедуре есть кривая обучения, которая необходима не только для оптимизации урожайности, но и для обеспечения здоровых изолированных нейронов. Техника извлечения спинного мозга может занять некоторое время, особенно для новорожденных мышей. Мы заметили, что длительное время, связанное с экстракцией спинальных кордов, приводит к нейронам, которые можно культивировать в течение значительно более короткого периода. Это несколько облегчается путем размещения нейронов на льду; Однако время все еще играет ключевую роль.
Существуют основные этапы процедуры, которые помогают обеспечить оптимальный выход нейронов. Если выход нейрона не такой, как eXpected, необходимо оценить несколько этапов. Во-первых, количество спинальных шнуров в идеале должно быть больше 4. Когда используются 3 спинальных шнура или меньше, выход обычно составляет менее 1 миллиона нейронов. Должна быть обеспечена адекватная подготовка пищеварительной среды (шаг 4.5). Оставляя ткань слишком долго в пищеварительной среде, вызывают чрезмерное разрушение клеток, в то время как использование пищеварительной среды, которая не была активирована при 37 ° C, приведет к уменьшению количества изолированных нейронов. Наконец, методика растирания (шаг 4.7) должна выполняться с точностью. Низкие урожаи обычно возникают из-за неадекватного растирания. Хорошим показателем является то, будет ли решение облачным во время растирания - если этого не произойдет, вполне вероятно, что растирание слишком мягкое.
Если выход такой же, как ожидалось, но, по-видимому, нейроны не регенерируют процессы в течение первых 1-2 дней, проблема, как правило, является провалом в надлежащем покрытии либо с недостаточной промывкойИли сушки (этап 2.2). Если ячейки первоначально обрабатывают процессы, а затем становятся апоптотическими до отметки 5-7 дней, может быть несколько проблем. Во-первых, убедитесь, что раствор HABG готов в течение 24 часов после выделения и что добавляется свежая добавка B27, которая была оттаивана в тот же день приготовления HABG. Антиоксиданты в этом дополнении должны быть свежими и не истекли. Затем убедитесь, что пузырьки не введены во время процесса растирания (шаг 4.7). Введение пузырьков воздуха способствует этой проблеме и может быть связано с сушкой нейронов. Кроме того, убедитесь, что культура не перегружена загрязнением, что можно объяснить неудачами в стерильности.
Здесь мы описываем использование 24-луночных планшетов, на которых можно засеять нейроны. Иногда необходимо проводить исследования времени и / или дозировки, например, при использовании фармакологических средств. Этот метод можно модифицировать, а нейроны можно высевать на 48-луночный планшетВместо этого. Так как площадь поверхности скважины в 48-луночном планшете вдвое меньше, чем в 24-луночном планшете, то объемы используемых растворов для покрытия должны быть разрезаны наполовину. Клетки также должны быть покрыты на половину объема ( т.е. 0,5 мл вместо 1,0 мл). Однако их концентрация должна оставаться неизменной ( т.е. 1-5 × 10 5 клеток / мл). Хотя это исследование было проведено с использованием мышей C57BL / 6, этот метод должен быть применим к другим генетически управляемым штаммам.
Ишемия спинного мозга и защита - область растущего интереса 12 , 13 , 14 . Клинически торакоабдоминальная аортальная хирургия может привести к разрушительному параличу, связанному с ишемией спинного мозга и реперфузией, патофизиология которой еще предстоит полностью понять 15 , 16 . Понимание того, как нейроны реагируют наE стресс ишемии возможен с использованием этой модели. Наша группа ранее опубликовала информацию о повреждениях нейронов спинного мозга, связанных с ишемическим оскорблением, через лишение кислородной глюкозы с использованием этой техники 17 . Модель также была расширена за счет включения культуры астроцитов, отделенной от нейронов 18 .
В заключение, этот метод ценен для изучения патофизиологии спинного мозга и микробиологии нейронов. Культура без сыворотки позволяет точно контролировать окружающую среду. Он обеспечивает прямой доступ для применения фармакологических агентов. В сочетании с дополнительными методами, такими как лихорадка кислородной глюкозы, этот метод может быть полезен для расширения нашего понимания патофизиологии детерминантной ишемии спинного мозга.
Раскрытие информации
Авторы не имеют раскрытия.
Благодарности
У авторов нет подтверждений.
Материалы
| Name | Company | Catalog Number | Comments |
| Hibernate A Medium - 500 mL | Thermo-Fisher | A1247501 | https://www.thermofisher.com/order/catalog/product/A1247501 |
| Hibernate A Minus Calcium - 500 mL | Brainbits | HA-Ca | http://www.brainbitsllc.com/hibernate-a-minus-calcium/ |
| Glutamax 100X - 100 mL | Thermo-Fisher | 35050061 | https://www.thermofisher.com/order/catalog/product/35050079 |
| B27 Supplement 50X - 10 mL | Thermo-Fisher | 17504044 | https://www.thermofisher.com/order/catalog/product/17504044 |
| Papain, Lyophilized - 100 mg | Worthington | LS003119 | http://www.worthington-biochem.com/pap/cat.html |
| Neurobasal A Medium - 500 mL | Thermo-Fisher | 10888022 | https://www.thermofisher.com/order/catalog/product/10888022 |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo-Fisher | 15140122 | https://www.thermofisher.com/order/catalog/product/15140122 |
| Poly-D-Lysine (PDL) hydrobromide - 5 mg | Sigma-Aldrich | P6407-5MG | http://www.sigmaaldrich.com/catalog/product/sigma/p6407?lang=en®ion=US |
| Mouse Laminin - 1 mg | Thermo-Fisher | 23017015 | https://www.thermofisher.com/order/catalog/product/23017015 |
| Trypan Blue - 20 mL | Sigma-Aldrich | T8154-20ML | http://www.sigmaaldrich.com/catalog/product/sigma/t8154?lang=en®ion=US |
| OptiPrep Density Gradient Medium - 250 mL | Sigma-Aldrich | D1556-250ML | http://www.sigmaaldrich.com/catalog/product/sigma/d1556?lang=en®ion=US |
| Dichlorodimethylsilane (DMDCS, Sigma Silicoat) | Sigma-Aldrich | 440272-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/440272?lang=en®ion=US |
| Chloroform | Sigma-Aldrich | 288306-1L | http://www.sigmaaldrich.com/catalog/product/sial/288306?lang=en®ion=US |
| Glass Pippette - 9" | Sigma-Aldrich | 13-678-20C | http://www.sigmaaldrich.com/catalog/product/sigma/cls7095d9?lang=en®ion=US |
| Pipette bulb - 5 mL | Sigma-Aldrich | Z186678-3EA | http://www.sigmaaldrich.com/catalog/product/aldrich/z186678?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold10-1 |
| BRAND® Petri dish, glass - 60 x 15 mm | Sigma-Aldrich | BR455717-10EA | http://www.sigmaaldrich.com/catalog/product/aldrich/br455717?lang=en®ion=US |
| Sterile 24-Well Cell Culture Plate | Sigma-Aldrich | M8812-100EA | http://www.sigmaaldrich.com/catalog/product/sigma/m8812?lang=en®ion=US |
| Hausser Hemacytometer (glass counting chamber) | Fischer Scientific | 02-671-6 | https://www.fishersci.com/shop/products/hausser-bright-line-phase-hemacytometer-hemacytometer/026716 |
| Glass Slides - 12 mm sterile cover glass - uncoated | Neuvitro | GG-12-1.5-Pre | http://www.neuvitro.com/german-coverslip-12mm-diameter.htm |
| NeuN Rabbit Monoclonal Antibody - 100 µL | Abcam | ab177487 | After fixing in paraformaldehyde (PFA) and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:200 for 18 h in 4 °C |
| MAP-2 Mouse Monoclonal Antibody - 50 µL | Abcam | ab11267 | After fixing in paraformaldehyde and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:500 for 18 h in 4 °C |
Ссылки
- Qayumi, A. K., et al. Animal model for investigation of spinal cord injury caused by aortic cross-clamping. J Invest Surg. 10 (1-2), 47-52 (1997).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Taira, Y., Marsala, M. Effect of proximal arterial perfusion pressure on function, spinal cord blood flow, and histopathologic changes after increasing intervals of aortic occlusion in the rat. Stroke. 27 (10), 1850-1858 (1996).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Ahlemeyer, B., Baumgart-Vogt, E. Optimized protocols for the simultaneous preparation of primary neuronal cultures of the neocortex, hippocampus and cerebellum from individual newborn (P0. 5) C57Bl/6J mice. J Neurosci Methods. 149 (2), 110-120 (2005).
- Brewer, G. J., Torricelli, J. R. Isolation and culture of adult neurons and neurospheres. Nat Protoc. 2 (6), 1490-1498 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Res. 126 (3), 397-425 (1977).
- Graber, D. J., Harris, B. T. Purification and culture of spinal motor neurons from rat embryos. Cold Spring Harb Protoc. 2013 (4), 319-326 (2013).
- Anderson, K. N., Potter, A. C., Piccenna, L. G., Quah, A. K., Davies, K. E., Cheema, S. S. Isolation and culture of motor neurons from the newborn mouse spinal cord. Brain Res Prot. 12 (3), 132-136 (2004).
- Gingras, M., Gagnon, V., Minotti, S., Durham, H. D., Berthod, F. Optimized protocols for isolation of primary motor neurons, astrocytes and microglia from embryonic mouse spinal cord. J Neurosci Methods. 163 (1), 111-118 (2007).
- Brewer, G. J., et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Su, M., Zhong, W., Ren, S. Dose-dependent protection of reseveratrol against spinal cord ischemic-reperfusion injury in rats. Trop J Pharm Res. 15 (6), 1225-1233 (2016).
- Haapanen, H., et al. Remote ischemic preconditioning protects the spinal cord against ischemic insult: An experimental study in a porcine model. J Thorac Cardiovasc Surg. 151 (3), 777-785 (2016).
- Conrad, M. F., Ye, J. Y., Chung, T. K., Davison, J. K., Cambria, R. P. Spinal cord complications after thoracic aortic surgery: long-term survival and functional status varies with deficit severity. J Vasc Surg. 48 (1), 47-53 (2008).
- Wong, D. R., et al. Delayed spinal cord deficits after thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 83 (4), 1345-1355 (2007).
- Freeman, K. A., et al. Alpha-2 agonist attenuates ischemic injury in spinal cord neurons. J Surg Res. 195 (1), 21-28 (2015).
- Freeman, K. A., et al. Spinal cord protection via alpha-2 agonist-mediated increase in glial cell-line-derived neurotrophic factor. J Thorac Cardiovasc Surg. 149 (2), 578-586 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены