Method Article
נוירונים חוט השדרה בידוד ותרבות מ עכברים ניאונטליים
In This Article
Summary
מחקר זה מציג טכניקה לבידוד של נוירונים מ WT עכברים neonatal. זה דורש דיסקציה זהיר של חוט השדרה מן העכבר הילוד, ואחריו הפרדת הנוירונים של רקמת חוט השדרה דרך מחשוף מכני אנזימטי.
Abstract
אנו מציגים פרוטוקול לבידוד ותרבות של נוירונים של חוט השדרה. הנוירונים מתקבלים C57BL הילוד / 6 עכברים מבודדים על הלידה 1-3 יום. עכבר המלטה, בדרך כלל 4-10 גורים שנולדו מתוך זוג הרבייה אחד, נאסף לניסוי אחד, מיתרי השדרה נאספים בנפרד מכל עכבר לאחר המתת חסד עם isoflurane. עמוד השדרה הוא גזור החוצה ואז חוט השדרה הוא שוחרר מן הטור. חוט השדרה הם לאחר מכן טחון כדי להגדיל את פני השטח של המשלוח עבור פרוטאז אנזימטי המאפשר נוירונים ותאים אחרים להשתחרר מן הרקמה. Trituration משמש לאחר מכן כדי לשחרר את התאים לתוך פתרון. פתרון זה מחולק לאחר מכן ב שיפוע צפיפות להפריד בין תאים שונים בתמיסה, המאפשר נוירונים להיות מבודדים. בערך 1-2.5 x 10 6 נוירונים יכול להיות מבודדים מקבוצה אחת המלטה. הנוירונים הם seeded אז על בארות מצופה דבק FactoRs המאפשרים צמיחה נכונה והתבגרות. הנוירונים לוקחים בערך 7 ימים כדי להגיע לבגרות במדיום הצמיחה והתרבות וניתן להשתמש בהם לאחר מכן לטיפול וניתוח.
Introduction
הבנת הפתולוגיה של חוט השדרה מחייבת שימוש במודלים שונים, הן ברמה המקרוסקופית והן ברמת המיקרוסקופיה. דגמי בעלי חיים גדולים וקטנים 1 , 2 , 3 משמשים בחקירות vivo של מחלת חוט השדרה ופציעה. בעוד שלומדים נושאים אלה in vivo יש את היתרונות שלה, ניתוח של חוט השדרה מוגבל homogenate חוט השדרה כולו או לסעיפים רקמות 4 . זה יוצר כמה עמימות כאשר מנסים לבודד תגובות ספציפיות ומטרות בעמוד השדרה בין נוירונים תושביה גליה הסובבים אותה. הזמינות הגוברת של עכברים מניפולציות גנטית מאפשרת חקירות מפורטות יותר של הביולוגיה ברמות תאית ומולקולרית. לכן, מודל העכבר הילוד משמש כאן, המאפשר ללמוד את המאפיינים הייחודיים והביולוגיה של נוירונים חוט השדרה במבחנה .
"הבידוד והשימור של נוירונים במבחנה אינו פשוט במיוחד.יש שפע של טכניקות לבידוד נוירון מן רקמת קליפת המוח של מכרסמים בוגרים, כי נראה לגרום למספר ניכר של נוירונים מבודדים ( כלומר מיליונים) 5 , 6 , 7. לעומת זאת, התשואה של נוירונים מרקמת חוט השדרה הוא נמוך 8 , 9 , 10 , בין השאר בשל המסה הקטנה של רקמות.יתר על כן, בעכברים, יש מיעוט יחסית של טכניקות לבידוד של הילודים נוירונים של חוט השדרה, ושיטות קיימות מוגבלים על ידי תשואות נוירונים נמוכות יותר ( כלומר מאות) 9 או מטורפות ומשאבים כבדים טכניקות הדורשות בידוד של עכברים עובריים 10 .בפרוטוקול זה, אנחנולהשתמש בטכניקה המאפשרת בידוד עלות משאבים יעיל של מספר ניכר של נוירונים מן החוט השדרה של עכברים בילודים. כפי נפוץ בטכניקות שפורסמו בעבר, אנו משתמשים papain כמו פרוטאז אנזימטי, המאפשר לשחרור של נוירונים מרקמת חוט השדרה 5 , 6 . בנוסף, אנו משתמשים שיפוע צפיפות הפרדת תאים מעודן, אשר בעבר הוכח להיות יעיל 6 , 10 . בעוד המדיום שבו תאים מודגרת יכול להשתנות, מניסיוננו כפי שפורסם בעבר 11 , תוספת עם תוסף בינוני B27 בינוני הוכיחה להיות קריטי עבור אריכות ימים נוירון. נוירונים הם בדרך כלל קיימא עבור עד 10 ימים, המאפשר טיפול להתבצע.
Protocol
הטיפול והטיפול בבעלי חיים בהליך זה בוצעו על פי הנחיות הוועדה לטיפול בבעלי חיים מוסדיים ושימוש באוניברסיטת קולורדו.
1. הכנת פתרונות
- הכן ואחסן את כל הפתרונות בטמפרטורות המתאימות, כפי שמוצג בטבלה 1 .
2. ציפוי בארות ושקופיות
הערה: נוירונים לא לדבוק היטב פלסטיק או משטחי זכוכית.
- יום אחד לפני הבידוד של הנוירונים, מעיל את הבארות של צלחת 24 תרבות סטרילית עם 0.5 מ"ל של פולי-D- ליזין (PDL, טבלה 2 ) ולהשאיר אותו ברדס זרימה למינרית O / N.
הערה: השיטה המועדפת היא להשתמש 24-גם צלחות מעיל רק בארות מרכז, כמו אידוי מן בארות הפריפריה נוטה להיות מואצת יותר ולהוביל לתוצאות עקבי. בנוסף, זכוכית שקופיות ניתן להציב את הבארות לפני לאO ציפוי. הנוירונים יצרפו את השקופיות זכוכית מצופה ניתן להסיר מאוחר יותר עבור הדמיה מיקרוסקופית נוספת . - ביום של בידוד, להסיר את PDL מן הבארות. לשטוף עם מים סטריליים במשך כמה דקות לפני הסרת כל המים הנותרים ומאפשר להתייבש במשך שעה 1 (ראה להלן).
- לאחר ייבוש, מעיל את השקופיות עם laminin ( טבלה 2 ).
הערה: כ 10 μL של laminin (10 מיקרוגרם / μL) מספיק כדי מעיל כל טוב של צלחת סטרילית 24 גם. זה מעורבב עם μL 340 בינוני (נפח כולל: 350 μL) על מנת לכסות את כל טוב. תן זה לשבת על 2 שעות ב RT ברדס תרבות ולאחר מכן לשאוב לפני ציפוי התאים.
3. קצירת חוט השדרה
הערה: כל המכשירים צריכים להיות autoclaved (135 ° C ו 30 psi עבור מחזורי 4 x 7 דקות) עבור סטריליות.
- להרדים 1-3 יום בן C57BL / 6 גורים העכבר בחדר עם isoflurane. לַחֲכוֹת30 s לאחר הפסקת התנועה וקמצוץ את הרגל כדי לאשר חוסר תגובה.
- להפריד את הראש מן הגוף באמצעות מספריים, עם גור במצב נוטה.
- לייצב את הרגליים האחוריות או זנב וזרועות על השולחן ההליך, עם הצד הגב מול המשתמש.
- חותכים את העור באמצעות מספריים איריס מעוקל.
- חותכים את חוט השדרה מן האזור המותני רק מעל הירכיים ולהמשיך לחתוך את שני הצדדים של בית החזה להפריד אותו מהגוף.
הערה: זה דורש דיסקציה זהיר של חוט השדרה מאיברים הקרביים, כדי למנוע נזק מכוון לאיברים אחרים ( איור 1 א ). - לשטוף ברצף במשך 10 שניות ב 3 x 10 ס"מ צלחות פטרי המכיל 5 מ"ל של 0.2 מיקרומטר מסנן מעוקר פוספט שנאגרו מלוחים (PBS) כדי להסיר רקמת עודף.
- הכנס מחט 22 G מזרק מלא 5 מ"ל של מסנן מעוקר PBS אל קצה הזנב של עמוד השדרה ואת סומק cranially, המאפשר את כבל tO היציאה לתוך צלחת פטרי הרביעי ( איור 1b ).
- איסוף חוט השדרה בצינור 15 מ"ל עם 5 מ"ל של HABG ( טבלה 1 ) על הקרח. השתמש בזהירות כדי למנוע מוחץ את חוט השדרה.
- חזור על שלבים 3.1-3.8 עבור כל גור במיטה.
הערה: באופן אידיאלי, תהליך זה צריך לקחת פחות מ -30 דקות לכל חוט השדרה כדי להבטיח בידוד נוירון בריא.
4. בידוד נוירונים
הערה: השלב הבא צריך להתבצע מכסה המנוע זרימה למינרית. היכרות עם טכניקה סטרילית בסיסית צפויה.
- רקמות
- קח את הצינור המכיל את חוט השדרה ולנער קלות להשעות את הרקמה.
- יוצקים רקמות מן הצינור לתוך צלחת פטרי 60 מ"מ זכוכית וקוביות עם להב גילוח כדי ליצור חתיכות בסדר ~ 0.5 מ"מ בגודל.
- מעבירים את הרקמה עם פיפטה רחב נשא לתוך צינור 15 מ"ל המכיל 5 מ"ל של HABG.
- מניחים אותו ב30 ° C אמבטיה למשך 30 דקות כדי לאפשר לתאים לאזן בטמפרטורה זו. שמור את התאים על שייקר מספיק רק כדי לאפשר להם להיות מושעה בנוזל.
הערה: צעד זה נעשה כדי למנוע מזעזע את התאים עם המעבר מן הקרח המדיום העיכול. שמירה על התאים ב 30 מעלות צלזיוס מסייעת להפחית את המוות התא הקשורים מטבוליזם מוגברת אחרת ב 37 מעלות צלזיוס.
- הכן את המדיום העיכול ( טבלה 1 ).
- הכן את שיפוע צפיפות (טבלה 1).
- הכן כל אחת 4 שכבות 4 צינורות נפרדים 15 מ"ל, כפי שתואר בטבלה 1 .
- הוסף 1 מ"ל מכל שכבה לתוך צינור 15 מ"ל חדש. התחל עם שכבה 1 בתחתית להוסיף ברצף עד להגיע השכבה 4 בראש. הימנע להפריע את השכבות תוך הוספת.
- לשטוף את צלחות מצופה PDL משלב 2.2. לשטוף עם מים סטריליים במשך כמה דקות לפני הסרת כל המים הנותריםהמאפשר להם להתייבש במשך 1 שעות.
- מעבירים את הרקמה המדיום עיכול.
- הסר את הצינור המכיל רקמות מן האמבט מים שייקר ב 30 מעלות צלזיוס ולאפשר לו להתיישב במשך כמה דקות.
- הסר את צינור העיכול בינוני מן האמבט מים 37 מעלות צלזיוס לשאוב אותו לתוך מזרק לנעול leur.
- לשאוב את HABG עודף מן הצינור המכיל רקמות.
- השתמש leur- לנעול 0.2 מסנן מיקרומטר על המזרק להוסיף בינוני עיכול לצינור המכיל רקמה.
- מניחים את הצינור באמבט מים 30 מעלות צלזיוס למשך 30 דקות. שמור על התאים רועד מספיק רק כדי לאפשר להם להיות מושעה בנוזל.
הערה: חשוב לא לשמור את התאים במדיום העיכול זמן רב מדי או לתת לטמפרטורה להגיע גבוה מדי, אשר עלול להוביל לעיכול מופרז וכתוצאה מכך הרקמה הופכת תלויה בתערובת ג'לטין.
- במהלך תקופה זו, מעיל laminin כמו בשלב 2.3.
- לבצע טחינה ( כלומר, הפרדת התאים מן הרקמה).
- הסר את הצינור מן רועד 30 מעלות צלזיוס אמבט מים ולאפשר לו להסתפק דקות ספורות.
- לשאוב עודף מערכת העיכול.
- להשעות את הרקמה ב 2 מ"ל של HABG.
- באמצעות פיפטה צרה נשא, triturate 10x במשך 45 שניות.
הערה: זה כנראה הצעד החשוב ביותר אחד יכול להפחית באופן משמעותי את התשואה אם לא נעשה כראוי.- לשאוב את הרקמה לתוך פיפטה ומיד לרוקן את התוכן בחזרה.
- הימנע החדרת אוויר, שכן זה יהיה להפחית באופן משמעותי את התשואה קיימא.
הערה: פיפטה האידיאלי הוא פיפטה זכוכית 9. קצה פיפטה צריך להיות מלוטש כדי להחליק את המשטחים הגסים.זה צריך להיות siliconized על ידי מיקום ב 1:20 פתרון של dichlorodimethylsilane (DMDCS) ב chloroform ו שמאל O / N. לאחר מכן, יש להסיר את פיפטה מותר לאוויר יבשהוא יהיה autoclaved עבור עיקור.
זהירות: DMDCS ו chloroform הם דליקים מאוד, siliconizing צריך להתבצע במנדף קטר.
- לשאוב את מ"ל העליון של supernatant ומכניסים אותו לתוך צינור חדש 15 מ"ל שכותרתו "אוסף".
- חזור על שלבים 4.7.3-4.7.5 שתי פעמים נוספות (צינור איסוף התא צריך 6 מ"ל בסוף).
- לאט להעביר את התוכן צינור אוסף לתוך צינור שיפוע מוכן בשלב 4.2, הימנעות הפרעה של שיפוע.
- בשלב זה, להסיר את המדיום neurobasal מוכן מראש ( טבלה 1 ) מהמקרר ולאפשר לו להתחמם ב 37 ° C אמבטיה.
- לטהר את הנוירונים.
- צנטריפוגה צינור שפופרת במשך 15 דקות ב 800 xg ו 22 ° C.
- אסוף את השכבה הרצויה (ים) עם פיפטה ( איור 2 ) ו במקום צינור חדש 15 מ"ל. עבור נוירו הגבוהה ביותר טוהרN בידוד ( כלומר > 90%), לאסוף שכבה 3. לקבלת תשואה יותר עם פחות טוהר ( כלומר > 70-80%), לאסוף שכבות 2 & 3.
- לדלל את שיפוע צפיפות על ידי הוספת 5 מ"ל של HABG לשכבות שנאספו זה עתה.
- צנטריפוגה ב XG 200 דקות 2 ב 22 ° C.
- מחק supernatant, מחדש להשעות 5 מ"ל של HABG, וכן קפיצי גלולה להשעות את התאים.
- צנטריפוגה ב 2 דקות x 200 ב 22 ° C.
- מחק supernatant, resuspend ב 3 מ"ל של המדיום neurobasal, ואת קפיצי גלולה resuspend התאים.
- ספירת התאים.
- קח 10 μL של הפתרון, עכשיו עם תאים במדיום neurobasal, ומערבבים עם 10 μL של כחול Trypan.
- מקום 10 μL של תערובת זו בספירת זכוכית ספירה.
- באמצעות תא ספירת זכוכית רגילה, לספור את מספר התאים בכל אחד מארבע 4 x 4 הרביעים. הוסף את כל התאים נספר (n), רברובד של 2 (גורם דילול), לחלק 4 (מספר הרביעים נספר), להכפיל את ידי 3 (נפח המדיום neurobasal), להכפיל ידי 10 4 כדי להשיג את ריכוז התאים בתאים / מ"ל.

- זרע את התאים על לוחות תרבות
- לדלל את ההשעיה התא 300,000 תאים 1 מ"ל של המדיום neurobasal.
הערה: בהתבסס על ריכוז של תאים שהתקבלו בשלבים לעיל, בינוני נוירובאס נוסף נוסף כדי להשיג ריכוז סופי של 3 * 10 5 תאים / מ"ל. המשוואה היא C 1 V 1 = C 2 V 2 , כאשר C 1 הוא הריכוז הראשוני של תאים המתקבלים מן הקציר; V 1 הוא 3 מ"ל; ו C 2 הוא 3 * 10 5 תאים / מ"ל, כפי שפורט לעיל. המשוואה נפתרת עבור V 2 . הוסף את נפח המדיום neurobasal צורך להפוך את הנפח הכולל של תאים בפתרון שווהאשר. - לנער בעדינות כדי להפיץ את התאים בפתרון ולהוסיף 1 מ"ל היטב כל מצופים 24-גם צלחות.
- לדלל את ההשעיה התא 300,000 תאים 1 מ"ל של המדיום neurobasal.
תוצאות
באמצעות טכניקה זו, יחיד המלטה (4-10 גורים) מאפשר בידוד של 1-2.5 10 6 נוירונים מתאים זריעה על צלחות תרבות. בדרך כלל, בארות 4-8 הם seeded בריכוז שהוזכר לעיל ( כלומר 300,000 תאים / מ"ל). איור 3 מראה את המראה של נוירונים בריכוז זה לאחר שבוע בתרבות ב נמוך ( א ) גבוה ( ב ) מיקרוסקופ אור הגדלה. עם זאת, יש לנו גם מסוגל לתאי התרבות בריכוזים גבוהים כמו 500,000 תאים / טוב נמוך כמו 100,000 תאים / טוב. שימוש בריכוז גבוה דורש תשומת לב בינונית וזהירה יותר לתנאים סביבתיים, כמו חומרים מזינים ניתן מדולל במהירות, המוביל לסביבה חומצית רעילה עבור התאים. עם ריכוזים נמוכים יותר, התאים נוטים לא להגיע בגרות מלאה, וכן יתר של תאים תומכים ( כלומר oligodendrocytes, מיילCroglia, ו astrocytes) הוא ציין.
התאים בדרך כלל להתחיל היצמדות אל פני השטח בתוך השעות הראשונות של שעות ( איור 4 א ). האקסונים יתחילו לנבוט בתוך 24-48 h הראשון ( איור 4 ב -4 ג ). קשרים בין נוירונים שונים בתרבות בדרך כלל להגיע לבגרות ב 7 ימים ( איור 4 ד ), שבו ניסויים נקודה מתבצעים בדרך כלל על הנוירונים.
נוירונים הם ניתנים לזיהוי תחת מיקרוסקופ אור, כמו שיש להם תחזיות axonal שונים. הבידוד שלנו באמצעות שכבה 3 ( איור 2 ) תשואות ~ 80-90% נוירונים בתרבות. זה אושר באמצעות מכתים immunofluorescent של סמנים ספציפיים נוירון. בתרשים 5c , חלבון cytoskeletal נוירון Microtubule-Associated Protein 2 (MAP2) הוא sמוכתמים, מראה קווי המתאר ואת התחזיות אקסונל של הנוירונים לאחר שבוע בתרבות. באופן דומה, באיור 6 ג , נוירון ספציפי סמן גרעיני NeuN מוכתם, מראה גרעינים עצביים. אלה סמנים נוירונים משולבים עם גרעין (DAPI, איור 5 א , 6 א ) ו cytoplasm (GFP, איור 5 ב, 6 ב ) הדמיה, ואת התמונות שהתקבלו הם התמזגו ( איור 5 ד, 6 ד ), המפרט את השפע היחסי של נוירונים לתאים אחרים תַרְבּוּת. בעת שימוש בשכבות 2 ו -3, התשואה של נוירונים הוא מעט גבוה יותר; עם זאת, יש נוטים להיות נוירונים פחות בפתרון הטהור (~ 70%).

איור 1: עמוד השדרה ניתח חוט השדרה פורסם מתוך עכבר 3 הילוד עכבר. החץ ב ( א ) נקודות לקראת סוף הזנב של עמוד השדרה, שבו מחט מוכנס כדי לשחרר את חוט השדרה. חוט שדרה שוחרר ( ב ) מוצג שקוע PBS. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 2: צפיפות צבע, עם תאים התווסף לאחר צנטריפוגה. השכבות מתוארות ומופיעות טוב יותר על תיאור הקריקטורה. השכבה השטחית ביותר (0) היא בדרך כלל פסולת מן רקמת חוט השדרה. שכבה 1 עשיר oligodendrocytes ו astrocytes. שכבות 2 ו -3 מכילים את רוב הנוירונים. בעוד שכבה 3 מכיל נוירונים עם טוהר הגבוהה ביותר, כמה תאים תומכים ( כלומר, astrocytes ו oligodendrocytes) נמצאים בשכבה 2. peLlet בתחתית בעיקר מכיל תאים microglial. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 3: מיקרוסקופיה אור של תרבויות תא עצבי לאחר 7 ימים של בידוד. ב 10x הגדלה ( א ), קשרים axonal בין קונגלומרטים שונים של נוירונים ניתן לראות. בהגדלה 40X ( b ), הנוירונים יכולים להיות דמיינו יותר מקרוב עם התחזיות אקסונל שלהם. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
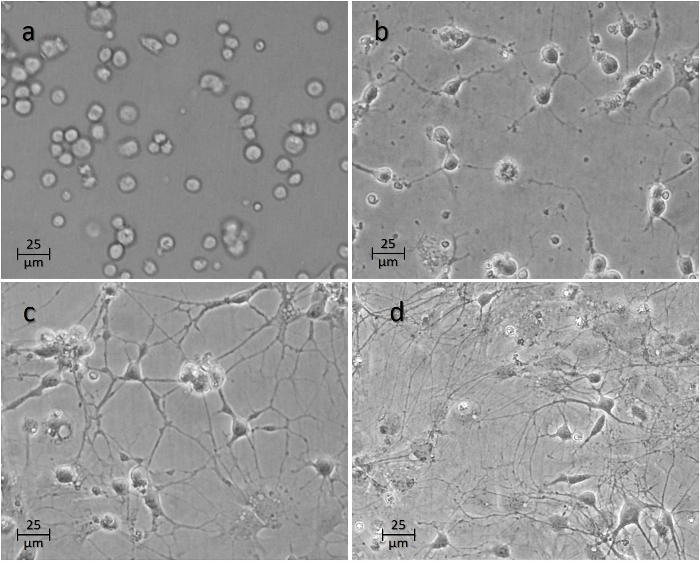
> איור 4: זמן הקורס של הנוירונים לאחר זריעת על וולס. תמונה ( א ) מראה את התאים 1 שעות, ( ב ) 24 שעות, ( ג ) 48 שעות, ו ( ד ) שבוע לאחר זריעה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 5: כתם Immunofluorescent של נוירונים באמצעות סמן Cytoskeletal עצביים MAP2. מכתים גרעיני (DAPI) מוצג בכחול ( א ), עם מכתים cytoplasmic (GFP) ירוק ( ב ) ו נוירון cytoskeletal חלבון (MAP2) באדום ( ג ). התמונות הממוזגות ( ד ) משולבות, מראה את השפע היחסי של נוירונים.יעד = "_ ריק"> אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.

איור 6: כתם Immunofluorescent של נוירונים באמצעות סמן גרעיני עצבי NeuN. מכתים גרעיני (DAPI) מוצג בכחול ( א ), עם מכתים cytoplasmic (GFP) ב ( ב ) גרעינים נוירונים (NeuN) באדום ( ג ). התמונות הממוזגות ( ד ) משולבות, מראה את השפע היחסי של נוירונים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
| כְּלֵי תִקְשׁוֹרֶת | אִחסוּן | רכיבים | הכנה | ||
| HABG | 4 ° C / 24h | 100 מ"ל | - הפשרת B27 ב 4 ° C מקרר O / N - מסנן לעקר (0.22 מיקרומטר) | ||
| מצב שינה א | 97.8 מ"ל | ||||
| B27 [2%] | 2 מ"ל | ||||
| GlutaMAX [0.5 מ"מ] | 0.25 מ"ל | ||||
| מדיה Neurobasal | 4 ° C / 1 בשבוע | 100 מ"ל | - הפשרת B27 ב 4 ° C מקרר O / N - מסנן לעקר (0.22 מיקרומטר) - Aliquot 50 מנות מ"ל לתוך צינורות 50 מ"ל (חנות ב 4 ° C) | ||
| Neurobasal A | 97 מ"ל | ||||
| B27 [2%] | 2 מ"ל | ||||
| GlutaMAX [0.5 מ"מ] | 0.25 מ"ל | ||||
| עט / דלקת [1%] | 1 מ"ל | ||||
| עיכול מדיה | יום של בידוד | 10 מ"ל | - לנער במרץ - תן לזה לשבת 37 מעלות צלזיוס אמבטיה למשך 30 דקות (מוכן באופן אידיאלי 30 דקות לפני השימוש) - מסנן לעקר (0.22 מיקרומטר) | ||
| HA-Ca | 10 מ"ל | ||||
| פאפאן | 25 מ"ג | ||||
| GlutaMAX [0.5 מ"מ] | 0.025 מ"ל | ||||
| צפיפות הדרגתית | יום של בידוד | 1 שיפוע | |||
| שִׁכבָה | OptiPrep | HABז | |||
| (0.13 מ"ל) | (5.29 מ"ל) | ||||
| 1 תחתית | 0.26 מ"ל | 1.24 מ"ל | |||
| 2 | 0.19 מ"ל | 1.31 מ"ל | |||
| 3 | 0.15 מ"ל | 1.35 מ"ל | |||
| 4 למעלה | 0.11 מ"ל | 1.39 מ"ל | |||
טבלה 1: הכנת המדיה והפתרונות המשמשים בפרוטוקול זה.
| ציפוי מצע | אִחסוּן | רכיבים | הכנה | |
| PDL | - 20 ° C להקפיא להפשיר פעם אחת | פולי-ליזין הידרוברומיד | 5 מ"ג | - Aliquot 4 מ"ל לתוך צינורות 15 מ"ל ולאחסן מיד ב -20 מעלות צלזיוס - 0.5 מ"ל / טוב (צלחת 24 גם) |
| מים סטריליים | 50 מ"ל | |||
| Laminin | יום ציפוי | Laminin (1 מ"ג / מ"ל) | 80 μL | - מספיק עבור 8 בארות בצלחת 24 גם - 0.35 מ"ל / טוב (צלחת 24 גם) |
| בינוני נוירובי | 2.72 מ"ל | |||
טבלה 2: הכנת מצעים ציפוי המשמש את המעיל וולס על אילו נוירונים הם מתורבתים.
Discussion
טכניקה זו מאפשרת תרבות אמין של נוירונים חוט השדרה. לאחר מיומנות הטכניקה מושגת, זה לוקח בערך 3.5 שעות כדי להשלים. הצלחנו לבצע את הבידוד של נוירונים מ 2 litters נפרדים (16 סה"כ עכברים) כ 4 שעות. צעד המפתח היתכנות היא היכולת לחלץ את חוט השדרה מן העכברים. התשואה מאפשרת ציפוי כמה בארות ועל היכולת לבחון את הנוירונים בתנאים שונים. הצלחנו לטפל נוירונים לאחר בגרות להעריך באופן אמין ביטוי חלבון באמצעות ניתוח כתם המערבי. יתר על כן, באמצעות שקופיות זכוכית בתוך הבארות עבור קבצים מצורפים נוירון מאפשר ניתוח מכתים נוספת של הנוירונים.
הליך זה הוא יתרון בכך שהוא אינו דורש רקמות עובריים ואת עוצמת העבודה הקשורים. יתר על כן, אין צורך להשתמש במיתרים בעמוד השדרה בוגרים כדי לאסוף רקמות מספיק עבור הליוויבידוד נוירון. זה מונע את הגורם של גיל הרכבה התנהגות פיזיולוגיה נוירון, כפי שניתן לראות עם עכברים בוגרים. עם זאת, טכניקה זו אינה ללא מגבלות. כפי שצוין קודם לכן, נוירונים בגילאי אינם נכללים באמצעות עכברים בילודים, וזה יכול להיות מגבלה אם התנהגות הקשורות לגיל וביולוגיה היא שטח החקירה. יש עקומת למידה לנוהל, אשר יש צורך לא רק כדי לייעל את התשואה, אבל כדי להבטיח כי הנוירונים מבודדים בריאים. טכניקת החילוץ של חוט השדרה יכולה להימשך זמן מה, במיוחד עם עכברים שנולדו לאחרונה. שמנו לב כי זמן ממושך הקשורים החילוץ של מיתרי השדרה מוביל נוירונים שיכולים להיות מתורבת לתקופה קצרה משמעותית. זה קצת הקלה על ידי המיקום של הנוירונים על הקרח; עם זאת, הזמן עדיין משחק תפקיד מפתח.
ישנם שלבים עיקריים בהליך המסייעים להבטיח את התשואה האופטימלית של נוירונים. אם התשואה נוירון אינו כמו הXpected, כמה צעדים יש להעריך. ראשית, מספר מיתרי השדרה צריך באופן אידיאלי להיות יותר מ 4. כאשר 3 מיתרי חוט השדרה או פחות משמשים, התשואה היא בדרך כלל פחות מ 1 מיליון נוירונים. הכנה נאותה של המדיום העיכול חייב להיות מובטחת (שלב 4.5). השארת רקמת זמן רב מדי במדיום העיכול יגרום התמוטטות מופרזת של תאים, תוך שימוש במדיום עיכול כי לא הופעל ב 37 ° C תגרום פחות נוירונים מבודדים. לבסוף, הטכניקה טחינה (שלב 4.7) חייב להתבצע בדייקנות. תשואות נמוכות בדרך כלל נובעות מטחינה לא מספקת. מחוון טוב הוא לראות אם הפתרון הופך מעונן במהלך הטחינה - אם זה לא יקרה, סביר להניח כי טחינה דקה עדינה מדי.
אם התשואה היא כצפוי אבל הנוירונים לא מופיעים מחדש תהליכים בתוך 1-2 ימים הראשונים, הבעיה היא בדרך כלל כישלון בציפוי הנכון, עם או כביסה לא מספקתאו ייבוש (שלב 2.2). אם תאים בתהליכים הפרויקט הראשון אבל לאחר מכן להפוך אפופטוטיים לפני סימן 5-7 יום, יכול להיות מספר בעיות. ראשית, להבטיח כי הפתרון HABG מוכן בתוך 24 שעות של בידוד וכי B27 תוספת טריים כי כבר מופשר באותו יום של הכנת HABG משמש. נוגדי החמצון בתוסף זה צריך להיות טרי ולא פג. לאחר מכן, ודא כי לא בועות מוצגים במהלך תהליך טחינה דקה (שלב 4.7). המבוא של בועות אוויר תורם לנושא זה עשוי להיות קשור לייבוש של הנוירונים. כמו כן, להבטיח כי התרבות אינה מוצפת זיהום, אשר ניתן לייחס לכשלים סטריליות.
כאן, אנו מתארים את השימוש של 24 גם צלחות שעליו זרע את הנוירונים. לפעמים, יש צורך לבצע זמן ו / או ניסויים במינון, כגון בעת שימוש סוכני תרופתי. הטכניקה יכולה להיות שונה ואת הנוירונים ניתן seeded על 48-גם plבמקום זאת. מאז פני השטח של באר בצלחת 48 גם חצי זה של צלחת 24 גם, הכרכים של פתרונות ציפוי בשימוש צריך להיות לחתוך במחצית. התאים צריכים גם להיות מצופה במחצית נפח ( כלומר 0.5 מ"ל במקום 1.0 מ"ל). עם זאת, הריכוז שלהם צריך להישאר זהה ( כלומר 1-5 x 10 5 תאים / מ"ל). בעוד מחקר זה בוצע באמצעות C57BL / 6 עכברים, הטכניקה צריכה להיות ישימה על פני זנים אחרים מניפולציה גנטית.
איסכמיה בחוט השדרה והגנה היא שטח של עניין הולך וגדל 12 , 13 , 14 . מבחינה קלינית, ניתוח אאורטי thoracoabdominal יכול לגרום לשיתוק הרסני הקשור איסכמיה חוט השדרה reperfusion, הפתופיזיולוגיה של אשר נשאר להיות מובן לחלוטין 15 , 16 . הבנת איך נוירונים להגיב לE הלחץ של איסכמיה הוא ריאלי באמצעות מודל זה. הקבוצה שלנו פרסמה בעבר על פגיעה בעמוד השדרה של חוט השדרה הקשורה לעלבון איסכמי באמצעות מחסור בגלוקוז בחמצן באמצעות טכניקה זו 17 . המודל יש גם המורחבת לכלול את התרבות של astrocytes, נפרד הנוירונים 18 .
לסיכום, טכניקה זו היא בעלת ערך לחקר פתופיזיולוגיה של חוט השדרה ומיקרוביולוגיה נוירונים. התרבות נטולת הסרום מאפשרת שליטה סביבתית מדויקת. זה מאפשר גישה ישירה עבור היישום של סוכני תרופתי. בשילוב עם טכניקות נוספות, כגון מניעת גלוקוז חמצן, טכניקה זו יכולה להיות שימושית כדי להרחיב את ההבנה שלנו של פתופיזיולוגיה של איסכמיה חוט השדרה דטרמינלית.
Disclosures
למחברים אין גילויים.
Acknowledgements
למחברים אין תודות.
Materials
| Name | Company | Catalog Number | Comments |
| Hibernate A Medium - 500 mL | Thermo-Fisher | A1247501 | https://www.thermofisher.com/order/catalog/product/A1247501 |
| Hibernate A Minus Calcium - 500 mL | Brainbits | HA-Ca | http://www.brainbitsllc.com/hibernate-a-minus-calcium/ |
| Glutamax 100X - 100 mL | Thermo-Fisher | 35050061 | https://www.thermofisher.com/order/catalog/product/35050079 |
| B27 Supplement 50X - 10 mL | Thermo-Fisher | 17504044 | https://www.thermofisher.com/order/catalog/product/17504044 |
| Papain, Lyophilized - 100 mg | Worthington | LS003119 | http://www.worthington-biochem.com/pap/cat.html |
| Neurobasal A Medium - 500 mL | Thermo-Fisher | 10888022 | https://www.thermofisher.com/order/catalog/product/10888022 |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo-Fisher | 15140122 | https://www.thermofisher.com/order/catalog/product/15140122 |
| Poly-D-Lysine (PDL) hydrobromide - 5 mg | Sigma-Aldrich | P6407-5MG | http://www.sigmaaldrich.com/catalog/product/sigma/p6407?lang=en®ion=US |
| Mouse Laminin - 1 mg | Thermo-Fisher | 23017015 | https://www.thermofisher.com/order/catalog/product/23017015 |
| Trypan Blue - 20 mL | Sigma-Aldrich | T8154-20ML | http://www.sigmaaldrich.com/catalog/product/sigma/t8154?lang=en®ion=US |
| OptiPrep Density Gradient Medium - 250 mL | Sigma-Aldrich | D1556-250ML | http://www.sigmaaldrich.com/catalog/product/sigma/d1556?lang=en®ion=US |
| Dichlorodimethylsilane (DMDCS, Sigma Silicoat) | Sigma-Aldrich | 440272-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/440272?lang=en®ion=US |
| Chloroform | Sigma-Aldrich | 288306-1L | http://www.sigmaaldrich.com/catalog/product/sial/288306?lang=en®ion=US |
| Glass Pippette - 9" | Sigma-Aldrich | 13-678-20C | http://www.sigmaaldrich.com/catalog/product/sigma/cls7095d9?lang=en®ion=US |
| Pipette bulb - 5 mL | Sigma-Aldrich | Z186678-3EA | http://www.sigmaaldrich.com/catalog/product/aldrich/z186678?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold10-1 |
| BRAND® Petri dish, glass - 60 x 15 mm | Sigma-Aldrich | BR455717-10EA | http://www.sigmaaldrich.com/catalog/product/aldrich/br455717?lang=en®ion=US |
| Sterile 24-Well Cell Culture Plate | Sigma-Aldrich | M8812-100EA | http://www.sigmaaldrich.com/catalog/product/sigma/m8812?lang=en®ion=US |
| Hausser Hemacytometer (glass counting chamber) | Fischer Scientific | 02-671-6 | https://www.fishersci.com/shop/products/hausser-bright-line-phase-hemacytometer-hemacytometer/026716 |
| Glass Slides - 12 mm sterile cover glass - uncoated | Neuvitro | GG-12-1.5-Pre | http://www.neuvitro.com/german-coverslip-12mm-diameter.htm |
| NeuN Rabbit Monoclonal Antibody - 100 µL | Abcam | ab177487 | After fixing in paraformaldehyde (PFA) and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:200 for 18 h in 4 °C |
| MAP-2 Mouse Monoclonal Antibody - 50 µL | Abcam | ab11267 | After fixing in paraformaldehyde and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:500 for 18 h in 4 °C |
References
- Qayumi, A. K., et al. Animal model for investigation of spinal cord injury caused by aortic cross-clamping. J Invest Surg. 10 (1-2), 47-52 (1997).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Taira, Y., Marsala, M. Effect of proximal arterial perfusion pressure on function, spinal cord blood flow, and histopathologic changes after increasing intervals of aortic occlusion in the rat. Stroke. 27 (10), 1850-1858 (1996).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Ahlemeyer, B., Baumgart-Vogt, E. Optimized protocols for the simultaneous preparation of primary neuronal cultures of the neocortex, hippocampus and cerebellum from individual newborn (P0. 5) C57Bl/6J mice. J Neurosci Methods. 149 (2), 110-120 (2005).
- Brewer, G. J., Torricelli, J. R. Isolation and culture of adult neurons and neurospheres. Nat Protoc. 2 (6), 1490-1498 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Res. 126 (3), 397-425 (1977).
- Graber, D. J., Harris, B. T. Purification and culture of spinal motor neurons from rat embryos. Cold Spring Harb Protoc. 2013 (4), 319-326 (2013).
- Anderson, K. N., Potter, A. C., Piccenna, L. G., Quah, A. K., Davies, K. E., Cheema, S. S. Isolation and culture of motor neurons from the newborn mouse spinal cord. Brain Res Prot. 12 (3), 132-136 (2004).
- Gingras, M., Gagnon, V., Minotti, S., Durham, H. D., Berthod, F. Optimized protocols for isolation of primary motor neurons, astrocytes and microglia from embryonic mouse spinal cord. J Neurosci Methods. 163 (1), 111-118 (2007).
- Brewer, G. J., et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Su, M., Zhong, W., Ren, S. Dose-dependent protection of reseveratrol against spinal cord ischemic-reperfusion injury in rats. Trop J Pharm Res. 15 (6), 1225-1233 (2016).
- Haapanen, H., et al. Remote ischemic preconditioning protects the spinal cord against ischemic insult: An experimental study in a porcine model. J Thorac Cardiovasc Surg. 151 (3), 777-785 (2016).
- Conrad, M. F., Ye, J. Y., Chung, T. K., Davison, J. K., Cambria, R. P. Spinal cord complications after thoracic aortic surgery: long-term survival and functional status varies with deficit severity. J Vasc Surg. 48 (1), 47-53 (2008).
- Wong, D. R., et al. Delayed spinal cord deficits after thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 83 (4), 1345-1355 (2007).
- Freeman, K. A., et al. Alpha-2 agonist attenuates ischemic injury in spinal cord neurons. J Surg Res. 195 (1), 21-28 (2015).
- Freeman, K. A., et al. Spinal cord protection via alpha-2 agonist-mediated increase in glial cell-line-derived neurotrophic factor. J Thorac Cardiovasc Surg. 149 (2), 578-586 (2015).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved