Method Article
脊髓神经元从新生小鼠中分离和培养
摘要
这项研究提出了一种从WT新生小鼠中分离神经元的技术。它需要从新生小鼠中仔细地解剖脊髓,然后通过机械和酶切割将脊髓组织中的神经元分离出来。
摘要
我们提出了脊髓神经元分离和培养的方案。神经元从新生儿C57BL / 6小鼠获得,并在出生后第1-3天分离。一只小鼠垫,通常从一个繁殖对出生的4-10只小狗被聚集一个实验,并且在用异氟烷治疗安乐死后,从每只小鼠单独收集脊髓。将脊柱解剖出来,然后将脊髓从柱上释放出来。然后将脊髓切碎以增加允许神经元和其他细胞从组织中释放的酶蛋白酶的递送的表面积。然后使用研磨将细胞释放到溶液中。随后将该溶液以密度梯度分级,以分离溶液中的各种细胞,允许分离神经元。从一个垃圾组可以分离出约1-2.5×10 6个神经元。然后将神经元接种到涂有粘合剂的孔上rs允许适当的成长和成熟。神经元在生长和培养基中需要约7天达到成熟度,此后可用于治疗和分析。
引言
了解脊髓病理学需要在宏观和微观层面上使用各种模型。大型和小型动物模型1,2,3用于脊髓疾病和损伤的体内研究。 在体内研究这些问题的优点是脊髓分析局限于全脊髓匀浆或组织切片4 。当在其驻留神经元和周围神经胶质中分离脊髓中的特定反应和目标时,这产生了一些歧义。遗传操纵的小鼠越来越多的可用性允许对细胞和分子水平的生物学进行更详细的研究。因此,这里使用新生儿小鼠模型,允许在体外研究脊髓神经元的独特性质和生物学。
在体外分离和维持神经元并不是特别简单,成年啮齿动物的皮层组织的神经元分离技术相对丰富,似乎导致大量的孤立神经元( 即数百万) 5 ,相反,由于组织质量较小,脊髓组织中神经元的产量较低8,9,10 ,另外在小鼠中,新生儿隔离技术相对较少脊髓神经元和现有的方法受到较低的神经元产量( 即数百个)的限制9或需要分离胚胎小鼠的费力和资源性重的技术10 。在这个协议中,我们使用一种技术,允许从新生小鼠脊髓的成本和资源有效的隔离大量的神经元。如以前发表的技术中常见的,我们使用木瓜蛋白酶作为酶蛋白酶,允许从脊髓组织释放神经元5,6 。此外,我们使用密度梯度进行精细细胞分离,其先前已被证明是有效的6,10 。虽然培养细胞的培养基可以根据我们的经验和以前发表的11来改变 ,但补充新鲜的B27培养基补充剂已被证明对神经元寿命至关重要。神经元通常可行达10天,允许进行治疗。
研究方案
根据科罗拉多大学机构动物护理和使用委员会的指导方针,对该手术中的动物进行护理和治疗。
准备解决方案
- 在适当的温度下准备并储存所有溶液,如表1所示。
2.涂层孔和滑块
注意:神经元不能很好地粘附在塑料或玻璃表面上。
- 在分离神经元前一天,用无菌的24孔培养板的孔用0.5mL聚-D-赖氨酸(PDL; 表2 )包被,并将其留在层流罩O / N中。
注意:优选的方法是使用24孔板并仅涂覆中心孔,因为来自外围孔的蒸发趋于更加加速并导致不一致的结果。此外,在t之前,玻璃载玻片可以放置在孔内o涂层。神经元将附着到涂覆的玻璃片上,并可以稍后去除以进行进一步的显微成像。 - 在隔离当天,从井中取出PDL。用无菌水清洗几分钟,然后取出任何剩余的水,并使其干燥1小时(见下文)。
- 干燥后,用层粘连蛋白涂覆载玻片( 表2 )。
注意:约10μL层粘连蛋白(10μg/μL)足以涂覆无菌24孔板的每个孔。将其与340μL培养基(总体积:350μL)混合以覆盖整个孔。让它在室温下在培养罩中静置2小时,然后在包被细胞之前吸出。
收获脊髓
注意:所有仪器均应进行高压灭菌(135°C和30 psi,4 x 7 min循环),以进行无菌处理。
- 将1-3天龄的C57BL / 6小鼠小鼠安乐死在带有异氟烷的室内。等待30秒后停止运动,捏腿,确认缺乏反应。
- 使用剪刀将头部与身体分开,小狗处于俯卧位。
- 稳定后腿或手臂在手术台上,背面朝用户。
- 使用弯曲的虹膜剪刀剪掉皮肤。
- 从腰部上方的腰部区切开脊髓,然后切开胸部两侧,将其与身体分开。
注意:这需要从内脏器官仔细解剖脊髓,以避免对其他器官的无意损伤( 图1a )。 - 在含有5mL0.2μm过滤器灭菌的磷酸盐缓冲盐水(PBS)的3×10cm培养皿中依次洗涤10s以除去多余的组织。
- 将22 G针头和注射器装满5 mL过滤灭菌的PBS到脊柱的尾端,颅内冲洗,使脐带to退出第四培养皿( 图1b )。
- 在15 mL管中收集脊髓,并加入5 mL HABG( 表1 )。小心避免压碎脊髓。
- 对垃圾中的每只小狗重复步骤3.1-3.8。
注意:理想情况下,这个过程每个脊髓需要不到30分钟,以确保健康的神经元分离。
隔离神经元
注意:以下步骤应在层流罩中进行。预计熟悉基本的无菌技术。
- 组织分娩
- 取包含脊髓的管,轻轻晃动,悬挂组织。
- 将组织从管中倒入60毫米玻璃培养皿和骰子用剃刀刀片,以产生大小为0.5毫米的细碎片。
- 将大孔移液器的组织转移到含有5mL HABG的15mL管中。
- 放在一个30℃水浴30分钟,以使细胞在该温度下平衡。将细胞保持在振动器上,足够使其悬浮在流体中。
注意:此步骤是为了避免在从冰到消化介质转移时对细胞的冲击。保持细胞在30°C有助于减少细胞死亡与另外增加的新陈代谢在37°C。
- 准备消化培养基( 表1 )。
- 准备密度梯度(表1)。
- 在4个不同的15 mL管中制备4层中的每一层,如表1所示 。
- 从每层加入1 mL到一个新的15 mL管中。从底部的第1层开始,并依次添加,直到到达顶层的第4层。加入时避免干扰层。
- 从步骤2.2洗涤PDL涂覆的板。用无菌水洗涤数分钟,然后取出任何剩余的水使其干燥1小时。
- 将组织转移至消化培养基。
- 从30℃的摇床水浴中取出含有组织的管,并使其沉降数分钟。
- 从37°C水浴中取出消化介质管,然后将其吸入皮肤锁定注射器。
- 从含有组织的管吸出多余的HABG。
- 在注射器上使用一个leur-lock 0.2μm过滤器,将消化液添加到含有组织的管中。
- 将管置于30°C水浴中30分钟。保持细胞晃动刚好足以让它们悬浮在液体中。
注意:重要的是不要将细胞保持在消化介质中太长时间,或者使温度过高,这可能导致过度消化,导致组织悬浮在凝胶状混合物中。
- 在此期间,如步骤2.3所示涂覆层粘连蛋白。 <执行研磨( 即从组织中分离细胞)。
- 从摇动的30°C水浴中取出管子,使其沉降数分钟。
- 吸出过量消化介质。
- 将组织悬浮于2 mL HABG中。
- 使用狭窄的移液管,捣碎10次,持续45秒。
注意:这可能是最关键的一个步骤,如果不能正确完成,可以显着降低产量。- 将组织吸入移液管,并立即将内容物倒空。
- 避免引入空气,因为它会显着降低可行的产量。
注意:理想的移液管是9"玻璃移液管,移液管的顶端应进行火花抛光,使粗糙表面光滑,然后将其放置在二氯二甲基硅烷(DMDCS)在氯仿中的1:20溶液中,然后留下O / N,然后取出移液管,风干用高压釜灭菌。
注意:DMDCS和氯仿是高度易燃的,硅化应在通风橱中进行。
- 吸出顶部2 mL上清液,并将其置于标有"收集"的新型15 mL管中。
- 重复步骤4.7.3-4.7.5两次(细胞收集管应至少有6 mL)。
- 将收集管内容物慢慢转移到步骤4.2中制备的梯度管中,避免了梯度的破坏。
- 此时,从冰箱中取出以前制备的神经基质培养基( 表1 ),并使其在37°C浴中温热。
- 净化神经元。
- 在800 xg和22℃下离心梯度管15分钟。
- 用移液管收集所需的层( 图2 ),并置于新的15 mL管中。对于最高纯度的神经n分离( 即 > 90%),收集层3.为了获得较少的纯度( 即 > 70-80%),收集层2和3。
- 通过向新收集的层中加入5mL HABG来稀释密度梯度。
- 在22℃下以200xg离心2分钟。
- 弃去上清液,重新悬浮在5 mL HABG中,轻轻摇匀,使细胞悬浮。
- 在22℃离心2分钟200×g。
- 弃去上清液,重悬于3 mL神经巴氏培养基中,轻轻摇匀,重悬细胞。
- 计数细胞
- 取10μL溶液,现在用神经巴氏培养基中的细胞,并与10μL台盼蓝混合。
- 将10μL该混合物置于玻璃计数室中。
- 使用标准的玻璃计数室,计算四个4×4象限中每一个中的细胞数。添加所有细胞计数(n),多层数2(稀释因子),除以4(计数的象限数),乘以3(神经基底培养基的体积),并乘以10 4以获得细胞/ mL的细胞浓度。

- 将培养板上的细胞种植
- 将细胞悬浮液稀释至1毫升神经巴氏培养基中的30万个细胞。
注意:根据上述步骤获得的细胞浓度,加入另外的神经基底培养基以获得3×10 5个细胞/ mL的终浓度。方程式为C 1 V 1 = C 2 V 2 ,其中C 1是从收获获得的细胞的初始浓度; V 1为3mL;如上所述,C 2为3×10 5个细胞/ mL。 V 2求解方程。加入使溶液中细胞总体积相等所需的神经巴培养液体积V 2 。 - 轻轻晃动将细胞分布在溶液中,并向涂覆的24孔板中的每个孔加1 mL。
- 将细胞悬浮液稀释至1毫升神经巴氏培养基中的30万个细胞。
结果
使用这种技术,单个垃圾(4-10只幼仔)允许分离适合种植在培养板上的1-2.5个10 6个神经元。通常,以上述浓度( 即 30万个细胞/ mL)接种4-8个孔。 图3显示了在低( a )和高( b )放大光学显微镜下培养一周后在该浓度下神经元的出现。然而,我们也能够以高达500,000个细胞/孔和低至100,000个细胞/孔的浓度培养细胞。使用较高的浓度需要对环境条件进行更加中等和谨慎的关注,因为营养物质可以快速消耗,导致细胞毒性的酸性环境。浓度较低时,细胞趋于完全不成熟,支持细胞过度生长( 即少突胶质细胞,mi观察到克罗奇和星形胶质细胞)。
电池通常会在前几小时内开始粘附在表面上( 图4a )。轴突将在第一个24-48小时内开始发芽( 图4b -4c )。培养中各种神经元之间的连接通常在7天达到成熟度( 图4d ),此时通常在神经元上进行实验。
神经元在光学显微镜下是可以识别的,因为它们具有明显的轴突预测。我们使用层3( 图2 )的分离产生培养物中约80-90%的神经元。这使用神经元特异性标志物的免疫荧光染色证实。在图5c中 ,神经元细胞骨架蛋白微管相关蛋白2(MAP2)是s在文化中一周后,显示了神经元的轮廓和轴突投影。类似地,在图6c中 ,神经元特异性核标记NeuN被染色,显示神经元核。这些神经元标记物与核(DAPI, 图5a ,6a )和细胞质(GFP, 图5b ,6b )成像组合,并且所得到的图像被合并( 图5d ,6d ),详细描述了神经元相对于其他细胞的相对丰度文化。当使用层2和3时,神经元的产量略高;然而,纯溶液(〜70%)中的神经元往往更少。

图1:从3日龄新生儿小鼠释放的脊柱解剖和脊髓。该( a )中的箭头指向脊柱的尾端,插入针头以释放脊髓。释放的脊髓( b )显示浸没在PBS中。 请点击此处查看此图的较大版本。

图2:密度梯度,离心后添加细胞。这些图层被概述,并且在卡通描绘中更好地可视化。最表层(0)通常来自脊髓组织的碎屑。第1层富含少突胶质细胞和星形胶质细胞。层2和3包含大部分神经元。虽然层3含有最高纯度的神经元,但在层2中发现了一些支持细胞( 即星形胶质细胞和少突胶质细胞)底部的小叶主要含有小胶质细胞。 请点击此处查看此图的较大版本。

图3:隔离7天后神经元细胞培养物的光学显微镜。在10倍放大倍数( a ),可以看到神经元的各种砾岩之间的轴突连接。在40倍放大倍率( b ),神经元可以与他们的轴突投影更紧密地可视化。 请点击此处查看此图的较大版本。
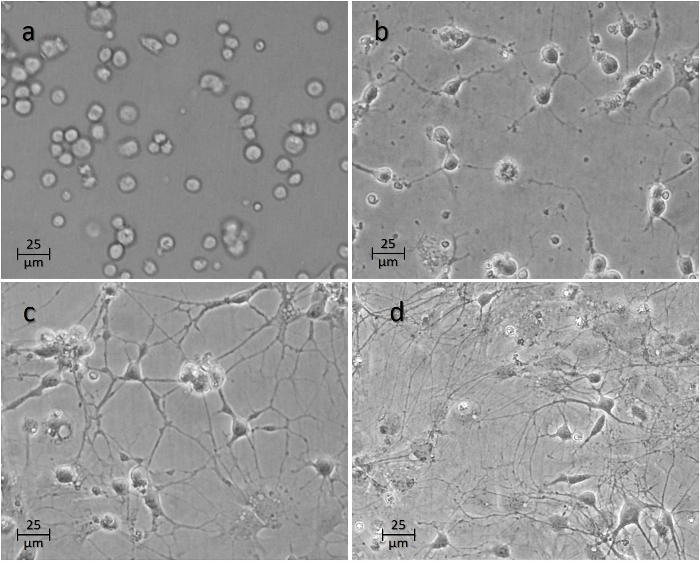
>图4:接种到井后神经元的时程。图( a )显示了播种1 h,( b )24 h,( c )48 h和( d )1周后的细胞。 请点击此处查看此图的较大版本。

图5:使用神经元细胞骨架标记物MAP2的神经元的免疫荧光染色。核染色(DAPI)显示为蓝色( a ),细胞质染色(GFP)为绿色( b ),神经元细胞骨架蛋白(MAP2)为红色( c )。合并图像( d )组合,显示神经元的相对丰度。target ="_ blank">请点击此处查看此图的较大版本。

图6:使用神经元核标记神经元的神经元的免疫荧光染色。核染色(DAPI)显示为蓝色( a ),细胞质染色(GFP)为绿色( b ),神经元核(NeuN)为红色( c )。合并图像( d )组合,显示神经元的相对丰度。 请点击此处查看此图的较大版本。
| 媒体 | 存储 | 配料 | 制备 | ||
| HABG | 4°C / 24h | 100毫升 | - 解冻B27在4°C冰箱O / N - 过滤灭菌(0.22μm) | ||
| 休眠A | 97.8 mL | ||||
| B27 [2%] | 2 mL | ||||
| GlutaMAX [0.5mM] | 0.25mL | ||||
| 神经系统媒体 | 4°C / 1周 | 100毫升 | - 解冻B27在4°C冰箱O / N - 过滤灭菌(0.22μm) - 将等份50mL分成50mL管(储存于4℃) | ||
| 神经系统A | 97 mL | ||||
| B27 [2%] | 2 mL | ||||
| GlutaMAX [0.5mM] | 0.25mL | ||||
| Pen / Strep [1%] | 1 mL | ||||
| 消化媒体 | 隔离日 | 10 mL | - 大力摇摆 - 让它在37°C浴中静置30分钟(理想的使用前30分钟准备) - 过滤灭菌(0.22μm) | ||
| HA-钙 | 10 mL | ||||
| 木瓜蛋白酶 | 25毫克 | ||||
| GlutaMAX [0.5mM] | 0.025mL | ||||
| 密度梯度 | 隔离日 | 1梯度 | |||
| 层 | OptiPrep | 民政事务局G | |||
| (0.13mL) | (5.29mL) | ||||
| 1底部 | 0.26mL | 1.24mL | |||
| 2 | 0.19mL | 1.31mL | |||
| 3 | 0.15mL | 1.35mL | |||
| 4顶 | 0.11mL | 1.39mL | |||
表1: 本议定书中使用的介质和溶液的制备。
| 涂层基材 | 存储 | 配料 | 制备 | |
| PDL | - 20°C 冻融一次 | 聚-D-赖氨酸氢溴酸盐 | 5毫克 | - 将等份4 mL放入15 mL管中,立即储存于-20°C - 0.5mL /孔(24孔板) |
| 无菌水 | 50 mL | |||
| 层粘连蛋白 | 涂层日 | 层粘连蛋白(1mg / mL) | 80μL | - 在24孔板中有8口井 - 0.35mL /孔(24孔板) |
| 神经巴氏培养基 | 2.72mL | |||
表2:用于涂覆神经元培养的孔的涂层底物的制备。
讨论
这种技术允许脊髓神经元的可靠培养。一旦熟练掌握了这项技术,大概需要3.5h才能完成。我们已经能够在大约4小时内从2个独立的小窝(总共16只小鼠)中进行神经元的分离。可行性的关键步骤是能够精通从小鼠中提取脊髓。产量允许电镀几个孔,并能够在各种条件下测试神经元。我们已经能够在成熟后治疗神经元,并使用蛋白质印迹分析可靠地评估蛋白质表达。此外,在孔内使用玻璃载玻片进行神经元附着,可进一步对神经元进行染色分析。
该方法的优点在于它不需要胚胎组织和相关的劳动强度。此外,没有必要使用成年脊髓来收集足够的组织以获得足够的e神经元分离。这可以防止神经元生理学中的年龄复合行为的因素,如成年小鼠所见。然而,这种技术并不是没有限制的。如前所述,使用新生儿小鼠排除老年神经元,如果年龄相关的行为和生物学是调查领域,这可能是一个限制。有一个程序的学习曲线,不仅要优化产量,还要确保孤立的神经元是健康的。脊髓提取技术可能需要一些时间来掌握,特别是与新生的小鼠。我们注意到与脊髓提取相关的延长时间导致可以培养明显更短的时期的神经元。这在神经元放置在冰上有所减轻;然而,时间依然起着关键的作用。
该过程中有关键步骤有助于确保神经元的最佳产量。如果神经元产量不如e预期,应该评估几个步骤。首先,脊髓的数量应理想地大于4.当使用3根脊髓或更少的脊髓时,产量通常小于100万个神经元。必须确保消化介质的充分准备(步骤4.5)。在消化介质中使组织过长太长时间会导致细胞过度分解,而使用37℃未激活的消化培养基将导致更少的孤立的神经元。最后,研磨技术(步骤4.7)必须精确地进行。低产量通常是由于研磨不足造成的。一个很好的指标是在研磨过程中看到溶液是否变得多云 - 如果不发生这种情况,则研磨可能太温和。
如果产量符合预期,但神经元在1-2天内似乎没有再生过程,则问题通常是适当涂层的失败,洗涤不充分或干燥(步骤2.2)。如果细胞最初投入过程,但在5-7天之前随后变得凋亡,可能会有几个问题。首先,确保HABG溶液在隔离24小时内制备,并且使用在HABG制备当天解冻的新鲜B27补充剂。本补充剂中的抗氧化剂需要新鲜而不会过期。接下来,确保在研磨过程中不引入气泡(步骤4.7)。气泡的引入有助于这个问题,并且可能与神经元的干燥有关。此外,确保文化不被污染所淹没,这可归因于无菌的失败。
在这里,我们描述了使用24孔板来种植神经元。有时,有必要进行时间和/或剂量试验,例如使用药理剂时。该技术可以修改,神经元可以种植在48孔板上吃了由于48孔板中的孔的表面积是24孔板中的一半,所以使用的涂层溶液的体积应该被切成两半。细胞也应以体积的一半( 即 0.5mL而不是1.0mL)包被。然而,它们的浓度应该保持不变( 即 1-5×10 5个细胞/ mL)。虽然本研究使用C57BL / 6小鼠进行,但该技术应适用于其他遗传操作的菌株。
脊髓缺血和保护是感兴趣的领域12,13,14 。临床上,胸腹主动脉手术可导致与脊髓缺血和再灌注相关的破坏性麻痹,其病理生理学尚待完全了解15,16 。了解神经元如何响应使用该模型,局部缺血的应激是可行的。我们组已经发表了关于通过使用这种技术的氧葡萄糖剥夺与缺血性损伤相关的脊髓神经元损伤17 。该模型也被扩展到包括与神经元18分开的星形胶质细胞的培养。
总之,这项技术对于脊髓病理生理学和神经元微生物学的研究是有价值的。无血清培养允许精确的环境控制。它可以直接进入药剂的应用。结合额外的技术,如氧葡萄糖剥夺,这种技术可以有助于扩大我们对决定性脊髓缺血的病理生理学的理解。
披露声明
作者没有披露。
致谢
作者没有确认。
材料
| Name | Company | Catalog Number | Comments |
| Hibernate A Medium - 500 mL | Thermo-Fisher | A1247501 | https://www.thermofisher.com/order/catalog/product/A1247501 |
| Hibernate A Minus Calcium - 500 mL | Brainbits | HA-Ca | http://www.brainbitsllc.com/hibernate-a-minus-calcium/ |
| Glutamax 100X - 100 mL | Thermo-Fisher | 35050061 | https://www.thermofisher.com/order/catalog/product/35050079 |
| B27 Supplement 50X - 10 mL | Thermo-Fisher | 17504044 | https://www.thermofisher.com/order/catalog/product/17504044 |
| Papain, Lyophilized - 100 mg | Worthington | LS003119 | http://www.worthington-biochem.com/pap/cat.html |
| Neurobasal A Medium - 500 mL | Thermo-Fisher | 10888022 | https://www.thermofisher.com/order/catalog/product/10888022 |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo-Fisher | 15140122 | https://www.thermofisher.com/order/catalog/product/15140122 |
| Poly-D-Lysine (PDL) hydrobromide - 5 mg | Sigma-Aldrich | P6407-5MG | http://www.sigmaaldrich.com/catalog/product/sigma/p6407?lang=en®ion=US |
| Mouse Laminin - 1 mg | Thermo-Fisher | 23017015 | https://www.thermofisher.com/order/catalog/product/23017015 |
| Trypan Blue - 20 mL | Sigma-Aldrich | T8154-20ML | http://www.sigmaaldrich.com/catalog/product/sigma/t8154?lang=en®ion=US |
| OptiPrep Density Gradient Medium - 250 mL | Sigma-Aldrich | D1556-250ML | http://www.sigmaaldrich.com/catalog/product/sigma/d1556?lang=en®ion=US |
| Dichlorodimethylsilane (DMDCS, Sigma Silicoat) | Sigma-Aldrich | 440272-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/440272?lang=en®ion=US |
| Chloroform | Sigma-Aldrich | 288306-1L | http://www.sigmaaldrich.com/catalog/product/sial/288306?lang=en®ion=US |
| Glass Pippette - 9" | Sigma-Aldrich | 13-678-20C | http://www.sigmaaldrich.com/catalog/product/sigma/cls7095d9?lang=en®ion=US |
| Pipette bulb - 5 mL | Sigma-Aldrich | Z186678-3EA | http://www.sigmaaldrich.com/catalog/product/aldrich/z186678?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold10-1 |
| BRAND® Petri dish, glass - 60 x 15 mm | Sigma-Aldrich | BR455717-10EA | http://www.sigmaaldrich.com/catalog/product/aldrich/br455717?lang=en®ion=US |
| Sterile 24-Well Cell Culture Plate | Sigma-Aldrich | M8812-100EA | http://www.sigmaaldrich.com/catalog/product/sigma/m8812?lang=en®ion=US |
| Hausser Hemacytometer (glass counting chamber) | Fischer Scientific | 02-671-6 | https://www.fishersci.com/shop/products/hausser-bright-line-phase-hemacytometer-hemacytometer/026716 |
| Glass Slides - 12 mm sterile cover glass - uncoated | Neuvitro | GG-12-1.5-Pre | http://www.neuvitro.com/german-coverslip-12mm-diameter.htm |
| NeuN Rabbit Monoclonal Antibody - 100 µL | Abcam | ab177487 | After fixing in paraformaldehyde (PFA) and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:200 for 18 h in 4 °C |
| MAP-2 Mouse Monoclonal Antibody - 50 µL | Abcam | ab11267 | After fixing in paraformaldehyde and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:500 for 18 h in 4 °C |
参考文献
- Qayumi, A. K., et al. Animal model for investigation of spinal cord injury caused by aortic cross-clamping. J Invest Surg. 10 (1-2), 47-52 (1997).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Taira, Y., Marsala, M. Effect of proximal arterial perfusion pressure on function, spinal cord blood flow, and histopathologic changes after increasing intervals of aortic occlusion in the rat. Stroke. 27 (10), 1850-1858 (1996).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Ahlemeyer, B., Baumgart-Vogt, E. Optimized protocols for the simultaneous preparation of primary neuronal cultures of the neocortex, hippocampus and cerebellum from individual newborn (P0. 5) C57Bl/6J mice. J Neurosci Methods. 149 (2), 110-120 (2005).
- Brewer, G. J., Torricelli, J. R. Isolation and culture of adult neurons and neurospheres. Nat Protoc. 2 (6), 1490-1498 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Res. 126 (3), 397-425 (1977).
- Graber, D. J., Harris, B. T. Purification and culture of spinal motor neurons from rat embryos. Cold Spring Harb Protoc. 2013 (4), 319-326 (2013).
- Anderson, K. N., Potter, A. C., Piccenna, L. G., Quah, A. K., Davies, K. E., Cheema, S. S. Isolation and culture of motor neurons from the newborn mouse spinal cord. Brain Res Prot. 12 (3), 132-136 (2004).
- Gingras, M., Gagnon, V., Minotti, S., Durham, H. D., Berthod, F. Optimized protocols for isolation of primary motor neurons, astrocytes and microglia from embryonic mouse spinal cord. J Neurosci Methods. 163 (1), 111-118 (2007).
- Brewer, G. J., et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Su, M., Zhong, W., Ren, S. Dose-dependent protection of reseveratrol against spinal cord ischemic-reperfusion injury in rats. Trop J Pharm Res. 15 (6), 1225-1233 (2016).
- Haapanen, H., et al. Remote ischemic preconditioning protects the spinal cord against ischemic insult: An experimental study in a porcine model. J Thorac Cardiovasc Surg. 151 (3), 777-785 (2016).
- Conrad, M. F., Ye, J. Y., Chung, T. K., Davison, J. K., Cambria, R. P. Spinal cord complications after thoracic aortic surgery: long-term survival and functional status varies with deficit severity. J Vasc Surg. 48 (1), 47-53 (2008).
- Wong, D. R., et al. Delayed spinal cord deficits after thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 83 (4), 1345-1355 (2007).
- Freeman, K. A., et al. Alpha-2 agonist attenuates ischemic injury in spinal cord neurons. J Surg Res. 195 (1), 21-28 (2015).
- Freeman, K. A., et al. Spinal cord protection via alpha-2 agonist-mediated increase in glial cell-line-derived neurotrophic factor. J Thorac Cardiovasc Surg. 149 (2), 578-586 (2015).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。