Method Article
新生児マウスからの脊髄ニューロンの単離と培養
要約
この研究は、WT新生児マウスからのニューロンの単離のための技術を提示する。新生仔マウスから脊髄を注意深く切開し、続いて脊髄組織からニューロンを機械的および酵素的に切断することが必要である。
要約
我々は、脊髄ニューロンの単離および培養のためのプロトコールを提示する。ニューロンは、新生児C57BL / 6マウスから得られ、生後1〜3日に単離される。通常、1匹の繁殖対から生まれた4〜10匹の仔マウスを1回の実験で集め、イソフルランで安楽死させた後、各マウスから脊髄を個別に採取する。脊柱を切開し、次いで脊髄を柱から解放する。次いで、ニューロンおよび他の細胞が組織から放出されることを可能にする酵素的プロテアーゼの送達の表面積を増加させるために、脊髄を細かく切り刻む。次いで、粉砕を用いて細胞を溶液に放出する。その後、この溶液を密度勾配で分画して、溶液中の様々な細胞を分離し、ニューロンを単離することができるようにする。約1-2.5×10 6個のニューロンを1つの繁殖群から単離することができる。次いで、ニューロンを接着剤でコーティングされたウェル上に播種する適切な成長および成熟を可能にするrs。ニューロンは、成長および培養培地中で成熟に達するまでに約7日を要し、その後、治療および分析のために使用することができる。
概要
脊髄の病理を理解するには、巨視的レベルと顕微鏡レベルの両方で、様々なモデルを使用する必要があります。大小の動物モデル1,2,3は 、脊髄疾患および傷害のインビボ研究のために使用される。 インビボでこれらの問題を研究することにはメリットがありますが、脊髄の解析は全脊髄ホモジネートまたは組織切片4に限定されます。これは、居住ニューロンおよび周囲グリアの間で脊髄における特定の応答および標的を分離しようとするときに、あいまいさを生じる。遺伝的に操作されたマウスの利用可能性の増加は、細胞レベルおよび分子レベルでの生物学のより詳細な調査を可能にする。したがって、ここでは新生仔マウスモデルが使用され、 インビトロでの脊髄ニューロンの固有の特性および生物学の研究が可能になる。
in vitroでのニューロンの単離と維持は特に簡単ではない大人のげっ歯類の皮質組織からのニューロンの単離のための技術が比較的豊富にあり、それは相当数の単離されたニューロン( すなわち数百万個)これとは対照的に、脊髄組織からのニューロンの収量は、組織の質量がより少ないために、部分的に8,9,10よりも低い。さらに、マウスでは、新生児の単離のための技術が相対的に不足している脊髄ニューロン、および既存の方法は、より低いニューロン収量( すなわち数百)または胚性マウスの単離を必要とする手間と資源重い技術によって制限される10 。このプロトコルでは、新生児マウスの脊髄からかなりの数のニューロンをコスト効率的かつリソース効率的に単離できる技術を使用する。以前に発表された技術でよく見られるように、我々は酵素プロテアーゼとしてパパインを使用し、脊髄組織からのニューロンの放出を可能にする。さらに、精製された細胞の分離には濃度勾配を使用していますが、これは以前は効果的であることが示されています6,10。細胞が培養される培地は様々であり得るが、我々の経験およびこれまでに公開された11のように 、新鮮なB27培地補充物はニューロンの寿命にとって重要であることが証明されている。ニューロンは、典型的には10日間まで生存可能であり、治療を行うことを可能にする。
プロトコル
この手技における動物のケアおよび治療は、コロラド大学の動物実験および使用委員会のガイドラインに従って行われた。
1.ソリューションの準備
- 表1に示すように、すべての溶液を適切な温度で調製して保管します。
2.コーティングウェルとスライド
注:ニューロンはプラスチックやガラスの表面には接着しません。
- ニューロンの単離の1日前に、無菌の24ウェル培養プレートのウェルを0.5mLのPoly-D-Lysine(PDL; 表2 )でコーティングし、それを層流フードO / Nに残す。
注:好ましい方法は、周辺ウェルからの蒸発がより加速され、一貫性のない結果につながる傾向があるため、24ウェルプレートを使用し、中心ウェルのみをコートすることである。さらに、ガラススライドはウェルの前に配置することができますoコーティング。ニューロンは、コーティングされたガラススライドに付着し、後でさらなる顕微鏡画像化のために除去することができる。 - 分離の日に、ウェルからPDLを除去する。残りの水を取り除いて1時間乾燥させる前に、滅菌水で数分間洗ってください(下記参照)。
- 乾燥後、スライドをラミニンで被覆する( 表2 )。
注:約10μLのラミニン(10μg/μL)で滅菌24ウェルプレートの各ウェルをコートできます。これは、ウェル全体を覆うために340μLの培地(総容量:350μL)と混合する。これを培養フード内で室温で2時間放置し、次に細胞をコーティングする前に吸引する。
3.脊髄を収穫する
注:すべての機器は、滅菌のためにオートクレーブ(135°Cおよび30 psi、4 x 7 minサイクル)する必要があります。
- イソフルランを含むチャンバー内で1〜3日齢のC57BL / 6マウスを安楽死させる。待つ30秒後に動きが止まり、脚をつまんで応答がないことを確認します。
- ハサミを使って体から頭を離し、腹を立てやすい位置にします。
- 背側を使用者に向けて、手順表の後足または尾と腕を安定させる。
- 湾曲したアイリスはさみを使用して皮膚を切ってください。
- 腰部の腰部から脊髄を切断し、胸部の両側を切断して体から分離させます。
注:これは、他の臓器( 図1a )への偶発的な損傷を避けるために内臓からの脊髄の注意深い解離を必要とする。 - 余分な組織を除去するために0.2μmのフィルターで滅菌したリン酸緩衝生理食塩水(PBS)5 mLを含む3 x 10 cmのペトリ皿で10秒間連続して洗浄します。
- 脊柱の尾端にフィルター滅菌したPBS5mLを充填した22Gの針とシリンジを挿入し、経頭蓋に流し、コードto第4ペトリ皿に出る( 図1b )。
- 氷上で5 mLのHABG( 表1 )を含む15 mLチューブに脊髄を採取する。脊髄を粉砕しないように注意してください。
- リターの各子犬についてステップ3.1~3.8を繰り返す。
注:理想的には、健康なニューロンの分離を確実にするために、このプロセスは脊髄あたり30分未満かかる必要があります。
4.分離ニューロン
注:次のステップは、層流フードで実行する必要があります。基本的な滅菌技術に精通していることが期待される。
- ティッシュミッシング
- 脊髄を含むチューブを軽く振り、組織を懸濁させます。
- チューブから組織を60 mmのガラスペトリ皿に注ぎ、かみそりの刃でサイコロを振って、〜0.5 mmの大きさの細片を作ります。
- 広口ピペットで組織をHABG 5 mLを含む15 mLチューブに移す。
- それを30℃の水浴中で30分間インキュベートし、細胞をこの温度で平衡化させた。細胞を振とう器の上に置いて、液体中に浮遊させておきます。
注:このステップは、氷から消化培地への移動時に細胞にショックを与えないようにするために行われます。細胞を30°Cに保つと、37℃での代謝の増加に関連した細胞死を減少させるのに役立ちます。
- 消化培地を調製する( 表1 )。
- 密度勾配を準備する(表1)。
- 表1に示すように、4つの層を4つの別々の15 mLチューブで準備します。
- 各層から1mLを新しい15mLチューブに加える。一番下のレイヤー1から始めて、上のレイヤー4に達するまで順次追加します。追加中にレイヤーを妨害しないでください。
- ステップ2.2のPDL被覆プレートを洗浄する。残りの水を取り除く前に滅菌水で数分間洗ってください。それらを1時間乾燥させる。
- 組織を消化培地に移す。
- 30℃のシェーカー水浴から組織含有チューブを取り出し、数分間静置する。
- 37℃の水槽から消化液チューブを取り出し、リールロックシリンジに吸引します。
- 組織含有チューブから余分なHABGを吸引する。
- シリンジにleur-lock 0.2μmフィルターを使用して、消化液を組織含有チューブに加えます。
- チューブを30℃のウォーターバスに30分間置きます。細胞を流体中に浮遊させるのに十分なだけ振とうさせる。
注:消化培地に細胞を長時間入れすぎないようにしたり、温度が高くなりすぎて過度の消化を招き、組織がゼラチン状の混合物に浮遊することがないようにすることが重要です。
- この期間中、ステップ2.3と同様にラミニンをコートする。 <粉砕を行う( すなわち 、細胞を組織から分離する)。
- 30℃の振とう水槽からチューブを取り出し、数分間静置する。
- 過剰な消化培地を吸引する。
- 2mLのHABGに組織を懸濁する。
- ナローボアピペットを使用して、45分間10倍に粉砕します。
注:これはおそらく単一の最も重要なステップであり、正しく行われていないと収量を大幅に減少させる可能性があります。- 組織をピペットに吸引し、直ちに内容物を戻す。
- 空気を導入することは避けてください。生存可能な収率を大幅に低下させます。
注:ピペットは、9インチのガラスピペットで、ピペットの先端を磨いて粗い表面を滑らかにし、クロロホルム中のジクロロジメチルシラン(DMDCS)の1:20溶液中に置き、 / Nその後、ピペットを取り出して風乾させ、その後、滅菌のためにオートクレーブにかけなければならない。
注意:DMDCSとクロロホルムは可燃性が高く、シリコンゴムはフュームフードで使用してください。
- 上清の上2 mLを吸引し、「コレクション」と名付けられた新しい15 mLチューブに入れます。
- 4.7.3-4.7.5の手順をさらに2回繰り返します(細胞回収チューブは最後に6 mLになるはずです)。
- 収集チューブの内容物をステップ4.2で準備したグラジエントチューブにゆっくり移し、グラジエントの混乱を避けます。
- この時点で、冷蔵庫から前もって調製した神経根培地( 表1 )を取り出し、37℃の温浴中で温める。
- ニューロンを精製する。
- グラジエントチューブを800 xgおよび22℃で15分間遠心します。
- ピペットで目的の層を集め( 図2 )、新しい15 mLチューブに入れます。最高純度のニューロ( すなわち > 90%)、層3を集める。純度がより低い( すなわち > 70-80%)より多くの収率を得るために、層2および3を集める。
- 新たに収集した層に5mLのHABGを加えることによって密度勾配を希釈する。
- 22℃で2分間200 xgで遠心分離する。
- 上清を捨て、5mLのHABGに再懸濁し、細胞を懸濁させるためにペレットを軽くたたきます。
- 22℃で200×gで2分間遠心分離する。
- 上清を捨て、3mLの神経細胞培地に再懸濁し、細胞を再懸濁するためにペレットを軽くたたきます。
- 細胞を数える。
- 10μLの溶液を、今では神経細胞培地に入れ、10μLのトリパンブルーと混合する。
- この混合物10μLをガラス計数室に入れる。
- 標準のガラス計数チャンバを使用して、4つの4×4象限のそれぞれの細胞の数を数えます。カウントされたすべてのセルを追加する(n)、マルチ(希釈係数)、4で割る(象限の数)、3倍(神経基底培地の体積)、および10 4を掛けて細胞/ mL中の細胞濃度を得る。

- 細胞を培養プレート上に播種する
- 細胞懸濁液を1mLの神経細胞培地中の300,000個の細胞に希釈する。
注:上記のステップで得られた細胞の濃度に基づいて、3×10 5細胞/ mLの最終濃度を得るために、追加の神経基底培地を添加する。式はC 1 V 1 = C 2 V 2であり、ここでC 1は収穫から得られた細胞の初期濃度であり、 V 1は3mLである。上記のように、C 2は3×10 5細胞/ mLである。方程式はV 2について解かれる。溶液中の細胞の総容量を等しくするために必要な神経細胞培地の容量を加えるV 2である 。 - 静かに振とうして溶液中の細胞を分散させ、コーティングした24ウェルプレートの各ウェルに1 mLを加える。
- 細胞懸濁液を1mLの神経細胞培地中の300,000個の細胞に希釈する。
結果
この技術を用いて、1匹のリター(4〜10匹の仔)は、培養プレートへの播種に適した1-2.5×10 6個のニューロンの単離を可能にする。典型的には、4〜8ウェルを上記の濃度( すなわち 300,000細胞/ mL)で播種する。 図3は低倍率( a )および高倍率( b )倍率の光学顕微鏡で培養して1週間後のこの濃度でのニューロンの出現を示す。しかしながら、我々はまた、500,000細胞/ウェルの高濃度および100,000細胞/ウェルの低濃度で細胞を培養することもできた。より高い濃度を使用するには、栄養素が急速に枯渇し、細胞にとって有毒な酸性環境につながるため、環境条件に中程度の注意を払う必要があります。より低い濃度では、細胞は完全な成熟に達しない傾向があり、支持細胞の過増殖( すなわち希突起膠細胞、miクロストリジウム、星状細胞)が観察される。
細胞は通常、最初の2時間以内に表面に付着し始める( 図4a )。軸索は、最初の24〜48時間以内に発芽し始める( 図 4b〜4c )。培養中の様々なニューロン間の接続は、通常7日間で成熟に達し( 図4d )、その時点で実験が典型的にはニューロン上で行われる。
ニューロンは、明瞭な軸索突起を有するため、光学顕微鏡下で同定することができる。レイヤー3( 図2 )を使用した私たちの分離は、培養で約80〜90%のニューロンをもたらします。これは、ニューロン特異的マーカーの免疫蛍光染色を用いて確認された。 図5cにおいて、ニューロン細胞骨格タンパク質である微小管関連タンパク質2(MAP2)は、1週間培養後のニューロンの輪郭および軸索突起を示す。同様に、 図6cでは、ニューロン特異的核マーカーNeuNが染色され、ニューロン核を示す。これらのニューロンマーカーは核(DAPI、 図5a 、6a )および細胞質(GFP、 図5b 、6b )イメージングと組み合わされ、得られた画像はマージされ( 図5d 、6d )、ニューロンの相対的存在量を文化。層2および3を使用する場合、ニューロンの収率はわずかに高い。しかし、純粋な溶液中のニューロンはより少ない傾向がある(約70%)。

図1:3日齢の新生仔マウスから放出された脊柱解剖および脊髄。ザ( a )の矢印は、脊髄の尾側端部を指し、針が挿入されて脊髄を解放する。放出された脊髄( b )は、PBS中に沈められて示されている。 この図の拡大版を見るには、ここをクリックしてください。

図2:遠心分離後に細胞が添加された密度勾配。これらのレイヤーは輪郭が描かれ、漫画の描写上でよりよく視覚化される。最も表面の薄い層(0)は、一般的に、脊髄組織からの破片である。層1は希突起膠細胞および星状細胞が豊富である。層2および層3は、大部分のニューロンを含む。第3層は最も純度の高いニューロンを含むが、いくつかの支持細胞( すなわち、星状細胞および希突起膠細胞)が第2層に見られる.pPE底部のlletは主に小膠細胞を含む。 この図の拡大版を見るには、ここをクリックしてください。

図3:7日間の単離後の神経細胞培養の光学顕微鏡検査。 10倍の倍率( a )では、ニューロンの様々な集塊間の軸索接続が見られる。 40倍の倍率( b )では、ニューロンは軸索突起によってより密接に視覚化することができる。 この図の拡大版を見るには、ここをクリックしてください。
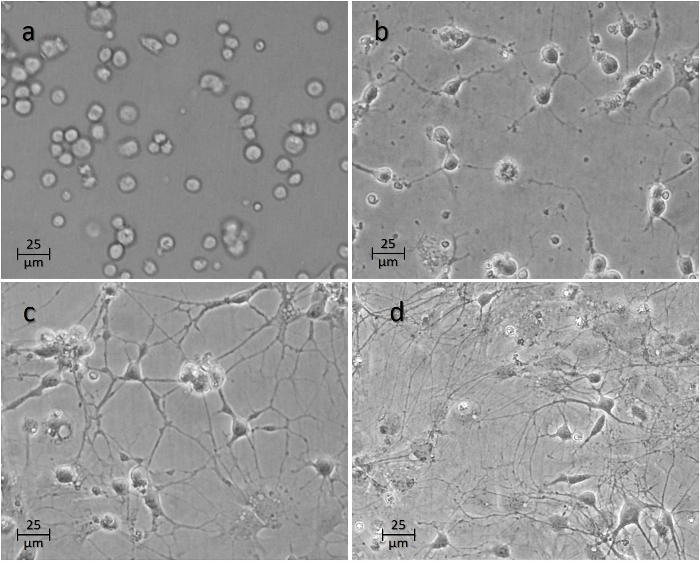
>図4:ウェルに播種した後のニューロンの時間経過。画像( a )は、播種1週間後の細胞1時間、( b )24時間、( c )48時間および( d )細胞を示す。 この図の拡大版を見るには、ここをクリックしてください。

図5:ニューロンの細胞骨格マーカーMAP2を用いたニューロンの免疫蛍光染色。赤色( c )の緑色( b )およびニューロン細胞骨格タンパク質(MAP2)の細胞質染色(GFP)を伴う青色( a )の核染色(DAPI)が示される。併合された画像( d )は、ニューロンの相対的存在度を示すものである。target = "_ blank">この図の拡大版を見るには、ここをクリックしてください。

図6:ニューロン核マーカーNeuNを用いたニューロンの免疫蛍光染色。核染色(DAPI)は青色( a )で示され、赤色( c )の緑色( b )および神経細胞核(NeuN)に細胞質染色(GFP)がある。併合された画像( d )は、ニューロンの相対的存在度を示すものである。 この図の拡大版を見るには、ここをクリックしてください。
| メディア | ストレージ | 材料 | 準備 | ||
| HABG | 4℃/ 24時間 | 100mL | - 4℃の冷蔵庫でB27を解凍する - フィルター滅菌(0.22μm) | ||
| 休止状態A | 97.8mL | ||||
| B27 [2%] | 2 mL | ||||
| GlutaMAX [0.5mM] | 0.25mL | ||||
| Neurobasal Media | 4°C / 1週間 | 100mL | - 4℃の冷蔵庫でB27を解凍する - フィルター滅菌(0.22μm) - 50 mLのチューブに50 mLずつ分注し(4℃で保存) | ||
| Neurobasal A | 97mL | ||||
| B27 [2%] | 2 mL | ||||
| GlutaMAX [0.5mM] | 0.25mL | ||||
| Pen / Strep [1%] | 1 mL | ||||
| 消化メディア | 隔離の日 | 10 mL | - 激しく振る - それを30分間37℃の浴槽に置く(理想的には使用前に30分間調製する) - フィルター滅菌(0.22μm) | ||
| HA-Ca | 10 mL | ||||
| パパイン | 25 mg | ||||
| GlutaMAX [0.5mM] | 0.025mL | ||||
| 密度勾配 | 隔離の日 | 1勾配 | |||
| 層 | OptiPrep | HABG | |||
| (0.13mL) | (5.29mL) | ||||
| 1ボトム | 0.26mL | 1.24mL | |||
| 2 | 0.19mL | 1.31mL | |||
| 3 | 0.15mL | 1.35mL | |||
| 4トップ | 0.11mL | 1.39mL | |||
表1: このプロトコールで使用される培地および溶液の調製。
| コーティング基材 | ストレージ | 材料 | 準備 | |
| PDL | -20℃ 一度フリーズ - 解凍 | ポリ-D-リジン臭化水素酸塩 | 5 mg | - 15 mLチューブに4 mLを分注し、直ちに-20°Cで保存する ・0.5mL /ウェル(24ウェルプレート) |
| 無菌水 | 50mL | |||
| ラミニン | コーティングの日 | ラミニン(1mg / mL) | 80μL | - 24ウェルプレートに8ウェル分 ・0.35mL /ウェル(24ウェルプレート) |
| 神経基底培地 | 2.72mL | |||
表2:ニューロンが培養されるウェルをコートするために使用されるコーティング基質の調製。
ディスカッション
この技術は、脊髄ニューロンの信頼できる培養を可能にする。技能の習熟度が達成されると、完了するまでに約3.5時間かかります。我々は、約4時間で2匹の別個の同腹仔(合計16匹のマウス)からニューロンの単離を行うことができた。実行可能性の重要なステップは、マウスから脊髄を巧みに抽出することができることです。歩留まりは、いくつかのウェルをメッキすること、および様々な条件下でニューロンを試験する能力を可能にする。我々は、成熟後にニューロンを処理し、ウェスタンブロット分析を用いてタンパク質発現を確実に評価することができた。さらに、ニューロン付着のためにウェル内部のガラススライドを使用することにより、ニューロンのさらなる染色分析が可能になる。
この手順は、胚組織および関連する労働強度を必要としない点で有利である。さらに、成人の脊髄を使用して、十分な組織を収集する必要はありませんeニューロンの分離。これは、成体マウスで見られるように、ニューロン生理学における年齢の複合的な行動の要因を防止する。しかしながら、この技術は制限がないわけではない。以前に述べたように、老化ニューロンは新生児マウスを使用することによって除外され、年齢関連の行動および生物学が調査領域である場合、これは制限になり得る。収量を最適化するだけでなく、単離されたニューロンが健康であることを保証するために必要な、この手順に対する学習曲線がある。脊髄抽出技術は、特に新たに生まれたマウスを習得するまでに時間がかかることがあります。我々は、脊髄の抽出に関連する長い時間が著しく短い期間培養することができるニューロンにつながることに気づいた。これは、氷上でのニューロンの配置によって幾分緩和される。しかし、時間はまだ重要な役割を果たしています。
この手順には、ニューロンの最適収量を確保するための重要なステップがあります。ニューロン収率がeいくつかのステップを評価する必要があります。まず、脊髄の数は理想的には4以上でなければならない.3本以下の脊髄を使用する場合、通常、収量は100万ニューロン未満である。消化培地の適切な調製が保証されなければならない(ステップ4.5)。 37℃で活性化されていない消化培地を使用すると、分離されたニューロンが少なくなりますが、消化培地で組織を長時間放置すると細胞が過剰に破壊されます。最後に、粉砕技術(ステップ4.7)を正確に実施しなければならない。低い収率は、通常、不十分な粉砕によって生じる。良い指標は、粉砕の間に溶液が濁るかどうかを見ることです。これが起こらないと、粉砕がやさしくなる可能性があります。
歩留まりが予想どおりであっても、ニューロンが最初の1~2日以内にプロセスを再生するように見えない場合、問題は通常、適切なコーティングの失敗であり、不十分な洗浄(ステップ2.2)。細胞が最初にプロセスを投影するが、5-7日前にアポトーシスになると、いくつかの問題が生じる可能性がある。まず、HABG溶液を24時間以内に調製し、HABG調製の同日に解凍した新鮮なB27サプリメントを使用することを確認する。このサプリメントの抗酸化物質は新鮮で期限切れでなくてはなりません。次に、粉砕プロセス中に気泡が全く導入されていないことを確認する(ステップ4.7)。気泡の導入はこの問題に寄与し、ニューロンの乾燥に関連する可能性がある。また、培養物が汚染で圧倒されないようにしてください。これは無菌状態の不具合に起因する可能性があります。
ここでは、ニューロンを播種する24ウェルプレートの使用について説明する。時には、薬理作用物質を使用する場合のように、時間および/または投薬試行を行うことが必要である。この技術は修正することができ、ニューロンは48ウェルplに播種することができる代わりにates。 48ウェルプレートのウェルの表面積は24ウェルプレートの表面積の半分であるため、使用されるコーティング溶液の量は半分に減らされるべきである。細胞はまた、容量の半分( すなわち、 1.0mLの代わりに0.5mL)でコーティングしなければならない。しかし、それらの濃度は同じままであるべきである( すなわち、 1〜5×10 5細胞/ mL)。この研究はC57BL / 6マウスを用いて実施されているが、その技術は他の遺伝子操作された系統にも適用可能であるべきである。
脊髄虚血および保護は、関心が高まっている分野12,13,14 である 。臨床的には、胸腔腹部大動脈手術は、脊髄虚血および再灌流に関連する致命的な麻痺を引き起こす可能性があり、その病態生理は完全に理解されていない15,16 。ニューロンがどのように反応するかを理解するこのモデルを用いて、虚血のストレスが実現可能である。我々のグループは、この技術を用いて酸素飢餓による虚血発作に関連した脊髄神経損傷を以前に発表している17 。このモデルはまた、ニューロン18とは別の星状細胞の培養物を含むように拡張されている18 。
結論として、この技法は、脊髄病態生理学およびニューロン微生物学の研究に有益である。無血清培養は、正確な環境制御を可能にする。薬理学的作用物質の適用のための直接的なアクセスを可能にする。酸素ブドウ糖欠乏などの追加の技術と組み合わせることにより、この技術は決定的な脊髄虚血の病態生理学の理解を拡大するのに役立つ可能性があります。
開示事項
著者には開示がない。
謝辞
著者には謝辞はありません。
資料
| Name | Company | Catalog Number | Comments |
| Hibernate A Medium - 500 mL | Thermo-Fisher | A1247501 | https://www.thermofisher.com/order/catalog/product/A1247501 |
| Hibernate A Minus Calcium - 500 mL | Brainbits | HA-Ca | http://www.brainbitsllc.com/hibernate-a-minus-calcium/ |
| Glutamax 100X - 100 mL | Thermo-Fisher | 35050061 | https://www.thermofisher.com/order/catalog/product/35050079 |
| B27 Supplement 50X - 10 mL | Thermo-Fisher | 17504044 | https://www.thermofisher.com/order/catalog/product/17504044 |
| Papain, Lyophilized - 100 mg | Worthington | LS003119 | http://www.worthington-biochem.com/pap/cat.html |
| Neurobasal A Medium - 500 mL | Thermo-Fisher | 10888022 | https://www.thermofisher.com/order/catalog/product/10888022 |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo-Fisher | 15140122 | https://www.thermofisher.com/order/catalog/product/15140122 |
| Poly-D-Lysine (PDL) hydrobromide - 5 mg | Sigma-Aldrich | P6407-5MG | http://www.sigmaaldrich.com/catalog/product/sigma/p6407?lang=en®ion=US |
| Mouse Laminin - 1 mg | Thermo-Fisher | 23017015 | https://www.thermofisher.com/order/catalog/product/23017015 |
| Trypan Blue - 20 mL | Sigma-Aldrich | T8154-20ML | http://www.sigmaaldrich.com/catalog/product/sigma/t8154?lang=en®ion=US |
| OptiPrep Density Gradient Medium - 250 mL | Sigma-Aldrich | D1556-250ML | http://www.sigmaaldrich.com/catalog/product/sigma/d1556?lang=en®ion=US |
| Dichlorodimethylsilane (DMDCS, Sigma Silicoat) | Sigma-Aldrich | 440272-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/440272?lang=en®ion=US |
| Chloroform | Sigma-Aldrich | 288306-1L | http://www.sigmaaldrich.com/catalog/product/sial/288306?lang=en®ion=US |
| Glass Pippette - 9" | Sigma-Aldrich | 13-678-20C | http://www.sigmaaldrich.com/catalog/product/sigma/cls7095d9?lang=en®ion=US |
| Pipette bulb - 5 mL | Sigma-Aldrich | Z186678-3EA | http://www.sigmaaldrich.com/catalog/product/aldrich/z186678?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold10-1 |
| BRAND® Petri dish, glass - 60 x 15 mm | Sigma-Aldrich | BR455717-10EA | http://www.sigmaaldrich.com/catalog/product/aldrich/br455717?lang=en®ion=US |
| Sterile 24-Well Cell Culture Plate | Sigma-Aldrich | M8812-100EA | http://www.sigmaaldrich.com/catalog/product/sigma/m8812?lang=en®ion=US |
| Hausser Hemacytometer (glass counting chamber) | Fischer Scientific | 02-671-6 | https://www.fishersci.com/shop/products/hausser-bright-line-phase-hemacytometer-hemacytometer/026716 |
| Glass Slides - 12 mm sterile cover glass - uncoated | Neuvitro | GG-12-1.5-Pre | http://www.neuvitro.com/german-coverslip-12mm-diameter.htm |
| NeuN Rabbit Monoclonal Antibody - 100 µL | Abcam | ab177487 | After fixing in paraformaldehyde (PFA) and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:200 for 18 h in 4 °C |
| MAP-2 Mouse Monoclonal Antibody - 50 µL | Abcam | ab11267 | After fixing in paraformaldehyde and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:500 for 18 h in 4 °C |
参考文献
- Qayumi, A. K., et al. Animal model for investigation of spinal cord injury caused by aortic cross-clamping. J Invest Surg. 10 (1-2), 47-52 (1997).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Taira, Y., Marsala, M. Effect of proximal arterial perfusion pressure on function, spinal cord blood flow, and histopathologic changes after increasing intervals of aortic occlusion in the rat. Stroke. 27 (10), 1850-1858 (1996).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Ahlemeyer, B., Baumgart-Vogt, E. Optimized protocols for the simultaneous preparation of primary neuronal cultures of the neocortex, hippocampus and cerebellum from individual newborn (P0. 5) C57Bl/6J mice. J Neurosci Methods. 149 (2), 110-120 (2005).
- Brewer, G. J., Torricelli, J. R. Isolation and culture of adult neurons and neurospheres. Nat Protoc. 2 (6), 1490-1498 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Res. 126 (3), 397-425 (1977).
- Graber, D. J., Harris, B. T. Purification and culture of spinal motor neurons from rat embryos. Cold Spring Harb Protoc. 2013 (4), 319-326 (2013).
- Anderson, K. N., Potter, A. C., Piccenna, L. G., Quah, A. K., Davies, K. E., Cheema, S. S. Isolation and culture of motor neurons from the newborn mouse spinal cord. Brain Res Prot. 12 (3), 132-136 (2004).
- Gingras, M., Gagnon, V., Minotti, S., Durham, H. D., Berthod, F. Optimized protocols for isolation of primary motor neurons, astrocytes and microglia from embryonic mouse spinal cord. J Neurosci Methods. 163 (1), 111-118 (2007).
- Brewer, G. J., et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Su, M., Zhong, W., Ren, S. Dose-dependent protection of reseveratrol against spinal cord ischemic-reperfusion injury in rats. Trop J Pharm Res. 15 (6), 1225-1233 (2016).
- Haapanen, H., et al. Remote ischemic preconditioning protects the spinal cord against ischemic insult: An experimental study in a porcine model. J Thorac Cardiovasc Surg. 151 (3), 777-785 (2016).
- Conrad, M. F., Ye, J. Y., Chung, T. K., Davison, J. K., Cambria, R. P. Spinal cord complications after thoracic aortic surgery: long-term survival and functional status varies with deficit severity. J Vasc Surg. 48 (1), 47-53 (2008).
- Wong, D. R., et al. Delayed spinal cord deficits after thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 83 (4), 1345-1355 (2007).
- Freeman, K. A., et al. Alpha-2 agonist attenuates ischemic injury in spinal cord neurons. J Surg Res. 195 (1), 21-28 (2015).
- Freeman, K. A., et al. Spinal cord protection via alpha-2 agonist-mediated increase in glial cell-line-derived neurotrophic factor. J Thorac Cardiovasc Surg. 149 (2), 578-586 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved