Method Article
Aislamiento y Cultura de Neuronas de la Médula Espinal de Ratones Neonatales
En este artículo
Resumen
Este estudio presenta una técnica para el aislamiento de neuronas de ratones neonatales WT. Requiere la cuidadosa disección de la médula espinal del ratón neonatal, seguida de la separación de las neuronas del tejido de la médula espinal mediante escisión mecánica y enzimática.
Resumen
Presentamos un protocolo para el aislamiento y cultivo de neuronas de la médula espinal. Las neuronas se obtienen a partir de ratones C57BL / 6 neonatales y se aíslan el día 1-3 postnatal. Una litera de ratón, generalmente 4-10 cachorros nacidos de un par reproductor, se recolecta para un experimento, y las médulas espinales se recogen individualmente de cada ratón después de la eutanasia con isoflurano. La columna vertebral se disecciona y luego la médula espinal se libera de la columna. Las médulas espinales se cortan entonces para aumentar el área superficial de suministro para una proteasa enzimática que permite que las neuronas y otras células sean liberadas del tejido. La trituración se utiliza entonces para liberar las células en solución. Esta solución se fracciona posteriormente en un gradiente de densidad para separar las diversas células en solución, permitiendo que las neuronas sean aisladas. Aproximadamente 1-2.5 x 10 6 neuronas se pueden aislar de un grupo de la litera. Las neuronas se sembraron luego en pocillos recubiertos con adhesivoRs que permiten un crecimiento y maduración adecuados. Las neuronas tardan aproximadamente 7 días en alcanzar la madurez en el medio de crecimiento y cultivo y pueden utilizarse posteriormente para tratamiento y análisis.
Introducción
La comprensión de la patología de la médula espinal requiere el uso de varios modelos, tanto en los niveles macroscópico y microscópico. Los modelos animales grandes y pequeños 1 , 2 , 3 se usan para investigaciones in vivo de la enfermedad y lesión de la médula espinal. Mientras que el estudio de estos temas in vivo tiene sus méritos, el análisis de la médula espinal se limita a toda la médula espinal homogenado o tejido secciones [ 4] . Esto crea cierta ambigüedad al tratar de aislar respuestas específicas y objetivos en la médula espinal entre sus neuronas residentes y la glía circundante. La creciente disponibilidad de ratones manipulados genéticamente permite realizar investigaciones más detalladas de la biología a nivel celular y molecular. Por lo tanto, un modelo de ratón neonatal se utiliza aquí, lo que permite el estudio de las propiedades únicas y la biología de las neuronas de la médula espinal in vitro .
El aislamiento y el mantenimiento de las neuronas in vitro no es particularmente sencillo.Existe una abundancia relativa de técnicas para el aislamiento neuronal del tejido cortical de los roedores adultos que parecen resultar en un número sustancial de neuronas aisladas ( es decir, millones) 5 , 6 , 7. En cambio, el rendimiento de las neuronas del tejido de la médula espinal es inferior 8 , 9 , 10 , en parte debido a la menor masa de tejido, y en los ratones existe una relativa escasez de técnicas para el aislamiento de neonatos Las neuronas de la médula espinal y los métodos existentes están limitados por rendimientos de neuronas más bajos ( es decir, cientos) 9 o por técnicas laboriosas y pesadas en recursos que requieren el aislamiento de ratones embrionarios 10 .En este protocolo,Utilice una técnica que permita el aislamiento económico y eficaz de un número sustancial de neuronas de las médulas espinales de los ratones neonatales. Como es común en las técnicas publicadas anteriormente, utilizamos la papaína como una proteasa enzimática, lo que permite la liberación de neuronas del tejido de la médula espinal 5 , 6 . Además, se utiliza un gradiente de densidad para la separación refinada de células, que se ha demostrado que es eficaz 6 , 10 . Mientras que el medio en el que las células se incuban puede variar, en nuestra experiencia y como se publicó anteriormente 11 , la suplementación con el suplemento de medio de cultivo B27 fresco ha demostrado ser crítico para la longevidad de las neuronas. Las neuronas son típicamente viables hasta 10 días, permitiendo que se realice el tratamiento.
Protocolo
El cuidado y tratamiento de los animales en este procedimiento se llevaron a cabo de acuerdo con las directrices del Comité Institucional de Cuidado y Uso de Animales en la Universidad de Colorado.
1. Preparación de soluciones
- Preparar y almacenar todas las soluciones a temperaturas apropiadas, como se muestra en la Tabla 1 .
2. Recubrimiento de pozos y diapositivas
NOTA: Las neuronas no se adhieren bien a superficies de plástico o vidrio.
- Un día antes del aislamiento de las neuronas, se cubren los pocillos de una placa de cultivo estéril de 24 pocillos con 0,5 ml de Poly-D-Lisina (PDL, Tabla 2 ) y se deja en una capa de flujo laminar O / N.
NOTA: El método preferido es usar placas de 24 pocillos y cubrir solamente los pocillos centrales, ya que la evaporación de los pocillos periféricos tiende a ser más acelerada y conducir a resultados inconsistentes. Adicionalmente, se pueden colocar diapositivas de vidrio dentro de los pocillos antes de tO revestimiento. Las neuronas se unirán a las diapositivas de vidrio revestidas y se pueden retirar posteriormente para obtener imágenes microscópicas adicionales . - El día del aislamiento, retire el PDL de los pozos. Lavar con agua estéril durante unos minutos antes de retirar el agua restante y dejar que se seque durante 1 h (ver más abajo).
- Después del secado, cubrir los portaobjetos con laminina ( Tabla 2 ).
NOTA: Aproximadamente 10 μl de laminina (10 μg / μl) es suficiente para revestir cada pocillo de una placa estéril de 24 pocillos. Esto se mezcla con 340 μl de medio (volumen total: 350 μl) para cubrir todo el pocillo. Dejar reposar durante 2 h a RT en una campana de cultivo y luego aspirar antes de recubrir las células.
3. Cosechando las Cuerdas Espinales
NOTA: Todos los instrumentos deben esterilizarse en autoclave (135 ° C y 30 psi durante 4 ciclos de 7 min) para la esterilidad.
- Euthanize cachorros de ratón C57BL / 6 de un día de edad en una cámara con isoflurano. Espere30 s después de la cesación del movimiento y pellizcar la pierna para confirmar la falta de respuesta.
- Separar la cabeza del cuerpo usando tijeras, con el cachorro en la posición prona.
- Estabilice las patas traseras o la cola y los brazos en la mesa de procedimientos, con el lado dorsal hacia el usuario.
- Corte la piel usando tijeras de iris curvadas.
- Corte la médula espinal de la región lumbar justo por encima de las caderas y proceda a cortar ambos lados del tórax para separarlo del cuerpo.
NOTA: Esto requiere la disección cuidadosa de la médula espinal de los órganos viscerales para evitar daños inadvertidos a otros órganos ( Figura 1a ). - Se lava secuencialmente durante 10 s en placas de Petri de 3 x 10 cm que contienen 5 ml de solución salina tamponada con fosfato (PBS) esterilizada con filtro de 0,2 μm para eliminar el exceso de tejido.
- Inserte una aguja de 22 G y una jeringa llena de 5 mL de PBS esterilizado con filtro en el extremo caudal de la columna vertebral y enjuague cranealmente, permitiendo que el cordón tO salida en una cuarta placa de Petri ( Figura 1b ).
- Recoger la médula espinal en un tubo de 15 mL con 5 mL de HABG ( Tabla 1 ) sobre hielo. Tenga cuidado de no aplastar la médula espinal.
- Repita los pasos 3.1-3.8 para cada cachorro en la litera.
NOTA: Idealmente, este proceso debe tomar menos de 30 min por médula espinal para asegurar el aislamiento sano de las neuronas.
4. Aislamiento de las neuronas
NOTA: El siguiente paso debe realizarse en una campana de flujo laminar. Se espera una familiaridad con la técnica estéril básica.
- Huevo de Tejido
- Tome el tubo que contiene las cuerdas espinales y agite ligeramente para suspender el tejido.
- Vierta el tejido del tubo en una placa de Petri de vidrio de 60 mm y pásela con una hoja de afeitar para crear piezas finas de ~ 0,5 mm de tamaño.
- Transferir el tejido con una pipeta de diámetro ancho en un tubo de 15 ml que contiene 5 ml de HABG.
- Colóquelo en un30 ° C durante 30 min para permitir que las células se equilibren a esta temperatura. Mantenga las células en un agitador lo suficiente como para permitir que se suspendan en el líquido.
NOTA: Este paso se hace para evitar el choque de las células tras la transferencia de hielo al medio de digestión. Mantener las células a 30 ° C ayuda a disminuir la muerte celular asociada con un metabolismo de otro modo aumentado a 37 ° C.
- Preparar el medio de digestión ( Tabla 1 ).
- Preparar el gradiente de densidad (Tabla 1).
- Prepare cada una de las 4 capas en 4 tubos separados de 15 mL, como se indica en la Tabla 1 .
- Añadir 1 ml de cada capa en un nuevo tubo de 15 ml. Comience con la capa 1 en la parte inferior y agregue secuencialmente hasta llegar a la capa 4 en la parte superior. Evite perturbar las capas mientras agrega.
- Lave las placas recubiertas de PDL de la etapa 2.2. Lavar con agua estéril durante unos minutos antes de retirar el agua restante yPermitiendo que se sequen durante 1 h.
- Transferir el tejido al medio de digestión.
- Retirar el tubo que contiene los tejidos del baño de agua agitador a 30 ° C y dejar reposar durante unos minutos.
- Retirar el tubo del medio de digestión del baño de agua a 37 ° C y aspirarlo en una jeringa de su-lock.
- Aspirar el exceso de HABG del tubo que contiene los tejidos.
- Utilice un filtro su-lock de 0,2 μm en la jeringa para añadir medio de digestión al tubo que contiene tejido.
- Colocar el tubo en un baño de agua a 30 ° C durante 30 min. Mantenga las células temblando lo suficiente como para permitir que se suspendan en el líquido.
NOTA: Es importante no mantener las células en el medio de digestión durante demasiado tiempo o dejar que la temperatura se eleve demasiado, lo que podría conducir a una digestión excesiva y dar lugar a que el tejido se suspenda en una mezcla gelatinosa.
- Durante este período, se cubre la laminina como en el paso 2.3.
- Realizar la trituración ( es decir, separar las células del tejido).
- Retire el tubo del baño de agua templado a 30 ° C y deje reposar durante unos minutos.
- Aspirar el exceso de medio de digestión.
- Suspender el tejido en 2 mL de HABG.
- Usando una pipeta de ánima estrecha, tritura 10 x durante 45 s.
NOTA: Este es probablemente el paso más importante y puede disminuir significativamente el rendimiento si no se hace correctamente.- Aspirar el tejido en la pipeta y vaciar inmediatamente el contenido.
- Evitar la introducción de aire, ya que disminuirá significativamente el rendimiento viable.
NOTA: La pipeta ideal es una pipeta de vidrio de 9 "La punta de la pipeta debe ser pulida con fuego para suavizar las superficies rugosas Luego debe ser siliconada colocando en una solución 1:20 de diclorodimetilsilano (DMDCS) en cloroformo La pipeta debe ser removida y dejada secar al aire.Debe esterilizarse en autoclave.
Precaución: El DMDCS y el cloroformo son altamente inflamables, y la siliconización debe realizarse en una campana extractora.
- Aspirar la parte superior de 2 ml de sobrenadante y colocarlo en un nuevo tubo de 15 ml denominado "colección".
- Repita los pasos 4.7.3-4.7.5 dos veces adicionales (el tubo de recolección de células debe tener 6 mL al final).
- Transferir lentamente el contenido del tubo de recogida en el tubo de gradiente preparado en el paso 4.2, evitando la interrupción del gradiente.
- En este punto, retire el medio neurobasal previamente preparado ( Tabla 1 ) del refrigerador y deje que se caliente en un baño a 37ºC.
- Purificar las neuronas.
- Centrifugar el tubo de gradiente durante 15 minutos a 800 xg y 22 ° C.
- Recoja la (s) capa (s) deseada (s) con una pipeta ( Figura 2 ) y colóquela en un nuevo tubo de 15 ml. Para el neuro más puroN aislamiento ( es decir > 90%), recoja la capa 3. Para obtener más rendimiento con menos pureza ( es decir, > 70-80%), recoja las capas 2 y 3.
- Diluir el gradiente de densidad añadiendo 5 mL de HABG a las capas recién recolectadas.
- Centrifugar a 200 xg durante 2 min a 22 ° C.
- Deseche el sobrenadante, vuelva a suspender en 5 mL de HABG y pellizque el sedimento para suspender las células.
- Centrifugar durante 2 min 200 xg a 22 ° C.
- Deseche el sobrenadante, resuspenda en 3 ml de medio neurobasal y pellizque el sedimento para resuspender las células.
- Cuente las celdas.
- Tomar 10 μL de la solución, ahora con células en medio neurobasal, y mezclar con 10 μl de azul Trypan.
- Colocar 10 μL de esta mezcla en una cámara de recuento de vidrio.
- Usando una cámara de recuento de vidrio estándar, cuente el número de células en cada uno de los cuatro cuadrantes de 4 x 4. Agregue todas las celdas contadas (n), multi(Factor de dilución), dividir por 4 (número de cuadrantes contados), multiplicar por 3 (volumen de medio neurobasal) y multiplicar por 10 4 para obtener la concentración de células en células / ml.

- Sembrar las células en las placas de cultivo
- Diluir la suspensión celular a 300.000 células en 1 mL de medio neurobasal.
NOTA: Sobre la base de la concentración de células obtenida en los pasos anteriores, se añade medio neurobasal adicional para obtener una concentración final de 3 * 10 5 células / ml. La ecuación es C 1 V 1 = C 2 V 2 , donde C 1 es la concentración inicial de células obtenidas de la cosecha; V $ ₁ $ es de 3 ml; Y C $ ₂ $ es de 3 x 10 $ ⁵ $ células / ml, como se discutió anteriormente. La ecuación se resuelve para V2. Añadir el volumen de neurobasal medio necesario para hacer el volumen total de células en solución igual aV 2 . - Agitar suavemente para distribuir las células en solución y agregar 1 ml a cada pocillo en las placas de 24 pocillos recubiertos.
- Diluir la suspensión celular a 300.000 células en 1 mL de medio neurobasal.
Resultados
Utilizando esta técnica, una sola camada (4-10 cachorros) permite el aislamiento de 1-2.5 10 6 neuronas adecuadas para siembra en placas de cultivo. Típicamente, se sembran 4-8 pocillos a la concentración mencionada anteriormente ( es decir, 300.000 células / ml). La Figura 3 demuestra la aparición de neuronas a esta concentración después de una semana en cultivo a microscopía de luz de aumento de baja ( a ) y alta ( b ). Sin embargo, también hemos sido capaces de cultivar células en concentraciones tan altas como 500.000 células / pocillo y tan bajas como 100.000 células / pocillo. El uso de las concentraciones más altas requiere más atención mediana y cuidadosa a las condiciones ambientales, ya que los nutrientes pueden ser agotados rápidamente, dando lugar a un ambiente ácido tóxico para las células. Con concentraciones más bajas, las células tienden a no alcanzar la madurez completa, y un crecimiento excesivo de células de soporte ( es decir , oligodendrocitos, miCroglia y astrocitos).
Las células empezarán típicamente a adherirse a la superficie dentro de las primeras dos horas ( Figura 4a ). Los axones comenzarán a brotar dentro de las primeras 24-48 h ( Figura 4b- 4c ). Las conexiones entre varias neuronas en el cultivo típicamente alcanzan la madurez a los 7 días ( Figura 4d ), momento en el que los experimentos se llevan a cabo típicamente en las neuronas.
Las neuronas son identificables bajo microscopía óptica, ya que tienen proyecciones axonales distintas. Nuestros aislamientos utilizando la capa 3 ( Figura 2 ) produce ~ 80-90% de neuronas en el cultivo. Esto se confirmó utilizando la tinción inmunofluorescente de marcadores neuronales específicos. En la figura 5c , la proteína citoesquelética de la neurona proteína asociada a microtúbulos 2 (MAP2) es sMostrando contornos y proyecciones axonales de las neuronas después de una semana en cultivo. De manera similar, en la Figura 6c , el marcador nuclear neuronal específico NeuN está teñido, mostrando núcleos neuronales. Estos marcadores neuronales se combinan con imágenes de núcleo (DAPI, Figura 5a , 6a ) y citoplasma (GFP, Figura 5b , 6b ), y las imágenes resultantes se combinan ( Figura 5d , 6d ), detallando la abundancia relativa de neuronas con otras células en cultura. Cuando se usan las capas 2 y 3, el rendimiento de las neuronas es ligeramente superior; Sin embargo, tienden a haber menos neuronas en la solución pura (~ 70%).

Figura 1: columna vertebral disecada y médula espinal liberada de un ratón neonatal de 3 días de edad. losFlecha en ( a ) puntos hacia el extremo caudal de la columna vertebral, donde se inserta una aguja para liberar la médula espinal. Una médula espinal liberada ( b ) se muestra sumergida en PBS. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Gradiente de densidad, con células añadidas después de la centrifugación. Las capas son esbozadas y mejor visualizadas en la representación de dibujos animados. La capa más superficial (0) es generalmente restos del tejido de la médula espinal. La capa 1 es rica en oligodendrocitos y astrocitos. Las capas 2 y 3 contienen la mayoría de las neuronas. Mientras que la capa 3 contiene neuronas con la mayor pureza, algunas células de soporte ( es decir, astrocitos y oligodendrocitos) se encuentran en la capa 2. El peLlet en la parte inferior contiene principalmente células microgliales. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Microscopía de luz de cultivos de células neuronales después de 7 días de aislamiento. A una ampliación de 10X ( a ), se pueden ver conexiones axonales entre varios conglomerados de neuronas. En la ampliación 40X ( b ), las neuronas pueden ser visualizadas más de cerca con sus proyecciones axonales. Haga clic aquí para ver una versión más grande de esta figura.
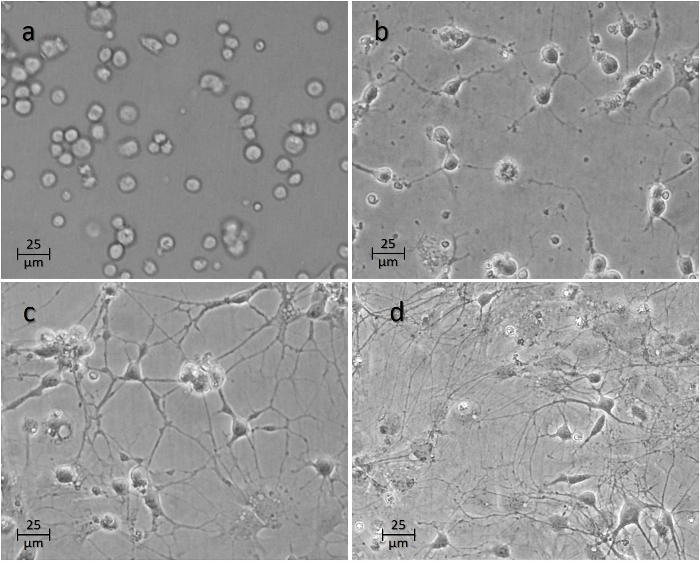
> Figura 4: Curso de tiempo de las neuronas después de la siembra en los pozos. La imagen ( a ) muestra las células 1 h, ( b ) 24 h, ( c ) 48 h, y ( d ) 1 semana después de la siembra. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Coloración inmunofluorescente de las neuronas utilizando Marcador Citoesquelético Neuronal MAP2. La tinción nuclear (DAPI) se muestra en azul ( a ), con tinción citoplasmática (GFP) en verde ( b ) y proteína citoesquelética neuronal (MAP2) en rojo ( c ). Las imágenes fusionadas ( d ) se combinan, mostrando la abundancia relativa de neuronas.Target = "_ blank"> Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Coloración inmunofluorescente de las neuronas utilizando Neuronal marcador nuclear NeuN. La tinción nuclear (DAPI) se muestra en azul ( a ), con tinción citoplasmática (GFP) en verde ( b ) y núcleos neuronales (NeuN) en rojo ( c ). Las imágenes fusionadas ( d ) se combinan, mostrando la abundancia relativa de neuronas. Haga clic aquí para ver una versión más grande de esta figura.
| Medios de comunicación | Almacenamiento | Ingredientes | Preparación | ||
| HABG | 4 ° C / 24h | 100 ml | - Descongelar B27 en refrigerador 4 ° C O / N - Esterilizar el filtro (0,22 μm) | ||
| Hibernar A | 97,8 ml | ||||
| B27 [2%] | 2 ml | ||||
| GlutaMAX [0,5 mM] | 0,25 ml | ||||
| Medios Neurobasal | 4 ° C / 1 semana | 100 ml | - Descongelar B27 en refrigerador 4 ° C O / N - Esterilizar el filtro (0,22 μm) - Alícuota de porciones de 50 ml en tubos de 50 ml (almacenar a 4 ° C) | ||
| Neurobasal A | 97 ml | ||||
| B27 [2%] | 2 ml | ||||
| GlutaMAX [0,5 mM] | 0,25 ml | ||||
| Pen / Strep [1%] | 1 ml | ||||
| Medios de digestión | Día del aislamiento | 10 ml | - Agite vigorosamente - Dejar reposar en baño a 37 ° C durante 30 min (idealmente preparado 30 minutos antes del uso) - Esterilizar el filtro (0,22 μm) | ||
| HA-Ca | 10 ml | ||||
| Papaína | 25 mg | ||||
| GlutaMAX [0,5 mM] | 0,025 ml | ||||
| Gradiente de densidad | Día del aislamiento | 1 Gradiente | |||
| Capa | OptiPrep | HABGRAMO | |||
| (0,13 ml) | (5,29 ml) | ||||
| 1 Parte inferior | 0,26 ml | 1,24 ml | |||
| 2 | 0,19 ml | 1,31 mL | |||
| 3 | 0,15 ml | 1,35 ml | |||
| 4 Arriba | 0,11 ml | 1,39 ml | |||
Tabla 1: Preparación de los medios y soluciones utilizados en este Protocolo.
| Sustrato de revestimiento | Almacenamiento | Ingredientes | Preparación | |
| PDL | - 20 ° C Congelar-descongelar una vez | Poli-D-lisina hidrobromuro | 5 mg | - Alícuota de 4 ml en tubos de 15 ml y almacenar inmediatamente a -20 ° C - 0,5 ml / pocillo (placa de 24 pocillos) |
| Agua esteralizada | 50 ml | |||
| Laminina | Día de recubrimiento | La laminina (1 mg / ml) | 80 μL | - Suficiente para 8 pozos en una placa de 24 pocillos - 0,35 ml / pocillo (placa de 24 pocillos) |
| Medio Neurobasal | 2,72 ml | |||
Vskip1.000000 baselineskip TABLA 2 Preparación de los sustratos de revestimiento usados para revestir los pocillos sobre los cuales se cultivan las neuronas.
Discusión
Esta técnica permite el cultivo confiable de las neuronas de la médula espinal. Una vez que la habilidad en la técnica se logra, se tarda aproximadamente 3,5 horas en completarse. Hemos podido llevar a cabo el aislamiento de neuronas de 2 camadas separadas (16 ratones en total) en aproximadamente 4 h. El paso clave en la factibilidad es ser capaces de extraer de manera competente las médulas espinales de los ratones. El rendimiento permite el chapado de varios pozos y la capacidad de probar las neuronas en diversas condiciones. Hemos sido capaces de tratar las neuronas después de la madurez y para evaluar de forma fiable la expresión de la proteína mediante el análisis de transferencia de Western. Además, el uso de diapositivas de vidrio en el interior de los pozos de fijación de las neuronas permite el análisis de tinción adicional de las neuronas.
Este procedimiento es ventajoso porque no requiere tejido embrionario y la intensidad de mano de obra asociada. Además, no es necesario usar médulas espinales adultas para recolectar suficiente tejido paraE aislamiento neuronal. Esto evita que el factor de edad composición de comportamiento en la fisiología neuronal, como se observa con ratones adultos. Sin embargo, esta técnica no está exenta de limitaciones. Como se mencionó anteriormente, las neuronas envejecidas se excluyen mediante el uso de ratones neonatales, y esto puede ser una limitación si el comportamiento relacionado con la edad y la biología es el área de investigación. Hay una curva de aprendizaje para el procedimiento, que es necesario no sólo para optimizar el rendimiento, sino para asegurar que las neuronas aisladas son saludables. La técnica de extracción de la médula espinal puede tomar algún tiempo para dominar, especialmente con los ratones recién nacidos. Hemos observado que el tiempo prolongado asociado con la extracción de las médulas espinales conduce a neuronas que se pueden cultivar durante un período significativamente más corto. Esto es algo aliviado por la colocación de las neuronas en el hielo; Sin embargo, el tiempo todavía juega un papel clave.
Hay pasos clave en el procedimiento que ayudan a asegurar el rendimiento óptimo de las neuronas. Si el rendimiento de la neurona no es como eSe deben evaluar algunos pasos. En primer lugar, el número de médulas espinales debería ser idealmente superior a 4. Cuando se utilizan 3 médulas espinales o menos, el rendimiento es generalmente inferior a 1 millón de neuronas. Se debe asegurar una preparación adecuada del medio de digestión (paso 4.5). Dejar el tejido durante demasiado tiempo en el medio de digestión causará una descomposición excesiva de las células, mientras que el uso de un medio de digestión que no se ha activado a 37 ° C resultará en menos neuronas aisladas. Finalmente, la técnica de trituración (paso 4.7) debe realizarse con precisión. Los rendimientos bajos suelen ser el resultado de una trituración inadecuada. Un buen indicador es ver si la solución se vuelve turbia durante la trituración - si esto no sucede, es probable que la trituración sea demasiado suave.
Si el rendimiento es el esperado, pero las neuronas no parecen regenerar los procesos dentro de los primeros 1-2 días, el problema suele ser un fracaso en el revestimiento adecuado, ya sea con un lavado inadecuadoO secado (etapa 2.2). Si las células inicialmente proyectan procesos pero posteriormente se convierten en apoptóticos antes de la marca de 5-7 días, podría haber varios problemas. En primer lugar, asegúrese de que la solución de HABG se prepara en las 24 h de aislamiento y que se utiliza el suplemento de B27 fresco que se ha descongelado el mismo día de la preparación de HABG. Los antioxidantes en este suplemento necesitan ser frescos y no expirados. A continuación, asegúrese de que no se introduzcan burbujas durante el proceso de trituración (paso 4.7). La introducción de burbujas de aire contribuye a esta cuestión y puede estar relacionada con el secado de las neuronas. Además, asegúrese de que el cultivo no está abrumado con la contaminación, que se puede atribuir a los fallos en la esterilidad.
Aquí, describimos el uso de placas de 24 pocillos sobre los cuales se sembraron las neuronas. A veces, es necesario llevar a cabo tiempo y / o ensayos de dosificación, como cuando se utilizan agentes farmacológicos. La técnica puede ser modificada y las neuronas pueden ser sembradas en 48 pocillosEn su lugar. Dado que la superficie de un pocillo en una placa de 48 pocillos es la mitad de la que se encuentra en una placa de 24 pocillos, los volúmenes de soluciones de revestimiento utilizados deben cortarse por la mitad. Las células también deben recubrirse a la mitad del volumen ( es decir, 0,5 ml en lugar de 1,0 ml). Sin embargo, su concentración debe permanecer la misma ( es decir, 1-5 x 10 5 células / ml). Aunque este estudio se ha llevado a cabo usando ratones C57BL / 6, la técnica debería ser aplicable a través de otras cepas manipuladas genéticamente.
La isquemia y la protección de la médula espinal es un área de creciente interés 12 , 13 , 14 . Clínicamente, la cirugía de la aorta toracoabdominal puede resultar en una parálisis devastadora relacionada con la isquemia y la reperfusión de la médula espinal, cuya fisiopatología sigue siendo completamente comprendida 15 , 16 . Comprender cómo responden las neuronasEl estrés de la isquemia es factible utilizando este modelo. Nuestro grupo ha publicado previamente sobre lesión neuronal medular relacionada con el insulto isquémico a través de la privación de glucosa de oxígeno utilizando esta técnica [ 17] . El modelo también se ha ampliado para incluir el cultivo de astrocitos, independiente de las neuronas [ 18] .
En conclusión, esta técnica es valiosa para el estudio de la fisiopatología de la médula espinal y la microbiología neuronal. El cultivo libre de suero permite un control ambiental preciso. Permite el acceso directo para la aplicación de agentes farmacológicos. Combinada con técnicas adicionales, como la privación de la glucosa del oxígeno, esta técnica puede ser útil para ampliar nuestra comprensión de la fisiopatología de la isquemia determinante de la médula espinal.
Divulgaciones
Los autores no tienen revelaciones.
Agradecimientos
Los autores no tienen reconocimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Hibernate A Medium - 500 mL | Thermo-Fisher | A1247501 | https://www.thermofisher.com/order/catalog/product/A1247501 |
| Hibernate A Minus Calcium - 500 mL | Brainbits | HA-Ca | http://www.brainbitsllc.com/hibernate-a-minus-calcium/ |
| Glutamax 100X - 100 mL | Thermo-Fisher | 35050061 | https://www.thermofisher.com/order/catalog/product/35050079 |
| B27 Supplement 50X - 10 mL | Thermo-Fisher | 17504044 | https://www.thermofisher.com/order/catalog/product/17504044 |
| Papain, Lyophilized - 100 mg | Worthington | LS003119 | http://www.worthington-biochem.com/pap/cat.html |
| Neurobasal A Medium - 500 mL | Thermo-Fisher | 10888022 | https://www.thermofisher.com/order/catalog/product/10888022 |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo-Fisher | 15140122 | https://www.thermofisher.com/order/catalog/product/15140122 |
| Poly-D-Lysine (PDL) hydrobromide - 5 mg | Sigma-Aldrich | P6407-5MG | http://www.sigmaaldrich.com/catalog/product/sigma/p6407?lang=en®ion=US |
| Mouse Laminin - 1 mg | Thermo-Fisher | 23017015 | https://www.thermofisher.com/order/catalog/product/23017015 |
| Trypan Blue - 20 mL | Sigma-Aldrich | T8154-20ML | http://www.sigmaaldrich.com/catalog/product/sigma/t8154?lang=en®ion=US |
| OptiPrep Density Gradient Medium - 250 mL | Sigma-Aldrich | D1556-250ML | http://www.sigmaaldrich.com/catalog/product/sigma/d1556?lang=en®ion=US |
| Dichlorodimethylsilane (DMDCS, Sigma Silicoat) | Sigma-Aldrich | 440272-100ML | http://www.sigmaaldrich.com/catalog/product/aldrich/440272?lang=en®ion=US |
| Chloroform | Sigma-Aldrich | 288306-1L | http://www.sigmaaldrich.com/catalog/product/sial/288306?lang=en®ion=US |
| Glass Pippette - 9" | Sigma-Aldrich | 13-678-20C | http://www.sigmaaldrich.com/catalog/product/sigma/cls7095d9?lang=en®ion=US |
| Pipette bulb - 5 mL | Sigma-Aldrich | Z186678-3EA | http://www.sigmaaldrich.com/catalog/product/aldrich/z186678?lang=en®ion=US&cm_sp=Insite-_-prodRecCold_xviews-_-prodRecCold10-1 |
| BRAND® Petri dish, glass - 60 x 15 mm | Sigma-Aldrich | BR455717-10EA | http://www.sigmaaldrich.com/catalog/product/aldrich/br455717?lang=en®ion=US |
| Sterile 24-Well Cell Culture Plate | Sigma-Aldrich | M8812-100EA | http://www.sigmaaldrich.com/catalog/product/sigma/m8812?lang=en®ion=US |
| Hausser Hemacytometer (glass counting chamber) | Fischer Scientific | 02-671-6 | https://www.fishersci.com/shop/products/hausser-bright-line-phase-hemacytometer-hemacytometer/026716 |
| Glass Slides - 12 mm sterile cover glass - uncoated | Neuvitro | GG-12-1.5-Pre | http://www.neuvitro.com/german-coverslip-12mm-diameter.htm |
| NeuN Rabbit Monoclonal Antibody - 100 µL | Abcam | ab177487 | After fixing in paraformaldehyde (PFA) and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:200 for 18 h in 4 °C |
| MAP-2 Mouse Monoclonal Antibody - 50 µL | Abcam | ab11267 | After fixing in paraformaldehyde and blocking with 5% BSA, cells on a 12 mm coverslip were incubated in the antibody diluted 1:500 for 18 h in 4 °C |
Referencias
- Qayumi, A. K., et al. Animal model for investigation of spinal cord injury caused by aortic cross-clamping. J Invest Surg. 10 (1-2), 47-52 (1997).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Taira, Y., Marsala, M. Effect of proximal arterial perfusion pressure on function, spinal cord blood flow, and histopathologic changes after increasing intervals of aortic occlusion in the rat. Stroke. 27 (10), 1850-1858 (1996).
- Stoppini, L., Buchs, P. -A., Muller, D. A simple method for organotypic cultures of nervous tissue. J Neurosci Methods. 37 (2), 173-182 (1991).
- Ahlemeyer, B., Baumgart-Vogt, E. Optimized protocols for the simultaneous preparation of primary neuronal cultures of the neocortex, hippocampus and cerebellum from individual newborn (P0. 5) C57Bl/6J mice. J Neurosci Methods. 149 (2), 110-120 (2005).
- Brewer, G. J., Torricelli, J. R. Isolation and culture of adult neurons and neurospheres. Nat Protoc. 2 (6), 1490-1498 (2007).
- Banker, G. A., Cowan, W. M. Rat hippocampal neurons in dispersed cell culture. Brain Res. 126 (3), 397-425 (1977).
- Graber, D. J., Harris, B. T. Purification and culture of spinal motor neurons from rat embryos. Cold Spring Harb Protoc. 2013 (4), 319-326 (2013).
- Anderson, K. N., Potter, A. C., Piccenna, L. G., Quah, A. K., Davies, K. E., Cheema, S. S. Isolation and culture of motor neurons from the newborn mouse spinal cord. Brain Res Prot. 12 (3), 132-136 (2004).
- Gingras, M., Gagnon, V., Minotti, S., Durham, H. D., Berthod, F. Optimized protocols for isolation of primary motor neurons, astrocytes and microglia from embryonic mouse spinal cord. J Neurosci Methods. 163 (1), 111-118 (2007).
- Brewer, G. J., et al. Optimized survival of hippocampal neurons in B27-supplemented Neurobasal, a new serum-free medium combination. J Neurosci Res. 35 (5), 567-576 (1993).
- Fang, B., et al. Ischemic preconditioning protects against spinal cord ischemia-reperfusion injury in rabbits by attenuating blood spinal cord barrier disruption. Int J Mol Sci. 14 (5), 10343-10354 (2013).
- Su, M., Zhong, W., Ren, S. Dose-dependent protection of reseveratrol against spinal cord ischemic-reperfusion injury in rats. Trop J Pharm Res. 15 (6), 1225-1233 (2016).
- Haapanen, H., et al. Remote ischemic preconditioning protects the spinal cord against ischemic insult: An experimental study in a porcine model. J Thorac Cardiovasc Surg. 151 (3), 777-785 (2016).
- Conrad, M. F., Ye, J. Y., Chung, T. K., Davison, J. K., Cambria, R. P. Spinal cord complications after thoracic aortic surgery: long-term survival and functional status varies with deficit severity. J Vasc Surg. 48 (1), 47-53 (2008).
- Wong, D. R., et al. Delayed spinal cord deficits after thoracoabdominal aortic aneurysm repair. Ann Thorac Surg. 83 (4), 1345-1355 (2007).
- Freeman, K. A., et al. Alpha-2 agonist attenuates ischemic injury in spinal cord neurons. J Surg Res. 195 (1), 21-28 (2015).
- Freeman, K. A., et al. Spinal cord protection via alpha-2 agonist-mediated increase in glial cell-line-derived neurotrophic factor. J Thorac Cardiovasc Surg. 149 (2), 578-586 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados