Method Article
Диссекция и культура мышей эмбриональной почки
В этой статье
Резюме
Этот протокол описывает метод выделения и культивирования метанефрических зачатков из эмбрионов мыши.
Аннотация
Цель этого протокола - описать метод вскрытия, выделения и культивирования метанефрических рудиментов мыши.
Во время развития почки млекопитающих две ткани-предшественники, уретеровая почка и метанефрическая мезенхима, общаются и взаимно индуцируют клеточные механизмы, чтобы в конечном итоге сформировать систему сбора и нефроны почки. Поскольку эмбрионы млекопитающих растут внутриутробно и поэтому недоступны для наблюдателя, была разработана культура органов. С помощью этого метода можно изучать эпителиально-мезенхимальные взаимодействия и клеточное поведение во время органогенеза почек. Кроме того, можно исследовать происхождение врожденных пороков развития почек и урогенитального тракта. После тщательного вскрытия метанефрические рудименты переносятся на фильтр, который плавает на питательной среде и может храниться в инкубаторе для культивирования клеток в течение нескольких дней. Однако необходимо знать, что условияИскусственно и может влиять на обмен веществ в ткани. Кроме того, проникновение испытываемых веществ может быть ограничено из-за внеклеточного матрикса и базальной мембраны, присутствующих в эксплантате.
Одним из главных преимуществ органной культуры является то, что экспериментатор может получить прямой доступ к органу. Эта технология дешевая, простая и допускает большое количество модификаций, таких как добавление биологически активных веществ, изучение генетических вариантов и применение передовых методов визуализации.
Введение
The mammalian kidney is derived from two primordial structures with mesodermal origin: the tubular epithelial ureteric bud and the metanephric mesenchyme. During nephrogenesis, the ureteric bud invades the metanephric mesenchyme and branches to form the collecting system. The metanephric mesenchyme gives rise to the epithelial elements of the nephrons. These processes occur in a precisely timed and spatially coordinated manner and are initiated by reciprocal inductive mechanisms. Both tissue components communicate and affect the other's cell morphogenesis.
In the 1920s, it was Boyden who performed the in vivo obstruction of the mesonephric duct in chicken, providing the first indication of inductive interactions as separated nephric blastema fail to differentiate1. At about the same time, the first successful attempts to culture chicken nephric rudiments in a hanging drop were published. Subsequently, the organ culture was developed to study tissue interactions in mammalian organogenesis. In the 1950s, Grobstein developed a technique in which metanephric rudiments could be cultured on a filter. This technique was modified by Saxén, who placed the filter on a Trowell-type screen in a culture dish1. Over the years, many modifications and applications for organ culture have emerged. The method described here is based on Saxén's technique but is simplified, as the filters float free on the medium and the diameter of the culture well only slightly exceeds the diameter of the filter, limiting unwanted movement of the filter.
Whole-organ culture is a classical, cheap, and simple but powerful tool to investigate cellular processes and intercellular communication during organogenesis. Organ culture allows for treatment with biological agents, such as growth factors, antibodies, antisense oligonucleotides, viruses, and peptides, as well as with pharmaceutical compounds and other chemicals. Also, gene function may be studied using explants derived from genetically modified mice or using inducible gene inactivation technology, such as the Cre-loxP system. This allows for the study of genetic mutations that cause embryonic lethality prior to the development of the kidney. Organ culture can also be combined with fluorescent tagging for gene function or lineage tracing and modern imaging techniques, which enable real-time monitoring of cell behavior2.
In the specific example provided here, the effect of EphrinB2-activated Eph-receptor signaling on the branching morphology of the ureteric bud was investigated. The morphology of the EphA4/EphB2 double-knockout mice suggested several severe defects in kidney development, which were detectable as early as embryonic day 11 (E11) and involved the ureteric bud, the ureter, and the common nephric duct3. Signaling via Eph receptors requires the clustering of the ligand-receptor dimer4. To over-activate Eph signaling, the kidney rudiments from E11.5 mouse embryos were cultured in the presence of clustered recombinant EphrinB2-Fc. EphrinB2 is a known ligand for the EphA4 receptor, which is expressed in the ureteric bud tips3.
протокол
Мышей поддерживали в соответствии с законодательством Швеции и законодательством Европейского Союза (2010/63 / ЕС). Все процедуры были выполнены в соответствии с указаниями Шведского комитета по этике (разрешения C79 / 9, C248 / 11 и C135 / 14). Процедуры в Гейдельбергском университете по животным предметам были одобрены Regierungspräsidium Karlsruhe и сотрудниками отдела охраны животных в Гейдельбергском университете.
1. Подготовка реагентов и материалов для культуры
ПРИМЕЧАНИЕ. Используйте ламинарный вытяжной колпак, чтобы свести к минимуму загрязнение.
- В день диссекции один только Fc-кластер докомплекса или рекомбинантный химерный белок эфрина сливают с Fc человека путем его смешивания с антителами против козьего антитела Fc человека при молярном соотношении 1: 5 в стерильном физиологическом растворе с фосфатным буфером (PBS). Инкубировать в течение 1 ч при 37 ° С. 5 .
- Подготовить культуральную среду путем добавления модифицированной Дульбекко среды Игла: питательныйСмесь F-12 (DMEM / F12) с 1% пенициллина / стрептомицина (об. / Об.), 1% глутамина (об. / Об.), 1% инсулинтрансрин-селена (об. / Об.), Трансферрин и 1,5 мкг / мл амфотерицина.
ПРИМЕЧАНИЕ: 10 мл среды достаточно для 16 эмбрионов. - Добавить кластерный рекомбинантный раствор эфрина в конечной концентрации 20 мкг / мл в культуральную среду. Используйте кластерный человеческий Fc в качестве контроля.
- Приготовьте культуральные планшеты, добавив 500 мкл культуральной среды в каждую лунку стерильной 4-луночной планшеты с бесстолбным плоским дном из полистирола.
- Используя стерильные щипцы, аккуратно поместите один поликарбонатный мембранный фильтр с размером пор 5 мкм на лунку сверху среды. Перенесите подготовленную пластину в инкубатор (37 ° C / 5% CO 2 ). Убедитесь, что фильтр остается сухим на верхней поверхности и плавает.
ПРИМЕЧАНИЕ. Один фильтр достаточно для двух почек анлагена. - Используя лезвие бритвы, разрежьте приблизительно 30 наконечников пипетки (объем: 100 мкл) приблизительноY 1 мм от наконечника, чтобы получить более широкое отверстие. Поместите наконечники обратно в стойку для пипеток.
2. Пресечение метанефрических рудиментов на E11.5
- Пожертвуйте беременную мышей с задержкой в E11.5 путем вывиха шейки матки (или используя метод, одобренный местным комитетом по этике).
- Удалите матку и эмбрионы, как описано Брауном и соавторами 6 . С этого момента вперед, работа под микроскопом рассечения.
- Используя щипцы для часовщика № 5, разрежьте эмбрион прямо под передними ногами. Используйте свежие чашки Петри для каждого эмбриона. Удалите ноги и хвост эмбриона. Для этого возьмите ткань, которую нужно удалить, с помощью одной пары пинцет-часовщиков № 5 и используйте концы второй пары для разрезания.
- Чтобы удалить массу вентрального органа, используйте кончики пары пинцет для бокового открытия стенки тела эмбриона в рострально-каудальном направлении.
- Вырезать поверхностно, параллельно tОн спинной аорты. Для ориентации используйте заполненную кровью и, следовательно, видимую дорсальную аорту. Тщательно отделите брюшную часть стенки тела от дорсальной части, используя кончики закрытых щипцов и переверните эмбрион. Вырезать стенку тела латерально в направлении от рострального к каудальному и использовать спинную аорту для ориентации, как и для предыдущей стороны.
- Как только брюшная стенка тела была отделена от спинного тела, возьмите ее одной парой щипцов и осторожно потяните, чтобы удалить ее, вместе с массой органа.
ПРИМЕЧАНИЕ: метанефрический анлаген обычно остается прикрепленным к дорсальной стенке тела. Это овальные, ~ 200 мкм длинные структуры, расположенные на уровне задних конечностей. - Держите спинной корпус тела с одной парой щипцов, с вентральной стороной вверх. Используя другую пару щипцов, захватите дорсальную аорту у ее рострального конца и осторожно отделите дорсальную аорту от дорсальной стенки тела.
ПРИМЕЧАНИЕ. Обе метанефрические почки обычно остаются прикрепленнымиНа спинной аорте. - Используя одну пару щипцов, отрежьте рострально к почковому анлагену, чтобы удалить аорту. Затем аккуратно отделите два почек анлагена, используя кончики щипцов.
- Тщательно очистите ненужную ткань от почек, используя кончики щипцов. Будьте осторожны, чтобы не повредить мезенхиму, так как повреждение может привести к неудовлетворительному росту и исключению эксплантата из дальнейшего анализа.
- Перенесите почечный анлаген отдельно с помощью пипетки микролитра и широко открытого наконечника пипетки в 10 мкл PBS к фильтру из поликарбонатной мембраны в 4-луночном планшете.
ПРИМЕЧАНИЕ: Из-за поверхностного натяжения эксплантат будет покрыт тонким слоем среды. Одного фильтра достаточно для двух почек-анлагена.- Поместите каждый из двух почек anlagen в центре каждой соответствующей половины фильтра. Перенесите пластину обратно в инкубатор при 37 ° C / 5% CO 2 . Оставить планшет в инкубаторе до метанефрического рудникаИмплантаты со следующего эмбриона готовы для размещения на фильтре.
- Повторите шаги 2.3-2.9.1 для каждого эмбриона.
ПРИМЕЧАНИЕ. При некоторой практике процедура вскрытия займет примерно 5 минут на эмбрион. - Инкубируйте почечный анлаген в течение 3 дней при 37 ° C / 5% CO 2 .
3. Приготовление реагентов для фиксации и окрашивания
- Для приготовления 4% параформальдегида (PFA) в PBS без кальция и магния (мас. / Об.) Растворяют PFA при 60 ° C в PBS, непрерывно помешивая. Остудите до комнатной температуры и используйте бумажный фильтр для удаления оставшихся частиц. Алиготе и держать при 4 ° C для немедленного использования или замораживания для длительного хранения.
ВНИМАНИЕ: PFA токсичен. Надевайте средства индивидуальной защиты, указанные в местных нормах безопасности, и работайте в вытяжном шкафу. Откажитесь от отходов в соответствии с установленными правилами и использованием специально предназначенных контейнеров для отходов. - Для приготовления раствора для проницаемости разбавляют Triton X-100В PBS без кальция и магния до 0,3% (об. / Об.).
- Для приготовления блокирующего раствора добавьте 5% (об. / Об.) Козьей сыворотки и 0,1% Triton X-100 в PBS без кальция и магния. Добавляют азид натрия до конечной концентрации 0,02% (мас. / Об.). Хранить при температуре 4 ° C.
Осторожно: азид натрия токсичен. Обрабатывать азид натрия в соответствии с местными правилами безопасности и охраны окружающей среды.
ПРИМЕЧАНИЕ. При использовании антител для окрашивания используйте 5% сыворотки от вида, из которого было получено вторичное антитело, чтобы получить блокирующий раствор. - Разбавьте биотинилированный Dolichorus biflorus agglutinin 1: 200 в блокирующем растворе. Разбавляют Alexa488-конъюгированный стрептавидин 1: 200 в блокирующем растворе.
- Для приготовления готовой к употреблению среды для вливания (см. Таблицу материалов) добавьте 0,1 г водорастворимого мукоадгезивного материала на основе поливинилового спирта к 25% (вес / объем) глицерина в 0,1 М Трис-HCl (pH 8,5) , Нагревают до 50 ° С при непрерывном перемешивании в течение 1 часа, охлаждают и доводят рН до 8,0-8,5, используя 1M NaOH. Избегайте более высоких концентраций NaOH. Добавить 100 мкг / мл N-пропилгаллата и тимеросал до конечной концентрации 0,02% (мас. / Об.). Перемешивают в течение 30 мин при комнатной температуре.
ОСТОРОЖНО: Тимеросал токсичен. Обращайтесь с ним в соответствии с местными правилами техники безопасности и охраны окружающей среды.- Заполните среду для заливки в пробирки по 50 мл, установите баланс ротора и центрифугируйте при 3200 xg и комнатную температуру на 10 мин. Декантируйте прозрачный раствор в 15 мл пробирки и выбросьте гранулу. Аликвоту и хранить при температуре -20 ° С в течение нескольких недель. После оттаивания держите раствор при 4 ° C. Теплый до ~ 30 ° C непосредственно перед использованием.
- Подготовьте столько же стеклянных горок, сколько будут установлены фильтры с эксплантами. Для этого приклейте два небольших покровных стекла размером 18 x 18 мм с обеих сторон стеклянного слайда, используя мгновенный клей. Оставьте пространство на 15 мм для фильтра между ними.
4. Фиксация и окрашивание
- После периода культивирования 3Дней в пробирке (div), удалите пластины из инкубатора и тщательно аспирируйте культуральную среду из каждой лунки с помощью микропипетки. Не прикасайтесь к фильтру и держите его в направлении стенки колодца.
- Добавить 500 мкл 4% PFA / PBS в каждую лунку. Фильтры будут плавать на фиксаторе. С помощью микропипетки осторожно добавьте фиксатор PFA по каплям, чтобы погрузить фильтры. Инкубируйте при комнатной температуре в течение 30 мин.
ПРИМЕЧАНИЕ. На всех последующих этапах следует соблюдать осторожность, чтобы не смыть эксплантаты с фильтра. Держите отверстие наконечника пипетки к стене колодца. - Удалить PFA и промыть дважды с 500 мкл PBS, погружая фильтр. Добавить 500 мкл раствора для пермеабилизации в каждую лунку и инкубировать при комнатной температуре в течение 1 часа.
- Промойте дважды 500 мкл PBS и добавьте 500 мкл блокирующего раствора в каждую лунку. Инкубируйте при комнатной температуре в течение 1 часа.
- Замените блокирующий раствор на250 мкл биотинилированного Dolichorus biflorus agglutinin, разведенного 1: 200 в блокирующем растворе, и инкубируют при 4 ° C в течение 24 часов.
- Удалить раствор Dolchorus biflorus agglutinin и дважды промыть 500 мкл PBS на лунку.
- Добавьте 250 мкл конъюгированного с Alexa488 стрептавидина, разбавленного 1: 200, в блокирующий раствор и инкубируйте при 4 ° C в течение 24 часов. Альтернативно, инкубируйте при комнатной температуре в течение 2 часов.
ПРИМЕЧАНИЕ. Лучшее соотношение сигнал / шум достигается при инкубации при 4 ° C. - Промойте дважды с 500 мкл PBS на лунку. Используя щипцы, перенесите фильтры на подготовленные стеклянные слайды, с эксплантатами вверх. Смонтируйте с ~ 50-100 мкл среды для заливки. Покрытие с покровными стеклами № 1,5 длиной 1,5 мм. Разрешить раствору внедряющей среды затвердеть в течение 2 часов при комнатной температуре в темноте. Приступайте к созданию изображений или хранению слайдов, завернутых в фольгу, при температуре 4 ° C до готовности к печати.
- Изображение с широкофокусным эпифлуоресцентным микроскопом 7 </ Sup>, соединенной с Hg-лампой, и используют зеркальный блок для синего возбуждения (полоса возбуждения, 460-4 495 нм, зеркальное зеркало 505 нм и полоса пропускания излучения 510-550 нм) и 20X объективы Plan-Apochromat, 0,75 числовые апертура.
Результаты
Метанефринный почковый анлаген получали из беременных черных-6 инбредных мышей в E11.5 и культивировали. Через 3 дня зачаток мочеточника разветвлялся до 5 раз, что приводило к разрастанию первоначально Т-образного уретрового зачатка. Каждый эксплантов фотографировали, а количество сегментов и конечных точек определяли количественно для определения ветвящихся генераций и для расчета количества конечных точек на ветку ( рисунок 1 ). ImageJ (четвертое поколение, 4 -е поколение было достигнуто лишь в 8% обработанных эксплантатов, по сравнению с 35% эксплантов контроля ( рис. 1b ). Соответственно, количество конечных точек на ветвь и конечные точки на мм 2 было уменьшено в Эксплантаты, обработанные кластерным EphrinB2, кроме того, треть эксплантатов имели необычную морфологию в уретеровых бутонах ( рис. 1 ). Эти результаты показывают, что EphrinB2 может иметь ограничивающий эффектНа ветвящийся процесс мочеточника, наиболее вероятно, активируя передачу сигналов EphA4 и EphB2 вперед.
Для успешного эксперимента очень важно, чтобы метанефрическая мезенхима не повреждалась при вскрытии. Любое повреждение мезенхимы снижает индуктивный потенциал, ведет к уменьшению или отсутствию ветвления ветви мочеточника и может быть источником смещения. Пример на рисунке 2А показывает эксплантов, где мезенхима почти отсутствует. Почка мочеточника не выходит за пределы Т-стадии. На рис. 2В показан пример, когда повреждение метанефрической мезенхимы приводило к слабому росту и разветвлению. Оба эксплантата должны быть исключены из анализа.
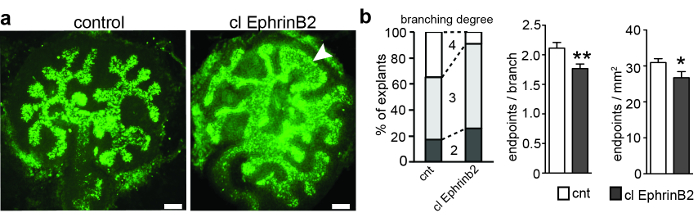
Рисунок 1: E11.5 Metanephric почки Anlagen Культивируется в течение 3 div и обрабатывается кластеризованных рекомбинантных EphrinB2 или ClustFc человека Fc в качестве контроля. ( A ) Метанефрический андаген почек рассекал на E11.5, культивировали в течение 3 дней и окрашивали биотинилированным Dolichorus biflorus agglutinin и Alexa488-конъюгированным стрептавидином. Эксплантаты были визуализированы широкофюзеляжным эпифлуоресцентным микроскопом с полосой пропускания возбуждения 460-495 нм, двухцветным зеркалом 505 нм, полосой пропускания излучения 510-550 нм и объективами 20X Plan-Apochromat. Применение кластерного рекомбинантного EphrinB2 (clEphrinB2) приводило к уменьшению сложности ветвления и пороков развития уретеровых бутонов (наконечник стрелы). ( B ) Левый график показывает ветвящиеся поколения в обработанных clEphrinB2 и контрольных эксплантатах. 4 -е поколение ветвления было достигнуто лишь в 8% обработанных эксплантатов, по сравнению с 35% контрольных эксплантов. Число конечных точек на ветвь (средний график) и конечные точки на область (правый график) было уменьшено (конечные точки на каждую ветвь УНТ, 2,1 ± 0,09, clEphrinB2, 1,7± 0,08, P = 0,007 **; Конечные точки на квадратный миллиметр: УНТ, 31 ± 0,01; ClEphrinB2, 27 ± 0,02; P = 0,04 *; N = 23). Данные представлены в виде среднего ± SEM и использовался непарный t-критерий Стьюдента. Шкала шкалы = 100 мкм. Эта цифра была изменена с Peuckert et al. , 2016 3 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
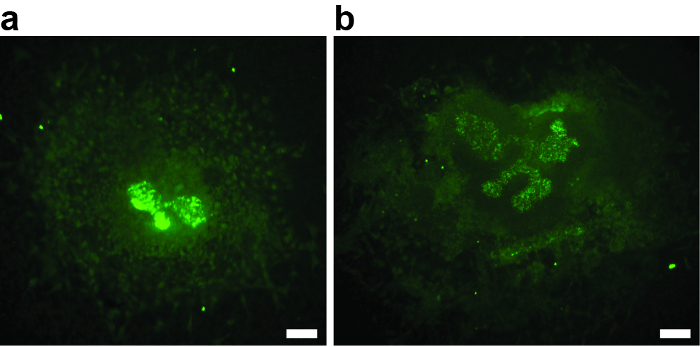
Рисунок 2: Примеры двух E11.5 метанефрических почек Anlagen, которые были повреждены во время рассечения, культивировали в течение 3 дней и окрашивали биотинилированным Dolichorus Biflorus Agglutinin и Alexa488-конъюгированным стрептавидином. ( A и B ). Повреждение мезенхимы приводило к слабому или отсутствующему росту и разветвлению бугочной ветви,Лишая эксплантов дальнейшего анализа. ( A ) метанефрический эксплантат почек после 3-х отделов, с отсутствием ветвления ветви мочеточника. Видно только первое ветвление на Т-стадии. ( B ) Metanephric почек эксплантат после 3 div, со слабым ветвлением ветви мочеточника. Шкала шкалы = 60 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
В этой рукописи описывается метод выделения развивающегося метанефрического анлагена из эмбриона мыши и культивирования зачатки органа. Этот метод является стандартной методикой, разработанной Grobstein 8 и Saxén 9 , 10 , и был адаптирован и модифицирован многими другими 11 , 12 . Успех метода зависит главным образом от продолжительности диссекции, так как выживаемость эксплантов и индуктивный потенциал уменьшаются с увеличением времени диссекции. Следует также позаботиться о том, чтобы не повредить мезенхиму при очищении зачатка почки от окружающей ткани. Повреждение метанефрической мезенхимы часто является причиной плохого роста эксплантов. Тем не менее, скорость диссекции и мелкие моторные навыки значительно улучшаются с практикой.
Химически определенная среда в представленном протоколе обычно используется для заменыСодержащую сыворотку среду в культуре первичных клеток и in vitro, и содержит смесь DME и F-12 Ham, 1: 1 (об. / Об.), Дополненную инсулин-трансферрин-селеном для поддержания роста и выживания эксплантатов. Инсулин способствует усвоению глюкозы и аминокислот, липогенезу и внутриклеточному транспорту. Селен, кофактор для глутатионпероксидазы, действует как антиоксидант. Трансферрин является железным носителем и помогает защитить от кислородных радикалов. В эмбриональной культуре почек добавление трансферрина к среде увеличивает дифференцировку канальцев и включение тимидина дозозависимым образом с максимальным эффектом около 50 мкг / мл 13 . Поэтому человеческий-голо-трансферрин дополнительно до- бавляют в среду, в результате чего конечная концентрация трансферрина составляет примерно 55 мкг / мл. Многие протоколы, которые используют простую, но химически менее определенную композицию, с минимальной существенной средой орла(MEM) или DMEM и 10% сыворотки ( то есть, фетальная бычья сыворотка, FBS) также дают очень удовлетворительные результаты 12 , 13 , 14 , 15 . Однако могут возникать различия между различными партиями FBS. Чтобы избежать таких изменений и исключить возможную интерференцию факторов роста, присутствующих в сыворотке с Eph-сигнализацией, была выбрана среда без сыворотки. Решение о том, использовать ли бессывороточную среду, зависит от экспериментальной установки и научного вопроса. Условия культивирования без сыворотки особенно необходимы, когда конечной целью является терапевтическое применение. Амфотерицин В, противогрибковый агент, включенный в этот протокол, можно опустить. Период культивирования в представленном примере составлял 3 дня, но метанефрические зачатки почек можно культивировать до 10 дней 15 . В культурах, превышающих 3 дня, среду следует менять каждые 48 часов. Развитие ребенкаЗачатки глаз in vitro воспроизводит последовательность in vivo предтрубчатых агрегатов, почечных пузырьков и запятых и S-образных тел. Через 3 дня in vitro гломерулоподобные структуры образовывали 15 , 16 . В более длинных культурах площадь эксплантов увеличивается еще больше из-за продолжающегося ветвления мочеточника. Примерно через 5 дней культивирования нефроны сегрегируются в дистальный, средний и проксимальный сегменты 16 .
Несмотря на относительную легкость и экономическую эффективность этой методики, позволяющую использовать универсальные приложения, некоторые соображения следует учитывать при планировании экспериментов и интерпретации результатов. Из-за внеклеточного матрикса и базальной мембраны, присутствующих в культивируемых органах, диффузия экзогенных агентов и частиц ограничена 17 . Кроме того, условия искусственной культуры и манипуляции могут вызывать изменения в метаболизмеIsm ткани, и поведение клетки, которое отличается от in vivo ситуации 15 , 18 . Наиболее заметно, что у эксплантов отсутствует кровоснабжение, а клубочки - бессосудистые; Хотя нефроны становятся сегментированными, отсутствуют зонирование и образование мозгового вещества и петель Генле 14,19. Таким образом, спектр применения эмбриональной культуры почек ограничен трубчатыми структурами, их ветвящейся морфологией и мезенхимально-эпителиальными взаимодействиями. Следовательно, научные вопросы, направленные на функцию почек, не могут быть решены.
Недавние модификации метода культуры, в котором зачатки почек выращиваются на стекле с покрытием в органотипическом развитии с низким объемом, вплоть до кортико-медуллярной зональности с удлиненными петлями Хенля 15 . Стоит также отметить, что в последнее время метод хранения и сохранения жизниЭмбриональных почек. Этот метод позволяет переносить зачатки почки зародыша в E11.5 в течение нескольких дней и позволяет культивировать их позже. Это особенно интересно для сотрудничества 20 . Природа культуры рудимента целых почек позволяет использовать различные методические приемы, в том числе современные методы визуализации. Чтобы не мешать движению в режиме реального времени, рекомендуется заменить плавающий фильтр фиксированным, например, вставкой для трансуэлла. Представленная технология даже расширена до культуральных тканевых блоков, содержащих весь урогенитальный тракт. Используя эту расширенную культуру, можно исследовать вставку мочеточника в мочевой пузырь 21 .
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы благодарят Лейфа Оксбурга и Дерека Адамса за щедрое распространение своих знаний, Лейфа Оксбурга за полезные комментарии к рукописи, Стефана Вёльфля и Ульрике Мюллер за их техническую поддержку и Саскию Шмиттекерт, Джулию Гобберт, Сашу Вейер и Виолу Майер за помощь в лаборатория Эта работа была поддержана Отделом Развития, Компанией Биологи (CP).
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F-12 | Thermo Fisher Scientific | 21331020 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140148 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | |
| DPBS, calcium, magnesium | Thermo Fisher Scientific | 14040117 | use for dissection |
| holo-Transferrin human | Sigma-Aldrich | T0665 | |
| Insulin-Transferrin-Selenium (ITS -G) (100x) | Thermo Fisher Scientific | 41400045 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Amphotericin B solution | Sigma-Aldrich | A2942 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Sodium azide | Sigma-Aldrich | S8032 | |
| Thimerosal | Sigma-Aldrich | T5125 | |
| Propyl gallate | Sigma-Aldrich | 2370 | |
| Mowiol 4-88 | Sigma-Aldrich | 81381 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Biotinylated Dolichorus Biflorus Agglutinin | Vector Laboratories | B-1035 | |
| Alexa488 conjugated Streptavidin | Jackson Immuno Research | 016-540-084 | |
| Recombinant Mouse Ephrin-B2 Fc Chimera Protein, CF | R&D Systems | 496-EB | |
| Recombinant Human IgG1 Fc, CF | R&D Systems | 110-HG-100 | |
| Goat Anti-Human IgG Fc Antibody | R&D Systems | G-102-C | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417 | use for fixation and immunostaining |
| Dumont #5, biologie tips, INOX, 11 cm | agnthos.se | 0208-5-PS | 2 pairs of forceps are needed |
| Iris scissors, straight, 12 cm | agnthos.se | 03-320-120 | |
| Dressing Forceps, straight, delicate, 13 cm | agnthos.se | 08-032-130 | |
| Petri dishes Nunclo Delta treated | Thermo Fisher Scientific | 150679 | |
| TMTP01300 Isopore Membrane Filter, polycarbonate, Hydrophilic, 5.0 µm, 13 mm, white, plain | MerckMillipore | TMTP01300 | |
| Nunclon Multidishes 4 wells, flat bottom | Sigma-Aldrich | D6789-1CS | |
| Microscope cover glass 24 x 50 mm thickn. No.1.5H 0.17+/-0.005 mm | nordicbiolabs | 107222 | |
| Cover glasses No.1.5, 18 mm x 18 mm | nordicbiolabs | 102032 | |
| Slides ~76 x 26 x 1, 1/2-w. ground plain | nordicbiolabs | 1030418 | |
| VWR Razor Blades | VWR | 55411-055 | |
| 50 mL centrifuge tubes | Sigma-Aldrich | CLS430828 | |
| 15 mL centrifuge tubes | Sigma-Aldrich | CLS430055 | |
| Whatman prepleated qualitative filter paper, Grade 113V, creped | Sigma-Aldrich | WHA1213125 | |
| Fixed stage research mircoscope | Olympus | BX61WI | |
| Black 6 inbred mice, male, C57BL/6NTac | Taconic | B6-M | |
| Black 6 inbred mice,female, C57BL/6NTac | Taconic | B6-F | |
| Greenough Stereo Microscope | Leica | Leica S6 E |
Ссылки
- Saxén, L. Organogenesis of the kidney. Developmental and Cell Biology Series. 19, Cambridge University Press. (1987).
- Lindström, N. O., et al. Integrated β-catenin, BMP, PTEN, and Notch signalling patterns the nephron. eLife. 4, e04000(2015).
- Peuckert, C., et al. Multimodal Eph/Ephrin signaling controls several phases of urogenital development. Kidney Int. 90 (2), 373-388 (2016).
- Pasquale, E. B. Eph receptor signalling casts a wide net on cell behaviour. Nat Rev Mol Cell Biol. 6 (6), 462-475 (2005).
- Bonanomi, D., et al. Ret Is a Multifunctional Coreceptor that Integrates Diffusible- and Contact-Axon Guidance Signals. Cell. 148 (2), 568-582 (2012).
- Brown, A. C., et al. Isolation and Culture of Cells from the Nephrogenic Zone of the Embryonic Mouse Kidney. J Vis Exp. (50), e2555(2011).
- Olympus Support. , Available from: http://www.olympusamerica.com/cpg_section/cpg_archived_product_details.asp?id=817 (2016).
- Grobstein, C. Inductive interaction in the development of the mouse metanephros. J Exp Zool. 130, 319-340 (1955).
- Saxén, L., Toivonen, S. Primary Embryonic Induction. , Academic Press. London. (1962).
- Saxén, L., Koskimies, O., Lahti, A., Miettinen, H., Rapola, J., Wartiovaara, J. Differentiation of kidney mesenchyme in an experimental model system. Adv Morphog. 7, 251-293 (1968).
- Dudley, A. T., Godin, R. E., Robertson, E. J. Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613 (1999).
- Perälä, N., et al. Sema4C-Plexin B2 signalling modulates ureteric branching in developing kidney. Differentiation. 81 (2), 81-91 (2011).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. J Embryol exp Morph. 82, 147-161 (1984).
- Watanabe, T., Costantini, F. Real-time analysis of ureteric bud branching morphogenesis. Dev Biol. 271, 98-108 (2004).
- Sebinger, D. D. R., Unbekandt, M., Ganeva, V. V., Ofenbauer, A., Werner, C., Davies, J. A. A Novel, Low-Volume Method for Organ Culture of Embryonic Kidneys That Allows Development of Cortico-Medullary Anatomical Organization. PLoS One. 5 (5), e10550(2010).
- Ekblom, P., Miettinen, A., Virtanen, I., Wahlström, T., Dawnay, A., Saxén, L. In vitro segregation of the metanephric nephron. Dev Biol. 84 (1), 88-95 (1981).
- Davies, J. A., Unbekandt, M. siRNA-mediated RNA interference in embryonic kidney organ culture. Methods Mol Biol. 886, 295-303 (2012).
- Saxén, L., Lehtonen, E. Embryonic kidney in organ culture. Differentiation. 36 (1), 2-11 (1987).
- Bard, J. B. L. The development of the mouse kidney embryogenesis writ small. Curr Opin Genet Dev. 2, 589-595 (1992).
- Davies, J. A. A method for cold storage and transport of viable embryonic kidney rudiments. Kidney Int. 70 (11), 2031-2034 (2006).
- Batourina, E., et al. Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Nat Genet. 32 (1), 109-115 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены