Method Article
Dissection et culture du rein embryonnaire de la souris
Dans cet article
Résumé
Ce protocole décrit une méthode pour isoler et cultiver des rudiments métasphoriques à partir d'embryons de souris.
Résumé
Le but de ce protocole est de décrire une méthode de dissection, d'isolement et de culture des rudiments métanéphriques de souris.
Au cours du développement du rein des mammifères, les deux tissus progéniteurs, le bourgeon urétéral et le mésenchyme métasphorique, communiquent et induisent réciproquement des mécanismes cellulaires pour former éventuellement le système collecteur et les néphrons du rein. Au fur et à mesure que les embryons de mammifères se développent par voie intra-utérine et qui sont inaccessibles à l'observateur, une culture d'organe a été développée. Avec cette méthode, il est possible d'étudier les interactions épithéliales-mésenchymateuses et le comportement cellulaire pendant l'organogenèse rénale. En outre, l'origine des malformations rénales congénitales et des voies urogénitales peut être étudiée. Après une dissection minutieuse, les rudiments métanéphriques sont transférés sur un filtre qui flotte sur un milieu de culture et peuvent être conservés dans un incubateur de culture cellulaire pendant plusieurs jours. Cependant, il faut savoir que les conditions sontArtificielle et pourrait influencer le métabolisme dans le tissu. En outre, la pénétration des substances d'essai pourrait être limitée en raison de la matrice extracellulaire et de la membrane basale présents dans l'explant.
Un des principaux avantages de la culture des organes est que l'expérimentateur peut avoir un accès direct à l'organe. Cette technologie est peu coûteuse, simple et permet un grand nombre de modifications, telles que l'ajout de substances biologiquement actives, l'étude des variantes génétiques et l'application de techniques avancées d'imagerie.
Introduction
The mammalian kidney is derived from two primordial structures with mesodermal origin: the tubular epithelial ureteric bud and the metanephric mesenchyme. During nephrogenesis, the ureteric bud invades the metanephric mesenchyme and branches to form the collecting system. The metanephric mesenchyme gives rise to the epithelial elements of the nephrons. These processes occur in a precisely timed and spatially coordinated manner and are initiated by reciprocal inductive mechanisms. Both tissue components communicate and affect the other's cell morphogenesis.
In the 1920s, it was Boyden who performed the in vivo obstruction of the mesonephric duct in chicken, providing the first indication of inductive interactions as separated nephric blastema fail to differentiate1. At about the same time, the first successful attempts to culture chicken nephric rudiments in a hanging drop were published. Subsequently, the organ culture was developed to study tissue interactions in mammalian organogenesis. In the 1950s, Grobstein developed a technique in which metanephric rudiments could be cultured on a filter. This technique was modified by Saxén, who placed the filter on a Trowell-type screen in a culture dish1. Over the years, many modifications and applications for organ culture have emerged. The method described here is based on Saxén's technique but is simplified, as the filters float free on the medium and the diameter of the culture well only slightly exceeds the diameter of the filter, limiting unwanted movement of the filter.
Whole-organ culture is a classical, cheap, and simple but powerful tool to investigate cellular processes and intercellular communication during organogenesis. Organ culture allows for treatment with biological agents, such as growth factors, antibodies, antisense oligonucleotides, viruses, and peptides, as well as with pharmaceutical compounds and other chemicals. Also, gene function may be studied using explants derived from genetically modified mice or using inducible gene inactivation technology, such as the Cre-loxP system. This allows for the study of genetic mutations that cause embryonic lethality prior to the development of the kidney. Organ culture can also be combined with fluorescent tagging for gene function or lineage tracing and modern imaging techniques, which enable real-time monitoring of cell behavior2.
In the specific example provided here, the effect of EphrinB2-activated Eph-receptor signaling on the branching morphology of the ureteric bud was investigated. The morphology of the EphA4/EphB2 double-knockout mice suggested several severe defects in kidney development, which were detectable as early as embryonic day 11 (E11) and involved the ureteric bud, the ureter, and the common nephric duct3. Signaling via Eph receptors requires the clustering of the ligand-receptor dimer4. To over-activate Eph signaling, the kidney rudiments from E11.5 mouse embryos were cultured in the presence of clustered recombinant EphrinB2-Fc. EphrinB2 is a known ligand for the EphA4 receptor, which is expressed in the ureteric bud tips3.
Protocole
Les souris ont été maintenues selon la réglementation suédoise et la législation de l'Union européenne (2010/63 / UE). Toutes les procédures ont été effectuées selon les directives du Comité suédois d'éthique (permis C79 / 9, C248 / 11 et C135 / 14). Les procédures à l'Université de Heidelberg portant sur des matières animales ont été approuvées par le Regierungspräsidium Karlsruhe et les agents de protection des animaux à l'Université de Heidelberg.
1. Préparation des réactifs et des matériaux pour la culture
REMARQUE: Utilisez un capot à flux laminaire pour minimiser la contamination.
- Le jour de la dissection, la protéine d'éphrine chimère recombinante Fc seule ou recombinante est fusionnée à Fc humaine en la mélangeant avec des anticorps contre la chèvre Fc anti-humains à un rapport molaire de 1: 5 dans une solution saline stérile tamponnée au phosphate (PBS). Incuber pendant 1 h à 37 ° C 5 .
- Préparer le milieu de culture en complétant l'Eagle Eagle modifié par Dulbecco: NutrientMélange F-12 (DMEM / F12) avec 1% de pénicilline / streptomycine (v / v), 1% de glutamine (v / v), 1% d'insuline-transferrine-sélénium (v / v), 50 μg / mL d'holo- La transferrine et 1,5 μg / ml d'amphotéricine.
REMARQUE: 10 ml de milieu sont suffisants pour 16 embryons. - Ajouter une solution d'éphrine recombinante en grappe à une concentration finale de 20 μg / ml sur le milieu de culture. Utilisez le Fc humain en cluster comme contrôle.
- Préparer des plaques de culture en ajoutant 500 μl de milieu de culture à chaque puits d'une plaque stérile, non revêtue, à base de polystyrène à fond plat et à 4 puits.
- En utilisant des pinces stériles, placez soigneusement un filtre à membrane en polycarbonate avec une taille de pore de 5 μm par puits sur le dessus du milieu. Transférer la plaque préparée à l'incubateur (37 ° C / 5% de CO 2 ). Assurez-vous que le filtre reste sec sur la surface supérieure et les flotteurs.
REMARQUE: Un filtre suffit pour deux anilènes rénaux. - En utilisant une lame de rasoir, couper environ 30 pointes de pipette (volume: 100 μL) approximatelY 1 mm de la pointe pour aboutir à une ouverture plus large. Placez les embouts dans une crémaillère à pipette.
2. Dissection de Rudiments Metanephriques à E11.5
- Sacrifiez une souris enceinte chronométrée à E11.5 par dislocation cervicale (ou utilisez une méthode approuvée par le comité local d'éthique).
- Supprimer l'utérus et les embryons, comme décrit par Brown et al 6 . Sur ce point, travailler sous un microscope à dissection.
- En utilisant la pince à horlogerie n ° 5, couper l'embryon directement sous les pattes antérieures. Utilisez un plat de Petri frais pour chaque embryon. Retirer les jambes et la queue de l'embryon. Pour ce faire, prenez le tissu à enlever avec une paire de pince à horlogerie n ° 5 et utilisez les pointes d'une deuxième paire pour couper.
- Pour enlever la masse d'organe ventrale, utilisez les pointes d'une pince pour ouvrir latéralement la paroi du corps de l'embryon dans une direction rostrale à caudale.
- Couper superficiellement, parallèlement à tL'aorte dorsale. Utilisez l'aorte dorsale remplie de sang et donc visible pour l'orientation. Séparez soigneusement la partie ventrale de la paroi du corps de la partie dorsale en utilisant les pointes de la pince fermée et retournez l'embryon. Coupez la paroi du corps latéralement dans une direction rostral à caudale et utilisez l'aorte dorsale pour l'orientation, comme pour le côté précédent.
- Une fois que la paroi du ventral a été séparée du corps dorsal, saisissez-la avec une paire de pince et tirez soigneusement pour l'enlever, avec la masse de l'organe.
REMARQUE: l'anilène métanéphrique reste habituellement attaché à la paroi du corps dorsal. Ce sont des structures ovales, de 200 μm de long situées au niveau des membres postérieurs. - Tenez la paroi du corps dorsal avec une paire de pince, avec le côté ventral vers le haut. À l'aide de l'autre pince, saisissez l'aorte dorsale à son extrémité rostrale et épluchez soigneusement l'aorte dorsale de la paroi du corps dorsal.
NOTE: Les deux reins métasphériques restent habituellement attachésÀ l'aorte dorsale. - À l'aide d'une paire de pinces, coupez vers le riz anlagen pour éliminer l'aorte. Ensuite, séparez soigneusement les deux anols du rein en utilisant les pointes de la pince.
- Éloignez soigneusement les tissus indésirables du rein anlagen en utilisant les pointes de la pince. Veillez à ne pas endommager le mésenchyme, car les dommages peuvent entraîner une mauvaise croissance et l'exclusion de l'explant à partir d'analyses ultérieures.
- Transférer le rein anlagen séparément à l'aide d'une pipette à microlitres et d'une pointe de pipette large-ouverte dans 10 μL de PBS au filtre à membrane en polycarbonate dans une plaque à 4 puits.
REMARQUE: En raison de la tension de surface, l'explant sera recouvert d'une mince couche de milieu. Un filtre suffit pour deux anilènes rénaux.- Placez chacun des deux anilènes rénaux au centre de chaque moitié respective du filtre. Transférer la plaque à l'incubateur à 37 ° C / 5% de CO 2 . Laisser la plaque dans l'incubateur jusqu'à ce que la rud metanephricLes imites du prochain embryon sont prêtes à être placées sur le filtre.
- Répétez les étapes 2.3-2.9.1 pour chaque embryon.
REMARQUE: avec une certaine pratique, la procédure de dissection prend environ 5 min par embryon. - Incuber le rein anlagen pendant 3 jours à 37 ° C / 5% de CO 2 .
3. Préparation des réactifs pour la fixation et la coloration
- Pour préparer 4% de paraformaldéhyde (PFA) dans du PBS sans calcium et magnésium (p / v), dissoudre le PFA à 60 ° C dans du PBS, en agitant continuellement. Refroidissez à température ambiante et utilisez un filtre en papier pour enlever les particules restantes. Aliquote et conservez à 4 ° C pour une utilisation immédiate ou un gel pour un stockage à long terme.
ATTENTION: le PFA est toxique. Portez l'équipement de protection individuelle spécifié dans les normes de sécurité locales et travaillez dans une hotte aspirante. Jeter les déchets en suivant les directives institutionnelles et en utilisant les conteneurs de déchets désignés. - Pour préparer une solution de perméabilisation, diluer Triton X-100Dans du PBS sans calcium et magnésium à 0,3% (v / v).
- Pour préparer une solution de blocage, ajouter 5% (v / v) de sérum de chèvre et 0,1% de Triton X-100 à PBS sans calcium et magnésium. Ajouter de l'azoture de sodium à une concentration finale de 0,02% (p / v). Conserver à 4 ° C.
ATTENTION: L'azide de sodium est toxique. Manipuler l'azide de sodium conformément à la réglementation locale sur la sécurité et la protection de l'environnement.
NOTE: Lorsque vous utilisez des anticorps pour la coloration, utilisez un sérum de 5% parmi les espèces dont l'anticorps secondaire a été dérivé pour obtenir une solution de blocage. - Diluer l'agglutinine biotinylée de Dolichorus biflorus 1: 200 dans la solution bloquant. Diluer la streptavidine conjuguée Alexa488 1: 200 dans la solution de blocage.
- Pour préparer un milieu d'incorporation prêt à l'emploi (voir la table des matériaux), ajouter 0,1 g de mucoadhésif à base d'alcool polyvinylique à l'eau / ml à 25% (p / v) de glycerol dans du Tris-HCl 0,1 M (pH 8,5) . Chauffer à 50 ° C sous agitation continue pendant 1 h, refroidir et régler le pH à 8,0-8,5 en utilisant 1M NaOH. Évitez les concentrations de NaOH plus élevées. Ajouter 100 μg / mL de N-propylgallate et thimerosal à une concentration finale de 0,02% (p / v). Mélanger pendant 30 minutes à température ambiante.
ATTENTION: Le thimerosal est toxique. Manipulez-le conformément à la réglementation locale sur la sécurité et la protection de l'environnement.- Remplissez le milieu d'incorporation dans des tubes de 50 ml, équilibrez le rotor et centrifugez à 3,200 xg et la température ambiante pendant 10 min. Décrivez la solution transparente dans des tubes de 15 mL et jeter la pastille. Aliquotez et conservez à -20 ° C pendant plusieurs semaines. Une fois décongelée, maintenir la solution à 4 ° C. Chaud à ~ 30 ° C immédiatement avant utilisation.
- Préparez autant de diapositives en verre que les filtres avec des explants doivent être montés. Pour cela, collez deux petits lamelles, 18 x 18 mm, de chaque côté de la glissière en verre à l'aide d'un adhésif instantané, laissez un espace de ~ 15 mm pour le filtre entre les deux.
4. Fixation et coloration
- Après une période de culture de 3Jours in vitro (div), retirer les plaques de l'incubateur et aspirer soigneusement le milieu de culture de chaque puits à l'aide d'une micropipette. Assurez-vous de ne pas toucher le filtre et de garder la pointe en direction de la paroi du puits.
- Ajouter 500 μL de PFA à 4% / PBS à chaque puits. Les filtres flottent sur le fixateur. À l'aide d'une micropipette, ajoutez soigneusement le fixateur PFA pour immerger les filtres. Incuber à température ambiante pendant 30 min.
REMARQUE: Pour toutes les étapes suivantes, il faut prendre soin de ne pas laver les explants du filtre. Gardez l'ouverture de la pointe de la pipette vers le mur du puits. - Retirez le PFA et rincez deux fois avec 500 μL de PBS, en immergeant le filtre. Ajouter 500 μL de solution de perméabilisation à chaque puits et incuber à température ambiante pendant 1 h.
- Rincer deux fois avec 500 μL de PBS et ajouter 500 μl de solution bloquant à chaque puits. Incuber à température ambiante pendant 1 heure.
- Remplacez la solution de blocage par250 μL d'agglutinine biotinylée de Dolichorus biflorus diluée à 1: 200 dans une solution bloquant et incubée à 4 ° C pendant 24 h.
- Enlever la solution d'agglutinine Dolichorus biflorus et rincer deux fois avec 500 μL de PBS par puits.
- Ajouter 250 μL de streptavidine conjuguée avec Alexa488 dilué 1: 200 dans la solution de blocage et incuber à 4 ° C pendant 24 h. Alternativement, incuber à température ambiante pendant 2 h.
REMARQUE: Un meilleur rapport signal / bruit est obtenu lorsque l'on incube à 4 ° C. - Rincer deux fois avec 500 μL de PBS par puits. En utilisant une pince, transférez les filtres sur les lames de verre préparées, avec les explants vers le haut. Monter avec ~ 50-100 μL de support d'encastrement. Couvrir avec des lamelles de 60 mm de long n ° 1.5. Laisser la solution du milieu d'incorporation se solidifier pendant 2 h à température ambiante dans l'obscurité. Procédez à l'imagerie ou rangez les diapositives, emballées dans du papier d'aluminium, à 4 ° C jusqu'à ce qu'elles soient prêtes à l'image.
- Image avec un microscope épifluorescent large champ 7 </ Sup> couplé à une lampe Hg et utiliser une unité miroir pour l'excitation bleue (passe-bande d'excitation, 460 - 495 nm, miroir dichromatique, 505 nm et bande passante d'émission, 510 à 550 nm) et 20X lentilles Plan-Apochromat, 0,75 numériques ouverture.
Résultats
L'anlagen rénale métasphorique a été dérivé de souris enceintes enceintes Black-6 chez E11.5 et ont été cultivées. Après 3 jours, le bourgeon urétéral s'est ramifié jusqu'à 5 fois, entraînant une ramification du bourrelet urétéral initialement en forme de T. Chaque explant a été photographié et les nombres de segments et de points d'extrémité ont été quantifiés pour déterminer les générations de ramifications et pour calculer le nombre de points d'extrémité par branche ( figure 1 ). ImageJ (génération), la 4ème génération a été atteinte dans seulement 8% des explants traités, par rapport à 35% des explants témoins ( figure 1b ). En conséquence, le nombre de points d'extrémité par branche et les points d'extrémité par mm 2 a été réduit dans Les explants traités avec EphrinB2 en grappe. En outre, un tiers des explants avaient une morphologie inhabituelle dans les conseils de bourgeons urétéraux ( figure 1 ). Ces résultats suggèrent que EphrinB2 pourrait avoir un effet restrictifSur le processus de ramage de l'urètre, le plus probable en activant la signalisation avant EphA4 et EphB2.
Pour une expérience réussie, il est essentiel que le mésenchyme metanephrique ne soit pas endommagé pendant la dissection. Toute blessure du mésenchyme diminue le potentiel inductif, entraîne une ramification urinaire uréreuse réduite ou absente, et pourrait constituer une source de biais. L'exemple de la figure 2A montre un explant où le mésenchyme manque presque. Le bourgeon urétéral n'a pas dépassé le stade T. La figure 2B montre un exemple où l'endommagement du mésenchyme metanephrique a entraîné une croissance et une ramification médiocres. Les deux explants doivent être exclus de l'analyse.
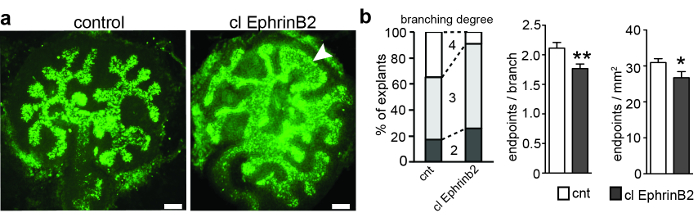
Figure 1: E11.5 Metanephric Kidney Anlagen Culture pour 3 div et traité avec EphrinB2 ou Clustered RecombinantFc humaine en tant que contrôle. ( A ) On a disséqué le rein métanéphrique anlagène à E11.5, on l'a cultivé pour 3 div et on les a colorés avec de l'agglutinine biotinylée de Dolichorus biflorus et de la streptavidine conjuguée à Alexa488. Les explants ont été imagés avec un microscope à épifluorescence à large champ avec un passage circulatoire d'excitation de 460-495 nm, un miroir dichromatique de 505 nm, un passage de bande d'émission de 510-550 nm et des lentilles Plan-Apochromat 20X. L'application d'EphrinB2 recombinant groupé (clEphrinB2) a entraîné une complexité de ramification réduite et une malformation des conseils de bourgeons urétéraux (tête de flèche). ( B ) Le graphique de gauche montre les générations de ramification dans les explants traités par clEphrinB2 et témoins. La 4ème génération de ramification a été atteinte dans seulement 8% des explants traités, comparativement à 35% des explants témoins. Le nombre de points d'extrémité par branche (graphe central) et les points d'extrémité par zone (graphique de droite) a été réduit (points d'extrémité par branche CNT, 2,1 ± 0,09; clEphrinB2, 1,7± 0,08, P = 0,007 **; Points limites par millimètre carré: CNT, 31 ± 0,01; ClEphrinB2, 27 ± 0,02; P = 0,04 *; N = 23). Les données sont présentées comme moyenne ± SEM et un test t de Student non accompagné a été utilisé. Barre d'échelle = 100 μm. Ce chiffre a été modifié à partir de Peuckert et al. , 2016 3 . Cliquez ici pour voir une version plus grande de ce chiffre.
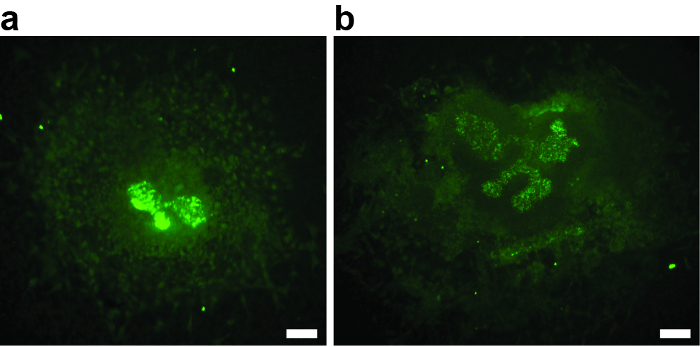
Figure 2: Exemples de deux E11.5 Metanephric Kidney Anlagen qui ont été endommagés lors de la dissection, cultivé pour 3 div et colorés avec de l'épidémie biotinylée de Dolichorus Biflorus et de la Streptavidine conjuguée Alexa488. ( A et B ) Les dommages causés par le mésenchyme ont entraîné une croissance médiocre ou absente et une ramification urinaire urétérale,Disqualifier les explants d'une analyse plus approfondie. ( A ) Expérimenté de rein metanephrique après 3 div, avec une ramification urinaire urinaire absente. Seule la première branche T-stage est visible. ( B ) Expansif de rein metanephrique après 3 div, avec une mauvaise branche urétrale. Barre d'échelle = 60 μm. Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce manuscrit décrit une méthode pour isoler l'anlagen méthanephrique en développement de l'embryon de souris et pour cultiver les rudiments d'organes. Cette méthode est une technique standard, développée par Grobstein 8 et Saxén 9 , 10 , et a été adaptée et modifiée par beaucoup d'autres 11 , 12 . Le succès de la méthode dépend principalement de la durée de la dissection, car la survie des explants et le potentiel inductif diminuent avec un temps de dissection prolongé. Des précautions doivent également être prises pour ne pas endommager le mésenchyme lors du nettoyage du rudiment du rein du tissu environnant. Les dommages causés par le mésenchyme metanephrique sont souvent la cause d'une mauvaise croissance des explants. Cependant, la vitesse de dissection et les compétences motrices fines s'améliorent considérablement avec la pratique.
Le milieu chimiquement défini dans le protocole présenté est couramment utilisé pour remplacer leLe milieu contenant du sérum dans la culture primaire des cellules et des organes in vitro et contient un mélange 1: 1 (v / v) de DMEM et de F-12 de Ham, complété par de l'insuline-transferrine-sélénium pour favoriser la croissance et la survie des explants. L'absorption d'acide aminé et de glycémie, la lipogenèse et le transport intracellulaire sont facilités par l'insuline. Le sélénium, un cofacteur pour la glutathion peroxydase, fonctionne comme antioxydant. La transferrine est un support de fer et contribue à la protection contre les radicaux oxygénés. Dans la culture du rein embryonnaire, l'ajout de transferrine au milieu augmente la différenciation des tubules et l'incorporation de la thymidine de manière dose-dépendante, avec un effet maximum autour de 50 μg / mL 13 . Par conséquent, l'holo-transferrine humaine est en outre complétée dans le milieu, ce qui donne une concentration finale en transferrine d'environ 55 μg / mL. De nombreux protocoles, qui utilisent une composition plus simple mais chimiquement moins définie, avec Eagle's Minimal Essential Medium(MEM) ou DMEM et 10% de sérum ( c'est-à-dire le sérum bovin fœtal, FBS) donnent également des résultats très satisfaisants 12 , 13 , 14 , 15 . Cependant, des variations entre différents lots de FBS peuvent se produire. Pour éviter de telles variations et pour exclure l'éventuelle interférence des facteurs de croissance présents dans le sérum avec la signalisation Eph, on a choisi un milieu sans sérum. La décision d'utiliser un milieu exempt de sérum dépend de la configuration expérimentale et de la question scientifique. Des conditions de culture exemptes de sérum seraient particulièrement nécessaires lorsque le but ultime est l'application thérapeutique. L'amphotéricine B, l'agent antifongique inclus dans ce protocole, peut être omise. La période de culture dans l'exemple présenté était de 3 jours, mais les rudiments rénaux metanephriques peuvent être cultivés jusqu'à 10 jours 15 . Dans des cultures de plus de 3 jours, le milieu doit être changé toutes les 48 h. Le développement du kidnappeLes rudiments in vitro récapitulent la séquence in vivo des agrégats pré-tubulaires, des vésicules rénales et des corps en forme de virgule et de S. Après 3 jours in vitro , des structures de type glomérulaire se sont formées 15 , 16 . Dans les cultures plus longues, la surface de l'explant augmente encore en raison de la ramification continue du bourgeon urétéral. À environ 5 jours de culture, les néphrons se sont séparés dans les segments distal, moyen et proximal 16 .
En dépit de la relative facilité et de la rentabilité de la technique, permettant des applications polyvalentes, il faut tenir compte de certaines considérations lors de la planification des expériences et de l'interprétation des résultats. En raison de la matrice extracellulaire et de la membrane basale présents dans les organes cultivés, la diffusion des agents exogènes et des particules est limitée 17 . En outre, les conditions de culture artificielle et les manipulations peuvent entraîner des changements dans le métabolismeIsm du tissu, et le comportement cellulaire qui diffère de la situation in vivo 15 , 18 . Plus visiblement, les explants manquent d'approvisionnement en sang, et les glomérules sont avasculaires; Bien que les néphrons deviennent segmentés, la zonation et la formation d'une médullaire et des boucles de Henle manquent 14 , 19 . Ainsi, le spectre d'application de la culture de rein embryonnaire est limité aux structures tubulaires, à leur morphologie ramifiée et aux interactions mésenchymateuses-épithéliales. Par conséquent, les questions scientifiques ciblant la fonction rénale ne peuvent être abordées.
Des modifications récentes de la méthode de culture dans laquelle les rudiments des reins sont cultivés sur du verre revêtu dans un développement organotypique à faible volume, même jusqu'à la zonation cortico-médullaire avec des boucles étendues de Henle 15 . Il convient également de noter que, récemment, une méthode pour stocker et préserver le vivantDes reins embryonnaires ont été publiés. Cette méthode permet le transport de rudiments de rein embryonnaire à E11.5 pendant plusieurs jours et permet de les cultiver plus tard. Ceci est particulièrement intéressant pour les collaborations 20 . La nature de la culture du rudiment du rein entier permet une variété d'adaptations méthodologiques, y compris des techniques avancées d'imagerie. Pour éviter de déranger les mouvements lors de l'imagerie en direct, il est recommandé de remplacer le flottant par un filtre fixe, tel qu'un encart transwell. La technologie présentée a même été étendue à des blocs de tissus culturels contenant tout le tractus urogénital. À l'aide de cette culture élargie, l'insertion de l'uretère dans la vessie peut être étudiée 21 .
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs remercient Leif Oxburgh et Derek Adams de partager généreusement leurs connaissances, Leif Oxburgh pour les commentaires utiles sur le manuscrit, et Stefan Wölfl et Ulrike Müller pour leur soutien technique et Saskia Schmitteckert, Julia Gobbert, Sascha Weyer et Viola Mayer pour l'aide dans le laboratoire. Ce travail a été soutenu par Development, The Company of Biologists (to CP).
matériels
| Name | Company | Catalog Number | Comments |
| DMEM/F-12 | Thermo Fisher Scientific | 21331020 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140148 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | |
| DPBS, calcium, magnesium | Thermo Fisher Scientific | 14040117 | use for dissection |
| holo-Transferrin human | Sigma-Aldrich | T0665 | |
| Insulin-Transferrin-Selenium (ITS -G) (100x) | Thermo Fisher Scientific | 41400045 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Amphotericin B solution | Sigma-Aldrich | A2942 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Sodium azide | Sigma-Aldrich | S8032 | |
| Thimerosal | Sigma-Aldrich | T5125 | |
| Propyl gallate | Sigma-Aldrich | 2370 | |
| Mowiol 4-88 | Sigma-Aldrich | 81381 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Biotinylated Dolichorus Biflorus Agglutinin | Vector Laboratories | B-1035 | |
| Alexa488 conjugated Streptavidin | Jackson Immuno Research | 016-540-084 | |
| Recombinant Mouse Ephrin-B2 Fc Chimera Protein, CF | R&D Systems | 496-EB | |
| Recombinant Human IgG1 Fc, CF | R&D Systems | 110-HG-100 | |
| Goat Anti-Human IgG Fc Antibody | R&D Systems | G-102-C | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417 | use for fixation and immunostaining |
| Dumont #5, biologie tips, INOX, 11 cm | agnthos.se | 0208-5-PS | 2 pairs of forceps are needed |
| Iris scissors, straight, 12 cm | agnthos.se | 03-320-120 | |
| Dressing Forceps, straight, delicate, 13 cm | agnthos.se | 08-032-130 | |
| Petri dishes Nunclo Delta treated | Thermo Fisher Scientific | 150679 | |
| TMTP01300 Isopore Membrane Filter, polycarbonate, Hydrophilic, 5.0 µm, 13 mm, white, plain | MerckMillipore | TMTP01300 | |
| Nunclon Multidishes 4 wells, flat bottom | Sigma-Aldrich | D6789-1CS | |
| Microscope cover glass 24 x 50 mm thickn. No.1.5H 0.17+/-0.005 mm | nordicbiolabs | 107222 | |
| Cover glasses No.1.5, 18 mm x 18 mm | nordicbiolabs | 102032 | |
| Slides ~76 x 26 x 1, 1/2-w. ground plain | nordicbiolabs | 1030418 | |
| VWR Razor Blades | VWR | 55411-055 | |
| 50 mL centrifuge tubes | Sigma-Aldrich | CLS430828 | |
| 15 mL centrifuge tubes | Sigma-Aldrich | CLS430055 | |
| Whatman prepleated qualitative filter paper, Grade 113V, creped | Sigma-Aldrich | WHA1213125 | |
| Fixed stage research mircoscope | Olympus | BX61WI | |
| Black 6 inbred mice, male, C57BL/6NTac | Taconic | B6-M | |
| Black 6 inbred mice,female, C57BL/6NTac | Taconic | B6-F | |
| Greenough Stereo Microscope | Leica | Leica S6 E |
Références
- Saxén, L. Organogenesis of the kidney. Developmental and Cell Biology Series. 19, Cambridge University Press. (1987).
- Lindström, N. O., et al. Integrated β-catenin, BMP, PTEN, and Notch signalling patterns the nephron. eLife. 4, e04000(2015).
- Peuckert, C., et al. Multimodal Eph/Ephrin signaling controls several phases of urogenital development. Kidney Int. 90 (2), 373-388 (2016).
- Pasquale, E. B. Eph receptor signalling casts a wide net on cell behaviour. Nat Rev Mol Cell Biol. 6 (6), 462-475 (2005).
- Bonanomi, D., et al. Ret Is a Multifunctional Coreceptor that Integrates Diffusible- and Contact-Axon Guidance Signals. Cell. 148 (2), 568-582 (2012).
- Brown, A. C., et al. Isolation and Culture of Cells from the Nephrogenic Zone of the Embryonic Mouse Kidney. J Vis Exp. (50), e2555(2011).
- Olympus Support. , Available from: http://www.olympusamerica.com/cpg_section/cpg_archived_product_details.asp?id=817 (2016).
- Grobstein, C. Inductive interaction in the development of the mouse metanephros. J Exp Zool. 130, 319-340 (1955).
- Saxén, L., Toivonen, S. Primary Embryonic Induction. , Academic Press. London. (1962).
- Saxén, L., Koskimies, O., Lahti, A., Miettinen, H., Rapola, J., Wartiovaara, J. Differentiation of kidney mesenchyme in an experimental model system. Adv Morphog. 7, 251-293 (1968).
- Dudley, A. T., Godin, R. E., Robertson, E. J. Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613 (1999).
- Perälä, N., et al. Sema4C-Plexin B2 signalling modulates ureteric branching in developing kidney. Differentiation. 81 (2), 81-91 (2011).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. J Embryol exp Morph. 82, 147-161 (1984).
- Watanabe, T., Costantini, F. Real-time analysis of ureteric bud branching morphogenesis. Dev Biol. 271, 98-108 (2004).
- Sebinger, D. D. R., Unbekandt, M., Ganeva, V. V., Ofenbauer, A., Werner, C., Davies, J. A. A Novel, Low-Volume Method for Organ Culture of Embryonic Kidneys That Allows Development of Cortico-Medullary Anatomical Organization. PLoS One. 5 (5), e10550(2010).
- Ekblom, P., Miettinen, A., Virtanen, I., Wahlström, T., Dawnay, A., Saxén, L. In vitro segregation of the metanephric nephron. Dev Biol. 84 (1), 88-95 (1981).
- Davies, J. A., Unbekandt, M. siRNA-mediated RNA interference in embryonic kidney organ culture. Methods Mol Biol. 886, 295-303 (2012).
- Saxén, L., Lehtonen, E. Embryonic kidney in organ culture. Differentiation. 36 (1), 2-11 (1987).
- Bard, J. B. L. The development of the mouse kidney embryogenesis writ small. Curr Opin Genet Dev. 2, 589-595 (1992).
- Davies, J. A. A method for cold storage and transport of viable embryonic kidney rudiments. Kidney Int. 70 (11), 2031-2034 (2006).
- Batourina, E., et al. Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Nat Genet. 32 (1), 109-115 (2002).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon