Method Article
Dissezione e cultura del rene embrionale del mouse
In questo articolo
Riepilogo
Questo protocollo descrive un metodo per isolare e coltivare rudimenti metanufricani da embrioni di topo.
Abstract
L'obiettivo di questo protocollo è quello di descrivere un metodo per la dissezione, l'isolamento e la cultura dei rudimenti metanofili del mouse.
Durante lo sviluppo del rene dei mammiferi, i due tessuti progenitrici, il germoglio ureterico e il mesenchim metanufrico, comunicano e reciprocamente inducono meccanismi cellulari per formare eventualmente il sistema di raccolta e i nefroni del rene. Poiché gli embrioni di mammiferi crescono intrauterini e pertanto sono inaccessibili all'osservatore, è stata sviluppata una cultura dell'organo. Con questo metodo è possibile studiare le interazioni epiteliali-mesenchimali e il comportamento cellulare durante l'organogenesi renale. Inoltre, l'origine di malformazioni del rene congenito e delle vie urogenitali può essere studiata. Dopo un'attenta dissezione, i rudimenti metanufricani vengono trasferiti su un filtro che galleggia sul mezzo di coltura e può essere mantenuto in un incubatore di colture di cellule per diversi giorni. Tuttavia, bisogna essere consapevoli che le condizioni sonoArtificiale e potrebbe influenzare il metabolismo nel tessuto. Inoltre, la penetrazione delle sostanze di prova potrebbe essere limitata a causa della matrice extracellulare e della membrana basale presente nell'esplosivo.
Un vantaggio principale della cultura dell'organo è che lo sperimentatore può ottenere l'accesso diretto all'organo. Questa tecnologia è economica, semplice e consente un gran numero di modifiche, come l'aggiunta di sostanze biologicamente attive, lo studio delle varianti genetiche e l'applicazione di tecniche di imaging avanzate.
Introduzione
The mammalian kidney is derived from two primordial structures with mesodermal origin: the tubular epithelial ureteric bud and the metanephric mesenchyme. During nephrogenesis, the ureteric bud invades the metanephric mesenchyme and branches to form the collecting system. The metanephric mesenchyme gives rise to the epithelial elements of the nephrons. These processes occur in a precisely timed and spatially coordinated manner and are initiated by reciprocal inductive mechanisms. Both tissue components communicate and affect the other's cell morphogenesis.
In the 1920s, it was Boyden who performed the in vivo obstruction of the mesonephric duct in chicken, providing the first indication of inductive interactions as separated nephric blastema fail to differentiate1. At about the same time, the first successful attempts to culture chicken nephric rudiments in a hanging drop were published. Subsequently, the organ culture was developed to study tissue interactions in mammalian organogenesis. In the 1950s, Grobstein developed a technique in which metanephric rudiments could be cultured on a filter. This technique was modified by Saxén, who placed the filter on a Trowell-type screen in a culture dish1. Over the years, many modifications and applications for organ culture have emerged. The method described here is based on Saxén's technique but is simplified, as the filters float free on the medium and the diameter of the culture well only slightly exceeds the diameter of the filter, limiting unwanted movement of the filter.
Whole-organ culture is a classical, cheap, and simple but powerful tool to investigate cellular processes and intercellular communication during organogenesis. Organ culture allows for treatment with biological agents, such as growth factors, antibodies, antisense oligonucleotides, viruses, and peptides, as well as with pharmaceutical compounds and other chemicals. Also, gene function may be studied using explants derived from genetically modified mice or using inducible gene inactivation technology, such as the Cre-loxP system. This allows for the study of genetic mutations that cause embryonic lethality prior to the development of the kidney. Organ culture can also be combined with fluorescent tagging for gene function or lineage tracing and modern imaging techniques, which enable real-time monitoring of cell behavior2.
In the specific example provided here, the effect of EphrinB2-activated Eph-receptor signaling on the branching morphology of the ureteric bud was investigated. The morphology of the EphA4/EphB2 double-knockout mice suggested several severe defects in kidney development, which were detectable as early as embryonic day 11 (E11) and involved the ureteric bud, the ureter, and the common nephric duct3. Signaling via Eph receptors requires the clustering of the ligand-receptor dimer4. To over-activate Eph signaling, the kidney rudiments from E11.5 mouse embryos were cultured in the presence of clustered recombinant EphrinB2-Fc. EphrinB2 is a known ligand for the EphA4 receptor, which is expressed in the ureteric bud tips3.
Protocollo
I topi sono stati mantenuti secondo la normativa svedese e la legislazione dell'Unione europea (2010/63 / UE). Tutte le procedure sono state eseguite seguendo le linee guida del comitato etico svedese (autorizza C79 / 9, C248 / 11 e C135 / 14). Le procedure presso l'Università di Heidelberg che coinvolgono soggetti di origine animale sono stati approvati dal Regierungspräsidium Karlsruhe e dagli Ufficiali di Benessere degli animali presso l'Università di Heidelberg.
1. Preparazione di reagenti e materiali per la cultura
NOTA: utilizzare una cappa a flusso laminare per ridurre al minimo la contaminazione.
- Nel giorno della dissezione, pre-cluster Fc umano solo o ricombinante proteina chimerica efrina fusa con Fc umana mescolandola con anticorpi caprini anti-umani Fc a un rapporto molare di 1: 5 in soluzione salina fosfata tamponata sterile (PBS). Incubare per 1 ora a 37 ° C 5 .
- Preparare il mezzo di coltura integrando il Modified Eagle Medium di Dulbecco: NutrienteLa miscela F-12 (DMEM / F12) con 1% di penicillina / streptomicina (v / v), 1% di glutammina (v / v), 1% di insulina transferrin-selenio (v / v), 50μg / Transferrin e 1,5 μg / mL di amfotericina.
NOTA: 10 ml di terreno è sufficiente per 16 embrioni. - Aggiungere una soluzione efrina ricombinata raggruppata a una concentrazione finale di 20 μg / mL al terreno di coltura. Usa Fc umano cluster come controllo.
- Preparare le piastre di coltura aggiungendo 500 μl di terreno di coltura a ciascun pozzetto di una piastra a 4 pozzetti in polistirolo sterile e non rivestita.
- Utilizzando pinze sterili, posizionare con cura un filtro a membrana in policarbonato con una dimensione di pori di 5 μm per pozzetto in cima al mezzo. Trasferire la piastra preparata all'incubatore (37 ° C / 5% CO 2 ). Assicurarsi che il filtro rimanga asciutto sulla superficie superiore e fluttua.
NOTA: Un filtro è sufficiente per due anlagen renali. - Usando una lama di rasoio, tagliare circa 30 punte pipetta (volume: 100 μL) approssimativamenteY 1 mm dalla punta per provocare un'ampia apertura. Riposizionare le punte in un rack di pipetta.
2. Dissezione dei Rudiments di Metanephric a E11.5
- Sacrificare un mouse in gravidanza a E11.5 con dislocazione cervicale (o utilizzando un metodo approvato dal comitato etico locale).
- Rimuovere l'utero e gli embrioni, come descritto da Brown e altri 6 . Da questo punto in avanti, lavorare sotto un microscopio di dissezione.
- Usando la pinza da orologeria n. 5, tagliate l'embrione direttamente sotto i piedini anteriori. Usa un piatto di Petri fresco per ogni embrione. Rimuovere le gambe e la coda dell'embrione. Per fare questo, afferrare il tessuto da rimuovere con una coppia di pinze da orologeria n. 5 e utilizzare le punte di una seconda coppia da tagliare.
- Per rimuovere la massa degli organi ventrali, utilizzare le punte di una coppia di pinze per aprire lateralmente la parete del corpo dell'embrione in una direzione rostrale-caudale.
- Tagliare superficialmente, parallelo a tL'aorta dorsale. Utilizzare l'aorta dorsale piena di sangue e quindi visibile per orientarsi. Separare con cautela la parte ventrale della parete del corpo dalla parte dorsale utilizzando le punte delle pinze chiuse e far girare l'embrione. Tagliare lateralmente la parete del corpo in una direzione rostrale-caudale e utilizzare l'aorta dorsale per l'orientamento, come per il lato precedente.
- Una volta che la parete ventrale del corpo è stata separata dal corpo dorsale, afferrarlo con una coppia di pinze e tirare attentamente per rimuoverla insieme alla massa dell'organo.
NOTA: L'anlagen di metanufricoltura di solito rimane attaccato alla parete del corpo dorsale. Sono strutture ovali, ~ 200 μm situate a livello degli arti posteriori. - Tenere la parete del corpo dorsale con una coppia di pinze, con il lato ventrale rivolto verso l'alto. Utilizzando l'altra coppia di pinze, afferrare l'aorta dorsale alla sua estremità rostrale e sbucchiare attentamente l'aorta dorsale dalla parete del corpo dorsale.
NOTA: entrambi i reni metanfricari di solito rimangono attaccatiL'aorta dorsale. - Usando una coppia di pinze, tagliare rostrally al rene anlagen per rimuovere l'aorta. Quindi, separare con attenzione i due anlagen renali utilizzando le punte delle pinze.
- Scorri con cautela il tessuto indesiderato dal rene anlagen usando le punte delle pinze. Fare attenzione a non danneggiare il mesenchima, in quanto i danni possono provocare una scarsa crescita ed escludere l'esplante dall'ulteriore analisi.
- Trasferire separatamente il rene anlagen usando una pipetta di microlitro e una punta di pipetta ampiamente aperta in 10 μL di PBS al filtro a membrana in policarbonato in una piastra a 4 pozzetti.
NOTA: a causa della tensione superficiale, l'esplante sarà coperto con uno strato sottile di media. Un filtro è sufficiente per due anlagen renale.- Posizionare ciascuno dei due anlagen al centro di ciascuna rispettiva metà del filtro. Trasferire la piastra all'incubatore a 37 ° C / 5% CO 2 . Lasciare la piastra nell'incubatrice finché non si avvicina il metanufricoLe imitazioni dell'embrione successivo sono pronte per essere poste sul filtro.
- Ripetere i passaggi 2.3-2.9.1 per ogni embrione.
NOTA: con una certa pratica, la procedura di dissezione richiederà circa 5 minuti per embrione. - Incubare il rene anlagen per 3 giorni a 37 ° C / 5% CO 2 .
3. Preparazione dei reagenti per la fissazione e la colorazione
- Per preparare 4% di paraformaldeide (PFA) in PBS senza calcio e magnesio (p / v), sciogliere il PFA a 60 ° C in PBS, continuando a mescolare. Riscaldare a temperatura ambiente e utilizzare un filtro di carta per rimuovere le particelle rimanenti. Aliquota e conservare a 4 ° C per uso immediato o congelare per l'immagazzinamento a lungo termine.
ATTENZIONE: PFA è tossico. Indossare l'attrezzatura di protezione individuale specificata negli standard locali di sicurezza e lavorare in una cappa di fumo. Scartare i rifiuti seguendo le linee guida istituzionali e utilizzare contenitori di rifiuti designati. - Per preparare la soluzione di permeabilizzazione, diluire Triton X-100In PBS senza calcio e magnesio allo 0,3% (v / v).
- Per preparare la soluzione di blocco, aggiungere il siero di capra del 5% (v / v) e lo 0,1% di Triton X-100 a PBS senza calcio e magnesio. Aggiungere azidi di sodio ad una concentrazione finale di 0,02% (w / v). Conservare a 4 ° C.
ATTENZIONE: l'azido di sodio è tossico. Maneggiare l'azide di sodio in conformità alle normative locali in materia di sicurezza e ambiente.
NOTA: quando si utilizzano anticorpi per la colorazione, utilizzare il siero del 5% della specie che è stato derivato dall'anticorpo secondario per realizzare una soluzione di blocco. - Diluire l'agglutinina Dolichorus biflorus biotinilata 1: 200 in soluzione di blocco. Diluire streptavidina coniugata Alexa488 1: 200 in soluzione di blocco.
- Per ottenere il mezzo di incisione pronto per l'uso (vedere la tabella dei materiali), aggiungere 0,1 g di glicerolo al 25% (w / v) in 0,1 m di Tris-HCl (pH 8,5) . Riscaldare a 50 ° C sotto agitazione continua per 1 h, raffreddare e regolare il pH a 8.0-8.5 usando 1M NaOH. Evitare concentrazioni più elevate di NaOH. Aggiungere 100 μg / mL N-propilgallato e timerosale ad una concentrazione finale di 0,02% (w / v). Mescolare per 30 minuti a temperatura ambiente.
ATTENZIONE: Thimerosal è tossico. Maneggiarlo conformemente alle normative locali in materia di sicurezza e ambiente.- Riempire il supporto di incorporazione in tubi da 50 ml, bilanciare il rotore e centrifugare a 3.200 xg e la temperatura ambiente per 10 min. Decantare la soluzione chiara in 15 mL tubi e scartare il pellet. Aliquota e conservare a -20 ° C per diverse settimane. Una volta scongelata, mantenere la soluzione a 4 ° C. Riscaldare a ~ 30 ° C immediatamente prima dell'uso.
- Preparare il maggior numero di diapositive in vetro come filtri con esplanti. Per questo, incollare due piccole copertine, 18 x 18 mm, su entrambi i lati del vetrino con l'adesivo istantaneo, lasciare uno spazio di circa 15 mm per il filtro.
4. Fissazione e colorazione
- Dopo un periodo di coltura di 3Giorni in vitro (div), togliere le piastre dall'incubatore e aspirare attentamente il mezzo di coltura da ciascun pozzetto utilizzando una micropipetta. Assicurarsi di non toccare il filtro e mantenerla aperta verso la parete del pozzetto.
- Aggiungere 500 μl di 4% di PFA / PBS a ciascun pozzetto. I filtri galleggiano sul fissativo. Utilizzando una micropipetta, aggiungete con cautela il fissativo PFA per sottomettere i filtri. Incubare a temperatura ambiente per 30 min.
NOTA: Per tutte le fasi successive, occorre prestare attenzione a non lavare le esplosioni dal filtro. Tenere l'apertura della punta della pipetta verso la parete del pozzetto. - Rimuovere il PFA e risciacquare due volte con 500 μl di PBS, sommersando il filtro. Aggiungere a ciascun pozzetto 500 μL di soluzione di permeabilizzazione e incubare a temperatura ambiente per 1 h.
- Sciacquare due volte con 500 μl di PBS e aggiungere a ciascun pozzetto 500 μL di soluzione di blocco. Incubare a temperatura ambiente per 1 ora.
- Sostituire la soluzione di blocco con250 μl di agglutinina biflorus biotinilata Dolichorus diluita 1: 200 in soluzione di blocco e incubare a 4 ° C per 24 ore.
- Rimuovere la soluzione di agglutinina Doliforum biflorus e risciacquare due volte con 500 μL di PBS per pozzetto.
- Aggiungere 250 μL di streptavidina coniugata con Alexa488, diluita 1: 200 in soluzione di blocco e incubare a 4 ° C per 24 ore. In alternativa, incubare a temperatura ambiente per 2 ore.
NOTA: si ottiene un migliore rapporto segnale-rumore quando incubato a 4 ° C. - Sciacquare due volte con 500 μl di PBS per pozzetto. Utilizzando la pinza, trasferire i filtri sulle vetrate preparate, con gli esplanti rivolti verso l'alto. Montare con ~ 50-100 μL di supporto incorporante. Copertura con coperchio da 1,5 mm di lunghezza da 60 mm. Lasciare che la soluzione di media incorporante si solidifichi per 2 ore a temperatura ambiente al buio. Procedere all'immagine o conservare le diapositive, avvolte in fogli, a 4 ° C fino a quando non sarà pronto per l'immagine.
- Immagine con un ampio campo di epifluorescenza microscopio 7 </ Sup> accoppiato ad una lampada Hg e utilizzare una unità a specchio per eccitazione blu (banda di eccitazione, 460 - 495 nm, specchio bicromato, 505 nm e banda di emissione, 510 - 550 nm) e 20x Plan-Apochromat lenti, 0,75 numeri apertura.
Risultati
L'anlagen renale metanico è stato derivati da topi in gravidanza Black-6 in E11.5 e sono stati coltivati. Dopo 3 giorni, il germoglio ureterico era ramificato fino a 5 volte, con conseguente ramificazione del germoglio uretrico inizialmente a forma di T. Ogni esplante è stato fotografato e il numero di segmenti e endpoint è stato quantificato per determinare le generazioni di ramificazione e per calcolare il numero di endpoint per ramo ( Figura 1 ). ImageJ (generazione di secondo, la quarta generazione è stata raggiunta solo nell'8% delle esplosioni trattate, rispetto al 35% delle esplosioni di controllo ( Figura 1b ). Di conseguenza, il numero di endpoint per ramo e endpoint per mm 2 Inoltre, un terzo degli esplanti aveva una morfologia insolita nei suggerimenti del budello uretrico ( Figura 1 ). Questi risultati suggeriscono che EphrinB2 potrebbe avere un effetto limitanteSul processo di ramificazione uretrica, probabilmente attivando la segnalazione in avanti di EphA4 e EphB2.
Per un esperimento di successo, è fondamentale che il mesenchim metanufrico non venga danneggiato durante la dissezione. Qualsiasi lesione del mesenchimo riduce il potenziale induttivo, porta a ramificazioni urinarie ridotte o assenti e potrebbe essere una fonte di bias. L'esempio nella Figura 2A mostra un esplante dove il mesenchimo è quasi mancante. Il germoglio ureterico non si è spostato oltre la fase T. La Figura 2B mostra un esempio in cui il danno del mesenchim metanufrico ha portato alla crescita e alla ramificazione poveri. Entrambi gli esplanti devono essere esclusi dall'analisi.
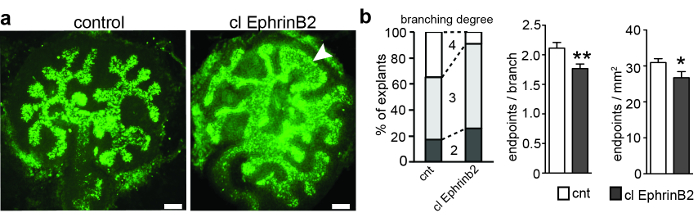
Figura 1: E11.5 Ananas del rene del metanofricano coltivato per 3 div e trattato con cluster EphrinB2 o cluster ricombinanteIl Fc umano come un controllo. ( A ) L'anlagen renale metanico è stato disciolto a E11.5, coltivato per 3 div e macchiato con agglutinina biflorus biotinilata e streptavidina conica Alexa488. Gli esplanti sono stati immagazzinati con un microscopio di epifluorescenza a larga scala con un passaggio di banda di eccitazione di 460-495 nm, uno specchio bicromato di 505 nm, un passaggio di banda di emissione di 510-550 nm e lenti Plan-Apochromat 20X. L'applicazione di EphrinB2 ricombinante cluster (clEphrinB2) ha determinato una ridotta complessità di ramificazione e una malformazione dei suggerimenti del bocciolo uretrico (punta di freccia). ( B ) Il grafico a sinistra mostra le generazioni di ramificazione in clEphrinB2 trattate ed esplosivi di controllo. La 4a generazione di ramificazione è stata raggiunta solo nell'8% delle esplosioni trattate, rispetto al 35% delle esplosioni di controllo. Il numero di endpoint per ramo (grafico centrale) e endpoint per area (grafico a destra) è stato ridotto (endpoint per ogni CNT di ramo, 2.1 ± 0.09, clEphrinB2, 1.7± 0,08, P = 0,007 **; Endpoint per millimetro quadrato: CNT, 31 ± 0.01; ClEphrinB2, 27 ± 0,02; P = 0,04 *; N = 23). I dati sono presentati come media ± SEM ed è stata utilizzata una t-test Student unpaired. Barra di scala = 100 μm. Questa cifra è stata modificata da Peuckert et al. , 2016 3 . Clicca qui per visualizzare una versione più grande di questa figura.
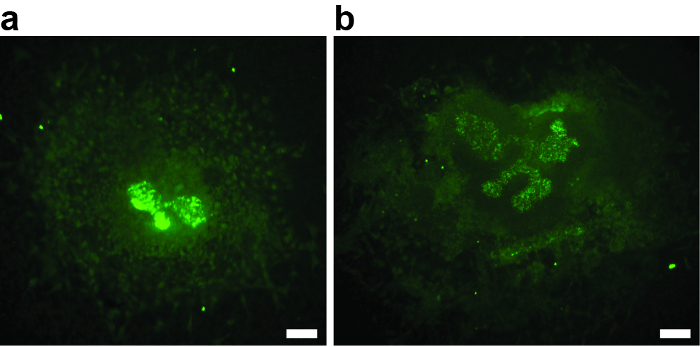
Figura 2: Esempi di due E11.5 ananassi renali metanarici che sono stati danneggiati durante la dissezione, coltivati per 3 div e macchiati con biotinilato Doliforum Biflorus Agglutinina e Streptavidin coniugato Alexa488. ( A e B ) Il danno del mesenchimo ha provocato una crescita povera o assente e ramificazione uretrica di germi,Escludendo gli esplanti dall'ulteriore analisi. ( A ) esplante di reni del Metanephric dopo 3 div, con assenza di ramificazione ureterica di germoglio. Solo il primo ramo della fase T è visibile. ( B ) esplante di reni del Metanephric dopo 3 div, con sfumatura del budello ureterico poveri. Barra di scala = 60 μm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Questo manoscritto descrive un metodo per isolare l'anlagen metanofrico in sviluppo dall'embrione del topo e per coltivare i rudimenti degli organi. Questo metodo è una tecnica standard, come sviluppato da Grobstein 8 e Saxén 9 , 10 ed è stato adattato e modificato da molti altri 11 , 12 . Il successo del metodo dipende principalmente dalla durata della dissezione, in quanto la sopravvivenza dell'esplante e il potenziale induttivo diminuiscono con il tempo di dissezione prolungato. È inoltre necessario prestare attenzione a non danneggiare il mesenchima durante la pulizia del rudimento del rene dal tessuto circostante. Il danno del mesenchim metanufrico è spesso il motivo della scarsa crescita degli esplanti. Tuttavia, la velocità di dissezione e le competenze motorie fine aumentano notevolmente con la pratica.
Il mezzo chimico definito nel protocollo presentato viene comunemente usato per sostituire ilContenente siero in cellule primarie e cultura dell'organismo in vitro e contiene una miscela 1: 1 (v / v) di DMEM e F-12 di Ham, integrata con insulina-trasferin-selenio per supportare la crescita e la sopravvivenza degli esplanti. L'assorbimento di glucosio e amminoacido, la lipogenesi e il trasporto intracellulare sono facilitati dall'insulina. Il selenio, un cofattore per la glutatione perossidasi, funge da antiossidante. Transferrin è un supporto di ferro che aiuta a proteggere dai radicali dell'ossigeno. Nella coltura embrionale del rene, l'aggiunta di transferrina al medium aumenta la differenziazione tubulare e l'incorporazione della timidina in modo dipendente dalla dose, con un effetto massimo di circa 50 μg / mL 13 . Pertanto, l'umano-holo-trasferinina viene ulteriormente integrato nel mezzo, determinando una concentrazione finale di transferrina di circa 55 μg / ml. Molti protocolli, che utilizzano una composizione più semplice ma chimicamente meno definita, con il Minimal Essential Medium di Eagle(MEM) o DMEM e 10% di siero ( cioè, siero fetale bovino, FBS) forniscono anche risultati molto soddisfacenti 12 , 13 , 14 , 15 . Tuttavia, possono verificarsi varianti tra diversi lotti di FBS. Per evitare tali variazioni e per escludere eventuali interferenze di fattori di crescita presenti nel siero con segnalazione Eph, è stato scelto il mezzo senza siero. La decisione di utilizzare il mezzo senza siero dipende dalla configurazione sperimentale e dalla questione scientifica. Saranno particolarmente richieste condizioni culturali prive di sieri quando l'obiettivo finale è l'applicazione terapeutica. Amphotericina B, l'agente antifungino incluso in questo protocollo, può essere omesso. Il periodo di coltura nell'esempio presentato è stato di 3 giorni, ma i rudimenti renali metanufricidi possono essere coltivati fino a 10 giorni 15 . Nelle colture superiori ai 3 giorni, il mezzo deve essere cambiato ogni 48 ore. Lo sviluppo del kidnI rudimenti in vitro recapitulano la sequenza in vivo di aggregati pre-tubolari, vescicole renali e corpi a virgola e a forma di S. Dopo 3 giorni in vitro , le strutture glomerulari hanno formato 15 , 16 . Nelle culture più lunghe, l'area esplante aumenta ulteriormente a causa della continua ramificazione del germoglio ureterico. A circa 5 giorni di coltura, i nefroni si sono segregati in segmenti distali, medi e proximal 16 .
Nonostante la relativa facilità e efficienza dei costi della tecnica, consentendo applicazioni versatili, alcune considerazioni dovrebbero essere tenute in considerazione quando pianificare esperimenti e interpretare i risultati. A causa della matrice extracellulare e della membrana basale presenti negli organi coltivati, la diffusione di agenti e particelle esogeni è limitata 17 . Inoltre, le condizioni di coltura artificiale e le manipolazioni possono causare cambiamenti nel metabolismoDel tessuto e del comportamento delle cellule che si differenzia dalla situazione in vivo 15 , 18 . Più notevolmente, gli esplanti mancano di approvvigionamento di sangue, ei glomeruli sono avascolari; Sebbene i nefri divengano segmentati, la zonazione e la formazione di una medulla e degli anelli di Henle mancano 14 , 19 . Così, lo spettro di applicazione della coltura embrionale del rene è limitato alle strutture tubolari, alla loro morfologia di ramificazione e alle interazioni mesenchimali-epiteliali. Di conseguenza, le questioni scientifiche che mirano alla funzione renale non possono essere risolte.
Le recenti modificazioni del metodo di coltura in cui i rudimenti del rene sono coltivati su vetro rivestito in uno sviluppo organotipico a basso volume fino a zonazione cortico-medullare con estremità estesi di Henle 15 . Vale anche la pena notare che, recentemente, un metodo per conservare e preservare la vitaSono stati pubblicati reni embrionali. Questo metodo consente il trasporto di rudimenti reni embrionali a E11.5 per diversi giorni e consente loro di essere coltivati in seguito. Questo è di particolare interesse per le collaborazioni 20 . La natura della cultura del rudimento intero rene consente una varietà di adattamenti metodologici, tra cui tecniche di imaging avanzate. Per evitare disturbi durante la riproduzione in tempo reale, si consiglia di sostituire il galleggiante con un filtro fisso, ad esempio un inserto a transwell. La tecnologia presentata è stata persino ampliata in blocchi di tessuti culturali che contengono l'intero tratto urogenitale. Utilizzando questa cultura espansa, l'inserzione uretrica nella vescica può essere studiata 21 .
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Gli autori ringraziano Leif Oxburgh e Derek Adams per aver generosamente condiviso la loro conoscenza, Leif Oxburgh per i commenti utili sul manoscritto e Stefan Wölfl e Ulrike Müller per il loro sostegno tecnico e per Saskia Schmitteckert, Julia Gobbert, Sascha Weyer e Viola Mayer laboratorio. Questo lavoro è stato sostenuto da Development, The Company of Biologists (a CP).
Materiali
| Name | Company | Catalog Number | Comments |
| DMEM/F-12 | Thermo Fisher Scientific | 21331020 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140148 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | |
| DPBS, calcium, magnesium | Thermo Fisher Scientific | 14040117 | use for dissection |
| holo-Transferrin human | Sigma-Aldrich | T0665 | |
| Insulin-Transferrin-Selenium (ITS -G) (100x) | Thermo Fisher Scientific | 41400045 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Amphotericin B solution | Sigma-Aldrich | A2942 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Sodium azide | Sigma-Aldrich | S8032 | |
| Thimerosal | Sigma-Aldrich | T5125 | |
| Propyl gallate | Sigma-Aldrich | 2370 | |
| Mowiol 4-88 | Sigma-Aldrich | 81381 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Biotinylated Dolichorus Biflorus Agglutinin | Vector Laboratories | B-1035 | |
| Alexa488 conjugated Streptavidin | Jackson Immuno Research | 016-540-084 | |
| Recombinant Mouse Ephrin-B2 Fc Chimera Protein, CF | R&D Systems | 496-EB | |
| Recombinant Human IgG1 Fc, CF | R&D Systems | 110-HG-100 | |
| Goat Anti-Human IgG Fc Antibody | R&D Systems | G-102-C | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417 | use for fixation and immunostaining |
| Dumont #5, biologie tips, INOX, 11 cm | agnthos.se | 0208-5-PS | 2 pairs of forceps are needed |
| Iris scissors, straight, 12 cm | agnthos.se | 03-320-120 | |
| Dressing Forceps, straight, delicate, 13 cm | agnthos.se | 08-032-130 | |
| Petri dishes Nunclo Delta treated | Thermo Fisher Scientific | 150679 | |
| TMTP01300 Isopore Membrane Filter, polycarbonate, Hydrophilic, 5.0 µm, 13 mm, white, plain | MerckMillipore | TMTP01300 | |
| Nunclon Multidishes 4 wells, flat bottom | Sigma-Aldrich | D6789-1CS | |
| Microscope cover glass 24 x 50 mm thickn. No.1.5H 0.17+/-0.005 mm | nordicbiolabs | 107222 | |
| Cover glasses No.1.5, 18 mm x 18 mm | nordicbiolabs | 102032 | |
| Slides ~76 x 26 x 1, 1/2-w. ground plain | nordicbiolabs | 1030418 | |
| VWR Razor Blades | VWR | 55411-055 | |
| 50 mL centrifuge tubes | Sigma-Aldrich | CLS430828 | |
| 15 mL centrifuge tubes | Sigma-Aldrich | CLS430055 | |
| Whatman prepleated qualitative filter paper, Grade 113V, creped | Sigma-Aldrich | WHA1213125 | |
| Fixed stage research mircoscope | Olympus | BX61WI | |
| Black 6 inbred mice, male, C57BL/6NTac | Taconic | B6-M | |
| Black 6 inbred mice,female, C57BL/6NTac | Taconic | B6-F | |
| Greenough Stereo Microscope | Leica | Leica S6 E |
Riferimenti
- Saxén, L. Organogenesis of the kidney. Developmental and Cell Biology Series. 19, Cambridge University Press. (1987).
- Lindström, N. O., et al. Integrated β-catenin, BMP, PTEN, and Notch signalling patterns the nephron. eLife. 4, e04000(2015).
- Peuckert, C., et al. Multimodal Eph/Ephrin signaling controls several phases of urogenital development. Kidney Int. 90 (2), 373-388 (2016).
- Pasquale, E. B. Eph receptor signalling casts a wide net on cell behaviour. Nat Rev Mol Cell Biol. 6 (6), 462-475 (2005).
- Bonanomi, D., et al. Ret Is a Multifunctional Coreceptor that Integrates Diffusible- and Contact-Axon Guidance Signals. Cell. 148 (2), 568-582 (2012).
- Brown, A. C., et al. Isolation and Culture of Cells from the Nephrogenic Zone of the Embryonic Mouse Kidney. J Vis Exp. (50), e2555(2011).
- Olympus Support. , Available from: http://www.olympusamerica.com/cpg_section/cpg_archived_product_details.asp?id=817 (2016).
- Grobstein, C. Inductive interaction in the development of the mouse metanephros. J Exp Zool. 130, 319-340 (1955).
- Saxén, L., Toivonen, S. Primary Embryonic Induction. , Academic Press. London. (1962).
- Saxén, L., Koskimies, O., Lahti, A., Miettinen, H., Rapola, J., Wartiovaara, J. Differentiation of kidney mesenchyme in an experimental model system. Adv Morphog. 7, 251-293 (1968).
- Dudley, A. T., Godin, R. E., Robertson, E. J. Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613 (1999).
- Perälä, N., et al. Sema4C-Plexin B2 signalling modulates ureteric branching in developing kidney. Differentiation. 81 (2), 81-91 (2011).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. J Embryol exp Morph. 82, 147-161 (1984).
- Watanabe, T., Costantini, F. Real-time analysis of ureteric bud branching morphogenesis. Dev Biol. 271, 98-108 (2004).
- Sebinger, D. D. R., Unbekandt, M., Ganeva, V. V., Ofenbauer, A., Werner, C., Davies, J. A. A Novel, Low-Volume Method for Organ Culture of Embryonic Kidneys That Allows Development of Cortico-Medullary Anatomical Organization. PLoS One. 5 (5), e10550(2010).
- Ekblom, P., Miettinen, A., Virtanen, I., Wahlström, T., Dawnay, A., Saxén, L. In vitro segregation of the metanephric nephron. Dev Biol. 84 (1), 88-95 (1981).
- Davies, J. A., Unbekandt, M. siRNA-mediated RNA interference in embryonic kidney organ culture. Methods Mol Biol. 886, 295-303 (2012).
- Saxén, L., Lehtonen, E. Embryonic kidney in organ culture. Differentiation. 36 (1), 2-11 (1987).
- Bard, J. B. L. The development of the mouse kidney embryogenesis writ small. Curr Opin Genet Dev. 2, 589-595 (1992).
- Davies, J. A. A method for cold storage and transport of viable embryonic kidney rudiments. Kidney Int. 70 (11), 2031-2034 (2006).
- Batourina, E., et al. Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Nat Genet. 32 (1), 109-115 (2002).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon