Method Article
마우스 배아 신장의 해부 및 배양
요약
이 프로토콜은 마우스 배아에서 metanephric의 기초를 분리하고 배양하는 방법을 설명합니다.
초록
이 프로토콜의 목표는 마우스 metanephric 기초의 해부, 격리 및 문화에 대한 방법을 설명하는 것입니다.
포유류 신장이 발달하는 동안 두 개의 전구 세포 조직, 즉 ureteric bud와 metanephric mesenchyme은 세포 기작을 전달하고 상호 작용하여 결국 포집 시스템과 신장의 네프론을 형성합니다. 포유류 배아가 자궁 내에서 자라며 관찰자가 접근하기 어렵 기 때문에 장기 배양이 개발되었습니다. 이 방법을 사용하면 신장 조직 형성 과정에서 상피 간엽 상호 작용과 세포 행동을 연구 할 수 있습니다. 또한 선천성 신장 및 비뇨 생식기 기형의 기원을 조사 할 수 있습니다. 조심스럽게 해부 된 후, metanephric 기초 물질은 배양 배지에 떠있는 필터로 옮겨져 며칠 동안 세포 배양기에 보관 될 수 있습니다. 그러나 조건은 다음과 같습니다.인공이며 조직의 신진 대사에 영향을 줄 수 있습니다. 또한, 시험 물질의 침투는 체외 이식편에 존재하는 세포 외 기질 및 기저막으로 인해 제한 될 수있다.
기관 문화의 한 주요 이점은 실험자가 기관에 직접 접근 할 수 있다는 것입니다. 이 기술은 저렴하고 간단하며 생물학적 활성 물질의 첨가, 유전 변이의 연구, 진보 된 영상 기술의 적용과 같은 많은 수정을 가능하게합니다.
서문
The mammalian kidney is derived from two primordial structures with mesodermal origin: the tubular epithelial ureteric bud and the metanephric mesenchyme. During nephrogenesis, the ureteric bud invades the metanephric mesenchyme and branches to form the collecting system. The metanephric mesenchyme gives rise to the epithelial elements of the nephrons. These processes occur in a precisely timed and spatially coordinated manner and are initiated by reciprocal inductive mechanisms. Both tissue components communicate and affect the other's cell morphogenesis.
In the 1920s, it was Boyden who performed the in vivo obstruction of the mesonephric duct in chicken, providing the first indication of inductive interactions as separated nephric blastema fail to differentiate1. At about the same time, the first successful attempts to culture chicken nephric rudiments in a hanging drop were published. Subsequently, the organ culture was developed to study tissue interactions in mammalian organogenesis. In the 1950s, Grobstein developed a technique in which metanephric rudiments could be cultured on a filter. This technique was modified by Saxén, who placed the filter on a Trowell-type screen in a culture dish1. Over the years, many modifications and applications for organ culture have emerged. The method described here is based on Saxén's technique but is simplified, as the filters float free on the medium and the diameter of the culture well only slightly exceeds the diameter of the filter, limiting unwanted movement of the filter.
Whole-organ culture is a classical, cheap, and simple but powerful tool to investigate cellular processes and intercellular communication during organogenesis. Organ culture allows for treatment with biological agents, such as growth factors, antibodies, antisense oligonucleotides, viruses, and peptides, as well as with pharmaceutical compounds and other chemicals. Also, gene function may be studied using explants derived from genetically modified mice or using inducible gene inactivation technology, such as the Cre-loxP system. This allows for the study of genetic mutations that cause embryonic lethality prior to the development of the kidney. Organ culture can also be combined with fluorescent tagging for gene function or lineage tracing and modern imaging techniques, which enable real-time monitoring of cell behavior2.
In the specific example provided here, the effect of EphrinB2-activated Eph-receptor signaling on the branching morphology of the ureteric bud was investigated. The morphology of the EphA4/EphB2 double-knockout mice suggested several severe defects in kidney development, which were detectable as early as embryonic day 11 (E11) and involved the ureteric bud, the ureter, and the common nephric duct3. Signaling via Eph receptors requires the clustering of the ligand-receptor dimer4. To over-activate Eph signaling, the kidney rudiments from E11.5 mouse embryos were cultured in the presence of clustered recombinant EphrinB2-Fc. EphrinB2 is a known ligand for the EphA4 receptor, which is expressed in the ureteric bud tips3.
프로토콜
마우스는 스웨덴의 규정 및 EU 법령 (2010 / 63 / EU)에 따라 유지 관리되었습니다. 모든 절차는 스웨덴 윤리위원회 (C79 / 9, C248 / 11 및 C135 / 14 허가)의 지침에 따라 수행되었습니다. 동물과 관련된 하이델베르그 대학의 절차는 하이델베르그 대학의 Regierungspräsidium Karlsruhe와 Animal Welfare Officers에 의해 승인되었습니다.
1. 시약 및 시약의 준비
참고 : 오염을 최소화하려면 층류 후드를 사용하십시오.
- 해부 당일에, 무균 인산 완충 식염수 (PBS) 중의 1 : 5의 몰비로 항 - 인간 Fc 염소 항체와 혼합함으로써 인간 Fc 단독 또는 인간 Fc에 융합 된 재조합 키메라 에프 린 단백질을 사전 - 클러스터링한다. 37 ° C에서 1 시간 동안 품어 둡니다. 5 .
- Dulbecco 's Modified Eagle Medium : Nutrient를 보충하여 배양 배지를 준비하십시오.1 % 페니실린 / 스트렙토 마이신 (v / v), 1 % 글루타민 (v / v), 1 % 인슐린 - 트랜스페린 - 셀레늄 (v / v), 50 μg / ml 인간 홀로 코 - 트랜스페린 및 1.5㎍ / mL 암포 테리 신이 포함된다.
참고 : 16 ML 배아의 10 ML 충분합니다. - 배양액에 최종 농도 20 μg / mL의 클러스터 된 재조합 에프린 용액을 첨가합니다. 클러스터 된 인간 Fc를 대조군으로 사용하십시오.
- 무균, 코팅되지 않은 평평한 바닥 폴리스티렌 4 잘 접시의 각 우물에 문화 매체 500 μL를 추가하여 문화 플레이트를 준비합니다.
- 무균 포셉을 사용하여 신중하게 매체 상단에 구멍 당 5 μm의 기공 크기와 하나의 폴리 카보 네이트 멤브레인 필터를 놓으십시오. 인큐베이터 (37 ° C / 5 % CO 2 )에 준비 접시를 전송하십시오. 필터가 윗면이 마를 때까지 뜨고 플로트가 발생하는지 확인하십시오.
참고 : 두 개의 신장 혈관에 대해 하나의 필터로 충분합니다. - 면도날을 사용하여 대략 30 피펫 팁 (볼륨 : 100 μL) approximately 끝에서 1mm가 더 넓게 열립니다. 팁을 다시 피펫 - 팁 랙에 넣으십시오.
2. E11.5에서 Metanephric Rudiments의 해부
- 자궁 경부 탈구 (또는 지역 윤리위원회의 승인을받은 방법을 사용)하여 E11.5에서 임신 임신 한 마우스를 희생합니다.
- Brown 외 6 에 설명 된대로 자궁과 배아를 제거합니다. 이 시점에서 해부 현미경으로 작업하십시오.
- 5 번 시계 제조기 겸자를 사용하여 앞다리 바로 아래에서 배아를 잘라냅니다. 각 배아에 신선한 페트리 접시를 사용하십시오. 배아의 꼬리와 다리를 제거하십시오. 이렇게하려면 5 번 시계 제조기 집게 한 쌍으로 제거 할 조직을 잡고 두 번째 쌍의 끝을 사용하여 자릅니다.
- 복부 기관의 질량을 제거하려면, 꼬리의 주둥이 방향으로 배아의 몸 벽을 옆으로 열려면 한 쌍의 포셉의 팁을 사용하십시오.
- 외형 적으로 절단, t와 평행하게그는 지느러미 대동맥. 오리 엔테이션을 위해 혈액으로 채워지기 때문에 눈에 보이는 대동맥을 사용하십시오. 조심스럽게 폐쇄 포셉의 팁을 사용하여 등쪽 부분에서 신체 벽의 복부 부분을 분리하고 배아를 뒤집습니다. 앞면과 마찬가지로 몸통 벽을 옆으로 대동맥 - 꼬리 방향으로 절단하고 배부 대동맥을 사용하여 방향을 잡습니다.
- 복부 몸의 벽이 지느러미 몸체에서 분리되면, 한 쌍의 포셉으로 잡아서 신중하게 잡아 당겨 기관 덩어리와 함께 제거하십시오.
참고 : metanephric anlagen은 일반적으로 등쪽 몸 벽에 붙어있어. 그들은 타원형이며, 뒷다리 수준에 위치한 ~ 200 μm 길이의 구조물입니다. - 복부 쪽이 위로 향하게 한 쌍의 포 셉를 사용하여 등쪽 몸통 벽을 지킨다. 포셉의 다른 한 켤레를 사용하여, 그것의 주둥이 끝에서 등쪽 대동맥을 잡고 조심스럽게 몸의 벽에서 등 대동맥을 껍질.
참고 : 두 metanephric 신장은 일반적으로 붙어있어등 대동맥에 붙어있다. - 한 쌍의 포셉을 사용하여 신장 anlagen에 rostrally 잘라 대동맥을 제거하십시오. 그런 다음 신중하게 포 셉의 팁을 사용하여 두 신장 anlagen 분리하십시오.
- 조심스럽게 포셉의 팁을 사용하여 신장 anlagen에서 원치 않는 조직을 껍질. mesenchyme을 손상시키지 않도록주의하십시오. 손상은 추가 분석에서 explant의 성장 및 배제를 초래할 수 있습니다.
- 4 잘 접시에 폴리 카보 네이트 멤브레인 필터에 PBS 10 μL에 microliter 피펫과 와이드 오픈 피펫 팁을 사용하여 신장 anlagen을 별도로 전송합니다.
참고 : 표면 장력으로 인해 체외 이식편은 얇은 매질로 덮여 있습니다. 하나의 필터로 두 개의 신장 혈관이 충분합니다.- 두 개의 신장 anlagen 각 필터의 각 절반의 중심에 놓습니다. 37 ° C / 5 % CO 2 에서 배양기로 플레이트를 다시 옮긴다. metanephric rud 때까지 인큐베이터에 접시를 남겨주세요다음 배아에서 iments은 필터에 배치 할 준비가되었습니다.
- 각 배아에 대해 2.3-2.9.1 단계를 반복합니다.
참고 : 일부 연습으로 해부 절차는 배아당 약 5 분 걸립니다. - 37 ° C / 5 % CO 2 에서 3 일 동안 신장 anlagen을 품어.
3. 고정 및 염색을위한 시약의 준비
- 칼슘과 마그네슘 (w / v)이없는 PBS에서 4 % 파라 포름 알데히드 (PFA)를 준비하려면 PFA를 60 ℃에서 PBS에 녹여서 지속적으로 저어줍니다. 실온으로 식힌 다음 페이퍼 필터를 사용하여 남아있는 입자를 제거합니다. 분주하고 4 ° C에서 보관하여 즉시 사용하거나 장기간 보관할 수 있습니다.
주의 : PFA는 유독합니다. 지역 안전 표준에 명시된 개인 보호 장비를 착용하고 흄 후드에서 작업하십시오. 시설 지침에 따라 지정된 폐기물 용기를 사용하여 폐기물을 버립니다. - permeabilization solution을 준비하기 위해 희석 된 Triton X-1000.3 % (v / v)가되도록 칼슘과 마그네슘이없는 PBS에서 처리 하였다.
- 차단 용액을 준비하기 위해 5 % (v / v) 염소 혈청과 0.1 % Triton X-100을 칼슘과 마그네슘없이 PBS에 첨가한다. 나트륨 아자 이드를 0.02 % (w / v)의 최종 농도로 첨가한다. 4 ° C에서 보관하십시오.
주의 : 나트륨 아자 이드는 독성이 있습니다. 지역 안전 및 환경 보호 규정에 따라 나트륨 아자 이드를 취급하십시오.
참고 : 염색을 위해 항체를 사용하는 경우 2 차 항체가 유도 된 종에서 5 % 혈청을 사용하여 차단 용액을 만듭니다. - biotinylated Dolichorus biflorus agglutinin을 1 : 200으로 블로킹 용액으로 희석한다. Alexa488 - conjugated streptavidin을 1 : 200으로 블로킹 용액으로 희석하십시오.
- 즉시 사용할 수있는 배지 (물질 표 참조)를 만들기 위해 0.1M Tris-HCl (pH 8.5)에 녹인 25 % (w / v) 글리세롤에 0.1g의 수용성 폴리 비닐 알코올 계 점착제 / mL를 넣는다. . 연속 교반하에 50 ° C로 1 시간 가열하고 식힌 다음 1을 사용하여 pH를 8.0-8.5로 조정한다.M NaOH. NaOH 농도를 높이 지 마십시오. 0.02 % (w / v)의 최종 농도로 100 μg / mL의 N- 프로필 게 네이트와 티 메로 살을 첨가한다. 실온에서 30 분 동안 교반한다.
주의 : Thimerosal은 독성이 있습니다. 해당 지역의 안전 및 환경 보호 규정에 따라 취급하십시오.- 50 ML 튜브에 삽입 매체를 채우고, 로터를 균형을, 그리고 3,200 XG 및 10 분 실온에서 원심 분리기. 15 mL 튜브에 투명한 용액을 따라 내고 펠렛을 버린다. 분주하고 -20 ℃에서 몇 주 동안 보관하십시오. 해동되면 용액을 4 ° C에 유지한다. 사용 직전 ~ 30 ° C로 예열하십시오.
- explants와 필터가 장착 될만큼 많은 유리 슬라이드를 준비합니다. 이를 위해 인스턴트 접착제를 사용하여 유리 슬라이드 양쪽에 18 x 18 mm 크기의 작은 커버 슬립 2 개를 붙이고 필터 사이에 15 mm의 공간을 남겨 둡니다.
4. 고정 및 염색
- 배양 기간 3배양기에서 플레이트를 제거하고 조심스럽게 micropipette를 사용하여 각 우물에서 문화 매체를 대기음. 필터를 만지지 말고 팁 입구를 우물 벽쪽으로 유지하십시오.
- 각 우물에 4 % PFA / PBS 500 μL를 추가합니다. 필터는 정착액 위에 뜨게됩니다. 마이크로 피펫을 사용하여 PFA 고정액을 조심스럽게 첨가하여 필터를 잠수시킵니다. 실온에서 30 분 동안 품어 낸다.
참고 : 다음 단계를 수행 할 때 필터에서 외과 체를 씻어 내지 않도록주의해야합니다. 우물 벽을 향한 피펫 팁의 개방을 유지하십시오. - PFA를 제거하고 500 μL의 PBS로 두 번 헹구십시오. 각 우물에 permeabilization 솔루션 500 μL를 추가하고 1 시간 동안 실온에서 품어.
- PBS 500 μL로 두 번 씻어서 각 잘 차단 솔루션의 500 μL를 추가합니다. 실온에서 1 시간 동안 인큐베이션한다.
- 차단 용액을250 μL의 biotinylated Dolichorus biflorus agglutinin은 1 : 200으로 블로킹 용액으로 희석하고 4 ° C에서 24 시간 동안 배양한다.
- Dolichorus biflorus agglutinin 솔루션을 제거하고 잘 PBS 당 500μL로 씻어.
- Alexa488 - conjugated streptavidin 250 μL를 1 : 200 희석 용액에 첨가하고 4 ° C에서 24 시간 동안 배양하십시오. 또는 실온에서 2 시간 동안 배양하십시오.
참고 : 4 ° C에서 배양하면 더 나은 신호 대 잡음비가 달성됩니다. - 1 웰당 PBS 500 μL로 두 번 씻어. 집게를 사용하여 explants이 위로 향하게 준비 슬라이드에 필터를 전송합니다. 임베딩 매체 ~ 50-100 μL로 탑재하십시오. 60mm 길이의 1.5 번 커버 슬립으로 덮으십시오. 매질 용액을 실온에서 2 시간 동안 응고시킨다. 이미지 준비가 끝날 때까지 4 ° C에서 포일로 싸인 슬라이드를 이미지화하거나 보관하십시오.
- 와이드 필드 epifluorescence 현미경 7 </ sup>를 Hg- 램프에 연결하고 청색 여기 (여기 대역 통과, 460 - 495 nm, 이색 거울, 505 nm, 방출 대역, 510 - 550 nm) 및 20X Plan-Apochromat 렌즈 용 거울 장치를 사용하여 0.75 구멍.
결과
Metanephric kidn anlagen은 E11.5에서 임신 한 Black-6 근친 교배 마우스에서 추출하여 배양 하였다. 3 일 후, ureteric bud는 5 번까지 분지되었고, 그 결과 초기 T 자 형태의 ureteric bud가 분출되었다. 각 체외 이식편을 촬영하고 분지 생성량을 결정하고 분지 당 종말점 수를 계산하기 위해 분절 수와 종점을 정량화했습니다 ( 그림 1 ). ImageJ ( 제 4 세대), 제 4 세대는 처리 된 체외 이식편의 단 8 %에서만 달성되었으며, 대조 체외 이식편의 35 %와 비교하여 ( 그림 1b ), 따라서 분기 당 종점 및 ㎟ 당 종점은 또한 EphrinB2가 제한된 효과를 나타낼 수 있음을 시사한다 ( 그림 1 ).ureteric bud branching 과정에서 EphA4와 EphB2의 순방향 신호 전달을 활성화하는 것이 가장 가능성이 높습니다.
성공적인 실험을 위해서는 해부학 동안 metanephric mesenchyme이 손상되지 않는 것이 중요합니다. mesenchyme의 모든 부상은 유도 잠재력을 감소, 감소 또는 부재 ureteric 버드 분기에 리드, 편견의 원천이 될 수 있습니다. 그림 2A 의 예는 간엽이 거의없는 체외 이식편을 보여줍니다. ureteric bud는 T-stage를 넘어 가지 않았습니다. 그림 2B 는 metanephric mesenchyme의 손상이 가난한 성장과 분기로 이어지는 예를 보여줍니다. 두 explants는 분석에서 제외해야합니다.
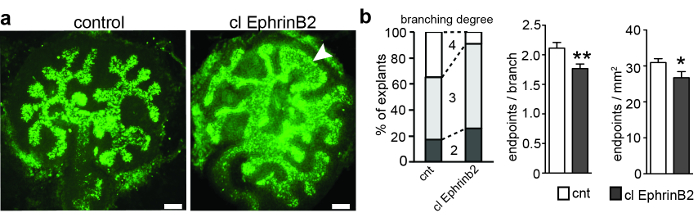
그림 1 : E11.5 Metanephric 신장 Anlagen 3 div에 대한 교양과 클러스터 재조합 EphrinB2 또는 클러스터와 치료통제로서 인간 Fc를 일으켰습니다. ( A ) Metanephric kidn anlagen을 E11.5에서 해부하고, 3div로 배양하고, biotinylated Dolichorus biflorus agglutinin과 Alexa488-conjugated streptavidin으로 염색 하였다. explants는 460-495 nm의 여기 bandpass, 505 nm의 dichromatic 거울, 510-550 nm의 방출 bandpass 및 20X 계획 Apochromat 렌즈와 광폭 epifluorescence 현미경으로 이미징되었습니다. 클러스터 된 재조합 EphrinB2 (clEphrinB2)의 적용은 분기의 복잡성과 ureteric bud 팁 (기형)의 기형을 감소시켰다. ( B ) 왼쪽 그래프는 clEphrinB2 처리 및 제어 explants의 분기 세대를 보여줍니다. 제 4 세대의 분지는 치료 된 체외 이식편의 단지 8 %에서만 얻어졌으며, 대조군의 체외 이식편의 35 %와 비교되었다. 한 지점 (중간 그래프) 당 끝점 수와 면적 당 끝점 수 (오른쪽 그래프)가 감소했습니다 (분기 CNT 당 종점, 2.1 ± 0.09, clEphrinB2, 1.7± 0.08, P = 0.007 **; 평방 밀리미터 당 종말점 : CNT, 31 ± 0.01; clEphrinB2, 27 ± 0.02; P = 0.04 *; n = 23). 데이터는 평균 ± SEM으로 표시하고 unpaired Student의 t- 검정을 사용했습니다. 스케일 바 = 100 μm. 이 수치는 Peuckert et al. , 2016 3 . 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
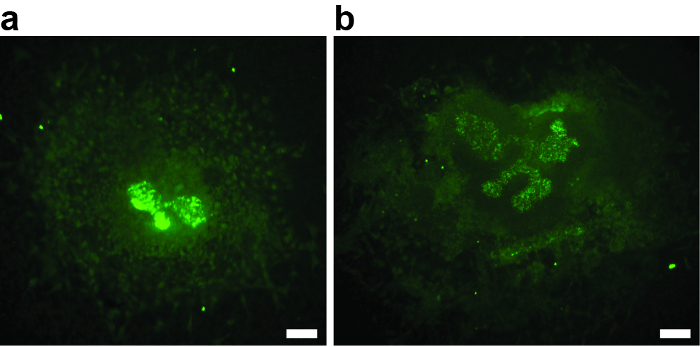
그림 2 : 해부 중에 손상된 2 개의 E11.5 Metanephric Kidney Anlagen의 예 : 3div로 배양하고 Biotinylated Dolichorus Biflorus Agglutinin 및 Alexa488- 접합 Streptavidin으로 염색 한 사례. ( A 와 B ) 중간 엽의 손상은 성장이 불량하거나 결핍되어 ureteric bud branching을 일으켰으며,explants 더 분석에서 실격. ( A ) 3 일 후에 Metanephric 신장 이식편, 결석 된 ureteric bud branching. 첫 번째 T- 스테이지 분기 만 보입니다. ( B ) 3 개월 후에 Metanephric 신장 이식편은 ureteric bud branching이 불량하다. 스케일 바 = 60 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 원고는 마우스 배아에서 발생하는 metanephric anlagen을 분리하고 장기 기초를 배양하는 방법을 설명합니다. 이 방법은 Grobstein 8 과 Saxén 9 , 10 에 의해 개발 된 표준 기법이며 많은 다른 사람들에 의해 수정되고 수정되었습니다 11 , 12 . 이 방법의 성공은 주로 절개의 지속 기간과 장기간의 절개 시간에 따른 생식 외 생존 및 유도 잠재력 감소에 달려 있습니다. 주변 조직으로부터 신장 조직을 제거 할 때 간 조직을 손상시키지 않도록주의해야합니다. metanephric mesenchyme의 손상은 종종 explants의 가난한 성장을위한 이유입니다. 그러나 절개 속도와 미세 운동 능력은 연습으로 크게 향상됩니다.
제시된 프로토콜에서 화학적으로 정의 된 매체는 일반적으로혈청을 함유 한 배지에서 1 일 1 회 (v / v) DMEM과 Ham 's F-12 혼합물을 함유하고 있으며, 체외 이식편의 성장과 생존을 지원하기 위해 인슐린 - 트랜스페린 - 셀레늄이 보충되었다. 포도당과 아미노산 섭취, 지방 생성 및 세포 내 수송은 인슐린에 의해 촉진됩니다. 글루타티온 퍼 옥시 다제의 보조 인자 인 셀레늄은 항산화 제로 작용합니다. Transferrin은 철 운반체로 산소 라디칼을 보호합니다. 배아 신장 배양에서, 배지에 트랜스페린을 첨가하면 배양 분화 및 티미 딘 도입이 용량 의존적으로 증가하고 최대 효과는 약 50㎍ / mL이다. 따라서 human-holo-transferrin을 배지에 추가로 보충하면 최종 transferrin 농도가 약 55 μg / mL가됩니다. 더 단순하지만 화학적으로 덜 정의 된 성분을 사용하는 많은 프로토콜은 Eagle 's Minimal Essential Medium(MEM) 또는 DMEM 및 10 % 혈청 ( 즉, 소 태아 혈청, FBS)도 매우 만족스러운 결과를 제공합니다 12 , 13 , 14 , 15 . 그러나, FBS의 서로 다른 로트 사이의 차이가 발생할 수 있습니다. 이러한 변화를 피하고 혈청에 존재하는 성장 인자의 Eph 신호 전달에 대한 가능한 간섭을 배제하기 위해 혈청이없는 배지를 선택했다. 무 혈청 배지를 사용할 지의 여부는 실험 설정과 과학적 질문에 달려 있습니다. 궁극적 인 목표가 치료 적용 일 때 무 혈청 배양 조건이 특히 필요할 것입니다. Amphotericin B,이 프로토콜에 포함 된 항진균제는 생략 할 수 있습니다. 제시된 예에서의 배양 기간은 3 일 이었지만, 메타 네프릭 신장 기원은 10 일까지 배양 할 수있다. 3 일을 넘는 배양에서는 매 48 시간마다 배지를 교환해야합니다. 유행의 발달시험 관내 체외 순환은 선 관상 응집체, 신장 소포 및 쉼표 및 S 자 모양 체의 생체 내 순서를 재현합니다. 체외에서 3 일 후에, 사구체와 같은 구조가 15 , 16이 되었다. 더 긴 배양 일 경우, ureteric bud의 계속 된 분지로 인해 explant area가 더 증가합니다. 문화의 약 5 일에서, nephrons는 원위, 중간 및 근위 세그먼트 16 으로 분리했다.
기술의 상대적 용이성과 비용 효율성에도 불구하고 다용도 응용 프로그램을 허용하기 때문에 실험을 계획하고 결과를 해석 할 때 몇 가지 고려 사항을 명심해야합니다. 배양 된 기관에 존재하는 세포 외 기질과 기저막 때문에 외인성 물질과 입자의 확산은 제한적입니다 17 . 또한, 인공 배양 조건 및 조작에 의해 대사 물이 변화 될 수있다조직의 조직 및 생체 내 상황과 다른 세포 행동 15 , 18 . 가장 현저하게, 체외 이식편은 혈액 공급이 부족하고 사구체는 무혈성이다. 네프론이 분열 되더라도, 죤의 형성과 뮬 럽 형성과 헨레의 루프는 14 , 19 개 빠져있다. 따라서, 배아 신장 배양의 적용 스펙트럼은 관형 구조, 분지 형태 및 간엽 상피 상호 작용에 국한된다. 결과적으로, 신장 기능을 목표로 한 과학적 질문은 다루어 질 수 없다.
Henle 15 의 연장 된 고리를 가진 대뇌 피질 수질 구획 (zortation)까지 심지어 체적이 낮은 유기체 형태의 발달에서 코팅 된 유리 위에서 신장 기원이 자라는 배양 방법의 최근 변형. 최근에는 생계를 저장하고 보존하는 방법도 주목할 만하다.배아 신장이 발표되었다. 이 방법은 E11.5에서 몇 일 동안 배아를 옮기고 나중에 배양 할 수있게한다. 이것은 특히 협력 20 에 관심이 있습니다. 전체 신장 기본 문화의 특성은 진보 된 영상 기술을 포함하여 다양한 방법 론적 적응을 가능하게합니다. 라이브 이미징 중에 방해가되는 움직임을 피하려면 트랜스웰 삽입 그림과 같은 고정 필터로 플로팅을 교체하는 것이 좋습니다. 제시된 기술은 심지어 전체 비뇨 생식기를 포함하는 조직 블록을 배양하기 위해 확장되었습니다. 이 팽창 된 배양 물을 사용하여 방광에 ureter 삽입을 조사 할 수 있습니다 21 .
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 Leif Oxburgh와 Derek Adams에게 도움을 주신 Leif Oxburgh와 Stefan Wölfl 및 Ulrike Müller와 Saskia Schmitteckert, Julia Gobbert, Sascha Weyer 및 Viola Mayer에게 도움을 주신 데 대해 감사드립니다. 랩. 이 작품은 개발, 생물 학자의 회사 (CP) 에 의해 지원되었다 .
자료
| Name | Company | Catalog Number | Comments |
| DMEM/F-12 | Thermo Fisher Scientific | 21331020 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher Scientific | 15140148 | |
| GlutaMAX Supplement | Thermo Fisher Scientific | 35050061 | |
| DPBS, calcium, magnesium | Thermo Fisher Scientific | 14040117 | use for dissection |
| holo-Transferrin human | Sigma-Aldrich | T0665 | |
| Insulin-Transferrin-Selenium (ITS -G) (100x) | Thermo Fisher Scientific | 41400045 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Amphotericin B solution | Sigma-Aldrich | A2942 | |
| Triton X-100 | Sigma-Aldrich | X100 | |
| Sodium azide | Sigma-Aldrich | S8032 | |
| Thimerosal | Sigma-Aldrich | T5125 | |
| Propyl gallate | Sigma-Aldrich | 2370 | |
| Mowiol 4-88 | Sigma-Aldrich | 81381 | |
| Glycerol | Sigma-Aldrich | G5516 | |
| Biotinylated Dolichorus Biflorus Agglutinin | Vector Laboratories | B-1035 | |
| Alexa488 conjugated Streptavidin | Jackson Immuno Research | 016-540-084 | |
| Recombinant Mouse Ephrin-B2 Fc Chimera Protein, CF | R&D Systems | 496-EB | |
| Recombinant Human IgG1 Fc, CF | R&D Systems | 110-HG-100 | |
| Goat Anti-Human IgG Fc Antibody | R&D Systems | G-102-C | |
| Phosphate buffered saline tablets | Sigma-Aldrich | P4417 | use for fixation and immunostaining |
| Dumont #5, biologie tips, INOX, 11 cm | agnthos.se | 0208-5-PS | 2 pairs of forceps are needed |
| Iris scissors, straight, 12 cm | agnthos.se | 03-320-120 | |
| Dressing Forceps, straight, delicate, 13 cm | agnthos.se | 08-032-130 | |
| Petri dishes Nunclo Delta treated | Thermo Fisher Scientific | 150679 | |
| TMTP01300 Isopore Membrane Filter, polycarbonate, Hydrophilic, 5.0 µm, 13 mm, white, plain | MerckMillipore | TMTP01300 | |
| Nunclon Multidishes 4 wells, flat bottom | Sigma-Aldrich | D6789-1CS | |
| Microscope cover glass 24 x 50 mm thickn. No.1.5H 0.17+/-0.005 mm | nordicbiolabs | 107222 | |
| Cover glasses No.1.5, 18 mm x 18 mm | nordicbiolabs | 102032 | |
| Slides ~76 x 26 x 1, 1/2-w. ground plain | nordicbiolabs | 1030418 | |
| VWR Razor Blades | VWR | 55411-055 | |
| 50 mL centrifuge tubes | Sigma-Aldrich | CLS430828 | |
| 15 mL centrifuge tubes | Sigma-Aldrich | CLS430055 | |
| Whatman prepleated qualitative filter paper, Grade 113V, creped | Sigma-Aldrich | WHA1213125 | |
| Fixed stage research mircoscope | Olympus | BX61WI | |
| Black 6 inbred mice, male, C57BL/6NTac | Taconic | B6-M | |
| Black 6 inbred mice,female, C57BL/6NTac | Taconic | B6-F | |
| Greenough Stereo Microscope | Leica | Leica S6 E |
참고문헌
- Saxén, L. Organogenesis of the kidney. Developmental and Cell Biology Series. 19, Cambridge University Press. (1987).
- Lindström, N. O., et al. Integrated β-catenin, BMP, PTEN, and Notch signalling patterns the nephron. eLife. 4, e04000(2015).
- Peuckert, C., et al. Multimodal Eph/Ephrin signaling controls several phases of urogenital development. Kidney Int. 90 (2), 373-388 (2016).
- Pasquale, E. B. Eph receptor signalling casts a wide net on cell behaviour. Nat Rev Mol Cell Biol. 6 (6), 462-475 (2005).
- Bonanomi, D., et al. Ret Is a Multifunctional Coreceptor that Integrates Diffusible- and Contact-Axon Guidance Signals. Cell. 148 (2), 568-582 (2012).
- Brown, A. C., et al. Isolation and Culture of Cells from the Nephrogenic Zone of the Embryonic Mouse Kidney. J Vis Exp. (50), e2555(2011).
- Olympus Support. , Available from: http://www.olympusamerica.com/cpg_section/cpg_archived_product_details.asp?id=817 (2016).
- Grobstein, C. Inductive interaction in the development of the mouse metanephros. J Exp Zool. 130, 319-340 (1955).
- Saxén, L., Toivonen, S. Primary Embryonic Induction. , Academic Press. London. (1962).
- Saxén, L., Koskimies, O., Lahti, A., Miettinen, H., Rapola, J., Wartiovaara, J. Differentiation of kidney mesenchyme in an experimental model system. Adv Morphog. 7, 251-293 (1968).
- Dudley, A. T., Godin, R. E., Robertson, E. J. Interaction between FGF and BMP signaling pathways regulates development of metanephric mesenchyme. Genes Dev. 13, 1601-1613 (1999).
- Perälä, N., et al. Sema4C-Plexin B2 signalling modulates ureteric branching in developing kidney. Differentiation. 81 (2), 81-91 (2011).
- Thesleff, I., Ekblom, P. Role of transferrin in branching morphogenesis, growth and differentiation of the embryonic kidney. J Embryol exp Morph. 82, 147-161 (1984).
- Watanabe, T., Costantini, F. Real-time analysis of ureteric bud branching morphogenesis. Dev Biol. 271, 98-108 (2004).
- Sebinger, D. D. R., Unbekandt, M., Ganeva, V. V., Ofenbauer, A., Werner, C., Davies, J. A. A Novel, Low-Volume Method for Organ Culture of Embryonic Kidneys That Allows Development of Cortico-Medullary Anatomical Organization. PLoS One. 5 (5), e10550(2010).
- Ekblom, P., Miettinen, A., Virtanen, I., Wahlström, T., Dawnay, A., Saxén, L. In vitro segregation of the metanephric nephron. Dev Biol. 84 (1), 88-95 (1981).
- Davies, J. A., Unbekandt, M. siRNA-mediated RNA interference in embryonic kidney organ culture. Methods Mol Biol. 886, 295-303 (2012).
- Saxén, L., Lehtonen, E. Embryonic kidney in organ culture. Differentiation. 36 (1), 2-11 (1987).
- Bard, J. B. L. The development of the mouse kidney embryogenesis writ small. Curr Opin Genet Dev. 2, 589-595 (1992).
- Davies, J. A. A method for cold storage and transport of viable embryonic kidney rudiments. Kidney Int. 70 (11), 2031-2034 (2006).
- Batourina, E., et al. Distal ureter morphogenesis depends on epithelial cell remodeling mediated by vitamin A and Ret. Nat Genet. 32 (1), 109-115 (2002).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유