Method Article
Получение нечеловеческих приматов ткани головного мозга для предварительного внедрения иммуногистохимии и электронной микроскопии
В этой статье
Резюме
Здесь мы предлагаем простой, недорогой и эффективный по времени протокола к химически исправить примата ткани мозга с акролеина фиксатором, что позволяет для длительного хранения, который совместим с предварительно встраивание иммуногистохимии для просвечивающей электронной микроскопии.
Аннотация
Несмотря на все технические достижения на световом уровне микроскопии, электронная микроскопия остается единственным инструментом в нейробиологии, чтобы изучить и охарактеризовать ультраструктурные и морфологические детали нейронов, такие как синаптические контакты. Хорошее сохранение мозговой ткани для электронной микроскопии может быть получено строгими методами крио-фиксация, но эти методы являются весьма дорогостоящими и ограничить использование иммунноокрашивания, что имеет решающее значение для понимания связности определенных нейронных систем. Методы замораживания-замещения, были разработаны, чтобы обеспечить сочетание крио-фиксации с иммунноокрашивания. Однако воспроизводимость этих методологических подходов, как правило, опирается на дорогостоящих устройствах замораживания. Кроме того, достижение надежных результатов с этой техникой очень отнимающее много времени и навыки вызова. Следовательно, традиционный химически фиксированный мозг, в частности, с акролеином фиксатором, остается методом времени эффективного и недорогим, чтобы объединить электронмикроскопии с применением иммуногистохимии. Здесь мы предоставляем надежный экспериментальный протокол, используя химическую фиксацию акролеин, что приводит к сохранению примата ткани головного мозга и является совместимым с предварительно встраивание иммуногистохимии и просвечивающей электронной микроскопическое исследование.
Введение
Световая микроскопия, в том числе конфокальной и двухфотонной микроскопии, оказалась эффективным инструментом для изучения в естественных нейронных процессов, среди прочего , 1, 2. Несмотря на то, типичное пространственное разрешение на (LM) уровне световой микроскопии составляет около 200 нм, последние технологические достижения с использованием различных источников света, таких как крайней ультрафиолетовой и мягкой рентгеновской микроскопии, значительно увеличились это разрешение на почти 10 нм пространственным разрешением 3 , 4, 5. Другие технологические достижения в области обработки изображений включают в сочетании магнитно - резонансной томографии с гистологии и обеспечить новый способ для измерения толщины миелиновой оболочки в естественных условиях, параметр , который традиционно измерима только на электронно - микроскопических (ЭМ) уровне 6, 7. AlthouGH эти достижения на уровне LM обеспечивают отличный инструмент для изучения живых процессов, детального вида и характеристики структур, таких как синаптические контакты, может быть достигнуто только с ЭМ, который предлагает решение, которое может достигать 0,5 нма. Однако наблюдение на уровне EM требует образцы, чтобы быть мертвым и изменены в некоторой степени, с химическими фиксаторов и дегидратации процессов, с тем чтобы сохранить цитоархитектуру. Таким образом, рассматривая биологические образцы с высоким разрешением может быть сложной задачей из - за радиационного повреждения от электронного пучка, низкий контраст, структурных отклонений мембран, или даже наличие артефактов , которые могут возникнуть после обезвоживания и эпоксидной смолы вложение 8, 9, 10.
Сохранение образцов в их нативной форме для структурного анализа может быть достигнуто с помощью «Cryo EM стекловидных разделов» или CEMOVIS, секционирования подхода, которыйвключает быстрое замораживание и внедрение образца в стекловидном льде и изучении секций под EM при криогенной температуре 11, 12. Эта процедура позволяет для исследования образцов , пока они еще твердые и полностью гидратированный, тем самым устраняя артефакты , вызванные обезвоживанием процессов 13. Тем не менее, этот метод включает в себя дополнительные устройства для крио-ultramicrotomy, а также дополнительные устройства на стандарте EM, с тем чтобы этим наблюдением при очень низких температурах, которые генерируют значительные дополнительные затраты. Кроме того, подход CEMOVIS исключает использование иммунноокрашивания методов, так как антитела, как правило, должны быть инкубировали при комнатной температуре. В качестве альтернативы, можно сочетать ультраструктурный анализ с иммуногистохимическими процедурами с использованием сублимационного замещения подхода, в течение которых образцы крио-фиксированные медленно размороженный в то время погружены в крио-защитный химических веществах и йан внедренный в специализированных смол, таких как Lowicryls. После встраивания иммунноокрашивания затем могут быть выполнены на таком материале 12. Тем не менее, сублимационное замещение и крио-фиксирующая метода отнимает много времени. Они требуют установок дополнительного оборудования и все еще требуют образцов, которые подвергаются воздействию органического растворителя и химическому фиксатору , которые могут изменить цитоархитектуру, несмотря на использовании низкой температуры 14, 15. Таким образом, несмотря на все технические достижения как на LM и уровня EM, химической фиксации ткани головного мозга, в частности , с акролеином, остается недорогой и эффективный по времени метод , чтобы объединить иммуногистохимии с EM 16.
В последние десятилетия было сделано много попыток найти смесь альдегидов, которые обеспечивают наилучшую сохранность тканей. До 1960-х годов, единственный химический закрепляющий, что дало приемлемые результаты для EM был четырехокись осмия, Тем не менее, четырехокись осмия является высокотоксичным и дорогим, исключающее его применение через сосудистую систему, чтобы исправить органы, такие как мозг. Акролеина был введен в конце 1950 - х годов в качестве надежного способа для сохранения тканей животного , пригодного для ЭМ наблюдения клеточных структур 17. Он проникает в ткани более глубоко и реагирует быстрее , чем другие альдегиды , когда используются для фиксации путем погружения и обеспечивает хорошую сохранность компонентов цитоплазмы, с минимальной усадкой ткани 17. Такая особенность дает акролеин фиксации явное преимущество по сравнению с другими альдегидами при использовании в свежей ткани, позволяя более точную локализацию живого молекулярных соединений, такие как ферменты и другие белки 18. Действительно, это было подтверждено на протяжении многих лет, как легкий, эффективный и недорогого метод фиксации для визуализации на уровне ЕСТ у многих видов, в том числе амфибий и грызунов, как эффективно StabiliZes пептиды и белки, сохраняют антигенность и обеспечивают относительно нетронутых ультраструктур при использовании в сочетании с другим альдегидом фиксативом 16, 18, 19, 20, 21. Протоколы для фиксации в акролеине грызунов с тех пор были стандартизированы и широко используются, в частности , группа ПИКЕЛА, чтобы осуществить двойное иммунноокрашивание для EM 16, 22. Несколько групп использовали акролеин фиксации в тканях мозга приматов , не человек 23. Однако, насколько нам известно, есть только один протокол опубликован эффективно описывающий химическую фиксацию с акролеином в отличных от человека приматов , который совместим с ЭМ иммунноокрашивания 24.
В этой статье мы предлагаем простой и надежный способ эффективно химически исправить не-шумН. приматы мозг с акролеином, что позволяет для потенциально длительного хранения вместе с предварительно встраиванием иммунноокрашивания и EM передачи экспертизы.
протокол
Заявление по этике: Все протоколы с участием животных были утверждены Comité де защита дез Animaux де l'Université Laval и были сделаны в соответствии с Канадским советом по уходу за животными Руководства к уходу и использованию экспериментальных животных (Ed 2.). Протокол, описанный здесь, был оптимизирован для взрослых животных приблизительно 800 г. Объемы закрепителя должны быть скорректированы в зависимости от размера животного.
1. Приготовление растворов для транскардиальной перфузии
- Готовят 1 л раствора 50 мМ натрий-фосфатный буферный солевой раствор (PBS), в соответствии со следующими этапами. Приготовьте раствор максимум 24 ч перед перфузией и держать при температуре 4 ° С до использования.
- Мера 800 мл дистиллированной воды в 1 л лабораторный стакан. Добавьте 5,87 г безводного двухосновного фосфата натрия (Na 2 HPO 4), 1,20 г моногидрата одноосновного фосфата натрия (NaH 2 PO 4 · H 2 O), и 9 гхлорида натрия (NaCl),. Перемешать до растворения.
- Доводят рН до 7,4 постепенным добавлением 5 N NaOH. Добавить дистиллированную воду до достижения общего объема 1 л
ВНИМАНИЕ: NaOH, является коррозионным химическим соединением. Носите соответствующие средства индивидуальной защиты (СИЗ;. Лабораторное пальто, перчатки, защитные очки и т.д.).
- Подготовьте 2 л 4% параформальдегида (PFA) в соответствии со следующими этапами. Это решение должно быть подготовлено не более 24 ч перед операцией и хранили при 4 ° С до использования.
- Мера 1,5 л дистиллированной воды в 2-л лабораторный стакан. Добавить 23,48 г безводного двухосновного фосфата натрия (Na 2 HPO 4) и 4,80 г моногидрата одноосновного фосфата натрия (NaH 2 PO 4 · H 2 O). Перемешать до растворения. Добавить дистиллированную воду до достижения общего объема 2 L.
- Раствор нагревают под вентиляционным колпаком, пока температура не достигнет примерно 45 - 55 ° C. Не нагревать до более чем 60 ° C.
- Постепенно добавить 80 г PFA в раствор и перемешивают до полного растворения (приблизительно 30 - 60 мин). Продолжайте контролировать температуру, чтобы держать его ниже 60 ° C.
ВНИМАНИЕ: ПФ обладает высокой летучестью в виде порошка. Он очень токсичен при контакте с кожей или глазами и опасен при вдыхании или проглатывании. Носите средства индивидуальной защиты и использовать с осторожностью под вентиляционным колпаком. - Раствор охлаждают до 4 & deg; С и фильтруют. Хранить при 4 ° С.
- Готовит 1 л 3% акролеина в 0,1 М фосфатного буфера (PB) в соответствии со следующими этапами. Раствор ПБ должен быть подготовлен не более 24 ч перед перфузией.
ВНИМАНИЕ: акролеин является высокотоксичным при вдыхании и может производить немедленный ущерб. Он также коррозионный и высокотоксичный при всасывании через кожу. Это канцероген и мутагенными свойствами. Носите соответствующие средства индивидуальной защиты и использовать под вентиляционным колпаком.- Мера 800 мл дистиллированной воды. Добавьте 8,66 г безводного двухосновного фосфата натрия (Na 2 HPO 4) и 5,38 г моногидрата одноосновного фосфата натрия (NaH 2 PO 4 · H 2 O). Перемешать, пока все соли не растворятся. Добавить дистиллированную воду до достижения общего объема 1 л Хранить раствор при температуре 4 ° С.
- Перед операцией передачи 900 мл раствора PB в стеклянный контейнер объемом 1 л и добавляют 30,94 мл 97% -ного раствора акролеина под вентиляционным колпаком. Добавить решение PB для достижения общего объема 1 л и размешать. Фильтр решения и держать его при температуре 4 ° С.
2. транскардиальная перфузия и мозг Препарирование
- Хранить растворы на льду в течение всей хирургической процедуры. Подготовьте насос, поместив трубку в первом растворе, который будет использоваться (PBS, 50 мМ) и поворачивая насос, пока воздух не остается в шланге. Для транскардиальной перфузии макаки, использовать 21 G иглу и установить отток при температуре приблизительно 80 мл / мин.
- Обезболить животное с внутримышечной инъекцией смесир кетамина (20 мг / кг), ксилазин (4 мг / кг) и ацепромазин (0,5 мг / кг). Поддерживать животное под изофлуран (3%) седативного эффекта.
- Закрепить конечности животного к столу вентилирования.
- С помощью скальпеля, удалить кожу до подмышек. Сокращение мышц живота. Используйте тяжелые хирургические ножницы, чтобы вырезать ребра по бокам, осторожно избегая жизненно важные органы.
- Вырезать диафрагму с хирургическими ножницами и поднимите грудную клетку, чтобы обнажить сердце. После того, как диафрагма режутся, действуйте быстро, так как сердце перестанет биться в течение нескольких минут.
- Удалить перикард с скальпелем и вставить иглу в левый желудочек. С помощью скальпеля, осторожно сделать небольшое иссечение в правое предсердие. Быстро запустить насос при 72 мл / мин и удерживать иглу на месте. Если возможно, наклоните животное, чтобы иметь свою голову на более низком уровне, чем сердце.
Примечание: Будьте осторожны, чтобы не проколоть межжелудочковой перегородки при установке иглы.- Rinsе кровь приблизительно 300 мл PBS, пока легкие белые и кровь не выходит из правого предсердия.
- Остановить насос, быстро перевести шланг / трубку с 3% -ным раствором акролеина и запустить насос снова. Постепенно увеличивайте скорость откачки до 80 мл / мин, как только сердце перестало биться. Заливать приблизительно 500 мл раствора акролеина.
- Остановить насос, быстро перенести шланг в 4% растворе PFA, и запустить насос снова. Этот шаг требует приблизительно 1 л PFA.
Примечание: Фиксация завершена, когда передние конечности являются жесткими и шея жесткая. - Отрежьте голову и тщательно препарировать мозг из черепа. Позаботьтесь, чтобы не повредить мозг с хирургическими инструментами. Перфузионное является оптимальным , когда мозг не бледный (никаких следов крови) и жесткие (Фигура 1А).
- Погрузите интактный мозг в 4% PFA в течение 1 ч при 4 ° С.
- Поочередно отрезать мозг с охлаждающей вибратомой (4 ° С)в желаемой плоскости в 50 мкм толщиной секций и собрать их в PBS (0,1 М) (рис 1B).
Примечание: Этот шаг может быть осуществлен разными способами в соответствии с требуемым протоколом. Полушария могут быть разделены до вибратомы резки, или держали целое. Если мозг слишком велик для вибратомы платформы, она может быть разрезана на более мелкие блоки. После этого шага, секции могут храниться в течение длительного периода времени при -30 ° С в растворе антифриза из 40% PB (50 мМ), 30% глицерина и 30% этиленгликоля.
3. Предварительно вложение иммуногистохимии (рисунок 1C)
- Подготовьте 4 л исходного раствора трис-буферном солевом растворе (TBS, 50 мМ, рН 7,6) следующим образом.
- Мера 2 л дистиллированной воды в 4 л лабораторный стакан, добавляют 24,23 г тригидроксиметил аминметан (THAM; С 4 Н 11 NO 3), и перемешать до растворения.
- Доводят рН до 7,6 с приблизительно 148 мл 1 н HCl. Кислота должна быть добавлена с cautiна, чтобы избежать достижения рН ниже 7,6. Общий объем должен быть 4 Л.
ВНИМАНИЕ: HCl, оказывает сильное коррозионное воздействие. Носите соответствующие средства индивидуальной защиты.
- Выбор секции (от этапа 2.11), содержащей область интереса для обработки на EM иммуногистохимию.
- Промывают свободно плавающие секции 3x в PBS (0,1 М, рН 7,4) в течение 5 мин при комнатной температуре, чтобы промыть раствор антифриза.
- Готовят 0,5% -ный раствор NaBH 4 , разбавленный в PBS.
- Взвешивают 0,05 г NaBH 4 и разбавить его в 10 мл PBS. Не накрывать. Готовят этот раствор непосредственно перед использованием.
- Инкубируйте разделы в свежеприготовленный раствор NaBH 4 в течение 30 мин при комнатной температуре. Рок мягко. Не накрывать.
- Промыть 3 раза в PBS в течение 10 мин при комнатной температуре, не качалки энергично, пока ни одна из реакционного газа остается.
- Подготовьте блокирующий раствор для EM с 2% соответствующей нормальной сыворотки и 0,5% холодной рыбьего желатина, разведенного в PBS.
Примечание: Количество Should рассчитывается для того, чтобы иметь достаточно для следующих трех шагов. Используйте сыворотку, сделанную из одних и тех же видов животных, принимающих вторичное антитело. Избегайте использование методов поиска антигена или добавления небольших количеств тритона (чтобы увеличить проникновение антител), так как эти способы существенно нарушить качество ткани. - Инкубируйте секции в блокирующем растворе в течение 1 ч при комнатной температуре. Рок мягко.
- Готовят раствор первичного антитела, разбавленного в блокирующем растворе.
Примечание: Концентрация первичного антитела, как правило, такие же, как для LM иммуногистохимии, но рассмотреть возможность проведения тестов с различными концентрациями антител заранее, так как некоторые первичные антитела не могут работать с акролеином. Если это так, то можно использовать смесь из глутарового альдегида (0,1 - 2%) и 4% PFA в течение транскардиальной перфузии и получить аналогичные результаты. Оптимизация времени инкубации и температуры, а также. - Инкубируйте разделы в растворе первичного антителав течение ночи при комнатной температуре при осторожном покачивании. Используйте ранее испытанный время инкубации и температуры.
- Промыть секции 3x в PBS в течение 5 мин при комнатной температуре при осторожном покачивании.
- Подготовьте 1: раствор биотинилированного вторичного антитела, разбавленного в блокирующем растворе 1000.
Примечание: Вторичное антитело должно быть поднято против вида хозяина, используемого для генерации первичного антитела. - Инкубируйте разделы в растворе вторичного антитела в течение 1,5 ч при комнатной температуре. Рок мягко.
- Готовят раствор, по меньшей мере 60 мин до конца вторичной инкубации антитела авидин-биотин-пероксидаза (ABC).
- Используйте калиброванный пипетки для измерения 8,80 мкл / мл растворов А и В и разбавить их в PBS.
- Rock мягко в течение по крайней мере 60 мин при комнатной температуре, чтобы позволить полным св зывания между авидинами и биотином молекулами.
- После инкубации в растворе вторичного антитела, промыть 3 раза в PBS в течение 10 мин при комнатной температуре.
- Инкубируйте разделы в ABC такlution в течение 1 ч при комнатной температуре. Рок мягко.
- Промыть один раз в PBS и дважды в TBS в течение 10 мин при комнатной температуре при осторожном покачивании.
- Подготовьте свежий раствор 0,05% 3,3'-диаминобензидина (DAB) с 0,005% H 2 O 2 , разбавленного в TBS.
- Взвешивают 12,5 мг ДАБ и разбавить его в 25 мл холодного TBS. Защита от света.
ВНИМАНИЕ: Порошок DAB обладает высокой летучестью и вреден при вдыхании. Он является канцерогенным и тератогенным. Таким образом, беременные или кормящие женщины не должны манипулировать этот продукт, даже при разбавлении. Используйте маску N95 при манипулировании и носить средства индивидуальной защиты. - Фильтр решение и добавить 4,5 мкл 30% H 2 O 2 непосредственно перед использованием.
- Взвешивают 12,5 мг ДАБ и разбавить его в 25 мл холодного TBS. Защита от света.
- Инкубировать срезы в растворе DAB в течение от 3 до 7 мин при комнатной температуре. Рок мягко.
Примечание: Коричневый осадок не должен быть слишком темным, чтобы избежать высокого уровня фонового окрашивания. Время инкубации должны быть оптимизированы соответствующим образом. - Остановить реакцию быстро мыть два разав холодной TBS, а затем два раза в течение 10 мин в холодном TBS при комнатной температуре, а затем два раза в течение 10 мин в PB, с мягким покачиванием.
Примечание: Использование PB (и не PBS) имеет решающее значение для того, чтобы устранить любые следы NaCl, как он будет реагировать с осмия и формы кристаллов.
4. Osmification и встраивание для электронной микроскопии
- Готовят раствор 1% осмия (OSO 4) , разведенного в PB. Защита от света.
ВНИМАНИЕ: осмий очень токсичен и не должны вступать в контакт с кожей, глазами, или рот и не следует вдыхать. Это может привести к смертельному исходу при попадании в организм. Она должна быть использована только под вентиляционным колпаком и с соответствующей индивидуальной защиты. - Инкубируйте разделы в 4 растворе OSO в течение 30 мин при комнатной температуре под капотом вентиляции (без перемешивания) и покрывают их алюминиевой фольгой , чтобы защитить их от света. Полностью сплющить секции перед добавлением раствора OsO 4.
Примечание: В секции становится очень темной и риGID, и следует манипулировать с осторожностью после этого шага. - Подготовьте водоотталкивающую эпоксидную смолу в течение osmification.
- Добавьте соответствующие количества каждого из компонентов смеси эпоксидной смолы (20 г эпоксидной смолы, 20 г отвердителя, 0,6 г ускорителя и 0,4 г пластификатора) в большой пластмассовой чашке. Движение с деревянной палочкой или пластиковой пипеткой до получения однородного коричневого цвета.
Примечание: Очень важно, чтобы использовать точную долю каждого компонента. - Передача равных количеств алюминиевых чашек соответствующих размеров, в зависимости от количества секций, подлежащая обработке. Дайте ему отдохнуть.
- Добавьте соответствующие количества каждого из компонентов смеси эпоксидной смолы (20 г эпоксидной смолы, 20 г отвердителя, 0,6 г ускорителя и 0,4 г пластификатора) в большой пластмассовой чашке. Движение с деревянной палочкой или пластиковой пипеткой до получения однородного коричневого цвета.
- Вымойте osmificated секции 3x в ПБ в течение 10 мин при комнатной температуре с низкой скоростью качания.
- Высушить разделы в следующей серии градуированного этанола в течение 2 минут каждые: 2 раза в 35% этаноле; 1 раз каждый в 50, 70, 80, 90, и 95% -ный этанол; и 3x в 100% этаноле.
- Перенесите секции в стеклянные флаконы для завершения dehydratiна процесс путем инкубации срезов 3 раза в течение 2 мин в окись пропилена.
ВНИМАНИЕ: Окись пропилена является очень летучим и токсичным органическим растворителем. Это может привести к серьезным повреждениям в глаза или на кожу при контакте или при вдыхании или проглатывании. Он был классифицирован как 2-й степени канцерогенного вещества. Она должна быть использована только под вентиляционным колпаком и средствами индивидуальной защиты. Кроме того, легко воспламеняется и должны храниться вдали от любого источника тепла.
Примечание: Перед этой стадии секции должны быть осторожно переносили в стеклянные флаконы, так как окись пропилена представляет собой органический растворитель и несовместим с пластмассой. На данный момент, участки очень хрупкие и должны управляться с осторожностью. Секции могут быть переданы в качестве альтернативы стеклянных флаконов перед этапом 4.5. - Передача секции осторожно, один за другим, в алюминиевые чашки и избежать контакта с воздухом как можно больше. Мини-вставлять разделы в предварительно смешанной водоотталкивающей эпоксидной смоле и инкубировать их на ночь под ventinг капот при комнатной температуре.
Примечание: На этом этапе, секции полностью обезвожены и очень хрупки и следует манипулировать с осторожностью. - Использование минерального масла, смазки готовят покрытые стеклянные слайды вместе с смазанным пластиковыми покровными.
- Смягчение смолы путем инкубирования алюминиевых чашек при температуре 60 ° С в течение 12-15 мин максимума. Тщательно расправьте участки на смазанную сторону предметного стекла. Поместите смазанные покровные и осторожно вытолкните оставшийся воздух.
- Инкубируйте слайды при температуре 60 ° С в течение 48 ч.
Примечание: Очень важно, чтобы не превышать 48 ч времени инкубации, как смола будет слишком трудно. - Удалите пластиковую покровные.
5. Подготовка проб для ультратонкой секционирования и наблюдения с помощью просвечивающего электронного микроскопа
- Используйте бинокль , чтобы найти интересующую область и вырезать небольшой четырехугольный кусок примерно 1 мм 2 с помощью скальпеля.
- Файл кончик блока смолы и клей Quadrangular кусок на него (рисунок 1С). Разрешить клей высохнуть в течение не менее 1 ч или в течение ночи перед секционирования.
- Использование ультрамикротома, вырезать четырехугольный кусок в 80 мкм толщины секций (рис 1D).
- Поместите блок смолы в ультрамикротоме палубы в вертикальном положении и, используя острое лезвие бритвы, постепенно разрезать каждую сторону блока смолы с образованием трапеции с гладкими сторонами.
- Поместите палубу в его горизонтальном положении и вращать блок до тех пор, длинная сторона трапеции не были обращены вниз.
- Используйте алмазный инструмент обрезки или стеклянный нож, чтобы обрезать поверхность четырехугольного куска. Установите ультрамикротоме вырезать 300 мкм толстых секций на 1 мм / с. Отрегулируйте нож, чтобы быть вертикально параллельно четырехугольного элемента и отображать очень небольшой горизонтальный угол приблизительно 1 °.
Примечание: Этот угол позволит пользователю приблизиться к ткани почти параллельно поверхности Ьблокировки, где immunolabeled элементы более вероятно, будут найдены. При использовании этих параметров с помощью алмазного инструмента обрезки, смола показывает блестящий белый цвет. Когда ткань режется, он меняется на фиолетовый или зеленоватый цвет. - Использование ультра 45 ° алмазного ножа, снабженная лодкой, заполненная дистиллированной водой, чтобы сократить толщину 80 мкм секций, разглаживают секции путем пропускания через них с куском поглощающей бумаги наклоненной в ксилоле, и собирать серийные срезы на формвар покрытии игровых сеток никелевых или голые 150 меш медных сеток (рис 1E).
- Поместите решетки в ящике для хранения сетки.
- Пятно сетки с цитратом свинца.
- Используйте 5 мл шприца и шприц 0,2 мкм фильтр, чтобы подготовить 1: 1 раствор фильтрованного цитрата свинца исходного раствора и фильтрованную дистиллированную воду. Защита от света.
Примечание: Исходный раствор цитрата свинца должно быть свежее каждый месяц, чтобы избежать образования твердой Deposего. См паспорта на склад рецепт. Кроме того, если нужно быть окрашены многие серии сеток, изменить разбавленный раствор, когда он становится молочно. - Поместите каждую сетку на каплю разбавленного раствора, с сечением в контакте с раствором. Инкубируют в течение 3 мин.
- Используйте маленькие щипчики для того чтобы держать сетку, и тщательно промойте его в двух стаканах, содержащих дистиллированную воду.
- Удалите излишки воды, осторожно с помощью абсорбирующей бумаги. Храните сетки в окне сетки. Подождите 30 минут , прежде чем рассматривать секции с помощью просвечивающей электронной микроскопии (ПЭМ; рис 1F).
- Используйте 5 мл шприца и шприц 0,2 мкм фильтр, чтобы подготовить 1: 1 раствор фильтрованного цитрата свинца исходного раствора и фильтрованную дистиллированную воду. Защита от света.
Результаты
В этом разделе представлены репрезентативные результаты, которые были получены после наблюдения, на уровне ЭМ передачи, из иммуноокрашивания примата ткани мозга химически фиксированной со смесью 3% акролеина и 4% PFA. Мы достигли хорошей сохранности ультраструктуры, как показано на относительно интактной миелиновой оболочки и аккуратной визуализации двойных мембран (фигура 2А). Синаптические контакты, наряду с нейронными элементами из микросреды, может быть легко идентифицированы (фигура 2В). Нейронные элементы, помеченный диаминобензидин (DAB) иммунопреципитат распознается на уровне ЭМ по их цитоплазме или заполненного аксоплазме. Плазматическая мембрана и наружная поверхность органелл также обычно выровнены с электронно-плотного осадком (рисунок 3).
В данном эксперименте мы использовали антитела агуInst переносчик серотонина (SERT), холин ацетилтрансфераза (чат) или Тирозингидроксилаза (TH) для визуализации нейронов immunolabeled элементов во внешнем (GPE) или внутреннего (GPI) сегмент белка обезьяны бледного шара (рисунок 3). Для того, чтобы сделать это, мы использовали сочетание фиксирующих химических веществ, которые сохраняют антигенные и ультраструктуры, что позволяет детально морфологическое исследование. Хотя многие антитела могут быть использованы с протоколом транскардиальной перфузии, описанным выше, мы рекомендуем пользователь выполнять концентрационные оптимизации тестов заранее, так как некоторые первичные антитела, как известны, не обеспечивают оптимальное иммунноокрашивание с акролеином фиксацией. В качестве альтернативы, когда антитела не обеспечивает оптимальное иммунноокрашивание с акролеином фиксацией, разбавление 0,1 - 2% глутарового альдегида в 4% PFA может быть использовано для транскардиальной перфузии. Это обеспечивает качество ткани относительно эквивалентного акролеин фиксированной ткани мозга с сохранением антигенным для многихантитела (фиг.4).
Наконец, мы предлагаем типичные примеры ЭМ микрофотографий, полученных после неподходящих манипуляций. А плохие результаты фиксации в измененных миелиновых оболочек (рис 5А, В) и трудности в визуализации двойных мембран нейритов (рис 5C, D), предотвращающих надежную идентификацию и анализ меченых и немеченых нейронных элементов. Избыточное время инкубации в растворе DAB создает излишнюю фон и неспецифическое окрашивание, которые потенциально могут генерировать ложные положительные результаты. Фон или неспецифическое окрашивание иногда появляется как неполное окрашивание нейрональных элементов (6А, В), но более часто , как многочисленны и близко расположенных окрашенных нейронные элементы (фиг.6С, D). Использование моющего средства в блокирующем растворе существенно изменяет качество ткани. Это может привести к пропускуорганеллы в меченых элементов (рис 7А) или деградации миелиновых оболочек (рис 7b) и клеточных мембран (рис 7c), оказание любой острой интерпретации микросреды трудно. И, наконец, ошибка в процессе osmification, например, с помощью промывки раствора , содержащего хлорид натрия, производит ненадежные результаты , когда клеточные структуры трудно отличить (рис 7D).
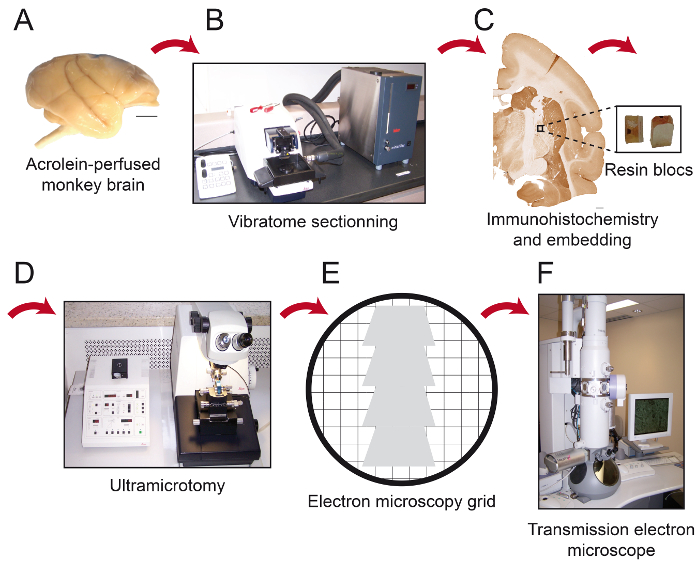
Рисунок 1: Схемы основных шагов Протокола. Обезьяны мозг (А) разрежет на серийные срезы с охлаждающей вибратомой (B). Это затем обрабатывается для предварительного встраивания иммуногистохимии и электронной микроскопии, после чего область интереса помещается на кончик блока смолы (С) и нарезать толщиной 80 нм sectiДополнения с ультрамикротомом (D). Ультратонкие срезы затем собирают на голых 150 меш медных сеток или формвар покрытием никелевых сеток (E), окрашивали цитратом свинца и готовы наблюдать под просвечивающего электронного микроскопа (F). Шкала баров: 1 мм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: Хорошо сохранившиеся Предстоятель ткань головного мозга после того, как акролеин-PFA транскардиальной перфузии. Электронные микрофотографии беличьей обезьяны (Saimiri sciureus) мозговая ткань GPi (А) и GPE (B) показывает представитель хорошо сохранившиеся материал после выполнения транскардиальной перфузии акролеина-PFA и метода иммунопероксидазного-диаминобензидина. мЕлины оболочка аксонов (а) является относительно нетронутой (см наконечника стрелы в А), а общие ультраструктурах хорошо сохраняются в А и В. профилей дендритных (г), небольшие немиелинизированные аксоны (а), и аксон варикоз (AV) могут легко быть идентифицированы. Пример аксона варикоза , устанавливающий симметричный синаптического контакта (между стрелками) с дендритным профилем (г) показан в B. Шкала бар: 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
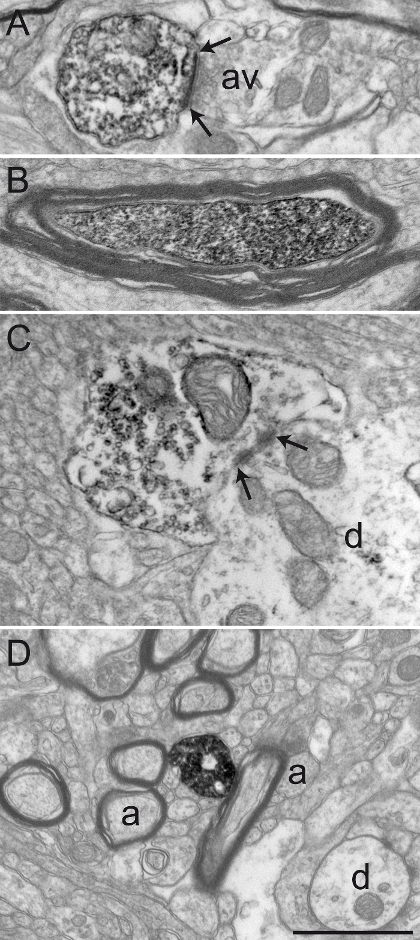
Рисунок 3: Секции из белка обезьяны GPE и GPI Immunolabeled для холинацетилтрансферазы (ХАТЫ), переносчик серотонина (SERT) и Тирозингидроксилазы (TH), используя иммунопероксидазный-диаминобензидин Техник. Иммуномеченные элементы могут быть легко идентифицированы с помощью их цитоплазмы или аксоплазма, заполненной осадок электронно-плотного DAB. Меченые дендритные профили признаны заполненными микрофиламенты, как показаны на А, где А-ХАТЫ иммуноокрашивания дендриты в GPi получают синаптические контакты (между стрелками) от немеченого аксона варикоза (AV). Электронно - микроскопический снимок в B показывает миелинизированные аксоны в GPE с относительно интактной миелиновой оболочки которого является аксоплазме immunolabeled для TH. Пример C показывает аксон варикоз в GPi immunolabeled для SERT и рассматривается установить симметричный синаптический контакт (между стрелками) с дендритом (г). В этом примере ДАБ осадить линий плазматическую мембрану и наружную поверхность органеллы (митохондрии и синаптических везикул). Варикоз аксона показано на D наблюдалось в GPE и immunolabeled для TH и представляет собой пример ДАБ осадок полностью заполняя axoplasm с синаптических везикул быть видимым, но более трудно разграничить. Элементы микросреды может быть легко идентифицированы, как проиллюстрированы с помощью миелиновых и немиелинизированных аксонов (а) и случайных дендритов (г), окружающих меченых аксонов варикоза. Электронные микрофотографии модифицируются с 25, 26, 27. Шкала бар: 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
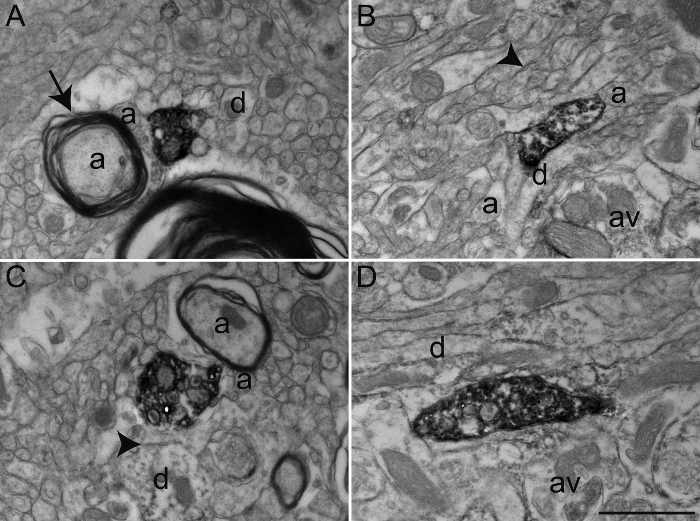
Рисунок 4: Примеры примата ткани головного мозга после Глютаральдегид-PFA транскардиальной перфузии. Типичные электронные микрофотографии макаки (Macaca fascicularis) мозговой ткани в GPE (А) и GPI (BD) после performiNG транскардиальным перфузии 0,2% глутарового альдегида смешивают с 4% PFA и техники иммунопероксидазного-диаминобензидина с антителом против переносчика серотонина (SERT). Как на фиг.2, immunolabeled элементы могут быть идентифицированы по их цитоплазме и аксоплазму , заполненная осадок электронно-плотный DAB. Общие ультраструктуры является относительно нетронутыми и элементы микросреды могут быть легко идентифицированы, как показано миелиновых и немиелинизированных аксонов (а) и случайных дендритов (г) и аксонов варикоз (AV) , окружающих меченых аксонов варикоз, как описано на фиг.2. Тем не менее, обратите внимание на несоответствие в качестве ультраструктуры, обозначаемый хорошо определенных плазматических мембран (наконечники стрел), но относительно поврежденного миелиновой оболочки (стрелка). Шкала бар: 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: Примеры примата ткани головного мозга , полученных после неудачного транскардиальным перфузии. Результаты неудачной химической фиксации показаны здесь в беличьей обезьяны GPI (A - B) и GPE (C - D) транскардиальную перфузию 0,9% ополаскивания раствором NaCl и смесь ледяной 4% PFA и 15% пикриновой кислоты разбавляют в 0,1 М PB (рН 7,4). Головной мозг фиксировал 1 ч при 4 ° С в 4% PFA и 30% сахарозе и нарезать толстые сагиттальные срезы 60 мкм с охлаждающей вибратомой. Неправильно фиксированная ткань мозга может быть признана поврежденной миелиновой оболочкой (А и В, стрелке), а также размытые или неопределенные плазматические мембраны (C и D, см стрелки для примеров). Различные нейронные элементы DIFficult, чтобы определить, что делает любую интерпретацию ультраструктуры ненадежной. Шкала бар: 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6: Примеры неспецифических ХАТ иммунноокрашивания в белке обезьяна GPE. Фоновое окрашивание или неспецифическое иммуномечение иногда появляется под EM как частичное окрашиванием крупных клеточных элементов, как показано на A - B (стрелка). Такое неспецифическое окрашивание появляется чаще всего на поверхности иммуноокрашивания секций. Другие примеры неспецифической иммунноокрашивании включают частое наблюдение за очень маленькие элементы, вызывающее маленькие, немиелинизированные аксоны частично или полностью заполнен DAB и расположен очень близко к одному аруга, как продемонстрировано в наконечниках C и D. Шкала бар: 1 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
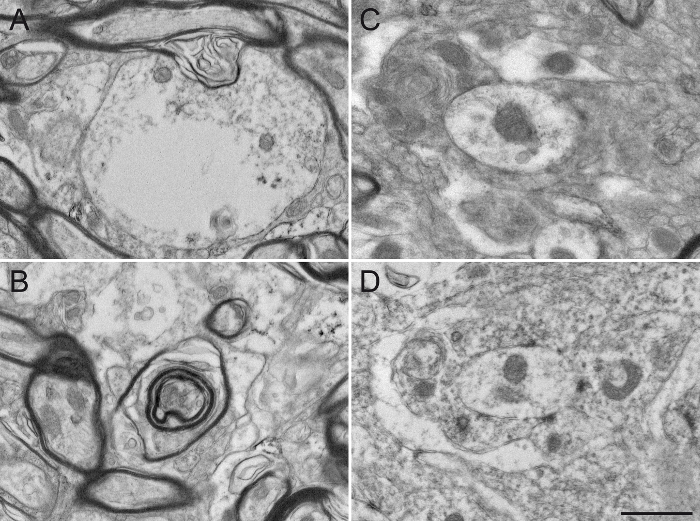
Рисунок 7: Поврежденный Белок обезьяна ткани после того, как серия Google Play Edition промахов в образце подготовке к электронной микроскопии. Применение моющих средств, таких как Triton X-100, в блокирующем растворе, даже при низкой концентрации 0,02%, существенно изменяет целостность ультраструктуры, повреждая цитоплазму дендритов (А) или миелиновой оболочки аксонов (B ). Различные нейрональные элементы также трудно отличить друг от друга (С), так как плазматические мембраны повреждены и трудно разграничить. Процесс osmification является ALSо важный шаг в подготовке проб. Использование хлорида натрия в ополаскивании растворов (D) изменяет фиксацию ткани, что делает последующий анализ трудно. Шкала бар: 800 нм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
В этой статье мы представляем надежный протокол для транскардиальной перфузии приматов, отличных от человека и предварительно вложения иммуногистохимии, пригодной для EM образца экспертизы. Несмотря на то, типично крио-ЭМ, такие как CEMOVIS, обеспечивает хорошее сохранение ультраструктуры мозга, он также ограничивает использование иммуногистохимии 12. Другие методы, в том числе крио-замещения и методики Tokuyaso, позволяют после внедрения иммуногистохимии, но эти методы являются дорогостоящими из - за дополнительные устройства , необходимых во время процесса и могут потребовать много времени и навыков вызова 12, 14, 15. Кроме того, для того , чтобы эффективно использовать метод крио-фиксации, образец должен быть относительно небольшим (до 200 мкм в толщину при использовании высокого давления замораживания 28 и 10 мкм при атмосферном давлении 29). В идеале, чтобы получить хорошийРезультаты с крио-фиксацией примата ткани головного мозга, образец должен быть взяты из биопсии, вызывая проблемы в поиске точного местоположения интересующей области. Эта проблема должна быть преодолена с помощью стереотаксических координат. Химической фиксации с акролеином и предварительно встраивание методики, предложенной выше, обеспечивает простой, недорогой, эффективный по времени и надежный метод подготовки проб приматов ткани головного мозга и иммунноокрашивания для EM. Следуя этим, один будет получить хорошо сохранившиеся ультраструктуры вместе с антигенным, чтобы для иммунноокрашивания большинства белков. Однако, химическая фиксация EM также имеет свои недостатки. Во-первых, в то время как закрепляющие растворы, такие как акролеин сохраняют морфологические детали ткани головного мозга, то возможно, что некоторые морфологические изменения происходят в процессе фиксации химической и изменить результаты по сравнению с теми, которые были бы получены при CEMOVIS или методов крио-замещения. Во-вторых, процесс фиксации ипоследующее обезвоживание , необходимое для смолы вложения удалить большую часть внеклеточной жидкости и сжать клеточные компоненты вместе, вызывая усадку ткани , что существенно изменяет их размер и форму , по сравнению с крио-фиксированных клеток 21, 30. Тем не менее, альдегид фиксация успешно используется во многих лабораториях по всему миру и получила широкое признание в литературе в качестве надежного метода для изучения ультраструктурные особенности нейронов и глиальных клеток, несмотря на ранее упомянутые проблемы 21, 30, 31, 32.
По сравнению со способом , описанным выше, postembedding иммуногистохимии , который необходим для крио-фиксированных образцов , внедренных в смолу метакрилата, является менее чувствительным и обнаружение антигенов центральной нервной системы ограничено 14 >, 33. Тем не менее, альдегидная фиксация также имеет свои ограничения в отношении антигенности. Поэтому, важно, чтобы проверить специфичность антител для данного протокола химической фиксации на уровне LM перед началом подготовки EM. Качество иммуногистохимии на акролеин фиксированной ткани головного мозга также зависит от ранее разрыва сильных альдегидных связей, созданных химической фиксацией. Этот шаг может быть достигнут путем инкубации срезов до того иммуногистохимий с боргидридом натрия (см шагов 3.3 - 3.5). Опуская этот шаг, несомненно , приведет к нерациональному иммуноокрашиванием 34. Если антитела, которые будут использоваться не дают оптимальное окрашивание срезов головного мозга на фиксированных с акролеином, можно использовать в качестве альтернативы глутарового альдегида (0,1 - 2%), разбавленного в 4% PFA. Это было доказано, что хорошо сохраняет ультраструктуру мозга в то время как в достаточной степени поддержания антигенности для многих антител и обеспечить ткани мозгаподходит для длительного хранения с минимальными изменениями 20, 21, 35, 36, 37. Кроме того , можно достичь относительно хорошей фиксации и антигенности , подходящую для ЭМ с PFA в одиночку, значительно повышая рН раствора, а сочетание более чем одного фиксатора во время перфузии обеспечило лучшие результаты 34, и исследования подтверждают , что PFA фиксации в одиночку , как правило производят плохо сохранившиеся ткани для EM обследования 38, 39. Однако, в некоторых редких случаях, антигенность очень трудно поддерживать, и только PFA фиксации остается единственным жизнеспособным вариантом для EM экспертизы.
Многие шаги в этом протоколе следует тщательно соблюдать для того, чтобы получить оптимальные результаты. Так, например, получение 4% -ного раствора ПФАдолжны быть выполнены при температурах выше 45 ° C для того, чтобы позволить порошок ПФА для растворения, но важно, чтобы температура оставалась ниже 60 ° C. В противном случае решение ПФА деполимеризуетс в формальдегид и муравьиную кислоту, которая фиксирует ткань по- разному и образует кислотный раствор , который может значительно изменить качество ткани 40, 41. Кроме того, очень важно , чтобы шаги перфузионные быть выполнены быстро , как только диафрагма была сокращена, так как гипоксия и гиперкапния будет производить необратимые физиологические изменения в головном мозге , что может привести к изменению качества и целостности ткани 31. Дефектная фиксация может быть вредной для сохранения ткани головного мозга и постоянно изменяет ультраструктуры ткани, такие как плазменные мембраны, митохондрия и синапсы. Таким образом, подготовка раствора и шаги перфузионных должны проводиться с осторожностью. Успешный образец Е.М. Препаратып также сильно зависит от хорошей после фиксации в осмии. В самом деле, прямая перфузия осмия было описано как производство достаточно неповрежденной ткани для наблюдения EM 21, 39. Однако, много различий в плане количества внеклеточного пространства и появление плазматической мембраны между осмием-перфузией и альдегидами перфузией животными были замечены. Кроме того, почернение и упрочнение тканей после осмия перфузии оказываются удалением головного мозга из черепа, последующей диссекции и дифференциации между белым и серым веществом более сложной, в пользу альдегидной перфузии для лучшей сохранности ткани и более легкого манипулирования 21. Альдегиды фиксация в одиночку, кажется, уменьшает внеклеточное пространство, которое изменяет целостность ткани и создает впечатление плотных контактов, где внеклеточное пространство следует рассматривать, таким образом, не показыватьприемлемые микрофотографии электронов , даже после окрашивания цитрата свинца 42. Тем не менее, в вторичная фиксация осмия изменил эту ситуацию, позволяя наиболее определенное разделение между элементами ткани, которая необходима для их идентификации 42, таким образом , четко обосновывая важность выполнения шагов osmification (шаги 4.1 - 4.2) с осторожностью.
Условия и концентрации, при которых выполняемые эти шаги были протестированы в нашей лаборатории, специально для встраивания предварительно иммуногистохимии с помощью DAB в качестве осадка на приматах срезов головного мозга. Хотя умение-вызов, дважды иммуногистохимии возможно через пост-вложение иммуногистохимии с частицами золота 43. Электронно-плотный ДАБ осадка, полученный после того, как метод иммунопероксидазного-диаминобензидин предлагаемый здесь очень легко определить на уровне ЭМ, так как он описывает плазматические мембраны и исчезаетэр поверхности органелл, в то же время позволяя идентифицировать суб-клеточных компонентов, таких как митохондрий и синаптических контактов. Кроме того, после того, как настоящая методика освоена для одного иммуногистохимии, можно выполнять двойные иммуногистохимии путем объединения ДАБ осаждения с частицами золота, которые более легко различить друг от друга, чем золотые частицы различных размеров. Мы рекомендуем делать строгое тестирование специфичности антител, концентрации осмия и времени инкубации и температуры до обработки участков мозга для EM. Протоколы для предварительного вложения и двойной иммуногистохимии для EM были ранее опубликованы и могут быть адаптированы для ткани мозга приматов 16.
В заключении, протокол перфузии транскардиальной для отличных от человека приматов, представленный выше позволяет длительного хранение участков мозга, которые впоследствии могут быть использованы для EM предварительно встраивания иммуногистохимии. Sectioнс, полученный также пригоден для нейроанатомических исследований на уровне LM. Следовательно, с помощью протокола, который подходит как для EM и LM, то можно уменьшить количество животных используются, экономически эффективные и этическое рассмотрением. Она также позволяет прямое сравнение между результатами, полученных на LM и уровнями ЭМ на то же животное и позволяет использовать соотносительный свет и электронно-микроскопический (CLEM) исследований. Исследования CLEM в основном сосредоточены на использовании генетически модифицированных мышей , экспрессирующих флуоресцентные белки, такие как EGFP, которые в дальнейшем могут быть помечены с электронно-плотного осадка , и наблюдаемые на уровне EM 44. В качестве альтернативы, чтобы обойти проблему иммуногистохимии, крио-фиксации могут быть объединено с внутринейрональными инжекциями электронно-плотными маркерами, такие как квантовые точки 45, до точки замерзания, что позволяет визуализировать на уровне EM 46. Однако квантовые точки не являются биологически совместимыми, иих использование является дорогостоящим и требует много времени из-за дополнительным замораживание аппарата, необходимым для последующей подготовки ткани. Хотя эти методы все еще предпочитают крио-фиксацию и заморозить замещения методов, существуют некоторые разработки для использования химических тегов на полу-тонких (300 нм) секций для мечения различных клеточных белков с синтетическими флуорофоров, которые могут быть соотнесены с анализом EM 47 , Методы, позволяющие, например, корреляция между одной специфической локализацией аксонов с использованием флуоресценции и его синаптической связью с нейронами данной целевой структуры с использованием EM, весьма перспективные для понимания организации нервной системы, в частности, у приматов. В этом случае, акролеин фиксации следует отдавать предпочтение более глутаровый альдегид, так как последний будет производить аутофлюоресценция, которые могли бы изменить правильную визуализацию структур головного мозга на уровне LM. Однако, очень немногие исследования такого типа были проведены в приматах, мostly из-за технические проблемы и высокую стоимость, что такие эксперименты навязывания. Таким образом, новые разработки необходимы для успешных и недорогого CLEM исследований у приматов, такие как улучшение методов фиксации или с помощью химических меток видимых на обоих уровнях LM и EM.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Это исследование было поддержано естественных наук и инженерного исследовательского совета Канады (NSERC, 401848-2011 к МП). MP получил награду карьеры от Fonds де Recherche дю Квебек-Santé (FRQ-S). LE был получателем докторской стипендии от Frq-S (FRQ-S 14D 29441). Мы благодарим Мари-Жозе Уоллман за техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
Ссылки
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены