Method Article
Preparação do Tecido Cerebral primata não humano para Pré-incorporação de imuno-histoquímica e Microscopia Electrónica
Neste Artigo
Resumo
Aqui, nós fornecemos um, de baixo custo fácil, e protocolo de tempo-eficiente para corrigir quimicamente o tecido cerebral dos primatas com fixador acroleína, permitindo a preservação a longo prazo que seja compatível com imunohistoquímica pré-incorporação para microscopia eletrônica de transmissão.
Resumo
Apesar de todos os avanços tecnológicos ao nível da microscopia de luz, microscopia eletrônica continua a ser a única ferramenta em neurociência para analisar e caracterizar detalhes ultra-estruturais e morfológicas de neurônios, como contatos sinápticos. Boa preservação do tecido cerebral para microscopia eletrônica pode ser obtida por métodos de crio-fixação rigorosos, mas essas técnicas são bastante caro e limitar o uso de imunomarcação, que é crucial para entender a conectividade dos sistemas neuronais identificados. métodos de congelação-substituição têm sido desenvolvidos para permitir que a combinação de crio-fixação com imunomarcação. No entanto, a reprodutibilidade dessas abordagens metodológicas geralmente se baseia em dispositivos de congelamento caros. Além disso, a obtenção de resultados confiáveis com esta técnica é muito demorado e desafiador habilidade. Assim, o cérebro quimicamente fixo tradicional, especialmente com fixador acroleína, continua a ser um método tempo-eficiente e de baixo custo para combinar electrõesmicroscopia com imuno-histoquímica. Aqui, nós fornecemos um protocolo experimental de confiança utilizando a fixação de acroleína química que conduz para a preservação do tecido do cérebro primata e é compatível com o pré-incorporação exame microscópico imuno-histoquímica e de transmissão de electrões.
Introdução
Microscopia de luz, incluindo confocal e microscopia de dois fótons, provou ser uma ferramenta eficiente para estudar em processos neuronais in vivo, entre outras coisas 1, 2. Embora a resolução espacial típico no nível de luz microscópica (LM) é aproximadamente de 200 nm, os recentes avanços tecnológicos usando diferentes fontes de luz, tais como a extrema ultravioleta e microscopia de raios-X suave, de forma notável aumento esta resolução para uma nm resolução quase 10 espacial 3 , 4, 5. Outros avanços tecnológicos na imagiologia incluem combinado ressonância magnética com a histologia e proporcionar um novo método para medir a espessura da bainha de mielina, in vivo, um parâmetro que foi tradicionalmente mensurável apenas no nível de microscopia electrónica (ME) 6, 7. although estes avanços no nível LM proporcionar uma excelente ferramenta para o estudo de processos de vida, uma vista de pormenor e caracterização de estruturas, tais como contactos sinápticos, só pode ser conseguido com EM, que oferece uma resolução que podem chegar a 0,5 nm. No entanto, a observação no nível EM requer que os espécimes estar morto e alterado em alguns aspectos, com fixadores químicos e processos de desidratação, a fim de preservar a citoarquitetura. Deste modo, examinando as amostras biológicas com elevada resolução pode ser difícil devido aos danos da radiação do feixe de electrões, de baixo contraste, os desvios estruturais de membranas, ou mesmo a presença de artefactos que podem ocorrer após a desidratação e epoxi incorporação 8, 9, 10.
Preservar os exemplares na sua forma nativa para análise estrutural pode ser conseguido através de "Cryo EM de secções vitrificados" ou CEMOVIS, uma abordagem que seccionamentoenvolve a congelação rápida e a incorporação da amostra em gelo vítreo e examinando as secções sob a EM, a uma temperatura criogénica 11, 12. Este procedimento permite a análise de amostras enquanto ainda estão sólida e completamente hidratado, eliminar artefactos causados por desidratação assim processa 13. No entanto, este método envolve a dispositivos adicionais para a crio-ultramicrotomia, bem como dispositivos adicionais na EM padrão, a fim de permitir que esta observação a temperaturas muito baixas, que geram custos adicionais significativos. Além disso, a abordagem CEMOVIS opõe-se à utilização de técnicas de imunomarcação, uma vez que os anticorpos normalmente têm de ser incubadas a temperatura ambiente. Em alternativa, é possível combinar a análise ultra-estrutural com os procedimentos de imuno-histoquímica utilizando uma abordagem de congelação-substituição, durante a qual as amostras fixadas com crio são lentamente descongeladas enquanto imersa em produtos químicos crio-protectora e são then incorporados em resinas especializadas, tais como Lowicryls. Pós-incorporação de imunomarcação pode então ser realizada em tal material 12. No entanto, as técnicas de substituição de congelamento e crio-fixação são demorados. Eles exigem a instalação de equipamento adicional e ainda necessitam de amostras para ser exposta ao solvente orgânico e fixador químico que pode alterar a citoarquitetura, apesar da utilização de uma baixa temperatura de 14, 15. Assim, apesar de todos os avanços tecnológicos, tanto a nível LM e EM, a fixação química do tecido do cérebro, particularmente com acroleína, continua a ser um método de baixo custo e eficiente tempo para combinar imuno-histoquímica com EM 16.
Nas últimas décadas, foram feitas muitas tentativas para encontrar uma mistura de aldeídos que fornecem a melhor preservação do tecido. Antes de 1960, o único fixador químico que deram origem a resultados aceitáveis para o EM era tetróxido de ósmio. No entanto, o tetróxido de ósmio é altamente tóxico e dispendioso, o que impede o seu uso através do sistema vascular para fixar os órgãos tais como o cérebro. Acroleína foi introduzida no final da década de 1950, como um método de confiança para a preservação do tecido animal adequado para observação EM de estruturas celulares 17. Ele penetra o tecido mais profundamente e reage mais rapidamente do que outros aldeídos quando utilizados para a fixação por imersão e permite uma boa conservação dos componentes citoplasmáticos, com encolhimento mínimo do tecido 17. Tal característica dá acroleína fixação uma clara vantagem sobre outros aldeídos quando utilizado em tecido fresco, por permitir uma localização mais exacta de vida compostos moleculares, tais como as enzimas e outras proteínas 18. Na verdade, foi validado através dos anos como um método fácil, eficiente e de baixo custo de fixação para visualização no nível de EM em muitas espécies, incluindo os anfíbios e roedores, como forma eficiente estabilizazes péptidos e proteínas, mantém a antigenicidade e fornece ultraestrutura relativamente intacto quando usado em combinação com um outro aldeído fixador 16, 18, 19, 20, 21. Os protocolos para a fixação de acroleína em roedores têm desde então sido normalizado e amplamente utilizado, particularmente pelo grupo Pickel, para implementar dupla imunomarcação para o EM 16, 22. Alguns grupos foram utilizados fixação acroleína em tecido do cérebro primata não-humano 23. No entanto, tanto quanto sabemos, só há um protocolo publicado eficientemente descrevendo fixação química com acroleína em primatas não-humanos, que é compatível com o EM imunomarcação 24.
Neste artigo, nós fornecemos um método fácil e confiável para corrigir eficientemente quimicamente não-humum cérebros de primatas com a acroleína, permitindo uma conservação potencialmente a longo prazo juntamente com pré-incorporação de imunomarcação e EM transmissão exame.
Protocolo
Declaração de Ética: Todos os protocolos envolvendo animais foram aprovados pelo Comité de Protecção dos Animais de l'Université Laval e foram feitas de acordo com a Canadian Council on Guia do Animal Care para o Cuidado e Uso de Animais Experimentais (Ed. 2). O protocolo aqui descrito foi optimizado para animais adultos de aproximadamente 800 g. Os volumes de fixador deve ser ajustada de acordo com o tamanho do animal.
1. Preparação de soluções para perfusão transcardíaca
- Prepare 1 L de uma solução 50 mM de fosfato de sódio-solução salina tamponada (PBS) de acordo com os seguintes passos. Preparar a solução de, no máximo, 24 h antes da perfusão e manter a 4 ° C até à sua utilização.
- Medir 800 mL de água destilada numa proveta de 1 L. Adicionar 5,87 g de fosfato de sódio dibásico anidro (Na 2 HPO 4), 1,20 g de mono-hidrato de fosfato de sio monobico (NaH 2 PO 4? H 2 O), e 9 gde cloreto de sódio (NaCl). Mexa para dissolver.
- Ajustar o pH para 7,4 por adição gradual de 5 N de NaOH. Adiciona-se água destilada para atingir um volume total de 1 L.
CUIDADO: NaOH é um composto químico corrosivo. Use o apropriado Equipamento de Proteção Individual (EPI;. Bata de laboratório, luvas, óculos de protecção, etc).
- Preparar 2 L de 4% de paraformaldeído (PFA) de acordo com os seguintes passos. Esta solução deve ser preparado, no máximo, 24 h antes da cirurgia e mantida a 4 ° C até à sua utilização.
- Medir 1,5 L de água destilada numa proveta de 2-L. Adicionar 23,48 g de fosfato de sódio dibásico anidro (Na 2 HPO 4) e 4,80 g de mono-hidrato de fosfato de sio monobico (NaH 2 PO 4? H 2 O). Mexa para dissolver. Adiciona-se água destilada para atingir um volume total de 2 L.
- Aquece-se a solução sob uma capa de ventilação, até que a temperatura atinja aproximadamente 45 - 55 ° C. Não aquecer a mais de 60 ° C.
- Adicionar gradualmente 80 g de PFA-se à solução e agita-se até estar completamente dissolvido (cerca de 30 - 60 min). Manter o controlo da temperatura para mantê-lo abaixo de 60 ° C.
CUIDADO: PFA é altamente volátil na sua forma de pó. É altamente tóxico se em contacto com os olhos ou a pele e é perigoso em caso de inalação ou ingestão. Utilizar EPI e usar com cautela sob uma capa de ventilação. - Arrefece-se a solução até 4 ° C e filtra-se. Armazenar a 4 ° C.
- Prepare 1 L de 3% de acroleína em tampão fosfato 0,1 (PB) de acordo com os seguintes passos. A solução de OP deve ser preparado no máximo 24 horas antes da perfusão.
CUIDADO: acroleína é altamente tóxico se inalado e pode produzir danos imediatos. Também é corrosivo e tóxico se altamente absorvido através da pele. É cancerígena e mutagênica. Vista a EPI adequado e usar sob um exaustor de ventilação.- Medir 800 mL de água destilada. Adicionar 8,66 g de fosfato de sódio dibásico anidro (Na 2 HPO 4) e 5,38 g de mono-hidrato de fosfato de sio monobico (NaH 2 PO 4? H 2 O). Mexa até que todos os sais se dissolvem. Adiciona-se água destilada para atingir um volume total de 1 L. Manter a solução a 4 ° C.
- Antes da cirurgia, transferir 900 mL da solução de PB para um recipiente de vidro de 1 L e adicionar 30,94 mL de solução de acroleína 97% sob uma capa de ventilação. Adicionar a solução de PB para atingir um volume total de 1 L e agitar. Filtra-se a solução e mantê-lo a 4 ° C.
2. intracardíaca perfusão e Cérebro Dissection
- Manter as soluções no gelo durante todo o procedimento cirúrgico. Preparar a bomba através da colocação do tubo na primeira solução para ser utilizado (PBS; 50 mM) e girando a bomba até que não permanece ar na mangueira. Para a perfusão transcardiaca de um macaco macaque, usar uma agulha G 21, e definir o fluxo de saída a aproximadamente 80 mL / min.
- Anestesiar o animal com uma injecção intramuscular de uma mistura detura de cetamina (20 mg / kg), xilazina (4 mg / kg), e acepromazina (0,5 mg / kg). Manter o animal sob isoflurano (3%) sedação.
- Anexar membros do animal para uma mesa de ventilação.
- Com um bisturi, retire a pele até as axilas. Cortar os músculos abdominais. Use pesados tesoura cirúrgica para cortar as costelas lateralmente, evitando cuidadosamente os órgãos vitais.
- Corte o diafragma com uma tesoura cirúrgica e levantar a caixa torácica para expor o coração. Uma vez que o diafragma é cortado, avançar rapidamente, uma vez que o coração vai parar de bater em poucos minutos.
- Remover o pericárdio com uma lâmina de bisturi e inserir a agulha no interior do ventrículo esquerdo. Com um bisturi, fazer cuidadosamente uma pequena excisão para o átrio direito. iniciar rapidamente a bomba a 72 mL / min e segure a agulha no lugar. Se possível, incline o animal a fim de ter sua cabeça em um nível mais baixo do que o coração.
NOTA: Tenha cuidado para não perfurar o septo interventricular ao inserir a agulha.- Rinse o sangue com aproximadamente 300 ml de PBS até os pulmões são brancas e não sai sangue da aurícula direita.
- Parar a bomba, rapidamente transferir a mangueira / tubo para a solução de acroleína 3%, e ligar a bomba novamente. Aumentar gradualmente a velocidade de bombeamento de 80 ml / min, uma vez que o coração parou de bater. Perfundir aproximadamente 500 mL da solução de acroleína.
- Parar a bomba, transferir rapidamente a mangueira para a solução PFA 4%, e ligar a bomba novamente. Este passo requer aproximadamente 1 L de PFA.
NOTA: A fixação é completa quando os membros anteriores são rígidos e do pescoço é duro. - Cortar a cabeça e dissecar cuidadosamente o cérebro fora do crânio. Tome cuidado para não danificar o cérebro com os instrumentos cirúrgicos. A perfusão é óptima quando o cérebro é pálido (sem vestígio de sangue) e rígida (Figura 1A).
- Mergulha-se o cérebro intacto em PFA a 4% durante 1 h a 4 ° C.
- Serialmente cortar o cérebro com um vibratome de arrefecimento (4 ° C)no plano desejado em 50 mm de espessura e recolhê-las em PBS (0,1 M) (Figura 1B).
NOTA: Esta etapa pode ser realizada de várias maneiras de acordo com o protocolo desejado. Hemisférios podem ser separados antes de vibratome de corte, ou todo mantido. Se o cérebro é muito grande para a plataforma vibratome, ele pode ser cortado em blocos menores. Após este passo, as secções podem ser armazenados por um longo período de tempo a -30 ° C em uma solução anticongelante feito de 40% de PB (50 mM), 30% glicerol, e 30% de etileno glicol.
A imuno-histoquímica 3. Pré-incorporação (Figura 1C)
- Prepara-se uma solução de 4 L de estoque de Tris-salino tamponado (TBS, 50 mM, pH 7,6) como se segue.
- Meça 2 L de água destilada numa proveta de 4 litros, adicionar 24,23 g de tri-hidroximetil aminometano (THAM; C 4 H 11 NO 3), e agitar para dissolver.
- Ajustar o pH para 7,6 com cerca de 148 mL de HCl 1 N. O ácido deve ser adicionado com cautipara evitar atingir um pH inferior a 7,6. O volume total deve ser de 4 L.
CUIDADO: HCl é altamente corrosivo. Usar o EPI adequado.
- Seleccionar secções (a partir do passo 2.11) contendo a região de interesse para ser processadas para EM imuno-histoquímica.
- Lavam-se as secções de flutuação livre 3x em PBS (0,1 M, pH 7,4) durante 5 min à temperatura ambiente para lavar a solução de anticongelante.
- Prepara-se uma solução a 0,5% de NaBH4 diluído em PBS.
- Pesar 0,05 g de NaBH4 e dilui-lo em 10 ml de PBS. Não cubra. Prepare esta solução imediatamente antes da utilização.
- Incubar as secções na solução preparada de fresco de NaBH4 durante 30 minutos à temperatura ambiente. Balançar suavemente. Não cubra.
- Lavar 3x em PBS durante 10 min à temperatura ambiente, de balanço vigorosamente até que nenhum dos gases de reacção se mantenha.
- Prepara-se uma solução de bloqueio para o EM com 2% de soro normal adequado e 0,5% de gelatina de peixe fria diluída em PBS.
NOTA: O shoul quantidaded ser calculada a fim de ter suficiente para as três etapas seguintes. Utilizar um soro feito a partir da mesma espécie animal que hospedam o anticorpo secundário. Evitar a utilização de métodos de recuperação de antigénios ou a adição de pequenas quantidades de triton (para aumentar a penetração dos anticorpos), uma vez que estes métodos comprometer significativamente a qualidade do tecido. - Incubar as secções em solução de bloqueio durante 1 h à TA. Balançar suavemente.
- Preparar a solução de anticorpo primário diluído em solução de bloqueio.
NOTA: A concentração do anticorpo primário é geralmente a mesma como para imuno-histoquímica LM, mas considerar a realização de ensaios com diferentes concentrações de anticorpos de antemão, como alguns anticorpos primários pode não funcionar com acroleína. Se assim for, é possível utilizar uma mistura de glutaraldeído (0,1-2%) e PFA a 4% para a perfusão transcardíaca e obter resultados semelhantes. Optimizar o tempo de incubação e temperatura, bem. - Incubar as secções em solução de anticorpo primáriodurante a noite à temperatura ambiente com agitação suave. Utilizar um tempo de incubação testados previamente e temperatura.
- Lavam-se as secções 3x em PBS durante 5 min à temperatura ambiente com agitação suave.
- Prepara-se uma solução de 1: 1000 de anticorpo secundário biotinilado diluído em solução de bloqueio.
NOTA: O anticorpo secundário tem de ser levantado contra as espécies hospedeiras utilizadas para produzir o anticorpo primário. - Incubar as secções em solução de anticorpo secundário durante 1,5 h à TA. Balançar suavemente.
- Prepara-se uma solução de avidina-biotina-peroxidase (ABC), pelo menos, 60 min antes do final da incubação do anticorpo secundário.
- Usar uma pipeta calibrada para medir a 8,80 mL / mL de soluções A e B e diluí-las em PBS.
- Rocha moderadamente durante pelo menos 60 min à temperatura ambiente para permitir a ligação entre as moléculas de avidina e biotina completa.
- Após a incubação em solução de anticorpo secundário, lavar 3x em PBS durante 10 min à TA.
- Incubar as seções no ABC de modolução durante 1 h à TA. Balançar suavemente.
- Lavar uma vez com PBS e duas vezes em TBS durante 10 minutos à temperatura ambiente com agitação suave.
- Prepara-se uma solução fresca de 0,05% de 3,3'-diaminobenzidina (DAB) com 0,005% de H 2 O 2 diluído em TBS.
- Pesar 12,5 mg de DAB e dilui-lo em 25 ml de TBS frio. Proteger da luz.
CUIDADO: O pó DAB é altamente volátil e perigoso se for inalado. Ele é cancerígeno e teratogênico. Assim, mulheres grávidas ou amamentando não devem manipular este produto, mesmo quando diluído. Use uma máscara N95 quando manipular e utilizar EPI. - Filtra-se a solução e adicionar 4,5 mL de 30% de H 2 O 2 imediatamente antes da utilização.
- Pesar 12,5 mg de DAB e dilui-lo em 25 ml de TBS frio. Proteger da luz.
- Incubar secções na solução DAB durante 3-7 minutos à temperatura ambiente. Balançar suavemente.
NOTA: O precipitado castanho não deve ser demasiado escura, a fim de evitar um elevado nível de coloração de fundo. O tempo de incubação deve ser optimizada em conformidade. - Parar a reacção através de lavagem duas vezes rapidamenteem TBS frio, em seguida, duas vezes durante 10 min em TBS frio à temperatura ambiente, seguido por duas vezes durante 10 min em PB, com agitação suave.
NOTA: O uso de PB (e não PBS) é crítico a fim de eliminar quaisquer vestígios de NaCl, uma vez que reagiria com cristais de ósmio e forma.
4. Osmification and Embedding para Electron microscópica Observação
- Prepara-se uma solução de 1% de tetróxido de ósmio (OsO4) diluída em PB. Proteger da luz.
CUIDADO: ósmio é altamente tóxico e não deve entrar em contacto com a pele, olhos ou boca e não deve ser inalado. Ele pode causar a morte se ingerido. Ele deve ser utilizado apenas sob um exaustor de ventilação e com PPE apropriado. - Incubar as secções em OsO4 a solução durante 30 minutos à TA sob o capô ventilação (sem agitação) e cobrindo-os com folha de alumínio para proteger da luz. Completamente achatar as seções antes da adição da solução de OsO4.
NOTA: As seções a tornar-se muito escuro e rigid e deve ser manipulada com cuidado seguir este passo. - Preparar resina epoxi repelente de água durante o osmification.
- Adicionar quantidades apropriadas de cada componente da mistura de resina epoxi (20 g de resina epoxi, 20 g de endurecedor, 0,6 g de acelerador e 0,4 g de plastificante) para uma grande copo de plástico. Agita-se com uma vareta de madeira ou pipeta de plástico até uma cor castanha homogénea.
NOTA: É fundamental usar a proporção exata de cada componente. - Transferir quantidades iguais de alumínio copos de tamanhos apropriados, dependendo do número de secções a ser processado. Deixe-a descansar.
- Adicionar quantidades apropriadas de cada componente da mistura de resina epoxi (20 g de resina epoxi, 20 g de endurecedor, 0,6 g de acelerador e 0,4 g de plastificante) para uma grande copo de plástico. Agita-se com uma vareta de madeira ou pipeta de plástico até uma cor castanha homogénea.
- Lavam-se as secções osmificated 3x em PB durante 10 min à TA com agitação de baixa velocidade.
- Desidratar as secções da seguinte série de etanol graduada durante 2 minutos cada: 2 vezes em 35% de etanol; 1 hora cada em 50, 70, 80, 90, e 95% de etanol; e 3x em 100% de etanol.
- Transferir as seções para frascos de vidro para completar os dehydratino processo por incubação das secções 3 vezes durante 2 minutos em óxido de propileno.
CUIDADO: O óxido de propileno é um solvente orgânico altamente volátil e tóxico. Ela pode causar sérios danos aos olhos ou da pele em caso de contacto ou se inalado ou ingerido. Foi classificada como uma substância cancerígena grau 2. Ele deve ser utilizado apenas sob um exaustor de ventilação e com PPE. Ele também é altamente inflamável e deve ser mantido longe de qualquer fonte de calor.
NOTA: Antes desta etapa, as secções devem ser cuidadosamente transferidos em frascos de vidro, uma vez que o óxido de propileno é um solvente orgânico e é incompatível com plástico. Neste ponto, as seções são muito frágeis e devem ser manipuladas com cuidado. As secções podem ser, alternativamente, transferido para frascos de vidro antes do passo 4.5. - secções transferir cuidadosamente, uma por uma, nas taças de alumínio e evitar contacto com o ar, tanto quanto possível. Liso-incorporar as secções em resina epoxi repelente de água previamente misturada e incubar-los durante a noite sob a Venting capa à TA.
NOTA: Nesta etapa, as seções são completamente desidratado e muito frágil e deve ser manipulada com cuidado. - Usando óleo mineral, preparar linas de vidro revestidas com gordura juntamente com lamelas de plástico lubrificados.
- Amolecer a resina por incubação de copos de alumínio a 60 ° C durante 12-15 minutos no máximo. Cuidadosamente achatar as seções do lado untada da lâmina de vidro. Coloque a lamela untada e cuidadosamente empurrar para fora qualquer ar remanescente.
- Incubar as lâminas a 60 ° C durante 48 h.
NOTA: É crítico para não exceder 48 h tempo de incubação, como a resina vai se tornar muito difícil. - Retirar as lamelas de plástico.
5. Preparação de Amostras para Ultrathin Seccionamento e Observação Usando um Microscópio Eletrônico de Transmissão
- Use binóculos para encontrar a região de interesse e cortar um pequeno pedaço quadrangular de aproximadamente 1 mm 2 com um bisturi.
- Arquivar a ponta de um bloco de resina e cola a qupedaço adrangular para ele (Figura 1C). Permitir que a cola secar durante, pelo menos, 1 hora ou durante a noite antes de seccionamento.
- Usando um ultramicrotomo, cortar a peça quadrangular em 80 secções um de espessura (Figura 1D).
- Colocar o bloco de resina em uma plataforma ultramicrótomo na posição vertical e, utilizando uma lâmina de barbear afiada, gradualmente cortar cada um dos lados do bloco de resina de modo a formar um trapézio, com os lados lisos.
- Colocar a plataforma na sua posição horizontal, e rodar o bloco até que o lado mais comprido do trapézio está voltado para baixo.
- Use uma ferramenta de corte de diamante ou uma faca de vidro para cortar a superfície da peça quadrangular. Definir a ultramicrótomo para cortar 300 mm de espessura a 1 mm / s. Ajustar a faca para ser verticalmente paralela à peça quadrangular e para apresentar um ângulo muito pequeno horizontal de cerca de 1 °.
NOTA: Este ângulo irá permitir que o usuário aproximar o tecido quase paralelo à superfície da bbloquear, onde os elementos imunomarcadas são mais provável de ser encontrado. Ao usar esses parâmetros com a ferramenta de corte de diamante, a resina apresenta uma cor branca brilhante. Quando o tecido está a ser cortado, ele muda para uma cor púrpura ou esverdeada. - Usar um ultra 45 ° faca de diamante equipado com um barco cheio com água destilada para reduzir de 80 mm de espessura, suavizar secções por passagem através deles com um pedaço de papel absorvente com ponta em xileno, e recolher secções seriadas em níquel grelhas de entalhe formvar-revestidos ou nuas 150 grelhas de cobre de malha (Figura 1E).
- Coloque as grades em uma caixa de armazenamento de grade.
- Manchar as grades com citrato de chumbo.
- Usar uma seringa de 5 mL e de um filtro de seringa 0,2 fim para preparar uma solução 1: 1 de solução de estoque de citrato de chumbo filtrada e água destilada filtrada. Proteger da luz.
NOTA: A solução estoque de citrato de chumbo deve ser feita a cada mês para evitar a formação de depos sólidosEstá. Veja a folha de dados de material para a receita estoque. Além disso, se muitas séries de grades precisam de ser marcadas, alterar a solução diluída quando torna-se leitosa. - Colocar cada grade para uma gota de solução diluída, com a secção em contacto com a solução. Incubar durante 3 min.
- Use pequenas pinças para segurar a grelha, e lave-o bem, em dois copos contendo água destilada.
- Retire o excesso de água com cuidado usando papel absorvente. Armazenar as grades em uma caixa de grade. Esperar 30 minutos antes de examinar as secções por Microscopia Electrónica de Transmissão (MET; Figura 1F).
- Usar uma seringa de 5 mL e de um filtro de seringa 0,2 fim para preparar uma solução 1: 1 de solução de estoque de citrato de chumbo filtrada e água destilada filtrada. Proteger da luz.
Resultados
Nesta secção, são apresentados resultados representativos, que foram obtidos após a observação, a nível ME de transmissão, de tecido do cérebro primata imunocoradas quimicamente fixadas com uma mistura de 3% de acroleína e PFA a 4%. Conseguimos uma boa preservação da ultra-estrutura, como indicado pela bainha de mielina relativamente intacto e a visualização puro de membranas duplos (Figura 2A). Contactos sinápticos, juntamente com os elementos neuronais do microambiente, pode ser facilmente identificado (Figura 2B). elementos neuronais marcados com diaminobenzidina (DAB) imunoprecipitado são reconhecidos no nível EM por seu citoplasma preenchida ou axoplasma. A membrana de plasma e a superfície exterior de organelos também estão tipicamente alinhadas com o precipitado de electrões denso (Figura 3).
Nesta experiência em particular, utilizou-se anticorpos against o transportador de serotonina (SERT), colina-acetiltransferase (ChAT), ou Tirosina Hidroxilase (TH) para visualizar elementos neuronais immunolabeled no segmento interno (GPI) do macaco esquilo pallidus globus (Figura 3) externo (GPe) ou. A fim de fazer isso, usamos uma combinação de produtos químicos fixadores que preservam antigenicidade, bem como ultra-estrutura, permitindo uma investigação morfológica detalhada. Embora muitos anticorpos podem ser utilizados com o protocolo de perfusão transcardíaca descrito acima, recomenda-se que os utilizadores realizar testes de concentração optimização de antemão, uma vez que alguns anticorpos primários são conhecidos por não fornecer imunomarcação óptima fixação com acroleína. Alternativamente, quando os anticorpos não fornecem imunomarcação óptima fixação com acroleína, numa diluição de 0,1 - 2% de glutaraldeído em PFA a 4% pode ser utilizada para perfusão intracardíaca. Ele proporciona uma qualidade de tecido relativamente equivalente para tecido cerebral fixado-acroleína com antigenicidade preservada para muitosanticorpos (Figura 4).
Finalmente, fornecemos exemplos típicos de microfotografias EM obtidos após manipulações impróprias. Uma fixação resultados pobres em bainhas de mielina alterados (Figura 5A, B) e as dificuldades na visualização das membranas duplas de neurites (Figura 5C, D), que impedem uma identificação e análise de elementos neuronais marcados e não marcados fiável. Um tempo de incubação excessiva na solução DAB cria fundo excessivo e coloração não específica que pode potencialmente produzir resultados falso-positivos. Fundo ou não-específico de coloração, por vezes, aparece como colorao incompleto de elementos neuronais (Figura 6A, B), mas mais frequentemente como numerosos e localizado perto elementos neuronais coradas (Figura 6C, D). O uso de detergente na solução de bloqueio altera de forma significativa a qualidade do tecido. Ela pode levar à falta deorganelos em elementos marcados (Figura 7A) ou degradação das bainhas de mielina (Figura 7B) e membranas celulares (Figura 7C), tornando qualquer interpretação aguda do microambiente difícil. Finalmente, um passo em falso no processo osmification, tais como a utilização de uma solução de lavagem contendo cloreto de sódio, produz resultados pouco fiáveis onde as estruturas celulares são difíceis de distinguir (Figura 7D).
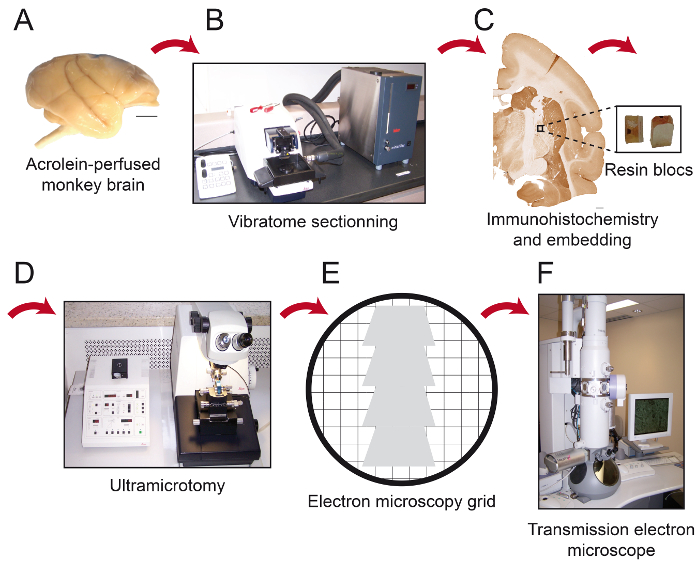
Figura 1: Esquemas de etapas essenciais do Protocolo. O cérebro de macaco (A) é cortada em secções em série com um vibratome de arrefecimento (B). Ele é então processado para pré-incorporação microscopia de imuno-histoquímica e de electrões, após o que a região de interesse é colocado na ponta de um bloco de resina (C) e cortada em 80 nm de espessura seçons com um ultramicrotomo (D). Secções ultrafinas são depois recolhidas em 150 grelhas de malha de cobre simples ou grades de níquel revestidas formvar-(E), coradas com citrato de chumbo e pronto para ser observada sob o microscópio electrónico de transmissão (F). Barras de escala: 1 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2: bem preservada de tecido cerebral após Primata acroleína-PFA transcardíaca perfusão. Eletromicrografias de macaco esquilo (Saimiri sciureus) tecido cerebral do GPi (A) e GPe (B) que mostra o material de representante bem preservada depois de realizar a perfusão transcardíaca acroleína-PFA e a técnica de imunoperoxidase-diaminobenzidina. Elesbainha Yelin de axónios (a) é relativamente intacta (ver ponta da seta na A), e a ultra-estrutura geral é bem preservada em A e B. perfis dendríticas (d), pequenas axónios sem mielina (a), e varicoses axonais (AV) pode facilmente ser identificado. Um exemplo de um axónio varicosidade, que estabelece um contacto sináptico simétrico (entre setas) com um perfil dendrítica (d) é mostrado em B. Barra de escala: 1? m. Por favor clique aqui para ver uma versão maior desta figura.
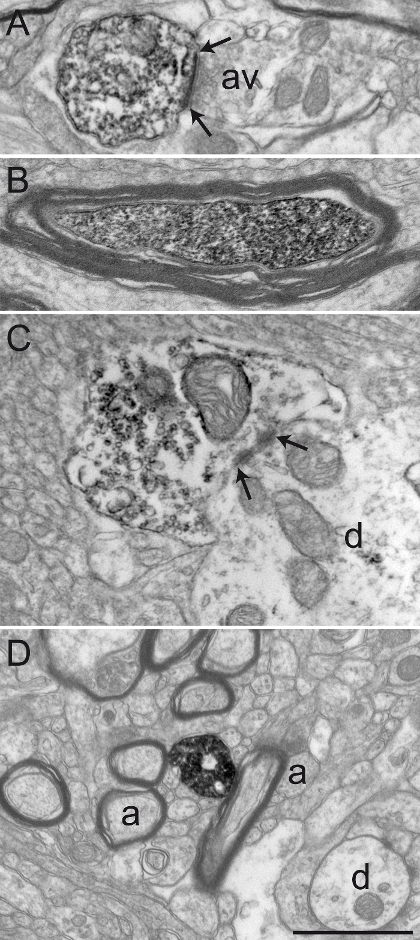
Figura 3: Secções de esquilo macaco GPe e GPi imunomarcadas para colina acetiltransferase (ChAT), transportador de serotonina (SERT), e Tirosina Hidroxilase (TH), utilizando a técnica de imunoperoxidase-diaminobenzidina. imunoelementos marcados podem ser facilmente identificados pelo seu citoplasma ou axoplasma preenchido com precipitado DAB electrões denso. Perfis dendríticas marcados são reconhecidos por microfilamentos a cheio, como se vê na A, em que um dendrito imunocoradas-ChAT no GPi recebe um contacto sináptico (entre setas) a partir de um axónio varicosidade não marcado (av). A fotografia de microscopia electrónica em B mostra um axónio mielinizados no GPe com uma bainha de mielina intacta relativamente cujo axoplasma é immunolabeled para TH. O exemplo em C mostra um varicosidade axónio no GPi immunolabeled para SERT e é visto para estabelecer um contacto sináptico simétrico (entre setas) com uma dendrite de (d). Neste exemplo, o DAB precipitar linhas a membrana do plasma e a superfície exterior de organelos (mitocôndria e vesículas sinápticas). O axónio varicosidade mostrada em D foi observada no GPe e immunolabeled para TH e representa um exemplo de DAB precipitado completamente o enchimento axopMSLA, com vesículas sinápticas ser visível, mas mais difícil delinear. Elementos do microambiente pode ser facilmente identificado, como exemplificado por axónios mielinizados e não mielinizados (a) e dendritos ocasionais (d) que envolve o varicosidade axónio marcado. Eletromicrografias são modificados a partir de 25, 26, 27. Barra de escala: 1? m. Por favor clique aqui para ver uma versão maior desta figura.
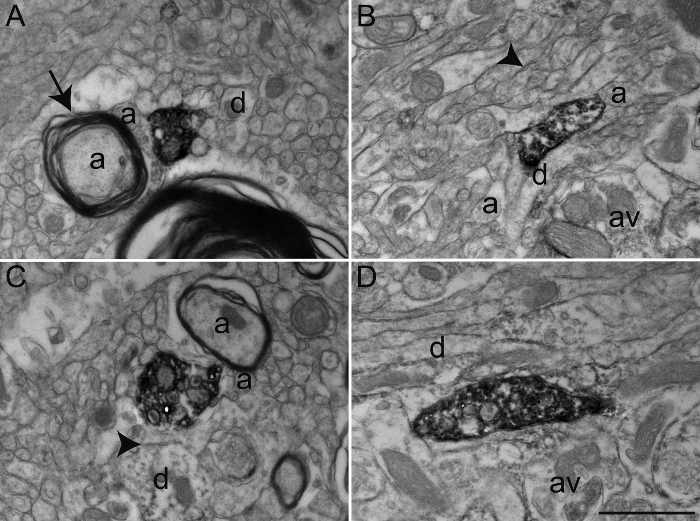
Figura 4: Exemplos de tecido cerebral após Primata Glutaraldeído-PFA transcardíaca perfusão. Micrografias electrónicas representativas de macaco macaque (Macaca fascicularis) de tecido cerebral de GPE (A) e GPi (BD) após performing transcardíaca perfusão com 0,2% de glutaraldeído misturado com PFA a 4% e a técnica de imunoperoxidase-diaminobenzidina com um anticorpo contra o transportador de serotonina (SERT). Como na Figura 2, immunolabeled elementos podem ser identificados pelo seu citoplasma e axoplasma preenchido com precipitado DAB electrões denso. Ultraestrutura geral é relativamente intacto e elementos do microambiente pode ser facilmente identificado, como mostrado por axónios mielinizados e não mielinizados (a) e dendritos ocasionais (d) e varicosidades axonais (AV) que rodeiam as varizes de axónios marcados, tal como descrito na Figura 2. No entanto, note que a inconsistência na qualidade de ultra-estrutura, indicada por membranas de plasma bem definidos (setas), mas bainha de mielina relativamente danificado (seta). Barra de escala: 1? m. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: Exemplos de tecido cerebral Primata obtido seguindo um sem êxito transcardíaca perfusão. Os resultados de uma fixação química vencida são mostrados aqui no macaco esquilo GPi (A - B) e GPe (C - D) perfundidos transcardiacamente com 0,9% de solução de lavagem de NaCl e uma mistura de gelado a 4% PFA e 15% pícrico ácido diluído em 0,1 M PB (pH 7,4). Os cérebros foram pós-fixadas 1 h a 4 ° C em PFA a 4% e 30% de sacarose e 60 cortadas em seces sagitais com um vibratome espessura de arrefecimento. Inadequadamente tecido cerebral fixado pode ser reconhecida por uma bainha de mielina danificado (A e B, pontas de seta), bem como por membranas plasmáticas borradas ou indefinidas (C e D, ver setas para exemplos). Diferentes elementos neuronais são difcil identificar, tornando qualquer interpretação da ultra-estrutura confiável. Barra de escala: 1? m. Por favor clique aqui para ver uma versão maior desta figura.

Figura 6: Exemplos de imunomarcação de ChAT não-específica no esquilo macaco GPe. Coloração de fundo ou de imunomarcação não-específica, por vezes, aparece sob a EM como a coloração parcial de grandes elementos celulares, como ilustrado em A - B (pontas de seta). Tal coloração inespecífica aparece mais frequentemente na superfície de secções imunocoradas. Outros exemplos de imunomarcação não específica incluem a observação frequente de elementos muito pequenos evocando pequenas axónios sem mielina, parcialmente ou completamente cheios com DAB e localizados muito perto de um umutro, como demonstrado por pontas de seta em C e D. Barra de escala: 1? m. Por favor clique aqui para ver uma versão maior desta figura.
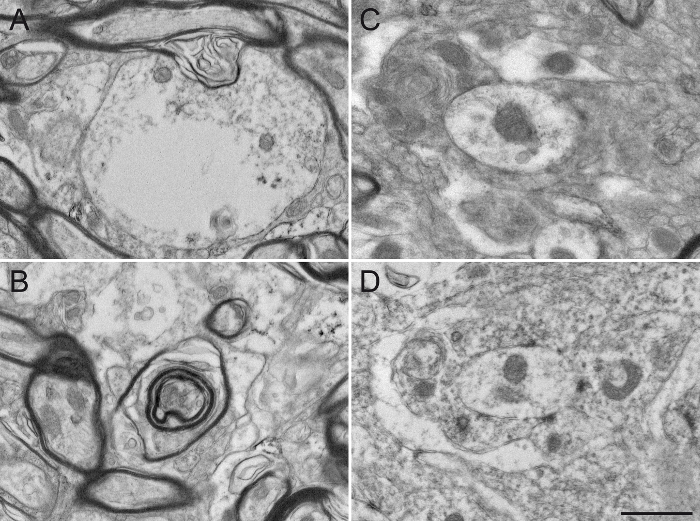
Figura 7: tecido danificado esquilo macaco GPe após Missteps na preparação de amostras para Microscopia Electrónica. A utilização de detergente, como o Triton X-100, na solução de bloqueio, mesmo a uma baixa concentração de 0,02%, altera substancialmente a integridade da ultraestrutura, danificando o citoplasma de dendritos (A) ou a bainha de mielina dos axónios (B ). Os elementos neuronais diferentes também são difíceis de distinguir uma da outra (C), uma vez que as membranas plasmáticas são danificadas e difíceis de delinear. O processo é osmification also um passo importante na preparação da amostra. O uso de cloreto de sódio em soluções de enxaguamento (D) altera a fixação do tecido, tornando difícil a análise subsequente. Barra de escala: 800 nm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Neste artigo, é apresentado um protocolo fiável para perfusão transcardíaca de primatas não-humanos e imuno-histoquímica de pré-embebimento adequado para exame da amostra EM. Embora típico crio-EM, tais como CEMOVIS, fornece uma boa preservação da ultra-estrutura do cérebro, mas também limita a utilização de imuno-histoquímica 12. Outras técnicas, incluindo a crio-substituição e técnica Tokuyaso, permitem a incorporação de pós-imuno-histoquímica, mas estas técnicas são dispendiosas, devido aos dispositivos adicionais necessários durante o processo e pode ser um desafio e habilidade-12, 14, 15-demorado. Além disso, a fim de utilizar de forma eficiente o método de crio-fixação, a amostra tem de ser relativamente pequeno (até 200 um de espessura quando usando-alta pressão de congelação 28 e 10 um, à pressão atmosférica 29). Idealmente, para obter um bomresultados com crio-fixação de tecido do cérebro primata, a amostra tem de ser tomada a partir de uma biópsia, causando problemas para encontrar a localização exacta da região de interesse. Este problema deve ser contornado usando coordenadas estereotáxica. A fixação química com acroleína e técnica de pré-incorporação proposto acima fornece um, de baixo custo fácil, eficiente em termos de tempo, e um método fiável para preparação de amostras de tecido do cérebro primata e imunomarcação para EM. Ao seguir estes passos, um obterá uma ultra-estrutura bem preservada juntamente com antigenicidade para permitir a imunomarcação da maior parte das proteínas. No entanto, a fixação química para EM também tem suas desvantagens. Em primeiro lugar, enquanto que as soluções do agente de fixao, tais como acroleína preservar os detalhes morfológicos do tecido cerebral, é possível que algumas alterações morfológicas ocorrer durante o processo de fixação química e alterar os resultados comparados com aqueles que seriam obtidos com as técnicas de crio-substituição CEMOVIS ou. Em segundo lugar, o processo de fixação edesidratação subsequente necessária para a incorporação de resina de remover a maior parte dos fluidos extracelulares e espremer componentes celulares em conjunto, fazendo com que o encolhimento do tecido que modifica significativamente o seu tamanho e forma em comparação com células fixadas com crio 21, 30. No entanto, a fixação aldeído tem sido usado com sucesso em muitos laboratórios em todo o mundo e é amplamente aceito na literatura como um método confiável para estudar as características ultra-estruturais de neurônios e células gliais, apesar de anteriormente mencionado preocupações 21, 30, 31, 32.
Em comparação com o método descrito acima, a imuno-histoquímica postembedding que é necessária para amostras fixadas com crio incorporados em resina de metacrilato, é menos sensível e a detecção de antigenes do sistema nervoso central é limitado 14 >, 33. No entanto, a fixação aldeído também tem suas limitações no que diz respeito à antigenicidade. Portanto, é importante testar a especificidade dos anticorpos para um dado protocolo de fixação química ao nível LM antes de iniciar a preparação EM. A qualidade da imunohistoquímica no tecido cerebral fixado-acroleína, também depende da quebra anteriormente as ligações fortes aldeído criado pela fixação química. Este passo pode ser conseguido através da incubação das secções antes de imuno-histoquímica com boro-hidreto de sódio (ver passos 3,3-3,5). Omitir este passo iria resultar em imunocoloração suboptimal 34. Se os anticorpos a serem utilizados não se dar uma óptima coloração em secções do cérebro fixadas com acroleína, é possível utilizar, em alternativa glutaraldeído (0,1 - 2%) diluído em PFA a 4%. Isto foi provado bem preservar ultraestrutura cérebro enquanto mantendo suficientemente antigenicidade para muitos anticorpos e para fornecer tecido cerebraladequado para armazenamento a longo prazo com alterações mínimas, 20, 21, 35, 36, 37. É também possível alcançar relativamente boa fixação e de antigenicidade adequada para o EM com PFA sozinhos por elevar significativamente o pH da solução, mas uma combinação de mais do que um fixador durante a perfusão proporcionou melhores resultados 34, e estudos suportam que a PFA fixação sozinho geralmente produzir tecido mal conservada para análise eM 38, 39. No entanto, em alguns casos raros, antigenicidade é muito difícil de manter, e PFA fixação sozinho permanece como a única opção viável para exame EM.
Muitos passos neste protocolo deve ser seguido cuidadosamente de modo a obter os resultados óptimos. Por exemplo, a preparação da solução de 4% de PFAdeve ser realizado a temperaturas acima de 45 ° C, a fim de permitir que o pó de PFA a dissolver, mas é imperativo que a temperatura permanece abaixo de 60 ° C. Caso contrário, a solução PFA despolimeriza em formaldeído e ácido fórmico, o qual fixa o tecido de forma diferente e forma uma solução ácida que poderia alterar significativamente a qualidade do tecido 40, 41. Além disso, é fundamental que os passos de perfusão ser efectuada rapidamente uma vez que o diafragma tenha sido cortado, uma vez que a hipoxia e hipercapnia produzirá mudanças fisiológicas irreversíveis para o cérebro que podem alterar a qualidade e integridade do tecido 31. fixação defeituosa pode ser prejudicial para a preservação do tecido cerebral e alterar permanentemente a ultra-estrutura do tecido, tais como membranas de plasma, mitocôndrias e sinapses. Assim, a preparação da solução e passos de perfusão necessita de ser levada a cabo com cuidado. Sucesso Preparados amostra EMn também altamente depende de um bom pós-fixação em tetróxido de ósmio. Com efeito, a perfusão directa com tetróxido de ósmio tem sido descrito como produzindo tecido razoavelmente intacta para observação EM 21, 39. No entanto, muitas diferenças em termos da quantidade do espaço extracelular e o aparecimento da membrana plasmática entre animais perfundidos-ósmio e perfundidos-aldeído ter sido notado. Além disso, o enegrecimento e o endurecimento dos tecidos após a perfusão de ósmio rendeu a remoção do cérebro do crânio, a dissecação subsequente, e a diferenciação entre matéria branca e cinzenta mais difícil, favorecendo aldeído perfusão para uma melhor conservação dos tecidos e a manipulação mais fácil 21. fixação aldeído sozinho parece reduzir o espaço extracelular, que altera a integridade do tecido e dá a impressão de junções apertadas onde o espaço extracelular deve ser visto, falhando assim a mostrarmicrografias electrónicas aceitáveis mesmo após coloração com citrato de chumbo 42. No entanto, postfixation em tetróxido de ósmio inverteu esta situação, permitindo uma separação mais definida entre elementos de tecido, o que é necessário para a sua identificação 42, justificando assim claramente a importância de efectuar os passos osmification (passos 4,1-4,2) com precaução.
As condições e as concentrações em que estas etapas são realizadas foram testados no nosso laboratório, especificamente para pré-incorporação de imuno-histoquímica utilizando DAB como o precipitado em seces de cebro de primatas. Embora-desafiando habilidade, duplo-imuno-histoquímica é possível através da incorporação pós-imuno-histoquímica com ouro as partículas 43. O electrões denso DAB precipitado obtido após a técnica de imunoperoxidase-diaminobenzidina aqui proposto é muito fácil de identificar no nível EM, uma vez que descreve as membranas de plasma e para foraer superfícies de organelos, enquanto ainda permitindo a identificação de componentes sub-celulares, tais como as mitocôndrias e os contactos sinápticos. Além disso, uma vez que a presente técnica é dominada por simples imuno-histoquímica, é possível realizar dupla imuno-histoquímica, combinando DAB precipitar com partículas de ouro, que são mais facilmente discerníveis entre si do que as partículas de ouro de tamanhos diferentes. Nós recomendamos fazendo testes rigorosos da especificidade do anticorpo, as concentrações de ósmio, e o tempo de incubação e temperatura de processamento antes de secções do cérebro para o EM. Os protocolos para a pré-embebimento e imuno-histoquímica para o EM dupla foram anteriormente publicados e pode ser adaptado para o tecido do cérebro primata 16.
Em conclusão, o protocolo de perfusão transcardíaca para primatas não-humanos apresentado acima permite o armazenamento a longo prazo das secções do cérebro que pode ser subsequentemente usado para o EM imunohistoquímica pré-incorporação. sections obtidos também são adequados para estudos neuroanatomical ao nível LM. Assim, usando um protocolo que é adequado tanto para EM e LM, é possível reduzir o número de animais utilizados, uma consideração de custo eficiente e ético. É também permite uma comparação directa entre os resultados obtidos no LM e os níveis de EM no mesmo animal e permite a utilização de luz Correlativo e estudos de microscopia electrónica (CLEM). CLEM estudos têm focado principalmente na utilização de ratos geneticamente modificados que expressam proteínas fluorescentes, tais como EGFP, o que poderia depois ser marcados com precipitado de electrões denso e observadas ao nível EM 44. Em alternativa, para contornar o problema de imuno-histoquímica, crio-fixação pode ser combinado com uma injecção intraneuronal de marcadores densos em electrões, tais como quantum dots 45, antes da congelação, permitindo a visualização no nível EM 46. No entanto, os pontos quânticos não são biocompatíveis, ea sua utilização é onerosa e demorada, devido ao aparelho de congelao adicional necessário para a preparação do tecido subsequente. Embora estas técnicas ainda favorecem crio-fixação e congelar-substituição métodos, existem alguns desenvolvimentos para a utilização de etiquetas químicas em semi-finas (300 nm) secções de rotular diferentes proteínas celulares com fluoróforos sintéticos, que pode ser correlacionada com a análise de EM 47 . As técnicas que permitem, por exemplo, a correlação entre uma localização específica utilizando axónio de fluorescência e a sua relação com os neurónios sináptica de uma dada estrutura alvo utilizando EM, são bastante promissora para a compreensão da organização do sistema nervoso, especialmente em primatas. Neste caso, a fixação acroleína devem ser favorecidos em detrimento de glutaraldeído, como o último irá produzir autofluorescência que poderia alterar a visualização adequada de estruturas cerebrais no nível LM. No entanto, muito poucos estudos deste tipo foram realizados em primatas, mostly devido aos desafios técnicos e ao alto custo que tais experimentos impor. Assim, os novos desenvolvimentos são necessários para estudos de sucesso e CLEM baixo custo em primatas, tais como a melhoria dos métodos de fixação ou de utilizar etiquetas químicas visíveis em ambos o LM e os níveis de EM.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este estudo foi apoiado pelas Ciências Naturais e Engenharia do Conselho de Investigação do Canadá (NSERC, 401848-2011 para MP). MP recebeu uma concessão carreira do Fonds de recherche du Quebec-Santé (FRQ-S). LE era o receptor de uma bolsa de doutoramento dos FRQ-S (FRQ-S 14D 29441). Agradecemos Marie-Josée Wallman para assistência técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
Referências
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados