Method Article
Preparazione del tessuto cerebrale Primate non umano per la pre-embedding immunoistochimica e microscopia elettronica
In questo articolo
Riepilogo
Qui, forniamo un semplice, a basso costo, e in tempi rapidi protocollo fissiamo chimicamente tessuto cerebrale dei primati con acroleina fissativo, consentendo per la conservazione a lungo termine che è compatibile con pre-embedding immunoistochimica per microscopia elettronica a trasmissione.
Abstract
Nonostante tutti i progressi tecnologici a livello microscopia ottica, microscopia elettronica rimane l'unico strumento in neuroscienze per esaminare e caratterizzare dettagli ultrastrutturali e morfologiche dei neuroni, come i contatti sinaptici. Buona conservazione del tessuto cerebrale di microscopia elettronica può essere ottenuta con metodi rigorosi crio-fissaggio, ma queste tecniche sono piuttosto costosi e limitare l'uso di immunomarcatura, che è cruciale per comprendere la connettività dei sistemi neuronali identificate. Metodi freeze-sostituzione sono stati sviluppati per consentire la combinazione di crio-fissazione con immunomarcatura. Tuttavia, la riproducibilità di questi approcci metodologici di solito si affida a dispositivi di congelamento costosi. Inoltre, ottenendo risultati affidabili con questa tecnica è molto tempo e abilità impegnativo. Quindi, il tradizionale cervello chimicamente fissa, in particolare con acroleina fissativo, rimane un metodo tempo efficiente ea basso costo per combinare elettronimicroscopia con immunoistochimica. Qui, forniamo un protocollo sperimentale affidabile usando fissazione acroleina chimico che conduce alla conservazione del tessuto cerebrale primati ed è compatibile con pre-embedding immunoistochimica e trasmissione di elettroni esame microscopico.
Introduzione
Microscopio ottico, tra cui confocale e microscopia a due fotoni, ha dimostrato di essere uno strumento efficace per studiare in processi neuronali in vivo, tra le altre cose 1, 2. Anche se la risoluzione spaziale tipica a livello (LM) Luce microscopica è di circa 200 nm, i recenti progressi tecnologici utilizzando diverse sorgenti luminose, quali ultravioletti estremi e soft microscopia a raggi X, sono notevolmente aumentate presente risoluzione risoluzione spaziale quasi 10 nm 3 , 4, 5. Altri progressi tecnologici nel campo dell'imaging comprendono combinati risonanza magnetica con istologia e fornire un nuovo metodo per misurare lo spessore della guaina mielinica in vivo, un parametro che era tradizionalmente misurabile solo a livello Microscopio Elettronico (EM) 6, 7. although questi progressi a livello LM forniscono un eccellente strumento per studiare processi viventi, una vista dettagliata e caratterizzazione di strutture, come contatti sinaptici, potrebbero essere ottenuti soltanto con EM, che offre una risoluzione che può raggiungere 0,5 nm. Tuttavia, l'osservazione al livello EM richiede i campioni morto e alterato in qualche modo, con fissativi chimici e processi di disidratazione, al fine di preservare il citoarchitettura. Così, esaminando campioni biologici ad alta risoluzione può essere difficile a causa di danni da radiazione dal fascio di elettroni, basso contrasto, deviazioni strutturali delle membrane, o anche la presenza di artefatti che possono verificarsi in seguito alla disidratazione ed epossidico incorporamento 8, 9, 10.
Conservando campioni nella loro forma nativa per l'analisi strutturale può essere ottenuto utilizzando "Cryo EM di sezioni vetrificati" o CEMOVIS, un approccio che sezionamentocoinvolge rapidamente congelamento e incorporare il campione in ghiaccio vitreo ed esaminando sezioni sotto EM ad una temperatura criogenica 11, 12. Questa procedura permette l'esame di campioni mentre sono ancora solido e completamente idratata, eliminando artefatti causati da disidratazione quindi elabora 13. Tuttavia, questo metodo richiede dispositivi aggiuntivi per crio-ultramicrotomia, nonché dispositivi aggiuntivi standard EM, al fine di consentire questa osservazione a temperature molto basse, che generano notevoli costi aggiuntivi. Inoltre, l'approccio CEMOVIS preclude l'uso di tecniche immunomarcatura, poiché gli anticorpi solito devono essere incubate a temperatura ambiente. In alternativa, è possibile combinare analisi ultrastrutturale con procedure immunoistochimiche utilizzando un approccio di congelamento-sostituzione, durante il quale i campioni crio-fissa sono lentamente scongelati mentre immerso nella chimica crio-protettivo e sono then incorporato in resine speciali, come ad esempio Lowicryls. Post-embedding immunomarcatura può quindi essere eseguita su tale materiale 12. Tuttavia, le tecniche di congelamento-sostituzione e crio-fissaggio sono in termini di tempo. Essi richiedono l'installazione di apparecchiature supplementari e richiedono ancora campioni esposti a solvente organico e un agente chimico che può alterare il citoarchitettura, nonostante l'uso di una bassa temperatura 14, 15. Quindi, nonostante tutti i progressi tecnologici sia a livello LM e EM, fissaggio chimico del tessuto cerebrale, in particolare con acroleina, rimane un metodo a basso costo e in tempi rapidi per combinare immunoistochimica con EM 16.
Negli ultimi decenni, molti tentativi sono stati fatti per trovare una miscela di aldeidi che forniscono la migliore conservazione dei tessuti. Prima di 1960, l'unico agente chimico che ha dato risultati accettabili per EM era tetrossido di osmio. Tuttavia, tetrossido di osmio è altamente tossico e costoso, precludendo il suo utilizzo attraverso il sistema vascolare per riparare organi come il cervello. Acroleina è stato introdotto alla fine del 1950 come un metodo affidabile per la conservazione dei tessuti animali adatto per EM osservazione delle strutture cellulari 17. Esso penetra il tessuto più profondamente e reagisce più rapidamente rispetto ad altri aldeidi quando utilizzate per il fissaggio mediante immersione e consente una buona conservazione dei componenti citoplasmatici, con minimo ritiro del tessuto 17. Tale caratteristica conferisce acroleina fissazione un evidente vantaggio rispetto ad altre aldeidi quando usato in tessuto fresco, permettendo una localizzazione più accurata di composti molecolari, come gli enzimi e altre proteine 18 vivente. Infatti, è stato convalidato attraverso gli anni come un metodo semplice, efficace e di basso costo di fissazione per visualizzazione a livello EM in molte specie, tra anfibi e roditori, come efficientemente stabiliZES peptidi e proteine, mantiene antigenicità e fornisce ultrastruttura relativamente intatto quando usato in combinazione con un altro aldeide fissativo 16, 18, 19, 20, 21. Protocolli per acroleina fissazione in roditori sono da allora stati standardizzati e ampiamente utilizzati, in particolare dal gruppo Pickel, per attuare doppio immunomarcatura per EM 16, 22. Alcuni gruppi hanno usato la fissazione acroleina nel tessuto cerebrale dei primati non umani 23. Tuttavia, a nostra conoscenza, non v'è un solo protocollo pubblicato che descrive in modo efficiente fissazione chimica con acroleina nei primati non umani che è compatibile con EM immunomarcatura 24.
In questo articolo, mettiamo a disposizione un metodo semplice e affidabile per risolvere in modo efficiente chimicamente non-humun cervello primati con acroleina, consentendo una conservazione a lungo termine potenzialmente insieme con pre-embedding immunomarcatura e EM trasmissione esame.
Protocollo
Etica Dichiarazione: Tutti i protocolli che coinvolgono gli animali sono stati approvati dal Comité de Protection des Animaux de l'Université Laval e sono stati realizzati in conformità con il Consiglio Canadese Guida di cura degli animali per la cura e l'uso di animali sperimentali (Ed. 2). Il protocollo qui descritto è stato ottimizzato per animali adulti di circa 800 g. I volumi di fissativo devono essere regolati in base alle dimensioni dell'animale.
1. Preparazione di soluzioni per transcardiac perfusione
- Preparare 1 L di una soluzione 50 mM sodio fosfato tamponata salina (PBS) secondo le seguenti fasi. Preparare la soluzione al massimo 24 ore prima perfusione e mantenere a 4 ° C fino al momento dell'uso.
- Misurare 800 ml di acqua distillata in un becher 1 L. Aggiungere 5,87 g di fosfato di sodio anidro bibasico (Na 2 HPO 4), 1,20 g di fosfato monobasico monoidrato sodio (NaH 2 PO 4 · H 2 O), e 9 gdi cloruro di sodio (NaCl). Mescolare per sciogliere.
- Regolare il pH a 7,4 aggiungendo gradualmente 5 N NaOH. Aggiungere acqua distillata per raggiungere un volume totale di 1 L.
ATTENZIONE: NaOH è un composto chimico corrosivo. Indossare la adeguati dispositivi di protezione individuale (DPI;. Camice da laboratorio, guanti, occhiali protettivi, ecc).
- Preparare 2 L di 4% paraformaldeide (PFA) secondo le seguenti fasi. Questa soluzione deve essere preparata al massimo 24 ore prima dell'intervento e mantenuto a 4 ° C fino al momento dell'uso.
- Misurare 1,5 L di acqua distillata in un 2-L becher. Aggiungere 23.48 g di fosfato di sodio anidro bibasico (Na 2 HPO 4) e 4,80 g di fosfato monobasico monoidrato sodio (NaH 2 PO 4 · 2 O H). Mescolare per sciogliere. Aggiungere acqua distillata per raggiungere un volume totale di 2 L.
- Riscaldare la soluzione sotto una cappa sfiato fino a quando la temperatura raggiunge circa 45 - 55 ° C. Non riscaldare a oltre 60 ° C.
- Aggiungere gradualmente 80 g di PFA alla soluzione e agitare fino a completa dissoluzione (circa 30 - 60 min). Continuare a monitorare la temperatura di tenerlo sotto i 60 ° C.
ATTENZIONE: PFA è altamente volatile nella sua forma di polvere. E 'altamente tossico se a contatto con occhi e pelle ed è pericoloso in caso di inalazione o ingestione. Indossare PPE e utilizzare con cautela sotto una cappa sfiato. - Raffreddare la soluzione fino a 4 ° C ed il filtro. Conservare a 4 ° C.
- Preparare 1 L di 3% acroleina in 0,1 M tampone fosfato (PB) secondo le seguenti fasi. La soluzione PB deve essere preparata al massimo 24 ore prima perfusione.
ATTENZIONE: L'acroleina è altamente tossico se inalato e può produrre danni immediati. E 'anche corrosivo e altamente tossico se assorbito attraverso la pelle. E 'agente cancerogeno e mutageno. Indossare PPE appropriata e utilizzare sotto una cappa sfiato.- Misurare 800 ml di acqua distillata. Aggiungere 8,66 g di fosfato di sodio anidro bibasico (Na 2 HPO 4) e 5,38 g di fosfato monobasico monoidrato sodio (NaH 2 PO 4 · H 2 O). Mescolare fino a quando tutti i sali si dissolvono. Aggiungere acqua distillata per raggiungere un volume totale di 1 L. Mantenere la soluzione a 4 ° C.
- Prima dell'intervento chirurgico, trasferire 900 mL della soluzione PB di un contenitore di vetro 1 L e aggiungere 30,94 ml di soluzione di acroleina 97% sotto una cappa sfiato. Aggiungere la soluzione PB di raggiungere un volume totale di 1 L e mescolate. Filtrare la soluzione e la tiene a 4 ° C.
2. transcardiac Perfusione e cervello dissezione
- Mantenere soluzioni sul ghiaccio durante l'intera procedura chirurgica. Preparare la pompa inserendo il tubo nella prima soluzione da usare (PBS; 50 mM) e ruotando la pompa fino aria rimane nel tubo. Per la perfusione transcardiaca di una scimmia macaco, utilizzare un ago G 21 e impostare il deflusso a circa 80 ml / min.
- Anestetizzare l'animale con un'iniezione intramuscolare di un mixture di ketamina (20 mg / kg), xilazina (4 mg / kg), e acepromazine (0,5 mg / kg). Mantenere l'animale sotto isoflurano (3%) sedazione.
- Fissare arti dell'animale a una tabella di sfiato.
- Con un bisturi, togliere la pelle fino alle ascelle. Tagliare i muscoli addominali. Utilizzare forbici pesanti chirurgiche per tagliare le nervature lateralmente evitando accuratamente gli organi vitali.
- Tagliare il diaframma con le forbici chirurgiche e sollevare la gabbia toracica per esporre il cuore. Una volta che il diaframma è tagliato, procedere rapidamente, poiché il cuore smetterà di battere in pochi minuti.
- Rimuovere il pericardio con una lama di bisturi e inserire l'ago nel ventricolo sinistro. Con un bisturi, fare attenzione un piccolo escissione all'atrio destro. avviare rapidamente la pompa a 72 ml / min e tenere l'ago in posizione. Se possibile, inclinare l'animale in modo da avere la sua testa su un livello più basso rispetto al cuore.
NOTA: Fare attenzione a non forare il setto interventricolare quando si inserisce l'ago.- Rinse il sangue con circa 300 ml di PBS fino a quando i polmoni sono bianchi e il sangue non esce l'atrio destro.
- Fermare la pompa, trasferire rapidamente il tubo / tubo alla soluzione acroleina 3%, e ricominciare la pompa. Aumentare gradualmente la velocità di pompaggio a 80 ml / min, una volta il cuore ha smesso di battere. Profumato circa 500 ml di soluzione di acroleina.
- Fermare la pompa, trasferire rapidamente il tubo alla soluzione PFA 4%, e ricominciare la pompa. Questo passaggio richiede circa 1 L di PFA.
NOTA: Il fissaggio è completa quando gli arti anteriori sono rigidi e il collo è rigido. - Tagliare la testa e sezionare con cura il cervello fuori dal cranio. Fare attenzione a non danneggiare il cervello con gli strumenti chirurgici. La perfusione è ottimale quando il cervello è pallido (senza tracce di sangue) e rigida (Figura 1A).
- Immergere il cervello intatto nel 4% PFA per 1 ora a 4 ° C.
- Serialmente tagliare il cervello con un raffreddamento vibratomo (4 ° C)nel piano desiderato in 50 sezioni micron di spessore e raccoglierli in PBS (0,1 M) (Figura 1B).
NOTA: Questa fase può essere effettuata in vari modi secondo il protocollo desiderato. Emisferi possono essere separati prima vibratome taglio, o tutto mantenuto. Se il cervello è troppo grande per la piattaforma vibratome, può essere tagliato in blocchi più piccoli. Dopo questo passo, le sezioni possono essere conservati per un lungo periodo di tempo a -30 ° C in una soluzione antigelo in 40% PB (50 mM), 30% glicerolo, e il 30% di glicole etilenico.
Immunoistochimica 3. Pre-incorporamento (Figura 1C)
- Preparare una 4 L soluzione stock di Tris-Buffered Saline (TBS, 50 mM, pH 7.6) come segue.
- Misurare 2L di acqua distillata in un becher 4 L, aggiungere 24,23 g di trihydroxymethyl aminomethane (THAM; C 4 H 11 NO 3), e mescolare per sciogliere.
- Regolare il pH a 7,6 con circa 148 ml di 1 N HCl. L'acido deve essere aggiunto con Cautiper evitare di raggiungere un pH inferiore a 7,6. Il volume totale dovrebbe essere 4 L.
ATTENZIONE: HCl è altamente corrosivo. Indossare i DPI appropriato.
- Seleziona sezioni (dal punto 2.11) contenente la regione di interesse per essere trattati per immunoistochimica EM.
- Lavare le sezioni libero di fluttuare 3x in PBS (0,1 M, pH 7,4) per 5 min a temperatura ambiente per sciacquare la soluzione antigelo.
- Preparare una soluzione allo 0,5% di NaBH 4 diluito in PBS.
- Pesare 0,05 g di NaBH 4 e diluire in 10 ml di PBS. Non coprire. Preparare questa soluzione al momento dell'uso.
- Incubare le sezioni nella soluzione appena preparata NaBH 4 per 30 minuti a RT. Agitare delicatamente. Non coprire.
- Lavare 3x in PBS per 10 minuti a temperatura ambiente, a dondolo energicamente fino a nessuno dei gas di reazione rimane.
- Preparare una soluzione di blocco per EM con 2% appropriato siero normale e 0,5% gelatina di pesce freddo diluito in PBS.
NOTA: La quantità should essere calcolato in modo da avere abbastanza per le seguenti tre fasi. Utilizzare un siero a base di una stessa specie animale ospitano l'anticorpo secondario. Evitare l'uso di metodi di recupero antigene o aggiunta di piccole quantità di Triton (per aumentare la penetrazione di anticorpi), in quanto tali metodi compromettono significativamente la qualità del tessuto. - Incubare le sezioni nella soluzione bloccante per 1 ora a RT. Agitare delicatamente.
- Preparare la soluzione di anticorpo primario diluito nella soluzione di blocco.
NOTA: La concentrazione dell'anticorpo primario è di solito uguale per LM immunoistochimica, ma si consideri che effettuano prove con diverse concentrazioni di anticorpi prima, come alcuni anticorpi primari possono non funzionare con acroleina. Se è così, è possibile utilizzare una combinazione di glutaraldeide (0,1-2%) e il 4% PFA per transcardiac perfusione e di ottenere risultati simili. Ottimizzare il tempo di incubazione e la temperatura pure. - Incubare le sezioni in soluzione di anticorpo primariouna notte a RT con dolce dondolio. Utilizzare un tempo di incubazione precedentemente testato e la temperatura.
- Lavare le sezioni 3x in PBS per 5 minuti a temperatura ambiente con dolce dondolio.
- Preparare una soluzione 1: 1.000 di anticorpo secondario biotinilato diluito in soluzione di blocco.
NOTA: L'anticorpo secondario deve essere sollevata contro la specie ospite utilizzati per generare l'anticorpo primario. - Incubare le sezioni in soluzione di anticorpo secondario per 1,5 ore a temperatura ambiente. Agitare delicatamente.
- Preparare una soluzione di avidina-biotina-perossidasi (ABC) almeno 60 minuti prima della fine dell'incubazione anticorpo secondario.
- Utilizzare una pipetta calibrata per misurare 8,80 microlitri / ml delle soluzioni A e B e diluite in PBS.
- Oscillare leggermente per almeno 60 minuti a temperatura ambiente per consentire il legame tra le molecole avidina e biotina completa.
- Dopo l'incubazione in soluzione di anticorpo secondario, lavare 3x in PBS per 10 minuti a RT.
- Incubare le sezioni in modo da ABCluzione 1 ora a RT. Agitare delicatamente.
- Lavare una volta in PBS e due volte in TBS per 10 minuti a RT con dolce dondolio.
- Preparare una soluzione fresca di 0,05% 3,3'-diaminobenzidina (DAB) con 0,005% H 2 O 2 diluito in TBS.
- Pesare 12,5 mg di DAB e diluirlo in 25 ml di TBS freddo. Proteggere dalla luce.
ATTENZIONE: La polvere DAB è altamente volatile e nocivo se inalato. Si è cancerogeno e teratogeno. Così, le donne incinte o che allattano non devono maneggiare il prodotto, anche se diluito. Utilizzare una maschera N95, quando la manipolazione e l'usura DPI. - Filtrare la soluzione e aggiungere 4,5 ml di 30% H 2 O 2 al momento dell'uso.
- Pesare 12,5 mg di DAB e diluirlo in 25 ml di TBS freddo. Proteggere dalla luce.
- Incubare sezioni nella soluzione DAB per 3 a 7 minuti a temperatura ambiente. Agitare delicatamente.
NOTA: Il precipitato marrone non deve essere troppo scura per evitare un elevato livello di colorazione di fondo. Il tempo di incubazione deve essere ottimizzato conseguenza. - Arrestare la reazione lavando due volte in rapidaa freddo TBS, poi due volte per 10 min in TBS fredda a temperatura ambiente, seguito da due volte per 10 minuti in PB, con oscillazione lieve.
NOTA: L'uso di PB (e non PBS) è critica per eliminare eventuali tracce di NaCl, come sarebbe reagire con cristalli osmio e forma.
4. Osmification and Embedding per Electron osservazione al microscopio
- Preparare una soluzione di 1% tetrossido di osmio (OsO 4) diluito in PB. Proteggere dalla luce.
ATTENZIONE: Osmio è altamente tossico e non deve entrare in contatto con la pelle, gli occhi o la bocca e non deve essere inalato. Può causare la morte se ingerito. Dovrebbe essere usato soltanto sotto una cappa sfiato e con DPI appropriato. - Incubare le sezioni in OsO 4 soluzione per 30 min a temperatura ambiente sotto il cofano sfiato (senza agitazione) e coprire con un foglio di alluminio per proteggere dalla luce. Completamente appiattire le sezioni prima di aggiungere la soluzione OsO 4.
NOTA: Le sezioni diventano molto buio e riGID e deve essere manipolato con cura seguendo questo passo. - Preparare resine epossidiche idrorepellente durante l'osmification.
- Aggiungere adeguate quantità di ciascun componente della miscela di resina epossidica (20 g di resina epossidica, 20 g di catalizzatore, 0,6 g di acceleratore e 0,4 g di plastificante) per una grande tazza di plastica. Mescolare con un bastone di legno o di pipetta di plastica fino ad ottenere un colore marrone omogeneo.
NOTA: E 'fondamentale utilizzare la proporzione esatta di ogni componente. - Trasferimento uguali quantità di tazze di alluminio di dimensioni appropriate, a seconda del numero di sezioni da processare. Lasciare riposare.
- Aggiungere adeguate quantità di ciascun componente della miscela di resina epossidica (20 g di resina epossidica, 20 g di catalizzatore, 0,6 g di acceleratore e 0,4 g di plastificante) per una grande tazza di plastica. Mescolare con un bastone di legno o di pipetta di plastica fino ad ottenere un colore marrone omogeneo.
- Lavare le sezioni osmificated 3x in PB per 10 minuti a temperatura ambiente con bassa velocità a dondolo.
- Disidratare sezioni nel seguente serie di etanolo graduata per 2 minuti ogni 2 volte in 35% di etanolo; 1 volta ciascuno, 50, 70, 80, 90, e 95% di etanolo; e 3 volte in 100% di etanolo.
- Trasferire le sezioni per fiale di vetro per completare le dehydratiil processo incubando le sezioni 3 volte per 2 minuti in ossido di propilene.
ATTENZIONE: L'ossido di propilene è un solvente organico volatile e altamente tossico. Può causare gravi danni agli occhi o la pelle in caso di contatto o se inalato o ingerito. È stato classificato come sostanza cancerogena di grado 2. Dovrebbe essere usato soltanto sotto una cappa sfiato e con DPI. E 'anche altamente infiammabile e deve essere tenuto lontano da qualsiasi fonte di calore.
NOTA: Prima di questo passaggio, sezioni devono essere attentamente trasferiti in fiale di vetro, poiché l'ossido di propilene è un solvente organico ed è incompatibile con la plastica. A questo punto, le sezioni sono molto fragili e devono essere manipolati con cura. Le sezioni possono essere alternativamente trasferiti in fiale di vetro prima della fase 4.5. - sezioni Trasferire accuratamente, uno per uno, nelle tazze in alluminio ed evitare il contatto con l'aria il più possibile. TV a incorporare sezioni in resina epossidica idrorepellente precedentemente miscelata e incubare una notte sotto la Venting cappa a RT.
NOTA: A questo punto, le sezioni sono completamente disidratati e molto fragile e deve essere manipolato con cura. - Utilizzo di olio minerale, preparare vetrini grasso rivestite assieme coprioggetto plastica unte.
- Ammorbidire la resina incubando tazze alluminio a 60 ° C per 12-15 minuti al massimo. appiattire attentamente le sezioni sul lato unta del vetrino. Posizionare il vetrino unta e con attenzione spingere fuori l'aria rimasta.
- Incubare i campioni a 60 ° C per 48 h.
NOTA: E 'fondamentale per non superare i 48 h tempo di incubazione, come la resina diventerà troppo duro. - Rimuovere il vetrino plastica.
5. Preparazione del campione per ultrasottile Sezioni e osservazione usando un microscopio elettronico a trasmissione
- Utilizzare binocolo per trovare la regione di interesse e tagliare un piccolo pezzo quadrangolare di circa 1 mm 2 con un bisturi.
- Depositare la punta di un blocco di resina ed incollare la qupiece adrangular su di esso (Figura 1C). Lasciare che la colla si asciughi per almeno 1 ora o durante la notte prima di sezionamento.
- Utilizzando un ultramicrotomo, tagliare il pezzo quadrangolare in 80 sezioni micron di spessore (Figura 1D).
- Posizionare il blocco di resina in una piattaforma ultramicrotomo in posizione verticale e, usando una lama di rasoio affilata, gradualmente tagliare ogni lato del blocco di resina per formare un trapezio con pareti lisce.
- Portare il piatto in posizione orizzontale e ruotare il blocco finché il lato più lungo del trapezio è rivolto verso il basso.
- Utilizzare un utensile di taglio di diamante o un coltello per tagliare vetro sulla superficie del pezzo quadrangolare. Impostare l'ultramicrotomo di taglio 300 um sezioni spesse a 1 mm / s. Regolare il coltello per essere verticalmente parallelo al pezzo quadrangolare e visualizzare un piccolo angolo orizzontale di circa 1 °.
NOTA: Questo angolo consente all'utente di avvicinarsi il tessuto quasi parallela alla superficie del bbloccare, dove gli elementi immunolabeled hanno maggiori probabilità di essere trovati. Quando si utilizzano questi parametri con l'utensile di taglio di diamante, la resina mostra un colore bianco lucido. Quando viene tagliato il tessuto, si trasforma in un colore viola o verde. - Utilizzare un diamante coltello 45 ° ultra dotato di una barca riempita con acqua distillata per tagliare 80 sezioni micron di spessore, lisciare sezioni passando sopra con un pezzo di carta assorbente punta in xilene, e raccogliere sezioni seriali sulle slot griglie Formvar rivestite con nichel o nude 150 griglie di rame maglia (Figura 1E).
- Posizionare le griglie in un contenitore griglia.
- Macchiare le griglie con citrato di piombo.
- Utilizzare una siringa da 5 ml e un filtro a siringa da 0,2 pm per preparare una soluzione 1: 1 di filtrato magazzino soluzione di citrato di piombo e acqua distillata filtrata. Proteggere dalla luce.
NOTA: La soluzione stock di citrato di piombo deve essere fatta fresca ogni mese per evitare la formazione di Depos solidisuo. Vedere la scheda tecnica del materiale per lo stock di ricetta. Inoltre, se hanno bisogno di essere macchiato molte serie di griglie, cambiare la soluzione diluita quando diventa lattiginoso. - Posizionare ogni griglia su una goccia della soluzione diluita, con la sezione a contatto con la soluzione. Incubare per 3 min.
- Utilizzare pinzette per tenere la griglia e sciacquare in due bicchieri contenenti acqua distillata.
- Rimuovere l'acqua in eccesso delicatamente con carta assorbente. Conservare le griglie in una scatola di griglia. Attendere 30 minuti prima di esaminare sezioni di microscopia elettronica a trasmissione (TEM; Figura 1F).
- Utilizzare una siringa da 5 ml e un filtro a siringa da 0,2 pm per preparare una soluzione 1: 1 di filtrato magazzino soluzione di citrato di piombo e acqua distillata filtrata. Proteggere dalla luce.
Risultati
In questa sezione, presentiamo risultati rappresentativi che sono stati ottenuti dopo l'osservazione, a livello EM trasmissione, di immunoistochimica tessuto cerebrale primate chimicamente fissato con una miscela del 3% acroleina e 4% PFA. Abbiamo raggiunto buona conservazione della ultrastruttura, come indicato dalla guaina mielinica relativamente intatto e la visualizzazione ordinata di doppi membrane (Figura 2A). Contatti sinaptici, oltre ad elementi neuronali dal microambiente, possono essere facilmente identificati (Figura 2B). elementi neuronali etichettati con diaminobenzidina (DAB) immunoprecipitato sono riconosciuti a livello EM da loro citoplasma pieno o axoplasm. La membrana plasmatica e la superficie esterna di organelli sono tipicamente rivestiti con il precipitato elettron-denso (Figura 3).
In questo particolare esperimento, abbiamo utilizzato anticorpi against il trasportatore della serotonina (SERT), colina acetiltransferasi (ChAT), o tirosina idrossilasi (TH) per visualizzare elementi neuronali immunolabeled in esterna (GPE) o (GPI) segmentazione interna del pallido scimmie scoiattolo globo (Figura 3). Per farlo, abbiamo utilizzato una combinazione di sostanze chimiche fissativo che conservano antigenicità così come ultrastruttura, permettendo un'indagine morfologica dettagliata. Sebbene molti anticorpi possono essere utilizzati con il protocollo transcardiac perfusione sopra descritto, si consiglia agli utenti di eseguire test di concentrazione ottimizzazione precedenza, dal momento che alcuni anticorpi primari sono noti per non fornire immunomarcatura ottimale con fissaggio acroleina. In alternativa, quando gli anticorpi non forniscono immunomarcatura ottimale con fissaggio acroleina, una diluizione 0,1 - 2% in glutaraldeide in 4% PFA può essere utilizzato per transcardiac perfusione. Esso fornisce una qualità relativamente tessuto equivalente al tessuto cerebrale acroleina-fissa con conservato antigenicità per moltianticorpi (Figura 4).
Infine, forniamo tipici esempi di microfotografie EM ottenuti a seguito manipolazioni inappropriate. A scarsi risultati fissaggio in guaine mieliniche alterati (Figura 5A, B) e difficoltà nella visualizzazione delle doppie membrane dei neuriti (Figura 5C, D), impedendo l'identificazione e l'analisi degli elementi neuronali etichettati e non etichettati affidabile. Un tempo eccessivo di incubazione nella soluzione di DAB crea sfondo eccessiva e colorazione aspecifica che possono potenzialmente generare risultati falsi-positivi. Sfondo o non specifica colorazione appare talvolta come colorazione incompleta di elementi neuronali (Figura 6A, B), ma più spesso numerose e strettamente situato elementi neuronali colorato (figura 6C, D). L'uso di detersivo nella soluzione bloccante modifica sensibilmente la qualità del tessuto. Si può portare a mancareorganelli in elementi con etichetta (Figura 7A) o degradazione della mielina (figura 7B) e membrane cellulari (figura 7C), rendendo qualsiasi interpretazione acuta del microambiente difficile. Infine, un passo falso nel processo osmification, come l'utilizzo di una soluzione di risciacquo contenente cloruro di sodio, produce risultati non affidabili in cui le strutture cellulari sono difficili da distinguere (figura 7D).
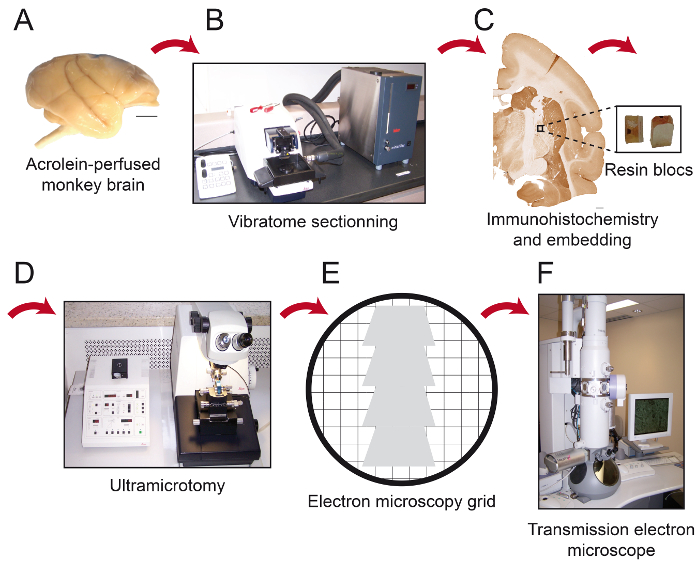
Figura 1: Schema di passi essenziali del protocollo. Il cervello di scimmia (A) viene tagliato in sezioni seriali con un vibratomo raffreddamento (B). Esso viene quindi elaborato per la pre-embedding immunoistochimica e microscopia elettronica, dopo di che la regione di interesse è posto sulla punta di un blocco di resina (C) e tagliato in 80 secti spessore nmons con un ultramicrotomo (D). Sezioni ultrasottili vengono quindi raccolte su nude 150 griglie maglia in rame o griglie di nichel Formvar rivestite (E), colorate con citrato di piombo e pronto per essere osservata al microscopio elettronico a trasmissione (F). Barre di scala: 1 mm. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 2: Ben conservato cervello dei primati Tissue dopo acroleina-PFA transcardiac perfusione. Microscopio elettronico di scimmie scoiattolo (Saimiri sciureus) tessuto cerebrale del GPi (A) e GPe (B) mostrando rappresentante materiale ben conservati dopo aver eseguito il transcardiac perfusione acroleina-PFA e la tecnica dell'immunoperossidasi-diaminobenzidina. il mguaina Yelin di assoni (a) è relativamente intatto (vedi punta di freccia in A), e l'ultrastruttura generale è ben conservato in A e B. profili dendritiche (d), piccoli assoni unmyelinated (a), e varicosità assone (AV) può facilmente essere identificati. Un esempio di un assone varicosity stabilire un contatto sinaptico simmetrica (tra frecce) a profilo dendritico (d) è mostrato in B. barra della scala: 1 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.
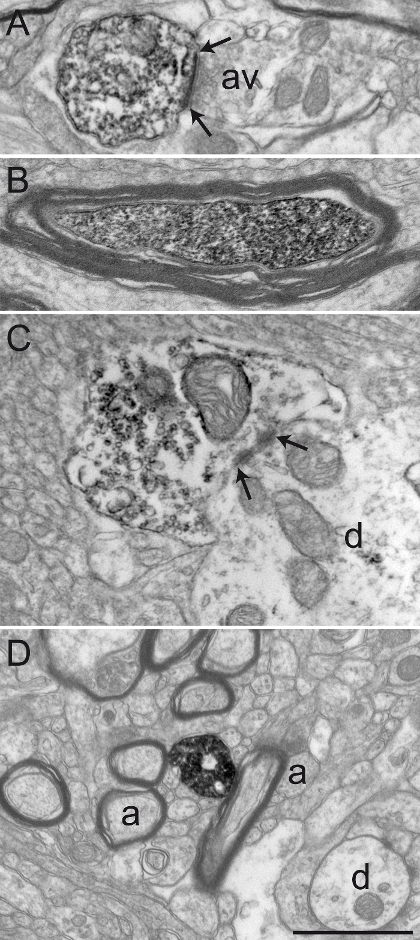
Figura 3: Le sezioni Squirrel Monkey GPe e GPi immunolabeled per colina acetiltransferasi (ChAT), il trasportatore della serotonina (SERT), e tirosina idrossilasi (TH) utilizzando la tecnica immunoperossidasi-diaminobenzidina. immunoelementi con etichetta possono essere facilmente identificati dal loro citoplasma o axoplasm riempito con elettron-denso DAB precipitato. Profili dendritiche etichettati sono riconosciuti da microfilamenti riempiti, come si è visto in A, dove un dendrite ChAT-immunostained in GPi riceve un contatto sinaptico (tra frecce) da un varicosity assone non marcata (av). Il microscopio elettronico a B mostra un assone mielinizzato nel GPe con una guaina mielinica relativamente intatto cui axoplasm è immunolabeled per TH. L'esempio C mostra un assone varicosità nel GPi immunolabeled per SERT ed è visto per stabilire un contatto sinaptico simmetrica (tra frecce) con un dendrite (d). In questo esempio, il DAB precipitare linee membrana plasmatica e la superficie esterna di organelli (mitocondri e vescicole sinaptiche). Il varicosity assone mostrato in D è stato osservato nel GPe e immunolabeled per TH e rappresenta un esempio di DAB precipitato completamente riempire l'axopLASM, con vescicole sinaptiche essendo visibile ma più difficile da delineare. Elementi del microambiente possono essere facilmente identificati, come esemplificato da assoni mieliniche e amieliniche (a) e dendriti occasionali (d) che circondano il varici assone etichetta. Microscopio elettronico vengono modificati da 25, 26, 27. barra della scala: 1 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.
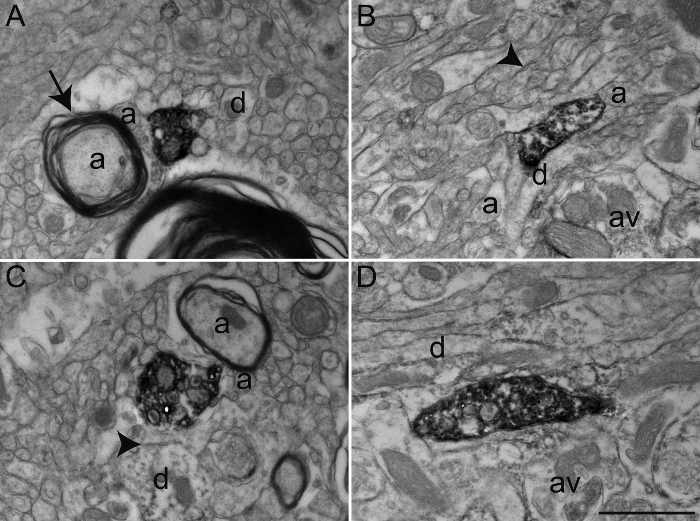
Figura 4: Esempi di primate tessuto cerebrale dopo Glutaraldeide-PFA transcardiac perfusione. Microscopio elettronico rappresentativi di macaco (Macaca fascicularis) tessuto cerebrale di GPE (A) e GPi (BD) dopo performing transcardiac perfusione con 0,2% di glutaraldeide miscelato con 4% PFA e tecnica immunoperossidasi diaminobenzidina con un anticorpo contro il trasportatore della serotonina (SERT). Come in figura 2, immunolabeled elementi possono essere identificati dalla loro citoplasma e axoplasm riempito con elettron-denso DAB precipitato. Ultrastruttura generale è relativamente intatto e elementi del microambiente può essere facilmente identificata, come dimostrato da assoni mieliniche e amieliniche (a) e dendriti occasionali (d) e varicosità assoni (AV) che circondano le varicosità degli assoni etichettati, come descritto nella Figura 2. Si noti tuttavia l'incoerenza nella qualità della ultrastruttura, indicato con membrane plasmatiche ben definite (frecce), ma relativamente guaina mielinica danneggiata (freccia). barra della scala: 1 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.
together.within-page keep- 
Figura 5: Esempi di primate tessuto cerebrale ottenuto a seguito di un riuscito transcardiac perfusione. I risultati di una fissazione chimica senza successo sono mostrati qui in scimmie scoiattolo GPi (A - B) e GPe (C - D) transcardially perfusione con 0,9% soluzione di risciacquo NaCl e una miscela di ghiaccio-freddo 4% di acido PFA e il 15% picrico diluita in 0.1 M PB (pH 7,4). Cervelli sono stati post-fissate 1 ora a 4 ° C in 4% PFA e il 30% di saccarosio e tagliati in sezioni sagittali 60 um di spessore con un vibratome raffreddamento. Impropriamente tessuto cerebrale fisso può essere riconosciuto da una guaina mielinica danneggiata (A e B, frecce), nonché da membrane plasmatiche sfocate o non definiti (C e D, vedi frecce per gli esempi). Diversi elementi neuronali sono DIFficile per identificare, rendendo ogni interpretazione del ultrastruttura inaffidabile. barra della scala: 1 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.

Figura 6: Esempi di non-specifico immunomarcatura ChAT nel Squirrel Monkey GPe. Colorazione di fondo o immunomarcatura aspecifica talvolta appare sotto l'EM come colorazione parziale di grandi elementi cellulari, come illustrato in A - B (frecce). Tale colorazione non specifica appare più spesso alla superficie delle sezioni immunostained. Altri esempi di immunomarcatura non specifici includono la frequente osservazione di elementi molto piccoli evocare piccoli assoni unmyelinated parzialmente o completamente riempito con DAB e situato molto vicino a quello di unnother, come dimostrato dalle frecce in C e D. barra della scala: 1 micron. Si prega di cliccare qui per vedere una versione più grande di questa figura.
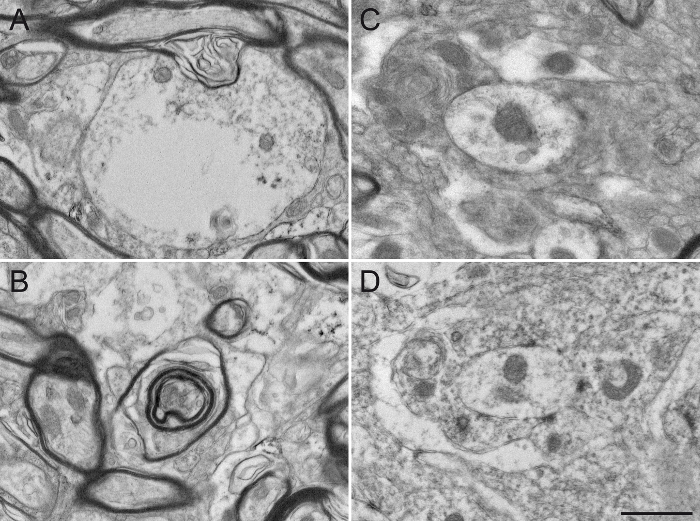
Figura 7: tessuto danneggiato Squirrel Monkey GPe dopo passi falsi nella preparazione dei campioni per la microscopia elettronica. L'uso di detersivo, come Triton X-100, nella soluzione bloccante, anche a bassa concentrazione di 0,02%, altera sostanzialmente l'integrità della ultrastruttura danneggiando citoplasma di dendriti (A) o la guaina mielinica degli assoni (B ). I diversi elementi neuronali sono anche difficili da distinguere l'uno dall'altro (C), in quanto le membrane plasmatiche sono danneggiati e difficile da delineare. Il processo è osmification also un passo importante nella preparazione del campione. L'uso di cloruro di sodio in soluzioni di risciacquo (D) altera la fissazione del tessuto, rendendo difficile la successiva analisi. barra della scala: 800 nm. Si prega di cliccare qui per vedere una versione più grande di questa figura.
Discussione
In questo articolo, presentiamo un protocollo affidabile per transcardiac perfusione di primati non umani e immunoistochimica pre-embedding adatto per l'esame del campione EM. Sebbene tipico crioconservati EM, come CEMOVIS, fornisce una buona conservazione della ultrastruttura cervello, limita anche l'uso di immunoistochimica 12. Altre tecniche, tra cui crio-sostituzione e tecnica Tokuyaso, consentono post-embedding immunoistochimica, ma queste tecniche sono costose a causa di ulteriori dispositivi necessari durante il processo e possono richiedere molto tempo e abilità impegnativo 12, 14, 15. Inoltre, al fine di utilizzare in modo efficiente il metodo crio-fissaggio, il campione deve essere relativamente piccola (fino a 200 pm di spessore utilizzando alta pressione congelamento 28 e 10 um a pressione atmosferica 29). Idealmente, per ottenere un buonrisultati con crio-fissazione del tessuto cerebrale dei primati, il campione deve essere preso da una biopsia, causando problemi nel trovare la posizione esatta della regione di interesse. Questo problema deve essere aggirato usando coordinate stereotassica. Il fissaggio chimico con acroleina e tecnica di pre-embedding sopra proposta fornisce un facile, a basso costo, tempo efficiente e affidabile metodo per la preparazione dei campioni di tessuto cerebrale primati e immunomarcatura per EM. Seguendo questa procedura, si otterrà un ultrastruttura ben conservato insieme antigenicità per consentire l'immunomarcatura della maggior parte delle proteine. Tuttavia, la fissazione chimica per EM ha anche i suoi svantaggi. In primo luogo, mentre le soluzioni fissativi come acroleina conservano i dettagli morfologiche del tessuto cerebrale, è possibile che alcuni cambiamenti morfologici si verificano durante il processo di fissaggio chimico e alterano i risultati rispetto a quelli che si otterrebbero con CEMOVIS o tecniche di crio-sostituzione. In secondo luogo, il processo di fissazione esuccessiva disidratazione necessaria per resina incorporamento rimuovere la maggior parte dei fluidi extracellulari e spremere componenti cellulari insieme, provocando il restringimento del tessuto che modifica in modo significativo la loro dimensione e forma rispetto alle cellule crio-fisso 21, 30. Ciò nonostante, l'aldeide fissazione è stato utilizzato con successo in molti laboratori di tutto il mondo ed è ampiamente accettata nella letteratura come un metodo affidabile per lo studio delle caratteristiche ultrastrutturali dei neuroni e cellule gliali, nonostante le preoccupazioni precedentemente accennato 21, 30, 31, 32.
In confronto con il metodo sopra descritto, l'immunoistochimica postembedding che è necessario per i campioni crio-fisso incorporati in resina metacrilato, è meno sensibile e il rilevamento di antigeni del sistema nervoso centrale è limitata 14 >, 33. Tuttavia, aldeide fissazione ha i suoi limiti in quanto riguarda antigenicità. Pertanto, è importante testare la specificità degli anticorpi per un dato protocollo di fissaggio chimico a livello LM prima di iniziare la preparazione EM. La qualità di immunoistochimica su tessuto cerebrale acroleina fisso dipende anche precedentemente rompere i legami forti aldeidici creati dalla fissazione chimica. Questa fase può essere ottenuta incubando le sezioni prima immunoistochimica con boroidruro di sodio (vedere i passi 3.3 - 3.5). Omettendo questo passaggio sarebbe sicuramente risultato subottimale immunocolorazione 34. Se gli anticorpi da utilizzare non danno colorazione ottimale su sezioni cerebrali fissi con acroleina, è possibile utilizzare in alternativa glutaraldeide (0,1 - 2% in) diluito in 4% PFA. Questo è stato dimostrato di ben preservare ultrastruttura cervello mentre sufficientemente mantenendo antigenicità per molti anticorpi e fornire tessuto cerebraleadatto alla conservazione a lungo termine con minime modifiche 20, 21, 35, 36, 37. È inoltre possibile ottenere relativamente buon fissaggio e antigenicità adatto per EM con PFA solo elevando notevolmente il pH della soluzione, ma una combinazione di più di un fissativo durante la perfusione ha fornito risultati migliori 34, e studi sostengono che la fissazione PFA solo generalmente produrre tessuti mal conservato per l'esame EM 38, 39. Tuttavia, in alcuni rari casi, antigenicità è molto difficile da mantenere, e PFA fissazione da solo resta l'unica opzione praticabile per l'esame EM.
Molti passi in questo protocollo devono essere accuratamente seguiti per ottenere risultati ottimali. Ad esempio, la preparazione della soluzione PFA 4%deve essere effettuata a temperature superiori a 45 ° C per permettere la polvere PFA per sciogliere, ma è imperativo che la temperatura rimane al di sotto di 60 ° C. In caso contrario, la soluzione PFA depolimerizza in formaldeide e acido formico, che fissa il tessuto diverso e forma una soluzione acida che potrebbe alterare sensibilmente la qualità del tessuto 40, 41. Inoltre, è fondamentale che le fasi di perfusione effettuate rapidamente una volta il diaframma è stato tagliato, poiché ipossia e ipercapnia producono cambiamenti fisiologici irreversibili al cervello che potrebbero alterare la qualità e l'integrità del tessuto 31. fissazione difettoso potrebbe essere dannoso per la conservazione del tessuto cerebrale e modificare permanentemente l'ultrastruttura del tessuto, come membrane plasmatiche, mitocondri e sinapsi. Pertanto, devono essere eseguite con cura preparazione della soluzione e gradini perfusione. Il successo del campione preparatio EMn anche altamente dipende da un buon post-fissazione in tetrossido di osmio. Infatti, la perfusione diretta con tetrossido di osmio è stato descritto come la produzione di tessuti ragionevolmente intatto per l'osservazione EM 21, 39. Tuttavia, molte differenze in termini di quantità di spazio extracellulare e la comparsa della membrana plasmatica tra animali osmio-perfuso e aldeide-perfusi sono stati notati. Inoltre, l'annerimento e l'indurimento dei tessuti dopo osmio perfusione reso la rimozione del cervello dal cranio, la successiva dissezione, e la differenziazione tra materia bianca e grigia più difficile, favorendo aldeide perfusione per una migliore conservazione del tessuto e più facile manipolazione 21. Aldeide fissaggio solo sembra ridurre lo spazio extracellulare, che altera l'integrità del tessuto e dà l'impressione di giunzioni strette dove lo spazio extracellulare dovrebbe essere visto, non riuscendo così a mostraremicroscopio elettronico accettabili anche dopo colorazione piombo citrato 42. Tuttavia, postfixation in tetrossido di osmio invertito questa situazione consentendo una separazione più precisa tra elementi del tessuto, che è necessario per la loro identificazione 42, giustificando così chiaramente l'importanza di eseguire le fasi osmification (passi 4.1 - 4.2) con cautela.
Le condizioni e le concentrazioni alle quali vengono effettuate queste operazioni sono state testate nel nostro laboratorio, specificamente per la pre-embedding immunoistochimica utilizzando DAB come precipitato su sezioni cerebrali primati. Sebbene abilità impegnativo doppio immunoistochimica è possibile attraverso post-embedding immunoistochimica con oro particelle 43. L'elettrone-denso DAB precipitato ottenuto dopo la tecnica immunoperossidasi diaminobenzidina qui proposto è molto facile da identificare a livello EM, poiché delinea le membrane plasmatiche e fuorier superfici di organelli, pur consentendo l'individuazione dei componenti subcellulari, come i mitocondri e contatti sinaptici. Inoltre, una volta che la presente tecnica è padroneggiata singolo immunoistochimica, è possibile eseguire un doppio immunoistochimica combinando DAB precipitare a particelle d'oro, che sono più facilmente discernere l'uno dall'altro di particelle d'oro di diverse dimensioni. Consigliamo di fare rigorosi test di specificità anticorpale, le concentrazioni di osmio, e il tempo di incubazione e la temperatura prima di elaborare sezioni del cervello per EM. Protocolli per pre-embedding e doppia immunoistochimica per EM sono stati pubblicati in precedenza e possono essere adattati per tessuto cerebrale primate 16.
In conclusione, il protocollo di perfusione transcardiaca di primati non umani presentata sopra consente la conservazione a lungo termine delle sezioni di cervello che può successivamente essere utilizzato per EM immunoistochimica pre-embedding. sections ottenuti sono adatti per studi neuroanatomici a livello LM anche. Quindi, utilizzando un protocollo che è adatto sia EM e LM, è possibile ridurre il numero di animali usati, una considerazione conveniente ed etico. Inoltre permette un confronto diretto tra i risultati ottenuti alla LM e livelli EM sullo stesso animale e permette l'uso di studi Electron microscopica (CLEM) Correlativo Luce e. Studi CLEM sono principalmente focalizzato sull'uso di topi geneticamente ingegnerizzati esprimono proteine fluorescenti, come EGFP, che potrebbero poi essere etichettate con precipitato elettron-denso e osservate a livello EM 44. In alternativa, per aggirare il problema di immunoistochimica, crio-fissaggio può essere combinato con un'iniezione intraneuronal di marcatori di elettroni dense, quali punti quantici 45, prima del congelamento, permettendo la visualizzazione a livello EM 46. Tuttavia, i punti quantici non sono biocompatibili, eil loro uso è costosa e richiede molto tempo a causa dell'apparecchiatura di congelamento aggiuntivo necessario per la successiva preparazione del tessuto. Sebbene queste tecniche ancora favoriscono crio-fissazione e congelare-sostituzione metodi, ci sono alcuni sviluppi per l'uso di marcatori chimici su sezioni semi-sottili (300 nm) per etichettare diverse proteine cellulari con fluorofori sintetici, che può essere correlata con analisi EM 47 . Tecniche che permettono, per esempio, la correlazione tra una localizzazione specifica assone con fluorescenza e la sua relazione con sinaptica neuroni di una data struttura bersaglio utilizzando EM, sono piuttosto promettenti per la comprensione della organizzazione del sistema nervoso, in particolare nei primati. In questo caso, acroleina fissaggio deve essere favorita rispetto glutaraldeide, in quanto quest'ultimo produrrà autofluorescenza che potrebbe alterare la corretta visualizzazione delle strutture cerebrali a livello LM. Tuttavia, pochi studi di questo tipo sono state intraprese nei primati, mostly causa di problemi tecnici e gli alti costi che tali esperimenti impongono. Così, nuovi sviluppi sono necessari per gli studi di successo e CLEM basso costo in primati, come il miglioramento metodi di fissazione o utilizzando i tag chimiche visibili sia a LM e livelli EM.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo studio è stato sostenuto dalle scienze naturali e ingegneria Research Council del Canada (NSERC, 401.848-2.011 a MP). MP ha ricevuto un premio alla carriera dal Fonds de recherche du Québec-Santé (FRQ-S). LE è stato il destinatario di una borsa di studio di dottorato dalle FRQ-S (FRQ-S 14D 29441). Ringraziamo Marie-Josée Wallman per l'assistenza tecnica.
Materiali
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
Riferimenti
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon