Method Article
Préparation du Primat tissu cérébral non humain pour immunohistochimie pré-enrobage et microscopie électronique
Dans cet article
Résumé
Ici, nous offrons un moyen facile, peu coûteuse et efficace protocole temps pour fixer chimiquement le tissu cérébral des primates avec acroléine fixatif, permettant la conservation à long terme qui est compatible avec l'immunohistochimie pré-enrobage pour la microscopie électronique à transmission.
Résumé
En dépit de toutes les avancées technologiques au niveau de la microscopie optique, la microscopie électronique reste le seul outil en neurosciences pour examiner et caractériser les détails ultrastructuraux et morphologiques des neurones, tels que des contacts synaptiques. Une bonne conservation du tissu cérébral pour la microscopie électronique peut être obtenu par des procédés cryo-fixation rigoureux, mais ces techniques sont plutôt coûteuses et limiter l'utilisation de immunomarquage, ce qui est crucial pour comprendre la connectivité des systèmes neuronaux identifiés. méthodes gel de substitution ont été mis au point pour permettre la combinaison de cryo-fixation avec immunomarquage. Cependant, la reproductibilité de ces approches méthodologiques repose généralement sur des dispositifs de congélation coûteux. De plus, l'obtention de résultats fiables avec cette technique est très consommatrice en temps et compétences difficiles. Par conséquent, le cerveau traditionnel chimiquement fixe, en particulier avec l'acroléine fixatif, reste un temps efficace et méthode peu coûteuse pour combiner électroniquemicroscopie avec immunohistochimie. Ici, nous fournissons un protocole expérimental fiable en utilisant la fixation d'acroléine chimique qui conduit à la préservation du tissu cérébral des primates et est compatible avec immunohistochimie pré-enrobage et de transmission examen au microscope électronique.
Introduction
La microscopie optique, y compris la microscopie confocale et à deux photons, est avérée être un outil efficace pour l' étude in vivo des processus neuronaux, entre autres 1, 2. Bien que la résolution spatiale typique au niveau de lumière microscopique (LM) est d' environ 200 nm, les progrès technologiques récents utilisant différentes sources de lumière, telles que l' ultraviolet extrême et la microscopie à rayons X mous, ont notablement augmenté cette résolution à une résolution spatiale de près de 10 nm 3 , 4, 5. D' autres avancées technologiques dans l' imagerie comprennent l' imagerie par résonance magnétique combinés avec l' histologie et de fournir un nouveau procédé pour mesurer l'épaisseur de la gaine de myéline in vivo, un paramètre qui est traditionnellement mesurable seulement au niveau de microscopie électronique (EM) 6, 7. although ces progrès au niveau des LM fournissent un excellent outil pour l'étude des processus vivants, une vue détaillée et la caractérisation des structures, telles que les contacts synaptiques, ne peuvent être atteints avec EM, qui offre une résolution qui peut atteindre 0,5 nm. Cependant, l'observation au niveau EM exige que les spécimens morts et modifié à certains égards, avec fixateurs chimiques et des procédés de déshydratation, afin de préserver la cytoarchitecture. Ainsi, l' examen d' échantillons biologiques à haute résolution peut être difficile en raison de dégâts d'irradiation du faisceau d'électrons, un faible contraste, les écarts de structure des membranes, ou même la présence d'artefacts qui peuvent se produire suite à l' incorporation déshydratation et époxy 8, 9, 10.
La préservation des spécimens dans leur forme native pour l'analyse structurelle peut être obtenue en utilisant « Cryo EM des sections vitrifiés » ou CEMOVIS, qu'une approche tronçonnageconsiste à congeler rapidement et l' incorporation de l'échantillon dans de la glace vitreuse et en examinant les sections sous le EM à une température cryogénique 11, 12. Cette procédure permet l'examen des échantillons alors qu'ils sont encore solides et totalement hydratée, éliminant ainsi les artefacts causés par des processus de déshydratation 13. Cependant, cette méthode implique des dispositifs supplémentaires pour cryo-ultramicrotomie, ainsi que des dispositifs supplémentaires sur l'EM standard, afin de permettre cette observation à des températures très basses, qui génèrent des coûts supplémentaires importants. De plus, l'approche CEMOVIS exclut l'utilisation de techniques immunomarquage, car les anticorps doivent généralement être mis en incubation à la température ambiante. Sinon, il est possible de combiner l'analyse ultrastructurale des procédures immunohistochimie en utilisant une approche gel de substitution, au cours de laquelle des échantillons fixés Cryo sont lentement décongelés tout immerged dans les produits chimiques cryo-protecteurs et sont een embarqué dans des résines spécialisées, telles que Lowicryls. Immunomarquage post-enrobage peut ensuite être effectuée sur un tel matériau 12. Cependant, le gel de substitution et de techniques de cryopréservation fixation prennent beaucoup de temps. Ils nécessitent l'installation d' un équipement supplémentaire et nécessitent encore des échantillons d'être exposés au solvant organique et un fixateur chimique qui peut altérer la cytoarchitecture, malgré l'utilisation d'une basse température 14, 15. Par conséquent, en dépit de toutes les avancées technologiques , tant au niveau LM et EM, fixation chimique du tissu cérébral, en particulier avec l' acroléine, reste un faible coût et une méthode efficace de combiner le temps immunohistochimie avec EM 16.
Au cours des dernières décennies, de nombreuses tentatives ont été faites pour trouver un mélange d'aldéhydes qui offrent la meilleure conservation des tissus. Avant les années 1960, la seule fixatif chimique qui a donné des résultats acceptables pour EM était osmium tétroxyde. Cependant, tétroxyde d'osmium est hautement toxique et coûteux, ce qui empêche son utilisation dans le système vasculaire pour réparer des organes tels que le cerveau. Acroléine a été introduit dans les années 1950 comme une méthode fiable pour la conservation des tissus animaux appropriés pour l' observation EM des structures cellulaires 17. Il pénètre dans le tissu plus profondément et réagit plus rapidement que d' autres aldéhydes lorsqu'ils sont utilisés pour la fixation par immersion et permet une bonne conservation des composants cytoplasmiques, avec un retrait minimal du tissu 17. Une telle caractéristique permet la fixation de l' acroléine un net avantage sur d' autres aldéhydes lorsqu'il est utilisé dans les tissus frais, en permettant une localisation plus précise de la vie des composés moléculaires, tels que des enzymes et d' autres protéines 18. En effet, il a été validé au fil des ans comme un moyen facile, efficace et méthode peu coûteuse de fixation pour la visualisation au niveau EM dans de nombreuses espèces, y compris les amphibiens et les rongeurs, comme efficacement Stabiliconserve une antigénicité et fournit ultrastructure relativement intact lorsqu'il est utilisé en combinaison avec un autre aldéhyde fixatif 16, 18, 19, 20, des peptides et des protéines de zes, 21. Protocoles pour la fixation d'acroléine chez les rongeurs ont depuis été normalisés et largement utilisé, en particulier par le groupe Pickel, à mettre en œuvre pour double immunomarquage EM 16, 22. Quelques groupes ont utilisé la fixation de l' acroléine dans le tissu cérébral des primates non humains 23. Cependant, à notre connaissance, il n'y a qu'un seul protocole publié décrivant efficacement la fixation chimique avec de l' acroléine chez les primates non humains qui est compatible avec EM immunomarquage 24.
Dans cet article, nous proposons une méthode simple et fiable pour résoudre efficacement chimiquement non-humun cerveau de primate avec acroléine, ce qui permet une conservation potentiellement à long terme ainsi que immunomarquage pré-enrobage et de transmission EM examen.
Protocole
Déclaration éthique: Tous les protocoles impliquant des animaux ont été approuvés par le Comité de Protection des Animaux de l'Université Laval et ont été faites conformément au Conseil canadien sur le Guide des animaux de soins sur le soin et l'utilisation des animaux (Ed 2.). Le protocole décrit ici a été optimisé pour les animaux adultes d'environ 800 g. Les volumes de fixatif doivent être ajustées en fonction de la taille de l'animal.
1. Préparation des solutions pour transcardiaque Perfusion
- Préparer 1 L d'une solution saline tamponnée au phosphate de sodium 50 mM (PBS), selon les étapes suivantes. Préparer la solution au plus 24 h avant la perfusion et de maintenir à 4 ° C jusqu'à utilisation.
- Mesurer 800 ml d'eau distillée dans un bêcher de 1 litre. Ajouter 5,87 g de phosphate de sodium dibasique anhydre (Na 2 HPO 4), 1,20 g de phosphate de sodium monobasique monohydraté (NaH 2 PO 4 · H 2 O), et 9 gde chlorure de sodium (NaCl). Remuez pour dissoudre.
- Ajuster le pH à 7,4 par addition progressive de NaOH 5 N. Ajouter de l'eau distillée pour atteindre un volume total de 1 L.
ATTENTION: NaOH est un composé chimique corrosif. Porter le vêtement de protection approprié (EPI;. Blouse de laboratoire, des gants, des lunettes de protection, etc.).
- Préparer 2 L de 4% de paraformaldehyde (PFA) selon les étapes suivantes. Cette solution doit être préparée au plus 24 h avant la chirurgie et maintenue à 4 ° C jusqu'à utilisation.
- Mesurer 1,5 L d'eau distillée dans un bêcher de 2 litres. Ajouter 23,48 g de phosphate de sodium dibasique anhydre (Na 2 HPO 4) et 4,80 g de phosphate de sodium monobasique monohydraté (NaH 2 PO 4 · H 2 O). Remuez pour dissoudre. Ajouter de l'eau distillée pour atteindre un volume total de 2 L.
- Chauffer la solution sous une hotte d'évacuation jusqu'à ce que la température atteigne environ 45 - 55 ° C. Ne pas chauffer à plus de 60 ° C.
- Ajouter graduellement 80 g de PFA à la solution et on agite jusqu'à dissolution complète (environ 30 - 60 min). Continuer à surveiller la température pour le maintenir en dessous de 60 ° C.
ATTENTION: PFA est très volatil sous sa forme de poudre. Il est très toxique en cas de contact avec les yeux ou la peau et est dangereux en cas d'inhalation ou ingestion. Porter l'EPI et utiliser avec précaution sous une hotte de ventilation. - On refroidit la solution à 4 ° C et on filtre. Conserver à 4 ° C.
- Préparer 1 L de 3% d'acroléine dans 0,1 M de tampon phosphate (PB) selon les étapes suivantes. La solution PB doit être préparé au plus 24 h avant la perfusion.
ATTENTION: Acroléine est en cas d'inhalation et hautement toxique peut produire des dommages immédiats. Il est également corrosif et très toxique en cas d'absorption par la peau. Il est cancérogène et mutagène. Porter l'EPI et utiliser sous une hotte de ventilation appropriée.- Mesurer 800 ml d'eau distillée. Ajouter 8,66 g de phosphate de sodium dibasique anhydre (Na 2 HPO 4) et 5,38 g de phosphate de sodium monobasique monohydraté (NaH 2 PO 4 · H 2 O). Remuer jusqu'à ce que tous les sels se dissolvent. Ajouter de l'eau distillée pour atteindre un volume total de 1 L. Conserver la solution à 4 ° C.
- Avant la chirurgie, transférer 900 ml de la solution PB dans un récipient en verre de 1 L et ajouter 30,94 ml de 97% de solution d'acroléine sous une hotte de ventilation. Ajouter une solution PB pour atteindre un volume total de 1 litre et mélanger. Filtrer la solution et le maintenir à 4 ° C.
2. transcardiaque et Perfusion cerveau Dissection
- Conserver les solutions sur la glace pendant toute intervention chirurgicale. Préparer la pompe en plaçant le tube dans la première solution à utiliser (PBS; 50 mM) et en tournant la pompe jusqu'à ce que l'air ne reste dans le tuyau. Pour la perfusion transcardiaque d'un singe macaque, utiliser une aiguille 21 G et régler le débit à environ 80 mL / min.
- Anesthésier l'animal avec une injection intramusculaire d'un mélangeture de la kétamine (20 mg / kg), xylazine (4 mg / kg) et d'acépromazine (0,5 mg / kg). Maintenir l'animal sous l'isoflurane (3%) sédation.
- Attachez les membres de l'animal à une table de ventilation.
- Avec un scalpel, enlever la peau jusqu'aux aisselles. Couper les muscles abdominaux. Utilisez des ciseaux chirurgicaux lourds pour couper les côtes latéralement en évitant soigneusement les organes vitaux.
- Couper le diaphragme avec des ciseaux chirurgicaux et soulever la cage thoracique pour exposer le coeur. Une fois que le diaphragme est coupé, passez rapidement, puisque le cœur cesse de battre en quelques minutes.
- Retirer le péricarde avec une lame de scalpel et insérer l'aiguille dans le ventricule gauche. Avec un scalpel, faites soigneusement une petite excision à l'oreillette droite. démarrer rapidement la pompe à 72 mL / min et maintenir l'aiguille en place. Si possible, inclinez l'animal afin d'avoir sa tête sur un niveau inférieur au cœur.
REMARQUE: Veillez à ne pas percer le septum interventriculaire lors de l'insertion de l'aiguille.- Rinse le sang avec environ 300 ml de PBS jusqu'à ce que les poumons sont blancs et pas de sang sort de l'oreillette droite.
- Arrêter la pompe, transférer rapidement le tuyau / tube à la solution d'acroléine 3%, et recommencer la pompe. Augmentez progressivement la vitesse de pompage à 80 mL / min, une fois que le cœur a cessé de battre. Perfuser environ 500 ml de la solution d'acroléine.
- Arrêter la pompe, transférer rapidement le tuyau à la solution PFA 4%, et recommencer la pompe. Cette étape nécessite environ 1 L de PFA.
NOTE: La fixation est terminée lorsque les pattes avant sont rigides et le cou est raide. - Couper la tête et disséquer soigneusement le cerveau du crâne. Prenez soin de ne pas endommager le cerveau avec les instruments chirurgicaux. La perfusion est optimale lorsque le cerveau est pâle (aucune trace de sang) et rigide (figure 1A).
- Immerger le cerveau intact dans 4% de PFA pendant 1 h à 4 ° C.
- couper le cerveau en série avec un refroidissement vibratome (4 ° C)dans le plan désiré en 50 um d' épaisseur et sections les recueillir dans du PBS (0,1 M) (figure 1B).
REMARQUE: Cette étape peut être effectuée de plusieurs façons selon le protocole souhaité. Hémisphères peuvent être séparés avant la coupe vibratome, ou ensemble conservé. Si le cerveau est trop grand pour la plate-forme vibratome, il peut être coupé en blocs plus petits. Après cette étape, les articles peuvent être stockés pendant une longue période de temps à -30 ° C dans une solution antigel faite de 40% PB (50 mM), 30% de glycerol et 30% d'éthylène glycol.
3. Immunohistochimie pré-enrobage (Figure 1C)
- Préparer un 4 L de solution mère saline tamponnée au Tris (TBS, 50 mM, pH 7,6) comme suit.
- Mesurer 2L d'eau distillée dans un bêcher de 4 L, ajouter 24,23 g de trihydroxyméthyl aminométhane (THAM, C 4 H 11 NO 3), et agiter pour dissoudre.
- Ajuster le pH à 7,6 avec environ 148 ml de 1 N HCl. L'acide doit être ajouté avec Cautià éviter d'atteindre un pH inférieur à 7,6. Le volume total devrait être 4 L.
ATTENTION: HCl est très corrosif. Porter l'EPI approprié.
- Sélectionner sections (de l'étape 2.11) contenant la région d'intérêt devant être traitées pour immunohistochimie EM.
- Laver les sections flottantes 3x dans du PBS (0,1 M, pH 7,4) pendant 5 min à température ambiante pour rincer la solution antigel.
- Préparer une solution à 0,5% de NaBH 4 dilué dans du PBS.
- Peser 0,05 g de NaBH 4 et de le diluer dans 10 ml de PBS. Ne pas couvrir. Préparer cette solution juste avant l'utilisation.
- Incuber les sections dans la solution de NaBH 4 fraîchement préparée pendant 30 minutes à température ambiante. Bercer doucement. Ne pas couvrir.
- Laver 3x dans du PBS pendant 10 min à température ambiante, à bascule vigoureusement jusqu'à ce qu'aucun des gaz de réaction reste.
- Préparer une solution de blocage pour EM avec 2% de sérum normal approprié et 0,5% de gélatine de poisson froid dilué dans du PBS.
NOTE: La quantité ShoulD est calculée afin d'avoir assez pour les trois étapes suivantes. Utilisation d'un sérum à base de la même espèce animale hébergeant l'anticorps secondaire. Évitez l'utilisation de méthodes de recherche d'antigènes ou addition de petites quantités de triton (pour augmenter la pénétration des anticorps), car ces méthodes compromettent considérablement la qualité du tissu. - Incuber les sections dans la solution de blocage pendant 1 h à température ambiante. Bercer doucement.
- Préparer une solution d'anticorps primaire dilué dans la solution de blocage.
NOTE: La concentration de l'anticorps primaire est généralement le même que pour l'immunohistochimie LM, mais envisager de procéder à des essais avec des concentrations d'anticorps différents au préalable, car certains anticorps primaires peuvent ne pas fonctionner avec de l'acroléine. Dans ce cas, il est possible d'utiliser un mélange de glutaraldéhyde (0,1 - 2%) et 4% PFA pour perfusion transcardiaque et d'obtenir des résultats similaires. Optimiser le temps d'incubation et de la température ainsi. - Incuber les sections dans une solution d'anticorps primairependant une nuit à température ambiante avec agitation légère. Utilisez un temps d'incubation précédemment testée et la température.
- Laver les sections 3x dans du PBS pendant 5 min à température ambiante avec agitation légère.
- Préparer un mélange 1: 1000 solution d'anticorps secondaire biotinylé dilué dans la solution de blocage.
NOTE: L'anticorps secondaire doit être soulevée contre les espèces hôtes utilisées pour produire l'anticorps primaire. - Incuber les sections dans une solution d'anticorps secondaire pendant 1,5 h à température ambiante. Bercer doucement.
- Préparer une solution de peroxydase avidine-biotine (ABC) au moins 60 min avant la fin de l'incubation de l'anticorps secondaire.
- Utiliser une pipette calibrée pour mesurer 8,80 ul / ml de solutions A et B et les diluer dans du PBS.
- Basculer légèrement pendant au moins 60 min à température ambiante pour permettre la liaison complète entre les molécules d'avidine et de la biotine.
- Après l'incubation dans une solution d'anticorps secondaire, laver 3x dans du PBS pendant 10 min à température ambiante.
- Incuber les sections de l'ABC afinlution pendant 1 h à température ambiante. Bercer doucement.
- Laver une fois dans du PBS et deux fois dans du TBS pendant 10 minutes à température ambiante avec agitation légère.
- Préparer une solution fraîche de 0,05% de 3,3'-diaminobenzidine (DAB) avec 0,005% de H 2 O 2 dilué dans du TBS.
- Peser 12,5 mg de DAB et le diluer dans 25 ml de TBS froid. Protéger de la lumière.
ATTENTION: La poudre DAB est très volatile et nocif en cas d'inhalation. Il est cancérigène et tératogène. Ainsi, les femmes enceintes ou qui allaitent ne doivent pas manipuler ce produit, même lorsqu'il est dilué. Utilisez un masque N95 lors de la manipulation et de porter des EPI. - Filtrer la solution et ajouter 4,5 ul de 30% de H 2 O 2 juste avant utilisation.
- Peser 12,5 mg de DAB et le diluer dans 25 ml de TBS froid. Protéger de la lumière.
- Incuber sections dans la solution DAB pendant 3 à 7 min à température ambiante. Bercer doucement.
NOTE: Le précipité brun ne doit pas être trop sombre afin d'éviter un niveau élevé de coloration de fond. Le temps d'incubation doit être optimisée en conséquence. - Arrêter la réaction en rapidement deux lavagesdans du TBS froid, puis deux fois pendant 10 min dans du TBS froid à la température ambiante, suivie par deux fois pendant 10 minutes dans PB, avec basculement doux.
NOTE: L'utilisation de PB (et non PBS) est essentielle en vue d'éliminer toute trace de NaCl, car il réagirait avec des cristaux d'osmium et de forme.
4. Osmification et Embedding pour Electron Observation Microscopique
- Préparer une solution de 1% de tétroxyde d' osmium (OsO 4) dilué dans du PB. Protéger de la lumière.
ATTENTION: osmium est hautement toxique et ne doit pas entrer en contact avec la peau, les yeux ou la bouche et ne doit pas être inhalée. Il peut entraîner la mort en cas d'ingestion. Il ne doit être utilisé sous une hotte de ventilation et de protection individuelle approprié. - Incuber les sections en solution OsO 4 pendant 30 min à température ambiante sous la hotte d' évacuation (sans agitation) et les recouvrir d' une feuille d'aluminium pour les protéger de la lumière. Complètement aplatir les sections avant d'ajouter la solution OsO 4.
NOTE: Les sections deviennent très sombres et rigid et doit être manipulé avec précaution suite à cette étape. - Préparer une résine époxy résistant à l'eau lors de la osmification.
- Ajouter des quantités appropriées de chaque composant de la composition de résine époxy (20 g de résine époxy, 20 g de durcisseur, 0,6 g d'accélérateur et 0,4 g de plastifiant) dans une grande tasse en plastique. Agiter avec une baguette en bois ou pipette en plastique jusqu'à l'obtention d'une couleur marron homogène.
NOTE: Il est essentiel d'utiliser la proportion exacte de chaque composant. - Transfert des quantités égales tasses en aluminium de dimensions appropriées, en fonction du nombre de sections à traiter. Laisser reposer.
- Ajouter des quantités appropriées de chaque composant de la composition de résine époxy (20 g de résine époxy, 20 g de durcisseur, 0,6 g d'accélérateur et 0,4 g de plastifiant) dans une grande tasse en plastique. Agiter avec une baguette en bois ou pipette en plastique jusqu'à l'obtention d'une couleur marron homogène.
- Laver les sections osmificated 3x dans PB pendant 10 min à température ambiante avec basculement faible vitesse.
- Déshydrater les sections de la série suivante de l'éthanol gradué pendant 2 minutes chacune: 2 fois dans 35% d'éthanol; 1 heure chacun à 50, 70, 80, 90, et 95% d'éthanol; et 3 fois dans 100% d'éthanol.
- Transférer les sections dans des flacons de verre pour compléter les dehydratile processus en incubant les sections 3 fois pendant 2 minutes dans de l'oxyde de propylène.
ATTENTION: L'oxyde de propylene est un solvant organique très volatil et toxique. Il peut causer des dommages graves aux yeux ou la peau en cas de contact ou par inhalation ou ingestion. Il a été classé comme substance cancérigène grade 2. Il ne doit être utilisé sous une hotte de ventilation et EPI. Il est également très inflammable et doit être tenu à l'écart de toute source de chaleur.
REMARQUE: Avant cette étape, les articles doivent être soigneusement transférés dans des flacons en verre, étant donné que l'oxyde de propylène est un solvant organique et est incompatible avec le plastique. À ce stade, les sections sont très fragiles et doivent être manipulés avec soin. Les sections peuvent être alternativement transférés dans des flacons de verre avant l'étape 4.5. - sections de transfert avec soin, un par un, dans les tasses en aluminium et éviter tout contact avec de l'air autant que possible. -Plat intégré les sections en résine époxy hydrofuge préalablement mélangés et les incuber pendant une nuit sous la Venting hotte à température ambiante.
NOTE: A ce stade, les sections sont complètement déshydratés et très fragile et doit être manipulé avec précaution. - Utilisation de l'huile minérale, de préparer des lames de verre revêtues de graisse, avec des lamelles en plastique graissés.
- Ramollir la résine par incubation des tasses en aluminium à 60 ° C pendant 12 à 15 min au maximum. aplatir soigneusement les sections sur le côté graissé de la lame de verre. Placez la lamelle graissé et soigneusement pousser tout l'air.
- Incuber les lames à 60 ° C pendant 48 h.
NOTE: Il est essentiel de ne pas dépasser 48 h temps d'incubation, comme la résine deviendra trop dur. - Enlever les lamelles en plastique.
5. Préparation d'échantillons pour ultraminces et Observation Sectionnement L'utilisation d'un microscope électronique à transmission
- Utilisez des jumelles pour trouver la région d'intérêt et couper un petit morceau quadrangulaire d'environ 1 mm 2 avec un scalpel.
- Déposer la pointe d'un bloc de résine et de colle de la quadrangular pièce sur celui - ci (Figure 1C). Laisser sécher la colle pendant au moins 1 h ou pendant une nuit avant la coupe.
- Utilisation d' un ultramicrotome, couper la pièce quadrangulaire en 80 sections um d'épaisseur (Figure 1D).
- Placer le bloc de résine dans un pont ultramicrotome en position verticale et, en utilisant une lame de rasoir, couper progressivement de chaque côté du bloc de résine pour former un trapèze avec des côtés lisses.
- Mettre la plate-forme dans sa position horizontale et faire pivoter le bloc jusqu'à ce que le côté le plus long du trapèze est tourné vers le bas.
- Utilisez un outil de coupe en diamant ou un couteau de verre pour couper la surface de la pièce quadrangulaire. Réglez le ultramicrotome pour couper à 300 um d'épaisseur à sections de 1 mm / s. Ajuster le couteau verticalement pour être parallèle à la pièce quadrangulaire et pour afficher un angle horizontal très faible d'environ 1 °.
NOTE: Cet angle permet à l'utilisateur d'approcher le tissu presque parallèle à la surface du bverrouiller, où les éléments immunomarquées sont plus susceptibles de se trouver. Lors de l'utilisation de ces paramètres avec l'outil de coupe de diamant, la résine affiche une couleur blanche brillante. Lorsque le tissu est coupé, il se transforme en une couleur pourpre ou verdâtre. - Utiliser un couteau en diamant ultra 45 ° équipé d'un bateau rempli d'eau distillée pour réduire de 80 um sections épaisses, lisser les sections en passant sur eux avec un morceau de papier absorbant pointe dans le xylène, et de recueillir des coupes en série sur des grilles de fente nickel revêtu formvar-ou nues 150 mailles des grilles de cuivre (Figure 1E).
- Placez les grilles dans une zone de stockage de grille.
- Colorer les grilles avec du citrate de plomb.
- Utiliser une seringue de 5 ml et d'un filtre à seringue de 0,2 um pour préparer une solution 1: 1 de solution de réserve de citrate de plomb filtrée et l'eau distillée filtrée. Protéger de la lumière.
REMARQUE: La solution mère de citrate de plomb doit être frais tous les mois pour éviter la formation de solides DEPOSses. Voir la fiche produit pour la recette de stock. De plus, si de nombreuses séries de grilles doivent être colorées, changer la solution diluée quand elle devient laiteuse. - Placer chaque grille sur une goutte de la solution diluée, avec la section en contact avec la solution. Incuber pendant 3 min.
- Utilisez de petites pinces pour tenir la grille, et bien rincer dans deux béchers contenant de l'eau distillée.
- Éliminer l'eau en excès à l'aide de papier absorbant doucement. Conserver les grilles dans une boîte de grille. Attendre 30 min avant d' examiner les articles par microscopie électronique à transmission (TEM; Figure 1F).
- Utiliser une seringue de 5 ml et d'un filtre à seringue de 0,2 um pour préparer une solution 1: 1 de solution de réserve de citrate de plomb filtrée et l'eau distillée filtrée. Protéger de la lumière.
Résultats
Dans cette section, nous présentons les résultats représentatifs qui ont été obtenus suite à l'observation, au niveau de l'EM de transmission, des tissus du cerveau de primate immunocolorées chimiquement fixé avec un mélange de 3% d'acroléine et 4% de PFA. Nous avons obtenu une bonne conservation de l'ultrastructure, comme indiqué par la gaine de myéline relativement intacte et la visualisation nette des doubles membranes (figure 2A). Contacts synaptiques, ainsi que des éléments neuronaux du microenvironnement, peuvent facilement être identifiés (figure 2B). éléments neuronaux marqués avec immunoprécipité de diaminobenzidine (DAB) sont reconnus au niveau EM par leur cytoplasme rempli ou axoplasme. La membrane de plasma et la surface extérieure du organelles sont également typiquement alignés avec le précipité dense aux électrons (Figure 3).
Dans cette expérience particulière, nous avons utilisé des anticorps against le transporteur de la serotonine (SERT), la choline acétyltransférase (ChAT), ou tyrosine hydroxylase (TH) pour visualiser les éléments neuronaux immunomarquées à l'extérieur (GPe) ou un segment interne (GPi) du singe écureuil globus pallidus (Figure 3). Pour ce faire, nous avons utilisé une combinaison de produits chimiques fixateurs qui préservent antigénicité ainsi que ultrastructure, ce qui permet une enquête morphologique détaillée. Bien que de nombreux anticorps peuvent être utilisés avec le protocole de perfusion transcardiaque décrit ci-dessus, nous recommandons aux utilisateurs d'effectuer des tests de concentration d'optimisation préalable, étant donné que certains anticorps primaires sont connus pour ne pas fournir immunomarquage optimale avec la fixation d'acroléine. En variante, lorsque des anticorps ne fournissent pas immunomarquage optimal avec la fixation de l'acroléine, une dilution de 0,1 à 2% de glutaraldéhyde dans 4% de PFA peut être utilisé pour la perfusion transcardiaque. Il offre une qualité de tissu relativement équivalent au tissu cérébral fixe acroléine avec antigénicité conservé pour beaucoupdes anticorps (Figure 4).
Enfin, nous fournissons des exemples typiques de microphotographies EM obtenus suite à des manipulations inappropriées. Il en résulte une mauvaise fixation de gaines de myéline modifiées (Figure 5A, B) et des difficultés dans la visualisation des doubles membranes des neurites (Figure 5C, D), ce qui empêche une identification fiable et l' analyse d'éléments neuronaux marqués et non marqués. Un temps d'incubation excessive dans la solution DAB crée fond excessive et la coloration non spécifique qui peut potentiellement générer des résultats faussement positifs. Arrière - plan ou la coloration non spécifique apparaît parfois incomplet coloration d'éléments neuronaux (figure 6A, B), mais le plus souvent aussi nombreux et éléments neuronaux étroitement situé colorées (figure 6C, D). L'utilisation d'un détergent dans la solution de blocage modifie de manière significative la qualité du tissu. Elle peut conduire à manquerorganelles dans des éléments marqués (Figure 7A) ou la dégradation des gaines de myéline (figure 7b) et des membranes cellulaires (Figure 7C), ce qui rend toute interprétation aiguë du microenvironnement difficile. Enfin, un faux - pas dans le processus de osmification, par exemple en utilisant une solution de rinçage contenant du chlorure de sodium, produit des résultats peu fiables lorsque les structures cellulaires sont difficiles à distinguer (Figure 7D).
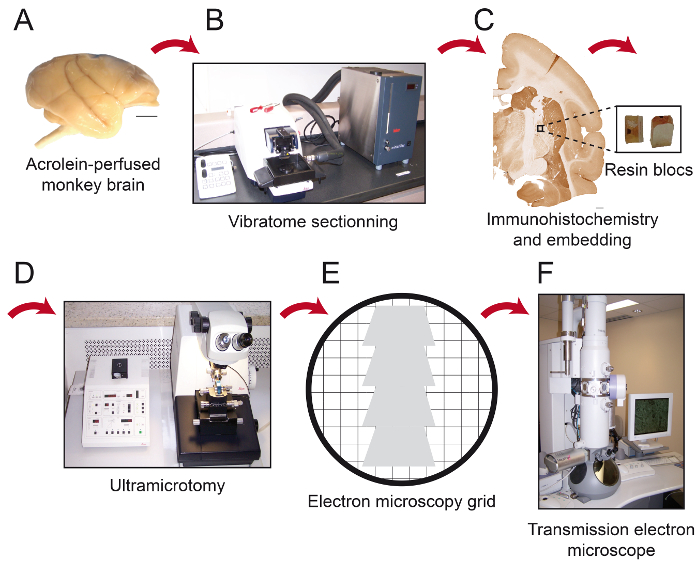
Figure 1: Schéma de étapes essentielles du Protocole. Le cerveau de singe (A) est coupée en des sections en série avec un vibratome de refroidissement (B). Il est ensuite traité pour l' immunohistochimie pré-enrobage et la microscopie électronique, après quoi la région d'intérêt est placé sur l'extrémité d'un bloc de résine (C) et découpé en 80 nm d' épaisseur sections avec un ultramicrotome (D). Des coupes ultrafines sont ensuite recueillies sur 150 nus des grilles de cuivre de maille ou des grilles de nickel formvar-revêtu (E), colorées avec du citrate de plomb et prêt à être observé au microscope électronique à transmission (F). Barres d'échelle: 1 mm. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 2: Primat tissu cérébral bien conservés après-PFA Acroléine transcardiaque Perfusion. Les micrographies électroniques de tissu cérébral singe écureuil (Saimiri sciureus) du GPi (A) et GPe (B) présentant un matériau bien conservés représentant après avoir effectué la perfusion transcardiaque acroléine PFA et la technique immunoperoxydase-diaminobenzidine. Leurgaine Yelin des axones (A) est relativement intacte (voir Arrowhead A), et l'ultrastructure générale est bien conservée dans A et B. profils dendritiques (d), des petits axones non myélinisés (a), et varicosités axonales (AV) peut facilement être identifiés. Un exemple d'un varicosités axonale établir un contact synaptique symétrique (entre les flèches) avec un profil dendritique (d) est représentée sur B. Barre d'échelle: 1 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
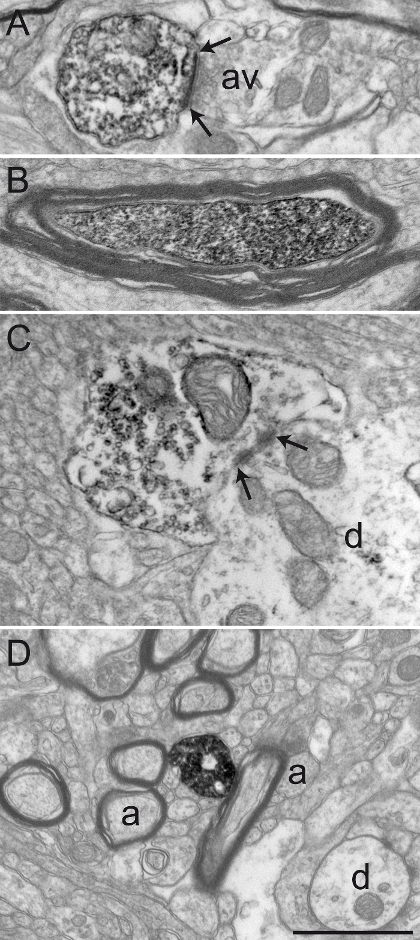
Figure 3: Sections de singe écureuil GPe et GPi immunomarquées de choline acétyltransférase (ChAT), Transporter serotonine (SERT), et tyrosine hydroxylase (TH) en utilisant la technique immunoperoxydase-diaminobenzidine. immunoéléments marqués peuvent être facilement identifiés par leur cytoplasme ou axoplasme rempli de précipité DAB dense aux électrons. Profils dendritiques marquées sont reconnus par les microfilaments remplis, comme on le voit en A, où une dendrite de ChAT-immunocoloration dans le GPi reçoit un contact synaptique (entre les flèches) à partir d' un varicosités (av) de l' axone non marqué. La micrographie électronique en B représente un axone myélinisées dans le GPe avec une gaine de myéline relativement intact dont axoplasme est immuno - TH. L'exemple C montre un varicosités axonale dans le GPi immunomarquées pour SERT et est vu d'établir un contact synaptique symétrique (entre les flèches) avec une dendrite (d). Dans cet exemple, les lignes de précipiter DAB la membrane plasmatique et la surface extérieure des organites (mitochondries et les vésicules synaptiques). Le varicosités axonale représenté sur D a été observée dans le GPe et immunomarquées pour TH et représente un exemple de DAB précipité remplissant entièrement le axoplasm, avec des vésicules synaptiques étant visible mais plus difficile à délimiter. Les éléments du microenvironnement peuvent facilement être identifiés, comme en témoigne axones myélinisés et amyéliniques (a) et dendrites occasionnels (d) entourant l'axone marqué varicosités. Les micrographies électroniques sont modifiées de 25, 26, 27. Barre d'échelle: 1 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
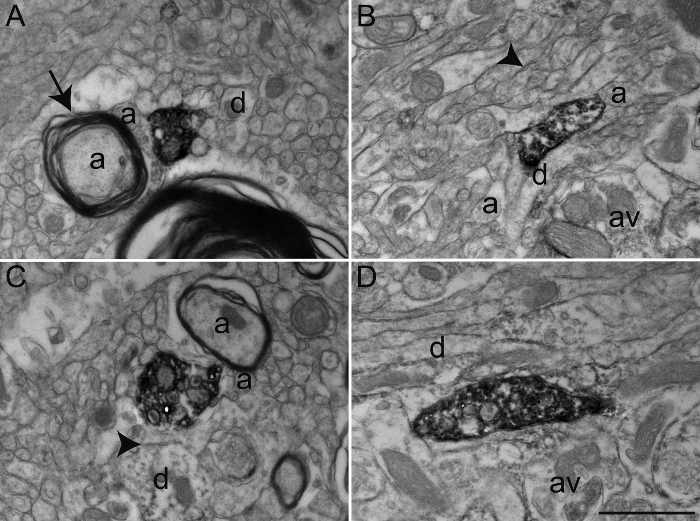
Figure 4: Exemples de tissu Primat du cerveau après Glutaraldehyde-PFA transcardiaque Perfusion. Représentatifs micrographies électroniques de macaque (Macaca fascicularis) de tissu cérébral de GPE (A) et Gpi (BD) après performiLa perfusion de ng avec 0,2% de glutaraldéhyde mélangé avec 4% de PFA et technique immunoperoxydase-diaminobenzidine avec un anticorps dirigé contre le transporteur de la serotonine (SERT). Comme dans la figure 2, immunomarquées éléments peuvent être identifiés par leur cytoplasme et axoplasme rempli de précipité DAB dense aux électrons. Ultrastructure générale est relativement intacte et les éléments du microenvironnement peut facilement être identifié, comme le montrent les axones myélinisés et non myélinisés (a) et dendrites occasionnels (d) et varicosités axonales (AV) entourant les varicosités axonales marqués, comme décrit sur la figure 2. Toutefois, notez l'incohérence de la qualité de ultrastructure, notée membranes plasmiques bien définies (flèches), mais la gaine de myéline relativement endommagée (flèche). Barre d'échelle: 1 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5: Exemples de Primat tissu cérébral obtenu à la suite d' un Unsuccessful transcardiaque Perfusion. Les résultats d'une fixation chimique infructueux sont présentés ici chez le singe écureuil GPi (A - B) et GPe (C - D) transcardiaque perfusé avec 0,9% de solution de rinçage NaCl et un mélange de glace 4% de PFA et 15% d' acide picrique dilué dans 0,1 M de PB (pH 7,4). Les cerveaux ont été post-fixes 1 h à 4 ° C dans 4% de PFA et 30% de saccharose et découpés en coupes sagittales 60 um d'épaisseur avec un vibratome refroidissement. Inappropriée du tissu cérébral fixe peut être reconnue par une gaine de myéline endommagée (A et B, des pointes de flèches), ainsi que par des membranes plasmatiques floues ou non définies (C et D, voir les pointes de flèche pour des exemples). Différents éléments neuronaux sont difficile à identifier, ce qui rend toute interprétation des ultrastructure peu fiables. Barre d'échelle: 1 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.

Figure 6: Exemples de ChAT non spécifique immunomarquage chez le singe écureuil GPe. La coloration de fond ou immunomarquage non spécifique apparaît parfois sous l'EM que la coloration partielle de grands éléments cellulaires, comme illustré sur A - B (têtes de flèches). Une telle coloration non spécifique apparaît plus souvent à la surface des examen immunohistochimique. D'autres exemples d'immunomarquage non spécifiques comprennent l'observation fréquente de très petits éléments évoquant petits axones non myélinisés partiellement ou complètement remplis de DAB et situés très proches l'un deutre, comme le montre par des flèches en C et D. Barre d'échelle: 1 um. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
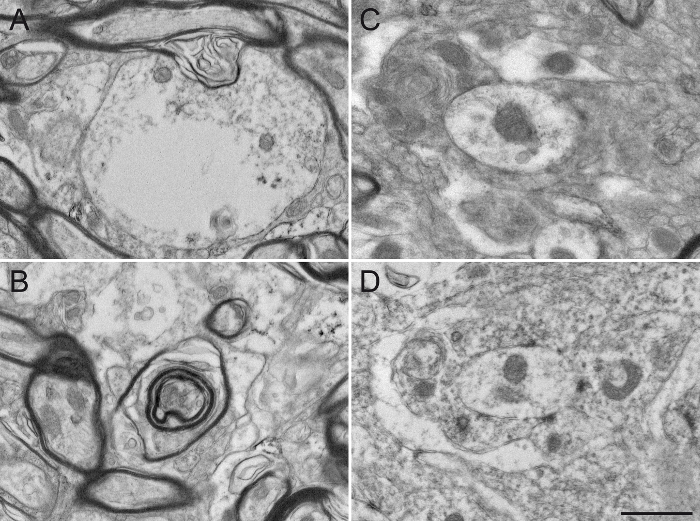
Figure 7: Singe écureuil endommagé GPe tissu après en faux pas Préparation d'échantillons pour la microscopie électronique. L'utilisation d' un détergent, tel que Triton X-100, dans la solution de blocage, même à une faible concentration de 0,02%, modifie sensiblement l'intégrité de l'ultrastructure en endommageant le cytoplasme des dendrites (A) ou la gaine de myéline des axones (B ). Les différents éléments neuronaux sont également difficiles à distinguer les unes des autres (C), étant donné que les membranes plasmatiques sont endommagés et difficile à définir. Le processus de osmification est also une étape importante dans la préparation des échantillons. L'utilisation de chlorure de sodium dans les solutions de rinçage (D) modifie la fixation du tissu, ce qui rend difficile une analyse ultérieure. Barre d'échelle: 800 nm. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Dans cet article, nous présentons un protocole fiable pour la perfusion transcardiaque des primates non humains et immunohistochimie pré-enrobage approprié pour l'examen de l'échantillon EM. Bien que typique cryo-EM, comme CEMOVIS, fournit une bonne conservation des ultrastructure du cerveau, elle limite également l'utilisation de 12 immunohistochimie. D' autres techniques, y compris cryo-substitution et technique Tokuyaso, permettent immunohistochimie post-intégration, mais ces techniques sont coûteuses en raison de dispositifs supplémentaires nécessaires au cours du processus et peut prendre beaucoup de temps et de compétences difficiles 12, 14, 15. En outre, afin d'utiliser efficacement la méthode cryo-fixation, l'échantillon doit être relativement faible (jusqu'à 200 um d'épaisseur lors de l' utilisation de congélation à haute pression 28 et 10 pm à la pression atmosphérique 29). Idéalement, pour obtenir un bonrésultats avec cryo-fixation du tissu cérébral des primates, l'échantillon doit être prélevé sur une biopsie, ce qui provoque des problèmes pour trouver l'emplacement exact de la région d'intérêt. Ce problème doit être contournée en utilisant les coordonnées stéréotaxiques. La fixation chimique avec acroléine et technique de pré-enrobage proposé ci-dessus fournit une méthode simple, peu coûteuse, de temps efficace et fiable pour la préparation d'échantillons de tissu cérébral des primates et immunomarquage pour EM. En suivant ces étapes, on obtiendra un ultrastructure bien conservé avec antigénicité pour permettre l'immunomarquage de la plupart des protéines. Cependant, la fixation chimique pour EM a aussi ses inconvénients. Tout d'abord, alors que des solutions fixateurs telles que acroléine conservent les détails morphologiques du tissu cérébral, il est possible que certains changements morphologiques se produisent au cours du processus de fixation chimique et de modifier les résultats par rapport à ceux qui seraient obtenus avec CEMOVIS ou techniques cryo-substitution. En second lieu, le processus de fixation etdéshydratation ultérieure nécessaire pour résine enrobage éliminer la plupart des fluides extracellulaires et presser ensemble les composants cellulaires, provoquant le retrait du tissu qui modifie de manière significative leur taille et la forme par rapport à des cellules cryo-fixe 21, 30. Néanmoins, la fixation de l' aldéhyde a été utilisé avec succès dans de nombreux laboratoires à travers le monde et est largement accepté dans la littérature comme une méthode fiable pour étudier les caractéristiques ultrastructurales des neurones et des cellules gliales, malgré les préoccupations déjà mentionnées 21, 30, 31, 32.
Par comparaison avec le procédé décrit ci - dessus, l'immunohistochimie postembedding qui est nécessaire pour les échantillons fixe cryo-noyées dans une résine de méthacrylate, est moins sensible et la détection des antigènes du système nerveux central est limitée 14 >, 33. Cependant, la fixation de l'aldéhyde a aussi ses limites en ce qui concerne antigénicité. Par conséquent, il est important de tester la spécificité des anticorps pour un protocole de fixation chimique donnée au niveau LM avant de commencer la préparation EM. La qualité de l'immunohistochimie sur les tissus du cerveau fixe acroléine dépend aussi de la rupture des liens précédemment aldéhydes forts créés par la fixation chimique. Cette étape peut être réalisée par incubation des sections avant immunohistochimie avec du borohydrure de sodium (voir les étapes 3.3 à 3.5). Omettre cette étape entraînerait certainement dans immunomarquage suboptimale 34. Si les anticorps à utiliser ne donnent pas de coloration optimale sur les sections du cerveau fixe avec l'acroléine, il est possible d'utiliser alternativement glutaraldehyde (0,1 - 2%) dilué dans 4% PFA. Cela a été prouvé à bien préserver ultrastructure du cerveau tout en maintenant suffisamment antigénicité pour de nombreux anticorps et de fournir le tissu cérébraladapté pour le stockage à long terme avec des modifications minimes 20, 21, 35, 36, 37. Il est également possible d'obtenir relativement bonne fixation et antigénicité seul approprié pour EM avec PFA en élevant considérablement le pH de la solution, mais une combinaison de plus d'un fixatif pendant la perfusion a fourni de meilleurs résultats 34, et les études soutiennent seul que la fixation PFA généralement produire des tissus mal conservés pour examen EM 38, 39. Cependant, dans certains cas rares, antigénicité est très difficile à maintenir, et la fixation PFA seul reste la seule option viable pour examen EM.
De nombreuses étapes de ce protocole doivent être soigneusement suivies afin d'obtenir les résultats optimaux. Par exemple, la préparation de la solution PFA 4%doit être effectuée à des températures supérieures à 45 ° C afin de permettre à la poudre PFA pour dissoudre, mais il est impératif que la température reste inférieure à 60 ° C. Sinon, la solution PFA dépolymérise en formaldéhyde et l' acide formique, qui fixe le tissu différente et forme une solution acide qui pourrait altérer de manière significative la qualité des tissus 40, 41. De plus, il est essentiel que les étapes de perfusion effectuées rapidement une fois que le diaphragme a été coupé, puisque l' hypoxie et hypercapnie produiront des changements physiologiques irréversibles au cerveau qui pourrait modifier la qualité et l' intégrité du tissu 31. fixation défectueuse pourrait être préjudiciable à la préservation du tissu cérébral et modifier de façon permanente l'ultrastructure du tissu, tels que les membranes plasmiques, les mitochondries et les synapses. Ainsi, la préparation de la solution et les étapes de perfusion doivent être effectués avec soin. EM échantillon avec succès préparation dépend aussi fortement sur une bonne post-fixation dans tétroxyde d'osmium. En effet, la perfusion directe avec le tétroxyde d'osmium a été décrit comme produisant des tissus raisonnablement intact pour l' observation de EM 21, 39. Cependant, de nombreuses différences en termes de quantité de l'espace extracellulaire et l'apparition de la membrane plasmique entre les animaux perfusé osmium et perfusé aldéhyde ont été remarqués. En outre, le noircissement et le durcissement des tissus après perfusion de l' osmium ont rendu le retrait du cerveau du crâne, la dissection ultérieure, et la différenciation entre la matière blanche et grise plus difficile, ce qui favorise la perfusion aldéhyde pour une meilleure conservation des tissus et une manipulation plus aisée 21. fixation Aldéhyde apparaît seul pour réduire l'espace extracellulaire, qui altère l'intégrité du tissu et donne l'impression des jonctions serrées où doit être vu l'espace extracellulaire, manquant ainsi de montrerDes micrographies électroniques acceptables même après coloration citrate de plomb 42. Cependant, postfixation dans du tétroxyde d'osmium a inversé cette situation en permettant une séparation plus nette entre les éléments de tissu, qui est nécessaire pour leur identification 42, justifiant ainsi clairement l'importance de la mise en oeuvre des étapes de osmification (étapes 4.1 à 4.2) avec précaution.
Les conditions et les concentrations dans lesquelles ces mesures sont mises en ont été testées dans notre laboratoire, en particulier pour immunohistochimie pré-enrobage en utilisant DAB comme précipité sur des coupes de cerveau de primate. Bien que les compétences difficiles, double-immunohistochimie est possible grâce à l' immunohistochimie post-intégration avec des particules d' or 43. La technique électronique dense DAB précipité obtenu après la immunoperoxydase-diaminobenzidine proposé ici est très facile d'identifier au niveau EM, car il décrit des membranes plasmiques et surer les surfaces des organelles, tout en permettant encore l'identification des composants sous-cellulaires, tels que les mitochondries et les contacts synaptiques. De plus, une fois que la présente technique est maîtrisée pour immunohistochimie unique, il est possible d'effectuer deux immunohistochimie en combinant précipité DAB à des particules d'or, qui sont plus facilement discernables les uns des autres que les particules d'or de différentes tailles. Nous recommandons de faire des tests rigoureux de la spécificité des anticorps, des concentrations d'osmium, et le temps d'incubation et de la température avant de traiter les sections du cerveau pour EM. Les protocoles de pré-intégration et double immunohistochimie pour EM ont été publiés et peuvent être adaptés pour les tissus du cerveau des primates 16.
En conclusion, le protocole de perfusion transcardiaque pour les primates non humains présentés ci-dessus permet le stockage à long terme des sections du cerveau qui peut ensuite être utilisé pour immunohistochimie pré-enrobage EM. sections obtenus sont également appropriés pour les études neuroanatomiques au niveau LM. Par conséquent, en utilisant un protocole qui convient à la fois EM et LM, il est possible de réduire le nombre d'animaux utilisés, un examen rentable et éthique. Il permet également une comparaison directe entre les résultats obtenus au niveau LM et EM sur le même animal et permet l'utilisation de la lumière et corrélative des études au microscope électronique (CLEM). CLEM études ont surtout mis l' accent sur l'utilisation de souris transgéniques exprimant des protéines fluorescentes, telles que la EGFP, ce qui pourrait ensuite être marqués avec un précipité dense aux électrons et observées au niveau EM 44. En variante, pour contourner le problème de l' immunohistochimie, cryo-fixation peut être combiné avec une injection intraneuronale de marqueurs opaques aux électrons, tels que des points quantiques, 45 avant la congélation, ce qui permet la visualisation au niveau de l' EM 46. Cependant, les points quantiques ne sont pas biocompatible, etleur utilisation est coûteuse et prend du temps en raison de l'appareil de congélation supplémentaire nécessaire pour la préparation ultérieure des tissus. Bien que ces techniques favorisent encore cryo-fixation et le gel de substitution des méthodes, il y a des développements pour l'utilisation de balises chimiques sur les sections semi-minces (300 nm) pour étiqueter différentes protéines cellulaires avec des fluorophores synthétiques, qui peuvent être corrélées avec l' analyse EM 47 . Les techniques permettant, par exemple, la corrélation entre une localisation spécifique des axones en utilisant la fluorescence et de sa relation synaptique avec les neurones d'une structure cible donnée en utilisant EM, sont assez prometteurs pour la compréhension de l'organisation du système nerveux, en particulier chez les primates. Dans ce cas, la fixation de l'acroléine devrait être favorisée par rapport à glutaraldehyde, comme celui-ci produira autofluorescence qui pourrait modifier la visualisation correcte des structures du cerveau au niveau de LM. Cependant, très peu d'études de ce type ont été réalisées chez les primates, mostly en raison de problèmes techniques et le coût élevé que ces expériences imposent. Ainsi, de nouveaux développements sont nécessaires pour des études réussies et CLEM faible coût chez les primates, tels que l'amélioration des méthodes de fixation ou en utilisant les balises chimiques visibles tant au niveau LM et EM.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Cette étude a été soutenue par le Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG, 401848-2011 à MP). Le député a reçu une bourse de carrière du Fonds de recherche du Québec-Santé (FRQ-S). LE a été le récipiendaire d'une bourse de doctorat des FRQ-S (FRQ-S 14D 29441). Nous remercions Marie-Josée Wallman d'assistance technique.
matériels
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
Références
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon