Method Article
非人类灵长类动物脑组织的制备预嵌入免疫组化和电子显微镜
摘要
在这里,我们提供了一种简单,低成本,和时间高效的协议进行化学固定与丙烯醛固定液灵长类脑组织,从而允许长期保存,其与预嵌入-免疫组化透射电子显微镜兼容。
摘要
尽管在光学显微镜级别的所有技术的进步,电子显微镜仍然是神经科学的唯一工具来检查和鉴定神经元,如突触联系的超微结构和形态的细节。脑组织的保存好电子显微镜可以通过严格的冷冻固定的方法来获得,但这些技术是相当昂贵和限制使用免疫标记,这关键是要了解确定的神经系统的连通性。冷冻替代方法已经被开发,使冷冻固定的与免疫标记的组合。然而,这些方式方法的重现性通常依赖于昂贵的冷冻设备。此外,获得可靠的结果,这种技术是非常耗时和技能挑战。因此,传统的化学固定脑,特别是丙烯醛的固定剂,仍是电子结合了时间效率和低成本的方法显微镜用免疫组化。在这里,我们提供使用化学丙烯醛固定,导致灵长类动物脑组织的保存,并与嵌入前免疫电镜和透射电镜检查相适应的可靠的实验方案。
引言
光镜,包括共焦和双光子显微镜,已被证明是用于体内神经元过程研究,除其他事项外1,2的有效工具。虽然在光镜(LM)级的典型的空间分辨率约为200nm时,使用不同的光源,如极紫外和软X射线显微术最近的技术进步,已经此分辨率显着增加至近10纳米的空间分辨率3 ,4,5。在其他成像技术的进步包括结合组织学磁共振成像和用于测量体内髓鞘,只在6电子显微镜(EM)的水平,7是传统上可测量的参数的厚度提供一种新颖的方法。 AlthouGH这些进步在LM水平用于研究活的过程,结构的详细视图和表征,如突触联系提供一个极好的工具,只能与EM,它提供的分辨率,可以达到0.5nm的来实现。然而,观察在EM级要求的标本是死的,并改变在某些方面,化学固定剂和脱水过程中,为了保持细胞结构。因此,在高分辨率检验的生物样品可以是具有挑战性由于从电子束辐射损伤,对比度低,膜的结构偏差,或可能出现以下脱水和环氧树脂包埋8,9,10的伪像甚至存在。
在用于结构分析它们的天然形式保存标本可以通过使用"EM冷冻玻化部分的"或CEMOVIS,一个切片的方法来实现该涉及快速冷冻和嵌入在玻璃体冰样品和在低温下11,12检查EM下的部分。这一程序可以检测样本的检验,而他们仍然坚实,充分水化,从而消除由于脱水处理的工件13。然而,该方法涉及为低温超薄切片额外的设备,以及在标准EM附加的设备,以允许该观察在非常低的温度,这产生显著额外的成本。此外,CEMOVIS方法排除了使用免疫标记技术中,由于抗体通常具有在RT下温育的。可替代地,有可能通过使用冷冻替代方法中,在此期间,而在低温保护化学品和浸入第是低温固定试样缓慢解冻与免疫组织化学程序超微结构分析结合恩嵌入专用树脂,如Lowicryls。后嵌入免疫标记然后可以在这样的材料12进行。然而,冷冻取代和冷冻固定技术是耗时的。它们需要额外的设备的安装,但是仍然需要样品被暴露于有机溶剂和化学固定剂可改变细胞结构,尽管使用一个低温14,15。因此,尽管两者在LM和EM水平,脑组织的化学固定,特别是丙烯醛的所有技术的进步,仍然是一个低成本的和时间有效的方法来免疫组织化学EM 16结合起来。
在过去的几十年,进行了许多尝试,发现提供最佳的组织保存醛的混合物。 20世纪60年代之前,这给了可接受的结果为EM的唯一化学固定是四氧化锇。然而,四氧化锇是剧毒和昂贵的,通过血管系统以固定的器官如脑排除其使用。丙烯醛在50年代后期推出了作为适用于蜂窝结构17的EM观察动物组织保存的可靠方法。它更深入地穿透组织并且比通过浸渍用于固定时,并且允许细胞质成分的良好的保存,与组织17的最小的收缩其它醛反应更迅速。在新鲜组织使用时,通过使活分子化合物,如酶和其它蛋白质18的更精确的定位,这种特征给丙烯醛固定比其它醛明显的优势。事实上,它已经经过多年用于可视化在许多物种,包括两栖类和啮齿类动物的EM水平固定的一种简单,高效,低成本的方法验证,因为它有效地stabiliZES肽和蛋白质,保留抗原性,并与另一种醛组合使用固定剂16,18,19,20,21时提供了相对完整超微结构。用于在啮齿动物丙烯醛固定协议已自然后被标准化并且广泛地使用,特别是由皮克尔组,以实现双重免疫标记为EM 16,22。几组在非人类灵长类动物的大脑组织23已经使用丙烯醛固定。然而,据我们所知,有效率地描述了在非人类的灵长类丙烯醛是与EM免疫标记24兼容的化学固定只有一个出版协议。
在本文中,我们提供了一种简单而可靠的方法以有效地化学修复非哼声一个灵长类动物大脑中的丙烯醛,允许预先埋设 - 免疫标记和传输EM检查沿着一个潜在的长期保存。
研究方案
伦理声明:所有涉及动物的协议是由科米特去保护DES ANIMAUX DE L'拉瓦尔大学批准,并按照加拿大动物保护协会的指南实验动物的护理和使用(编2)被做了。这里所述的方案对于大约800克成年动物优化。固定的量应根据动物的大小进行调整。
1.一种用于Transcardiac灌注溶液的制备
- 根据以下步骤制备1升50mM的磷酸钠的磷酸盐缓冲盐水(PBS)溶液。灌注之前制备至多24小时的溶液,并保持在4℃直至使用。
- 测量800毫升蒸馏水在1升烧杯中。添加5.87克磷酸氢钙无水的钠(Na 2 HPO 4)中加入1.20g磷酸二氢钠一水合物的(的NaH 2 PO 4·H 2 O),和9g的氯化钠(NaCl)。搅拌溶解。
- 通过逐渐加入5 N氢氧化钠调节pH至7.4。添加蒸馏水达到100 L的总体积
注意:将NaOH是腐蚀性化学化合物。穿相应的个人防护设备(PPE;实验室外套,手套,护目镜等 )。
- 制备2升根据下面的步骤4%低聚甲醛(PFA)的。该解决方案应准备手术前至多24个小时,并保持在4℃直至使用。
- 测量1.5升的蒸馏水中的2升烧杯中。添加23.48克二元无水磷酸的钠(Na 2 HPO 4)和4.80克磷酸二氢钠一水合物的(的NaH 2 PO 4·H 2 O)。搅拌溶解。添加蒸馏水达到200 L的总体积
- 55℃ - 直至温度达到约45加热排气罩下的溶液中。不要加热到60℃以上。
- 逐渐80克PFA的添加到该溶液中并搅拌直到完全溶解(约30 - 60分钟)。保持监测温度以保持其在60℃以下。
注意:PFA处于其粉末形式高挥发性。这是如果有剧毒的眼睛或皮肤接触,并在吸入或食入的情况下危险。穿PPE和排气罩下谨慎使用。 - 冷却该溶液至4℃,并过滤。储存于4℃。
- 根据以下步骤在0.1M磷酸盐缓冲液(PB)制备1升3%的丙烯醛。该PB溶液应该至多24个小时灌注之前被制备。
注意:丙烯醛是如果吸入,并且能够产生直接的伤害具有高毒性。这也是腐蚀性和剧毒,如果通过皮肤吸收。它是致癌和致突变性。穿相应的PPE和通气罩下使用。- 测量800毫升蒸馏水。添加8.66克磷酸氢钙无水硫酸钠( 硫酸钠 HPO 4)和5.38克磷酸二氢钠一水合物的(的NaH 2 PO 4·H 2 O)。搅拌,直到所有的盐溶解。加蒸馏水至达到1 L.的总体积保持在4℃下该溶液中。
- 手术前,转移900毫升的PB溶液到1L的玻璃容器中,并添加30.94毫升的97%的丙烯醛溶液通气罩下。添加PB溶液达到1升,搅拌的总体积。过滤溶液,并保持它在4℃下。
2. Transcardiac灌注和脑解剖
- 在整个手术过程中保持在冰上的解决方案。 (50毫PBS)和上直到没有空气保留在软管将泵通过将管在所述第一溶液中使用制备泵。对于猕猴的transcardiac灌注,使用21号针,并设置流出在大约80毫升/分钟。
- 麻醉动物提供一个组合的一个肌内注射氯胺酮(20毫克/千克),甲苯噻嗪(4毫克/千克),并乙酰丙嗪(0.5毫克/千克)的真实存在。保持下异氟烷(3%)镇静动物。
- 附上动物的四肢通风表。
- 用手术刀,去除皮肤到腋窝。切开腹部肌肉。使用重型手术剪刀小心地避免重要器官横向切割的肋骨。
- 切手术剪隔膜,提高肋骨暴露心脏。一旦隔膜被切断,迅速地进行,因为心脏将停止分钟内跳动。
- 删除用手术刀刀片心包和针头插入左心室。用手术刀,认真做一个小切除至右心房。在72毫升/分钟快速启动泵并保持针就位。如果可能的话,倾斜的动物才能拥有它的头比心脏较低的水平。
注意:要小心,不要插入针时刺穿室间隔。- RINSe为约300毫升的PBS直到肺血是白色的,没有血液出来的右心房。
- 停泵,快速软管/管转移到3%丙烯醛的解决方案,并重新启动水泵。一旦心脏已经停止了跳动逐渐提高抽速,以80毫升/分钟。灌注约500 mL丙烯醛溶液。
- 停泵,快速软管转移到4%PFA解决方案,并重新启动水泵。该步骤需要约1升的PFA。
注:固定完成后,前肢是刚性和颈部僵硬。 - 切头,仔细解剖出脑颅骨。注意不要用手术器械损伤大脑。灌注是最佳时的脑苍白(无血液曲线)和刚性( 图1A)。
- 浸入完整的脑在4%PFA中于4℃下1个小时。
- 连续切割大脑与冷却振动切片机(4℃)在所期望的平面成50个微米厚的切片并收集它们在PBS(0.1M)( 图1B)。
注意:此步骤可以以多种方式根据期望的协议来进行。半球可以事先分开,以振动切片机切割,或保持整体。如果大脑的振动切片机平台太大,它可以被切割成更小的块。此步骤之后,部分可被存储的时间在-30℃下在由40%的PB(50毫摩尔),30%甘油和30%乙二醇的防冻液长的时间。
3.预嵌入免疫组织化学(图1C)
- 准备如下的Tris缓冲盐水的4升储备溶液(TBS,50mM的,pH值7.6)。
- 测量2L蒸馏水在一个4升烧杯中,加入24.23克三羟甲氨基甲烷的(THAM; C 4 H 11 NO 3),并搅拌至溶解。
- 调节pH至7.6用约148毫升的1N HCl。酸应该CAUTI被添加上避免达到低于7.6的pH值。的总体积应为4 L.
注意:盐酸是高度腐蚀性的。穿戴合适的个人防护装备。
- 含有感兴趣的区域选择部(来自步骤2.11),以用于免疫组织化学EM被处理。
- 在室温洗PBS自由浮动部3X(0.1M,pH 7.4)中5分钟以冲洗防冻溶液。
- 制备的NaBH 4 0.5%溶液在PBS中稀释。
- 权衡0.05克的NaBH 4和稀释在10mL PBS中。不包括。使用前准备这个解决方案。
- 在孵育在室温30分钟的新鲜制备的NaBH 4溶液中的部分。轻轻摇动。不包括。
- 洗涤3次在PBS中持续10分钟,在室温,剧烈摇动,直到没有反应气体的保持。
- 准备EM用2%适当正常血清和PBS中稀释的0.5%冷的鱼明胶封闭溶液。
注:量建议立即进行删除D IN为了计算有足够的用于以下三个步骤。使用从托管的二级抗体的同种动物做了血清。避免使用的抗原修复方法或添加少量的Triton(增加抗体的穿透),因为这些方法显著损害组织的质量。 - 在孵育在室温下1个小时的封闭溶液的章节。轻轻摇动。
- 准备在封闭溶液稀释的初级抗体溶液。
注意:第一抗体的浓度通常是相同LM免疫组织化学,但考虑与不同的抗体浓度进行测试预先,因为一些初级抗体可能不与丙烯醛工作。如果是这样,可以使用戊二醛的混合物(0.1 - 2%)和4%PFA中transcardiac灌注并获得类似的结果。优化培养时间,培养温度为好。 - 孵育在初级抗体溶液中的部分隔夜在室温下用温和的摇摆。使用之前测试的孵育时间和温度。
- 洗部3X的PBS在RT 5分钟轻微摇动。
- 制备1:在封闭溶液稀释生物素化的第二抗体的溶液1000。
注:第二抗体必须针对用于产生第一抗体的宿主物种得到提升。 - 孵育在第二抗体溶液中的部分在RT下1.5小时。轻轻摇动。
- 制备二级抗体孵育结束之前至少60分钟的抗生物素蛋白 - 生物素 - 过氧化物酶(ABC)溶液。
- 使用校准的移液管来测量8.80μL/ mL的溶液A和B的和稀它们在PBS中。
- 温和摇动在室温至少60分钟,以允许完全的抗生物素蛋白和生物素分子之间的结合。
- 在次级抗体溶液孵育后,洗涤3次在PBS中在RT下10分钟。
- 孵育节在ABC这样lution在RT 1个小时。轻轻摇动。
- 在TBS中洗一次在PBS中和两次在室温10分钟,轻轻摇动。
- 制备0.05%3,3'-二氨基联苯胺(DAB)的用0.005%H 2 O 2的TBS稀释新鲜溶液。
- 称取12.5毫克DAB的和稀释在25mL冷的TBS。避光。
注意:如果吸入民建联粉挥发性高,有害的。它是致癌和致畸。因此,当稀释时怀孕或哺乳妇女不宜操作这个产品,甚至。操作时,请使用N95口罩和穿PPE。 - 过滤溶液,并在即将使用前添加30%H 2 O 2 4.5μL。
- 称取12.5毫克DAB的和稀释在25mL冷的TBS。避光。
- 在孵育在室温下将DAB溶液3-7分钟的部分。轻轻摇动。
注:棕色沉淀不应该为了避免背景染色高水平太暗。培养时间应相应优化。 - 通过快速洗涤两次停止反应在寒冷的TBS,然后两次在RT冷TBS 10分钟,接着在PB为两次10分钟,用温和的摇动。
注意:使用PB(而不是PBS)的是为了消除的NaCl任何痕迹,因为它会与锇和形成晶体的反应是至关重要的。
4. Osmification和嵌入的电镜观察
- 制备1%的四氧化锇在PB稀释的溶液(OSO 4)。避光。
注意:锇是剧毒,不得与皮肤,眼睛或口腔接触,并且不应该被吸入。如果误食可导致死亡。它应该只在一个排气罩,并用适当的PPE使用。 - 孵育在所述排气罩(不搅拌)下在室温下30分钟的OsO 4溶液中的部分,并覆盖它们用铝箔以保护它们免受光。完全平坦化段之前将所述的OsO 4溶液。
注:部分变得非常黑暗和RIGID,应小心下面这个步骤进行操作。 - 在osmification期间准备憎水环氧树脂。
- 添加环氧树脂混合物(20克环氧树脂,20g的硬化剂,0.6g的加速器和0.4g增塑剂)的各成分的合适的量为大塑料杯中。用木棒或塑料移液管搅拌,直到获得均匀的棕色。
注:这是利用各组分的准确比例的关键。 - 转移等量至适当大小的铝杯,根据段的数量以进行处理。让它休息。
- 添加环氧树脂混合物(20克环氧树脂,20g的硬化剂,0.6g的加速器和0.4g增塑剂)的各成分的合适的量为大塑料杯中。用木棒或塑料移液管搅拌,直到获得均匀的棕色。
- 洗osmificated切片在PB 3倍,在室温10分钟以低速摇摆。
- 脱水在以下系列梯度的乙醇的部分为每次2分钟:2次,35%的乙醇;每个在50,70,80,90,和95%乙醇1周时间;和3X在100%乙醇。
- 转移部分到玻璃瓶完成dehydrati上通过孵育切片3次,在环氧丙烷2分钟的过程。
注意:环氧丙烷是高挥发性和毒性有机溶剂。它可引起接触的情况下,或者如果吸入或摄入眼睛或皮肤造成严重损害。它已被列为2级致癌物质。它应该只在一个排气罩和与PPE一起使用。这也是高度易燃,应远离任何热源。
注意:在这个步骤之前,部分应仔细在玻璃小瓶中转移,因为氧化丙烯是有机溶剂,并与塑料不相容。在这一点上,部分是很脆弱的,应小心进行操作。部分可以可选地转移至步骤4.5之前玻璃小瓶中。 - 小心转移部分,一个接一个,在铝杯和避免与空气尽可能接触。平嵌入先前混合防水性环氧树脂的部分和VENTIN下过夜孵育他们在RT克罩。
注:在此步骤中,部分是完全脱水和非常脆弱,应小心进行操作。 - 使用矿物油,制备润滑脂涂覆的玻璃载片与脂塑料盖玻片一起。
- 至多在60℃温育铝杯12-15分钟软化树脂。小心弄平在载玻片的脂侧的部分。放置润滑盖玻片小心推出任何残留的空气。
- 孵育载玻片在60℃下48小时。
注:不超过48小时的培养时间,因为树脂将变得太硬,这一点至关重要。 - 除去塑料盖玻片。
5.样品制备超薄切片和观察用透射电子显微镜
- 用望远镜找到感兴趣的区域,并切一小四片约1mm 2用手术刀。
- 文件的树脂块的前端与胶曲adrangular片在其上( 图1C)。让胶水干燥至少1小时之前或切片过夜。
- 使用超薄切片机,切四边形片成80微米厚的切片( 图1D)。
- 代替树脂块在垂直位置超薄切片甲板和,用锋利的剃刀刀片,逐渐切断树脂块的每一侧,以形成具有光滑侧面的梯形。
- 把甲板在其水平位置和旋转,直到梯形的最长边朝下的块。
- 使用金刚石修整工具或玻璃刀的四边形片的表面修整。设置超薄切割300个微米厚的切片以1毫米/秒。调整刀能够上下平行四边形片并显示大约1°非常小的水平角度。
注意:该角度将允许用户以接近组织几乎平行于B的表面锁定,其中免疫标记元素更容易被发现。当使用这些参数与金刚石修整工具,该树脂显示有光泽的白色。当组织被切断,它将变为紫色或绿色的颜色。 - 使用配备有装有蒸馏水船切为80μm厚的切片的超45°的金刚石刀,通过使在它们用一块吸收二甲苯放倒纸的平滑部分,并且收集上涂布聚乙烯醇缩甲醛 - 镍槽栅格或连续切片裸150个目铜网上( 图1E)。
- 将网格的网格储物盒。
- 染色柠檬酸铅的网格。
- 使用5毫升的注射器和一个0.2微米的针筒式过滤器,以制备1:过滤柠檬酸铅储备溶液1溶液并过滤蒸馏水。避光保存它。
注:柠檬酸铅的储备液应新鲜每月以避免固体depos形成它的。请参阅库存配方中的材料数据表。此外,如果多个系列电网需要进行染色,当它变成乳白色改变稀释液。 - 每个网格放置到稀释的溶液的液滴,在与溶液接触的部分。孵育3分钟。
- 用小镊子举行的网格,并彻底冲洗含蒸馏水两个烧杯。
- 轻轻地用吸油纸去除多余的水。存储网格的网格框。等待检查由透射电子显微镜的截面前30分钟(TEM; 图1F)。
- 使用5毫升的注射器和一个0.2微米的针筒式过滤器,以制备1:过滤柠檬酸铅储备溶液1溶液并过滤蒸馏水。避光保存它。
结果
在本节中,我们提出获得,继观察,在发送EM水平,进行免疫染色的灵长类动物的脑组织化学固定用3%丙烯醛的混合物和4%PFA的代表性结果。我们所取得的超微结构的良好保存,由相对完整髓鞘和双膜( 图2A)的可视整齐所示。突触联系,从微环境的神经元元件,均可以很容易被识别( 图2B)。标记的二氨基联苯胺(DAB)免疫沉淀物的神经元元件在EM水平可以通过填充细胞质或轴浆被识别。质膜和细胞器的外表面也通常衬有电子致密沉淀物( 图3)。
在这个特殊的实验中,我们使用的抗体AGAINST羟色胺转运蛋白(SERT),胆碱乙酰转移酶(ChAT的),或酪氨酸羟化酶(TH)以显现在外部(GPE)或松鼠猴苍白球( 图3)的内部(GPI)段免疫标记的神经元元件。为了做到这一点,我们使用了固定的化学物质,保留抗原性和超微结构的结合,使详细的形态学研究。尽管许多抗体可与上面描述的transcardiac灌注协议一起使用,我们建议用户执行优化浓度的测试预先,因为某些主抗体是已知的,以不提供与丙烯醛固定最佳免疫标记。可选地,当抗体不提供最佳免疫标记与丙烯醛固定,0.1的稀释液 - 2%戊二醛在4%PFA可用于transcardiac灌注。它提供组织质量相对相当于丙烯醛固定的脑组织与许多抗原性保存抗体( 图4)。
最后,我们提供以下不当操作而获得EM显微照片的典型例子。阿差固定导致改变的髓鞘( 图5A,B)和困难神经突的双膜( 图5C,D),以防止一个可靠的识别和标记和未标记的神经元元件的分析的可视化。在DAB溶液中的过度温育时间创建过量背景,并且可以潜在地产生假阳性结果的非特异性染色。背景或者非特异性染色有时会出现的神经元元件的不完全染色( 图6A,B),但更常见的为多,而且位于密切染色的神经元元件( 图6C,D)。在封闭溶液中的洗涤剂使用的显著改变了组织的质量。这可能会导致丢失细胞器在标记元件( 图7A)或髓鞘( 图7B)和细胞膜( 图7C)的降解,使该微环境困难的任何急性解释。最后,在过程osmification一个失误,例如使用含有氯化钠漂洗溶液,其中产生所述蜂窝结构是难以区分( 图7D)不可靠的结果。
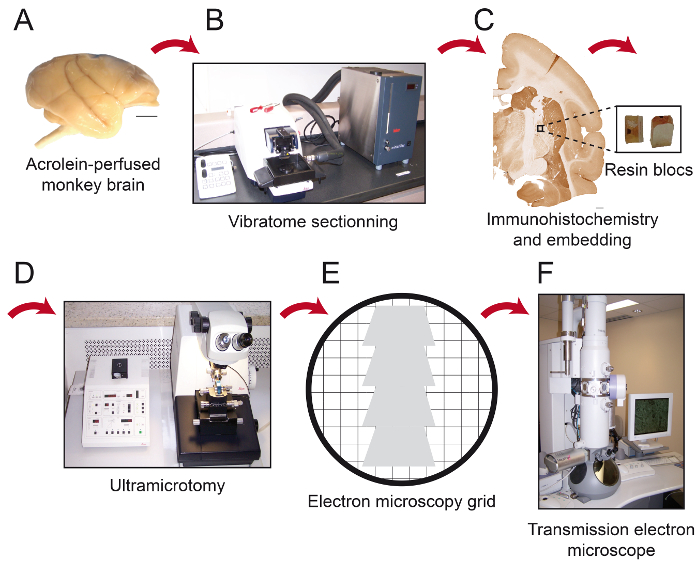
图1:该议定书的基本步骤的示意图。猴脑(A)被切割成连续切片与冷却振动切片机(B)。它然后处理嵌入前的免疫组织化学和电子显微镜,在这之后的感兴趣区域被放置在树脂块(C)的前端,并切成80纳米厚的secti组件用超微切片机(D)。超薄切片,然后在裸露的150个目铜网上或涂覆聚乙烯醇缩甲醛-镍网格(E)收集,用柠檬酸铅和准备透射型电子显微镜(F)下被观察染色。比例尺1毫米。 请点击此处查看该图的放大版本。

图2:丙烯醛PFA Transcardiac灌注后保存完好的灵长类动物脑组织。松鼠猴( 松鼠猴 )的内侧部(A)和Google Play版(B)示出了有代表性的脑组织的电子显微镜照片进行丙烯醛的PFA transcardiac灌注和免疫过氧化物酶二氨基联苯胺技术后保存完好的材料。第m轴突的(a)的叶林鞘是相对完整的(见慈姑在A)中 ,和一般的超微结构保存完好A和B中的树突状剖面(d)中,小的无髓鞘的轴突的(a),和轴突膨体(AV)可以很容易地识别。轴突静脉曲张建立对称突触接触(箭头之间)具有树枝状轮廓(D)的例子示于B中 。比例尺:1μm以下。 请点击此处查看该图的放大版本。
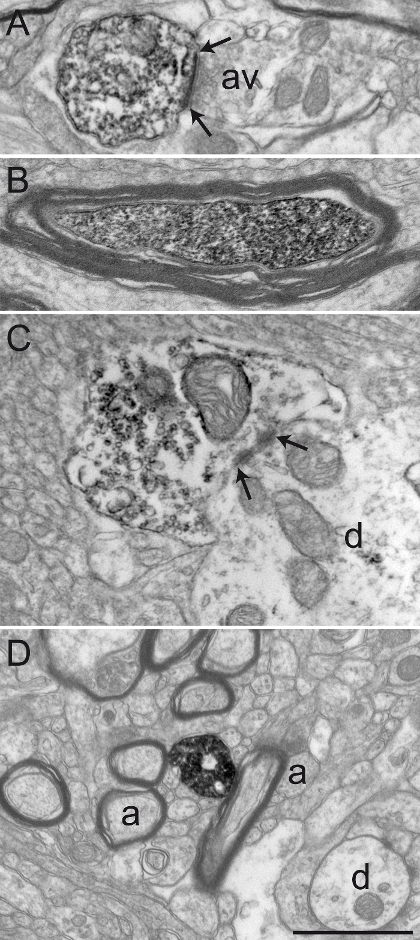
图3:通过使用免疫过氧化物酶-二氨基联苯胺技术从松鼠猴Google Play版和GPI免疫标记为胆碱乙酰转移酶(聊天),羟色胺转运蛋白(SERT)和酪氨酸羟化酶(TH)的部分。免疫标记的元件可以很容易地通过它们的细胞质或轴浆填充有电子致密DAB沉淀来鉴定。标记的树突状轮廓由填充微丝识别,如在A,其中在内侧部聊天免疫染色树突接收来自未标记的轴突静脉曲张(AV)突触接触(箭头之间)观察。在B中的电子显微照片示出了在一个Google Play版髓鞘的轴突与相对完整的髓鞘其轴浆被免疫标记为TH。在C中的例子示出了在内侧部的轴突静脉曲张免疫标记为SERT和被看见建立对称突触接触(箭头之间)与枝晶(d)中。在此实例中,DAB沉淀线质膜和细胞器(线粒体和突触小泡)的外表面。在Google Play版中观察到D中所示的轴突静脉曲张和免疫标记为TH和表示DAB的一个例子沉淀完全填充所述axopLASM,与突触小泡可见,但更加难以界定。微环境的元件可以很容易地被识别,由包围标记的轴突静脉曲张髓鞘和轴突无髓鞘的(a)和偶尔的树突(d)中所例示。电子显微照片是从25,26,27修改。比例尺:1μm以下。 请点击此处查看该图的放大版本。
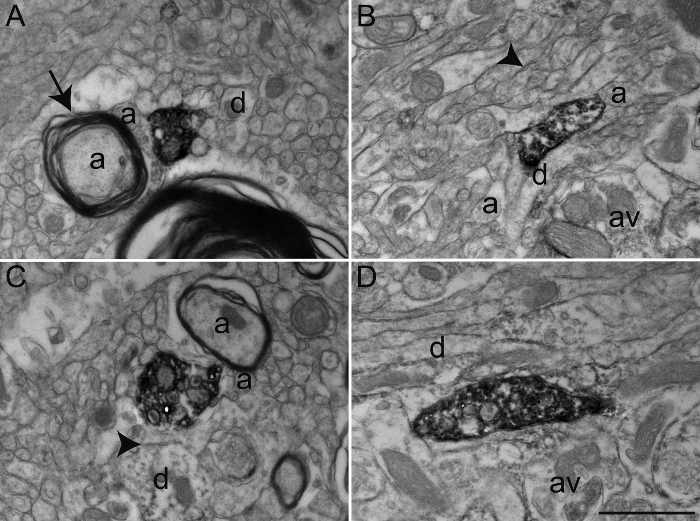
图4:戊二醛PFA Transcardiac灌注后灵长类脑组织的实例。后performi猕猴( 食蟹猴 )的Google Play版(A)和GPI(BD)的脑组织的代表性电子显微照片纳克transcardiac用0.2%的戊二醛混合灌注用4%PFA和免疫过氧化物酶二氨基联苯胺技术与针对血清素转运蛋白(SERT)的抗体。如在图2中 ,免疫标记元件可以通过它们的细胞质和轴浆填充有电子致密DAB沉淀来鉴定。一般超微结构是相对完整的和微环境的元件可以容易地被识别,如图髓鞘和轴突无髓鞘的(a)和偶尔的树突(d)和轴突膨体(AV)包围所述标记的轴突静脉曲张,如在图2中描述。但是,请注意在超微结构的质量的不一致,通过良好定义的质膜(箭头)来表示,但相对损坏髓鞘(箭头)。比例尺:1μm以下。 请点击此处查看该图的放大版本。

图5:以下不成功的Transcardiac灌注获得灵长类脑组织的实例。从一个不成功的化学固定结果显示在此处在松鼠猴内侧部(A - B)和Google Play版(C - D)用0.9%NaCl冲洗溶液和冰冷的4%的混合物经心脏灌注PFA和15%苦味酸稀释在0.1M PB(pH7.4)中。脑在4%PFA和30%的蔗糖中后固定1个小时,在4℃并切成60个微米厚的矢状切面与冷却振动切片机。不适当地固定脑组织可以通过损坏的髓鞘(A和B,箭头)被识别,以及通过模糊或不确定的质膜(C和D,见箭头的例子)。不同的神经元元件DIFficult识别,使超微结构靠不住的任何解释。比例尺:1μm以下。 请点击此处查看该图的放大版本。

图6:在松鼠猴Google Play版非特定聊天免疫标记的实例。背景染色或非特异性免疫标记大细胞元件的EM作为部分染色下有时会出现, 如在示出的- B(箭头)。这种非特异性染色在免疫染色的部分的表面更经常出现。非特异性免疫标记的其他实例包括非常小的元件的唤起小,无髓鞘的轴突部分或完全填充有DAB和位于非常接近一个频繁观察诺特尔,这表现在在C和D箭头。比例尺:1μm以下。 请点击此处查看该图的放大版本。
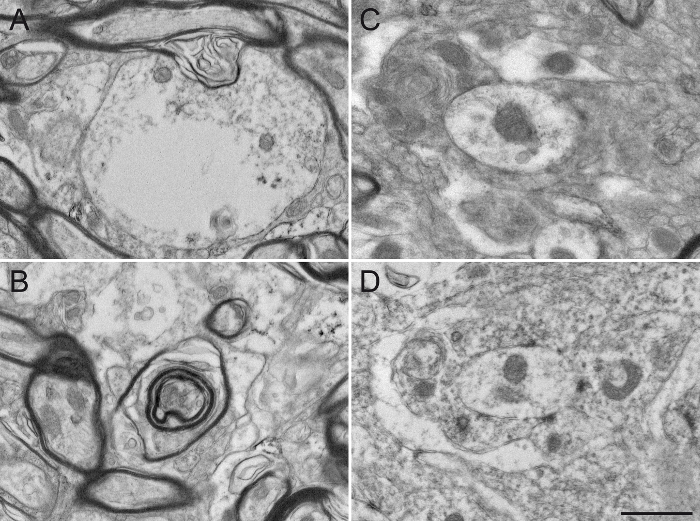
图7:在损坏样品制备用于电子显微镜的失误后松鼠猴组织Google Play版。使用洗涤剂,如Triton X-100,在封闭溶液,甚至在0.02%的低浓度,基本上通过破坏枝晶的细胞质(A)或轴突的髓鞘改变超微结构的完整性(B )。在不同的神经元元件也难以彼此(C)区分开来,因为质膜受损,难以描绘。该osmification过程是阿尔斯○在样品制备中的重要一步。在漂洗溶液(D)中使用的氯化钠改变了组织的固定,使得后续的分析困难。比例尺:800nm的。 请点击此处查看该图的放大版本。
讨论
在本文中,我们提出了非人类的灵长类动物和适于EM样品检查嵌入预免疫的transcardiac灌注一个可靠的协议。虽然典型的冷冻电镜,如CEMOVIS,提供脑组织超微结构的保存较好,这也限制了使用免疫组织化学12。其它技术,包括冷冻替代和Tokuyaso技术中,允许后嵌入免疫组织化学,但是这些技术是昂贵的,由于该过程期间所需的附加设备,并且可以是费时和技能挑战12,14,15。此外,为了有效地使用低温定影方法中,样品具有(使用高压在大气压下29冷冻28和10微米时最高达200微米厚),以相对较小。理想的情况下,获得良好与灵长类脑组织的低温定影的结果,样品必须从活检采取,导致在寻找的感兴趣区域的准确位置的问题。这个问题必须通过使用立体坐标来规避。在化学固定与丙烯醛和上面提出的预嵌入技术提供了一种简单的,低成本的,时间效率,而对于灵长类脑组织样品制备可靠的方法和免疫标记以EM。通过以下步骤,人们将获得保存完好的超微结构与抗原一起以允许大多数蛋白质的免疫标记。然而,对于EM化学固定也有它的缺点。首先,虽然固定溶液如丙烯醛保护脑组织的形态细节,可能的是,在化学固定过程发生并改变相比于那些将与CEMOVIS或冷冻替代技术来获得的结果有些形态变化。其次,固定过程和随后的所需的树脂嵌入除去大部分的细胞外液中的和挤压细胞组分一起,引起组织的收缩率显著改变它们的尺寸和形状相比,低温固定的细胞21,30脱水。尽管如此,醛固定已成功在世界各地的许多实验室使用,并且已被广泛接受的文献作为研究神经元和神经胶质细胞的超微结构特征的可靠方法,尽管前面提到的顾虑21,30,31,32。
通过与上述的方法相比,其需要用于嵌入在甲基丙烯酸甲酯树脂低温固定的样品的免疫组织化学postembedding,是较不敏感的和中枢神经系统的抗原的检测是有限14 33。然而,醛固定也有它的问候抗原性限制。因此,在开始的EM制备之前,以测试在所述LM水平给定的化学固定协议的抗体的特异性是重要的。免疫组化对丙烯醛固定脑组织的质量还取决于先前打破由化学固定产生的强醛债券。该步骤可以通过用硼氢化钠之前,免疫组织化学孵育切片( - 3.5参见步骤3.3)来实现。省略这一步肯定会导致次优免疫34。如果待使用的抗体不给在固定有丙烯醛脑切片染色最佳,因此能够替代地使用戊二醛 - 在4%PFA中稀释(0.1 2%)。这已经被证明是良好的保护脑组织超微结构,同时保持足够的抗原性许多抗体,并提供脑组织适合于用最小的改变20,21,35,36,37长期贮存。另外,也可以通过显著升高溶液的pH单独实现相对良好的固定和抗原适合用于EM与PFA,但灌注期间有一个以上的固定剂的组合提供了更好的结果34,以及研究支持PFA固定单独通常生产用于EM检查38,39保存不好组织。然而,在某些罕见的情况下,抗原性是非常难以维持,并单独PFA固定仍然是EM检查的唯一可行的选择。
在这个协议中的许多步骤应该以获得最佳的结果小心地遵循。例如,4%PFA溶液的制备必须在温度高于45℃,以允许PFA粉末溶解来执行,但它是必要的温度保持低于60℃。否则,PFA解聚溶液成甲醛和甲酸,其不同地固定组织,并形成一种酸性溶液,可以显著改变组织质量40,41。另外,至关重要的是,在灌注步骤中迅速地进行一次隔膜已被切断,由于低氧高二氧化碳会产生不可逆的生理变化到大脑,可以改变组织31的质量和完整性。缺陷的固定可能损害脑组织的保存和永久改变组织,如质膜,线粒体和突触的超微结构。因此,溶液的制备和灌注步骤需要被小心进行。成功的EM样品preparation您还高度依赖于在四氧化锇好后固定。事实上,直接灌注用四氧化锇已被描述为用于EM观察21,39产生合理完整的组织。然而,在细胞外空间的量和锇灌注和醛灌注动物之间质膜的外观方面有许多差异已被注意到。此外,锇灌注后的组织的黑化和硬化渲染去除大脑从头骨,随后的夹层之间,以及白质和灰质分化比较困难,有利于醛灌注更好组织保存和更容易操作21。醛固定单独出现,以减少细胞外空间,其改变了组织的完整性,并给出紧密连接,其中细胞外空间应该被看作的印象,从而不能表现出甚至柠檬酸铅染色42之后可接受的电子显微镜照片。然而,后固定在四氧化锇通过允许组织元件之间的最明确的分离,这是必要的它们的识别42逆转这种情况下,因此清楚地证明进行osmification步骤的重要性(步骤4.1 - 4.2)慎用。
下这些步骤被执行的条件和浓度已经在我们的实验室进行了测试,具体地用于预嵌入-使用DAB作为灵长类动物的脑切片的免疫组织化学沉淀。虽然技能挑战,双免疫组织化学通过是可能的后包埋免疫组织化学与金颗粒43。的电子致密DAB沉淀后这里提出的免疫过氧化物酶二氨基联苯胺的技术是很容易识别在EM电平而获得的,因为它概述了质膜和出ER的细胞器的表面上,同时仍允许亚细胞组分,如线粒体和突触联系的识别。此外,一旦本技术掌握了单一免疫组化,所以能够通过结合DAB沉淀到金颗粒,其更容易地从彼此辨别比不同大小的金颗粒进行双免疫组织化学。我们建议处理脑切片的EM前做抗体特异性,锇的浓度和孵育时间和温度的严格测试。预嵌入和EM双重免疫组化协议此前已公布,可以适用于灵长类动物的大脑组织16。
总之,上面提出用于非人类灵长类动物的transcardiac灌注协议允许的脑切片的长期储存,可随后用于EM嵌入前的免疫组织化学。 Sectio获得纳秒也适于在水平LM神经解剖学研究。因此,通过使用一个协议,该协议是适合于EM和LM,能够减少所使用的动物的数量,具有成本效益和伦理考虑。它还允许在同一动物在LM得到的结果与EM水平之间的直接比较,并允许使用相关光学和电子显微镜(CLEM)的研究。 CLEM研究已主要集中在使用表达荧光蛋白,如绿色荧光蛋白,以后可与电子致密沉淀物标记,并在EM级44观察到的基因工程小鼠的。可替代地,以规避可与电子密度标记,一个神经元内注射组合免疫组化,低温定影的问题如量子点45,在冷冻之前,允许可视化在EM水平46。然而,量子点不是生物相容性,和它们的使用是昂贵的和耗时的,由于需要用于后续的组织制备的附加冷冻装置。虽然这些技术仍然有利于低温定影和冷冻替代方法,也有一些进展对半薄(300 nm)的部分使用化学标签的用合成的荧光团来标记不同的细胞蛋白,其可与EM分析47相关联。技术允许,例如,使用荧光一个特定的轴突定位及与使用EM给定的目标结构的神经元突触的关系之间的相关性,是相当有前途的神经系统的组织的理解,特别是在灵长类动物。在这种情况下,丙烯醛的固定应在戊二醛的青睐,因为后者会产生自发荧光,可以在LM水平改变脑结构的适当可视化。然而,这种类型的极少数的研究已经在灵长类动物中进行的,男ostly由于技术的挑战,这样的实验征收成本高。因此,需要对灵长类动物的成功和低成本CLEM研究,如提高固定方法或使用在LM和EM水平可见光化学标签的新发展。
披露声明
作者什么都没有透露。
致谢
这项研究是由加拿大自然科学和工程研究理事会(NSERC,401848-2011到MP)的支持。 MP从全宗德RECHERCHE魁北克-桑特(FRQ-S)获得了职业生涯奖。 LE是从FRQ-S(FRQ-S 14D 29441)的博士研究金的接收者。我们感谢玛丽 - Josée沃尔曼技术援助。
材料
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
参考文献
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。