Method Article
プレ埋め込み免疫組織化学および電子顕微鏡のための非ヒト霊長類脳組織の調製
要約
ここでは、我々は簡単に、低コストを提供し、時間効率のよいプロトコルは、化学的に透過型電子顕微鏡のための免疫組織化学を事前に埋め込むと互換性のある長期保存を可能に、アクロレイン固定液と霊長類の脳組織を修正します。
要約
光学顕微鏡レベルでのすべての技術の進歩にもかかわらず、電子顕微鏡は、シナプスの連絡先などの神経細胞の超微細構造および形態学的な詳細を検討し、特徴づけるための神経科学における唯一のツールのまま。電子顕微鏡のための脳組織の良好な保存が厳しい低温定着方法によって得ることができるが、これらの技術は、かなり高価であると同定された神経系の接続性を理解することが重要である免疫標識の使用を制限します。凍結置換法は、免疫標識とクライオ固定の組み合わせを可能にするために開発されています。しかし、これらの方法論的アプローチの再現性は、通常は高価な凍結デバイスに依存しています。また、この技術の信頼性の高い結果を達成することは非常に時間がかかり、スキル困難です。したがって、特にアクロレイン固定伝統的な化学的に固定された脳は、電子を結合する時間効率および低コストの方法のままで免疫組織化学と顕微鏡。ここでは、霊長類の脳組織の維持につながり、プレ埋め込み免疫組織化学および透過型電子顕微鏡検査と互換性のある化学アクロレイン固定を使用して信頼性の高い実験プロトコルを提供します。
概要
共焦点及び二光子顕微鏡を含む光学顕微鏡は、他のものの1、2のうち、 インビボ神経プロセスで研究するための効率的なツールであることが証明されました。光学顕微鏡(LM)レベルでの典型的な空間分解能は約200nmであるが、このような極紫外線および軟X線顕微鏡などの異なる光源を用いた最近の技術の進歩は、特に、約10 nmの空間分解能3にこの解像度を増加しています、4、5。イメージングにおける他の技術的進歩は、組織学と組み合わせた磁気共鳴画像を含み、 インビボでミエリン鞘の厚さを測定するための新規な方法、唯一の電子顕微鏡(EM)レベル6,7に伝統的に測定可能であったパラメータを提供します。 AlthouGH LMレベルでのこれらの進歩は、シナプス接触の生体プロセス、構造の詳細図および特性を研究するための優れたツールを提供し、わずか0.5ナノメートルに達することができ、解像度を提供EM、を用いて達成することができます。しかし、EMレベルでの観察は、細胞構築を維持するために、化学固定剤と脱水プロセスと、いくつかの方法で死んで、変更する標本が必要です。従って、高解像度で生体試料を検査することは、放射電子ビームによる損傷、低コントラスト、膜の構造偏差、又は8、9、10を埋め込む以下脱水及びエポキシ起こり得るアーチファクトのも存在に挑戦することができます。
構造解析のために彼らの本来の形で標本を保存する「クライオビトリファイドセクションのEM」またはCEMOVIS、切片化アプローチを用いることによって達成することができます急速凍結及び硝子体氷で試料を埋め込み、極低温11、12にEM下のセクションを調べることを含みます。彼らはまだ固体と完全に水和している間、この手順は、このように脱水工程13に起因するアーチファクトを除去する、試料の検査を可能にします。しかし、この方法では、重要な追加コストを発生させる非常に低い温度でこの観察を可能にするために、凍結超薄切片のための追加の装置と同様に、標準のEMに関する追加のデバイスを必要とします。また、CEMOVISアプローチは、抗体は、通常、室温でインキュベートしなければならないため、技術を免疫標識の使用を妨げます。また、凍結固定した標本をゆっくりと凍結防止化学薬品に浸しながら解凍し、目されている、その間、凍結置換法を使用して免疫組織化学的方法で超微細構造解析を組み合わせることが可能ですエンなどLowicrylsなどの特殊な樹脂に包埋しました。ポスト埋め込み免疫標識は、その後、材料12上で実行することができます。しかし、凍結置換とクライオ固定技術は時間がかかります。彼らは、追加の装置の設置を必要とし、依然として低温14,15の使用にもかかわらず、有機溶媒および細胞構築を変更することができる化学固定液に露出されるようにサンプルを必要とします。したがって、特にアクロレインとLMとEMレベル、脳組織の化学的固定、の両方ですべての技術的進歩にもかかわらず、EM 16で免疫組織化学を結合する低コストおよび時間効率的な方法のままです。
過去数十年間で、多くの試みが最高の組織保存を提供アルデヒドの混合物を見つけるために行われました。 1960年代の前に、EMのために許容可能な結果を与えただけで化学固定液は、四酸化オスミウムました。しかし、四酸化オスミウムは、脳のような臓器を修正するために血管系を通してその使用を排除し、毒性の高い、高価です。アクロレインは、細胞構造17のEM観察に適した動物組織の保存のための信頼性の高い方法として、1950年代後半に導入されました。これは、より深く組織を貫通し、浸漬によって固定のために使用され、組織17の最小の収縮と細胞質成分の良好な保存を可能にする他のアルデヒドよりも速く反応します。そのような酵素および他のタンパク質18の生体分子化合物のより正確な局在化を可能にすることにより、新鮮な組織で使用される場合、このような特徴は、アクロレイン固定を他のアルデヒドを超える明確な利点を与えます。確かに、それは効率的stabiliとして、両生類及びげっ歯類を含む多くの種でEMレベルで可視化のための固定の、簡単で効率的かつ低コストの方法として、年間を通じて検証されていますZESペプチドおよびタンパク質は、抗原性を保持し、他のアルデヒド固定剤16、18、19、20、21と組み合わせて使用される場合、比較的無傷の超微細構造を提供します。げっ歯類におけるアクロレイン固定用プロトコルは、それ以来EM 16、22二重免疫標識を実施するために、特にPickel基によって、広範囲に標準化に使用されてきました。いくつかのグループは、ヒト以外の霊長類の脳組織23にアクロレイン固定を使用していました。しかし、我々の知る限り、効率的にEMが24を免疫標識と互換性のある非ヒト霊長類におけるアクロレインとの化学的固定を記述する一つだけ発表されたプロトコルがあります。
この記事では、我々は、効率的、化学的に非ハムを修正するための簡単で信頼性の高い方法を提供します免疫標識および送信EM検査を事前に埋め込むとともに、潜在的に長期保存を可能にアクロレインと霊長類の脳、。
プロトコル
倫理文:動物を含むすべてのプロトコルは、Comitéデ保護デAnimauxドゥ大学ラバルによって承認されたと実験動物の管理と使用(エド2。)への動物管理者ガイドのカナダの協議会に合わせて行われました。ここで説明するプロトコルは、約800グラムの成体動物のために最適化しました。固定液の量は、動物の大きさに応じて調整する必要があります。
経心臓灌流用の溶液の調製
- 以下の手順に従って、50mMのリン酸ナトリウム緩衝生理食塩水(PBS)溶液の1リットル調製。灌流前に、ほとんどの24時間で溶液を準備し、使用するまで4℃で維持します。
- 1Lのビーカー中で蒸留水800mLを測定します。二塩基性無水リン酸ナトリウムの5.87グラムを追加し(Na 2 HPO 4)、一塩基一水和物リン酸ナトリウム1.20gの(のNaH 2 PO 4・H 2 O)、および9グラム塩化ナトリウム(NaCl)での。溶解するように攪拌します。
- 徐々に5NのNaOHを添加することによりpHを7.4に調整します。 1 L.の総量に到達するために蒸留水を追加します。
注意:NaOHを腐食性の化学化合物です。適切な個人保護具を着用(PPE;実験室コート、手袋、保護眼鏡など )。
- 以下の手順に従って、4%パラホルムアルデヒド(PFA)の2リットルを調製。このソリューションは、手術の前に、ほとんどの24時間で調製し、使用するまで4℃で保存する必要があります。
- 2リットルのビーカーに蒸留水1.5 Lを測定します。二塩基性無水リン酸ナトリウム23.48グラム(のNa 2 HPO 4)、一塩基一水和物リン酸ナトリウムの4.80グラム追加(のNaH 2 PO 4・H 2 O)。溶解するように攪拌します。 2 L.の総量に到達するために蒸留水を追加します。
- 55°C - 温度が約45に達するまで排気フードの下で溶液を加熱します。 60°C以上に加熱しないでください。
- 徐々に溶液にPFAの80グラムを追加し、完全に溶解するまで撹拌する(約30から60分)。 60℃以下に保つために、温度を監視してください。
注意:PFAは、その粉末状の揮発性が高いです。これは、目や皮膚に接触した場合に非常に有毒であり、吸入または経口摂取の場合に危険です。 PPEを着用し、換気フードの下、注意して使用します。 - 4°Cとフィルターにソリューションをクールダウン。 4°Cで保存。
- 以下の手順に従って0.1 Mリン酸緩衝液(PB)中の3%のアクロレインの1 Lを準備します。 PB溶液を灌流前に、ほとんどの24時間で調製しなければなりません。
注意:アクロレインを吸入すると非常に有毒であるとすぐに損傷を生成することができます。皮膚から吸収された場合、それはまた、腐食性及び毒性が高いです。これは、発がん性物質や変異原性です。適切なPPEを着用し、換気フードの下に使用します。- 蒸留水800mLを測定します。二塩基性無水リン酸ナトリウムの8.66グラムを追加し(Na 2 HPO 4)、一塩基一水和物リン酸ナトリウム(のNaH 2 PO 4・H 2 O)の5.38グラム。全ての塩が溶解するまで攪拌します。 4℃で溶液をキープ1 L.の総量に到達するために蒸留水を追加します。
- 手術前に、1Lのガラス容器にPB液900mLのを転送し、排気フード下で97%のアクロレイン溶液30.94 mLを加え。 1 Lと攪拌の総量に到達するためにPBのソリューションを追加します。溶液を濾過し、4℃で保管してください。
2.経心臓灌流し、脳の解剖
- 全体の外科的処置の間、氷の上で解決策をしてください。使用された最初の溶液中にチューブを配置することによって、ポンプを準備し(PBS; 50mMの)と全く空気がホース内に残っていないまでにポンプをオン。マカクザルの経心臓灌流のために、21 G針を使用し、約80 mL /分の流出を設定します。
- ミックスの筋肉内注射で動物を麻酔ケタミンのトゥーレた(20mg / kg)を、キシラジン(4mg / kg)、およびアセプロマジン(0.5ミリグラム/キログラム)。イソフルラン(3%)鎮静下に動物を維持します。
- 通気表に、動物の手足を取り付けます。
- メスで、脇の下に皮膚を取り除きます。腹部の筋肉をカット。慎重に重要な臓器を避けて横方向にリブをカットする大型外科はさみを使用してください。
- 手術用ハサミで横隔膜をカットし、心臓を露出させ胸郭を上げます。ダイヤフラムが切断されると、心臓が数分以内に暴行を停止しますので、、、速やかに進行。
- メスの刃と心膜を取り外し、左心室に針を挿入します。メスで、慎重に右心房に小さな切除を行います。迅速に72 mL /分でポンプを起動し、所定の位置に針を保持します。可能であれば、心より低いレベルにその頭を持つために動物を傾けます。
注:針を挿入するときに心室中隔を貫通しないように注意してください。- Rins肺までPBSの約300mlで電子血が白であり、何の血液が右心房から出てきません。
- ポンプを停止し、すぐに3%アクロレイン溶液にホース/チューブを転送し、再びポンプを起動します。心臓が鼓動を停止した後、徐々に80 mL /分に排気速度を増加させます。アクロレイン溶液の約500mLのを灌流。
- すぐに、ポンプを停止し、4%PFA溶液にホースを転送し、再びポンプを起動します。このステップでは、PFAの約1リットルが必要です。
注:前肢が硬く、首が硬いときに固定が完了しています。 - 頭をカットし、慎重に頭蓋骨の外に脳を解剖。手術器具で脳に損傷を与えないように注意してください。脳が淡い(血液の痕跡)と剛性( 図1A)である場合、灌流が最適です。
- 4℃で1時間、4%PFAで無傷の脳を浸します。
- 連続冷却ビブラトーム(4°C)で脳を切断と厚さ50μmの切片に、所望の平面内にPBS(0.1 M)( 図1B)でそれらを集めます。
注:このステップは、所望のプロトコルに応じて多くの方法で行うことができます。半球を切断ビブラトーム前分離、又は全部を維持することができます。脳はビブラトームプラットフォームに対して大きすぎる場合、それは小さなブロックに切断することができます。このステップの後、切片を40%PB(50ミリモル)、30%グリセロール、30%エチレングリコールからなる不凍液に-30℃で長期間保存することができます。
3.プレ埋め込み免疫組織化学(図1C)
- 次のようにトリス緩衝生理食塩水(TBS、50mMの、pHが7.6)の4 Lストック溶液を調製します。
- 4リットルのビーカーに蒸留水2Lを測定し、トリヒドロキシメチルアミノメタンを24.23グラム追加(THAMを、C 4 H 11 NO 3)、および溶解するかき混ぜます。
- 1 N HClを約148 mLの7.6にpHを調整します。酸は、CAUTIを添加しなければなりません7.6未満のpHに到達しないようにします。総体積はなければならない4 L.
注意:HClは非常に腐食性です。適切なPPEを着用してください。
- EM免疫組織化学のために処理されるべき関心領域を含有する(ステップ2.11から)セクションを選択します。
- 不凍液をリンスし、室温で5分間、PBS中の遊離浮遊切片3X(0.1M、pH7.4)で洗浄します。
- PBSで希釈したのNaBH 4の0.5%溶液を調製します。
- NaBH 4を0.05gを秤量し、PBS 10mL中に希釈します。ふさがないでください。使用直前に、この溶液を調製します。
- 室温で30分間、新たに調製したNaBH 4を溶液中で切片をインキュベートします。優しくロック。ふさがないでください。
- RTで10分間PBSで洗浄3回、反応ガス残るのいずれまで激しく揺動。
- 2%の適当な正常血清およびPBSで希釈した0.5%コールド魚ゼラチンとEMのためにブロッキング溶液を調製します。
注:数量shoul以下の3つのステップのための十分なを持っているために計算さdは。二次抗体をホスティングしている同じ動物種から作られた血清を使用してください。これらの方法は大幅に組織の品質を損なうとして、(抗体の浸透を高めるために)抗原の検索方法やトリトンの少量の追加の使用は避けてください。 - RTで1時間ブロッキング溶液中で切片をインキュベートします。優しくロック。
- ブロッキング溶液で希釈した一次抗体溶液を準備します。
注:一次抗体の濃度は、通常LM免疫組織化学の場合と同じであるが、いくつかの一次抗体は、アクロレインでは動作しない可能性があるため、予め異なる抗体濃度で試験を行うことを検討してください。 ( - 2%0.1)、4%PFA経心臓灌流のために、同様の結果を得ている場合、グルタルアルデヒドの混合物を使用することが可能です。同様インキュベーション時間と温度を最適化します。 - 一次抗体溶液中のセクションをインキュベート一晩、室温で穏やかに揺らしながら。以前に試験インキュベーション時間および温度を使用してください。
- 穏やかに揺らしながら室温で5分間PBSでセクション3回洗います。
- ブロッキング溶液に希釈したビオチン化二次抗体1000溶液:1を準備します。
注:二次抗体は、一次抗体を生成するために使用される宿主種に対して提起されなければなりません。 - RTで1.5時間、二次抗体溶液中で切片をインキュベートします。優しくロック。
- 少なくとも60分前に、二次抗体のインキュベーションの終わりに、アビジン - ビオチン - ペルオキシダーゼ(ABC)溶液を調製します。
- 溶液AとBの8.80μL/ mLで測定し、PBSでそれらを希釈するために較正されたピペットを使用しています。
- アビジンとビオチン分子間の結合を完全に許可するようにRTで少なくとも60分間穏やかに揺らし。
- 二次抗体溶液中でインキュベーションした後、室温で10分間、PBSで3回洗浄します。
- そうABCのセクションをインキュベートRTで1時間lution。優しくロック。
- 穏やかに揺らしながら室温で10分間TBSで一回PBSで二回洗浄してください。
- TBS中に希釈した0.005%H 2 O 2での0.05%の3,3'-ジアミノベンジジン(DAB)の新鮮な溶液を調製します。
- DABの12.5ミリグラムを秤量し、冷たいTBS 25mLにそれを希釈します。光から保護します。
注意:DAB粉末が吸入すると、揮発性の高いと有害です。これは、発がん性や催奇形性があります。したがって、妊娠中や授乳中の女性は、希釈した場合でも、本製品を操作することはできません。操作する際にN95マスクを使用し、PPEを着用してください。 - 溶液を濾過し、使用直前に30%H 2 O 2の4.5μLを追加します。
- DABの12.5ミリグラムを秤量し、冷たいTBS 25mLにそれを希釈します。光から保護します。
- 室温で3~7分間DAB溶液中で切片をインキュベートします。優しくロック。
注:褐色の沈殿物は、バックグラウンド染色の高レベルを避けるために、暗すぎてはなりません。インキュベーション時間はそれに応じて最適化する必要があります。 - すばやく2回洗浄して反応を停止します冷たいTBSで、2回、室温で冷たいTBSで10分間、穏やかに揺らしながらPBで二回10分間、続い。
注:PBの使用(としないPBS)は、オスミウム、フォーム結晶と反応するように、塩化ナトリウムの痕跡を除去するために重要です。
電子顕微鏡観察のための4 Osmificationと埋め込み
- PBで希釈した1%四酸化オスミウム(のOsO 4)の溶液を調製します。光から保護します。
注意:オスミウムは非常に毒性があり、皮膚に接触してはならない、目、口および吸入してはなりません。摂取した場合には死を引き起こす可能性があります。それだけで換気フードの下、適切なPPEして使用する必要があります。 - (撹拌なし)通気フードの下RTで30分間のOsO 4溶液のセクションをインキュベートし、光から保護するためにアルミホイルでそれらを覆います。完全に前のOsO 4溶液を添加するセクションを平ら。
注:セクションでは、非常に暗いと里になってGIDと、この工程の後に、注意して操作しなければなりません。 - osmification中に撥水性エポキシ樹脂を準備します。
- 大きいプラスチックカップにエポキシ樹脂混合物(エポキシ樹脂20gを、硬化剤を20g、アクセル0.6gの可塑剤を0.4g)の各成分の適切な量を追加します。均質な褐色の色が得られるまで、木の棒またはプラスチックピペットで攪拌します。
注:これは、各成分の正確な割合を使用することが重要です。 - 処理されるセクションの数に応じて、適切な大きさのアルミカップに等しい量を転送します。それは休息することを許可します。
- 大きいプラスチックカップにエポキシ樹脂混合物(エポキシ樹脂20gを、硬化剤を20g、アクセル0.6gの可塑剤を0.4g)の各成分の適切な量を追加します。均質な褐色の色が得られるまで、木の棒またはプラスチックピペットで攪拌します。
- osmificatedのセクションでは、低速揺り動かしながらRTで10分間PBで3倍洗います。
- 2分毎に段階的エタノール以下の一連のセクションを脱水:35%エタノールで2回。 50、70、80、90、および95%エタノールで1回ずつ。および100%エタノールで3倍。
- dehydratiを完了するために、ガラスバイアルにセクションを転送プロセス上のプロピレンオキシドで2分間、切片を3回インキュベートすることによって。
注意:プロピレンオキシドは、高揮発性及び毒性の有機溶媒です。これは、接触した場合、あるいは吸入または摂取した場合、目や皮膚に重大な損傷を引き起こす可能性があります。これは、グレード2発がん性物質として分類されています。それだけで換気フードの下とPPEして使用する必要があります。それはまた、非常に可燃性であると離れて任意の熱源から保たれるべきです。
注:プロピレンオキシドは、有機溶媒であり、プラスチックと互換性がないので、この工程の前に、切片を慎重に、ガラスバイアルで転送されるべきです。この時点で、セクションが非常に脆弱であり、注意して操作しなければなりません。セクションは、代替的に4.5の工程の前にガラスバイアルに移すことができます。 - アルミカップに、丁寧に一つ一つのセクションを転送し、できるだけ多くの空気との接触を避けます。フラット埋め込む先に混合した撥水性エポキシ樹脂のセクションおよびventin下で一晩、それらをインキュベートRTでグラムフード。
注:このステップでは、セクションでは、完全に脱水し、非常に脆弱であり、注意して操作しなければなりません。 - 鉱物油を使用して、グリースプラスチックカバースリップとともにグリースでコーティングしたスライドガラスを準備します。
- 最大で12〜15分間、60℃でアルミカップをインキュベートすることによって、樹脂を軟化。慎重にスライドガラスの油を塗った側のセクションを平ら。油を塗ったカバースリップを置き、慎重に残っている空気を押し出します。
- 48時間60℃でスライドをインキュベートします。
注:樹脂はあまりにもハードになるように、48時間のインキュベーション時間を超えないようにすることが重要です。 - プラスチック製のカバースリップを削除します。
透過型電子顕微鏡を用いて超薄セクショニングと観察用の5試料調製
- 関心のある領域を見つけるために、双眼鏡を使用し、メスで約1mm 2の小さな四角形の部分をカット。
- 樹脂ブロックの先端ファイルとQUを接着その上adrangularピース( 図1C)。接着剤は、前切片に少なくとも1時間または一晩乾燥させます。
- ウルトラミクロトームを用いて、80μmの厚さの切片( 図1D)に四角片を切断します。
- 垂直位置でウルトラミクロトームデッキに樹脂ブロックを配置し、鋭利なカミソリの刃を使用して、徐々に滑らかな側面を有する台形を形成するために、樹脂ブロックの各辺を切断します。
- 水平位置でデッキを入れ、台形の最も長い側が下向きにされるまで、ブロックを回転させます。
- 四角片の表面をトリミングするためのツールをトリミングダイヤモンドやガラスナイフを使用してください。ウルトラミクロトーム/秒1mmに300μmの厚さの切片をカットするように設定。垂直四角片に平行であり、約1°の非常に小さな水平角を表示することがナイフを調整します。
注:この角度は、ユーザーが、組織に接近することを可能にするほぼBの表面に平行な免疫標識の要素が発見される可能性が高い場合には、ロックします。ダイアモンドトリミングツールを使用してこれらのパラメータを使用する場合、樹脂は、光沢のある白色を表示します。組織が切断された場合、それは紫や緑がかった色に変化します。 - 、厚さ80μmの切片をカットし、蒸留水で満たされたボートを備えた超45°ダイヤモンドナイフを使用してキシレンに先端紙を吸収する部分でそれらを通過することによってセクションを平滑化し、ホルムバール被覆ニッケルスロットグリッド上の連続切片を収集したり裸の150のメッシュ銅グリッド( 図1E)。
- グリッドストレージボックスにグリッドを配置します。
- クエン酸鉛でグリッドを染色。
- 1濾過リードクエン酸ストック溶液の溶液、濾過、蒸留水:5mLの注射器と1を調製し、0.2μmのシリンジフィルタを使用。光から保護します。
注:リードクエン酸の原液は固形deposの形成を避けるために、毎月新鮮なされるべきですその。在庫レシピの材料データシートを参照してください。グリッドの多くのシリーズが染色する必要がある場合、それは乳白色になったときに加えて、希釈液を変更します。 - 溶液と接触している部分で、希釈された溶液の液滴の上に各グリッドを置き。 3分間インキュベートします。
- グリッドを保持するために、小さなピンセットを使用して、徹底的に蒸留水を含む二つのビーカーにそれをすすぎます。
- 優しく吸収紙を使用して余分な水分を取り除きます。グリッドボックスにグリッドを保管してください。透過型電子顕微鏡(; 図1F TEM)によって切片を検査する前に30分待ちます。
- 1濾過リードクエン酸ストック溶液の溶液、濾過、蒸留水:5mLの注射器と1を調製し、0.2μmのシリンジフィルタを使用。光から保護します。
結果
このセクションでは、我々は、化学的に3%のアクロレインの混合物、4%PFAで固定し免疫染色霊長類の脳組織の、送信EMレベルで、観察後に得られた代表的な結果を提示します。比較的無傷のミエリン鞘と二重膜( 図2A)のニート可視化によって示されるように、我々は、超微細構造の良好な保存を達成しました。シナプス接点は、微小環境からニューロンの要素と共に、容易に( 図2B)を同定することができます。ジアミノベンジジン(DAB)免疫沈降物で標識されたニューロンの要素は、それらの充填された細胞質または軸索原形質によってEMレベルで認識されます。原形質膜および細胞小器官の外側表面はまた、典型的には、電子密度の沈殿物( 図3)で裏打ちされています。
この特定の実験では、抗体のAGAを使用しましたリスザルの淡蒼球の(GPE)、外部または内部(GPI)セグメント( 図3)で免疫標識ニューロン要素を視覚化するために、セロトニントランスポーター(SERT)、コリンアセチルトランスフェラーゼ(チャット)、またはチロシンヒドロキシラーゼ(TH)をINST。そのために、我々は詳細な形態学的調査を許可する、超微細構造と同様の抗原性を保持する固定化学物質の組み合わせを使用していました。多くの抗体は、上記の経心臓灌流プロトコルで使用することができるが、我々はいくつかの一次抗体は、アクロレイン固定して最適な免疫標識を提供しないことが知られているので、ユーザーは、予め最適化濃度のテストを実行することをお勧めします。抗体はアクロレイン固定して最適な免疫標識を提供しない場合あるいは、0.1の希釈 - 4%PFA中の2%グルタルアルデヒドを経心臓灌流のために使用することができます。それは多くのために保存された抗原性とアクロレイン固定脳組織に比較的同等の組織の品質を提供します抗体( 図4)。
最後に、私たちは、不適切な操作後に得られたEM顕微鏡写真の典型的な例を提供します。標識及び非標識神経素子の信頼性が同定および分析を防止する改変されたミエリン鞘( 図5A、B)および神経突起の二重膜の可視化の困難( 図5C、D)に乏しい固定をもたらします。 DAB溶液中での過度なインキュベーション時間は、過剰なバックグラウンドと潜在的に偽陽性の結果を生成することができ、非特異的な染色を作成します。背景又は非特異的染色は、時々 、神経要素( 図6A、B)のような不完全な染色が現れるが、より多くの場合、多数の密接に染色された神経要素( 図6C、D)に位置します。ブロッキング溶液中の界面活性剤の使用が大幅に組織の品質を変更します。それは行方不明につながる可能性困難な微小環境のいずれかの急性解釈をレンダリングする標識された素子( 図7A)またはミエリン鞘( 図7B)および細胞膜( 図7C)の分解のオルガネラ、。最後に、塩化ナトリウムを含有するリンス液を用いたとしてosmificationプロセスにおける失策は、細胞構造は、( 図7D)を区別することは困難であり、信頼できない結果を生成します。
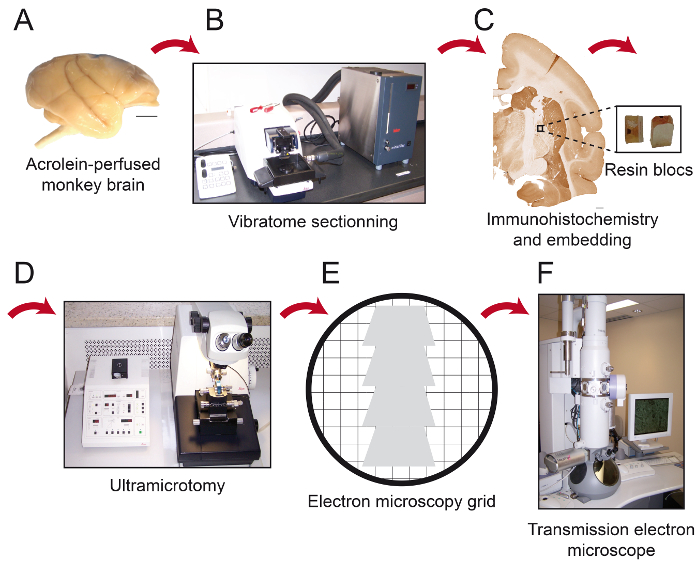
図1:プロトコルの重要なステップの概略図。サル脳(A)は、冷却ビブラトーム(B)で連続切片に切断されます。次いで、それを関心領域が樹脂ブロック(C)の先端に配置された後、プリ埋め込み免疫組織化学および電子顕微鏡用に処理し、80nmの厚さsectiに切断されますウルトラミクロトーム(D)とのアドオン。超薄切片は、次いでクエン酸鉛で染色し、透過型電子顕微鏡(F)で観察される準備ができて、裸の150のメッシュ銅グリッドまたはホルムバール被覆ニッケルグリッド(E)に収集されます。スケールバー:1ミリメートル。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:アクロレイン-PFA経心臓灌流後によく保存さ霊長類の脳組織。 GPiの(A)及びGPE(B)アクロレインPFAの経心臓灌流および免疫ジアミノベンジジン法を行った後の代表的なよく保存材料を示すのリスザル( サイミリシウレウス )脳組織の電子顕微鏡写真。メートル軸索のyelinシース(A)(Aにおける矢印を参照)が比較的無傷であり、一般的な超微細構造が十分小さい無髄軸索(A)、及び軸索静脈瘤(AV)は、容易に、AとB樹状プロファイル(d)にすることができる保存され識別されます。樹状プロファイル(D)と(矢印の間)対称シナプス接触を確立軸索静脈瘤の一例は、Bに示されています。スケールバー:1μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
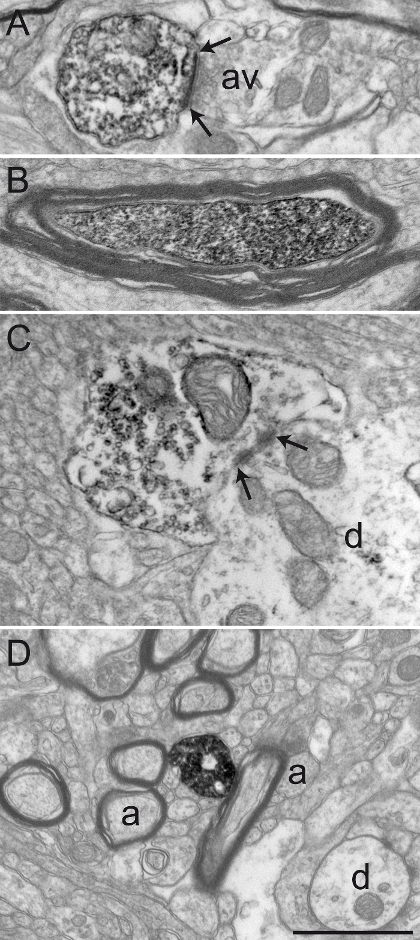
図3:免疫ペルオキシダーゼジアミノベンジジン法を用いて、コリンアセチルトランスフェラーゼ(チャット)、セロトニントランスポーター(SERT)、及びチロシンヒドロキシラーゼ(TH)のためのリスザルGPEおよびGPiの免疫標識からの切片。免疫標識された要素は、容易に細胞質または電子密度DAB沈殿物が充填された軸索原形質によって同定することができます。 GPiの中のChAT免疫染色樹状突起は、非標識軸索静脈瘤(AV)から(矢印の間)のシナプス接触を受けるAに見られるように、標識された樹状プロファイルは、充填されたマイクロフィラメントによって認識されます。 Bにおける電子顕微鏡写真は、軸索原形質THのために免疫標識された比較的無傷のミエリン鞘とGPEにおける有髄軸索を示します。 Cの例では、GPiので軸索静脈瘤は、SERTのための免疫標識示し、デンドライト(D)と(矢印の間)対称シナプス接触を確立するように見られます。この例では、DABは、ラインに原形質膜および細胞小器官(ミトコンドリアやシナプス小胞)の外表面を沈殿します。 Dに示す軸索静脈瘤は、GPEで観察されTHのための免疫標識および完全axopを充填沈殿DABの一例を示しましたシナプス小胞が見えるが、線引きすることがより困難であると、lasm。標識された軸索静脈瘤を取り囲む有髄および無髄軸索(a)および時折樹状突起(d)に例示されるような微小環境の要素を容易に同定することができます。電子顕微鏡写真は、25、26、27から変更されています。スケールバー:1μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
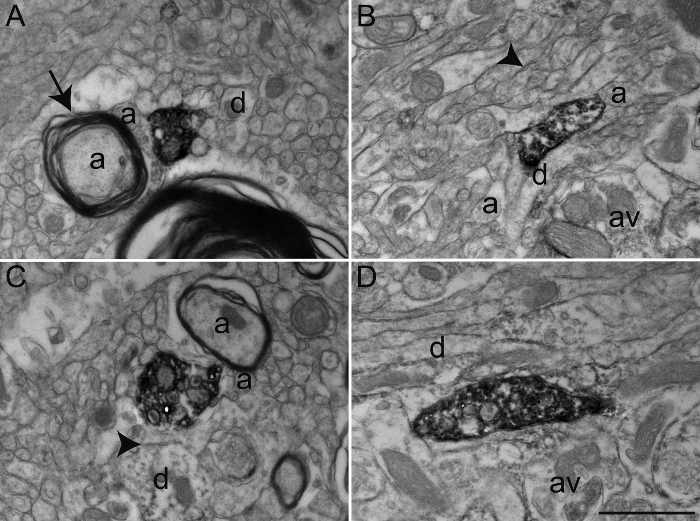
図4:グルタルアルデヒド-PFA経心臓灌流後の霊長類の脳組織の例。 performi後マカクザル( カニクイザル )GPE(A)とGPiの(BD)の脳組織の代表的な電子顕微鏡写真セロトニントランスポーター(SERT)に対する抗体を用いて4%PFAおよび免疫ジアミノベンジジン法と混合し、0.2%グルタルアルデヒドで経心臓灌流をngの。 図2のように、免疫標識要素は、その細胞質および電子密度DAB沈殿物が充填された軸索原形質によって同定することができます。 図2で説明したように、静脈瘤軸索標識周囲の一般的な超微細構造は、比較的無傷であると微小環境の要素は、容易に識別することができ、有髄および無髄軸索によって示されるように(a)および時折樹状突起(d)および軸索静脈瘤(AV)。しかし、明確に定義された原形質膜(矢印)で示される超微細構造の質の矛盾、が、比較的損傷を受けた髄鞘(矢印)に注意してください。スケールバー:1μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図5:失敗経心臓灌流後に得られた霊長類の脳組織の例。そしてGPE(C - D)経0.9%NaClでリンス溶液、氷冷4%PFAの混合物と希釈15%ピクリン酸で灌流-失敗化学固定の結果は、ここではリスザルGPiの(B A)に示されています0.1 M PBにおける液(pH 7.4)。脳を4%PFAおよび30%スクロース中で4℃で1時間、後固定し、冷却ビブラトームを用いて厚さ60μmの矢状切片に切断しました。不適切に固定された脳組織を損傷ミエリン鞘(AとB、矢印)によって、ならびにぼやけまたは未定義の原形質膜によって認識することができる(C及びD、例のために矢印を参照)。異なる神経要素がDIFされています信頼できない超微細構造の任意の解釈をレンダリングする、識別するためにficult。スケールバー:1μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6:リスザルGPEにおける非特定のチャット免疫標識の例。 B(矢印) -に示すように、バックグラウンド染色または非特異的免疫標識は、時には、大細胞要素の部分的染色としてEM下に表示されます。このような非特異的染色は免疫染色セクションの表面でより頻繁に表示されます。非特異的免疫標識の他の例は、部分的にまたは完全にDABを充填し、1つのAに非常に近い位置する小さな、無髄軸索を引き起こす非常に小さな要素の頻繁な観察を含みますNotherの、C及びDにおける矢印によって示されるように。スケールバー:1μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
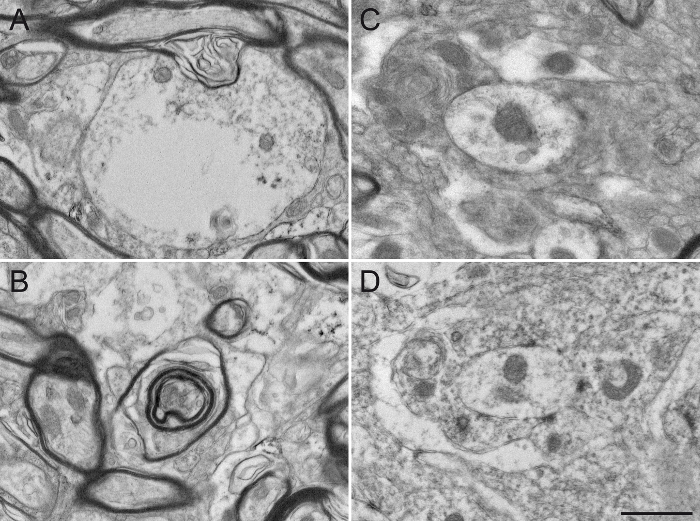
図7:電子顕微鏡用試料調製における失策後損傷リスザルGPE組織。 0.02%の低濃度でブロッキング溶液中のこのようなトリトンX-100などの界面活性剤の使用は、実質的に樹状突起の細胞質(A)または軸索のミエリン鞘(Bを損傷することによって超微細構造の完全性を変化させます)。原形質膜が損傷し、線引きすることは困難であるので、異なる神経要素が、互いに(C)と区別することが困難です。 osmificationプロセスはALSでありますサンプル調製の重要なステップO。溶液(D)をすすぎ中の塩化ナトリウムの使用が難しいその後の分析をレンダリングする、組織の固定を変化させます。スケールバー:800 nmの。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
この記事では、我々は、ヒト以外の霊長類の経心臓灌流およびEMのサンプル検査に適した事前埋め込み免疫組織化学のための信頼性の高いプロトコルを提示します。例えばCEMOVISような典型的なクライオEMは、脳の微細構造の良好な保存を提供するが、それはまた、免疫組織化学12の使用を制限します。クライオ置換およびTokuyaso技術を含む他の技術は、免疫組織化学を埋め込むポストできるように、これらの技術は、デュー・プロセス中に必要な追加のデバイスに高価であり、時間がかかり、12、14、15のスキルに挑戦することができます。また、効率的に凍結固定法を使用するために、試料は(大気圧29で28と10μmの凍結高圧を使用する場合、厚さ200ミクロンまで)は比較的小さくなければなりません。理想的には、良い取得します霊長類の脳組織の低温定着を用いた結果は、試料は、関心領域の正確な位置を見つけることに問題を引き起こし、生検から採取しなければなりません。この問題は、定位座標を使用することによって回避されなければなりません。アクロレイン及び上記提案されたプレ埋め込み技術による化学固定が容易、低コスト、時間効率、および霊長類の脳組織の試料調製のための信頼できる方法およびEMのための免疫標識を提供します。これらの手順に従うことで、一つはほとんどのタンパク質の免疫標識を可能にするために、抗原と一緒によく保存された超微細構造を得ることができます。しかし、EMのための化学的固定はまた、その欠点を持っています。例えばアクロレイン等の固定溶液は、脳組織の形態学的な細部を保持しながら、まず、いくつかの形態学的変化は、化学固定プロセス中に発生しCEMOVISまたはクライオ置換技術を用いて得られるものに比べて結果を変えることが可能です。第二に、固定工程と大幅にサイズを変更し、凍結固定した細胞21、30と比較して形状の組織の収縮を引き起こし、細胞外液のほとんどを除去し、一緒に細胞成分を圧搾埋め込み樹脂に必要なその後の脱水。それにもかかわらず、アルデヒド固定は、世界中の多くの研究室で正常に使用されており、広く前述の懸念21、30、31、32にもかかわらず、神経細胞とグリア細胞の超微細構造の特徴を研究するための信頼性の高い方法として文献に受け入れられています。
上述の方法と比較して、メタクリル樹脂中に包埋凍結固定したサンプルのために必要とされるpostembedding免疫組織化学は、あまり敏感であり、中枢神経系の抗原の検出が制限されている14 > 33。しかし、アルデヒド固定はまた、抗原性の点で限界があります。したがって、EMの準備を開始する前に、LMレベルで所与の化学固定プロトコルの抗体の特異性を試験することが重要です。アクロレイン固定脳組織の免疫組織化学の品質も以前に化学固定により作成された強力なアルデヒド結合を切断によって異なります。このステップは、( - 3.5手順3.3を参照)、水素化ホウ素ナトリウムを用いて免疫組織化学の前のセクションをインキュベートすることによって達成することができます。このステップを省略すると、間違いなく次善の免疫染色34につながります。 4%PFA中で希釈 - (2%0.1)使用される抗体は、アクロレインで固定した脳切片上の最適な染色を与えていない場合、代わりにグルタルアルデヒドを使用することが可能です。これは、十分に多くの抗体のための抗原性を維持しながら、脳の超微細構造をよく保存して、脳組織を提供することが証明されました最小限の変更20、21、35、36、37との長期保存に適し。大幅に溶液のpHを上昇させることによってのみPFAとEMに適した比較的良好な固定及び抗原性を達成することも可能であるが、灌流の間に、複数の固定の組み合わせは、より良い結果34を提供している、との研究では、一般的にだけではそのPFA固定をサポートEM検査38、39にはあまり保存された組織を作ります。しかし、いくつかのまれなケースでは、抗原性を維持することは非常に困難であり、単独でPFA固定は、EM検査のための唯一の実行可能な選択肢のまま。
このプロトコルには多くのステップは、最適な結果を得るために慎重に従ってください。例えば、4%PFA溶液の調製PFA粉末を溶解させるために45℃以上の温度で行われ、温度が60℃未満のままであることが必須であるしなければなりません。そうでなければ、PFA溶液は、ホルムアルデヒドと異なる組織を固定し、著しく組織品質40、41を変更することができ、酸性溶液を形成ギ酸、に解重合します。低酸素症および高炭酸ガスが組織31の品質と完全性を変えることができ、脳への不可逆的な生理的変化を生成しますので、また、振動板が切断された後、灌流段階を迅速に行うことが重要です。欠陥の固定は、脳組織の保存に有害であると恒久的な形質膜、ミトコンドリアやシナプスのような組織の超微細構造を変えることができます。このように、溶液調製及び灌流のステップは、注意して実施する必要があります。成功したEMのサンプルpreparationはまた、高度に四酸化オスミウムで良いポスト固定に依存します。実際に、四酸化オスミウムとの直接灌流EM観察21、39のために合理的に無傷の組織を産生するように記載されています。しかし、細胞外スペースの量およびオスミウム灌流およびアルデヒド灌流動物間の形質膜の外観の面で多くの違いが注目されています。さらに、オスミウム灌流後の組織の黒化や硬化は、より良い組織保存および容易な操作のための21のアルデヒド灌流を好む、頭蓋骨から脳の除去、その後の解剖、および白と灰白質の区別がより困難になります。単独のアルデヒド固定は、このように表示するために失敗し、組織の整合性を変え、細胞外空間に見られるべきであるタイトジャンクションの印象を与える細胞外空間を、減らすために表示されますでもクエン酸鉛染色42後の許容可能な電子顕微鏡写真。慎重に-しかし、四酸化オスミウムでpostfixationは、このように明確osmification工程を行うことの重要性を正当化する、それらの同定42のために必要である組織要素との間の最も明確な分離を可能にすることによって、この状況を逆転させ(4.2 4.1ステップ)。
これらのステップが実施される条件および濃度は、特に霊長類の脳切片上の沈殿物としてDABを用いたプレ埋め込み免疫組織化学のために、我々の研究室で試験されています。スキル挑戦が、二重免疫組織化学は、金粒子43と埋め込み後、免疫組織化学によって可能です。それが出て原形質膜とを概説するので電子密度DABは、ここで提案されている免疫ペルオキシダーゼジアミノベンジジン技術はEMレベルで識別することは非常に容易になった後に得られた沈殿物ER細胞小器官の表面、依然としてそのようなミトコンドリアやシナプスの連絡先などのサブ細胞成分の同定を可能にします。本技術は、単一の免疫組織化学のために習得された後、さらに、DABがより容易に、異なるサイズの金粒子よりも互いから識別された金粒子に析出組み合わせて二重免疫組織化学を行うことが可能です。私たちは、EMのための脳切片を処理する前に、抗体特異性、オスミウム濃度、およびインキュベーション時間および温度の厳格なテストを行うことをお勧めします。前の埋め込みやEMのための二重免疫組織化学のためのプロトコルは、以前に公開されていると霊長類の脳組織16に適合させることができます。
結論として、上記の非ヒト霊長類のための経心臓灌流プロトコールは、その後、EMプレ埋め込み免疫組織化学のために使用することができる脳切片の長期保存を可能にします。 Sectio得られNSはまた、LMレベルでの神経解剖学の研究に適しています。したがって、EM及びLMの両方に適しているプロトコルを使用して、使用された動物の数、コスト効率および倫理的な考慮を低減することができます。それはまた、同じ動物にLMで得られた結果とEMレベル間の直接比較を可能にし、相関的光学および電子顕微鏡(CLEM)試験の使用を可能にします。クレム研究はほとんど後EMレベル44での電子密度の沈殿物で標識し、観察することができ、このようなEGFPなどの蛍光タンパク質を発現する遺伝子操作マウスの使用に焦点を当ててきました。あるいは、免疫組織化学の問題を回避するために、低温定着前EMレベル46での可視化を可能にする、凍結するために、量子ドット45のような電子密度マーカーのニューロン内注射と組み合わせることができます。しかし、量子ドットは、生体適合性ではない、と彼らの使用は、その後の組織の準備のために必要な追加の冷凍装置に費用と時間がかかります。これらの技術はまだ凍結固定し、凍結置換法を好むが、EM分析47と相関させることができる合成フルオロフォアと異なる細胞タンパク質を標識する半薄(300 nm)のセクション、上の化学タグを使用するためのいくつかの進展があります。可能な技術は、例えば、蛍光およびEMを使用して、指定された標的構造のニューロンとのシナプスの関係を使用してある特定の軸索のローカリゼーションとの間の相関は、具体的には、霊長類における神経系の組織の理解のためにかなり有望です。後者はLMレベルで脳構造の適切な視覚化を変更する可能性が自家蛍光を生成するように、この場合には、アクロレインの固定は、グルタルアルデヒドよりも好まれるべきです。しかし、このタイプの非常に少数の研究は、霊長類において行われてきた、メートルostly技術的な課題と、そのような実験を課す高コストのために。したがって、新たな開発は、このような固定方法を改善または両方LMとEMレベルで可視の化学タグを使用するなどの霊長類に成功したと低コストCLEM研究のために必要とされます。
開示事項
著者は、開示することは何もありません。
謝辞
この研究は、自然科学とカナダの工学研究会(NSERC、MPに401848から2011)によってサポートされていました。 MPは、 フォンデRECHERCHEデュケベックサンテ(FRQ-S)からキャリア賞を受け取りました。 LEはFRQ-S(FRQ-S 14D 29441)から博士交わりの受信者でした。私たちは、技術支援のためにマリージョゼWallmanに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Dibasic anhydrous sodium phosphate (Na2HPO4) | Fisher scientific | S374-500 | |
| Monobasic monohydrate sodium phosphate (NaH2PO4·H2O) | EM Science | SX0710-1 | |
| Sodium chloride (NaCl) | Fisher scientific | S271-3 | |
| Hydroxymethyl aminomethane (THAM) | Fisher scientific | T370-500 | |
| HCl | EMD | HX0603-3 | 1 N dilution. Product is corrosive. Use with appropriate protection. |
| NaOH | EMD | SX0590-1 | 5 N dilution. Product is corrosive. Use with appropriate protection. |
| Paraformaldehyde (PFA) | Sigma | P6148 | 4% dilution. Product is highly volatile in its powder form and highly toxic. Use with caution under a venting hood with appropriate protection. |
| Acrolein (90%) | Sigma | 110221 | 3% dilution. Product is highly toxic. Use under a venting hood with appropriate protection. |
| Autopsy venting table | Mopec | CE400 | |
| Electronic perfusion pump | cole parmer | masterflex L/S 7523-90 | |
| Needle (perfusion) | terumo | NN-1838R | 18 G 11/2 |
| Needle | terumo | NN-2713R | 21 G 1/2 |
| Ketamine | 20 mg/kg | ||
| Xylazine | 4 mg/kg | ||
| Acepromazine | 0.5 mg/kg | ||
| Scalpel | |||
| Scalpel blades | Feather lance | 201011 J9913 | No.22 for surgery and No. 11 for EM |
| Surgical scissors | |||
| Rongeurs | |||
| Vibratome | Leica | VT 1200S | Calibrate blade before each use, when the device allows it |
| Vibratome razor blade | Gillette | GIN 642107 | |
| Glycerol | Fisher scientific | G33-4 | 30% dilution |
| Ethylene glycol | Fisher scientific | E178-4 | 30% dilution |
| Sodium borohydride (NaBH4) | Sigma | S-9125 | |
| Normal horse serum (NHS) | Jackson immunoResearch Laboratories | 008-000-121 | 2% dilution |
| Cold-fish gelatin | Aurion | 900.033 | 0.5% dilution. Original product is concentrated at 40% |
| Primary antibody, SERT | Santa Cruz biotechnology | SC-1458 | 1/500 dilution |
| Primary antibody, ChAT | Chemicon (Millipore) | AB144P | 1/25 dilution |
| Primary antibody, TH | ImmunoStar | 22941 | 1/1,000 dilution |
| Biotinylated secondary antibody, goat | Vector laboratories | BA-9500 | 1/1,000 dilution |
| Biotinylated secondary antibody, mouse | Vector laboratories | BA-2000 | 1/1,000 dilution |
| Vectastain elite ABC kit | Vector laboratories | PK6100 | 8.8 µL/mL of A and B each |
| 3,3'-diaminobenzidine (DAB) | Sigma | D5637 | 0.05% dilution. Product is highly volatile in its powder form and toxic. Do not throw waste in the sink. |
| Peroxide (H2O2) 30% | Fisher scientific | H-323 | 0.005% dilution |
| Osmium tetroxide (OsO4) | Electron microscopic science | 2% 19152 4% 19150 | Original solution can be either 2 or 4%. Keep attention to which one is used to calculate the final 1% dilution. Product is very sensitive to light. Osmium is highly toxic. Use only under a venting hood with appropriate protection. |
| Durcupan water-repellent epoxy resin | Sigma | A: M epoxy resin (44611) B: hardener 964 (44612) C: accelerator 960 (DY 060) (44613) D: plasticizer (44614) | Polymerize 48 h at 58 °C before throwing in waste. |
| Alumium cups | Electron microscopic science | 70048-01 | |
| Ethanol | commercial alcohols | 1019C | Dilute in distilled water with appropriate concentration |
| Propylene oxide | Electron microscopic science | 20401 | Organic solvent. Highly volatile and toxic. Use under a venting hood. |
| Non-coated medium glass slides | brain research laboratories | 3875-FR | Grease surface with mineral oil |
| Plastic film (Aclar embedding film) | Electron microscopic science | 50425-25 | Grease surface with mineral oil |
| Ultramicrotome | Leica UC7 | EM UC7 | |
| Diamond trimming tool (ultratrim) | Diatome | UT 1081 | Can use glass knife alternatively |
| Ultra 45° Diatome Diamond knife | Diatome | MC13437 | equipped with a boat |
| Xylenes | Fisher scientific | X5SK-4 | |
| 150-mesh copper grids | Electron microscopic science | G150-cu | |
| grid-box | Electron microscopic science | 71138 | Can store up to 100 grids |
| Sodium citrate | Anachemia | 81983 | |
| Lead nitrate | Sigma | L-6258 | Make a stock solution of lead citrate made of 1.33 g of lead nitrate and 1.76 g of sodium citrate diluted in 42 mL of preboiled and cooled distilled water to which 8 mL of 1 N NaOH are added after the conversion from lead nitrate to lead citrate is complete. pH should be approximately 12. Store solution in a hermetic plastic bottle and protect from light. |
| Syringe | terumo | SS-05L | 5 mL |
| Syringe filter | Corning | 431222 | 0.2 µm |
| Absorbing paper (bibulous paper) | Electron microscopic science | 70086-1 | |
| Parafilm | Laboratory film | PM-999 | |
| Mineral oil | Sigma | M5904 |
参考文献
- Pozzi, P., Gandolfi, D., et al. High-throughput spatial light modulation two-photon microscopy for fast functional imaging. Neurophotonics. 2 (1), 015005(2015).
- Zhou, Y., et al. A comparison study of detecting gold nanorods in living cells with confocal reflectance microscopy and two-photon fluorescence microscopy. J. Microsc. 237 (2), 200-207 (2010).
- Chao, W., Kim, J., Rekawa, S., Fischer, P., Anderson, E. H. Demonstration of 12 nm resolution Fresnel zone plate lens based soft X-ray microscopy. Opt. Express. 17 (20), 17669-17677 (2009).
- Wachulak, P., Bartnik, A., Fiedorowicz, H. A 50 nm spatial resolution EUV imaging-resolution dependence on object thickness and illumination bandwidth. Opt Express. , (2011).
- Wachulak, P., et al. A compact "water window" microscope with 60 nm spatial resolution for applications in biology and nanotechnology. Microsc. Microanal. , 1-10 (2015).
- Stikov, N., et al. In vivo histology of the myelin g-ratio with magnetic resonance imaging. Neuroimage. 118, 397-405 (2015).
- Stikov, N., et al. Quantitative analysis of the myelin g-ratio from electron microscopy images of the macaque corpus callosum. Data Brief. 4, 368-373 (2015).
- Mollenhauer, H. H. Artifacts caused by dehydration and epoxy embedding in transmission electron microscopy. Microsc. Res. Tech. 26 (6), 496-512 (1993).
- Henderson, R. Realizing the potential of electron cryo-microscopy. Q. Rev. Biophys. 37 (1), 3-13 (2004).
- Sander, B., Golas, M. M. Visualization of bionanostructures using transmission electron microscopical techniques. Microsc. Res. Tech. 74 (7), 642-663 (2011).
- Ren, G., Rudenko, G., Ludtke, S. J., Deisenhofer, J., Chiu, W., Pownall, H. J. Model of human low-density lipoprotein and bound receptor based on cryoEM. Proc. Natl. Acad. Sci. U.S.A. 107 (3), 1059-1064 (2010).
- Webster, P., Schwarz, H., Griffiths, G. Preparation of cells and tissues for immuno EM. Methods Cell Biol. 88, 45-58 (2008).
- Kürner, J., Medalia, O., Linaroudis, A. A., Baumeister, W. New insights into the structural organization of eukaryotic and prokaryotic cytoskeletons using cryo-electron tomography. Exp. Cell Res. 301 (1), 38-42 (2004).
- Humbel, B. M. Freeze-substitution. Handbook of cryo-preparation methods for electron microscopy. 13, 319-341 (2009).
- Stierhof, Y., Humbel, B. M., van Donselaar, E., Schwarz, H. Cryo-fixation, freeze-substitution rehydration and Tokuyaso cryo-sectioning. Handbook of cryo-preparation methods for electron microscopy. 14, 344-365 (2009).
- Leranth, C., Pickel, M. V. Electron microscopic pre-embedding double-immunohistochemical methods. Neuroanatomical tract-tracing methods 2. , 129-172 (1989).
- Luft, J. H. The use of acrolein as a fixative for light and electron microscopy. Anat. Rec. 133, 305-305 (1959).
- Saito, T., Keino, H. Acrolein as a fixative for enzyme cytochemistry. J. Histochem. Cytochem. 24 (12), 1258-1269 (1976).
- King, J. C., Lechan, R. M., Kugel, G., Anthony, E. L. Acrolein: a fixative for immunocytochemical localization of peptides in the central nervous system. J. Histochem. Cytochem. 31 (1), 62-68 (1983).
- Sabatini, D. D., Bensch, K., Barrnett, R. J. Cytochemistry and electron microscopy. The preservation of cellular ultrastructure and enzymatic activity by aldehyde fixation. J. Cell Biol. 17, 19-58 (1963).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: I. Preservation with aldehyde perfusates versus direct perfusion with osmium tetroxide with special reference to membranes and the extracellular space. J. Ultrastruct. Res. 12, 160-186 (1965).
- Sesack, S. R., Pickel, V. M. Dual ultrastructural localization of enkephalin and tyrosine hydroxylase immunoreactivity in the rat ventral tegmental area: multiple substrates for opiate-dopamine interactions. J. Neurosci. 12 (4), 1335-1350 (1992).
- Mathai, A., Ma, Y., Paré, J., Villalba, R. M., Wichmann, T., Smith, Y. Reduced cortical innervation of the subthalamic nucleus in MPTP-treated parkinsonian monkeys. Brain. 138 (4), 946-962 (2015).
- Villalba, R. M., Paré, J., Smith, Y. Three-dimensional electron microscopy imaging of spines in non-human primates. Transmission electron microscopy methods for understanding the brain. 115, 81-103 (2016).
- Eid, L., Champigny, M., Parent, A., Parent, M. Quantitative and ultrastructural study of serotonin innervation of the globus pallidus in squirrel monkeys. Eur. J. Neurosci. 37 (10), 1659-1668 (2013).
- Eid, L., Parent, A., Parent, M. Asynaptic feature and heterogeneous distribution of the cholinergic innervation of the globus pallidus in primates. Brain Struct. Funct. 221, 1139-1155 (2016).
- Eid, L., Parent, M. Morphological evidence for dopamine interactions with pallidal neurons in primates. Front. Neuroanat. 9, 111-114 (2015).
- McDonald, K. High-pressure freezing for preservation of high resolution fine structure and antigenicity for immunolabeling. Methods Mol. Biol. 117, 77-97 (1999).
- Gilkey, J., Staehelin, L. Advances in ultrarapid freezing for the preservation of cellular ultrastructure. J. Electron Microsc. Tech. 3, 177-210 (1986).
- Korogod, N., Petersen, C. C. H., Knott, G. W. Ultrastructural analysis of adult mouse neocortex comparing aldehyde perfusion with cryo fixation. eLife. 4, (2015).
- Karlsson, U., Schultz, R. Fixation of the central nervous system for electron microscopy by aldehyde perfusion: III. Structural changes after exsanguination and delayed perfusion. J. Ultrastruct. Res. 14, 47-63 (1966).
- Schultz, R. L., Maynard, E. A., Pease, D. C. Electron microscopy of neurons and neuroglia of cerebral cortex and corpus callosum. Am. J. Anat. 100 (3), 369-407 (1957).
- Gocht, A. Use of LR white resin for post-embedding immunolabelling of brain tissue. Acta Anat. (Basel). 145 (4), 327-339 (1992).
- Eldred, W. D., Zucker, C., Karten, H. J., Yazulla, S. Comparison of fixation and penetration enhancement techniques for use in ultrastructural immunocytochemistry. J. Histochem. Cytochem. 31 (2), 285-292 (1983).
- Manocha, S. L. Effect of glutaraldehyde fixation on the localization of various oxidative and hydrolytic enzymes in the brain of rhesus monkey, Macaca mulatta. Histochem. J. 2 (3), 249-260 (1970).
- Mrini, A., Moukhles, H., Jacomy, H., Bosler, O., Doucet, G. Efficient immunodetection of various protein antigens in glutaraldehyde-fixed brain tissue. J. Histochem. Cytochem. 43 (12), 1285-1291 (1995).
- Storm-Mathisen, J., Ottersen, O. P. Immunocytochemistry of glutamate at the synaptic level. J. Histochem. Cytochem. 38 (12), 1733-1743 (1990).
- Hwang, S. J., Rustioni, A., Valtschanoff, J. G. Kainate receptors in primary afferents to the rat gracile nucleus. Neurosci. Lett. 312 (3), 137-140 (2001).
- Palay, S. L., McGee-Russeel, S. M., Gordon, S. Jr, Grillo, M. A. Fixation of neural tissues for electron microscopy by perfusion with solutions of osmium tetroxide. J. Cell Biol. 12, 385-410 (1962).
- Corthell, J. Chapter 9, Perfusion and Immersion Fixation. Basic Molecular Protocols in Neuroscience: Tips, Tricks, and Pitfalls. , 1st ed, Academic Press. 83-90 (2014).
- Helander, K. G. Formaldehyde prepared from paraformaldehyde is stable. Biotech. Histochem. 75 (1), 19-22 (2000).
- van Harreveld, A., Khattab, F. I. Perfusion fixation with glutaraldehyde and post-fixation with osmium tetroxide for electron microscopy. J. Cell. Sci. 3 (4), 579-594 (1968).
- Renno, W. M. Post-embedding double-gold labeling immunoelectron microscopic co-localization of neurotransmitters in the rat brain. Med. Sci. Monit. 7 (2), 188-200 (2001).
- Ellisman, M. H., Deerinck, T. J., Shu, X., Sosinsky, G. E. Picking Faces out of a Crowd: Genetic Labels for Identification of Proteins in Correlated Light and Electron Microscopy Imaging. Methods Cell Biol. 111, 139-155 (2012).
- Labrecque, S., et al. Hyperspectral multiplex single-particle tracking of different receptor subtypes labeled with quantum dots in live neurons. J. Biomed. Opt. 21 (4), 046008(2016).
- Bailey, R., Smith, A., Nie, S. Quantum dots in biology and medicine. Physica E Low Dimens. Syst. Nanostruct. 25 (1), 1-12 (2004).
- Perkovic, M., et al. Correlative light- and electron microscopy with chemical tags. J. Struct. Biol. 186 (2), 205-213 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved