Method Article
В этой статье
Резюме
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
Аннотация
Ангиогенез, определяемый как рост новых кровеносных сосудов из уже существующих судов, включает в себя эндотелиальные клетки, перицитов, гладкие мышечные клетки, клетки иммунной системы, а также координацию с лимфатическими сосудами и нервами. Нескольких ячеек, многоступенчатая система взаимодействия требует исследование ангиогенеза в физиологически соответствующей среде. Таким образом, в то время как использование в пробирке моделей клеточных культур обеспечили механистических понимание, общая критика в том , что они не перепросматривать сложности , связанные с сетью микрососудов. Целью данного протокола является демонстрация возможности сделать покадровой сравнения неповрежденных микрососудистых сетей до и после стимуляции ангиогенеза в культуре тканей крыс брыжейки. Культивированный ткани содержат микрососудистых сетей, которые поддерживают их иерархию. Иммуногистохимическое маркировка подтверждает наличие эндотелиальных клеток, клеток гладкой мускулатуры, перицитов, кровеносных сосудов и лимфатических сосудов. Вddition, мечения тканей с BSI-лектинов позволяет сравнение замедленную регионов локальной сети до и после сыворотки или фактора роста стимуляции характеризуется повышенной капиллярной всходов и плотности сосудов. По сравнению с моделями общих клеточных культур, этот метод обеспечивает инструмент для исследования эндотелиальных клеток линии дифференцировки и ткани специфического ангиогенного оценки лекарственных средств в физиологически соответствующих капиллярных сетей.
Введение
Рост сети микрососудов и ремоделирования являются общие знаменатели для функции тканей, заживление ран, а также несколько патологий и ключевой процесс ангиогенеза, определяется как рост новых кровеносных сосудов из существующих 1, 2. Для тканевой инженерии новых сосудов или проектирование ангиогенные терапии на основе, понимая важность клеточной динамики, вовлеченных в ангиогенез имеет решающее значение. Тем не менее, этот процесс является сложным. Он может варьироваться в определенных местах в пределах сети микрососудов и включает в себя несколько типов клеток (т.е. эндотелиальные клетки, клетки гладких мышц, перицитов, макрофаги, стволовые клетки) и несколько систем (лимфатическую сети и нейронных сетей). Хотя модели в пробирке внесли огромный вклад в изучение взаимосвязи между различными клетками , участвующими в ангиогенезе 3, их физиологическое значение может быть подорвана из - за Thei г ограниченную сложность и тот факт , что они не точно отражают сценарий в естественных условиях. Для преодоления этих ограничений, трехмерных систем культивирования 3, исключая виво модели ткани 4, микрофлюидальные системы 5, 6, и вычислительные модели 7 были разработаны и внедрены в последние годы. Тем не менее, все еще существует необходимость в модели с возможностью покадровой для исследования ангиогенеза в неповрежденных микрососудистых сетях бывших естественных условиях. Создание новых моделей покадровой для изучения ангиогенеза с этим уровнем сложности обеспечит бесценным инструментом, чтобы понять основные механизмы, регулирующие ангиогенез и улучшить методы лечения.
Потенциальная модель , которая позволяет ех естественных условиях исследование ангиогенеза через неповрежденной сети микрососудов является брыжейки модель культуры крысы> 8. В недавней работе мы показали, что в крови и лимфатической микрососудистых сети остаются жизнеспособными после культивирования. Что еще более важно, брыжейки модель культуры крысы могут быть использованы для исследования функциональных перицитов-эндотелиальной взаимодействия клеток, крови и лимфатической соединений эндотелиальных клеток и покадровой обработки изображений. Целью данной работы является предоставление нашего протокола для метода формирования изображений в заданный промежуток времени. Наши показательные результаты документирования нескольких типов клеток, которые остаются жизнеспособными после стимуляции ангиогенеза с сывороткой и предлагают примеры использования этого метода для количественной оценки тканей специфические ангиогенные ответов, а также исследования отслеживания клеток эндотелия.
протокол
Все эксперименты на животных и процедуры были одобрены Institutional Animal Care и использования Комитетом по Tulane университета (IACUC) путем.
1. Хирургическая процедура настройки
- Автоклавы инструменты, хирургические принадлежности и расходные материалы культуры до операции. Хирургические расходные материалы для каждой крысы включают в себя: 1 драп, 1 драпировку с предварительно вырезанное отверстие (0,5 х 1,5 дюйма) в центре, марлевые тампоны и 1 впитывающего лежащей снизу. Хирургические инструменты включают в себя: 1 скальпель с номером 10 лезвия, 2 пары пинцет и пару тонких ножниц. принадлежности культуры включают в себя: 1 простыня, 1 пара пинцета, и подготовили вставки пластины 6-а с поликарбонатом фильтрами.
- Стерилизовать плексигласа платформу, хирургический этап и хирургическая Benchtop пространство с 70% этанола. Держите хирургический этап в стерильной миске до использования.
- Создание хирургической стадии путем бурения приблизительно 2 в 1 с в отверстие в центре культуры блюдо 100 мм. Затем, используйте наждачную бумагу для сглаживаниялюбые острые края и добавить слой силиконового клея к краям в отверстие, чтобы создать приподнятую поверхность для тканей.
- В качестве альтернативы, разработать хирургический этап с использованием программного обеспечения САПР и сделать с помощью 3-D печати (рисунок 1).
- Поместите стерильный абсорбирующий вниз и лежащей снизу лежал оргстекло платформу на вершине. Поместите драпировку, без предварительно вырезанное отверстие, через нагретую площадку рядом с абсорбирующим лежащей снизу.
- Предварительно теплой стерильным фосфатно-буферным солевым раствором (PBS) средства массовой информации и физиологический раствор до 37 ° С. Место СМИ и PBS в отдельной посуде культуры на вершине грелку и место физиологического раствора в мл коническую трубку 50, рядом с хирургической установки.
- Убедитесь, что все пакеты открыты до начала операции, чтобы обеспечить стерильную обработку всех материалов. Полный перечень общих инструментов, используемых в данной процедуре, перечислены в разделе Таблица конкретных хирургических материалов и инструментов.
2. Mesenterу тканей Уборочная
- Использование взрослых самцов крыс Wistar (350 ± 25 г; 6 - 8-недельного возраста). Другие штаммы и возраст крыс могут быть замещены.
- Обезболить крысу через внутримышечной инъекции кетамина (80 мг / кг массы тела) и ксилазина (8 мг / кг массы тела). Подтвердите крыса находится под наркозом, зажимая между пальцами, чтобы проверить наличие рефлекторной реакции; не должно быть ни одного. Преимущественное обезболивание для этого терминала процедуры не требуется.
- Бритье брюшной области и удалить оставшиеся волосы с помощью крема для удаления волос. Протрите кожи живота дважды с 70% изопропилового спирта с последующим повидон-йода. Для салфетками хирург должен начаться в центре места операции и перейти к внешней стороне на подготовленную поверхность в круговом образом, чтобы они не перекрывают друг друга областей, которые были предварительно вымыты с той же самой части стерильной марли или стерильного ватного тампона. Затем перенесите животное в стерильном хирургической установки и место на вершине плексигласа Platформа.
- Используя лезвие скальпеля, сделать 0,75 - 1,25 в разрез в кишечнике, начиная с 1 в ниже грудины. Будьте осторожны, чтобы не проколоть кишечника или брыжейки (1 слой кожи, 1 слой соединительной ткани, а также 1 слой мышц).
- Поместите драпировку с предварительно вырезанное отверстие через надрез и поместить стерильный хирургический этап на вершине салфетке. Убедитесь, что открытие совпадет с разрезом. Используйте стерильные ватные наконечником аппликаторы, чтобы найти и вытащить подвздошной через отверстие хирургической стадии.
- Вытащите 6 - 8 брыжейки окна через стадию с использованием ватным аппликаторы, и будьте осторожны , чтобы не коснуться окна (Рисунок 1). Ткани обычно собирают из подвздошной области тонкой кишки, начиная около слепой кишки. Держите открытые ткани влажной с подогреваемой стерильным физиологическим раствором по мере необходимости с помощью стерильного шприца капают раствор.
- Эвтаназии крыс путем инъекции внутрисердечной пентобарбитала натрия (0,2 мл на крысу). Перед удалением меняsenteric окна, убедитесь, что крыса эвтаназии пальпации сердце; не должно быть никакого пульса.
- Удалить нужные ткани брыжейки с помощью пинцета, чтобы захватить жировой ткани и тонкие ножницы, чтобы вырезать окно. Оставьте границу жира (2 мм) вокруг окна. Вымойте ткани раз в подогретой стерильной PBS и один раз в средствах массовой информации.
- Возвращение экстериоризированного подвздошной в брюшную полость и распоряжаться животного в соответствии с ведомственным руководящим принципам.
3. Брыжейка культуры ткани для ЗАМЕДЛЕННАЯ исследований
- Передача автоклавного поставок культуры (смотри раздел 1.1) и ткани в стерильный ламинарный.
- Используйте пинцет для передачи каждой ткани поверх мембраны из поликарбоната фильтра. Захват тканей жировой ткани, чтобы не повредить сосудистую сеть.
- Быстро распространение ткани с помощью жировой ткани, соблюдая осторожность, чтобы не коснуться окна. Инверсия вставку с тканью в нижней части 6-луночного планшета и накрыть 3 мл среды (рисунок 1 ). Типичные среды, используемые для этой процедуры включает в минимальном базовом Media (MEM) с добавлением 1% пенициллин стрептомицин (PenStrep) и 10% фетальной бычьей сыворотки (ФБС). Средства массовой информации могут быть дополнены другими сывороток и / или факторов роста для стимуляции ангиогенеза.
- Повторите шаги 3.2 - 3.3 для каждой ткани и культуры в стандартных условиях инкубатора (5% СО 2, 37 ° С) в течение до 5 дней.
4. Замедленная Визуализация брыжейки ткани
- В день съемки, дополняют средства массовой информации в каждую лунку с сопряженными BSI-лектин и инкубировать в стандартных условиях культивирования в течение 30 мин. Вымойте ткани дважды лектин свободных средств массовой информации. BSI-лектин пятно остается видимым на брыжейки ткани до 3-х дней в культуре.
- Перенести пластину на предметный столик микроскопа. Выявление кровеносных и лимфатических сосудов, основанные на их морфологии и структуры сети.
- Найдите нужную область сети на каждой ткани и делать снимки. Примите к сведению изображенияместо, чтобы обеспечить тот же регион будет захвачен для последующих изображений. При использовании моторизованного столика, документировать координаты.
- Возвращение тканей в инкубаторе и не продолжают культуру до желаемой конечной точки. Повторите шаги 4.1 - 4.3 по мере необходимости в зависимости от требуемых экспериментальных точек времени.
5. Ткань иммунноокрашивания
- BSI-лектин Этикетировочное
- Инкубируйте ткани в течение 30 мин при температуре 37 ° С с 1:40 ФИТЦ-конъюгированного лектина в средах (2,5 мл раствора антител на лунку в 6-луночный планшет) с последующими двумя полосканий со средствами массовой информации. Для полосканий, добавить носитель, а затем немедленно заменить.
- Live / Dead Этикетировочное
- Инкубируйте ткани в течение 10 мин при температуре 37 ° С с 1: 500 2 мМ этидий гомодимер-1 и 1: 500 1 мМ кальцеина AM в среде (2,5 мл раствора антител на лунку в 6-луночный планшет) с последующими двумя полосканий со средствами массовой информации.
- BSI-лектин / NG2 Этикетировочное
- Спред ткани на микроскоп соскользнуле (1 - 2 ткани / слайд) и дайте высохнуть. Удалить лишний жир с помощью скальпеля, нажав вниз твердо акцизным жир.
- Закрепить ткани в холодном метаноле в течение 30 мин при -20 ° С. Промыть тканей с PBS (3 х 10 мин).
- Для получения первичной маркировки антител инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 кроличьего поликлонального антитела NG2 и 5% сыворотки нормальной козьей (NGS). Промыть тканей с PBS (3 х 10 мин).
- Для вторичной маркировки антител инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 козы к антителам кролика cy2-конъюгированные антитела (GAR-cy2) и 5% NGS. Промыть тканей с PBS (3 х 10 мин).
- Инкубируйте ткани в течение 30 мин при комнатной температуре с 1:40 ФИТЦ-конъюгированного лектина в PBS с последующей двух промывок PBS. Для полосканий, добавьте PBS, а затем немедленно заменить.
- Для крепления слайдов, охватывают ткани с 50:50 PBS и растворе глицерина и место покровное на вершине. Уплотнение скользящие края, используя лак для ногтей.
- LYVE-1 / РЕСАМ Этикетировочное
- Спред ткани на предметное стекло (1 - 2 ткани / слайд) и дайте высохнуть. Удалить лишний жир с помощью скальпеля, нажав вниз твердо акцизным жир.
- Закрепить ткани в холодном метаноле в течение 30 мин при -20 ° С. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для получения первичной маркировки антител инкубировать ткани в течение 1 ч при комнатной температуре с 1: 200 мышиной моноклонального CD31 антитела и 1: 100 кроличьего поликлонального LYVE-1 антитела в PBS + 0,1% сапонина + 2% бычьего сывороточного альбумина (БСА) + 5% NGS , Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для вторичной маркировки антител, инкубировать ткани в течение 1 ч при комнатной температуре с 1: 500 Cy-3 конъюгированного стрептавидина антитела и 1: 100 GAR-CY2 в PBS + 0,1% сапонина + 2% БСА + 5% NGS. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для крепления слайдов, покровных тканей с 50:50 PBS и растворе глицерина и помещают покровное на вершине. Уплотнение скользящие края, используя лак для ногтей.
- BrdU / BSI-лектин Этикетировочное
- Добавить 1 мг / мл BrdU к средствам массовой информации и заменить ткани носитель с BrdU раствором. Инкубировать в течение 2 ч при 37 ° С.
- Спред ткани на предметное стекло (1 - 2 ткани / слайд) и дайте высохнуть. Удалить лишний жир с помощью скальпеля, нажав вниз твердо акцизным жир.
- Закрепить ткани в холодном метаноле в течение 30 мин при -20 ° С. Промыть тканей с PBS (3 х 10 мин).
- Денатурации ДНК ткани в 2 М HCl в течение 1 ч при 37 ° С. Мытье ткани в PBS + 0,1% сапонина (3 х 10 мин).
- Для получения первичной маркировки антител, инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 мышиное моноклональное анти-BrdU в PBS + 0,1% сапонина + 2% БСА + 5% NGS. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для вторичной маркировки антител, инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 козьего анти-мышиного Cy-3 антитела, конъюгированного (GAM-Су3) в PBS + 0,1% сапонина + 2% БСА + 5% NGS. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Инкубируйте ткани в течение 30 мин при комнатной температуре с 1:40 ФИТЦ-конъюгированного лектина в PBS с последующей двух промывок PBS.
- Для крепления слайдов, покровных тканей с 50:50 PBS и растворе глицерина и место покровное на вершине. Уплотнение скользящие края, используя лак для ногтей.
- BSI-лектин / маркировка CD11b
- Спред ткани на предметное стекло (1 - 2 ткани / слайд) и дайте высохнуть. Удалить лишний жир с помощью скальпеля, нажав вниз твердо акцизным жир.
- Закрепить ткани в холодном метаноле в течение 30 мин при -20 ° С. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для получения первичной маркировки антител инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 мышиное анти-крысиного CD11b в PBS + 0,1% сапонина + 2% БСА + 5% NGS. Промыть тканей с PBS + 0,1% сапонина (3 х 10 мин).
- Для вторичной маркировки антител инкубировать ткани в течение 1 ч при комнатной температуре с 1: 100 GAM-Су3 в PBS + 0,1% сапонина + 2% БСА + 5% NGS. Вымойте тканей с PBS+ 0,1% сапонина (3 х 10 мин).
- Инкубируйте ткани в течение 30 мин при комнатной температуре с 1:40 ФИТЦ-конъюгированного лектина в PBS с последующей двух промывок PBS.
- Для крепления слайдов, покровных тканей с 50:50 PBS и растворе глицерина и место покровное на вершине. Уплотнение скользящие края, используя лак для ногтей.
Результаты
После 3 -х дней в культуре ткани были помечены живой / мертвой комплекту жизнеспособность / цитотоксичность , чтобы продемонстрировать жизнеспособность микрососудов у крыс брыжейки модели культуры (фиг.2А). Большинство клеток, присутствующих в брыжейки остаются жизнеспособными в культуре, где эндотелиальные клетки были определены на основании их расположения в капиллярных сегментах. Пролиферации эндотелиальных клеток была также подтверждена лектин / BrdU маркировки (рис 2D). Гладкая мышечных клеток и присутствие перицитов вдоль сосудов было подтверждено NG2 маркировки (рис 2B). Этикетировочное для LYVE1 и PECAM идентифицированных разветвленности лимфатическую и микрососудистых сетей в крови и подтвердили поддерживать лимфатическую по сравнению с эндотелиальной клетки крови фенотипа (рис 2C).
Замедленной особенностью этой модели была использована мечения microvascular сети с BSI-лектина в различные моменты времени и с изображениями и ту же область в пределах сети с течением времени; эта возможность является особенно ценным для исследования ткани кровеносных сосудов конкретных ответов. Добавок среды с 10% сыворотки вызвала надежный ангиогенный ответ после 3-х дней стимуляции. Кроме того, новые сегменты сосудов и капиллярных ростки были идентифицированы 5 -й день стимуляции (рисунок 3). Метод покадровой обработки изображений позволил для количественного сравнения участков сети до и после стимуляции (рисунок 4). Для этого представительного исследования, которое подтверждает наши предыдущие результаты 9, количество сосудов в области сосудистой и количество капиллярных проростков в области сосудистой количественно определяли с одного 4X на изображении ткани. сегменты кровеносного сосуда были определены как лектин-позитивных сегментов эндотелиальных клеток крови, присутствующих между двумя точками ветвления и капиллярные ростки были определены как слепому, завершившийся сегменты, происходящие из-хозяина судна. Сравнение Покадровый сетевых регионов также включено отслеживание сегментов эндотелиальных клеток (рисунок 5) и идентификация крови / лимфатический сосуд неправильному кучность (рисунок 6). Маркировку культивируемых тканей для лектин и CD11b дополнительно подтвердили наличие интерстициальных макрофагов (рис 7) в сетях ремоделирования.

Рисунок 1. Брыжеечные окна были расположены, вытащив тонкую кишку через хирургической стадии. Хирургический этап был разработан и сделан 3-D печати. Эллиптический отверстие в центре приблизительно 2 в 1 с на стадии (а). Мезентериальные окна затем были распространены на верхней части мембраны вставки, и вставка переворачивали и помещали в лунку (B). Шкала бар = 2 см.ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2. Кровеносные сосуды сохраняют жизнеспособность в модели культуры крысы брыжейки. Живой / мертвый анализ выполняется после того, как культуры показал высокое отношение живых клеток (зеленые) мертвые клетки (красный) , специально вдоль кровеносных сосудов (А). Ткани брыжейки были помечены лектин и анти-NG2, для идентификации перицитов (красный) наряду с судов (зеленый) и подтвердить , что различные типы клеток присутствуют в тканях посткультура (B). Тканей были также помечены против PECAM / LYVE-1 для выявления крови (красные) сосуды из лимфатической (зеленый) сосуды (C). Для того, чтобы исследовать, если микрососудистых клетки подвергаются пролиферации в культуре, ткани брыжейки метили лектин / анти-BrdU , На капиллярных сегментов , помеченных лектина (зеленый), несколько ячеек были подтверждены быть пролиферативная (красный) (D). Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Время покадровой визуализации брыжейки крысы позволяет наблюдать микрососудов ремоделирования в течение культуры. Надежный ангиогенный ответ наблюдался после того, как 3 (В) и 5 дней (С) культуры с 10% стимуляции сывороткой. Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Файлы / ftp_upload / 55183 / 55183fig4.jpg "/>
Рисунок 4. Микрососудистые сети в модели культуры крысы брыжейки были обследованы до и после того, как ангиогенез. Сравнение той же сети , помеченный лектина в день 0 и 3 -й день (A, B) после стимуляции с 10% сыворотки выявляет новые сосуды. Лектин также этикетки популяцию неопознанных интерстициальных клеток. Количественное определение плотности сосудов (C, D) , а количество капиллярных проростков на сосудистую область (Е, F) , подтвердили увеличение обоих показателей для каждой ткани. С, Е) до (день 0) и после того, как (день 3) сравнения на ткани. D, F) Сравнение между днем 0 и день 3 средние с использованием парного критерия Стьюдента подтвердили значительную разницу в обоих среднее число сегментов сосудов (р <0,0001) и среднее число побегов (р <0,00001) в расчете на область сосудистой , Белые столбики представляют день 0, а черные полосы представляют День 3. Valuэс представляют собой средние значения ± SEM. Для этого репрезентативного анализа, 13 ткани собирали из 2-х крыс. Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5. Модель культуры брыжейки крысы могут быть использованы для исследования сосудов остров судьбы и включение в близлежащих сетей. Использование покадровой обработки изображений, сосудистых островов, определяемый как отключенных эндотелиальных сегменты, были определены в день 0 и их подключение к близлежащей сети было подтверждено 3-й день после стимуляции развитие кровеносных сосудов. Ткани брыжейки стимулировали bFGF (A, B) и VEGF / PDFG-BB (C, D). Полые стрелки показывают разъединенные сегменты на 0-й день и сплошные стрелки представляют собой островную соединение с Networк. Наконечники указывают расположение соединений между сосудистым островом и близлежащей сети. Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 6. Время покадровой изображения демонстрируют способность наблюдать лимфатическую и кровеносных сосудов кучность. Лимфатической (л) суда можно отличить от артериол (а) и венул (v) на основе маркировки морфологии на день 0 (A). На 5 -й день после стимуляции с 10% сыворотки, лимфатический морфология теряется и сосуды , по всей видимости интегрировали с близлежащим ангиогенных кровеносных сосудов (В). Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы увидеть увеличеннуюверсия этой фигуры.
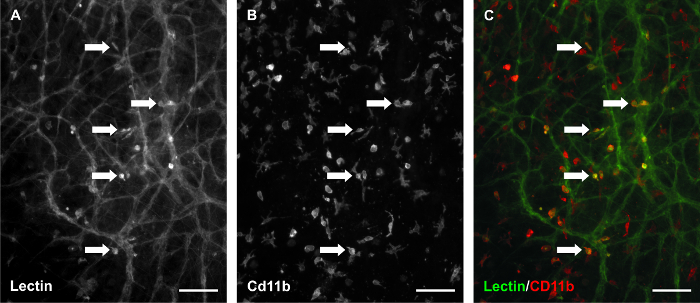
Рисунок 7. Макрофаги остаются присутствуют в культивируемых тканях крыс брыжейки. Лектин / CD11b совместно этикетирование тканей, культивированных в течение 3-х дней с 10% сыворотки позволяют предположить, что лектин позитивные интерстициальные клетки представляют собой подмножество макрофагов. (А) представитель изображения маркировки BSI-лектинов. (B) CD11b маркировки в том же поле зрения. (C) объединенное изображение. Стрелки определить примеры совместного маркировки. Масштабные полоски = 100 мкм. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Этот протокол документов метод с использованием модели культуры крысы брыжейки в качестве инструмента для экс естественных условиях покадровой визуализации роста микрососудистой сети. Предыдущая работа в нашей лаборатории установила использование нашей модели 1) ангиогенеза 8, 2) лимфангиогенез 8, 3) перицитов-эндотелиальной взаимодействий клеток 8, и 4) антиангиогенная тестирования на наркотики 9. Способность к визуализации культивируемых тканей крысы брыжейки в различные моменты времени предлагает количественный анализ для оценки тканеспецифические ответов роста и отслеживание межклеточных взаимодействий при различных ангиогенных стимулов. Увеличение пролиферации эндотелиальных клеток во время ангиогенеза и наличие перицитах согласуются с нашей предыдущей работе 8 и проверки динамических взаимодействий между несколькими типами клеток во время ангиогенеза в культивируемых тканях крыс брыжейки.
По сравнению с обычно используемыми моделями для культивирования тканей и в лабораторных системах клеточных культур, брыжейки модель культуры крыса является уникальным , поскольку рост происходит в интактной, реальной сети микрососудов. Рассмотрим в отличие от аортального кольца анализа, который был создан для изучения ангиогенеза из сегментов аорты в коллагеновый гель 10. В то время как прорастают аортального кольца включает в себя несколько типов клеток, капиллярные ростки вырастают из отделенных сегментов аорты, которая очень отличается от сценария в естественных условиях. Модель среза мозга еще одна бывшая модель естественных условиях, но она лишена лимфатических сосудов. Кроме того, модель срез мозга не было показано , чтобы иметь возможность покадровой обработки изображений до и после стимуляции ангиогенного 11. Другой бывший естественных условиях модель , которая была недавно введена в сетчатка модель культуры. Преимуществом модели является то, что сетчатка ангиогенез происходит от интактной microvascuLAR сети внутри ткани 12, 13. Для этих моделей, GFP-трансгенных линий мышей могут быть использованы , чтобы иметь возможность наблюдать капиллярную всходов в течение долгого времени, но , к сожалению, брыжейка мышь бессосудистая 14, устраняя GFP-трансгенные мыши брыжейки замещение брыжейки крысы, как и используемый в нашей модели. Кроме того, мы покажем , что простой лектин маркировки крысы брыжейки тканей в культуре достаточно , чтобы определить рост сети в различные моменты времени и в сравнении с другими моделями ех естественных условиях, наша модель позволяет одновременное наблюдение как кровеносных и лимфатических эндотелиальных клеток.
BSI-лектин был использован в данной работе для визуализации микрососудов сетей и выявления ангиогенные ответов. Лектин представляет собой структуру белка, который связывается с гликопротеинов на эндотелиальных клетках и был выбран для этого протокола из-за его короткого времени инкубации по сравнению с эндотелиальной АнтибOdy маркеры. Лектин дешевле, чем антитела, и она не требует фиксации; он также может быть легко смешаны в культуральной среде и заменяли свежей средой после окончания периода инкубации. В то время как будущие исследования необходимы , чтобы выяснить потенциальные последствия метода лектин маркировки на процессе ангиогенеза, наши репрезентативные результаты (рисунок 4) показывают , что прочный ангиогенез может быть вызван и предыдущая работа 9 показывает , что ангиогенез в лектиновых маркированы сетях может быть подавлена с помощью таргетинга фактор роста эндотелия сосудов (VEGF). Антитела маркеры потенциально могут быть использованы в качестве альтернативного маркировки подход, когда существует потребность в более специфических маркеров, или когда возникает необходимость исследовать другие типы клеток, которые присутствуют в микрососудистых сетях, таких как клетки гладких мышц, перицитов и нервов. Другой потенциальный метод для визуализации клеток будет трансфекция гена.
Преимущество использования покадровой модели крысы брыжейки была подчеркнута в представительных результатов для этого протокола. Сравнение изображений до и после лечения уменьшает проблемы изменчивости, которые влияют на непарных статистический анализ. Конкретные ответы эксплантов варьировалась от 20% до 233% увеличения плотности сосудов и от 40% до 3500% увеличение плотности проростков. Конкретные причины этого изменения остается неизвестным, но измерения роста в той же ткани, со временем представить возможность подтвердить тканевые конкретные ответы.
Сравнительный анализ изображений в различные моменты времени в процессе роста микрососудистой также позволяет отслеживать эндотелиальные клетки. Например, наша лаборатория определила сосудистые острова как сегменты эндотелиальных клеток в непосредственной близости от микрососудистых сетей, которые отключены от соседних сетей 15, 16. Для того, чтобы подтвердить, что эти острова подключиться к близлежащей NetworK в ответ на ангиогенные стимулы, была использована модель культуры крысы брыжейки. Как показано на рисунке 5, сосудистые острова отслеживались после стимуляции ткани с основным фактором роста фибробластов (bFGF) или VEGF плюс тромбоцитарный фактор роста (PDGF). Мы также показали, Сходные результаты стимуляции сообщение в сыворотке (данные не показаны здесь). После стимуляции ангиогенеза, то первоначально разъединенные сосудистыми островки можно найти подключены к сетям соседних.
Другие возможные области применения модели культуры брыжейки крысы могли использовать возможность исследовать взаимосвязи между лимфатической и кровеносных сосудов и их соответствующих эндотелиальных клеток и отслеживания интерстициального судьбы клеток. Время покадровой изображения тех же микрососудистых сетей до и после стимуляции с 10% сыворотки в этой модели были приведены примеры потенциальной интеграции сосудов лимфатической с кровью (рисунок 6). До стимуляции, лимфатической и Vess кровиELS отличались основанные на морфологии сосуда. После стимуляции лимфатической в сравнении идентичности кровеносных сосудов становится менее ясным. Потенциал взаимодействия эндотелиальных клеток лимфатической / крови поддерживается наблюдением PECAM + / LYVE-1- крови эндотелиальные клетки, соединяющие с PECAM + / LYVE-1 + лимфатическими эндотелиальными клетками (данные не показаны). Эти наблюдения поддерживают использование модели культуры крысы брыжейки для исследования эндотелиальных клеток пластичностью лимфатической / крови. Рисунок 6A также подчеркивает лектин маркировки очевидных интерстициальных клеток. Хотя эта маркировка не соответствует и гетерогенным из ткани к ткани, он делает акцент на присутствие клеток эндогенных резидентов ткани. CD11b маркировка культивируемых тканей (Рисунок 7) показывает , что эти лектин-позитивные интерстициальные клетки могут быть подмножеством макрофагов. С учетом возникающих интерес к макрофагальной участия в ангиогенеза 20, дополнительно прочностьМодель может быть его использование для отслеживания динамики макрофагов с течением времени.
Как и другие модели естественных условиях бывших, текущее ограничение изучения ангиогенеза в модели культуры крысы брыжейки является отсутствие кровотока. Касательное напряжение , вызванное потоком крови было показано, играют важную роль в морфологии клеток эндотелия и пролиферацию, а также ангиогенез 17, 18, 19. Для получения репрезентативных результатов , представленных на рисунке 4, отсутствие напряжения сдвига само по себе может быть достаточно , чтобы вызвать ангиогенный отклик в культивируемых сетях. Тем не менее, мы знаем , что на основе нашей первой публикации , характеризующего модель культуры крысы брыжейки 8, что средства массовой информации Программы дополнительного питания приводит к увеличению ангиогенеза в сравнении одних только средств массовой информации. Будущие исследования, включающие поток в культивируемых микрососудистых сетей, несомненно, необходимо более тесно имитироватьв естественных условиях сценария. Потенциальные подходы для включения потока могут включать в себя катетеризация питающей сети артериол или даже катетеризация артерии дальше вверх по течению в пределах жира границы мезентериальных окон. Тем не менее, несмотря на отсутствие потока, жизнеспособность нескольких типов клеток, содержание крови и лимфатической микрососудистых сетей, а также пролиферации клеток во время ангиогенеза поддерживает относительную повышенный уровень культуральной модели крыс брыжейки коэффициент сложности по сравнению с клеткой , основанной в моделях пробирке.
В заключение, этот протокол описывает простой, воспроизводимый ех естественных условиях метод для визуализации кровеносных сосудов ответы в неповрежденных микрососудистых сетях. Такой способ предлагает альтернативу клетке , основанную на моделях пробирке для оценки динамики ангиогенных клеток в определенных местах в сетевой среде. Способ также предлагает новый инструмент для исследования ангиогенеза, лимфангиогенез и кровь / лимфатическую СУИ-скороговорканин одновременно.
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
Материалы
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
Ссылки
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены