Method Article
Un
En este artículo
Resumen
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
Resumen
La angiogénesis, definida como el crecimiento de nuevos vasos sanguíneos a partir de vasos pre-existentes, implica células endoteliales, pericitos, células de músculo liso, células inmunes, y la coordinación con los vasos linfáticos y nervios. El multi-celda, las interacciones de múltiples sistemas requieren la investigación de la angiogénesis en un entorno fisiológicamente relevante. Por lo tanto, mientras que el uso de los modelos de cultivo celular in vitro han proporcionado ideas mecanicistas, una crítica frecuente es que no se recapitulan la complejidad asociada con una red microvascular. El objetivo de este protocolo es demostrar la capacidad de hacer comparaciones con lapso de tiempo de redes microvasculares intactas antes y después de la estimulación de la angiogénesis en los tejidos mesenterio de rata. tejidos cultivados contienen redes microvasculares que mantienen su jerarquía. marcaje inmunohistoquímico confirma la presencia de células endoteliales, células de músculo liso, pericitos, vasos sanguíneos y los vasos linfáticos. En unddition, el etiquetado de los tejidos con BSI-lectina permite la comparación de lapso de tiempo de las regiones locales de la red antes y después de la estimulación con suero o factor de crecimiento caracterizado por el aumento de la brotación y la densidad de los vasos capilares. En comparación con los modelos de cultivo celular comunes, este método proporciona una herramienta para estudios de linaje de células endoteliales y la evaluación de medicamentos angiogénico específico de tejido en las redes microvasculares fisiológicamente relevantes.
Introducción
Crecimiento de la red microvascular y la remodelación son denominadores comunes para la función del tejido, cicatrización de heridas, y múltiples patologías y un proceso clave es la angiogénesis, que se define como el crecimiento de nuevos vasos sanguíneos a partir de los ya existentes 1, 2. Para la ingeniería de tejidos nuevos vasos o el diseño de terapias basadas angiogénicos, la comprensión de la importancia de la dinámica celulares implicados en la angiogénesis es crítica. Sin embargo, este proceso es complejo. Puede variar en lugares específicos dentro de una red microvascular y consiste en múltiples tipos de células (es decir, células endoteliales, células de músculo liso, pericitos, macrófagos, células madre) y sistemas múltiples (redes linfáticas y redes neuronales). Aunque los modelos in vitro han contribuido enormemente a examinar la relación entre las diferentes células implicadas en la angiogénesis 3, su relevancia fisiológica puede ser socavado debido a thei r complejidad limitada y el hecho de que no reflejan estrechamente un escenario en vivo. Para superar estas limitaciones, los sistemas de cultivo tridimensional 3, ex vivo modelos tisulares 4, los sistemas de microfluidos 5, 6, 7 y modelos computacionales se han desarrollado e introducido en los últimos años. Sin embargo, todavía hay una necesidad de un modelo con capacidad de lapso de tiempo para investigar la angiogénesis en las redes microvasculares intactas ex vivo. El establecimiento de nuevos modelos de lapso de tiempo para los estudios de la angiogénesis con ese nivel de complejidad proporcionará una herramienta muy valiosa para comprender los mecanismos subyacentes que regulan la angiogénesis y para mejorar las terapias.
Un posible modelo que permite la investigación ex vivo de la angiogénesis a través de una red microvascular intacto es el modelo de cultivo de mesenterio de rata> 8. En un trabajo reciente, hemos demostrado que las redes microvasculares linfáticos sangre y permanecen viables después del cultivo. Más importante aún, el modelo de cultivo de mesenterio de rata se puede utilizar para investigar las interacciones funcionales de pericitos células endoteliales, la sangre y las conexiones de las células endoteliales linfáticas, y time-lapse. El objetivo de este trabajo es proporcionar a nuestro protocolo para el método de imagen de lapso de tiempo. Nuestros resultados representativos documentan los múltiples tipos de células que se mantienen viables después de la estimulación de la angiogénesis con suero y ofrecen ejemplos del uso de este método para la cuantificación de las respuestas angiogénicas específicos de tejido, así como estudios de seguimiento de células endoteliales.
Protocolo
Todos los experimentos y procedimientos con animales fueron aprobados por el Comité de Cuidado y Uso de Animales Institucional de la Universidad de Tulane (IACUC).
1. Procedimiento de configuración quirúrgica
- instrumentos quirúrgicos, equipos de autoclave, y suministros de cultivo antes de la cirugía. suministros quirúrgicos para cada rata incluyen: 1 sábana, 1 sábana con orificio precortado (0,5 pulgadas x 1,5 pulgadas) en el centro, gasas, y 1 almohadilla inferior absorbente. Los instrumentos quirúrgicos incluyen: 1 escalpelo con una cuchilla de número 10, 2 pares de pinzas, y un par de tijeras finas. Los suministros de cultivo incluyen: 1 sábana, 1 par de pinzas, y se prepararon para placas de 6 pocillos con filtros de policarbonato.
- Esterilizar una plataforma de plexiglás, una etapa quirúrgica y un espacio de mesa quirúrgica con 70% de etanol. Mantenga la etapa quirúrgica en un recipiente estéril hasta su uso.
- Crear una etapa quirúrgica mediante la perforación de una de aproximadamente 2 en por 1 en el agujero en el centro de una placa de cultivo de 100 mm. A continuación, utilice papel de lija para suavizarlos bordes afilados y añaden una capa de pegamento de silicona a los bordes del agujero para crear una superficie elevada para los tejidos.
- Por otra parte, el diseño de la etapa quirúrgica utilizando software de CAD y hacer un 3-D de impresión (Figura 1).
- Coloque una almohadilla inferior absorbente estéril y extienda una plataforma de plexiglás en la parte superior de la misma. Coloque la sábana, sin un agujero pre-corte, a través de una almohadilla caliente al lado de la almohadilla inferior absorbente.
- Pre-caliente solución salina estéril tamponada con fosfato (PBS), medios de comunicación y solución salina a 37 ° C. Coloque los medios de comunicación y PBS en placas de cultivo separadas encima de la resistencia de calentamiento y el lugar de solución salina en un tubo cónico de 50 ml al lado de la configuración quirúrgica.
- Asegúrese de que todos los paquetes se abren antes del comienzo de la cirugía para asegurar una manipulación estéril de todos los materiales. Una lista completa de las herramientas comunes que se utilizan en este procedimiento se muestran en el Tabla de materiales quirúrgicos y herramientas específicas.
2. MesenterLa recolección de tejidos y
- Uso de adultos ratas Wistar machos (350 ± 25 g; 6 - 8 semanas de edad). Otras cepas y edades de las ratas pueden ser sustituidos.
- Anestesiar la rata a través de una inyección intramuscular de ketamina (80 mg / kg de peso corporal) y xilazina (8 mg / kg de peso corporal). Confirmar la rata está bajo anestesia apretando entre los dedos para comprobar si hay una respuesta refleja; no debería haber ninguna. analgesia preventiva para este procedimiento terminal no es necesario.
- Afeitarse la región abdominal y eliminar el vello restante usando crema de depilación. Limpiar la piel abdominal dos veces con alcohol isopropílico al 70%, seguido de povidona-yodo. Para las toallitas el cirujano debe comenzar en el centro de la zona quirúrgica y se mueven hacia el exterior de la zona preparada de una manera circular para no solapar zonas que han sido lavadas previamente con la misma pieza de gasa estéril o bastoncillo de algodón estéril. A continuación, traslado de los animales a la configuración quirúrgica estéril y colocar encima de la plataforma de plexiglásformar.
- El uso de una hoja de bisturí, hacer un 0,75 en - 1,25 en la incisión en el intestino a partir del 1 de debajo del esternón. Tenga cuidado de no perforar el intestino o mesenterio (1 capa de la piel, 1 capa de tejido conectivo, y 1 capa de músculo).
- Colocar una sábana con un agujero pre-corte sobre la incisión y colocar una etapa quirúrgica estéril encima de la cortina. Asegúrese de que los alinea con la apertura de la incisión. Utilizar bastoncillos de algodón estériles para localizar y extraer el íleon a través de la boca del escenario quirúrgico.
- Tire de 6 - 8 ventanas mesentéricas a través de la fase usando bastoncillos de algodón, y tenga cuidado de no tocar las ventanas (Figura 1). Los tejidos se recogen típicamente de la región del íleon del intestino delgado comenzando cerca del ciego. Mantenga tejidos expuestos húmedo con solución salina estéril calentado según sea necesario con una jeringa estéril a gotear la solución.
- La eutanasia a las ratas mediante la inyección intracardíaca de pentobarbital sódico (0,2 ml por rata). Antes de retirar misenteric ventanas, aseguran que la rata se sacrificó palpando el corazón; no debería haber ningún pulso.
- Retire los tejidos mesenterio deseados mediante el uso de pinzas para agarrar la almohadilla de grasa y unas tijeras finas para cortar la ventana. Deja un borde de grasa (2 mm) alrededor de la ventana. Lavar los tejidos una vez en PBS estéril calentado y una vez en los medios de comunicación.
- Volver íleon exteriorizada a la cavidad abdominal y disponer de animales de acuerdo con las directrices institucionales.
3. Mesenterio cultivo tisular para estudios con lapso de tiempo
- Transferencia de suministros de cultivo tratadas en autoclave (ver sección 1.1) y los tejidos a una campana de flujo laminar estéril.
- Use pinzas para transferir cada tejido encima de una membrana de filtro de policarbonato. tejidos para discapacitados cerca de la almohadilla de grasa para evitar daños en el sistema vascular.
- propagar rápidamente el tejido usando la almohadilla de grasa, teniendo cuidado de no tocar la ventana. Invertir el inserto con el tejido en la parte inferior de una placa de 6 pocillos y cubrir con 3 ml de medio (Figura 1 ). medios típicos utilizados para este procedimiento incluye medio esencial mínimo (MEM) con 1% de penicilina estreptomicina (PenStrep) y 10% de suero bovino fetal (FBS). Los medios pueden complementarse con otros sueros y / o factores de crecimiento para estimular la angiogénesis.
- Repita los pasos 3.2 a 3.3 para cada tejido y la cultura en condiciones estándar de la incubadora (5% CO2, 37 ° C) durante un máximo de 5 días.
4. Time-lapse de Mesenterio Tissue
- En el día de formación de imágenes, complementar los medios de comunicación en cada pocillo con conjugado BSI-lectina y se incuba bajo condiciones de cultivo estándar para 30 min. Lavar tejidos dos veces con medio libre de lectina. BSI-lectina mancha permanecerá visible en el tejido del mesenterio para un máximo de 3 días de cultivo.
- La transferencia de la placa a una platina del microscopio. Identificar los vasos sanguíneos y linfáticos en función de su estructura de la morfología y de la red.
- Localizar una región de red deseada en cada tejido y tomar imágenes. Tomar nota de la proyección de imagenubicación para garantizar la misma región será capturado por las imágenes subsiguientes. Si se utiliza una plataforma motorizada, documentar las coordenadas.
- Devolver los tejidos a la incubadora y continuar con la cultura hasta el punto final deseado. Repita los pasos 4.1 a 4.3, según sea necesario en función de los puntos de tiempo experimentales deseados.
5. Tejido Immunolabeling
- Etiquetado BSI-lectina
- Incubar los tejidos durante 30 min a 37 ° C con 1:40 lectina conjugada con FITC en los medios (2,5 ml solución de anticuerpo por pocillo en placa de 6 pocillos), seguido de dos lavados con medios de comunicación. Para enjuagues, añadir medios y luego vuelva a colocar inmediatamente.
- Etiquetado Live / Dead
- Incubar los tejidos durante 10 min a 37 ° C con 1: 500 de etidio 2 mM homodímero-1 y 1: 500 1 mM de calceína AM en los medios (2,5 ml solución de anticuerpo por pocillo en placa de 6 pocillos), seguido de dos lavados con medios de comunicación.
- BSI-lectina / Etiquetado NG2
- tejidos separadas en un microscopio deslizaronE (1 - 2 tejidos / diapositiva) y dejar secar. Eliminar el exceso de grasa con un bisturí presionando firmemente para extirpar la grasa.
- Para reparar tejidos en metanol frío durante 30 minutos a -20 ° C. Lavar los tejidos con PBS (3 x 10 min).
- Para el etiquetado de anticuerpo primario incubar tejidos para 1 h a temperatura ambiente con 1: anticuerpo policlonal de conejo y de NG2 100 5% de suero de cabra normal (NGS). Lavar los tejidos con PBS (3 x 10 min).
- Para el etiquetado de anticuerpo secundario se incuba tejidos para 1 h a temperatura ambiente con 1: 100 de cabra anti-conejo conjugado con CY2 anticuerpo (GAR-CY2) y 5% NGS. Lavar los tejidos con PBS (3 x 10 min).
- Incubar los tejidos durante 30 min a temperatura ambiente con 01:40 lectina conjugada con FITC en PBS seguido de dos lavados con PBS. Para enjuagues, añadir PBS y luego reemplace inmediatamente.
- Para montar las diapositivas, con cobertura de tejidos 50:50 PBS y solución de glicerol y el cubreobjetos en la parte superior. Sellar los bordes de diapositivas utilizando el esmalte de uñas.
- LYVE-1 / Etiquetado PECAM
- Difundir los tejidos en un portaobjetos de microscopio (1 - 2 tejidos / diapositiva) y dejar secar. Eliminar el exceso de grasa con un bisturí presionando firmemente para extirpar la grasa.
- Para reparar tejidos en metanol frío durante 30 minutos a -20 ° C. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para el etiquetado de anticuerpo primario incubar tejidos para 1 h a temperatura ambiente con 1: monoclonal biotinilado anticuerpo CD31 200 del ratón y 1: 100 de conejo policlonal LYVE-1 de anticuerpos en + 0,1% de saponina + 2% de albúmina de suero bovino PBS (BSA) + 5% NGS . Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para el etiquetado de anticuerpo secundario, se incuban los tejidos durante 1 h a temperatura ambiente con 1: anticuerpo de estreptavidina 500 conjugado con Cy3 y 1: 100 GAR-CY2 en PBS + 0,1% de saponina + 2% BSA + 5% NGS. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para montar diapositivas, tejidos cubierta con 50:50 solución de PBS y glicerol y colocar un cubreobjetos en la parte superior. Sellar los bordes de diapositivas utilizando el esmalte de uñas.
- BrdU / BSI-lectina de etiquetado
- Añadir 1 mg / ml de BrdU a los medios de comunicación y la sustitución de los medios de tejido con una solución de BrdU. Incubar durante 2 horas a 37 ° C.
- Difundir los tejidos en un portaobjetos de microscopio (1 - 2 tejidos / diapositiva) y dejar secar. Eliminar el exceso de grasa con un bisturí presionando firmemente para extirpar la grasa.
- Para reparar tejidos en metanol frío durante 30 minutos a -20 ° C. Lavar los tejidos con PBS (3 x 10 min).
- Desnaturalizar el ADN de tejidos en HCl 2 M durante 1 hora a 37 ° C. Lavar los tejidos en PBS + 0,1% de saponina (3 x 10 min).
- Para el marcaje del anticuerpo primario, se incuban los tejidos durante 1 h a temperatura ambiente con 1: 100 de ratón monoclonal anti-BrdU en PBS + 0,1% de saponina + 2% BSA + 5% NGS. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para el etiquetado de anticuerpo secundario, se incuban los tejidos durante 1 h a temperatura ambiente con 1: anticuerpo 100 de cabra anti-ratón conjugado con Cy3 (GAM-Cy3) en PBS + 0,1% de saponina + 2% BSA + 5% NGS. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Incubar tejidos para 30 min a temperatura ambiente con una y cuarenta lectina conjugada con FITC en PBS seguido de dos lavados con PBS.
- Para montar las diapositivas, los tejidos de la cubierta con PBS 50:50 y solución de glicerol y el cubreobjetos en la parte superior. Sellar los bordes de diapositivas utilizando el esmalte de uñas.
- BSI-lectina etiquetado / CD11b
- Difundir los tejidos en un portaobjetos de microscopio (1 - 2 tejidos / diapositiva) y dejar secar. Eliminar el exceso de grasa con un bisturí presionando firmemente para extirpar la grasa.
- Para reparar tejidos en metanol frío durante 30 minutos a -20 ° C. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para el etiquetado de anticuerpo primario incubar tejidos para 1 h a temperatura ambiente con 1: 100 de ratón anti-rata CD11b en PBS + 0,1% de saponina + 2% BSA + 5% NGS. Lavar los tejidos con PBS + 0,1% de saponina (3 x 10 min).
- Para el etiquetado de anticuerpo secundario se incuba tejidos para 1 h a temperatura ambiente con 1: 100 GAM-Cy3 en PBS + 0,1% de saponina + 2% BSA + 5% NGS. Lavar los tejidos con PBS+ 0,1% de saponina (3 x 10 min).
- Incubar los tejidos durante 30 min a temperatura ambiente con 01:40 lectina conjugada con FITC en PBS seguido de dos lavados con PBS.
- Para montar las diapositivas, los tejidos de la cubierta con PBS 50:50 y solución de glicerol y el cubreobjetos en la parte superior. Sellar los bordes de diapositivas utilizando el esmalte de uñas.
Resultados
Después de 3 días de cultivo, los tejidos se marcaron con un kit de viabilidad / citotoxicidad en vivo / muerto para demostrar la viabilidad de la microvasculatura en el mesenterio de rata modelo de cultivo (Figura 2A). La mayoría de las células presentes en el mesenterio se mantuvo viable en la cultura en la que las células endoteliales fueron identificados en base a su ubicación en segmentos microvasculares. Proliferación de células endoteliales también se confirmó por medio del etiquetado de lectina / BrdU (Figura 2D). Células musculares lisas y pericitos presencia a lo largo de los vasos se confirmó con el etiquetado NG2 (Figura 2B). Las etiquetas de los LYVE1 y PECAM identificó ramificación redes microvasculares linfáticos y sangre y confirmó la mantenida linfático frente fenotipo de las células endoteliales en la sangre (Figura 2C).
La función de lapso de tiempo de este modelo se utilizó marcando el microvaredes scular con BSI-lectina en diferentes puntos temporales y la formación de imágenes de la misma región dentro de la red con el tiempo; esta capacidad es particularmente valioso para la investigación de respuestas angiogénicas específicas de tejido. La suplementación de los medios con 10% de suero causó una respuesta angiogénica sólido después de 3 días de estimulación. Además, los nuevos segmentos de vasos capilares y los brotes fueron identificados por día 5 de estimulación (Figura 3). El método de imagen de lapso de tiempo permitido para la comparación cuantitativa de las regiones de la red antes y después de la estimulación (Figura 4). Para este estudio representativo, lo que corrobora los resultados previos 9, el número de vasos por el área vascular y el número de brotes capilares por área vascular se cuantificaron una imagen 4X por tejido de. segmentos de los vasos sanguíneos se definieron como segmentos de células endoteliales de sangre lectina-positivas presentes entre dos puntos de ramificación y brotes capilares fueron definidos como ciegos terminado segmentos procedentes de un recipiente de acogida. Comparación de lapso de tiempo de las regiones de red también habilitado el seguimiento de los segmentos de células endoteliales (Figura 5) y la identificación de la sangre / de los vasos linfáticos mis-patrón (Figura 6). Etiquetado de tejidos cultivados para la lectina y CD11b, además, confirmó la presencia de los macrófagos residentes intersticiales (Figura 7) en redes de remodelación.

Figura 1. ventanas mesentéricos se encuentran sacando el intestino delgado a través de una etapa quirúrgica. La etapa quirúrgica fue diseñado y realizado mediante impresión 3-D. El agujero elíptico en el centro es de aproximadamente 2 por 1 en en (A). Las ventanas mesentéricos a continuación se extienden sobre la parte superior de un inserto de membrana, y el inserto se invirtió y se ponen en un pozo (B). Barra de escala = 2 cm.ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 2. Los vasos sanguíneos se mantienen viables en el modelo de cultivo de mesenterio de rata. Ensayo en vivo / muerto realizado después del cultivo mostró una alta proporción de células vivas (verde) a las células muertas (rojas) específicamente a lo largo de los vasos sanguíneos (A). Tejidos mesenterio se marcaron con lectina y anti-NG2, para identificar los pericitos (rojo), junto con los vasos (verde) y para confirmar que los diferentes tipos de células están presentes en los tejidos post-cultivo (B). Los tejidos también se marcaron contra PECAM / LYVE-1 para identificar los vasos sanguíneos (rojo) desde linfático (verde) vasos (C). Para investigar si las células microvasculares se someten a la proliferación en cultivo, tejidos mesenterio se marcaron con lectina / anti-BrdU . En los segmentos capilares marcados con lectina (verde), se confirmaron varias celdas a ser proliferativa (rojo) (D). Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. El tiempo de lapso de tiempo de formación de imágenes del mesenterio de rata permite observar la remodelación microvascular en el transcurso del cultivo. Se observó una respuesta angiogénica sólida después de 3 (B) y 5 días (C) de la cultura con la estimulación con suero 10%. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
archivos / ftp_upload / 55183 / 55183fig4.jpg "/>
Figura 4. redes microvasculares en el modelo de cultivo de mesenterio de rata se obtuvieron imágenes de antes y después de la angiogénesis. La comparación de la misma red marcado con lectina en el día 0 y día 3 (A, B) después de la estimulación con 10% de suero identifica nuevos vasos. Lectina también etiqueta una población de células intersticiales no identificados. La cuantificación de la densidad de los vasos (C, D) y el número de brotes capilares por área vascular (E, F), se confirmó un aumento en ambos métrica para cada tejido. Comparaciones después (día 3) por el tejido C, E) antes (día 0) y. D, F) La comparación entre el día 0 y el día 3 promedios usando una prueba t de Student pareada confirmó una diferencia significativa tanto en el número medio de segmentos de vasos (p <0,0001) y el número promedio de brotes (p <0,00001) por área vascular . Las barras blancas representan el día 0, y barras negras representan el día 3. ValuES son medias ± SEM. Para este análisis representativo, 13 tejidos se recogieron de 2 ratas. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5. La rata modelo de cultivo mesenterio se puede utilizar para investigar el destino isla vascular e incorporación en redes cercanas. Utilizando imágenes de lapso de tiempo, islas vasculares, que se define como segmentos desconectados endoteliales, fueron identificados en el día 0 y su conexión a la red cercana fue confirmada por el día 3 de estimulación post-angiogénico. Tejidos mesenterio fueron estimuladas con bFGF (A, B) y VEGF / PDFG-BB (C, D). flechas huecas muestran segmentos desconectados en el día 0 y flechas continuas representan la conexión a la isla Network. Las puntas de flecha indican la ubicación de las conexiones entre una isla vascular y la red cerca. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6. imágenes con lapso de tiempo demuestran la capacidad de observar linfático y los vasos sanguíneos del patrón. Linfático (l) los buques se puede distinguir de las arteriolas (a) y vénulas (v) sobre la base de la morfología de etiquetado en el día 0 (A). En el día 5 después de la estimulación con 10% de suero, morfología linfático se pierde y los vasos parecen haber integrado con los vasos sanguíneos angiogénicos cercanos (B). Barras de escala = 100 m. Haga clic aquí para ver una más grandeversión de esta figura.
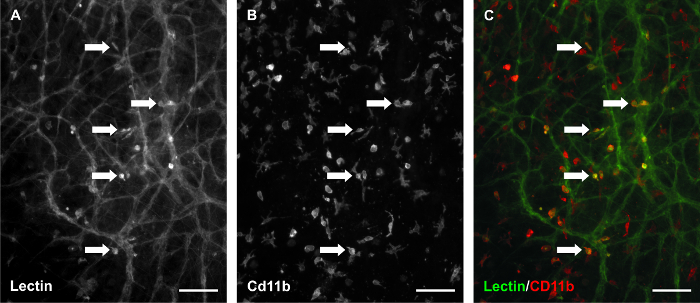
Figura 7. Los macrófagos permanecen presentes en los tejidos mesentéricos de rata. Lectina / CD11b co-etiquetado de los tejidos cultivados durante 3 días con 10% de suero sugieren que la lectina de células intersticiales positivos son un subconjunto de los macrófagos. (A) Una imagen representativa de etiquetado BSI-lectina. Etiquetado (B) CD11b en el mismo campo de visión. (C) La imagen fusionada. Las flechas identifican ejemplos de co-etiquetado. Barras de escala = 100 m. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo se documenta un método para utilizar el modelo de cultivo de mesenterio de rata como una herramienta ex vivo para time-lapse de crecimiento de la red microvascular. El trabajo previo en nuestro laboratorio ha establecido el uso de nuestro modelo para 1) la angiogénesis 8, 2) linfagiogénesis 8, 3) la interacción de células endoteliales de pericitos-8, y 4) las pruebas de drogas anti-angiogénico 9. La capacidad para obtener imágenes de tejidos mesenterio de rata cultivadas en múltiples momentos ofrece un ensayo cuantitativo para evaluar las respuestas de crecimiento específicos de tejido y el seguimiento de las interacciones célula-célula durante varios estímulos angiogénicos. El aumento de la proliferación de las células endoteliales durante la angiogénesis y la presencia de pericitos son consistentes con nuestros trabajos anteriores 8 y validar las interacciones dinámicas entre múltiples tipos de células durante la angiogénesis en los tejidos mesentéricos de rata en cultivo.
En comparación con los modelos de cultivo de tejidos de uso común y en los sistemas de cultivo de células in vitro, el modelo de cultivo de mesenterio de rata es único porque se produce el crecimiento dentro de una red microvascular intacta, real. Considere en contraste el ensayo del anillo aórtico, que se estableció para estudiar el brote angiogénico a partir de segmentos de aorta en un gel de colágeno 10. Mientras que la brotación en el anillo aórtico implica múltiples tipos de células, brotes capilares crecen fuera de los segmentos extirpados de la aorta, que es muy diferente de la situación in vivo. El modelo de cortes de cerebro es otro modelo ex vivo, pero es vacío de vasos linfáticos. Además, el modelo de cortes de cerebro no se ha demostrado que es capaz de formación de imágenes de lapso de tiempo antes y después de la estimulación angiogénica 11. Otro modelo ex vivo que ha sido introducido recientemente es el modelo de cultivo de retina. La ventaja del modelo de retina es que la angiogénesis se produce desde microvascu intactalar redes dentro del tejido 12, 13. Para estos modelos, las cepas de ratones GFP transgénicos se pueden utilizar para poder observar de capilares con el tiempo, pero, por desgracia, el mesenterio del ratón es avascular 14, eliminando la sustitución de los ratones mesenterio GFP-transgénicos para mesenterio de rata, tal como se utiliza en nuestro modelo. Además, se muestra que un simple etiquetado lectina de tejidos mesenterio de rata en cultivo es suficiente para determinar el crecimiento de la red en diferentes puntos temporales y en comparación con el otro ex modelos in vivo, nuestro modelo permite la observación simultánea de la sangre y las células endoteliales linfáticas.
BSI-lectina se utiliza en este documento para visualizar las redes microvasculares y detectar respuestas angiogénicas. Lectina es una estructura de la proteína que se une a glicoproteínas en células endoteliales y se seleccionó para este protocolo debido a su tiempo de incubación corto en comparación con antib endotelialody marcadores. Lectina es menos costoso que los anticuerpos y que no requiere la fijación; También se puede mezclar fácilmente en el medio de cultivo y se reemplazó con medio fresco después de la finalización del período de incubación. Si bien se necesitan futuros estudios para dilucidar los efectos potenciales de la técnica de etiquetado lectina en el proceso angiogénico, nuestros resultados representativos (Figura 4) demuestran que la angiogénesis robusto puede ser inducida y el trabajo previo 9 demuestra que la angiogénesis en las redes de lectina marcada puede ser inhibida por medio de la orientación Vascular endotelial Growth Factor (VEGF). marcadores de anticuerpos potencialmente se pueden utilizar como un enfoque de etiquetado alternativa cuando hay una necesidad de marcadores más específicos, o cuando hay una necesidad de investigar otros tipos de células que están presentes en las redes microvasculares tales como las células de músculo liso, pericitos, y nervios. Otro método potencial para las células visualizar sería transfección de genes.
La ventaja de utilizar el modelo de rata mesenterio de lapso de tiempo se ha destacado en los resultados representativos de este protocolo. La comparación de las imágenes antes y después del tratamiento reduce los problemas de variabilidad que influyen en el análisis estadístico no pareado. Las respuestas específicas de explantes variaban de 20% a 233% de aumento en la densidad de vasos y del 40% al 3.500% de aumento en la densidad de brotes. Las causas específicas de esta variación se desconocen, pero medir el crecimiento en el mismo tejido con el tiempo presentan la capacidad de confirmar las respuestas específicas de tejido.
Análisis comparativo de imágenes en diferentes puntos de tiempo durante el crecimiento microvascular también permite el seguimiento de las células endoteliales. Por ejemplo, nuestro laboratorio ha identificado islas vasculares como segmentos de células endoteliales en la zona de las redes microvasculares que se desconecta de redes cercanas 15, 16. Para confirmar que estas islas se conectan a la Networ cercanaK en respuesta a los estímulos angiogénicos, se utilizó el modelo de cultivo de mesenterio de rata. Como se muestra en la Figura 5, islas vasculares fueron rastreados después de la estimulación con el tejido de base del factor de crecimiento de fibroblastos (bFGF) o VEGF más factor de crecimiento derivado de plaquetas (PDGF). También hemos mostrado resultados similares estimulación con suero post (datos no mostrados aquí). Después de la estimulación de la angiogénesis, las islas desconectadas vasculares originalmente se encuentran conectados a las redes cercanas.
Otras aplicaciones potenciales del modelo de cultivo mesenterio de ratas podrían aprovechar la capacidad de investigar las relaciones entre los vasos linfáticos y sanguíneos y sus respectivas células endoteliales y el seguimiento del destino de las células intersticiales. Imágenes con lapso de tiempo de las mismas redes microvasculares antes y después de la estimulación con 10% de suero en este modelo proporcionan ejemplos de integración potencial vaso linfático-a-sangre (Figura 6). Antes de la estimulación, linfática y sanguínea Vessels se distingue sobre la base de la morfología del vaso. Después de la estimulación, linfático frente a la identidad de los vasos sanguíneos se volvió menos clara. El potencial de las interacciones de células endoteliales linfáticas / sangre es apoyado por la observación de PECAM células + / LYVE-1- endoteliales de sangre de conexión con PECAM + / LYVE-1 + células endoteliales linfáticas (datos no mostrados aquí). Estas observaciones apoyan el uso del modelo de cultivo mesenterio de rata para investigar linfático / sangre plasticidad de las células endoteliales. La figura 6A también destaca el etiquetado de lectina de las células intersticiales aparentes. Si bien este etiquetado es inconsistente y heterogéneo de tejido a tejido, lo hace destacar la presencia de células residentes tejido endógeno. CD11b etiquetado de tejidos cultivados (Figura 7) sugiere que estas células intersticiales de lectina-positivo podría ser un subconjunto de los macrófagos. Dado el interés emergente en la participación de los macrófagos en la angiogénesis 20, una fortaleza adicional de lamodelo podría ser su uso para realizar un seguimiento de la dinámica de los macrófagos en el tiempo.
Al igual que otros modelos ex vivo, una limitación actual de estudiar la angiogénesis en el modelo de cultivo de mesenterio de rata es la falta de flujo sanguíneo. El esfuerzo cortante causado por el flujo sanguíneo se ha demostrado que desempeñan un papel en la morfología celular endotelial y la proliferación, así como la angiogénesis 17, 18, 19. Para los resultados representativos presentados en la Figura 4, la ausencia de la tensión de cizallamiento solo puede haber sido suficiente para inducir una respuesta angiogénica en las redes cultivadas. Sin embargo, sabemos que en base a nuestra publicación inicial que caracteriza el modelo de cultivo de mesenterio de rata 8, que las causas de suplementación medios aumento de la angiogénesis en comparación con medio solo. sin duda, se necesitan más estudios que incorporan flujo dentro de las redes microvasculares cultivadas para imitar más de cerca laen el escenario vivo. enfoques potenciales para la incorporación de flujo podrían incluir la canalización de la red de alimentación arteriolas o incluso la canulación de las arterias más aguas arriba dentro de la frontera de la grasa mesentérica ventanas. Sin embargo, a pesar de la falta de flujo, la viabilidad de múltiples tipos de células, el mantenimiento de la sangre y las redes microvasculares linfáticos, y la proliferación celular durante la angiogénesis es compatible con un mayor nivel relativo del modelo de cultivo de mesenterio de rata de la complejidad en comparación con células basado en modelos in vitro.
En conclusión, este protocolo describe un método simple, reproducible ex vivo para obtener imágenes de respuestas angiogénicas en las redes microvasculares intactas. Dicho método ofrece una alternativa a la célula basado en modelos in vitro para la evaluación de la dinámica de células angiogénicas en lugares específicos dentro de un entorno de red. El método también ofrece una nueva herramienta para la investigación de la angiogénesis, Linfangiogénesis y sangre / linfáticos mis-golpeteoNing simultáneamente.
Divulgaciones
The authors declare that they have no competing financial interests.
Agradecimientos
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
Materiales
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
Referencias
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados