Method Article
Un
Dans cet article
Résumé
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
Résumé
Angiogenèse, définie comme la croissance de nouveaux vaisseaux sanguins à partir de vaisseaux préexistants, implique des cellules endothéliales, péricytes, les cellules musculaires lisses, les cellules immunitaires, et la coordination avec les vaisseaux lymphatiques et les nerfs. Le multi-cellulaire, les interactions multi-système nécessite l'enquête de l'angiogenèse dans un environnement physiologiquement pertinents. Ainsi, alors que l'utilisation de modèles in vitro de cultures cellulaires ont fourni des indications mécanistes, une critique commune est qu'ils ne récapitulent la complexité associée à un réseau microvasculaire. L'objectif de ce protocole est de démontrer la capacité de faire des comparaisons time-lapse de réseaux microvasculaires intacts avant et après stimulation de l'angiogenèse dans les tissus mésentère de rat en culture. tissus de culture contiennent des réseaux microvasculaires qui maintiennent leur hiérarchie. marquage immunohistochimique confirme la présence de cellules endothéliales, cellules musculaires lisses et les pericytes, les vaisseaux sanguins et les vaisseaux lymphatiques. Dans unddition, marquage de tissus avec une lectine BSI permet de comparer le temps écoulé des régions du réseau local avant et après la stimulation du facteur de croissance ou du sérum, caractérisé par une augmentation de la germination et de la densité capillaire du récipient. En comparaison avec les modèles de culture cellulaire communs, cette méthode fournit un outil pour les études endothéliales de la lignée cellulaire et évaluation du médicament angiogénique spécifique de tissu dans les réseaux microvasculaires physiologiquement pertinents.
Introduction
La croissance du réseau microvasculaire et le remodelage des dénominateurs communs pour la fonction des tissus, la cicatrisation des plaies, et de multiples pathologies et un processus clé est l' angiogenèse, définie comme la croissance de nouveaux vaisseaux sanguins à partir de ceux qui existent déjà 1, 2. Pour les tissus d'ingénierie de nouveaux navires ou la conception de thérapies angiogéniques, la compréhension de l'importance de la dynamique cellulaires impliqués dans l'angiogenèse est critique. Cependant, ce procédé est complexe. Elle peut varier à des emplacements spécifiques à l' intérieur d' un réseau microvasculaire et implique plusieurs types de cellules ( par exemple les cellules endothéliales, les cellules musculaires lisses, des pericytes, des macrophages, des cellules souches) et plusieurs systèmes (réseaux lymphatiques et des réseaux de neurones). Bien que les modèles in vitro ont contribué énormément à l' examen de la relation entre les différentes cellules impliquées dans l' angiogenèse 3, leur pertinence physiologique peut être compromise en raison de Thei r complexité limitée et le fait qu'ils ne reflètent pas étroitement un scénario in vivo. Pour surmonter ces limitations, les systèmes de culture en trois dimensions 3 modèles de tissus, ex vivo 4, les systèmes microfluidiques 5, 6 et 7 modèles de calcul ont été élaborés et mis en place au cours des dernières années. Cependant, il existe encore un besoin d'un modèle avec une capacité time-lapse pour étudier l' angiogenèse dans les réseaux microvasculaires intacts ex vivo. La mise en place de nouveaux modèles time-lapse pour les études de l'angiogenèse avec ce niveau de complexité fournira un outil précieux pour comprendre les mécanismes sous-jacents qui régissent l'angiogenèse et d'améliorer les thérapies.
Un modèle de potentiel qui permet à l'étude ex vivo de l' angiogenèse à travers un réseau microvasculaire intacte est le mésentère modèle de culture de rat> 8. Dans des travaux récents, nous avons démontré que le sang et les réseaux microvasculaires lymphatiques restent viables après culture. Plus important encore, le mésentère modèle de culture de rat peut être utilisé pour étudier les interactions fonctionnelles de péricytes-endothélial cellulaires, le sang et les connexions des cellules endothéliales lymphatiques et imagerie time-lapse. L'objectif de ce document est de fournir notre protocole pour la méthode d'imagerie time-lapse. Nos résultats représentatifs de documenter les multiples types de cellules qui demeurent viables après la stimulation de l'angiogenèse avec du sérum et offrent des exemples d'utilisation de cette méthode pour quantifier les réponses angiogéniques spécifiques de tissus ainsi que des études de suivi des cellules endothéliales.
Protocole
Toutes les expériences et les procédures animales ont été approuvées par Institutional Care Committee et l'utilisation des animaux de l'Université de Tulane (IACUC).
1. Configuration de la procédure chirurgicale
- instruments autoclaves, des fournitures chirurgicales et les fournitures de culture avant la chirurgie. fournitures chirurgicales pour chaque rat comprennent: 1 drap, 1 drap avec trou prédécoupé (0,5 po x 1,5 po) dans le centre, des tampons de gaze, et 1 underpad absorbant. Les instruments chirurgicaux comprennent: 1 scalpel avec une lame numéro 10, 2 paires de pinces, et une paire de ciseaux fins. fournitures de culture comprennent: 1 drap, 1 paire de pinces, et préparés à 6 puits inserts de plaque avec des filtres en polycarbonate.
- Stériliser une plate-forme en plexiglas, une étape chirurgicale et un espace de paillasse chirurgical avec 70% d'éthanol. Gardez l'étape chirurgicale dans un bol stérile jusqu'à utilisation.
- Créer une étape chirurgicale par le forage d'un environ 2 par 1 dans le trou dans le centre d'une boîte de culture de 100 mm. Ensuite, utilisez du papier de verre pour lisserles arêtes coupantes et ajouter une couche de colle silicone sur les bords du trou pour créer une surface surélevée pour les tissus.
- Vous pouvez également concevoir la scène chirurgicale en utilisant un logiciel de CAO et de faire en 3-D impression (Figure 1).
- Placer un underpad absorbant stérile et posez une plate-forme de plexiglass sur le dessus de celui-ci. Placez le drap, sans un trou pré-coupé, sur un coussin chauffant à côté de la thibaude absorbant.
- Préchauffer une solution saline tamponnée au phosphate stérile (PBS), les médias et une solution saline à 37 ° C. La place des médias et du PBS dans des boîtes de culture séparées au sommet du coussin chauffant et lieu de solution saline dans un tube de 50 ml conique à côté de la configuration chirurgicale.
- Assurez-vous que tous les paquets sont ouverts avant le début de la chirurgie pour assurer une manipulation stérile de tous les matériaux. Une liste complète des outils communs utilisés dans cette procédure sont répertoriés dans la Table des matières et outils chirurgicaux spécifiques.
2. MesenterLa récolte de tissus y
- Utiliser des rats adultes mâles Wistar (350 ± 25 g; 6 - 8 semaines d'âge). D'autres souches et l'âge des rats peuvent être substitués.
- Anesthésier le rat par une injection intramusculaire de kétamine (80 mg / kg de poids corporel) et de xylazine (8 mg / kg de poids corporel). Vérifiez que le rat est sous anesthésie par pincement entre les orteils pour vérifier une réponse réflexe; il devrait y avoir aucun. analgésie préemptive pour cette procédure terminal est pas nécessaire.
- Rasez la région abdominale et enlever restante cheveux à l'aide de la crème d'épilation. Essuyer la peau abdominale deux fois avec 70% d'alcool isopropylique suivie povidone-iode. Pour les lingettes, le chirurgien doit commencer au centre du site chirurgical et de se déplacer vers l'extérieur de la zone préparée de manière circulaire pour ne pas recouvrir les zones qui ont été préalablement lavés avec le même morceau de gaze stérile ou un tampon de coton stérile. Puis transfert animal à l'installation chirurgicale stérile et placer au sommet de la plate plexiglassforme.
- En utilisant une lame de scalpel, faire un 0,75 - 1,25 en incision dans l'intestin à partir du 1 au-dessous du sternum. Veillez à ne pas percer l'intestin ou mésentère (1 couche de la peau, 1 couche de tissu conjonctif, et 1 couche de muscle).
- Placez un drap avec un trou pré-découpé sur l'incision et placez un stade chirurgical stérile au-dessus du drap. Assurer l'ouverture aligne avec l'incision. Utiliser des applicateurs de coton-tige stérile pour localiser et extraire l'iléon à travers l'ouverture de scène chirurgicale.
- Tirez 6 - 8 fenêtres mésentériques à travers la scène en utilisant des applicateurs de coton-tige, et faire attention à ne pas toucher les fenêtres (Figure 1). Les tissus sont généralement récoltées à partir de la zone de l'iléon de l'intestin grêle, en commençant près du caecum. Gardez les tissus exposés humide avec une solution saline stérile chauffée au besoin à l'aide d'une seringue stérile au goutte à goutte la solution.
- Euthanasier le rat par injection intracardiaque de pentobarbital sodique (0,2 ml par rat). Avant de me retirerfenêtres senteric, assurent le rat est euthanasié en palpant le cœur; il devrait y avoir aucune impulsion.
- Retirer les tissus mésentère souhaités à l'aide des pinces pour saisir le coussinet adipeux et des ciseaux fins pour couper la fenêtre. Laissez une bordure de graisse (2 mm) autour de la fenêtre. Laver les tissus une fois dans réchauffé PBS stérile et une fois dans les médias.
- Retour iléon extériorisé à la cavité abdominale et de disposer des animaux selon les directives institutionnelles.
3. Mesentery Tissue Culture d'études de time-lapse
- Transfert des fournitures autoclavés de culture (voir section 1.1) et les tissus à une hotte à flux laminaire stérile.
- Utilisez des pinces pour transférer chaque tissu au sommet d'une membrane filtrante de polycarbonate. tissus d'appui par le coussinet adipeux pour éviter d'endommager le système vasculaire.
- répandre rapidement le tissu en utilisant le coussinet adipeux, en faisant attention à ne pas toucher la fenêtre. Inversez l'insert avec le tissu dans le fond d'une plaque à 6 puits et couvrir avec 3 ml de médias (Figure 1 ). média typique utilisé pour cette procédure comprend Essential Media minimum (MEM) avec 1% de pénicilline streptomycine (Penstrep) et 10% de sérum bovin fœtal (FBS). Les médias peuvent être complétés par d'autres sérums et / ou des facteurs de croissance pour stimuler l'angiogenèse.
- Répétez les étapes 3.2 à 3.3 pour chaque tissu et de la culture dans des conditions d'incubation standards (5% de CO 2, 37 ° C) pendant 5 jours.
4. Time-Lapse Imaging de Mesentery Tissue
- Le jour de l'imagerie, de compléter les supports dans chaque puits avec des conjugués BSI lectine et incuber dans des conditions standard de culture pendant 30 min. Laver les tissus à deux reprises avec des médias libres lectine. BSI-lectine tache restera visible sur le tissu mésentère pour 3 jours de culture.
- Transférer la plaque à un étage de microscope. Identifier les vaisseaux sanguins et lymphatiques en fonction de leur morphologie et la structure de réseau.
- Localiser une région de réseau souhaité sur chaque tissu et prendre des images. Prendre note de l'imagerieemplacement pour assurer la même région sera capturé pour les images suivantes. Si vous utilisez une platine motorisée, documenter les coordonnées.
- tissus Retour à l'incubateur et continuer à la culture jusqu'au point final souhaité. Répétez les étapes 4/1 à 4/3, au besoin en fonction des points souhaités de temps expérimentaux.
5. Tissue immunomarquage
- BSI-lectine Étiquetage
- Incuber les tissus pendant 30 min à 37 ° C avec 1:40 lectine conjuguée au FITC dans les médias (solution d'anticorps mL 2,5 par puits dans une plaque de 6 puits) suivie de deux rinçages avec les médias. Pour rinçages, ajouter des médias, puis remplacer immédiatement.
- Étiquetage en direct / Dead
- Incuber les tissus pendant 10 min à 37 ° C avec 1: 500 mM éthidium 2 homodimère-1 et 1: 500 1 mM calcéine AM dans les médias (solution d'anticorps mL 2,5 par puits dans une plaque de 6 puits) suivie de deux rinçages avec les médias.
- BSI-lectine / NG2 Étiquetage
- tissus Spread sur un microscope glissaiente (1 - 2 tissus / slide) et laisser sécher. Retirer l'excès de graisse avec un scalpel en appuyant fermement pour exciser la graisse.
- Fixer les tissus dans le méthanol froid pendant 30 min à -20 ° C. Laver les tissus avec du PBS (3 x 10 mn).
- Pour l'étiquetage des anticorps primaire incuber les tissus pendant 1 h à température ambiante avec 1: 100 lapin anticorps polyclonaux de NG2 et 5% de sérum de chèvre normal (NGS). Laver les tissus avec du PBS (3 x 10 mn).
- Pour l'étiquetage des anticorps secondaire incuber les tissus pendant 1 h à température ambiante avec 1: 100 chèvre anti-lapin CY2 conjugué anticorps (GAR-CY2) et 5% NGS. Laver les tissus avec du PBS (3 x 10 mn).
- Incuber les tissus pendant 30 min à température ambiante avec de la lectine 01:40 conjugué au FITC dans du PBS suivi par deux rinçages avec du PBS. Pour rinçages, ajouter du PBS, puis remplacer immédiatement.
- Pour monter les diapositives, couvrir les tissus avec 50:50 PBS et solution de glycérol et lieu lamelle sur le dessus. Sceller les bords de la lame à l'aide de vernis à ongles.
- LYVE-1 / PECAM étiquetage
- Étaler les tissus sur une lame de microscope (1 - 2 tissus / glissière) et laisser sécher. Retirer l'excès de graisse avec un scalpel en appuyant fermement pour exciser la graisse.
- Fixer les tissus dans le méthanol froid pendant 30 min à -20 ° C. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage de l'anticorps primaire incuber les tissus pendant 1 h à température ambiante avec 1: anticorps monoclonal biotinylé anticorps CD31 200 de souris et 1: 100 polyclonal de lapin LYVE-1 anticorps dans du PBS + 0,1% de saponine + 2% de sérum albumine bovine (BSA) + 5% de NGS . Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage de l'anticorps secondaire, incuber les tissus pendant 1 h à température ambiante avec 1: 500 d'anticorps streptavidine conjugué à Cy3 et 1: 100 GAR-CY2 dans du PBS + 0,1% de saponine + BSA 2% + 5% de NGS. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour monter des diapositives, des tissus de couverture avec 50:50 PBS et de glycérol solution et placer une lamelle sur le dessus. Sceller les bords de la lame à l'aide de vernis à ongles.
- BrdU / BSI-lectine Étiquetage
- Ajouter 1 mg / mL BrdU aux médias et remplacer le support de tissu avec une solution de BrdU. Incuber pendant 2 h à 37 ° C.
- Étaler les tissus sur une lame de microscope (1 - 2 tissus / glissière) et laisser sécher. Retirer l'excès de graisse avec un scalpel en appuyant fermement pour exciser la graisse.
- Fixer les tissus dans le méthanol froid pendant 30 min à -20 ° C. Laver les tissus avec du PBS (3 x 10 mn).
- Dénaturer l'ADN de tissu dans du HCl 2 M pendant 1 h à 37 ° C. Laver les tissus dans du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage de l'anticorps primaire, l'incubation des tissus pendant 1 h à température ambiante avec 1: 100 monoclonal de souris anti-BrdU dans du PBS + 0,1% de saponine + BSA 2% + 5% de NGS. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage de l'anticorps secondaire, incuber les tissus pendant 1 h à température ambiante avec 1: 100 d'anticorps de chèvre anti-souris conjugué à Cy3 (GAM-Cy3) dans du PBS + 0,1% de saponine + BSA 2% + 5% de NGS. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Incuber les tissus pendant 30 min à température ambiante avec 1:40 lectine conjuguée au FITC dans du PBS suivi par deux rinçages avec du PBS.
- Pour monter des diapositives, des tissus de couverture avec 50:50 PBS et solution de glycérol et lieu lamelle sur le dessus. Sceller les bords de la lame à l'aide de vernis à ongles.
- BSI-lectine / étiquetage CD11b
- Étaler les tissus sur une lame de microscope (1 - 2 tissus / glissière) et laisser sécher. Retirer l'excès de graisse avec un scalpel en appuyant fermement pour exciser la graisse.
- Fixer les tissus dans le méthanol froid pendant 30 min à -20 ° C. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage de l'anticorps primaire incuber les tissus pendant 1 h à température ambiante avec 1: 100 souris anti-CD11b rat dans du PBS + 0,1% de saponine + BSA 2% + 5% de NGS. Laver les tissus avec du PBS + 0,1% de saponine (3 x 10 mn).
- Pour le marquage d'un anticorps secondaire incuber les tissus pendant 1 h à température ambiante avec 1: 100 GAM-Cy3 dans du PBS + 0,1% de saponine + BSA 2% + 5% de NGS. Laver les tissus avec du PBS+ 0,1% saponine (3 x 10 mn).
- Incuber les tissus pendant 30 min à température ambiante avec de la lectine 01:40 conjugué au FITC dans du PBS suivi par deux rinçages avec du PBS.
- Pour monter des diapositives, des tissus de couverture avec 50:50 PBS et solution de glycérol et lieu lamelle sur le dessus. Sceller les bords de la lame à l'aide de vernis à ongles.
Résultats
Après 3 jours de culture, les tissus ont été marqués avec un kit mort en direct / viabilité / cytotoxicité pour démontrer la viabilité de la microvascularisation dans le modèle de culture mésentère de rat (figure 2A). La majorité des cellules présentes dans le mésentère est restée viable dans la culture où les cellules endothéliales ont été identifiées en fonction de leur emplacement dans les segments microvasculaires. La prolifération des cellules endothéliales a également été confirmée par marquage lectine / BrdU (figure 2D). Cellule musculaire lisse et la présence de péricytes le long des vaisseaux a été confirmé avec l' étiquetage des NG2 (figure 2B). Étiquetage pour LYVE1 et PECAM identifiés ramification des réseaux lymphatiques et microvasculaires du sang et a confirmé le phénotype maintenu lymphatique contre des cellules endothéliales de sang (figure 2C).
La fonction time-lapse de ce modèle a été utilisé par l'étiquetage de la microvaréseaux scular avec BSI-lectine à différents points de temps et l'imagerie de la même région au sein du réseau au fil du temps; cette capacité est particulièrement utile pour étudier les réponses angiogéniques spécifiques de tissus. La supplémentation de milieux avec 10% de sérum a provoqué une réponse angiogénique solide après 3 jours de stimulation. En outre, de nouveaux segments de vaisseaux et les pousses capillaires ont été identifiés par jour 5 de stimulation (Figure 3). Procédé d'imagerie time-lapse a permis la comparaison quantitative des régions du réseau avant et après la stimulation (figure 4). Pour cette étude représentative, ce qui corrobore nos résultats précédents 9, le nombre de navires par zone vasculaire et le nombre de germes capillaires par zone vasculaire ont été quantifiées d'une image 4X par le tissu. segments de vaisseaux sanguins ont été définis comme des segments de cellules endothéliales de sang lectine positifs présents entre deux points de branchement et les pousses capillaires ont été définis comme aveugle terminé des segments provenant d'un vaisseau hôte. Comparaison Time-lapse des régions de réseau a également permis le suivi des segments de cellules endothéliales (Figure 5) et de l' identification de sang / vaisseaux lymphatiques mal motif (figure 6). Étiquetage des tissus cultivés pour lectine et CD11b en outre confirmé la présence de macrophages résidents interstitiels (figure 7) dans les réseaux de remodelage.

Figure 1. fenêtres mésentériques étaient situées en tirant de l'intestin grêle par une étape chirurgicale. L'étape chirurgicale a été conçu et réalisé par l'impression 3-D. Le trou elliptique dans le centre est d' environ 2 par 1 (A). Les fenêtres mésentériques ont ensuite été étalés sur le dessus d'un insert de membrane, et l'insert a été inversées et placées dans un puits (B). Barre d'échelle = 2 cm.ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2. Les vaisseaux sanguins restent viables dans le modèle de culture mésentère de rat. Test Live / morts effectuée après la culture a montré un taux élevé de cellules vivantes (vert) à cellules mortes (rouges) spécifiquement le long des vaisseaux sanguins (A). Tissus Mésentère ont été marqués avec lectine et anti-NG2, pour identifier les péricytes (rouge) aux côtés de navires (vert) et de confirmer que les différents types de cellules sont présentes dans les tissus post-culture (B). Les tissus ont été également marqués contre PECAM / LYVE-1 pour identifier le sang (rouge) les navires de lymphatique (vert) des navires (C). Pour étudier si les cellules microvasculaires subissent une prolifération dans la culture, les tissus mésentère ont été marquées avec lectine / anti-BrdU . Sur les segments capillaires marqués avec lectine (vert), plusieurs cellules ont été confirmées comme proliférative (rouge) (D). Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 3. Time-lapse imagerie du mésentère de rat permet l' observation de remodelage microvasculaire au cours de la culture. Une réponse angiogénique solide a été observée après 3 (B) et 5 jours (C) de la culture avec une stimulation sérique de 10%. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
fichiers / ftp_upload / 55183 / 55183fig4.jpg "/>
Figure 4. Les réseaux microvasculaires dans le modèle de culture mésentère de rat ont été imagées avant et après l' angiogenèse. Comparaison du même réseau marqué avec lectine le jour 0 et le jour 3 (A, B) post-stimulation avec 10% de sérum identifie de nouveaux navires. Lectine marque également une population de cellules interstitielles non identifiés. La quantification de la densité de la cuve (C, D) et le nombre de pousses capillaires par unité de surface vasculaire (E, F) a confirmé une augmentation des paramètres pour chaque tissu. C, E) Avant (jour 0) et après (jour 3) les comparaisons par les tissus. D, F) Comparaison entre le jour 0 et le jour 3 en moyenne en utilisant un test t de Student apparié a confirmé une différence significative dans le nombre moyen de segments de vaisseaux (p <0,0001) et le nombre moyen de germes (p <0,00001) par zone vasculaire . Les barres blanches représentent jour 0, et les barres noires représentent jour 3. Values sont des moyennes ± SEM. Pour cette analyse représentative, 13 tissus ont été récoltés à partir de 2 rats. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5. Le mésentère modèle de culture de rat peut être utilisé pour enquêter sur le sort vasculaire de l' île et l' incorporation dans les réseaux à proximité. En utilisant l'imagerie time-lapse, îles vasculaires, défini comme segments endothéliales déconnectés, ont été identifiés le jour 0 et leur connexion au réseau à proximité a été confirmé par jour 3 stimulation post-angiogénique. Mésentère tissus ont été stimulées avec bFGF (A, B) et le VEGF / PDFG-BB (C, D). flèches creuses montrent des segments déconnectés le jour 0 et flèches pleines représentent la connexion de l'île à l'network. Arrowheads indiquent l'emplacement des connexions entre une île vasculaire et le réseau à proximité. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 6. images Time-lapse démontrent la capacité d'observer lymphatique et des vaisseaux sanguins patterning. Lymphatique (l) des navires peut être distingué des artérioles (a) et veinules (v) basée sur l' étiquetage morphologie au jour 0 (A). Au jour 5 après stimulation avec 10% de sérum, la morphologie lymphatique est perdue et les vaisseaux semblent avoir intégré les vaisseaux sanguins angiogéniques voisines (B). Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une plus grandeversion de ce chiffre.
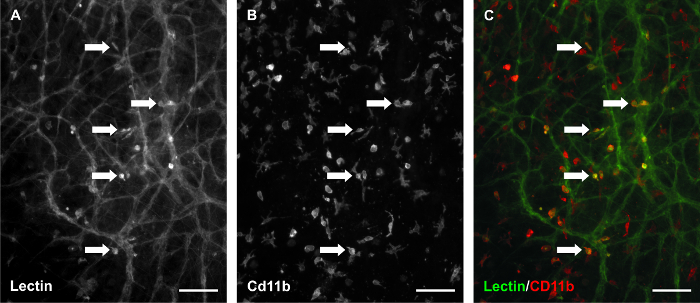
Figure 7. Macrophages restent présents dans les tissus mésentériques de rat en culture. Lectine / CD11b co-marquage des tissus cultivés pendant 3 jours avec 10% de sérum suggèrent que les cellules interstitielles positives lectine sont un sous-ensemble des macrophages. (A) Une image représentative de l' étiquetage BSI-lectine. Étiquetage (B) CD11b dans le même champ de vision. (C) L'image fusionnée. Les flèches identifient des exemples de co-marquage. Les barres d'échelle = 100 um. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Ce protocole documente une méthode pour utiliser le modèle de culture de mésentère de rat comme un ex vivo outil pour imagerie time-lapse de la croissance du réseau microvasculaire. Des travaux antérieurs dans notre laboratoire a établi l'utilisation de notre modèle pour 1) l' angiogenèse 8, 2) lymphangiogenèse 8, 3) les interactions cellulaires péricytes-endothélial 8, et 4) le dépistage des drogues anti-angiogénique 9. La possibilité pour l'imagerie des tissus mésentère de rat en culture à de multiples points de temps offre un dosage quantitatif pour évaluer les réponses de croissance à spécificité tissulaire et le suivi des interactions entre les cellules lors de divers stimuli angiogéniques. La prolifération accrue des cellules endothéliales lors de l' angiogenèse et la présence de péricytes sont compatibles avec nos travaux précédents 8 et valider les interactions dynamiques entre plusieurs types de cellules au cours de l' angiogenèse dans les tissus mésentériques de rat en culture.
Par rapport aux modèles de culture de tissus couramment utilisés et dans les systèmes de culture cellulaire in vitro, le mésentère modèle de culture de rat est unique parce que la croissance se produit au sein d' un, réseau réel microvasculaire intact. Considérons au contraire le test de l' anneau aortique, qui a été créé pour étudier la germination angiogénique à partir de segments de l' aorte dans un gel de collagène 10. Alors que la germination dans l'anneau aortique implique plusieurs types de cellules, les germes capillaires se développent hors des segments excisés de l'aorte, qui est très différent du scénario in vivo. Le modèle de tranches de cerveau est un autre modèle ex vivo, mais il est dépourvu de vaisseaux lymphatiques. En outre, le modèle de tranche de cerveau n'a pas été montré pour être capable d'imagerie time-lapse avant et après stimulation angiogénique 11. Un autre modèle ex vivo qui a été récemment mis en place est le modèle de culture rétine. L'avantage du modèle de rétine est que l'angiogenèse se produit à partir microvascu intacteréseaux lar dans le tissu 12, 13. Pour ces modèles, les souches de souris GFP transgénique peuvent être utilisés pour être en mesure d'observer capillaire germination au fil du temps, mais malheureusement, le mésentère de la souris est avasculaire 14, ce qui élimine la substitution des souris mésentère GFP-transgénique pour mésentère de rat, tel qu'il est utilisé dans notre modèle. De plus, nous montrons qu'un étiquetage lectine simple des tissus du mésentère de rat en culture est suffisante pour déterminer la croissance du réseau à différents points de temps et par rapport aux autres modèles ex vivo, notre modèle permet l'observation simultanée de sang et des cellules endothéliales lymphatiques.
BSI-lectine a été utilisé dans le présent document pour visualiser les réseaux microvasculaires et détecter les réponses angiogéniques. Lectine est une structure de protéine qui se lie à des glycoprotéines sur les cellules endothéliales et a été choisi pour ce protocole en raison de sa courte durée d'incubation par rapport à ANTIB endothélialmarqueurs ody. Lectine est moins coûteux que des anticorps, et elle ne nécessite pas de fixation; il peut aussi être facilement mélangé dans les milieux de culture et remplacé par un milieu frais après la fin de la période d'incubation. Alors que les études futures sont nécessaires pour élucider les effets potentiels de la technique de marquage lectine sur le processus angiogénique, nos résultats représentatifs (figure 4) montrent que l' angiogenèse robuste peut être induite et les travaux antérieurs 9 démontre que l' angiogenèse dans les réseaux de lectine marqué peut être inhibée par ciblage Vascular Endothelial Growth Factor (VEGF). des marqueurs d'anticorps peuvent potentiellement être utilisés en tant que méthode d'étiquetage alternative quand il y a un besoin pour des marqueurs plus spécifiques, ou quand il est nécessaire d'examiner les autres types de cellules qui sont présentes dans les réseaux microvasculaires telles que les cellules musculaires lisses, des pericytes et des nerfs. Une autre méthode potentielle pour les cellules de visualisation serait transfection génique.
L'avantage d'utiliser le modèle de mésentère de rat time-lapse a été mis en évidence dans les résultats représentatifs pour ce protocole. La comparaison des images avant et après le traitement réduit les problèmes de variabilité qui influent sur l'analyse statistique non apparié. Les réponses spécifiques aux explants ont varié de 20% à 233% d'augmentation de la densité des vaisseaux et de 40% à 3500% d'augmentation de la densité de graines germées. Les causes spécifiques de cette variation restent inconnues, mais la mesure de la croissance dans le même tissu au fil du temps présentent la capacité de confirmer les réponses spécifiques des tissus.
analyse comparative des images à différents moments au cours de la croissance microvasculaire permet également le suivi des cellules endothéliales. Par exemple, notre laboratoire a identifié les îles vasculaires que les segments de cellules endothéliales dans le voisinage des réseaux microvasculaires qui sont déconnectés des réseaux à proximité 15, 16. Pour confirmer que ces îles se connectent au networ à proximiték en réponse à des stimuli angiogéniques, le modèle de culture mésentère de rat a été utilisé. Comme on le voit sur la figure 5, les îles vasculaires ont été suivies après la stimulation de tissu avec le facteur de croissance des fibroblastes de base (bFGF) ou du facteur de croissance VEGF , plus de dérivé des plaquettes (PDGF). Nous avons également montré des résultats similaires stimulation post sérique (données non présentées ici). Après la stimulation de l'angiogenèse, les îles vasculaires à l'origine déconnectés se trouvent connectés à des réseaux à proximité.
D'autres applications potentielles du mésentère modèle de culture de rat pourrait tirer parti de la capacité d'enquêter sur les relations entre les lymphatiques et les vaisseaux sanguins et leurs cellules endothéliales respectives et le suivi du sort des cellules interstitielles. Images Time-lapse des mêmes réseaux microvasculaires avant et après stimulation avec du sérum de 10% dans ce modèle ont fourni des exemples d'intégration potentielle lymphatique à des vaisseaux sanguins (figure 6). Avant stimulation, lymphatique et sanguin vessels ont été distingués en fonction de la morphologie navire. Après stimulation, lymphatique contre l'identité des vaisseaux sanguins est devenu moins clair. Le potentiel d'interactions cellules endothéliales lymphatiques / sanguins est prise en charge par l'observation de PECAM cellules + / LYVE-1- sang endothéliales liaison avec PECAM + / LYVE-1 + cellules endothéliales lymphatiques (données non présentées ici). Ces observations confirment l'utilisation du modèle de culture mésentère de rat pour étudier lymphatique / sang cellule endothéliale plasticité. La figure 6A souligne également l'étiquetage de la lectine des cellules interstitielles apparentes. Bien que cette étiquette est incohérente et hétérogène de tissu à l'autre, cela souligne la présence de cellules résidentes du tissu endogène. Étiquetage CD11b des tissus cultivés (figure 7) suggère que ces cellules interstitielles lectine positif pourrait être un sous-ensemble de macrophages. Compte tenu de l'intérêt croissant de l'implication des macrophages dans l' angiogenèse 20, une résistance supplémentaire de lamodèle pourrait être son utilisation pour suivre la dynamique du macrophage au fil du temps.
Tout comme d' autres modèles ex vivo, une limitation du courant d'étudier l' angiogenèse dans le modèle de culture mésentérique du rat est l'absence de flux sanguin. Contrainte de cisaillement causée par le flux sanguin a été montré à jouer un rôle dans la morphologie des cellules endothéliales et la prolifération, ainsi que l' angiogenèse 17, 18, 19. Pour les résultats représentatifs présentés dans la figure 4, l'absence de contrainte de cisaillement seul a pu être suffisante pour induire une réponse angiogénique dans les réseaux de culture. Cependant, nous savons que sur la base de notre publication initiale caractérisant le modèle de culture mésentère de rat 8, que les causes de supplémentation des médias ont augmenté par rapport angiogenèse seuls médias. Les études futures intégrant flux au sein des réseaux microvasculaires cultivées sont sans aucun doute nécessaires pour imiter plus étroitement ladans le scénario vivo. Les approches potentielles pour l'écoulement incorporant pourraient inclure canulation des artérioles d'alimentation du réseau ou même cathétérisme d'autres artères en amont à l'intérieur de la frontière graisse des fenêtres mésentériques. Cependant, en dépit de l'absence d'écoulement, la viabilité de plusieurs types de cellules, le maintien du sang et des réseaux microvasculaires lymphatiques et la prolifération cellulaire au cours de l' angiogenèse supporte par rapport niveau accru du modèle de culture mésentère de rat de la complexité par rapport à la base des modèles in vitro cellulaire.
En conclusion, ce protocole décrit une reproductibilité ex vivo méthode simple, pour l' imagerie des réponses angiogéniques dans les réseaux microvasculaires intacts. Une telle méthode offre une alternative à base de cellules dans des modèles in vitro pour évaluer la dynamique des cellules angiogéniques à des emplacements spécifiques dans un environnement réseau. La méthode propose également un nouvel outil pour étudier l'angiogenèse, la lymphangiogenèse et de sang / lymphatique mal bagoutning simultanément.
Déclarations de divulgation
The authors declare that they have no competing financial interests.
Remerciements
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
matériels
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
Références
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon