Method Article
アン
要約
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
要約
血管新生は、既存の血管からの新たな血管の成長として定義され、内皮細胞、周皮細胞、平滑筋細胞、免疫細胞、及びリンパ管および神経との調整を含みます。マルチセル、マルチシステムの相互作用は、生理学的に関連する環境における血管形成の調査を必要とします。 in vitro細胞培養モデルの使用は、機械的な洞察を提供してきつつ、一般的な批判は、それらが微小血管ネットワークに関連する複雑さを再現しないことです。このプロトコルの目的は、培養ラット腸間膜組織における血管新生の刺激の前と後に無傷の微小血管ネットワークのタイムラプス比較を行う能力を実証することです。培養組織は、その階層を維持する微小血管ネットワークが含まれています。免疫組織化学的標識化は、内皮細胞、平滑筋細胞、周皮細胞、血管およびリンパ管の存在を確認します。でdditionは、BSI-レクチンと組織を標識すると、増加した毛細血管の発芽と血管密度によって特徴づけられる血清または成長因子刺激の前と後に、ローカルネットワーク領域の経時比較を可能にします。一般的な細胞培養モデルと比較すると、この方法は、内皮細胞系統の研究および生理学的に関連する微小血管ネットワークにおける組織特異的血管新生薬物評価のためのツールを提供します。
概要
微小血管ネットワークの成長とリモデリングは、組織機能のための共通の分母、創傷治癒、および複数の病状であり、重要なプロセスは、既存の1、2から新たな血管の成長として定義され、血管形成です。組織は新しい血管を設計するか、血管新生に基づく治療を設計するため、血管新生に関与する細胞のダイナミクスの重要性を理解することが重要です。しかしながら、この方法は複雑です。これは、微小血管ネットワーク内の特定の位置で変化し、複数の細胞型( 例えば 、内皮細胞、平滑筋細胞、周皮細胞、マクロファージ、幹細胞)と、複数のシステム(リンパ管ネットワーク及びニューラルネットワーク)を含むことができます。 in vitroモデルは、血管新生3に関与する異なるセル間の関係を調べることに大いに貢献してきたが、それらの生理学的関連性はtheiのために弱体化することができます限られた複雑さと、彼らは密接にin vivoでのシナリオを反映していないという事実rを。これらの制限、三次元培養系3、 エクスビボ組織モデル4を克服するために、マイクロ流体システム5、6、および計算モデル7は、近年開発され導入されています。しかし、無傷の微小血管ネットワークエクスビボでの血管形成を調査するタイムラプス機能を持つモデルの必要性が依然として存在します。複雑さのレベルの血管新生研究のための新たなタイムラプスモデルの確立は、血管新生を調節する根底にあるメカニズムを理解し、治療法を改善するための貴重なツールを提供します。
無傷の微小血管ネットワークを介して血管新生のex vivoでの調査を可能にする潜在的なモデルは、ラット腸間膜培養モデルであります> 8。最近の研究では、血液とリンパ微小血管ネットワークは培養後に生存し続けることが実証されています。さらに重要なことは、ラット腸間膜培養モデルは、機能的な周皮細胞 - 内皮細胞の相互作用、血液およびリンパ管内皮細胞コネクション、タイムラプス撮影を調査するために使用することができます。本稿の目的は、タイムラプスイメージング法のために私たちのプロトコルを提供することです。当社の代表的な結果は、血清と血管新生の刺激後に生き続けると組織特異的血管新生反応と同様に内皮細胞追跡研究を定量化するため、このメソッドの使用例を提供する複数の細胞型を文書化します。
プロトコル
全ての動物実験および手順は、チューレーン大学の施設内動物管理使用委員会(IACUC)によって承認されました。
1.外科プロシージャを設定
- 手術前にオートクレーブ機器、手術用消耗品、および文化用品。各ラットに対する外科用品が含まれます:1ドレープ、プレカット穴に1ドレープを(0.5インチ×1.5で)中央に、ガーゼパッド、および1吸収性アンダーパッド。手術器具が含まれます:数10ブレードで1メス、ピンセットの2ペア、および微細なハサミを。文化用品が含まれます:1ドレープ、ピンセットの1組、およびポリカーボネートフィルターで6ウェルプレートのインサートを用意しています。
- プレキシガラスのプラットフォーム、外科的なステージと70%エタノールで手術用卓上スペースを滅菌します。使用するまで無菌ボウルに外科的ステージを保管してください。
- 100ミリメートル培養皿の中央に穴中1により約2で穿孔することによって、外科的ステージを作成します。次に、滑らかにするためにサンドペーパーを使用任意のシャープなエッジとは、組織のための隆起表面を作成するために、穴のエッジにシリコーン接着剤の層を追加します。
- 代替的に、CADソフトウェアを使用して外科的ステージを設計し、3-D印刷( 図1)によって行います。
- ダウン滅菌吸収性アンダーパッドを配置し、その上にプレキシガラスのプラットフォームを築きます。吸収性アンダーパッドの隣に加熱パッド上で、プレカット穴なしで、ドレープを配置します。
- 前加温滅菌リン酸緩衝生理食塩水(PBS)、37°Cにメディアおよび生理食塩水。独立した培養皿に入れメディアとPBS加熱パッドの上、手術のセットアップの隣に50 mLのコニカルチューブに生理食塩水を配置します。
- すべてのパッケージは、すべての材料の滅菌処理を確実にするために、手術の開始に先立って開かれていることを確認します。この手順で使用する一般的なツールの完全なリストは、に記載されています 具体的な外科材料とツールの表 。
2. MesenterY組織の収穫
- 使用大人の雄Wistarラット(350±25グラム; 6 - 8週齢)。他の株およびラットの年齢を置換することができます。
- ケタミン(80 mg / kg体重)およびキシラジン(8 mg / kg体重)の筋肉内注射によりラットを麻酔。ラットが反射反応を確認するために足の指の間につまんで麻酔下であることを確認。どれがあってはなりません。このターミナル手続きのための先制鎮痛は必要ありません。
- 腹部を剃ると脱毛クリームを使用して残りの毛を取り除きます。ポビドンヨードに続く70%イソプロピルアルコールで二回腹部の皮膚を拭いてください。ワイプのために、外科医は、手術部位の中心に開始すべきであると以前に滅菌ガーゼまたは滅菌綿棒の同じ部分でスクラビングされた領域を重ならないように円形に準備されたエリアの外に移動します。その後、無菌手術用セットアップに動物を転送し、プレキシガラスプラットの上に置きます形。
- 胸骨下の1を開始し、腸の切開で1.25 - メスの刃を使用して、0.75を作ります。腸や腸間膜(皮膚の1層、結合組織の1層、および筋肉の1層)を穿刺しないように注意してください。
- 切開オーバープレカット穴とドレープを配置し、ドレープの上に無菌手術用のステージを配置します。開口部は切開部と整列することを確認してください。外科的ステージ開口部を通って回腸を見つけて引き出しを滅菌綿棒アプリケータを使用してください。
- 綿棒アプリケーターを使用してステージを8腸間膜Windows、およびWindows( 図1)には触れないように気をつけて- 6を引き出します。組織は、通常、盲腸の近く始まる小腸の回腸の領域から採取されます。ソリューションを滴下し、無菌注射器を使用して、必要に応じて加温した滅菌生理食塩水で湿った露出された組織を保管してください。
- ペントバルビタールナトリウム(ラット当たり0.2 mL)を心臓内注射を介してラットを安楽死させます。私を削除する前にsenteric窓は、ラットが心を触診によって安楽死させていることを確認します。何のパルスがあってはなりません。
- ウィンドウをカットする脂肪パッドと細かいハサミをつかむためにピンセットを使用することによって、所望の腸間膜組織を削除します。窓周りの脂肪(2ミリメートル)の境界線を残します。メディアで一度温めた滅菌PBSで一度組織を洗浄し。
- 腹腔に体外回腸を戻し、施設のガイドラインに従って動物を処分。
タイムラプス研究3.腸間膜組織培養
- 無菌層流フードへの転送オートクレーブ処理培養用品(1.1節を参照)や組織。
- ポリカーボネートフィルター膜の上に、各組織を転送するためにピンセットを使用してください。血管系の損傷を防ぐために、脂肪パッドによって組織をつかみます。
- 迅速ウィンドウに触れないように注意しながら、脂肪パッドを使用して、組織を広げます。 6ウェルプレートの底部に組織とインサートを反転し、メディアの3ミリリットル( 図1でカバー)。この手順のために使用される典型的な培地は、1%のペニシリンストレプトマイシン(PenStrep)及び10%ウシ胎児血清(FBS)を有する最小必須培地(MEM)を含みます。メディアは、血管新生を刺激する他の血清および/または成長因子を補充することができます。
- までの5日間、標準的なインキュベーター条件の各組織と文化のための3.3(5%CO 2、37℃) -繰り返して、3.2を繰り返します。
腸間膜組織の4タイムラプスイメージング
- イメージングの日に、共役BSIレクチンで各ウェルに培地を補充し、30分間の標準的な培養条件下でインキュベートします。レクチンを含まない培地で二回組織を洗ってください。 BSI-レクチン染色は、培養中の最大3日間腸間膜組織に表示されたままになります。
- 顕微鏡ステージにプレートを転送します。その形態やネットワーク構造に基づいて、血液やリンパ管を識別します。
- 各組織上の所望のネットワーク領域を見つけて、画像を撮影します。イメージングのメモを取ります同じ領域を確保するための場所が、後続のイメージのためにキャプチャされます。電動ステージを使用している場合、座標を文書化します。
- インキュベーターに組織を戻し、所望の最終地点まで培養を続けます。希望の実験の時点に応じて、必要に応じて4.3 - 繰り返し、4.1を繰り返します。
5.組織免疫標識
- BSI-レクチンラベリング
- メディアを有する2つのすすぎに続いて培地中1:40 FITC結合レクチン(6ウェルプレート中のウェルあたり2.5 mLの抗体溶液)を用いて37℃で30分間組織をインキュベートします。リンスの場合は、メディアを追加した後、すぐに交換してください。
- ライブ/デッドラベリング
- 1 37℃で10分間組織をインキュベート500 2mMのエチジウムホモダイマー1及び1:メディアを有する2つのすすぎに続いて、メディア500、1mMのカルセインAM(6ウェルプレート中のウェルあたり2.5 mLの抗体溶液)。
- BSI-レクチン/ NG2ラベリング
- スライドし、顕微鏡での組織を広げますE(1から2の組織/スライド)と乾燥させます。脂肪を切除するためにしっかりと下に押して、メスで余分な脂肪を取り除きます。
- -20℃で30分間、冷メタノールで組織を修正しました。 PBS(3×10分)で組織を洗います。
- 100ウサギポリクローナルNG2抗体および5%正常ヤギ血清(NGS):一次抗体の標識のために1を用いて室温で1時間、組織をインキュベートします。 PBS(3×10分)で組織を洗います。
- 100ヤギ抗ウサギCY2結合抗体(GAR-CY2)および5%NGS:二次抗体の標識のために1を用いて室温で1時間、組織をインキュベートします。 PBS(3×10分)で組織を洗います。
- PBSで2回リンスに続いて、PBS中の午前1時40分FITC結合レクチンを用いて室温で30分間、組織をインキュベートします。リンスのために、PBSを追加し、すぐに交換してください。
- スライドをマウントするには、上部の50:50 PBSで組織およびグリセロール溶液と場所のカバースリップをカバーしています。マニキュアを使用して、スライドの端をシールします。
- LYVE-1 / PECAMラベリング
- 顕微鏡スライド上の組織を広げて(1から2の組織/スライド)と乾燥させます。脂肪を切除するためにしっかりと下に押して、メスで余分な脂肪を取り除きます。
- -20℃で30分間、冷メタノールで組織を修正しました。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- 200マウスモノクローナルビオチン化CD31抗体と1:一次抗体の標識のために1ながら室温で1時間、組織をインキュベート100ウサギポリクローナルLYVE-1抗体をPBS + 0.1%サポニン+ 2%ウシ血清アルブミン(BSA)+ 5%NGS 。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- 二次抗体の標識のために、1を用いて室温で1時間、組織をインキュベート:PBS + 0.1%サポニン+ 2%BSA + 5%NGSで100 GAR-CY2:500 Cy3結合ストレプトアビジン抗体および1。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- 50:50 PBSとグリセロール溶液でスライド、カバー組織をマウントして、上にカバースリップを配置します。マニキュアを使用して、スライドの端をシールします。
- BrdU / BSI-レクチンラベリング
- メディアへの1mg / mLのBrdUのを追加し、BrdUの溶液で組織メディアを交換。 37℃で2時間インキュベートします。
- 顕微鏡スライド上の組織を広げて(1から2の組織/スライド)と乾燥させます。脂肪を切除するためにしっかりと下に押して、メスで余分な脂肪を取り除きます。
- -20℃で30分間、冷メタノールで組織を修正しました。 PBS(3×10分)で組織を洗います。
- 37℃で1時間、2 M HCl中の組織DNAを変性させます。 PBS + 0.1%サポニン(3×10分)で組織を洗います。
- PBS + 0.1%サポニン+ 2%BSA + 5%NGSで100モノクローナルマウス抗BrdU:一次抗体の標識のために、1を用いて室温で1時間、組織をインキュベートします。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- 二次抗体標識のために、1を室温で1時間、組織をインキュベート100ヤギ抗マウスCy3結合抗体をPBS + 0.1%サポニン+ 2%BSA + 5%NGS中(GAM-のCy3)を。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- をPBSで2回リンスに続いてPBSで1:40 FITC結合レクチンを用いて室温で30分間、組織をインキュベートします。
- スライドをマウントするには、上部の50:50 PBSとグリセロールソリューションと場所カバースリップを有する組織をカバーしています。マニキュアを使用して、スライドの端をシールします。
- BSI-レクチン/ CD11bのラベリング
- 顕微鏡スライド上の組織を広げて(1から2の組織/スライド)と乾燥させます。脂肪を切除するためにしっかりと下に押して、メスで余分な脂肪を取り除きます。
- -20℃で30分間、冷メタノールで組織を修正しました。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- PBSで100マウス抗ラットのCD11b + 0.1%サポニン+ 2%BSA + 5%NGS:一次抗体の標識のために1を用いて室温で1時間、組織をインキュベートします。洗浄は、PBS + 0.1%サポニン(3×10分)を有する組織します。
- 二次抗体の標識のために1を用いて室温で1時間、組織をインキュベート:PBS + 0.1%サポニン+ 2%BSA + 5%NGSで100 GAM-のCy3。 PBSで組織を洗います+ 0.1%サポニン(3×10分)。
- PBSで2回リンスに続いて、PBS中の午前1時40分FITC結合レクチンを用いて室温で30分間、組織をインキュベートします。
- スライドをマウントするには、上部の50:50 PBSとグリセロールソリューションと場所カバースリップを有する組織をカバーしています。マニキュアを使用して、スライドの端をシールします。
結果
培養3日後、組織を、ラット腸間膜培養モデル( 図2A)で微小血管系の生存能力を実証するために生/死生存率/細胞毒性キットを用いて標識しました。腸間膜中に存在する細胞の大部分は、内皮細胞が微小血管セグメントにおけるそれらの位置に基づいて同定された培養物中で生存可能のままでした。内皮細胞増殖はまた、レクチン/ BrdU標識( 図2D)により確認しました。血管に沿って平滑筋細胞および周皮細胞の存在は、NG2標識( 図2B)で確認しました。 LYVE1とPECAMのための標識化は、リンパや血液の微小血管ネットワークを分岐同定し、血液内皮細胞表現型( 図2C) 対維持リンパを確認しました。
このモデルのタイムラプス機能がmicrovaを標識することによって利用されましたBSI-レクチンとscularネットワーク異なる時点と時間をかけてネットワーク内の同じ領域を撮像。この機能は、組織特異的血管新生応答を調査するために特に有用です。 10%血清を含む培地の補充は、刺激の3日後に堅牢な血管新生応答を引き起こしました。さらに、新たな血管セグメントと毛細血管の芽は、刺激の5日目( 図3)により同定しました。刺激の前と後のネットワーク領域の定量的な比較( 図4)に許可さタイムラプスイメージング方法。私たちの以前の結果9を裏付けるこの代表的な研究については、血管面積当たりの血管の数と血管面積当たりの毛細血管の芽の数は、組織ごとに1 4X画像から定量しました。血管セグメントは2つの分岐点と毛細血管新芽の間に存在するレクチン陽性の血液内皮細胞のセグメントとして定義されていたが終了ブラインドのように定義されていましたホスト容器から発信セグメント。ネットワーク領域のタイムラプス比較はまた、内皮細胞のセグメントの追跡( 図5)および血液/リンパ管の誤パターニング( 図6)の識別を可能にしました。レクチンとのCD11bのための培養組織の標識は、さらにネットワークを改造に間質常駐マクロファージ( 図7)の存在を確認しました。

図1.腸間膜窓は、手術の段階を通じて、小腸を引き出して位置していました。外科的ステージは3次元印刷によって設計され、作られました。中央にある楕円形の穴は約2(A)中の1によってです。腸間膜ウィンドウは、膜挿入の上に広げられ、インサートを反転してよく(B)に入れました。スケールバー= 2 cmです。ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図2.血管はラット腸間膜培養モデルで生存し続けます。培養後に行わ生/死アッセイは、具体的には、血管(A)に沿って、死細胞(赤)に生細胞(緑)の高い比率を示しました。腸間膜組織を血管(緑色)と一緒に周皮細胞(赤色)を識別するために、細胞の異なるタイプの後、培養組織(B)中に存在することを確認するために、レクチンと抗NG2で標識しました。組織はまた、リンパ管(緑)船舶(C)からの血液(赤)血管を識別するために、PECAM / LYVE-1に対する標識しました。微小血管細胞は、培養中の増殖を起こすかどうかを調べるために、腸間膜組織をレクチン/抗BrdUで標識しました 。レクチン(緑色)で標識されたキャピラリーのセグメントに、複数の細胞を増殖(赤)(D)であることを確認しました。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

ラット腸間膜の図3.タイムラプスイメージングは、培養の過程で微小血管リモデリングを観察することができます。頑強な血管新生反応を、10%の血清刺激による培養の3(B)及び5日(C)後に観察されました。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ファイル/ ftp_upload / 55183 / 55183fig4.jpg "/>
ラット腸間膜培養モデルにおける図4微小血管ネットワークは、前および血管形成後に画像化しました。 10%血清を0日目と3日目(A、B)上のレクチンで標識された同一のネットワーク、刺激後の比較は、新しい血管を識別します。レクチンはまた、正体不明の間質細胞の集団にラベルを付けます。血管密度(C、D)および血管面積当たりの毛細血管芽の数(E、F)の定量化は、それぞれの組織のために両方の指標の増加を確認しました。前にC、E)(0日目)および組織あたりの後(3日目)の比較。 D、F)の比較は、一日の間に対のスチューデントのt検定を用いて0日3平均は血管セグメントの平均数(p <0.0001)および血管面積当たりの芽(p <0.00001)の平均数の両方に有意な差が確認され。白いバーは、0日目を表し、黒いバーは、3日目バリューを表しますエスは、SEM±平均値です。この代表的な分析のために、13の組織を2匹のラットから採取しました。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

ラット腸間膜培養モデル5図は、近くのネットワークに血管の島の運命と取り込みを調査するために使用することができます。切断された内皮セグメントとして定義されるタイムラプスイメージング、血管の島々を、使用して、0日目に同定され、近くのネットワークへの接続は後3日目の血管新生刺激によって確認されました。腸間膜組織をbFGFの(A、B)およびVEGF / PDFG-BB(C、D)で刺激しました。白抜きの矢印は、0日目に非接続セグメントを示し、実線の矢印はnetworへアイランドの接続を表しますK。矢頭は血管の島と近くのネットワーク間の接続の位置を示します。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図6.タイムラプス画像は、リンパ管や血管パターニングを観察する能力を実証します。リンパ(L)の容器は0日目(A)上の標識の形態に基づいて動脈(a)および細静脈(V)と区別することができます。 10%血清を後5日目の刺激では、リンパ管形態が失われ、血管が近くの血管新生血管(B)と統合しているように見えるされています。スケールバー=100μmです。 拡大表示するにはここをクリックしてください。この図のバージョン。
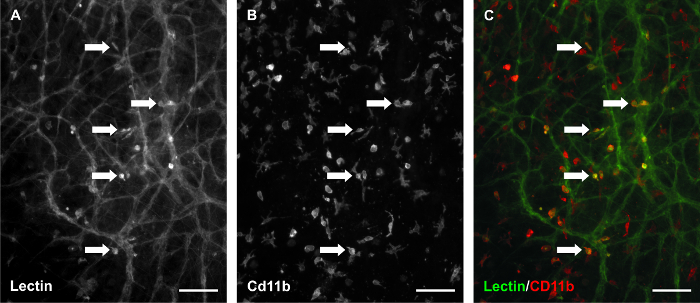
図7.マクロファージは、培養ラット腸間膜組織中に存在したまま。 10%血清で3日間培養した組織のレクチン/ CD11bの共標識レクチン陽性の間質細胞は、マクロファージのサブセットであることを示唆しています。 (A)BSI-レクチン標識の代表画像。 (B)同一視野でのCD11bラベリング。 (C)合成画像。矢印は、同時標識の例を識別します。スケールバー=100μmです。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
このプロトコルは、微小血管ネットワークの成長のタイムラプスイメージングのためのex vivoでのツールとしてラットの腸間膜培養モデルを使用するための方法を提示します。我々の研究室での以前の研究は、1のための我々のモデル)、血管新生8、2)リンパ管8、3)周皮細胞-内皮細胞の相互作用8、および4)抗血管新生薬物検査9の使用を確立しています。複数の時点で培養したラットの腸間膜組織を画像化するための能力は、組織特異的成長応答及び様々な血管新生刺激時の細胞間相互作用の追跡を評価するための定量的アッセイを提供しています。血管新生中の内皮細胞の増殖増加および周皮細胞の存在は、私たちの前の仕事8と一致しており、培養ラット腸間膜組織における血管新生の間に複数の細胞型の間の動的相互作用を検証します。
インビトロ細胞培養系で比較LASS = "jove_content">は、ラット腸間膜培養モデルは独特です。対照的に、コラーゲンゲル10に大動脈セグメントからの血管新生発芽を研究するために設立された大動脈輪アッセイを、考えてみましょう。大動脈リングで発芽する複数の細胞型を伴うが、毛細血管芽がin vivoでのシナリオとは非常に異なっている、大動脈の切除されたセグメントの外に成長します。脳切片モデルは別のex vivoモデルであるが、それはリンパ管の空隙です。また、脳切片モデルは、血管新生刺激の11前後のタイムラプス撮影することができることが示されていません。最近導入された別のex vivoモデルは、網膜培養モデルです。網膜モデルの利点は、血管新生がそのままmicrovascuから発生することがあります組織12、13内の LARネットワーク。これらのモデルについては、GFPトランスジェニックマウス系統は、経時発芽毛細血管を観察することができるように使用することができるが、我々のモデルで利用される残念ながら、マウス腸間膜は、ラット腸間膜のためのGFPトランスジェニックマウスの腸間膜置換を排除する、無血管14です。さらに、我々は、培養中のラット腸間膜組織の単純なレクチン標識は、異なる時点でのネットワークの成長を決定するのに十分であり、他のex vivoでのモデルと比較して、我々のモデルは、血液およびリンパ管内皮細胞の両方の同時観察を可能にすることを示しています。
BSI-レクチンは、微小血管ネットワークを可視化し、血管新生応答を検出するために、本論文で使用されました。レクチンは、内皮細胞上の糖タンパク質に結合するタンパク質の構造であり、内皮antibに比べて、その短いインキュベーション時間にこのプロトコルのために選択しましたODYマーカー。レクチンは、抗体よりも安価であり、それは固定する必要はありません。それはまた、容易に、培養培地中で混合し、インキュベーション期間が終了した後、新鮮な培地と交換することができます。今後の研究が血管形成過程にレクチン標識技術の潜在的な影響を解明するために必要とされているが、私たちの代表的な結果( 図4)が実証堅牢な血管新生を誘導することができ、前作9は、レクチンラベル付きネットワークにおける血管新生を標的と経由して抑制することができることを実証していること血管内皮増殖因子(VEGF)。より特異的なマーカーが必要である場合、抗体マーカーは、潜在的に代替的標識アプローチとして使用することができ、または、平滑筋細胞、周皮細胞、および神経などの微小血管ネットワーク中に存在する他の細胞型を調査する必要がある場合。細胞を可視化するための別の潜在的な方法は、遺伝子トランスフェクションであろう。
タイムラプスラット腸間膜モデルを使用する利点は、このプロトコルのための代表的な結果で強調されています。治療前後の画像の比較は、非対の統計的解析に影響を与える変動性の問題を低減します。外植片特異的応答は、出芽密度3,500%増加する血管密度の40%から233%の増加を20%から変化しました。この変化のための具体的な原因は不明のままですが、時間をかけて同じ組織の成長を測定することは、組織特異的応答を確認する能力を提示します。
微小血管成長中の異なる時点での画像の比較分析は、内皮細胞の追跡を可能にします。たとえば、私たちの研究室は、近くのネットワーク15、16から切断された微小血管ネットワークの近傍における内皮細胞のセグメントなどの血管の島々を特定しました。これらの島が近くnetworに接続することを確認するために、血管新生刺激に応答してK、ラット腸間膜培養モデルを使用しました。 図5に示すように、血管のアイランドは、基本線維芽細胞増殖因子(bFGF)、又はVEGFプラス血小板由来増殖因子(PDGF)を有する組織刺激の後に追跡しました。我々はまた、同様の結果(データは図示せず)の血清刺激後を示しています。血管新生の刺激の後、当初は切断血管の島々は、近くのネットワークに接続されています。
ラット腸間膜培養モデルの他の潜在的な用途は、リンパ管と血管とそれぞれの内皮細胞および間質細胞の運命の追跡との間の関係を調査する能力を活用することができました。このモデルでは、10%血清を用いた刺激は、潜在的なリンパツー血管統合の例( 図6)を提供する前と後の同じ微小血管ネットワークのタイムラプス画像。刺激、リンパや血液ヴェス前ELSは、血管形態に基づいて区別されました。刺激後、血管のアイデンティティに対するリンパ管は、あまり明らかになりました。リンパ管/血液内皮細胞相互作用の可能性はPECAM + / LYVE-1 +リンパ内皮細胞(データは図示せず)に接続PECAM + / LYVE-1-血液内皮細胞の観察によって支持されます。これらの観察は、リンパ管/血液内皮細胞の可塑性を調査するため、ラット腸間膜培養モデルの使用をサポートしています。 図6Aはまた、見かけの間質細胞のレクチン標識を強調しています。この標識は、組織から組織への矛盾や不均一であるが、それは内因性組織の常在細胞の存在を強調ありません。培養組織( 図7)のCD11bの標識は、これらのレクチン陽性の間質細胞は、マクロファージのサブセットであり得ることを示唆しています。マクロファージの関与の新興関心血管新生20で、追加の強さを考えるとモデルは、時間の経過とともに、マクロファージのダイナミクスを追跡するためのその使用である可能性があります。
多くの他のex vivoでのモデルのように、ラット腸間膜培養モデルにおける血管新生を研究する電流制限は、血流の不足です。血流に起因するせん断応力は、内皮細胞の形態および増殖、ならびに血管形成17、18、19において役割を果たすことが示されています。 図4に示す代表的な結果を得るために、単独で、せん断応力が存在しないことは、培養ネットワークにおける血管新生応答を誘導するのに十分であったかもしれません。しかし、我々はラット腸間膜培養モデル8を特徴付ける我々の最初の出版物に基づいていることを知って、そのメディアの補充の原因は、培地単独対血管新生を増加させました。培養された微小血管ネットワーク内の流れを取り入れ、将来の研究は間違いなく、より密接に模倣するために必要とされています生体内のシナリオインチ流れを組み込むための潜在的なアプローチは細動脈を供給ネットワークまたは腸間膜窓の脂肪国境内さらに上流の動脈のさえ挿管の挿管が含まれる場合があります。しかし、流れの欠如にもかかわらず、血管新生の間に複数の細胞型、血液とリンパ微小血管ネットワークの保守、および細胞増殖の生存率は、in vitroモデルに基づいて、セルに比べて複雑さのラット腸間膜培養モデルの相対的な増加レベルをサポートしています。
結論として、このプロトコルは、無傷の微小血管ネットワークにおける血管新生応答を画像化するための簡単な、再現性のex vivoでの方法について説明します。このような方法は、ネットワーク環境内の特定の位置で血管新生細胞動態を評価するためのin vitroモデルに基づいて、セルに代わるものを提供しています。この方法はまた、血管新生、リンパ管および血液/リンパ管の誤パタパタを調査するための新たなツールを提供しています同時に寧。
開示事項
The authors declare that they have no competing financial interests.
謝辞
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
資料
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
参考文献
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved