Method Article
一个
摘要
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
摘要
血管生成,定义为新的血管从预先存在的血管的生长,包括内皮细胞,周细胞,平滑肌细胞,免疫细胞,并与淋巴管和神经的协调。多小区,多系统的相互作用必要的血管生成在生理相关环境的调查。因此,虽然使用体外细胞培养模型提供了机械的见解,一个共同的批评是它们不概括与微血管网络相关联的复杂性。该协议的目的是证明之前和在培养的大鼠肠系膜组织血管生成的刺激后,使完整的微血管网络的时移进行比较的能力。培养组织含有维持其层次微血管网络。免疫标记证实了内皮细胞,平滑肌细胞,周细胞,血管和淋巴管的存在。在一个ddition,与BSI-凝集素标记的组织使前后血清或生长因子刺激由毛细血管发芽和血管密度后,本地网络区域的延时比较。相比于普通细胞培养模型,这种方法提供了在生理学相关微血管网络内皮细胞谱系研究和组织特异性血管生成药物评价的工具。
引言
微血管网络的增长和重塑是用于组织功能共同点,伤口愈合,和多个病症和一个关键过程是血管生成,定义为新血管从已有的1,2的生长。组织工程新船或设计基于血管生成疗法,了解参与血管生成的细胞动力学的重要性是至关重要的。然而,这个过程是复杂的。它可以在一个微血管网络内的特定位置而变化,并且涉及多种细胞类型( 即内皮细胞,平滑肌细胞,周细胞,巨噬细胞,干细胞)和多个系统(淋巴网络和神经网络)。虽然在体外模型已作出了巨大贡献,以检查参与血管生成3种不同的细胞之间的关系,它们的生理相关性可由于兵卫被削弱 - [R复杂性有限,事实上,他们没有真实地反映体内的情况。为了克服这些限制,三维培养系统3, 离体组织模型4中 ,微流体系统5,6,和计算模型7已经被开发并引入在最近几年。然而,仍然需要具有时间推移能力的模型来研究在完整微血管网络体外血管生成。血管生成研究建立新的延时模式与复杂性的水平将提供一个宝贵的工具来了解调节血管生成的基本机制,以提高治疗。
使血管跨越一个完整的微血管网络体外调查一个潜在的模型大鼠肠系膜养殖模式> 8。在最近的工作中,我们已经表明,血液和淋巴微血管网络保持培养后存活。更重要的是,大鼠肠系膜培养模型可用于研究官能周细胞 - 内皮细胞相互作用,血液和淋巴管内皮细胞的连接,和延时成像。本文的目的是为我们的时间推移成像方法的协议。我们的代表性的结果文件证明血管生成的刺激与血清后保持存活,并提供使用用于量化组织特定的血管生成反应以及内皮细胞追踪研究该方法的实施例的多种细胞类型。
研究方案
所有的动物实验和程序由美国杜兰大学的机构动物护理和使用委员会(IACUC)的批准。
1.手术过程设置
- 高压灭菌仪器,手术用品,并在手术前文化用品。每只大鼠手术耗材包括:1悬垂性好,悬垂1与预切孔(0.5英寸×1.5英寸)的中心,纱布垫,1个吸水焊。手术器械包括:1手术刀用10号刀片,2双镊子和一对细剪刀。培养用品包括:1的悬垂性,1镊子,并准备用的聚碳酸酯过滤器6孔板插入。
- 消毒一个有机玻璃平台,手术阶段和用70%乙醇的外科工作台空间。保持手术分期在无菌碗中待用。
- 在100毫米培养皿的中心钻孔在大约2通过1创建一个手术阶段。接下来,用砂纸顺利任何尖锐的边缘,并添加硅胶胶水层到孔的边缘,以创建用于组织中升高的表面。
- 另外,采用CAD软件设计手术阶段和3-D打印( 图1)做出。
- 将无菌吸水焊下来,躺在它上面一个有机玻璃平台。放置悬垂未经预切孔,在旁边的吸湿焊加热垫。
- 预暖的无菌磷酸盐缓冲盐水(PBS),介质和盐水至37℃。地方媒体和PBS单独培养皿在50mL锥形旁边的外科设置管加热垫和地方盐水顶上。
- 确保所有软件包之前,手术开始打开,确保所有材料的消毒处理。在此过程中使用的常用工具的完整列表中列出 具体的手术材料和工具表 。
2. Mesenterÿ组织收获
- 使用成年雄性Wistar大鼠(350±25克; 6 - 8周龄)。其它菌株和大鼠的年龄可以被取代。
- 通过氯胺酮(80毫克/公斤体重)和赛拉嗪(8毫克/公斤体重)的肌内注射麻醉大鼠。确认大鼠处于麻醉状态的脚趾之间掐来检查反射反应;应该没有。此终端过程先发制人镇痛是没有必要的。
- 剃须腹部和使用脱毛膏去除剩余的头发。用70%的异丙醇接着碘伏擦拭腹部皮肤的两倍。用于擦拭物的外科医生应该开始在手术部位的中心,并移动到圆形方式制备的区域的外侧,以不重叠的那些具有相同的一块无菌纱布或无菌棉签预先洗涤的区域。然后动物转移到无菌手术的设置,然后将有机玻璃高原之上形成。
- 使用手术刀刀片,使在一个0.75 - 1.25在切口在胸骨下方开始1肠道。小心不要刺破肠或肠系膜(1层皮肤,1层结缔组织,1层肌肉)。
- 放置一个悬垂超过切口一个预切孔和放置无菌手术阶段悬垂的顶上。确保与切口对齐开幕。用消毒棉签涂抹定位,并通过手术分期开盘拉出回肠。
- 用棉签涂抹通过阶段8肠系膜窗口,并注意不要触碰窗口( 图1) -拉6。组织通常由小肠盲肠附近开始的回肠区域采收。保持暴露组织湿润使用无菌注射器滴下的溶液根据需要加热的无菌盐水。
- 安乐死通过戊巴比妥钠的心内注射鼠(每只鼠0.2mL)中。在卸下我senteric窗口,确保老鼠被触诊心脏安乐死;应该没有脉冲。
- 通过使用镊子夹住脂肪垫和精细剪刀剪开窗口中删除所需的肠系膜组织。离开的脂肪(2mm)的窗口周围的边框。媒体在温暖无菌PBS洗一次组织一次。
- 返回形象化回肠到腹腔,并根据机构指南动物的处理。
3.肠系膜组织培养时间推移研究
- 传输蒸压文化用品(参见1.1节)和组织无菌层流罩。
- 用镊子每个组织转移聚碳酸酯过滤膜上面。由脂肪垫抓组织,以避免损坏血管。
- 使用快速脂肪垫,小心不要碰到窗口传播组织。倒置与组织插入到6孔板的底部,并用3毫升培养基( 图1覆盖)。用于这一过程的典型介质包括极限必需培养基(MEM)中,用1%青霉素链霉素(PenStrep)和10%胎牛血清(FBS)。媒体可辅以其它血清和/或生长因子刺激血管生成。
- 重复步骤3.2 - 3.3长达5天的标准培养箱条件的每个组织和培养(5%CO 2,37℃)。
4.肠系膜组织的时间推移成像
- 上成像的当天,用共轭BSI-凝集素补充媒体在每个孔和标准培养条件下温育30分钟。提供免费凝集素媒体组织洗净两次。 BSI-凝集素染色将肠系膜组织保持可见在培养3天。
- 板块转移到显微镜阶段。标识基于其形态和网络结构的血液和淋巴管。
- 找到每个组织所需的网络区域,并拍摄图像。记下成像位置,以确保在同一区域将被捕获为后续图像。如果使用机动阶段,记录的坐标。
- 返回组织的孵化器,并继续培养至所需的终点。根据所需实验时间点需要4.3 - 重复步骤4.1。
5.组织免疫标记
- BSI-凝集素标签
- 在37°C孵育组织30分钟,在媒体后跟两个漂洗与媒体1:40 FITC-缀合凝集素(在6孔板每孔2.5毫升抗体溶液)。对于漂洗,添加媒体,然后立即更换。
- 活/死贴标
- 在37℃下用1孵育组织10分钟:500 2毫乙锭同型二聚体-1和1:500 1毫钙黄绿素中媒体后跟两个漂洗用媒体的AM(在6孔板每孔2.5毫升抗体溶液)。
- BSI-凝集素/ NG2标签
- 在显微镜传播组织下滑E(1 - 2组织/幻灯片),并晾干。通过稳固地向下按切除脂肪用手术刀去除多余油脂。
- 固定在冷甲醇组织在-20℃下30分钟。用PBS(3×10分钟)冲洗组织。
- 初级抗体标记孵育1在室温下1小时的组织:100兔多克隆NG2抗体和5%正常山羊血清(NGS)。用PBS(3×10分钟)冲洗组织。
- 对于二级抗体标记孵育在室温下1小时的组织以1:100的山羊抗 - 兔CY2共轭抗体(GAR-CY 2)和5%NGS。用PBS(3×10分钟)冲洗组织。
- 孵育在室温下30分钟,组织用PBS中1:40 FITC-缀合凝集素后跟两个漂洗用PBS。对于漂洗,加入PBS,然后立即更换。
- 要安装的幻灯片,覆盖在上面以50:50 PBS组织和甘油溶液和地点盖玻片。使用密封指甲油幻灯片边缘。
- LYVE-1 / PECAM贴标
- 铺在显微镜载玻片组织(1 - 2组织/滑动)并晾干。通过稳固地向下按切除脂肪用手术刀去除多余油脂。
- 固定在冷甲醇组织在-20℃下30分钟。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 200小鼠单克隆生物素化的CD31抗体和1:初级抗体标记在室温下用1孵育1小时组织100兔多克隆LYVE-1的PBS + 0.1%皂角苷+ 2%牛血清白蛋白抗体(BSA)+ 5%NGS 。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 对于二级抗体标记,孵育组织为在室温下用1 1小时:500 CY3共轭链霉抗抗体和1:在PBS + 0.1%皂角苷+ 2%BSA + 5%NGS 100 GAR-CY2。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 要挂载幻灯片,封面组织以50:50 PBS和甘油溶液并放置一个盖玻片放在上面。使用密封指甲油幻灯片边缘。
- 的BrdU / BSI-凝集素标签
- 1毫克/毫升的BrdU添加到媒体并用BrdU溶液替换组织媒体。在37℃下孵育2小时。
- 铺在显微镜载玻片组织(1 - 2组织/滑动)并晾干。通过稳固地向下按切除脂肪用手术刀去除多余油脂。
- 固定在冷甲醇组织在-20℃下30分钟。用PBS(3×10分钟)冲洗组织。
- 变性组织的DNA中的2M HCl中在37℃下1小时。在PBS + 0.1%皂角苷(3×10分钟)冲洗组织。
- 初级抗体标记,孵育组织为在室温下用1 1小时:100单克隆小鼠抗BrdU在PBS + 0.1%皂角苷+ 2%BSA + 5%NGS。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 对于二级抗体标记,孵育在室温下1小时的组织以1:100的山羊抗小鼠的Cy3缀合的抗体(GAM-Cy3标记)在PBS + 0.1%皂角苷+ 2%BSA + 5%NGS。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 孵育在室温下30分钟,组织用PBS中1:40 FITC-缀合凝集素后跟两个漂洗用PBS。
- 要安装在上面滑动,封面组织以50:50 PBS和甘油溶液和地点盖玻片。使用密封指甲油幻灯片边缘。
- BSI-凝集素/ CD11b的标签
- 铺在显微镜载玻片组织(1 - 2组织/滑动)并晾干。通过稳固地向下按切除脂肪用手术刀去除多余油脂。
- 固定在冷甲醇组织在-20℃下30分钟。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 初级抗体标记孵育在室温下1小时的组织以1:100的小鼠抗大鼠的CD11b在PBS + 0.1%皂角苷+ 2%BSA + 5%NGS。洗用PBS + 0.1%皂角苷(3×10分钟)的组织。
- 对于二级抗体标记孵育在室温下用1 1小时组织:100 GAM-Cy3的在PBS + 0.1%皂角苷+ 2%BSA + 5%NGS。用PBS洗涤组织+ 0.1%皂角苷(3×10分钟)。
- 孵育在室温下30分钟,组织用PBS中1:40 FITC-缀合凝集素后跟两个漂洗用PBS。
- 要安装在上面滑动,封面组织以50:50 PBS和甘油溶液和地点盖玻片。使用密封指甲油幻灯片边缘。
结果
后在培养3天后,组织被标记有活/死活力/细胞毒性试剂盒以证明在大鼠肠系膜培养模型( 图2A)微血管的生存能力。大部分存在于肠系膜细胞保持在血管内皮细胞,根据他们在微血管段位置确定的文化活力。内皮细胞的增殖也被外源凝集素/ BrdU标记( 图2D)确认。平滑肌细胞和周细胞的存在沿血管被证实与NG2标记( 图2B)。标记为LYVE1和PECAM鉴定分支淋巴和血液微血管网络,并确认了保持淋巴与血液内皮细胞表型( 图2C)。
这种模式的定时功能被贴标签microva利用scular网络与在不同时间点的BSI-凝集素和成像网络在一段时间内的同一区域;这种能力调查的组织特异性的血管生成反应特别有价值。的10%血清培养基中补充造成刺激后3天坚固血管生成响应。此外,新的血管段和毛细管芽进行第5天的刺激( 图3)来识别。允许网络区域的前和刺激后( 图4)的定量比较的时间推移成像方法。对于这种代表性的研究,这证实了我们以前的结果9,每血管面积船只的数量和每个血管面积毛细血管新芽的数量从每个组织执行一次4X图像量化。血管片段被定义为两个分支点和毛细血管豆芽之间存在外源凝集素阳性血内皮细胞段被定义为瞎结束段从主机容器始发。网络区域的时间推移的比较也使内皮细胞的段跟踪( 图5)和血液/淋巴管误构图识别( 图6)。为外源凝集素和CD11b培养组织的标记附加地证实插页定居巨噬细胞的重塑网络存在( 图7)。

图1.肠系膜窗口分别位于通过手术阶段拉出小肠。外科阶段用的3-D印刷设计和制造。在中心的椭圆孔是约2中通过1(A)中。然后肠系膜窗户被摊开在膜插入件的顶部,且插入物倒置并放入井(B)中 。比例尺= 2厘米。ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg"目标="_空白">点击此处查看该图的放大版本。

图2.血管大鼠肠系膜养殖模式保持活力。培养后进行活/死法显示活细胞(绿色),死细胞(红色),专门沿血管(A)的比例较高。肠系膜组织中标记凝集素和抗NG2,以确定周细胞(红色)沿着容器(绿),以证实不同类型的细胞都存在于培养后的组织(B)。组织中也标记为针对PECAM / LYVE-1从淋巴识别血液(红色)的船只(绿色)容器(C)。为了研究微血管细胞进行培养增殖,肠系膜组织被标记凝集素/抗BrdU 。标有凝集素(绿色)的毛细管段,多个小区被证实为增殖性(红色)(D)。比例尺= 100微米。 请点击此处查看该图的放大版本。

图3.时间推移大鼠肠系膜成像能够观察微血管重塑在培养过程。后培养3(B)和5天(C)的含10%血清刺激观察到的鲁棒血管生成响应。比例尺= 100微米。 请点击此处查看该图的放大版本。
文件/ ftp_upload / 55183 / 55183fig4.jpg"/>
图4.在大鼠肠系膜培养模型微血管网前和血管形成后成像。标记与0天和第3天(A,B)凝集素相同的网络刺激后,用10%血清的比较确定新的血管。凝集素还授予不明间质细胞群体。血管密度(C,D),并每血管面积(E,F)毛细管豆芽数量的量化证实在这两个指标对每个组织的增加。 C,E)前(第0天)和每组织后(第3天)比较。 D,F)比较0天和一天之间采用配对学生t检验3平均证实在两种平均数血管段的(P <0.0001)和豆芽的平均数目(P <0.00001每血管面积显著差) 。白条表示0天,和黑条代表天3. VALUES是平均值±SEM。对于这种代表性的分析,13组织从2只收获。比例尺= 100微米。 请点击此处查看该图的放大版本。

图5.大鼠肠系膜培养模型可以用于研究血管岛屿的命运和纳入附近的网络。使用时间推移成像,血管岛屿,定义为断开的血管内皮段,被确定第0天他们到附近的网络连接是由每天3后血管刺激证实。肠系膜组织用的bFGF(A,B)和VEGF / PDFG-BB(C,D)的刺激。空心箭头显示第0天断开连接段,实线箭头表示的岛屿连接到BP网络在ķ。箭头指示血管岛和附近的网络之间的连接的位置。比例尺= 100微米。 请点击此处查看该图的放大版本。

图6.延时图像展示给观察淋巴管和血管图案的能力。淋巴(升)的船只可以从动脉(a)和小静脉进行区分(ⅴ)的基础上对第0天(A)的标签的形态。后第5天刺激,用10%血清,淋巴形态丢失和船只似乎已与附近的血管的血管(B)的结合。比例尺= 100微米。 请点击此处查看大图版本这个数字。
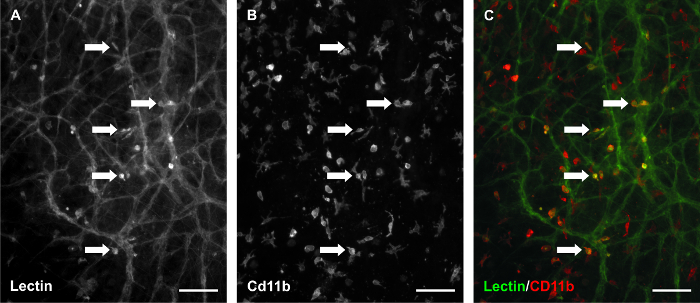
图7.巨噬细胞仍然存在于培养的大鼠肠系膜组织。外源凝集素/ CD11b的3天,用10%血清培养组织的共标记表明外源凝集素阳性细胞间质是巨噬细胞的一个子集。 (A)BSI-凝集素标记的形象代表。 (B)的CD11b标签在同一视场。 (C)的合并后的图像。箭头识别共同标记的例子。比例尺= 100微米。 请点击此处查看该图的放大版本。
讨论
该协议记录了使用大鼠肠系膜文化模型作为微血管网络增长的时间推移成像的体外工具的方法。在我们的实验室以前的工作已经建立了使用我们的1模型)血管生成8,2)淋巴管8,3)周细胞-内皮细胞相互作用8,和4)抗血管生成药物测试的9。对于在多个时间点培养的大鼠肠系膜组织成像的能力提供了用于评价组织特异性生长反应和细胞 - 细胞相互作用的过程中的各种血管生成刺激物的追踪的定量测定。血管生成过程中的内皮细胞的增加的增殖和周细胞的存在与我们以前的工作8一致,在培养的大鼠肠系膜组织的血管生成过程中验证多种细胞类型之间的动态相互作用。
相比于通常使用的组织培养模型和体外细胞培养系统,大鼠肠系膜培养模型是独特的,因为生长一个完整的,真实的微血管网络内发生。考虑对比主动脉环法,它的设立是为了研究主动脉段血管生成萌芽的胶原凝胶10。而在主动脉环发芽涉及多种细胞类型,毛细管芽生长出的主动脉,这是从在体内情形非常不同的切除区段。脑切片模型是另一个体外模型,但它是淋巴管的空隙。此外,大脑切片模型尚未上映之前,和血管刺激11后能够时间推移成像的。已近期推出的另一体外模型是视网膜养殖模式。视网膜模型的优点是,血管生成从完整microvascu发生组织12,13内拉尔网络。对于这些模型,GFP转基因小鼠品系可用于能够观察毛细血管发芽随着时间的推移,但不幸的是,在小鼠肠系膜是无血管14,消除了对大鼠肠系膜GFP的转基因小鼠肠系膜取代,如在我们的模型使用。此外,我们表明,在培养的大鼠肠系膜组织的简单凝集素标记是足以确定在不同时间点和相比于其他体外模型网络的增长,我们的模型允许血液和淋巴管内皮细胞的同时观察。
BSI-凝集素在本文中用于可视化微血管网络和发现的血管生成反应。凝集素是蛋白质结构结合到内皮细胞上的糖蛋白,并选择用于此协议,由于其短的温育时间相比内皮antibODY标记。凝集素是除抗体更便宜,它不需要固定;它也可以在培养基中很容易地混合,并用温育期结束后的新鲜培养基更换。尽管还需要进一步的研究来阐明对血管生成过程中的外源凝集素标记技术的潜在影响,我们的代表结果( 图4)表明,强大的血管可诱发和前期工作9表明,凝集素标记网络的血管生成可以通过靶向抑制血管内皮生长因子(VEGF)。抗体标记物可以潜在地作为替代标记方法时,有必要进行更具体的标记物,或者当有必要以调查存在于微血管网络如平滑肌细胞,周细胞和神经其它细胞类型。用于可视化细胞的另一个潜在方法是基因转染。
使用时间推移大鼠肠系膜模型的优点已经强调了此协议的代表性成果。图像处理前和处理后的比较减少了影响非成对的统计分析变异性的问题。外植具体反应在血管密度20%〜233%增长,并从萌芽密度40%至3500%,增幅变化。这种变化的具体原因尚不清楚,但在测量同一组织增长时出示确认组织特异性反应的能力。
微血管生长期间在不同时间点的图像的对比分析也允许跟踪内皮细胞。例如,我们的实验室已确定血管的岛屿如在从附近的网络15,16断开微血管网络附近内皮细胞段。为了证实这些岛屿连接到附近的BP网络在K的响应于血管生成刺激,使用大鼠肠系膜培养模型。 如图5所示,血管岛屿被组织刺激与碱性成纤维细胞生长因子(bFGF)或血管内皮生长因子加血小板衍生生长因子(PDGF)后跟踪。我们还表明了类似的结果后血清刺激(数据未如图所示)。血管生成的刺激后,可以连接到附近的网络发现原来断开的血管岛屿。
大鼠肠系膜培养模型的其他潜在应用可以利用调查淋巴管和血管以及它们各自的内皮细胞和间质细胞的命运的跟踪之间的关系的能力。之前和在该模型中的10%血清刺激后同一微血管网络的时间推移的图像提供潜在淋巴到血管整合( 图6)的例子。之前的刺激,淋巴及血液VESS基于容器形态ELS进行区分。刺激后,与淋巴血管身份变得不太清楚。淋巴/血液内皮细胞的相互作用的电位通过PECAM的观察的支持与PECAM连接+ / LYVE-1-血内皮细胞+ / LYVE-1 +淋巴管内皮细胞(此处未示出数据)。这些观察结果支持使用大鼠肠系膜养殖模式的调查淋巴/血液内皮细胞的可塑性。 图6A还强调明显的间质细胞凝集素标签。虽然这种标签是不一致的,从组织到组织异质的,它确实强调内源性组织驻留细胞的存在。培养组织的细胞CD11b标记( 图7)表明,这些凝集素阳性细胞间质可以是一个子组的巨噬细胞的。定在巨噬细胞参与新兴兴趣在血管20中的一个附加的强度模型可能是它的使用随着时间的推移来跟踪巨噬细胞动态。
就像其他的体外模型,在大鼠肠系膜培养模型研究血管生成的电流限制是缺乏血流。引起的血液流动的剪应力已经显示出在血管内皮细胞形态和增殖以及血管17,18,19的作用。对于在图4中提出的代表性的结果,由于没有剪应力的单独可能已经足以诱导在培养的网络的血管生成反应。但是,我们知道,根据我们最初发布表征大鼠肠系膜培养模型8,该媒体补充原因导致的血管生成与单纯的媒体。结合培养的微血管网络内流动未来的研究无疑需要更加紧密地模仿在体内的情况。对于合并流势的方法可能包括网络喂养动脉插管甚至肠系膜窗口脂肪境内进一步上行动脉插管。然而,尽管缺乏流动的,多种细胞类型的活力,血液和淋巴微血管网络,和细胞增殖的血管生成过程中的维护支持复杂的大鼠肠系膜培养模型的相对增加的水平与基于体外模型细胞。
总之,本协议描述成像在完整的微血管网络的血管生成反应一个简单的,可重复的体外方法。这样的方法提供了用于在网络环境内的特定位置评估血管生成细胞动力学基于体外模型细胞的替代品。该方法还提供了一个新的工具,调查新生血管,淋巴管和血液/淋巴误行话宁同时进行。
披露声明
The authors declare that they have no competing financial interests.
致谢
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
材料
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
参考文献
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。