Method Article
Ein
In diesem Artikel
Zusammenfassung
Angiogenesis involves multi-cell, multi-system interactions that need to be investigated in a physiologically relevant environment. The objective of this study is to demonstrate the ability of the rat mesentery culture model to make time-lapse comparisons of intact microvascular networks during angiogenesis.
Zusammenfassung
Angiogenesis, definiert als das Wachstum neuer Blutgefäße aus bestehenden Gefäßen beinhaltet Endothelzellen, Perizyten, glatte Muskelzellen, Immunzellen und die Koordination mit der Lymphgefäße und Nerven. Die Multi-Zelle, erfordern Multi-System-Interaktionen, die Untersuchung der Angiogenese in einem physiologisch relevanten Umfeld. Während also die Verwendung von in vitro-Zellkulturmodelle mechanistische Erkenntnisse zur Verfügung gestellt haben, eine gemeinsame Kritik ist , dass sie rekapitulieren nicht die Komplexität , die mit einer mikrovaskulären Netzwerk verbunden. Das Ziel dieses Protokolls ist es, die Fähigkeit zu demonstrieren, Zeitraffer-Vergleiche von intakten mikrovaskuläre Netzwerke vor und nach der Angiogenese Stimulation in kultivierten Ratte Gekröse Gewebe zu machen. Kultivierte Gewebe enthalten mikrovaskuläre Netzwerke, die ihre Hierarchie pflegen. Immunhistochemischen Markierung bestätigt das Vorhandensein von Endothelzellen, glatten Muskelzellen, Perizyten, Blutgefäße und Lymphgefäße. In einemddition, Etikettieren Gewebe mit BSI-Lektin ermöglicht Zeitraffer-Vergleich von lokalen Netzregionen vor und nach dem Serum oder Wachstumsfaktor-Stimulation durch erhöhte Kapillare sprießen und Gefäßdichte gekennzeichnet. Im Vergleich zu herkömmlichen Zellkulturmodelle, stellt dieses Verfahren ein Werkzeug für die Endothel-Zelllinie Studien und Gewebe-spezifische angiogene Arzneimittel Auswertung in physiologisch relevanten mikrovaskuläre Netzwerke.
Einleitung
Die mikrovaskuläre Netzwerk Wachstum und Umbau sind gemeinsame Nenner für die Gewebefunktion, Wundheilung, und mehrere Pathologien und ein Schlüsselprozess ist die Angiogenese, definiert als das Wachstum neuer Blutgefäße aus bestehenden 1, 2. Für das Tissue Engineering neue Schiffe oder angiogenen Therapien entwerfen, das Verständnis der Bedeutung der zellulären Dynamik an der Angiogenese beteiligt ist kritisch. Jedoch ist dieses Verfahren komplex. Es kann an spezifischen Stellen innerhalb einer mikrovaskulären Netzwerk variieren und mehrere Zelltypen (zB endothelialen Zellen, glatten Muskelzellen, Perizyten, Makrophagen, Stammzellen) beinhaltet und mehrere Systeme (lymphatischen Netze und neuronale Netze). Obwohl in vitro Modellen enorm , um die Beziehung zwischen verschiedenen Zellen beigetragen haben , bei der Angiogenese 3, deren physiologische Relevanz beteiligt Prüfung kann aufgrund thei untergraben begrenzter Komplexität r und die Tatsache , dass sie eine in vivo - Szenario nicht genau reflektieren. Um diese Einschränkungen zu überwinden, dreidimensionale Kultursysteme 3, ex vivo - Gewebemodelle 4, mikrofluidische Systeme 5, 6 und Rechenmodelle 7 wurden in den letzten Jahren entwickelt und eingeführt. Es besteht jedoch immer noch ein Bedarf für ein Modell mit Zeitraffer Fähigkeit zur Angiogenese in intakten mikrovaskulären Netzwerke ex vivo zu untersuchen. Der Aufbau neuer Zeitraffer-Modelle für die Angiogenese-Studien mit diesem Grad an Komplexität wird ein unschätzbares Werkzeug zur Verfügung stellen, die zugrunde liegenden Mechanismen regulieren die Angiogenese und zur Verbesserung der Therapien zu verstehen.
Ein mögliches Modell, das die Ex - vivo - Untersuchung der Angiogenese in einem intakten mikrovaskulären Netzwerk ermöglicht , ist die Kulturmodell Ratte Gekröse> 8. In einer neueren Arbeit haben wir gezeigt, dass Blut-und lymphatischen mikrovaskuläre Netzwerke nach Kultur lebensfähig bleiben. funktionellen pericyte-Endothel-Interaktionen zu untersuchen, Blut-und lymphatischen endothelialen Zellverbindungen und Zeitraffer-Bildgebung Noch wichtiger ist, kann die Ratte Gekröse Kulturmodell verwendet werden. Das Ziel dieser Arbeit ist unser Protokoll für den Zeitraffer-Bildgebungsverfahren bereitzustellen. Unsere repräsentative Ergebnisse dokumentieren die mehrere Zelltypen, die mit Serum nach der Stimulation der Angiogenese lebensfähig bleiben und bieten Beispiele für die Verwendung dieser Methode für gewebespezifische angiogene Antworten sowie Endothelzellen Tracking-Studien zu quantifizieren.
Protokoll
Alle Tierversuche und Verfahren wurden von der Tulane University Institutional Animal Care und Use Committee (IACUC) zugelassen.
1. Chirurgisches Verfahren einrichten
- Autoklav Instrumente, chirurgische Versorgung und Kultur liefert vor der Operation. Chirurgische Versorgung für jede Ratte umfassen: 1 Tuch, 1 drapieren mit vorgeschnittenen Loch (0,5 Zoll x 1,5 Zoll) in der Mitte, Gazekompressen und 1 saugfähige Unterlage. Chirurgische Instrumente umfassen: 1 Skalpell mit einer Reihe 10 Klinge, 2 Paar Pinzette, und ein Paar von einer feinen Schere. Kultur Lieferungen umfassen: 1 Tuch, 1 Pinzette und vorbereitet 6-Well-Platte Einsätze mit Polycarbonat-Filtern.
- Sterilisieren eine Plexiglas-Plattform, eine chirurgische Bühne und eine chirurgische Benchtop Raum mit 70% Ethanol. Halten Sie die OP-Stufe in einer sterilen Schale bis zum Gebrauch.
- Erstellen Sie eine chirurgische Bühne durch einen etwa 2 in von 1 in Loch in der Mitte einer 100 mm Kulturschale zu bohren. Als nächstes verwenden Schmirgelpapier glättenScharfe Kanten und eine Schicht aus Silikonkleber auf die Kanten des Lochs fügen Sie eine erhabene Oberfläche für die Gewebe zu schaffen.
- Alternativ entwerfen die chirurgische Phase CAD - Software und von 3-D - Druck (Abbildung 1).
- Legen Sie eine sterile saugfähige Unterlage nach unten und legen ein Plexiglas-Plattform oben drauf. Legen Sie das Tuch, ohne ein vorgeschnittenes Loch, über eine beheizte Pad neben dem absorbierenden underpad.
- Pre-warmer steriler phosphatgepufferter Kochsalzlösung (PBS), Medien und Kochsalzlösung auf 37 ° C. Ort Medien und PBS in getrennten Kulturschalen oben auf dem Heizkissen und Stelle saline in einem 50 ml konischen Röhrchen neben der chirurgischen Einrichtung.
- Sicherstellen, dass alle Pakete vor dem Beginn der Operation geöffnet werden sterile Handhabung aller Materialien zu gewährleisten. Eine vollständige Liste der gemeinsamen Werkzeuge in diesem Verfahren verwendet werden, in der aufgelistet Tabelle der spezifischen chirurgischen Materialien und Werkzeuge.
2. Mesentery Tissue Ernte
- Verwenden erwachsenen männlichen Wistar-Ratten (350 ± 25 g; 6 - 8 Wochen alt). Andere Stämme und Alter der Ratten kann ersetzt werden.
- Anästhesieren die Ratte über eine intramuskuläre Injektion von Ketamin (80 mg / kg Körpergewicht) und Xylazin (8 mg / kg Körpergewicht). Bestätigen Sie die Ratte unter Narkose ist zwischen den Zehen durch Kneifen für eine Reflexantwort zu überprüfen; sollte es keine geben. Präemptive Analgesie für dieses Terminal Verfahren ist nicht erforderlich.
- Rasieren Sie den Bauchbereich und entfernen Sie restlichen Haare mit Haarentfernungs-Creme. Wischbauchhaut zweimal mit 70% igem Isopropylalkohol gefolgt von Povidon-Iod. Für die Wischtücher in der Mitte der Operationsstelle beginnen und so überlappen, um keine Bereiche in einer kreisförmigen Weise nach außen des vorbereiteten Bereichs bewegen, die zuvor mit dem gleichen Stück steriler Gaze oder steriles Wattestäbchen geschrubbt der Chirurg sollte. Dann übertragen Tier zum sterilen OP-Setup und legen oben auf dem Plexiglas platbilden.
- Mit einem Skalpell, machen Sie eine 0,75 in - 1,25 in Einschnitt im Darm ab dem 1. in unterhalb des Brustbeins. Achten Sie darauf, nicht den Darm oder Gekröse (1 Schicht der Haut, 1 Schicht von Bindegewebe und 1 Muskelschicht) zu durchstechen.
- Legen Sie ein Tuch mit einem vorgeschnittenen Loch über den Einschnitt und legen Sie eine sterile OP-Bühne oben auf dem Tuch. Sicherstellen, dass die Öffnung steht im Einklang mit dem Einschnitt. Verwenden Sie sterile Wattestäbchen zu lokalisieren und das Ileum durch die chirurgische Bühnenöffnung herausziehen.
- Ziehen Sie 6 - 8 mesenterialen Fenster , durch die Bühne mit Wattestäbchen, und darauf achten , nicht die Fenster zu berühren (Abbildung 1). Gewebe werden typischerweise aus dem Ileum Bereich des Dünndarms ausgehend in der Nähe des Blinddarms geerntet. Halten Sie ausgesetzt Gewebe feucht mit erwärmter steriler Kochsalzlösung als eine sterile Spritze erforderlich unter Verwendung der Lösung tropft.
- Euthanize die Ratte über Intrakardial von Pentobarbital - Natrium (0,2 ml pro Ratte). Vor mir Entfernensenteric Fenster, sicherstellen, dass die Ratte durch Palpation des Herzens eingeschläfert wird; es sollte kein Impuls sein.
- Entfernen gewünschte Gekröse Gewebe durch Pinzette mit dem Fettpolster und einer feinen Schere zu greifen, das Fenster zu schneiden. Lassen Sie eine Grenze von Fett (2 mm) rund um das Fenster. Waschen Sie Gewebe einmal in erwärmte sterile PBS und einmal in den Medien.
- Zurück exteriorisierten Ileum in die Bauchhöhle und entsorgen Tier gemäß gültiger Richtlinien.
3. Mesentery Gewebekultur für Zeitrafferstudien
- Transfer autoklaviert Kultur liefert und Gewebe zu einer sterilen Laminar-Flow-Haube (siehe Abschnitt 1.1).
- Verwenden einer Pinzette jedes Gewebe auf einem Polycarbonat-Filtermembran zu übertragen. Schnappen Gewebe durch das Fettpolster zu vermeiden, dass die Gefäße schädigen.
- Schnell verbreitete das Gewebe, das die Fettpolster verwenden, wobei darauf geachtet, das Fenster nicht zu berühren. Kehren Sie die Einlage mit dem Gewebe in den Boden einer 6-Well - Platte geben und mit 3 ml Medium (Abbildung 1 ). Typische Medien für dieses Verfahren verwendet wird, umfasst Minimum Essential Medium (MEM) mit 1% Penicillin Streptomycin (PenStrep) und 10% fötalem Rinderserum (FBS). Medien können mit anderen Seren und / oder Wachstumsfaktoren, die Angiogenese zu stimulieren, ergänzt werden.
- Wiederholen Sie die Schritte 3,2-3,3 für jedes Gewebe und Kultur in Standard - Inkubator Bedingungen (5% CO 2, 37 ° C) für bis zu 5 Tage.
4. Time-Lapse-Imaging von Mesentery Tissue
- Am Tag der Bildgebung, ergänzen die Medien in jeder Vertiefung mit konjugierten BSI-Lektin und unter Standardkulturbedingungen für 30 min inkubiert. Waschen Sie Gewebe zweimal mit Lektin-freien Medien. BSI-Lektin Fleck auf dem Gekröse Gewebe für bis zu 3 Tage in der Kultur sichtbar bleiben.
- Übertragen Sie die Platte zu einem Mikroskoptisch. Identifizieren Sie Blut- und Lymphgefäße auf der Grundlage ihrer Morphologie und Netzstruktur.
- Suchen Sie eine gewünschte Netzbereich auf jedem Gewebe und nehmen Bilder. Beachten Sie die BildgebungLage die gleiche Region zu gewährleisten wird für nachfolgende Bilder aufgenommen werden. Wenn eine motorisierte Bühne verwenden, dokumentieren die Koordinaten.
- Zurück Gewebe in den Inkubator und weiter zu Kultur, bis der gewünschte Endpunkt. Wiederholen Sie die Schritte 4,1-4,3 je nach Bedarf, je nach gewünschten experimentellen Zeitpunkten.
5. Gewebeimmunmarkierung
- BSI-Lektin Labeling
- Inkubieren Gewebe für 30 min bei 37 ° C mit 1.40 FITC-konjugiertem Lektin in Medien (2,5 ml Antikörperlösung pro Well in 6-Well-Platte) durch zwei Spülungen mit Medien folgt. Für Spülungen, fügen Sie Medien und dann sofort zu ersetzen.
- Live / Dead Labeling
- Inkubieren Gewebe für 10 min bei 37 ° C mit 1: 500 2 mM Ethidium Homodimer-1 und 1: 500 1 mM Calcein AM in Medium (2,5 ml Antikörperlösung pro Well in 6-Well-Platte) durch zwei Spülungen mit Medien folgt.
- BSI-Lektin / NG2 Labeling
- Spread Gewebe auf einem Mikroskop geschobene (1 - 2 Gewebe / Folie) und trocknen lassen. Entfernen Sie überschüssiges Fett mit einem Skalpell durch Drücken Sie fest nach unten um das Fett zu auszuschneiden.
- Fix Gewebe in kaltem Methanol 30 Minuten bei -20 ° C. Waschen Gewebe mit PBS (3 x 10 min).
- Für die primäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100 Kaninchen-polyklonalen Antikörper NG2 und 5% normalem Ziegenserum (NGS). Waschen Gewebe mit PBS (3 x 10 min).
- Für sekundäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100 goat anti-rabbit CY2-konjugiertem Antikörper (GAR-CY2) und 5% NGS. Waschen Gewebe mit PBS (3 x 10 min).
- Inkubieren Gewebe für 30 min bei Raumtemperatur mit 01.40 FITC-konjugiertem Lektin in PBS, gefolgt von zwei Spülungen mit PBS. Für Spülungen, fügen PBS und dann sofort zu ersetzen.
- Um die Folien montieren, decken Gewebe mit 50:50 PBS und Glycerin-Lösung und Eindecken an der Spitze. Verschließen Sie die Dia Kanten mit Nagellack.
- LYVE-1 / PECAM Labeling
- Verbreiten Sie Gewebe auf einem Objektträger (1 - 2 Gewebe / Folie) und trocknen lassen. Entfernen Sie überschüssiges Fett mit einem Skalpell durch Drücken Sie fest nach unten um das Fett zu auszuschneiden.
- Fix Gewebe in kaltem Methanol 30 Minuten bei -20 ° C. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Für die primäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 200 monoclonalen Maus-biotinyliertem CD31-Antikörper und 1: 100 Kaninchen polyklonalen LYVE-1-Antikörper in PBS + 0,1% Saponin + 2% Rinderserumalbumin (BSA) + 5% NGS . Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Für sekundäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 500 CY3-konjugiertem Streptavidin-Antikörper und 1: 100 GAR-CY2 in PBS + 0,1% Saponin + 2% BSA + 5% NGS. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Zur Montage Träger, Deckgewebe mit 50:50 PBS und Glycerin-Lösung und setzen Sie ein Deckglas an der Spitze. Verschließen Sie die Dia Kanten mit Nagellack.
- BrdU / BSI-Lektin Labeling
- 1 mg / ml BrdU auf Medien und Gewebemedien mit BrdU-Lösung zu ersetzen. bei 37 ° C für 2 h inkubiert.
- Verbreiten Sie Gewebe auf einem Objektträger (1 - 2 Gewebe / Folie) und trocknen lassen. Entfernen Sie überschüssiges Fett mit einem Skalpell durch Drücken Sie fest nach unten um das Fett zu auszuschneiden.
- Fix Gewebe in kaltem Methanol 30 Minuten bei -20 ° C. Waschen Gewebe mit PBS (3 x 10 min).
- Gewebe DNA in 2 M HCl für 1 h bei 37 ° C denaturieren. Waschen Gewebe in PBS + 0,1% Saponin (3 x 10 min).
- Für die primäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100 monoklonaler Maus-anti-BrdU in PBS + 0,1% Saponin + 2% BSA + 5% NGS. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Für sekundäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100 Ziegen- anti-Maus-Cy3-konjugiertem Antikörper (GAM-Cy3) in PBS + 0,1% Saponin + 2% BSA + 5% NGS. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Inkubieren Gewebe für 30 min bei Raumtemperatur mit 01.40 FITC-konjugiertem Lektin in PBS, gefolgt von zwei Spülungen mit PBS.
- Zur Montage Träger, Deckgewebe mit 50:50 PBS und Glycerin-Lösung und Eindecken an der Spitze. Verschließen Sie die Dia Kanten mit Nagellack.
- BSI-Lektin / CD11b Kennzeichnung
- Verbreiten Sie Gewebe auf einem Objektträger (1 - 2 Gewebe / Folie) und trocknen lassen. Entfernen Sie überschüssiges Fett mit einem Skalpell durch Drücken Sie fest nach unten um das Fett zu auszuschneiden.
- Fix Gewebe in kaltem Methanol 30 Minuten bei -20 ° C. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Für die primäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100-Maus-anti-Ratten-CD11b in PBS + 0,1% Saponin + 2% BSA + 5% NGS. Waschen Gewebe mit PBS + 0,1% Saponin (3 x 10 min).
- Für sekundäre Antikörpermarkierung inkubieren Gewebe für 1 h bei Raumtemperatur mit 1: 100 GAM-Cy3 in PBS + 0,1% Saponin + 2% BSA + 5% NGS. Waschen Sie Gewebe mit PBS+ 0,1% Saponin (3 x 10 min).
- Inkubieren Gewebe für 30 min bei Raumtemperatur mit 01.40 FITC-konjugiertem Lektin in PBS, gefolgt von zwei Spülungen mit PBS.
- Zur Montage Träger, Deckgewebe mit 50:50 PBS und Glycerin-Lösung und Eindecken an der Spitze. Verschließen Sie die Dia Kanten mit Nagellack.
Ergebnisse
Nach 3 Tagen in Kultur Gewebe wurden mit einer Live / Dead Lebensfähigkeit / Zytotoxizität Kit markiert , um die Lebensfähigkeit des microvasculature bei der Ratte Gekröse Kulturmodell (Abbildung 2A) zu demonstrieren. Die Mehrzahl der Zellen, die in der Gekröse lebensfähig blieben in der Kultur, in der Endothel-Zellen identifiziert wurden in mikrovaskulären Segmente auf ihren Standort. Endothelzellproliferation wurde auch von Lektin / BrdU - Markierung (2D) bestätigt. Zellen der glatten Muskulatur und Perizyten Gegenwart entlang Gefäßen wurden NG2 Kennzeichnung (2B) bestätigt. Labeling für LYVE1 und PECAM identifiziert Verzweigung Lymph- und Blutmikrovaskuläre Netzwerke und bestätigte , dass die lymphatischen im Vergleich zu Blut Endothelzellen Phänotyp (2C) gehalten.
Die Zeitraffer Merkmal dieses Modells wurde durch Markierung des microva genutztscular Netzwerken mit BSI-Lektins zu verschiedenen Zeitpunkten und Abbilden der Region innerhalb des Netzwerks über die Zeit; Diese Fähigkeit ist besonders wertvolle gewebespezifische angiogene Antworten für die Untersuchung. Die Ergänzung von Medien mit 10% Serum verursacht eine robuste angiogene Reaktion nach 3 Tagen Stimulation. Zusätzlich werden neue Gefäßsegmente und Kapillar Sprossen wurden am Tag 5 der Stimulation (Figur 3) identifiziert. Die Zeitraffer-Imaging - Verfahren für den quantitativen Vergleich von Netzregionen erlaubt vor und nach Stimulation (Abbildung 4). Für diese repräsentative Studie, die unsere bisherigen Ergebnisse 9, die Anzahl der Gefäße pro Gefäßbereich und die Anzahl der Kapillar - Sprossen pro Gefässhof wurden pro Gewebe quantifiziert von einem 4X Bild erhärtet. Blutgefäßsegmente definiert wurden als Lektin-positive Zellsegmente Blut endothelialen, die zwischen zwei Verzweigungspunkten und Kapillar-Sprossen wurden als Blind definiert beendet Segmente von einem Host Behälter stammen. Zeitraffer-Vergleich der Netzwerkregionen auch Verfolgung von Endothelzellen Segmente (5) und die Identifizierung von Blut / Lymphgefäß mis-Musterung (Abbildung 6) aktiviert. Kennzeichnung von kultivierten Gewebe für Lectin und CD11b bestätigt zusätzlich die Gegenwart von interstitiellen Makrophagen (Abbildung 7) in Remodeling - Netzwerken.

Abbildung 1. Mesenteriale Fenster wurden durch Herausziehen des Dünndarms durch eine chirurgische Stufe angeordnet. Die chirurgische Phase wurde durch 3-D-Druck entwickelt und hergestellt. Die elliptische Loch in der Mitte etwa 2 in von 1 (A). Die mesenterialen Fenster wurden verteilt dann an die Spitze eines Membraneinsatzes und der Einsatz wurde umgedreht und in einen Brunnen (B). Maßstabsbalken = 2 cm.ecsource.jove.com/files/ftp_upload/55183/55183fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 2. Die Blutgefäße lebensfähig bleiben in der Ratte Gekröse Kulturmodell. Live / Dead - Test nach der Kultur durchgeführt zeigte ein hohes Verhältnis von lebenden Zellen (grün) zu toten Zellen (rot) speziell entlang der Blutgefäße (A). Mesentery Gewebe wurden mit Lektin und anti-NG2 markiert, an Perizyten (rot) an Schiffen (grün) zu identifizieren und dass verschiedene Arten von Zellen zu bestätigen vorhanden sind , in den post Kultur Gewebe (B). Die Gewebe wurden auch gegen PECAM beschriftet / LYVE-1 Blut (rot) Gefäße aus lymphatischen (grün) Schiffe (C) zu identifizieren. Um zu untersuchen, ob die mikrovaskuläre Zellen-Proliferation in Kultur unterziehen, Gekröse Gewebe wurden mit Lektin / anti-BrdU . Auf Kapillar - Segmente mit Lektin (grün) markiert wurden bestätigt mehrere Zellen proliferative (rot) (D) zu sein. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Zeitraffer-Bildgebung der Ratte Mesenterium ermöglicht im Laufe der Kultur mikrovaskuläre Remodeling beobachten. Eine robuste angiogene Reaktion wurde nach 3 (B) und 5 Tage (C) der Kultur mit 10% Serum - Stimulation beobachtet. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
files / ftp_upload / 55183 / 55183fig4.jpg "/>
Abbildung 4. Die mikrovaskuläre Netzwerke im Kulturmodell Ratte Gekröse wurden bebildert vor und nach der Angiogenese. Vergleich des gleichen Netzes markiert mit Lektin am Tag 0 und Tag 3 (A, B) nach Stimulation mit 10% Serum identifiziert neue Gefäße. Lektin-Etiketten auch eine Population von nicht identifizierten interstitiellen Zellen. Quantifizierung der Gefäßdichte (C, D) und die Anzahl der kapillaren Sprossen pro Gefäßbereich (E, F) bestätigt für jedes Gewebe eine Zunahme in beiden Metriken. C, E) vor (Tag 0) und nach (Tag 3) Vergleiche pro Gewebe. D, F) Vergleich zwischen Tag 0 und Tag 3 Mittelwerte ein gekoppeltes Student-t-Test bestätigt einen signifikanten Unterschied sowohl in der durchschnittlichen Anzahl von Gefäßsegmente (p <0,0001) und der durchschnittlichen Anzahl von Sprossen (p <0,00001) pro Gefässhof . Weiße Balken repräsentieren Tag 0 und schwarze Balken repräsentieren Tag 3. Values sind Mittelwerte ± SEM. Für diese repräsentative Analyse wurden 13 Gewebe aus zwei Ratten geerntet. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 5. Die Kulturmodell Ratte Gekröse kann für die Untersuchung von Gefäß Insel Schicksal und die Einbindung in der Nähe Netze verwendet werden. Mit Zeitraffer-Bildgebung, vaskuläre Inseln, als nicht verbunden endothelialen Segmente definiert, wurden am Tag identifiziert 0 und deren Verbindung mit dem nahe gelegenen Netzwerk wurde von Tag 3 nach der angiogenen Stimulation bestätigt. Mesenterium - Gewebe wurden mit bFGF (A, B) und VEGF / PDFG-BB (C, D) stimuliert. Hohl Pfeile zeigen getrennte Segmente am Tag 0 und solide Pfeile repräsentieren Insel Verbindung zum network. Pfeilspitzen zeigen die Lage der Verbindungen zwischen einer vaskulären Insel und dem nahe gelegenen Netzwerk. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abbildung 6. Zeitraffer-Bilder zeigen die Fähigkeit Lymph- und Blutgefäßmusterbildung zu beobachten. Lymphatische (l) Schiffe können von Arteriolen zu unterscheiden (a) und Venolen (v) , bezogen auf die Kennzeichnung Morphologie am Tag 0 (A). Am Tag 5 nach Stimulation mit 10% Serum wird lymphatischen Morphologie verloren und Gefäße scheinen mit den nahe gelegenen angiogenen Blutgefäße (B) integriert zu haben. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier ein , um zu vergrößernVersion dieser Figur.
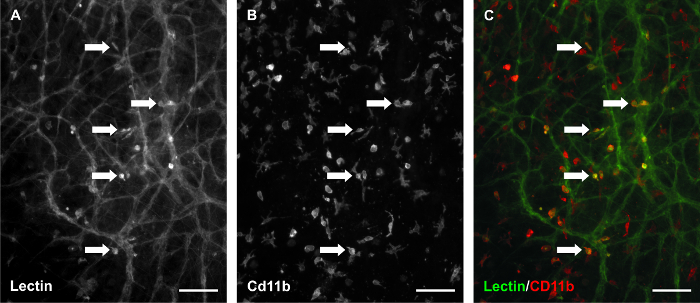
Abbildung 7. Makrophagen bleiben in kultivierten Ratte mesenterialen Gewebe. Lectin / CD11b co-Kennzeichnung von Geweben für 3 Tage kultiviert mit 10% Serum legen nahe, dass Lectin positive interstitiellen Zellen sind eine Untergruppe von Makrophagen. (A) Ein repräsentatives Bild von BSI-Lektin - Kennzeichnung. (B) CD11b Etikett im selben Sichtfeld. (C) Das fusionierte Bild. Die Pfeile kennzeichnen Beispiele von Co-Kennzeichnung. Maßstabsbalken = 100 & mgr; m. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Dieses Protokoll dokumentiert ein Verfahren zur Verwendung der Ratte Gekröse Kulturmodell als Ex - vivo - Werkzeug für Zeitraffer-Bildgebung von mikrovaskulären Netzwerk Wachstum. Frühere Arbeiten in unserem Labor wurde für 1) Angiogenese 8, 2) Lymphangiogenese 8, 3) pericyte-Endothel-Interaktionen 8, die Verwendung unseres Modells etabliert und 4) anti-angiogenen Drogen - Test - 9. Die Fähigkeit zum Abbilden kultivierten Ratten Mesenterium Gewebe zu mehreren Zeitpunkten bietet eine quantitative Assay für gewebespezifische Wachstumsreaktionen und die Verfolgung von Zell-Zell-Wechselwirkungen während der verschiedenen angiogenen Stimuli auswertet. Die erhöhte Proliferation von Endothelzellen während der Angiogenese und die Anwesenheit von Perizyten sind konsistent mit unseren früheren Arbeiten 8 und die dynamischen Interaktionen zwischen mehreren Zelltypen während der Angiogenese in kultivierten Ratten mesenterialen Gewebe validieren.
Im Vergleich zu häufig verwendeten Gewebekulturmodelle und in vitro - Zellkultursystemen, ist die Ratte Gekröse Kulturmodell einzigartig , weil das Wachstum innerhalb eines intakten, real mikrovaskulären Netzwerk auftritt. Betrachten Sie die Aorten - Ring - Test im Gegensatz, die etabliert wurde in einem Kollagen - Gel 10 angiogenen Sprießen von Aorten - Segmente zu studieren. Während Sprießen mehrere Zelltypen in dem aortischen Ring beinhaltet, Kapillar Sprossen wachsen aus den ausgeschnittenen Segmente der Aorta, die aus der in vivo - Szenario unterscheidet. Das Hirnschnittmodell ist ein weiterer Ex - vivo - Modell, aber es ist frei von Lymphgefäßen. Darüber hinaus hat das Hirnschnittmodell nicht vor und nach der angiogenen Stimulation 11 der Lage , Zeitraffer-Bildgebung gezeigt werden. Ein weiterer Ex - vivo - Modell , das vor kurzem eingeführt wurde , ist die Retina Kulturmodell. Der Vorteil der Retina Modells ist, dass die Angiogenese tritt aus intakten microvascular Netzwerke innerhalb des Gewebes 12, 13. Bei diesen Modellen GFP-transgenen Mäuse - Stämme können verwendet werden, um Kapillare zu beobachten , im Laufe der Zeit sprießen, aber leider ist die Maus Gekröse avascular 14, das GFP-transgenen Mäusen Gekröse Substitution für Ratten - Gekröse beseitigen, wie in unserem Modell genutzt. Darüber hinaus zeigen wir , dass eine einfache Kennzeichnung von Lektin Ratte Mesenterium Geweben in Kultur ausreichend ist , das Wachstum des Netzwerks zu verschiedenen Zeitpunkten und im Vergleich zu den anderen ex vivo Modellen unser Modell für die gleichzeitige Beobachtung von sowohl Blut- und lymphatischen Endothelzellen ermöglicht zu bestimmen.
BSI-Lektin wurde in diesem Papier mit mikrovaskuläre Netzwerke zu visualisieren und angiogene Antworten erkennen. Lectin ist eine Proteinstruktur, die Glykoproteine auf Endothelzellen bindet, und wurde für dieses Protokoll aufgrund der kurzen Inkubationszeit im Vergleich zu endothelial ANTIB ausgewähltenody Marker. Lectin ist weniger teuer als Antikörper und es erfordert keine Befestigungs; es kann auch mit frischem Medium nach der Inkubationszeit Enden in den Kulturmedien und ersetzt leicht gemischt werden. Während zukünftige Studien die möglichen Auswirkungen der Lektin - Markierungstechnik auf dem angiogenen Prozess aufzuklären benötigt werden , unsere repräsentative Ergebnisse (Abbildung 4) zeigen , dass die robuste Angiogenese induziert und 9 früheren Arbeiten demonstriert werden kann , dass die Angiogenese in Lektin markierte Netzwerke über Targeting gehemmt werden Vascular Endothelial Growth Factor (VEGF). Antikörper-Marker können möglicherweise als Alternative Markierungsmethode verwendet werden, wenn es einen Bedarf an spezifischeren Markern ist, oder wenn es eine Notwendigkeit, andere Zelltypen zu untersuchen, die in den mikrovaskulären Netzwerke wie glatte Muskelzellen vorhanden sind, Perizyten und Nerven. Ein weiteres mögliches Verfahren zur Visualisierung von Zellen würden Gen-Transfektion sein.
Der Vorteil der Zeitraffer-Ratte Gekröse-Modell hat sich in den repräsentativen Ergebnissen für dieses Protokoll hervorgehoben. Der Vergleich der Bilder vor und nach der Behandlung reduziert die Probleme der Variabilität, die nicht-gepaarte statistische Analyse beeinflussen. Das Explantat spezifischen Antworten von 20% bis 233% ige Erhöhung der Gefäßdichte und von 40% bis 3,500% Erhöhung der Spross Dichte variiert. Die spezifischen Ursachen für diese Variante sind unbekannt, aber in demselben Gewebe im Laufe der Zeit das Wachstum Messung zeigen die Fähigkeit, Gewebe spezifische Antworten zu bestätigen.
Vergleichende Analyse von Bildern, die zu verschiedenen Zeitpunkten während der mikrovaskulären Wachstums ermöglicht auch Endothelzellen zur Nachführung. Zum Beispiel hat unser Labor vaskulären endothelialen Zell Inseln als Segmente in der Nähe der mikrovaskulären Netzwerke identifiziert , die von nahe gelegenen Netzwerke 15, 16 getrennt sind. Um zu bestätigen, dass diese Inseln zu den nahe gelegenen networ verbindenk in Antwort auf angiogene Stimuli wurde die Ratte Mesenterium Kulturmodell verwendet. Wie in 5 gezeigt, wurden vaskuläre islands nach Gewebestimulation mit basischen Fibroblast Growth Factor (bFGF) oder VEGF und Platelet-Derived Growth Factor (PDGF) verfolgt. Wir haben auch ähnliche Ergebnisse Post Serumstimulation (Daten hier nicht gezeigt) gezeigt. Nach der Stimulation der Angiogenese, können die ursprünglich getrennten vaskulären Inseln gefunden in der Nähe Netzwerke angeschlossen werden.
Andere mögliche Anwendungen der Ratte Mesenterium Kulturmodell konnte die Möglichkeit nutzen, um die Beziehungen zwischen den Lymph- und Blutgefäße und ihre jeweiligen Endothelzellen und die Verfolgung von interstitiellen Zellschicksal zu untersuchen. Zeitraffer-Bilder von der gleichen mikrovaskuläre Netzwerke vor und nach Stimulation mit 10% Serum in diesem Modell zur Verfügung gestellt Beispiele für mögliche lymphatischen-to-Blutgefäß - Integration (Abbildung 6). Vor Stimulation, Lymph- und Blut vessels wurden basierend auf Gefäßmorphologie aus. Nach der Stimulation wurde lymphatischen gegen Blutgefäß Identität weniger klar. Das Potential für lymphatische / Blut Wechselwirkungen endothelial Zelle wird durch die Beobachtung unterstützt PECAM + / LYVE-1- Blut Endothelzellen Verbinden mit PECAM + / LYVE-1 + lymphatischen Endothelzellen (Daten hier nicht gezeigt). Diese Beobachtungen unterstützen die Verwendung des Kulturmodell Ratte Gekröse zur Untersuchung von lymphatischen / Blut endothelialen Zellplastizität. 6A zeigt auch das Lektin Kennzeichnung scheinbaren interstitiellen Zellen. Während diese Markierung von Gewebe zu Gewebe inkonsistent und heterogen ist, macht es die Anwesenheit von endogenem Gewebe residenten Zellen betonen. CD11b Kennzeichnung von kultivierten Gewebe (7) legt nahe , dass diese Lektin-positive interstitiellen Zellen eine Teilmenge von Makrophagen sein könnte. In Anbetracht der sich abzeichnende Interesse an Makrophagen - Beteiligung an der Angiogenese 20 eine zusätzliche Festigkeit derModell könnte seine Verwendung zu Makrophagen Dynamik im Laufe der Zeit zu verfolgen.
Ähnlich wie andere ex vivo Modelle, eine Strombegrenzung Angiogenese in der Ratte Mesenterium Kulturmodell zu studieren , ist der Mangel an Blutfluß. Schubspannung durch den Blutfluss verursacht hat , eine Rolle bei der endothelialen Zellmorphologie und die Proliferation sowie die Angiogenese 17, 18, 19 zu spielen gezeigt. Für die repräsentative Ergebnisse , dargestellt in Figur 4, die Abwesenheit von Scherspannung allein möglicherweise ausreichend, eine angiogene Antwort in den kultivierten Netzwerke zu induzieren. Wir wissen jedoch, dass auf der Grundlage unserer ersten Veröffentlichung Charakterisierung der Ratte Gekröse Kulturmodell 8, dass die Medien - Supplementierung verursacht eine erhöhte Angiogenese im Vergleich zu Medien allein. Zukünftige Studien fließen in den kultivierten mikrovaskulären Netzwerke enthält zweifellos notwendig, um mehr zu imitieren eng dieIn - vivo - Szenario. Mögliche Ansätze für die Einbeziehung fließen könnte Kanülierung Netzwerk Fütterung Arteriolen oder sogar Kanülierung weiter stromaufwärts Arterien innerhalb der Fett Grenze der mesenterialen Fenster schließen. Doch trotz der fehlenden Strömung, die Lebensfähigkeit von mehreren Zelltypen, die Aufrechterhaltung von Blut und lymphatischen mikrovaskuläre Netzwerke und Zellproliferation während der Angiogenese unterstützt die relativ erhöhtes Maß an Komplexität der Ratte Mesenterium Kulturmodell im Vergleich zu zellbasierten in vitro - Modellen.
Abschließend beschreibt dieses Protokoll eine einfache und reproduzierbare ex - vivo - Verfahren zur Abbildung angiogene Antworten in intakten mikrovaskulären Netzwerken. Ein solches Verfahren bietet eine Alternative zur zellbasierten in vitro - Modelle für die Bewertung angiogenen Zelldynamik an spezifischen Stellen innerhalb einer Netzwerkumgebung. Das Verfahren bietet auch ein neues Werkzeug für die Untersuchung von Angiogenese, Lymphangiogenese und Blut / lymphatische mis-Rüttlergleichzeitig ning.
Offenlegungen
The authors declare that they have no competing financial interests.
Danksagungen
This work was supported by National Institutes of Health Grant 5-P20GM103629 to WLM and the Tulane Center for Aging. We would like to thank Matthew Nice for his help with editing the protocol text.
Materialien
| Name | Company | Catalog Number | Comments |
| Drape | Cardinal Health | 4012 | 12” x 12” Bio-Shield Regular Sterilization Wraps |
| Scalpel Handle | Roboz Surgical Instrument | RS-9843 | Scalpel Handle, #3; Solid; 4" Length |
| Sterile Surgical Blade | Cincinnati Surgical | 0110 | Stainless Steel; Size 10 |
| Culture Dish (60 mm) | Thermo Scientific | 130181 | 10/Sleeve |
| Graefe Forcep (curved tweezers) | Roboz Surgical Instrument | RS-5135 | Micro Dissecting Forceps; Serrated; Slight Curve; 0.8 mm Tip Width; 4" Length |
| Graefe Forcep (straight tweezers) | Roboz Surgical Instrument | RS-5130 | Micro Dissecting Forceps; Serrated, Straight; 0.8 mm Tip Width; 4" Length |
| Noyes Micro Scissor | Roboz Surgical Instrument | RS-5677 | Noyes Micro Dissecting Spring Scissors; Straight, Sharp-Blunt Points; 13 mm Cutting Edge; 0.25 mm Tip Width, 4 1/2" Overall Length |
| Gauze Pads | FisherBrand | 13-761-52 | Non-Sterile Cotton Gauze Sponges; 4" x 4" 12-Ply |
| Cotton-Tippled Applicators | FisherBrand | 23-400-124 | 6" Length; Wooden Shaft; Single Use Only |
| 6-Well Plate | Fisher Scientific | 08-772-49 | Flat Bottom with Low Evaporation Lid; Polystyrene; Non-Pyrogenic |
| Sterile Syring 5 mL | Fisher Scientific | 14-829-45 | Luer-Lok Tip |
| Sterile Bowl | Medical Action Industries Inc. | 01232 | 32 oz. Peel Pouch; Blue; Sterile Single Use |
| 6-Well Plate Inserts (CellCrown Inserts) | SIGMA | Z681792-3EA | 6-Well Plate Inserts; Non-Sterile |
| Polycarbonate Filter Membrane | SIGMA | TMTP04700 | Isopore Membrane Filter; Polycarbonate; Hydrophilic; 5.0 µm, 47 mm, White Plain |
| Name | Company | Catalog Number | Comments/Description |
| Beuthanasia | Schering-Plough Animal Health Corp. Union (Ordered from MWI Veterinary Supply) | MWI #: 011168 | Active Ingredient: Per 100 mL, 390 mg pentobarbital sodium, 50 mg phenytoin sodium |
| Ketamine | Fort Dodge Animal Health (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Kateset 100 mg/mL |
| Xylazine | LLOYD. Inc. (Ordered from MWI Veterinary Supply) | MWI #: 000680 | Anased 100 mg/mL |
| Saline | Baxter | 2F7122 | |
| PBS | Invitrogen | 14040-133 | |
| MEM | Invitrogen | 11095080 | |
| PenStrep | Invitrogen | 15140-122 | |
| FBS | Invitrogen | 16000-044 | |
| BSA | Jackson ImmunoResearch | 001-000-162 | |
| Saponin | SIGMA | S7900-100G | |
| Isopropyl Alcohol | Fisher Scientific | S25372 | |
| Povidone-Iodine | Operand | 82-226 | |
| Hydrochloric Acid | SIGMA | 320331 | |
| Methanol | Fisher Scientific | 67-56-1 | |
| Glycerol | Fisher Scientific | 56-81-5 | |
| FITC-conjugated Lectin | SIGMA | L9381-2MG | |
| Anti-NG2 Chondroitin Sulfate Proteoglycan Antibody | SIGMA | AB5320 | |
| PECAM (CD31) Antibody | BD Biosciences | 555026 | |
| LYVE-1 Antibody | AngioBio Co. | 11-034 | |
| Goat Anti-Rabbit Cy2-conjugated Antibody | Jackson ImmunoResearch | 111-585-144 | |
| Goat Anti-Mouse Cy3-conjugated Antibody | Jackson ImmunoResearch | 115-227-003 | |
| Streptavidin Cy3-conjugated Antibody | Jackson ImmunoResearch | 016-160-084 | |
| Live/Dead Viability/Cytotoxicity Kit | Invitrogen | L3224 | |
| Normal Goat Serum | Jackson ImmunoResearch | 005-000-121 | |
| 5-Bromo-2'-Deoxyuridine | SIGMA | B5002 | |
| Monoclonal Mouse Anti-Bromodeoxyuridine Clone Bu20a | Dako | M074401-8 | |
| Mouse Anti-Rat CD11b | AbD Serotec | MCA275R |
Referenzen
- Carmeliet, P., Jain, R. K. Angiogenesis in cancer and other diseases. Nature. 407 (6801), 249-257 (2000).
- Carmeliet, P. Angiogenesis in life, disease and medicine. Nature. 438 (7070), 932-936 (2005).
- Kaunas, R., Kang, H., Bayless, K. J. Synergistic Regulation of Angiogenic Sprouting by Biochemical Factors and Wall Shear Stress. Cell Mol Bioeng. 4 (4), 547-559 (2011).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5 (9), 1518-1534 (2010).
- Song, J. W., Munn, L. L. Fluid forces control endothelial sprouting. Proc Natl Acad Sci U S A. 108 (37), 15342-15347 (2011).
- Chan, J. M., et al. Engineering of in vitro 3D capillary beds by self-directed angiogenic sprouting. PLoS One. 7 (12), e50582(2012).
- Peirce, S. M., Mac Gabhann, F., Bautch, V. L. Integration of experimental and computational approaches to sprouting angiogenesis. Curr Opin Hematol. 19 (3), 184-191 (2012).
- Stapor, P. C., Azimi, M. S., Ahsan, T., Murfee, W. L. An angiogenesis model for investigating multicellular interactions across intact microvascular networks. Am J Physiol Heart Circ Physiol. 304 (2), H235-H245 (2013).
- Azimi, M. S., et al. An ex vivo model for anti-angiogenic drug testing on intact microvascular networks. PLoS One. 10 (3), e0119227(2015).
- Nicosia, R. F., Ottinetti, A. Growth of microvessels in serum-free matrix culture of rat aorta. A quantitative assay of angiogenesis in vitro. Lab Invest. 63 (1), 115-122 (1990).
- Hutter-Schmid, B., Kniewallner, K. M., Humpel, C. Organotypic brain slice cultures as a model to study angiogenesis of brain vessels. Front Cell Dev Biol. 3, 52(2015).
- Sawamiphak, S., Ritter, M., Acker-Palmer, A. Preparation of retinal explant cultures to study ex vivo tip endothelial cell responses. Nat Protoc. 5 (10), 1659-1665 (2010).
- Unoki, N., Murakami, T., Ogino, K., Nukada, M., Yoshimura, N. Time-lapse imaging of retinal angiogenesis reveals decreased development and progression of neovascular sprouting by anecortave desacetate. Invest Ophthalmol Vis Sci. 51 (5), 2347-2355 (2010).
- Norrby, K. In vivo models of angiogenesis. J Cell Mol Med. 10 (3), 588-612 (2006).
- Kelly-Goss, M. R., Sweat, R. S., Azimi, M. S., Murfee, W. L. Vascular islands during microvascular regression and regrowth in adult networks. Front Physiol. 4, 108(2013).
- Kelly-Goss, M. R., et al. Cell proliferation along vascular islands during microvascular network growth. BMC Physiol. 12, 7(2012).
- Skalak, T. C., Price, R. J. The role of mechanical stresses in microvascular remodeling. Microcirculation. 3 (2), 143-165 (1996).
- Kadohama, T., Nishimura, K., Hoshino, Y., Sasajima, T., Sumpio, B. E. Effects of different types of fluid shear stress on endothelial cell proliferation and survival. J Cell Physiol. 212 (1), 244-251 (2007).
- Milkiewicz, M., Brown, M. D., Egginton, S., Hudlicka, O. Association between shear stress, angiogenesis, and VEGF in skeletal muscles in vivo. Microcirculation. 8 (4), 229-241 (2001).
- Corliss, B. A., Azimi, M. S., Munson, J. M., Peirce, S. M., Murfee, W. L. Macrophages: An Inflammatory Link Between Angiogenesis and Lymphangiogenesis. Microcirculation. 23 (2), 95-121 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten