Method Article
Сканирующей электронной микроскопии (SEM) Протоколы для Проблемной завода, оомицет и грибковые Образцы
В этой статье
Резюме
Problems in the processing of biological samples for scanning electron microscopy observation include cell collapse, treatment of samples from wet microenvironments and cell destruction. Low-cost and relatively rapid protocols suited for preparing challenging samples such as floral meristems, oomycete cysts, and fungi (Agaricales) are compiled and detailed here.
Аннотация
Общие проблемы при обработке биологических образцов для наблюдений с помощью сканирующего электронного микроскопа (SEM), включают коллапс клеток, обработка образцов из влажных микросреды и разрушение клеток. Использование молодых цветочных тканей, оомицет цисты, и спор грибов (Agaricales) в качестве примеров, конкретные протоколы для обработки тонких образцов, описанных здесь, которые необходимо преодолеть некоторые из основных проблем в лечении образца для захвата изображения при SEM.
Цветочные меристемы, скрепленные FAA (формалин-уксусный-спирт) и обрабатывается с точкой сушильную Critical (CPD) не проявляла разрушилась клеточные стенки или искаженное органы. Эти результаты имеют решающее значение для реконструкции цветочного развития. Подобная CPD-основанная обработка образцов из влажных микросреды, таких как глутаральдегида фиксированные оомицет кист, является оптимальным для проверки дифференциального роста диагностических характеристик (например, киста) шипами на различных типах суbstrates. Уничтожение трофоцитов прикрепленных к спор грибов удалось избежать после регидратации, обезвоживания и лечения CPD, что является важным шагом для дальнейшего функциональных исследований этих клеток.
Подробно изложенные здесь протоколы представляют собой недорогие и быстрые альтернативы для приобретения качественных изображений, чтобы восстановить процессы роста и изучения диагностических характеристик.
Введение
В биологии, использование сканирующей электронной микроскопии (SEM) была распространена на изучение структурной эволюции, сравнительной морфологии, развития органов, а также характеристика популяций или видов 1. Благодаря двухмерном виде микроскопических структур, таких областях, как микроморфологией и систематики прибыль от SEM техники достижений , начиная со второй половины 20 - го века. Например, введение методики покрыти распылением в 1970 - е годы стало возможным наблюдения деликатных материалов , таких как стрелять верхушках и цветов путем более широкого томографию непроводящих тканей 2, 3. СЭМ использует электронов , выбитых с поверхности образца , чтобы воспроизвести топографию в высоковакуумной среде 4.
Исследования с участием SEM сосредоточены как на выводе структурных персонажей и реконструкции growtч процессы. Новые структурные символы, имеющие отношение к систематике и систематика широкого спектра организмов были обнаружены из наблюдений SEM. Например, растительные признаки используются для видовой диагностики или надвидовых классификаций, таких , как одетый ямах древесины 5, клеймо разнообразия 6, нектарники и цветочные морфологии 7, 8, детали трихому 9 и пыльцевые зерна 10, 11, не может быть правильно визуализированных без SEM. Успешные наблюдения с обычными SEM были также достигнуты для длительного времени фиксированных формалином организмов 12 и растений гербарий образцов 13.
С другой стороны, исследования реконструкции процессов роста с использованием сканирующего электронного микроскопа включают широкий круг вопросов, таких как развитие органа 14, инфеctions , вызванные бактериями 15, растений корневой физиологии 16, механизмы крепления паразит-хозяин 17, 18, воздействие препарата на паразитов 19, mycoparasitism и антибиоз 20, 21, мальформации рост 22, сравнительное развитие диких и мутантных особей 23, и целые жизненные циклы 24. Несмотря на то, экологические сканирующие электронные микроскопы (ESEM) 25 может иметь важные преимущества для наблюдения влажных биологических образцов в процессах роста, тонкий материал все еще может быть поставлена под угрозу , даже в низком вакууме состояния ESEM), и должны быть обработаны надлежащим образом, чтобы избежать потери ценного морфологическое наблюдение.
В этой статье, обзор конкретных протоколов для SEM наблюдения трех Diffразличны типы образцов представлены: цветочные меристемы, оомицетами (сапролегния) и грибковые материал. Эти протоколы компилировать опыт наших предыдущих исследований SEM на основе 26, 27, 28, 29, 30, 31, 32, 33, где были обнаружены специфические трудности и альтернативные решения. В случае растений сравнительного опытно -конструкторских и структурных исследований, использование SEM началось в 1970 - е годы 34, 35, и с тех пор, исследователи обнаружили , что некоторые цветочные особенности более лабильны , чем считалось ранее 36. Реконструкция цветочного развития предполагает захват всех стадий между молодыми цветочными меристем и опыления. Для достижения этой цели, это еззеntial что образец топография и целостность клеточной стенки не поставить под угрозу после фиксации и последующего обезвоживания. Молодые цветочные меристемы особенно уязвимы для распада клеточной стенки (рис 1a, 1b). Кроме того, тонкие структуры, такие как нектарниками, лепестки, рыльца и спорангиев требуют эффективных и undamaging протоколов. В настоящем обзоре обобщены оптимальный протокол, чтобы держать молодых и деликатных тканей нетронутыми для визуализации SEM.
В случае оомицетов (Stramenopiles) -она из самых разнообразных и широко распространенных групп паразитов, с хостами , начиная от микробов и растений беспозвоночных и позвоночных животных 37 - Есть споры , которые растут и развиваются во влажной среде. Это условие представляет собой сложную задачу для наблюдения SEM, поскольку споры нуждаются в адекватной субстрат не подходит для стандартных протоколов SEM. Среди оомицетов, виды Saprolegnia представляют особый интерес , потому что они чап вызвать сильное сокращение аквакультур, рыбными и популяции земноводных 38. Микроморфологические характеристики, такие как крючковатыми колючками кист, были признаны полезными для идентификации видов Saprolegnia, что имеет основополагающее значение для установления контроля за инфекцией и возможные методы лечения 39. Здесь есть экспериментальный протокол для сравнения закономерности роста позвоночника кист на различных подложках и манипулировать образец для критической точки сушилки (CPD) подготовки и последующего наблюдения SEM.
В третьем случае, есть интересные находки , которые пришли после осмотра спорами грибов Phellorinia herculanea ф. Stellata ф. Нова (Agaricales) 31. Вместе со спорами, группа неожиданных детских клеток была определена в соответствии с SEM. С предыдущими традиционными протоколами и необработанного материала, кормилицы клетки пришли НУт полностью развалилась (рис 1в). Дальнейшие выводы о конкретных тканях , связанных с спор может быть сделано с простыми , но важных изменений в стандартных подходов , описанных здесь (рис 1d).
В данном обзоре, существуют подробные SEM протоколы, которые могут быть использованы для решения различных проблем, связанных с наблюдением SEM в покрытосеменные, оомицеты и Agaricales, такие как коллапсу клеток и сокращение меристемы ткани, неоптимального роста киста шипов, и разрушения эфемерные ткани, соответственно.

Рисунок 1: Сравнение образцов , обработанных без (а, с) и с (б, г) протокола FAA-этанол-CPD. (А - б) Цветочные почки Anacyclus clavatus, среднего развития. Bud обрабатывали осмия 46 </ SUP> (а) и Бутон обрабатывают с протоколом FAA-CPD (б). (C - d) трофоцитов спорами Phellorinia herculanea ф. Stellata. Высушенные образцы без обработки (с) и с протоколом здесь описано для Agaricales (г). Spores в оранжевый цвет. Весы: (AB) 100 мкм, (кд) 50 мкм. Фотографии были сделаны Y. Руис-Леон. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
Примечание: Этот протокол включает в себя шесть основных секций, три посвящены конкретным организмов (разделы 1-3), и три, описывающие процедуры, общие для всех (4-6). Звездочки (*) указывают на действия измененных экспериментаторами.
1. Исследования развивающихся стран и полностью сформированными растений Структуры
- Сбор и фиксация
- Если растительный материал собирается в месте, где нет доступа к вытяжном шкафу, ввести и погрузить материал в 70% этанола в центрифужные пробирки. В идеале, погружать материал после 48 ч в FAA (шаги 1.1.1-1.1.3), чтобы избежать чрезмерного обезвоживания в этаноле. Если вытяжной шкаф доступен для растительного материала, пропустите этот шаг и продолжить 1.1.1.
- Подготовьте формалин-уксусная спирта (FAA) закрепитель в вытяжном шкафу, снабженном альдегид фильтром. Добавить 85 ч 70% денатурированного этанола, 10 частей 60% -ного раствора формальдегида и 5 частей ледяной уксусной кислоты. Подготовить FAAкак раз перед закреплением материала, так как его длительное хранение не рекомендуется 40.
- Под вытяжным шкафом, влить запас FAA в индивидуальную широкогорлую и герметичных пластиковых бутылок. Используйте столько бутылок, как есть образцы, доступные, а также создавать метки для идентификации образцов.
- Выберите цветочные или вегетативные меристемы, чтобы исправить, чтобы они не были повреждены насекомыми, грибами или экстремальных погодных условий. Обрежьте ветви, удаляя нежелательный материал, и сразу же сдать пробу в растворе FAA.
- После 72-96 ч, залить FAA в пластиковый контейнер для химического удаления. Немедленно промойте образцы три раза со свежим 70% -ным этанолом, чтобы удалить остатки FAA. Фиксированный материал можно хранить неопределенно долго в 70% этаноле.
- Вскрытие и обезвоживание
- Рассеките фиксированный материал в 70% этаноле под стереомикроскопа использованием УЛЬТРАВЫСОКОЕ пинцет, пеedles, пинцеты, щетки, и микро-скальпели (максимальный размер ткани должна быть около 1 см 3, или 2 см для плоского материала). Рассекают образцы в чашку Петри, покрытой с этанолом, чтобы предотвратить ткани от высыхания. Используйте чашку Петри с основанием, покрытой сухим черным кремнем, чтобы лучше видеть контрастные белые ткани.
- Поместите расчлененный материал в контейнерах для образцов критической точки сушилки (НПР, рис 2а). На данный момент, погрузить контейнеры в чашку Петри с 70% -ным этанолом, и включают в себя идентификацию образца этикетки (сделанные с карандашом и бумагой). Для получения более эффективной сушки для дальнейшей обработки, во избежание смешивания молодых и зрелых образцы в том же самом контейнере. *
- Положите крышки на контейнеры и хранение их в пластиковые центрифужные пробирки с большим количеством 70% этанола. Хранить пробирки в течение ночи, если материал не обрабатывается немедленно.
- Передача расчлененный материала через следующий этанол серииs в герметичных банках или центрифужные пробирки: 70%, 90%, 100% и 100%. Оставьте образцы в каждом растворе в течение 1 ч, по крайней мере. Хранить образцы в течение ночи в 100% -ном растворе этанола.
- Перенесите контейнеры с материалом в НПР (раздел 4).
- Монтаж и подготовка растительных тканей для наблюдения SEM
- Написать идентификационный номер образца под держателей образцов SEM (т.е. алюминиевых заглушек). Накройте верхней части пней с двухсторонней ленты. Поместите окурки в держатель образца (рис 2b).
- Под стереомикроскопа, осторожно откройте контейнеры, несущие молодые и тонкие образцы уже высушенные в НПР. Имейте в виду, что после лечения CPD, образцы становятся светлее и чувствительны к электростатике. Закройте контейнеры после того, как образцы были вывезены во избежание попадания пыли или примесей.
- Поместите образцы на клейкой поверхности пней, планируя заранее желаемаяположение (как только образцы касаются поверхности, очень трудно удалить их). Не пытайтесь нести основную рассечение в этой точке; просто удалить нежелательные ткани, которое легко подобрать. Для палинологическими исследований, рассекают пыльники и открыть их, чтобы выставить пыльцы на корешки.
- Помещенный длинные пробы (например, 2 см длиной) , такие как соцветий в горизонтальном положении. Когда это возможно, образцы ориентируют той же структуры для полярных, сбоку и вид снизу. Оставьте достаточно места между образцами на пенек.
- Если образцы не могут быть обработаны сразу же, держать их защиту в течение ночи в герметичном контейнере с силикагелем , чтобы избежать регидратации (рис 2С) *. Coat образцы с использованием ионно-плазменного напыления для нанесения покрытий и передавать их на РЭМ (разделы 5 и 6).

Рисунок 2: Инструменты для образца manipulatiна и обработки перед обследованием SEM. (А) Steel производства образец контейнер с отверстиями стенками для развязки этанол / СО 2 в камере CPD. (Б) Стальные заглушки внутри пластикового держателя образца. (С) Стеклянная тара используется для хранения образцов , защищенные от влаги и пыли. В основании, есть отделение для силикагеля. (D) Критическая точка Сушильная. В передней, есть (слева направо) манометр, выключатель питания, системы контроля температуры и индикации температуры. Обычная рабочее давление CO 2 -этанол обмена составляет 60 бар (800 фунтов на квадратный дюйм). В верхней части, есть четыре клапана (впуск, сливные, вентиляции и выхлопных контроля), обрамляющие центральную камеру для образца. Фотографии были сделаны Y. Руис-Леон и М. А. Белло. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Выращивание и фиксация цисты
- Готовят пептон и глюкозу (ПГ-L) медиа - 41 с использованием D - (+) - глюкоза (6 г) и микологического пептона (3 г) *. Добавьте до 900 мл водопроводной воды и автоклав 40 мин при 121 ° С. Налейте 50 мл предварительно автоклавного раствора А (NaH 2 PO 4, 0,13 М) и 50 мл раствора B (Na 2 HPO 4, 0,13 М).
- Из маточных культур штаммов Saprolegnia рагазШса поддерживается на пептон, глюкоза, агаровой среде (ПГК, который получают , как PG-л , но с добавлением 10 г европейской бактериологического агара в глюкозу и пептон перед автоклава), растут мицелии колонии в 0,5 мл ПГ-л капель в течение 24-48 ч при 20 ° С в чашках Петри. Индуцирования споруляции промыванием мицелий с автоклавного водопроводной водой три раза и выдержки их в термостате в течение 15 ч при 20 ° C= "Xref"> 42, 43.
- Сбор высвобожденные вторичных зооспор, осторожно пипеткой верхнюю часть подвески и объединить их в 1 мл порциями. Перемешивают энергично Зооспоры в течение 30 с встряхиванием для получения вторичных кист 44.
- Чтобы проверить дифференциальный рост шипов цист на отдельных чашках Петри (р60), положить 0,5 мл вторичного киста суспензии на различные поверхности (т.е. углерода, золота и меди ПЭМ сетей; лососевых и хека рыбьей чешуи (ранее отбеленные), а также стекла покровные стекла) *. Инкубацию цист при 20 ° С в течение 70 мин, что способствует прикреплению цист на поверхность.
- Удалить жидкость и добавляют 0,5 мл 2% -ного глутарового альдегида к каждой поверхности для фиксации цист. Хранить образцы при комнатной температуре в вытяжном шкафу в течение 1 ч.
- Удалите глутаровый альдегид и обезвоживают образца через ряд этанол (30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% и 100%), с добавлением 5 мл каждого раствора в этаноле в течение 15 мин. После того, как в прошлом 100% -ного этанола, образец может храниться до месяца в герметичную чашку Петри. На этом этапе образцы готовы быть высушены в НПР.
- Тщательно передачи сетки и весы от чашки Петри к держателю, пригодного для НПР (раздел 4). Для этого шага, используется держатель для ППР сетки или держатель образца при штабелировании, сохраняющими образцы, отделенные друг от друга. Возьмите сетки и весы с помощью пинцета, имея в виду, что цисты должна быть обращена вверх все время сетками. *
- Монтаж и подготовка проб киста для наблюдения SEM
- Установите сетки и весов на алюминиевых заглушек, которые ранее были покрыты двухсторонней углеродной лентой и маркированы под ним.
- Передача образцов к распыл для нанесения покрытий (раздел 5).
- Обратите внимание на образцы под (раздел 6) SEM.
3. Изучение гербария Грибковые спорами Phellorinia herculanea под SEM
- Регидратация и обезвоживание спор
- Оберните каждую пробу тщательно фильтровальной бумагой, образуя карандашные меченных конверты ~ 0,5-1 см 2, следя за тем, чтобы не раздавить их. Уплотнение фильтровальную бумагу со скрепками. Передача запакованных образцов на чашку Петри и погружают их в 10 мл воды для регидратации тканей вокруг спор.
- Немедленно поставить образцы в микроволновой печи (600 Вт в течение приблизительно 20 лет). Удалите материал как только вода начинает испаряться, и дайте ему остыть при комнатной температуре.
- Пропускают через образцы следующей серии этанола: 30%, 50%, 70%, 80%, 90%, 95%, 100% и 100%. В зависимости от количества образцов, используйте химический стакан или центрифужные пробирки для этого шага. Оставьте образцов в течение 15 мин в каждом растворе.
- Поместите образцы в НПР (раздел 4).
- Монтаж и рУслуги ремонта споры для наблюдения SEM
- Откройте конверты. Налейте споры на предварительно подготовленную заглушкой с двухсторонней ленты. В качестве альтернативы, собирать споры с липкой поверхностью окурков, следя за тем, чтобы не раздавить их *.
- Если образцы содержат мало спор, в дополнение к предыдущему шагу, вырезать небольшой кусочек оболочки (~ 1 мм 2) и поместите его на новый заглушке *.
- Поместите тканей в распыл для нанесения покрытий (раздел 5).
- Соблюдайте под (раздел 6) SEM.
4. Сушка материала с использованием критической точки Сушилка для белья (CPD, рис 2d)
- Используйте CPD в проветриваемом помещении и убедитесь, что все клапаны машины закрыты. Проверьте, если образец камеры пуст и чист.
- Включите машину и убедитесь, что тестовая система контроля температуры происходит автоматически. Если CPD имеет внешнюю систему холодильная ванна, проверьте уровень воды перед переключением Iт на.
- Следуйте инструкциям производителя по конкретному CPD , используемой для этанола и СО 2 обмена. Для обеспечения безопасности, несут на этот шаг под руководством кого-то обученный для использования машины. Помните, что он подвергается воздействию быстро изменяющегося давления, это может сильно продуть.
- Вынимают образцы и продолжить с шагом 1.3 при работе с тканями растений, шаг 2.2 при работе с оомицеты кист, и шаги 3.2 при работе с спор грибов.
5. Покрытие образцов с золота с использованием распыл Coater (рис 3а)
- Проверьте распыл устройство для нанесения покрытий. Убедитесь в том, что цель золотой катод находится в хорошем состоянии. Используйте ткань без ворса поливают 90% этанолом для очистки стенок вакуумной камеры и крышку камеры, если это необходимо.
- Отметьте держатель с распылением чисел рядом с каждым заглушке отверстие для дальнейшей идентификации образцов под микроскопом. Осторожно поместите заглушек загружена SAMPLэс и закрепить их. С помощью поворотного этапа планетарной образца для обеспечения равномерного покрытия на образцах с неровными поверхностями.
- Следуйте инструкциям производителя , чтобы настроить такие параметры, как рабочее расстояние, рабочее давление газа (например, 5 × 10 -1 - 7 х 10 -1 мбар) (например, 30 мм.), Выбивания времени (например, 50 лет), толщина золотого слоя (например, 12 нм) тока (например, 15 мА) и напряжения питания (например, 600 в) 45.
- Снимите заглушки и взять их (раздел 6) SEM. В качестве альтернативы, поместите окурки в герметичный контейнер с силикагелем (фиг.2с).

Рисунок 3: дл покрыти распылением , (а) и с помощью сканирующего электронного микроскопа (б). (А) Вид спереди вакуумной камеры (слева), газ VALVе, таймер, вакуум, и текущий контроль. (Б) Вид сбоку основных компонентов SEM (слева направо): вакуумная колонна с камеры для образца, на экране компьютера с контролем, и монитор палаты. Фотографии были сделаны Y. Руис-Леон. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
6. Наблюдение под растровым электронным микроскопом (РЭМ, 3б)
- SEM запуска
- Следуйте инструкциям производителя , чтобы начать и установить СЭМ, регулируя высоту образца объективный диаметр диафрагмы (например, для растений 2 мкм и для грибов и оомицетов 4 мкм), рабочее напряжение (например, 15 кВ).
- Проверьте правильность выравнивания системы электронного пучка и установки осевого выравнивания и стигматоры в соответствии с указаниями изготовителя. Отрегулировать тон работает расстояние, чтобы получить адекватную глубину резкости.
- захват изображения
- Получите сфокусированное изображение образца и использовать его в качестве отправной точки. Увеличить масштаб близко к максимальному уровню и сфокусировать изображение снова. Выберите участки с неровностями поверхности, такие как отверстия. Правильный астигматизм и настроить оптимальную контрастность и яркость.
- Захват помощью сканирующего электронного микроскопа изображение с высоким разрешением. Используйте детектор ОЭ, если изображение показывает, что образцы заряжены. В противном случае, установите детектор SE. Изменение детекторов в соответствии с инструкциями изготовителя.
Результаты
Цветочный Разработка и фиксирование Разработка и полностью сформированными растений Структуры
Использование протокола FAA-CPD, описанный здесь, молодые и зрелые ткани растений оптимально фиксируется и обезвоживается для работы с изображениями SEM. Такие процессы, как цветочные развития могут быть восстановлены , так как рельеф и форма бутонов не искажается клетки с термоусадкой (рис 1b, 1d, 4a-F). Структуры с сложной формы могут быть с успехом покрыта равномерным слоем проводящего материала (металла из устройства для нанесения покрытия методом распыления), что позволяет восстановление в противном случае недостижимых деталей (Фигуры 4g-I, 5e). Хорошее качество изображения образцов от мокрых микросреды, которые раньше были переплачивает с электронным током , если сильно обезвожен и с покрытием, могут быть достигнуты (цифры 4F, 5а, 5b). Важные детали, такие как пыльца поверхности стены (5б, 5в) и различные типы indumenta (рис 5d-г) могут быть изучены в глубину без искусственных или нежелательных частиц или искаженных форм.
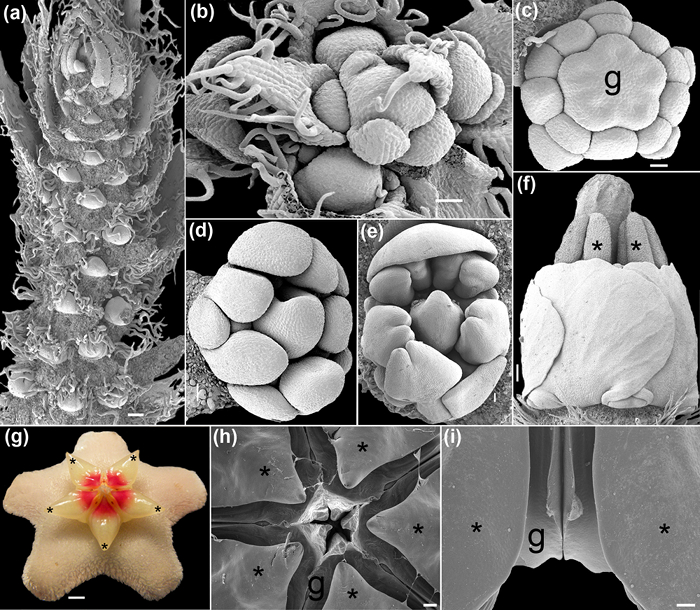
Рисунок 4: Ранний (а, б), в середине (C- е) и поздние (фи) цветочные развитие захватили под SEM. (А) из Caesalpinia Кисть Спиноза (Молина) Kuntze с несколькими цветочными меристем. (Б) Вид сверху молодой соцветия Polygala Aubl сияние. (С) Цветочный бутон Krameria ixine Loefl. во время гинецеем дифференциации. (D - е) Бутоны Erythrina зр. (Е) вид сбоку цветок Krameria ixine. Пыльники и стиль торчат. (Г - я) Хойя мясистая (L.) R. Brown. ( г) Цветок в опыления (цифровое изображение , полученное с Olympus SP-590UZ 26x). (Ч) Вид сверху тычинок и плодолистиков сплит. (Я) Вид сбоку пары тычинок фланговых два плодолистиков. Звездочки указывают тычинки. г = гинекей. Весы: (а, I) 1 мм, (б, г) 400 мкм, (в) 200 мкм, (е) 500 мкм, (F, H) 2 мм, (г) 0,25 см. Фотографии были сделаны М. А. Белло. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 5: SEM микрофотографии спорангиев и пыльцы (а, б), подробные поверхности (C- е) и indumenta (е - г). (А) спорангии Dryopteris зр. (Б) Пыльца Prunus Дульсис DA Webб посадка на рыльцем. (С) Пыльца Nepenthes ALATA Бланко. (D) Вид сбоку соцветия Erigeron karvinskianus DC. Изображение взято с опцией детектора BSE. (Е) Боковой вид мохообразных Peristoma зр. (Е) Железистая и не-железистые трихомы на абаксиальной поверхности листа розмарином лекарственный L. (Г) Вид сверху листа плоских шкал Olea еигораеа L. Весы: (а) 400 мкм, (б) 60 мкм, (в) 5 мкм, (г) 4 мм, (е) 600 мкм, (F) 200 мкм, (г) 600 мкм. Фотографии были сделаны Y. Руис-Леон. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Влияние различных подложках на позвоночнике Рост среднего кист Saprolegnia рагазШса
Модель роста позвоночника отличается на различных подложках. На стекле, шипы были удлинены и показали петли на их кончиках (таблица 1, рисунок 6а). На угле и золото сетки шипы короче, курчавый и растут более обильно вокруг кист без образования петель (рис 6b, 6d). Хотя на медные сетки, колючки имели тенденцию к скручиванию без зацикливания, некоторые из них удлиненное (рис 6в). На рыбью чешую, шипы были кудрявые, в изобилии вокруг поверхности , а иногда образуются петельные концы (рис 6е-е).

Рисунок 6: Дифференциальные модели роста шипами Saprolegnia рагазШса в цисты , погруженных в жидких средах. (А) Glass. (Б) углерода. (С) Медь. (D) золото. (Е) хека масштаба. (Е) Лосось масштаба. Прямые шипы были разработаны на стекле и меди, в то время как Скрученные колючки были сформированы на углерод, золото, и рыбьей чешуи. Крючковатым советы (белые стрелки) шипов наблюдаются во всех колючек, растущих на стекле и в нескольких шипов на рыбью чешую. Киста стены в желтый цвет. Масштаб: 20 мкм. Фотографии были сделаны Y. Руис-Леон и С. Rezinciuc. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
| поверхность | Позвоночник морфология | |
| относительное удлинение | Петля на конце | |
| Стеклянная крышка | Хорошее удлинение, шипы легко подсчитать | настоящее время |
| Рыбья чешуя | Шипы с фигурными форма не легко подсчитать | настоящее время |
| TEM сетки | Короткие и фигурные шипы не легко подсчитать | Нет на месте |
Таблица 1: Позвоночник морфологии с использованием различных видов субстрата.
Неожиданные наблюдения в Phellorinia herculanea ф. Stellata
Помимо неожиданного нахождения laticiferous гиф на exoperidium П. herculanea, Калонхе и др. 31 нашли шаровидные и гладкие трофоцитов (8-13 мкм) , смешанный со спорами в материале обезвоживают НПР благодаря стадии регидратации , выполняемой в микроволновой печи. (Рисунок 1d). Структура и детали стен тон нюни клетки и споры хорошо сохранились , несмотря на их дифференциальной композиции (рис 1c-D).
Обсуждение
Что касается стандартных протоколов SEM, процедуры, представленные здесь, включают в себя относительно быстро, легко следовать, и методологии недорогих. В зависимости от количества образцов и легкость обработки, это занимает от четырех до пяти дней, чтобы получить хорошее качество изображения. В том числе адекватных мер безопасности для НПР и эксплуатации SEM, процедуры просты в обращении. Особую осторожность следует принимать с формалином и глутаральдегид (см шаги 1.1.1 1.1.3 и 2.1.5 протокола). Есть определенные шаги , где, в случае необходимости, этот процесс может быть остановлен в течение длительного времени без повреждения образцов или разрушая предыдущие шаги (например, шаги 1.1.5, 1.2.3 и 1.3.5). С точки зрения стоимости, большая часть оборудования может быть повторно использована для нескольких препаратов (например, ППР алюминиевых контейнеров и держатели - заглушки), а реагенты не являются дорогими химические вещества доступны от всех коммерческих поставщиков.
Недостатки этих процедурнеобходимость надлежащей утилизации химических отходов для альдегидов и этанола, а также отсутствие основных поставок и ограничений техники. Материалы , такие как золотой диск для нанесения покрытий методом распыления и цилиндром СО 2 для ППР должны быть проверены заранее. Если они находятся в постоянном использовании, лаборатория потребует нескольких запасов из них, которые в конечном итоге повышает затраты. Поскольку отдельные исследователи часто не могут оправдать расходы, полученные из содержания этих видов поставок, или они просто не должны использовать SEM непрерывно, эти процедуры в настоящее время, как правило, осуществляется в лабораториях с внешними службами электронной микроскопии.
Методика наблюдения РЭМ ограничена большим увеличением исследования поверхностей. Если внутренние ткани должны быть соблюдены, образцы должны быть сокращены надлежащим образом изучить внешний вид внутренних тканей. Для того, чтобы исследовать внутренние аспекты клеток при высоких маgnification, требуется просвечивающего электронного микроскопа (ПЭМ). Критические шаги в рамках протокола являются собственно фиксации и обезвоживание образцов до лечения CPD, где она имеет решающее значение для поддержания тканей в безопасности от шокирующих изменений и прямого контакта с воздухом. Кроме того, тщательное управление изменения давления в камере для образца ППР и количество покрытия, нанесенного на различных типах образцов имеет важное значение.
Несмотря на эти ограничения и специальных манипуляций, изучение биологических образцов с SEM следующие протоколы , описанные здесь , позволяет для решения некоторых общих проблем, таких , как клеточной стенки и искажения органа (рисунки 1, 4, 5), ограничений по наблюдению и рост структур исходя из влажных и жидких сред (рис 5, 6), а также уничтожение чувствительных клеток (рис 1c, 1d).
Протоколы представленные здесь allowed реинтерпретации и анкетирование традиционных таксономических характеристик, таких как структура позвоночника в кист Saprolegnia 47. Картина дифференциального роста шипов сапролегния на различных поверхностях демонстрирует лабильность этой функции и ее ограничения в отношении видов диагностики. В дополнение к захвату соответствующих характеристик для таксономических исследований, этапы развития органов, а также инфекционных заболеваний, функции тканей никогда не наблюдались ранее были изучены благодаря этим методам. Теперь, этот протокол может быть расширен до тысячи тематических исследований , ожидающих быть изучены 33. Согласно рецензируемых базы данных литературы Scopus, в последние пять последних лет были 7425 публикации работ, посвященных SEM визуализации растений (4914), оомицеты (21) и грибов (2490). Этот факт говорит о том, что исследования в оомицетов с использованием изображений SEM по-прежнему очень мало по сравнению срастения и грибы. С ESEM, цифры еще ниже. Есть 588 рукописи в тот же промежуток времени: 337 в растениях, 1 в оомицетов и 250 в грибах.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
Этот проект получил финансирование от научно-исследовательской и инновационной программы Европейского Союза Горизонт-2020 в рамках гранта соглашения № 634429. Данная публикация отражает только точку зрения автора, и Европейская комиссия не может нести ответственность за любое использование, которое может быть изготовлен из информации содержащиеся в нем. Мы также признаем, финансовый вклад, внесенный Real Ботанические, CSIC. SR благодарит Европейский Союз [ОИС-Sapro-238550] для поддержки своих исследований в Saprolegnia. Мы также хотим поблагодарить Francisco Calonge за любезно предоставить herculanea изображения Phellorinia и B. Pueyo для обработки образцов (рисунок 5). Все снимки были сделаны с помощью службы SEM на Real Ботанические-CSIC в Мадриде.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetic acid | No specific supplier | Skin irritation, eye irritation | |
| aluminium stubs | Ted Pella, Inc. | 16221 | www.tedpella.com |
| Centrifuge tubes | No specific supplier | ||
| Critical Point Dryer | Polaron Quatum Technologies | CPD7501 | |
| D-(+)-Glucose | Merck | 1,083,421,000 | |
| Double sided sellotape | No specific supplier | ||
| Ethanol absolute | No specific supplier | Flammable | |
| European bacteriological agar | Conda | 1800.00 | www.condalab.com |
| Filter paper | No specific supplier | ||
| Forceps | No specific supplier | ||
| Formalin 4% | No specific supplier | Harmful, acute toxicity, skin sensitisation, carcinogenicity. Flammable | |
| Glass cover slips | No specific supplier | ||
| Glass hermetic container | No specific supplier | ||
| Glutaraldehyde 25% DC 253857.1611 (L) | Dismadel S.L. | 3336 | www.dismadel.com |
| Mycological peptone | Conda | 1922.00 | www.condalab.com |
| needles | No specific supplier | ||
| Petri dishes | No specific supplier | ||
| Plastic containers | No specific supplier | ||
| Sample holder with lid for the critical point dryer | Ted Pella, Inc. | 4591 | www.tedpella.com |
| scalpels | No specific supplier | ||
| Scanning Electron Microscope | Hitachi | S3000N | |
| Software for SEM | |||
| Solution A: NaH2PO4 | |||
| Solution B: Na2HPO4 | |||
| Specimen holders | No specific supplier | ||
| Sputter coater | Balzers | SCD 004 | |
| Stereomicroscope | No specific supplier | ||
| Transmission Electron Microscope (TEM) grids | Electron Microscopy Sciences | G200 (Square Mesh) | www.emsdiassum.com |
| Tweezers | No specific supplier |
Ссылки
- Endress, P. K., Baas, P., Gregory, M. Systematic plant morphology and anatomy: 50 years of progress. Taxon. 49 (3), 401-434 (2000).
- Falk, R. H., Gifford, E. M., Cutter, E. G. Scanning electron microscopy of developing plant organs. Science. 168 (3938), 1471-1474 (1970).
- Damblon, F. Sputtering, a new method of coating pollen grains in scanning electron microscopy. Grana. 15 (3), 137-144 (1975).
- Everhart, T. E., Thornley, R. F. M. Wide-band detector for micro-microampere low-energy electron currents. J. Sci. Instrum. 37 (7), 37246-37248 (1960).
- Collins, S. P., et al. Advantages of environmental scanning electron microscopy in studies of microorganisms. Microsc. Res. Techniq. 25 (5-6), 398-405 (1993).
- Fannes, W., Vanhove, M. P. M., Huyse, T., Paladini, G. A scanning electron microscope technique for studying the sclerites of Cichlidogyrus. Parasitol. Res. 114 (5), 2031-2034 (2015).
- Erbar, C., Leins, P. Portioned pollen release and the syndromes of secondary pollen presentation in the Campanulales-Asterales complex. Flora. 190 (4), 323-338 (1995).
- Jansen, S., Smets, E., Baas, P. Vestures in woody plants: a review. IAWA Journal. 19 (4), 347-382 (1998).
- Bortolin Costa, M. F., et al. Stigma diversity in tropical legumes with considerations on stigma classification. Bot. Rev. 80 (1), 1-29 (2014).
- Almeida, O. J. G., Cota-Sánchez, J. H., Paoli, A. A. S. The systematic significance of floral morphology, nectaries, and nectar concentration in epiphytic cacti of tribes Hylocereeae and Rhipsalideae (Cactaceae). Perspect. Plant Ecol. 15 (5), 255-268 (2013).
- Konarska, A. Comparison of the structure of floral nectaries in two Euonymus L. species (Celastraceae). Protoplasma. 252 (3), 901-910 (2015).
- Giuliani, C., Maleci Bini, L. Insight into the structure and chemistry of glandular trichomes of Labiatae, with emphasis on subfamily Lamioideae. Plant Syst. Evol. 276 (3-4), 199-208 (2008).
- Li, K., Zheng, B., Wang, Y., Zhou, L. L.Breeding system and pollination biology of Paeonia delavayi (Paeoniaceae), an endangered plant in the Southwest of China. Pak. J. Bot. 46 (5), 1631-1642 (2014).
- García, L., Rivero, M., Droppelmann, F. Descripción morfológica y viabilidad del polen de Nothofagus nervosa (Nothofagaceae). Bosque. 36 (3), 487-496 (2015).
- Prenner, G., Klitgaard, B. B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae). Am. J. Bot. 95 (11), 1349-1365 (2008).
- Ratnayake, K., Joyce, D. C., Webb, R. I. A convenient sample preparation protocol for scanning electron microscope examination of xylem-occluding bacterial biofilm on cut flowers and foliage. Sci. Hortic-Amsterdam. 140 (1), 12-18 (2012).
- Çolak, G., Celalettin Baykul, M., Gürler, R., Çatak, E., Caner, N. Investigation of the effects of aluminium stress on some macro and micro-nutrient contents of the seedlings of Lycopersicon esculentum Mill. by using scanning electron microscope. Pak. J. Bot. 46 (1), 147-160 (2014).
- Arafa, S. Z. Scanning electron microscope observations on the monogenean parasite Paraquadriacanthus nasalis from the nasal cavities of the freshwater fish Clarias gariepinus in Egypt with a note on some surface features of its microhabitat. Parasitol. Res. 110 (5), 1687-1693 (2012).
- Uppalapatia, S. R., Kerwinb, J. L., Fujitac, Y. Epifluorescence and scanning electron microscopy of host-pathogen interactions between Pythium porphyrae (Peronosporales, Oomycota)and Porphyra yezoensis (Bangiales, Rhodophyta). Bot. Mar. 44 (2), 139-145 (2001).
- Meaney, M., Haughey, S., Brennan, G. P., Fairweather, I. A scanning electron microscope study on the route of entry of clorsulon into the liver fluke, Fasciola hepatica. Parasitol. Res. 95 (2), 117-128 (2005).
- Sundarasekar, J., Sahgal, G., Subramaniam, S. Anti-candida activity by Hymenocallis littoralis extracts for opportunistic oral and genital infection Candida albicans. Bangladesh J. Pharmacol. 7 (3), 211-216 (2012).
- Benhamou, N., Rey, P., Picard, K., Tirilly, Y. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens. Phytopathology. 89 (6), 506-517 (1999).
- Singh, A., et al. First evidence of putrescine involvement in mitigating the floral malformation in mangoes: A scanning electron microscope study. Protoplasma. 251 (5), 1255-1261 (2014).
- Xiang, C., et al. Fine mapping of a palea defective 1 (pd1), a locus associated with palea and stamen development in rice. Plant Cell Rep. 34 (12), 2151-2159 (2015).
- Mendoza, L., Hernandez, F., Ajello, L. Life cycle of the human and animal oomycete pathogen Pythium insidiosum. J. Clin. Microbiol. 31 (11), 2967-2973 (1993).
- Bello, M. A., Rudall, P. J., González, F., Fernández, J. L. Floral morphology and development in Aragoa (Plantaginaceae) andrelated members of the order Lamiales. Int. J. Plant Sci. 165 (5), 723-738 (2004).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral morphology and development in Quillajaceae and Surianaceae (Fabales), the species-poor relatives of Leguminosae and Polygalaceae. Ann. Bot. 100 (4), 1491-1505 (2007).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral ontogeny in Polygalaceae and its bearing on the homologies of keeled flowers in Fabales. Int. J. Plant Sci. 171 (5), 482-498 (2010).
- Bello, M. A., Alvarez, I., Torices, R., Fuertes-Aguilar, J. Floral development and evolution of capitulum structure in Anacyclus (Anthemideae, Asteraceae). Ann. Bot. 112 (8), 1597-1612 (2013).
- Bello, M. A., Martínez-Asperilla, A., Fuertes-Aguilar, J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance. Bot. J. Linn. Soc. 181 (1), 84-98 (2016).
- Calonge, F. D., Martínez, A. J., Falcó, I., Samper, L. E. Phellorinia herculanea f. stellata f. nova encontrada en España. Bol. Soc. Micol.Madrid. 35 (1), 65-70 (2011).
- Liu, Y., et al. Deciphering microbial landscapes of fish eggs to mitigate emerging diseases. ISME J. 8 (10), 2002-2014 (2014).
- Sandoval-Sierra, J. V., Diéguez-Uribeondo, J. A comprehensive protocol for improving the description of Saprolegniales (Oomycota): two practical examples (Saprolegnia aenigmatica sp. nov. and Saprolegnia racemosa sp. nov.). PLOS one. , (2015).
- Endress, P. K. Zur vergleichenden Entwicklungsmorphologie, Embryologie und Systematik bei Laurales. Bot. Jahrb. Syst. 92 (2), 331-428 (1972).
- Tucker, S. Floral development in Saururus cernuus (Saururaceae):1. Floral initiation and stamen development. Am. J. Bot. 62 (3), 993-1005 (1975).
- Endress, P. K., Matthews, M. L. Progress and problems in the assessment of flower morphology in higher-level systematics. Plant Syst. Evol. 298 (2), 257-276 (2012).
- Beakes, G. W., Glockling, S. L., Sekimoto, S. The evolutionary phylogeny of the oomycete "fungi". Protoplasma. 249 (1), 3-19 (2012).
- Romansic, J. M., et al. Effects of the pathogenic water mold Saprolegnia ferax on survival of amphibian larvae. Dis. Aquat. Organ. 83 (3), 187-193 (2009).
- van West, P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: new challengues for an old problem. Mycologist. 20 (3), 99-104 (2006).
- Johansen, D. A. Plant microtechnique. , McGrow-Hill. New York. (1940).
- Unestam, T. Studies on the crayfish plague fungus Aphanomyces astaci. Some factors affecting growth in vitro. Physiol. Plantarum. 18 (2), 483-505 (1965).
- Cerenius, L., Söderhäll, K. Repeated zoospore emergence from isolated spore cysts of Aphanomyces astaci. Exp. Mycol. 8 (4), 370-377 (1984).
- Diéguez-Uribeondo, J., Cerenius, L., Söderhäll, K. Repeated zoospore emergence in Saprolegnia parasitica. Mycol. Res. 98 (7), 810-815 (1994).
- Söderhäll, K., Svensson, E., Unestam, T. Chitinase and protease activities in germinating zoospore cysts of a parasitic fungus, Aphanomyces astaci, Oomycetes. Mycopathologia. 64 (1), 9-11 (1978).
- Echlin, P. Handbook of sample preparation for scanning electron microscopy and X-Ray Microanalysis. , Springer Science + Business Media, LLC. NY. (2009).
- Osumi, M., et al. Preparation for observation of fine structure of biological specimens by high-resolution SEM. Microscopy. 32 (4), 321-330 (1983).
- Rezinciuc, S. The Saprolegniales morpho-molecular puzzle: an insight into markers identifying specific and subspecific levels in main parasites. , Universidad Internacional Menéndez Pelayo. Doctoral Thesis (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены