Method Article
Microscopia Eletrônica de Varredura (MEV) Protocolos para a Problemática da planta, oomiceto e amostras fúngicas
Neste Artigo
Resumo
Problems in the processing of biological samples for scanning electron microscopy observation include cell collapse, treatment of samples from wet microenvironments and cell destruction. Low-cost and relatively rapid protocols suited for preparing challenging samples such as floral meristems, oomycete cysts, and fungi (Agaricales) are compiled and detailed here.
Resumo
Os problemas mais comuns no processamento de amostras biológicas para observações ao microscópio eletrônico de varredura (MEV) incluem colapso das células, o tratamento de amostras de microambientes molhadas e destruição celular. Utilizando tecidos jovens florais, cistos oomicetos e esporos de fungos (Agaricales) como exemplos, protocolos específicos para processar amostras delicadas são descritos aqui que superar alguns dos principais desafios no tratamento da amostra para a captura de imagem sob o SEM.
meristemas florais fixos com FAA (formalina-acético-Álcool) e processados com o Ponto Crítico Secador (CPD) não apresentaram colapso paredes celulares ou órgãos distorcidas. Estes resultados são cruciais para a reconstrução do desenvolvimento floral. Um tratamento à base de CPD semelhante de amostras de micro-ambientes molhados, tais como os cistos oomicetos fixadas com glutaraldeído, é ideal para testar o crescimento diferencial de características de diagnóstico (por exemplo, os espinhos de quisto) em diferentes tipos de substrates. A destruição das células ligadas a enfermeira esporos de fungos foi evitada após re-hidratação, desidratação, e o tratamento de CPD, um passo importante para mais estudos funcionais destas células.
Os protocolos detalhados aqui representam de baixo custo e alternativas rápidas para a aquisição de imagens de boa qualidade para reconstruir os processos de crescimento e estudar características de diagnóstico.
Introdução
Na biologia, o uso de microscopia eletrônica de varredura (SEM) foi estendido para estudos de evolução estrutural, a morfologia comparativa, o desenvolvimento de órgãos, e caracterização de populações ou espécies 1. Com a sua visão bidimensional de estruturas microscópicas, áreas como a micromorfologia e sistemática lucrado com SEM técnica avanços desde a segunda metade do século 20. Por exemplo, a introdução da metodologia de revestimento por pulverização na década de 1970 fez eventuais observações de materiais delicados, como ápices vegetativos e flores que reforcem a imagem de tecidos não condutores 2, 3. SEM utiliza electrões ejectados a partir da superfície do espécime de reproduzir a topografia num ambiente de alto vácuo 4.
Estudos envolvendo SEM estão focados tanto a inferência de caracteres estruturais ea reconstrução da growth processos. Novos personagens estruturais relevantes para a taxonomia e sistemática de uma vasta gama de organismos foram descobertos a partir de observações SEM. Por exemplo, características de plantas utilizado para o diagnóstico espécie ou classificações supraspecific, como os poços guarnecidas de madeira 5, o estigma diversidade 6, nectary e floral morfologia 7, 8, detalhes de tricomas 9, e grãos de pólen 10, 11, pode não ser corretamente visualizadas sem SEM. Observações de sucesso com SEM convencional também foram atingidos por longa data organismos fixados em formol 12 e herbário espécimes de plantas 13.
Por outro lado, os estudos de reconstrução dos processos de crescimento utilizando SEM envolve uma ampla gama de tópicos, tais como o desenvolvimento de órgãos 14, INFECÇÕES induzidas por bactérias 15, planta raiz fisiologia 16, os mecanismos de fixação parasita-hospedeiro 17, 18, efeitos de drogas sobre parasitas 19, micoparasitismo e antibiose 20, 21, o crescimento malformação 22, de desenvolvimento comparativa de indivíduos selvagens e mutantes 23, e ciclos de vida inteiras 24. Embora microscópios electrónicos de varrimento ambiental (ESEM) 25 pode ter vantagens importantes para a observação de amostras biológicas molhado em processos de crescimento, material delicado ainda pode ser comprometida mesmo na condição de baixo vácuo do ESEM), e têm de ser processados de forma adequada para evitar a perda observação morfológica de valioso.
Neste artigo, uma revisão de protocolos específicos para a observação SEM de três different tipos de amostras é apresentada: meristemas florais, oomicetos (Saprolegnia), e material fúngico. Estes protocolos compilar a experiência de nossos estudos anteriores baseados em SEM 26, 27, 28, 29, 30, 31, 32, 33, onde as dificuldades específicas e soluções alternativas foram encontrados. No caso de uma instalação de desenvolvimento comparativa e estudos estruturais, a utilização de SEM começou na década de 1970 34, 35, e desde então, os pesquisadores descobriram que certas características florais são mais instáveis do que se pensava 36. Reconstrução do desenvolvimento floral envolve a captura de todas as fases entre jovens meristemas florais e antese. Para alcançar este objectivo, é ESSEntial que a topografia da amostra e da integridade da parede celular não sejam comprometidas após a fixação e a desidratação subsequente. Meristemas florais jovens são particularmente vulneráveis ao colapso da parede celular (Figuras 1a, 1b). Da mesma forma, as estruturas delicadas como nectáreos, pétalas, estigmas e sporangia exigem protocolos eficazes e undamaging. Esta revisão resume um protocolo ideal para manter os tecidos jovens e delicadas intactas para geração de imagens SEM.
No caso dos oomicetos (Stramenopiles) -um dos grupos mais diversos e generalizadas de parasitas, com hospedeiros que variam de micróbios e plantas para os invertebrados e vertebrados 37 - há esporos que crescem e se desenvolvem em um ambiente úmido. Esta condição representa um desafio para a observação SEM, porque os esporos precisam de um substrato adequado não é adequado para protocolos SEM padrão. Entre os oomicetos, espécies de Saprolegnia são de particular interesse porque eles can causar reduções graves no aquacultura, pesca e populações de anfíbios 38. Características micromorfológicas, como os espinhos em forma de gancho de cistos, foram encontrados para ser útil para identificar espécies de Saprolegnia, que é fundamental para estabelecer controles de infecção e tratamentos potenciais 39. Aqui, existe um protocolo experimental para comparar os padrões do crescimento da coluna de cistos em substratos diferentes e para manipular a amostra para a preparação crítica secador de ponto (CPD) e subsequente observação SEM.
Em um terceiro caso, há descobertas interessantes que surgiram depois de uma inspecção dos esporos dos fungos Phellorinia herculanea f. f stellata. nova (Agaricales) 31. Juntamente com os esporos, um grupo de células berçário inesperados foi identificado sob o SEM. Com protocolos tradicionais anteriores e de matérias não tratadas, as células enfermeira veio UOt desmoronou completamente (Figura 1c). Mais inferências sobre tecidos específicos associados aos esporos podem ser feitas com as modificações simples, mas cruciais para as abordagens padrão descritos aqui (Figura 1D).
Nesta revisão, há protocolos detalhados SEM que podem ser usados para lidar com diferentes problemas associados com a observação SEM em angiospermas, oomycetes e Agaricales, tais como o colapso celular e encolhimento tecido meristemático, o crescimento não-ideal de espinhos cisto, e destruição de tecidos efêmeras, respectivamente.

Figura 1: Comparação das amostras tratadas sem (A, C) e com (b, d) o protocolo FAA-etanol-CPD. (A - b) Os botões florais do Anacyclus Clavatus, mid-desenvolvimento. Bud tratada com tetróxido de ósmio 46 </ sup> (a) e Bud tratados com o protocolo FAA-CPD (b). (C - d) células enfermeira com esporos de Phellorinia herculanea f. stellata. As amostras secas, sem qualquer tratamento (C) e com o protocolo aqui descrito para Agaricales (d). Esporos em laranja. Escalas: (AB) 100 uM, (CD) de 50 um. Fotos foram tiradas por Y. Ruiz-León. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
NOTA: Este protocolo inclui seis seções principais, três dedicados a organismos específicos (secções 1-3), e três que descrevem os procedimentos comuns a todos (4-6). Asteriscos (*) indicam passos modificados pelos pesquisadores.
1. Estudos de Desenvolvimento e Estruturas Vegetais completamente formado
- Recolha e fixação
- Se o material vegetal é coletado em um local sem acesso a uma câmara de exaustão, introduzir e imergir o material em 70% de etanol em tubos de centrífuga. Idealmente, imergir o material depois de 48 h em FAA (passos itens 1.1.1-1.1.3) para evitar a desidratação excessiva no etanol. Se uma câmara de exaustão é acessível ao material vegetal, ignore este passo e continuar com 1.1.1.
- Prepare o fixador de formalina-acético-álcool (FAA) em um exaustor equipado com um filtro de aldeído. Adicionam-se 85 partes de 70% de etanol desnaturado, 10 partes de solução de formaldeído a 60%, e 5 partes de ácido acético glacial. Prepare o FAApouco antes de fixar o material, como seu armazenamento a longo prazo não é recomendado 40.
- Sob a câmara de exaustão, despeje o estoque de FAA em indivíduo de boca larga e garrafas de plástico à prova de vazamento. Use como muitas garrafas como existem amostras disponíveis, e criar etiquetas para identificação da amostra.
- Selecione os meristemas florais ou vegetativas para corrigir, garantindo que eles não são danificados por insetos, fungos ou condições meteorológicas extremas. Cortar os ramos, a remoção de material não desejado, e depositar a amostra imediatamente na solução FAA.
- Depois de 72-96 h, despeje a FAA em um recipiente de plástico para eliminação de resíduos químicos. Imediatamente, lavar as amostras três vezes com etanol fresco a 70% para remover qualquer FAA residual. material fixado pode ser armazenado indefinidamente em 70% de etanol.
- Dissecção e desidratação
- Dissecar o material fixado em 70% de etanol, ao microscópio estereoscópico, usando uma pinça ultrafinas, needles, fórceps, escovas, e bisturis micro-(o tamanho máximo do tecido deve ser de cerca de 1 cm 3, ou 2 cm para material plano). Dissecar as amostras para uma placa de Petri cobertas com etanol para impedir que os tecidos de secagem. Use uma placa de Petri com a base coberta com silício negro seco para ver melhor os tecidos brancos contrastantes.
- Coloque o material dissecado em recipientes das amostras para o secador de ponto crítico (CPD, Figura 2a). Neste ponto, imergir os recipientes no prato de Petri com 70% de etanol, e incluem as etiquetas de identificação da amostra (feito com papel e lápis). Para a secagem mais eficaz para posterior manipulação, evitar misturar as amostras de jovens e adultos no mesmo recipiente. *
- Coloque as tampas nos recipientes e depositá-los em tubos de centrífuga de plástico com uma abundância de 70% de etanol. Armazenar os tubos durante a noite, se o material não é processada imediatamente.
- Transferir o material dissecados através do seguinte serie de etanols em potes herméticos ou tubos de centrifugação: 70%, 90%, 100% e 100%. Deixar as amostras em cada solução durante 1 h a menos. Manter as amostras durante a noite numa solução de etanol a 100%.
- Transfira os recipientes com o material para o CPD (secção 4).
- Montagem e preparação de tecidos de plantas para a observação SEM
- Escreva o número de identificação da amostra por baixo dos suportes de amostras de SEM (ou seja, topos de alumínio). Cubra o topo da topos com fita dupla face. Coloque os tocos em um suporte de amostra (Figura 2b).
- Sob um microscópio estereoscópico, abra cuidadosamente os contentores que transportam as amostras jovens e delicadas já secas no CPD. Tenha em mente que, após o tratamento CPD, as amostras se tornam mais leves e sensíveis a eletrostática. Feche os recipientes uma vez que as amostras foram tomadas para evitar a poeira ou impurezas.
- Coloque as amostras na superfície pegajosa dos topos, planejar com antecedência o desejadoposição (uma vez que as amostras de toque na superfície, é muito difícil removê-los). Não tente transportar uma grande dissecção neste ponto; simplesmente remover o tecido indesejado que é fácil de pegar. Para os estudos palinológicos, dissecar as anteras e abri-los para expor o pólen sobre os tocos.
- Amostras longas Put (por exemplo, 2 cm de comprimento), tais como inflorescências na posição horizontal. Quando possível, as amostras oriente da mesma estrutura para polar, lateral e vista de fundo. Deixe espaço suficiente entre as amostras no topo.
- Se as amostras não pode ser imediatamente processado, mantê-los protegidos durante a noite num recipiente hermético com gel de sílica para evitar a re-hidratação (Figura 2c) *. Revista as amostras usando o revestidor por crepitação e transferi-los para o SEM (seções 5 e 6).

Figura 2: Ferramentas para manipulati amostraon e processamento antes da observação SEM. (A) recipiente para espécimes feitos de aço com paredes perfuradas para a transferência de etanol / CO 2 na câmara de CPD. (B) topos de aço dentro de um suporte de amostra de plástico. Recipiente (C) de vidro usado para manter as amostras protegidas da humidade e do pó. Na base, existe um compartimento de gel de sílica. (D) Pontos Críticos de secador. Na frente, há (a partir da esquerda para a direita) o manômetro, o interruptor de energia, o sistema de controle de temperatura, eo indicador de temperatura. Pressão de trabalho habitual para CO 2 intercâmbio etanol é de 60 bar (800 psi). No topo, há quatro válvulas (controles de entrada, drenagem, ventilação e exaustão) que ladeiam a câmara de amostra central. Fotos foram tiradas por Y. Ruiz-León e MA Bello. Por favor clique aqui para ver uma versão maior desta figura.
- Crescendo e fixa os cistos
- Prepare peptona e glucose (PG-l) meios de comunicação 41, utilizando ácido D - (+) - glucose (6 g), e peptona micológica (3 g) *. Adicione até 900 mL de água da torneira e autoclave 40 min a 121 ° C. Pour 50 ml da solução previamente autoclavada A (NaH 2 PO 4, 0,13 M) e 50 ml de solução B (Na 2 HPO 4, 0,13 M).
- A partir de culturas de estirpes de parasitica Saprolegnia mantidos em peptona, glucose, meios de agar (PGA, que é preparado como PG-l, mas a adição de 10 g de ágar bacteriológico Europeia para a glicose e a peptona antes da autoclave), crescer colónias micélios em 0,5 ml de PG-l gotículas durante 24-48 h a 20 ° C em placas de Petri. Induzir a esporulação por lavagem do micélio com água da torneira autoclavada três vezes e incubando-as durante 15 h a 20 ° C= "xref"> 42, 43.
- Recolher os zoósporos secundários divulgados pipetando suavemente a parte superior da suspensão e reunir-los em porções de 1 mL. Agite vigorosamente os zoósporos de 30 s em vortex para produzir cistos secundários 44.
- Para testar o crescimento diferencial dos espinhos de cistos, em separado Petri (p60), coloque 0,5 mL da suspensão cisto secundária em superfícies diferentes (ou seja, de carbono, grades de ouro e cobre TEM; salmão e peixe pescada escalas (anteriormente branqueados) e tampa de vidro deslizamentos) *. Incubar os cistos, a 20 ° C durante 70 min, o que favorece a fixação dos quistos para a superfície.
- Remover o líquido e adicionar 0,5 ml de glutaraldeído a 2% para cada uma das superfícies para a fixação dos cistos. Manter as amostras à temperatura ambiente sob uma hotte durante 1 h.
- Remover o glutaraldeído e desidratar a amostra através de uma série de etanol (30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% e 100%), a adição de 5 mL de cada solução de etanol durante 15 min. Uma vez que na última solução de etanol a 100%, a amostra pode ser armazenada durante até um mês em uma placa de Petri selado. Nesta fase, as amostras estão prontas a ser seco na DPC.
- transferir cuidadosamente as grades e as escalas a partir da placa de Petri com um suporte adequado para o CPD (Seção 4). Para esta etapa, usar um suporte de grelha de CPD ou um suporte de amostra de empilhamento, que manter as amostras separadas umas das outras. Tome as grades e escalas com uma pinça, tendo em mente que os cistos deve estar voltado para cima nas grades o tempo todo. *
- Amostras de cistos de montagem e preparação para observação SEM
- Montar as grades e as escalas nos topos de alumínio que foram previamente cobertas com fita dupla face de carbono e rotulados por baixo.
- Transferir as amostras para o revestidor por crepitação (seção 5).
- Observe as amostras no âmbito do SEM (secção 6).
3. Estudo do Herbário fúngicas Esporos de Phellorinia herculanea sob SEM
- Reidratação e desidratação de esporos
- Enrole cada amostra cuidadosamente com papel de filtro, formando envelopes marcados com lápis ~ 0,5-1 cm 2, tomando cuidado para não esmagá-los. Selar o papel de filtro com clipes de papel. Transferir as amostras embaladas para uma placa de Petri e mergulhe-os em 10 ml de água para hidratar os tecidos em torno dos esporos.
- imediatamente colocar as amostras em um forno de microondas (600 W durante aproximadamente 20 s). Retire o material uma vez que a água começa a evaporar, e deixe-a esfriar à temperatura ambiente.
- Passar as amostras através da seguinte série de etanol: 30%, 50%, 70%, 80%, 90%, 95%, 100% e 100%. Dependendo da quantidade de amostras, utilizar uma proveta ou de centrifugação de tubos para este passo. Deixar as amostras durante 15 minutos em cada solução.
- Coloque as amostras para o CPD (secção 4).
- Montagem e preparing esporos para observação SEM
- Abrir os envelopes. Despeje os esporos em um topo previamente preparado com fita dupla face. Alternativamente, recolher os esporos com a superfície adesiva do topos, tomando cuidado para não esmagá-los *.
- Se as amostras contêm poucos esporos, para além da etapa anterior, corte um pequeno pedaço do envelope (~ 2 1 mM) e colocá-lo numa nova ponta *.
- Coloque os tecidos para o revestimento por pulverização catódica (seção 5).
- Observar sob a SEM (secção 6).
4. Secagem de material que utiliza um Ponto Crítico de Secador (CPD, Figura 2d)
- Use o CPD em uma área ventilada e verificar se todas as válvulas da máquina estão fechados. Verifique se a câmara de amostra está vazio e limpo.
- Ligue a máquina e verifique se o teste do sistema de controle de temperatura ocorre automaticamente. Se o CPD tem um sistema de banho de refrigeração externo, verifique os níveis de água antes de mudar itonelada.
- Siga as instruções do fabricante do CPD específico utilizado para o etanol e intercâmbio de CO 2. Por razões de segurança, continue este passo sob a supervisão de alguém treinado para a utilização da máquina. Lembre-se que ele é exposto a mudanças de pressão rápidas, poderia explodir violentamente.
- Retire as amostras e continuar com o passo 1.3 Se trabalhar com tecidos vegetais, passo 2.2 se trabalhar com Oomycetes cistos, e as etapas 3.2 se trabalhar com esporos de fungos.
5. O revestimento das amostras com ouro Usando o Sputter Coater (Figura 3a)
- Verifique o revestidor por crepitação. Verifique se o alvo de cátodo de ouro está em boas condições. Use um pano que não solte fiapos encharcado com 90% de etanol para limpar as paredes da câmara de vácuo e da tampa da câmara, se necessário.
- Marcar o titular da pulverização catódica com números ao lado de cada buraco de stub para posterior identificação das amostras sob o microscópio. Com cuidado, coloque o tocos carregado com o samples e fixá-los. Use um estágio espécime planetária rotativo para garantir um revestimento uniforme em amostras com superfícies irregulares.
- Siga as instruções do fabricante para ajustar configurações, como a distância de trabalho, pressão de gás de operação (por exemplo, 5 x 10 -1 - 7 x 10 -1 mbar) (por exemplo, 30 mm.), O tempo de pulverização catódica (por exemplo, 50 s), espessura da camada de ouro (por exemplo, 12 nm) a corrente (por exemplo, 15 mA) e à alimentação de tensão (por exemplo, 600 V) 45.
- Remover os tocos e levá-los para o SEM (secção 6). Em alternativa, colocar os tocos em um recipiente fechado, com gel de sílica (Figura 2c).

Figura 3: revestidor por pulverização catódica, (a) e microscopia electrónica de varrimento (b). (A) Vista frontal da câmara de vácuo (à esquerda), valv gáse, temporizador, vácuo e controles atuais. (B) Vista lateral dos componentes principais de SEM (da esquerda para a direita): a coluna de vácuo com a câmara de amostra, a tela do computador com os controles, e um monitor da Câmara. Fotos foram tiradas por Y. Ruiz-León. Por favor clique aqui para ver uma versão maior desta figura.
6. observação ao microscópio eletrônico de varredura (MEV, Figura 3b)
- SEM arranque
- Siga as instruções do fabricante para iniciar e definir o SEM, ajustar a altura da amostra o diâmetro da abertura objetivo (por exemplo, para as plantas 2 mm e para fungos e oomycetes 4 mm), a tensão de operação (por exemplo, 15 kV).
- Verifique o alinhamento correcto do sistema de feixe de elétrons e definir o alinhamento axial e os stigmators de acordo com as indicações do fabricante. Ajuste tele distância de trabalho, a fim de se obter uma profundidade de campo adequada.
- Captura de imagem
- Obter uma imagem focalizada da amostra e usá-lo como ponto de partida. Aumentar a ampliação perto do nível máximo e focar a imagem novamente. Escolha áreas com irregularidades da superfície, tais como buracos. corrigir o astigmatismo e ajustar o contraste ideal e brilho.
- Capturar a imagem SEM com a alta-resolução. Use o detector de BSE se a imagem mostra que as amostras são cobrados. Caso contrário, o detector ajustado SE. Mudar os detectores seguindo as instruções do fabricante.
Resultados
Desenvolvimento Floral e Fixação de Desenvolvimento e Estruturas Vegetais completamente formado
Usando o protocolo FAA-CPD descrito aqui, jovens e maduros tecidos vegetais são perfeitamente fixadas e desidratadas para geração de imagens SEM. Processos tais como o desenvolvimento floral pode ser reconstruído, porque a topografia ea forma dos botões não é distorcida por celular encolhendo (Figuras 1b, 1d, 4a-f). As estruturas com formas complexas podem ser cobertos com sucesso com uma camada uniforme de material condutor (o metal a partir do revestidor por crepitação), permitindo a recuperação de detalhes de outro modo inacessíveis (Figuras 4G-I, 5e). Imagens de boa qualidade de amostras provenientes de microambientes molhadas, que costumavam ser sobrecarregado com a corrente de elétrons se mal desidratado e revestido, pode ser alcançado (Figuras 4f, 5A, 5B). detalhes importantes, tais como a superfície da parede de pólen (Figura 5B, 5C) e diferentes tipos de indumenta (Figuras 5d-g) pode ser estudado em profundidade, sem partículas artificiais ou indesejáveis ou formas distorcidas.
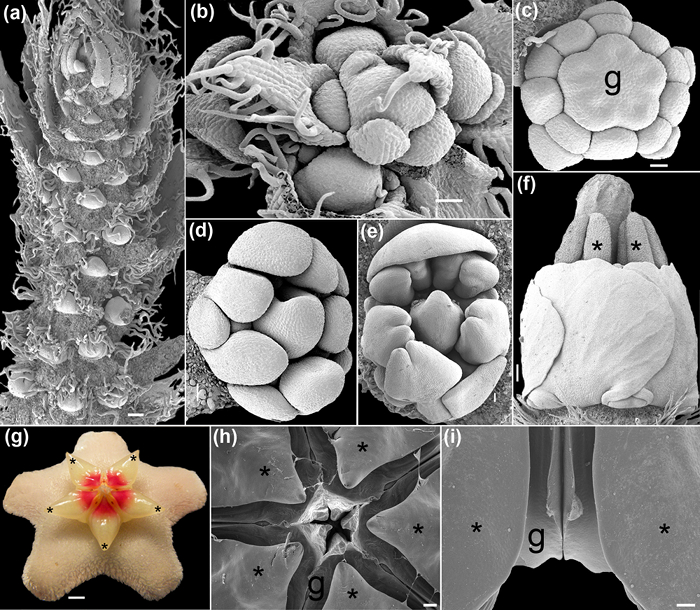
Figura 4: antecipada (a, b), médio (e C-), e (fi) o desenvolvimento floral tarde capturado ao SEM. (A) Racemo de Caesalpinia spinosa (Molina) Kuntze com vários meristemas florais. (B) Vista de cima de um jovem raceme Polygala violacea Aubl. (C) botão floral de Krameria ixine Loefl. durante a diferenciação gineceu. (D - e) Broto de Erythrina sp. (F) Vista lateral de uma flor de Krameria ixine. As anteras e estilo de se projetar. (G - i) Hoya carnosa (L.) R. Brown. ( g) Flor na antese (imagem digital tomada com um Olympus SP-590UZ 26X). (H) Vista superior dos estames e carpelos de divisão. (I) Visão lateral de um par de estames flanqueando dois carpelos. Os asteriscos indicam estames. g = gineceu. Escalas: (a, i) de 1 mm, (b, d) 400 uM, (c) 200 uM, (e) 500 uM, (F, H) 2 mM, (g) 0,25 cm. Fotos foram tiradas por MA Bello. Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: micrografias de esporângios e pólen (a, b), superfícies detalhados (C- e) e (f indumenta - g). (A) Os esporângios de Dryopteris sp. (B) Pólen de Prunus dulcis DA Webb desembarque no estigma. (C) Pólen de Nepenthes alata Blanco. (D) Vista lateral de uma inflorescência da erigeron karvinskianus DC. Imagem tomada opção detector BSE com. (E) Vista lateral do sp bryophyte peristoma. (F) glandular e tricomas não-glandulares na superfície abaxial de uma folha de Rosmarinus officinalis L. (G) Vista de cima da folha escalas planas de Olea europaea L. Escalas: (a) 400 uM, (b) 60 uM, (c) 5? M, (d) a 4 mm, (e) 600 uM, (f) 200 uM, (g) 600 uM. Fotos foram tiradas por Y. Ruiz-León. Por favor clique aqui para ver uma versão maior desta figura.
Efeito de diferentes substratos sobre o crescimento Coluna do Secundário Cistos Saprolegnia parasitica
O padrão de crescimento espinha era diferente em diferentes substratos. No vidro, as espinhas eram alongados e mostrou laços em suas pontas (Tabela 1, Figura 6a). No carbono e ouro grades as espinhas são mais curtos, enrolado e crescer mais abundantemente em torno dos cistos sem formar loops (Figuras 6b, 6d). Embora em grelhas de cobre, as espinhas tendiam a ondular sem loop, alguns deles alongada (Figura 6c). Em escama de peixe, as espinhas eram encaracolados, abundante em torno da superfície e às vezes formada em loop extremidades (Figura 6e-f).

Figura 6: padrões de crescimento diferencial dos espinhos de Saprolegnia parasitica em cistos imersos em meio líquido. (A) Glass. (B) Carbon. (C) de cobre. (D) Gold. (E) Pescada escala. (F) escala Salmon. espinhas retas foram desenvolvidos em vidro e cobre, enquanto espinhos enrolados foram formados em escalas de carbono, ouro e peixe. As pontas em forma de gancho (setas brancas) dos espinhos são observáveis em todos os espinhos que crescem em vidro e em poucos espinhos em escamas de peixe. As paredes do cisto estão em amarelo. Escala: 20 jim. Fotos foram tiradas por Y. Ruiz-León e S. Rezinciuc. Por favor clique aqui para ver uma versão maior desta figura.
| Superfície | morfologia espinha | |
| Alongamento | Laço na ponta | |
| tampa de vidro | Bom alongamento, espinhas fácil contar | Presente |
| escamas de peixe | Espinhas com forma encaracolados não é fácil de contar | Presente |
| grades TEM | espinhos curtos e encaracolados não é fácil de contar | Ausente |
Tabela 1: Morfologia da espinha utilizando diferentes tipos de substrato.
Observações inesperadas em Phellorinia herculanea f. stellata
Além da constatação inesperada de hifas Laticíferos na exoperidium de P. herculanea, Calonge et ai. 31 encontrado globosos e as células enfermeira lisas (8-13 uM) misturado com esporos no material desidratado com CPD, graças à etapa de re-hidratação realizada no micro-ondas. (Figura 1D). A estrutura e os detalhes das muralhas de tele enfermeira células e os esporos são bem preservadas, apesar da sua composição diferencial (Figuras 1C-d).
Discussão
No que diz respeito aos protocolos SEM padrão, os procedimentos aqui apresentados incluem relativamente rápida, fácil de seguir, e metodologias de baixo custo. Dependendo da quantidade de amostras e na facilidade de processamento, que leva quatro a cinco dias para adquirir imagens de boa qualidade. Incluindo as precauções de segurança adequadas para a CPD e operação SEM, os procedimentos são fáceis de manusear. Um cuidado especial deve ser tomado com formalina e o glutaraldeído (consulte os passos 1.1.1 a 1.1.3 e 2.1.5 do protocolo). Há determinados passos em que, se necessário, o processo pode ser interrompido por um longo período de tempo sem danificar as amostras ou arruinar passos anteriores (por exemplo, as etapas de 1.1.5, 1.2.3, e 1.3.5). Em termos de custo, muito do equipamento pode ser reutilizado para várias preparações (por exemplo, recipientes de alumínio CPD e detentores de stub), e os reagentes são produtos químicos não-caros disponível a partir de todos os fornecedores comerciais.
Desvantagens desses procedimentos sãoa necessidade de eliminação de resíduos químicos adequada para os aldeídos e o etanol e a falta de fontes de chave e as limitações da técnica. Os materiais tais como o disco de ouro para o revestidor por crepitação e o cilindro de CO 2 para o DPC deve ser verificado com antecedência. Se eles estiverem em uso contínuo, o laboratório vai exigir vários estoques de-los, o que eventualmente eleva os custos. Porque os pesquisadores individuais muitas vezes não podem justificar as despesas decorrentes da manutenção desses tipos de suprimentos, ou eles simplesmente não precisa usar o SEM continuamente, esses procedimentos hoje em dia tendem a ser realizado em laboratórios com serviços de microscopia de elétrons externos.
A técnica de observação do SEM é limitada a um estudo de alta ampliação de superfícies. Se os tecidos internos precisam ser observado, as amostras devem ser cortados de forma adequada para explorar a aparência externa dos tecidos internos. Para explorar os aspectos internos das células a alta MAgnification, é necessário um microscópio electrónico de transmissão (TEM). As etapas críticas no âmbito do protocolo são a fixação adequada e desidratação das amostras antes do tratamento CPD, onde é crucial para manter os tecidos a salvo de mudanças chocantes e contato direto com o ar. Além disso, uma gestão cuidadosa da mudança de pressão na câmara de amostras de CPD e a quantidade de revestimento depositado em diferentes tipos de amostras é importante.
Apesar destas limitações e manipulações especiais, o estudo de amostras biológicas com SEM seguindo os protocolos descritos aqui permite a resolução de alguns problemas comuns, como a parede celular e distorção órgão (Figuras 1, 4, 5), as restrições à observação e o crescimento das estruturas proveniente de ambientes húmidos e líquidos (Figuras 5, 6), e a destruição de células sensíveis (Figuras 1c, 1d).
Os protocolos aqui apresentados têm allowed a reinterpretação e questionamento de características taxonômicos tradicionais, como a estrutura da coluna em cistos de Saprolegnia 47. O padrão de crescimento diferencial dos espinhos Saprolegnia em superfícies diferentes demonstra a instabilidade deste recurso e as suas limitações para o diagnóstico espécie. Além disso para a captura de características relevantes para estudos taxonómicos, fases do desenvolvimento dos órgãos, e doenças infecciosas, as funções de tecidos não observados antes têm sido exploradas, graças a estas técnicas. Agora, este protocolo pode ser estendido para milhares de estudos de casos que esperam para ser examinados 33. De acordo com o banco de dados da literatura peer-reviewed Scopus, no último dos últimos cinco anos, houve 7.425 publicações de trabalhos que lidam com SEM imagem de plantas (4914), oomycetes (21) e fungos (2.490). Este fato sugere que a pesquisa em oomycetes usando a imagem SEM ainda é muito escassa em comparação complantas e fungos. Com ESEM, os números são ainda mais baixos. Há 588 manuscritos no mesmo período de tempo: 337 em plantas, 1 em oomycetes e 250 em fungos.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este projecto recebeu financiamento do programa de pesquisa e inovação Horizonte 2020 da União Europeia ao abrigo do acordo de subvenção No. 634429. Esta publicação reflecte apenas as opiniões do autor, ea Comissão Europeia não pode ser responsabilizada por qualquer uso que possa ser dado à informação nele contidas. Nós também reconhecemos a contribuição financeira do real Jardín Botánico, CSIC. SR é grato à União Europeia [ITN-SAPRO-238550] pelo apoio de sua pesquisa em Saprolegnia. Também quero agradecer a Francisco Calonge por gentilmente fornecer as imagens herculanea Phellorinia e B. Pueyo para o processamento de amostras (Figura 5). Todas as imagens foram tiradas pelo serviço de SEM no Real Jardín Botánico-CSIC em Madrid.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid | No specific supplier | Skin irritation, eye irritation | |
| aluminium stubs | Ted Pella, Inc. | 16221 | www.tedpella.com |
| Centrifuge tubes | No specific supplier | ||
| Critical Point Dryer | Polaron Quatum Technologies | CPD7501 | |
| D-(+)-Glucose | Merck | 1,083,421,000 | |
| Double sided sellotape | No specific supplier | ||
| Ethanol absolute | No specific supplier | Flammable | |
| European bacteriological agar | Conda | 1800.00 | www.condalab.com |
| Filter paper | No specific supplier | ||
| Forceps | No specific supplier | ||
| Formalin 4% | No specific supplier | Harmful, acute toxicity, skin sensitisation, carcinogenicity. Flammable | |
| Glass cover slips | No specific supplier | ||
| Glass hermetic container | No specific supplier | ||
| Glutaraldehyde 25% DC 253857.1611 (L) | Dismadel S.L. | 3336 | www.dismadel.com |
| Mycological peptone | Conda | 1922.00 | www.condalab.com |
| needles | No specific supplier | ||
| Petri dishes | No specific supplier | ||
| Plastic containers | No specific supplier | ||
| Sample holder with lid for the critical point dryer | Ted Pella, Inc. | 4591 | www.tedpella.com |
| scalpels | No specific supplier | ||
| Scanning Electron Microscope | Hitachi | S3000N | |
| Software for SEM | |||
| Solution A: NaH2PO4 | |||
| Solution B: Na2HPO4 | |||
| Specimen holders | No specific supplier | ||
| Sputter coater | Balzers | SCD 004 | |
| Stereomicroscope | No specific supplier | ||
| Transmission Electron Microscope (TEM) grids | Electron Microscopy Sciences | G200 (Square Mesh) | www.emsdiassum.com |
| Tweezers | No specific supplier |
Referências
- Endress, P. K., Baas, P., Gregory, M. Systematic plant morphology and anatomy: 50 years of progress. Taxon. 49 (3), 401-434 (2000).
- Falk, R. H., Gifford, E. M., Cutter, E. G. Scanning electron microscopy of developing plant organs. Science. 168 (3938), 1471-1474 (1970).
- Damblon, F. Sputtering, a new method of coating pollen grains in scanning electron microscopy. Grana. 15 (3), 137-144 (1975).
- Everhart, T. E., Thornley, R. F. M. Wide-band detector for micro-microampere low-energy electron currents. J. Sci. Instrum. 37 (7), 37246-37248 (1960).
- Collins, S. P., et al. Advantages of environmental scanning electron microscopy in studies of microorganisms. Microsc. Res. Techniq. 25 (5-6), 398-405 (1993).
- Fannes, W., Vanhove, M. P. M., Huyse, T., Paladini, G. A scanning electron microscope technique for studying the sclerites of Cichlidogyrus. Parasitol. Res. 114 (5), 2031-2034 (2015).
- Erbar, C., Leins, P. Portioned pollen release and the syndromes of secondary pollen presentation in the Campanulales-Asterales complex. Flora. 190 (4), 323-338 (1995).
- Jansen, S., Smets, E., Baas, P. Vestures in woody plants: a review. IAWA Journal. 19 (4), 347-382 (1998).
- Bortolin Costa, M. F., et al. Stigma diversity in tropical legumes with considerations on stigma classification. Bot. Rev. 80 (1), 1-29 (2014).
- Almeida, O. J. G., Cota-Sánchez, J. H., Paoli, A. A. S. The systematic significance of floral morphology, nectaries, and nectar concentration in epiphytic cacti of tribes Hylocereeae and Rhipsalideae (Cactaceae). Perspect. Plant Ecol. 15 (5), 255-268 (2013).
- Konarska, A. Comparison of the structure of floral nectaries in two Euonymus L. species (Celastraceae). Protoplasma. 252 (3), 901-910 (2015).
- Giuliani, C., Maleci Bini, L. Insight into the structure and chemistry of glandular trichomes of Labiatae, with emphasis on subfamily Lamioideae. Plant Syst. Evol. 276 (3-4), 199-208 (2008).
- Li, K., Zheng, B., Wang, Y., Zhou, L. L.Breeding system and pollination biology of Paeonia delavayi (Paeoniaceae), an endangered plant in the Southwest of China. Pak. J. Bot. 46 (5), 1631-1642 (2014).
- García, L., Rivero, M., Droppelmann, F. Descripción morfológica y viabilidad del polen de Nothofagus nervosa (Nothofagaceae). Bosque. 36 (3), 487-496 (2015).
- Prenner, G., Klitgaard, B. B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae). Am. J. Bot. 95 (11), 1349-1365 (2008).
- Ratnayake, K., Joyce, D. C., Webb, R. I. A convenient sample preparation protocol for scanning electron microscope examination of xylem-occluding bacterial biofilm on cut flowers and foliage. Sci. Hortic-Amsterdam. 140 (1), 12-18 (2012).
- Çolak, G., Celalettin Baykul, M., Gürler, R., Çatak, E., Caner, N. Investigation of the effects of aluminium stress on some macro and micro-nutrient contents of the seedlings of Lycopersicon esculentum Mill. by using scanning electron microscope. Pak. J. Bot. 46 (1), 147-160 (2014).
- Arafa, S. Z. Scanning electron microscope observations on the monogenean parasite Paraquadriacanthus nasalis from the nasal cavities of the freshwater fish Clarias gariepinus in Egypt with a note on some surface features of its microhabitat. Parasitol. Res. 110 (5), 1687-1693 (2012).
- Uppalapatia, S. R., Kerwinb, J. L., Fujitac, Y. Epifluorescence and scanning electron microscopy of host-pathogen interactions between Pythium porphyrae (Peronosporales, Oomycota)and Porphyra yezoensis (Bangiales, Rhodophyta). Bot. Mar. 44 (2), 139-145 (2001).
- Meaney, M., Haughey, S., Brennan, G. P., Fairweather, I. A scanning electron microscope study on the route of entry of clorsulon into the liver fluke, Fasciola hepatica. Parasitol. Res. 95 (2), 117-128 (2005).
- Sundarasekar, J., Sahgal, G., Subramaniam, S. Anti-candida activity by Hymenocallis littoralis extracts for opportunistic oral and genital infection Candida albicans. Bangladesh J. Pharmacol. 7 (3), 211-216 (2012).
- Benhamou, N., Rey, P., Picard, K., Tirilly, Y. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens. Phytopathology. 89 (6), 506-517 (1999).
- Singh, A., et al. First evidence of putrescine involvement in mitigating the floral malformation in mangoes: A scanning electron microscope study. Protoplasma. 251 (5), 1255-1261 (2014).
- Xiang, C., et al. Fine mapping of a palea defective 1 (pd1), a locus associated with palea and stamen development in rice. Plant Cell Rep. 34 (12), 2151-2159 (2015).
- Mendoza, L., Hernandez, F., Ajello, L. Life cycle of the human and animal oomycete pathogen Pythium insidiosum. J. Clin. Microbiol. 31 (11), 2967-2973 (1993).
- Bello, M. A., Rudall, P. J., González, F., Fernández, J. L. Floral morphology and development in Aragoa (Plantaginaceae) andrelated members of the order Lamiales. Int. J. Plant Sci. 165 (5), 723-738 (2004).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral morphology and development in Quillajaceae and Surianaceae (Fabales), the species-poor relatives of Leguminosae and Polygalaceae. Ann. Bot. 100 (4), 1491-1505 (2007).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral ontogeny in Polygalaceae and its bearing on the homologies of keeled flowers in Fabales. Int. J. Plant Sci. 171 (5), 482-498 (2010).
- Bello, M. A., Alvarez, I., Torices, R., Fuertes-Aguilar, J. Floral development and evolution of capitulum structure in Anacyclus (Anthemideae, Asteraceae). Ann. Bot. 112 (8), 1597-1612 (2013).
- Bello, M. A., Martínez-Asperilla, A., Fuertes-Aguilar, J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance. Bot. J. Linn. Soc. 181 (1), 84-98 (2016).
- Calonge, F. D., Martínez, A. J., Falcó, I., Samper, L. E. Phellorinia herculanea f. stellata f. nova encontrada en España. Bol. Soc. Micol.Madrid. 35 (1), 65-70 (2011).
- Liu, Y., et al. Deciphering microbial landscapes of fish eggs to mitigate emerging diseases. ISME J. 8 (10), 2002-2014 (2014).
- Sandoval-Sierra, J. V., Diéguez-Uribeondo, J. A comprehensive protocol for improving the description of Saprolegniales (Oomycota): two practical examples (Saprolegnia aenigmatica sp. nov. and Saprolegnia racemosa sp. nov.). PLOS one. , (2015).
- Endress, P. K. Zur vergleichenden Entwicklungsmorphologie, Embryologie und Systematik bei Laurales. Bot. Jahrb. Syst. 92 (2), 331-428 (1972).
- Tucker, S. Floral development in Saururus cernuus (Saururaceae):1. Floral initiation and stamen development. Am. J. Bot. 62 (3), 993-1005 (1975).
- Endress, P. K., Matthews, M. L. Progress and problems in the assessment of flower morphology in higher-level systematics. Plant Syst. Evol. 298 (2), 257-276 (2012).
- Beakes, G. W., Glockling, S. L., Sekimoto, S. The evolutionary phylogeny of the oomycete "fungi". Protoplasma. 249 (1), 3-19 (2012).
- Romansic, J. M., et al. Effects of the pathogenic water mold Saprolegnia ferax on survival of amphibian larvae. Dis. Aquat. Organ. 83 (3), 187-193 (2009).
- van West, P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: new challengues for an old problem. Mycologist. 20 (3), 99-104 (2006).
- Johansen, D. A. Plant microtechnique. , McGrow-Hill. New York. (1940).
- Unestam, T. Studies on the crayfish plague fungus Aphanomyces astaci. Some factors affecting growth in vitro. Physiol. Plantarum. 18 (2), 483-505 (1965).
- Cerenius, L., Söderhäll, K. Repeated zoospore emergence from isolated spore cysts of Aphanomyces astaci. Exp. Mycol. 8 (4), 370-377 (1984).
- Diéguez-Uribeondo, J., Cerenius, L., Söderhäll, K. Repeated zoospore emergence in Saprolegnia parasitica. Mycol. Res. 98 (7), 810-815 (1994).
- Söderhäll, K., Svensson, E., Unestam, T. Chitinase and protease activities in germinating zoospore cysts of a parasitic fungus, Aphanomyces astaci, Oomycetes. Mycopathologia. 64 (1), 9-11 (1978).
- Echlin, P. Handbook of sample preparation for scanning electron microscopy and X-Ray Microanalysis. , Springer Science + Business Media, LLC. NY. (2009).
- Osumi, M., et al. Preparation for observation of fine structure of biological specimens by high-resolution SEM. Microscopy. 32 (4), 321-330 (1983).
- Rezinciuc, S. The Saprolegniales morpho-molecular puzzle: an insight into markers identifying specific and subspecific levels in main parasites. , Universidad Internacional Menéndez Pelayo. Doctoral Thesis (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados