Method Article
Microscopie électronique à balayage (MEB) Protocoles pour Problematic plantes, Oomycètes et échantillons Fungal
Dans cet article
Résumé
Problems in the processing of biological samples for scanning electron microscopy observation include cell collapse, treatment of samples from wet microenvironments and cell destruction. Low-cost and relatively rapid protocols suited for preparing challenging samples such as floral meristems, oomycete cysts, and fungi (Agaricales) are compiled and detailed here.
Résumé
Les problèmes courants dans le traitement d'échantillons biologiques pour des observations au microscope électronique à balayage (MEB) comprennent l'effondrement des cellules, le traitement des échantillons de micro-environnements humides et la destruction des cellules. Utilisation de jeunes tissus floraux, des kystes oomycètes, et les spores de champignons (Agaricales) à titre d'exemples, des protocoles spécifiques pour traiter les échantillons délicats sont décrits ici qui surmontent certains des principaux défis dans le traitement de l'échantillon pour la capture d'image sous la SEM.
méristèmes floraux fixes avec la FAA (Formol-Acetic-alcool) et traitées avec le Point Sèche critique (DPC) n'affichait effondrés parois cellulaires ou des organes déformés. Ces résultats sont essentiels pour la reconstruction du développement floral. Un traitement à base de CPD-même des échantillons de micro - environnements humides, tels que les kystes de oomycètes glutaraldéhyde fixe, est optimal pour tester la croissance différentielle des caractéristiques de diagnostic (par exemple, les épines de kyste) sur différents types de substrates. Destruction des infirmières cellules attachées aux spores de champignons a été évitée après la réhydratation, la déshydratation et le traitement de DPC, une étape importante pour d'autres études fonctionnelles de ces cellules.
Les protocoles détaillés ici représentent à faible coût et des alternatives rapides pour l'acquisition d'images de bonne qualité pour reconstituer les processus de croissance et d'étudier les caractéristiques de diagnostic.
Introduction
En biologie, l'utilisation de la microscopie électronique à balayage (MEB) a été étendue à l' étude de l' évolution structurelle, la morphologie comparée, le développement des organes, et la caractérisation des populations ou des espèces 1. Avec sa vue en deux dimensions des structures microscopiques, des domaines tels que la micromorphologie et Systématique profité de SEM avance technique depuis la seconde moitié du 20 e siècle. Par exemple, l'introduction de la méthode de revêtement par pulvérisation cathodique dans les années 1970 a fait des observations possibles de matériaux fragiles tels que les sommets et les fleurs pousses amélioration de l'imagerie des tissus non conducteurs 2, 3. SEM utilise des électrons éjectés de la surface de l'échantillon pour reproduire la topographie dans un environnement sous vide poussé 4.
Les études portant sur SEM se concentrent à la fois l'inférence de caractères structurels et la reconstruction de growth processus. De nouveaux personnages structurels pertinents à la taxonomie et la systématique d'un large éventail d'organismes ont été découverts à partir d'observations MEB. Par exemple, les caractéristiques des plantes utilisées pour le diagnostic des espèces ou des classifications supraspécifiques, telles que les fosses ornées de bois 5, la stigmatisation de la diversité 6, nectaire et floral morphologie 7, 8, les détails de trichomes 9, et les grains de pollen 10, 11, ne peut pas être correctement visualisés sans SEM. Observations réussies avec SEM classique ont également été obtenus pour les organismes fixés au formol de longue date 12 et herbarium de spécimens végétaux 13.
D'autre part, les études de la reconstruction des processus de croissance à l' aide de SEM impliquent un large éventail de sujets, tels que le développement des organes 14, infections induites par les bactéries 15, plante racine physiologie 16, les mécanismes de fixation hôte-parasite 17, 18, les effets de la drogue sur les parasites 19, mycoparasitisme et antibiose 20, 21, la croissance malformation 22, développement comparative des individus sauvages et mutantes 23 et cycle de vie 24. Bien que les microscopes électroniques à balayage environnemental (ESEM) 25 peuvent avoir des avantages importants pour l'observation d'échantillons biologiques humides dans les processus de croissance, la matière délicate peut encore être compromise même en condition de faible vide de l'ESEM), et doivent être traitées de manière adéquate pour éviter la perte l'observation morphologique de valeur.
Dans cet article, un examen des protocoles spécifiques pour l'observation SEM de trois difftypes érents d'échantillons est présenté: méristèmes floraux, oomycètes (Saprolegnia) et matériel fongique. Ces protocoles compilent l'expérience de nos études antérieures basées sur SEM 26, 27, 28, 29, 30, 31, 32, 33, où les difficultés spécifiques et des solutions alternatives ont été trouvées. Dans le cas de l' usine de développement comparatif et des études structurales, l'utilisation de SEM a commencé dans les années 1970 34, 35, et depuis lors, les chercheurs ont découvert que certaines caractéristiques florales sont plus labile que pensait auparavant 36. Reconstruction du développement floral implique la capture de toutes les étapes entre les jeunes méristèmes floraux et anthèse. Pour atteindre cet objectif, il est essential que la topographie de l'échantillon et l'intégrité de la paroi cellulaire ne sont pas compromises après la fixation et la déshydratation subséquente. Les jeunes méristèmes floraux sont particulièrement vulnérables à la paroi cellulaire effondrement (figures 1a, 1b). De même, les structures délicates telles que nectaires, pétales, stigmas et sporanges exigent des protocoles efficaces et undamaging. Cette revue résume un protocole optimal pour garder les jeunes et délicats tissus intacts pour l'imagerie SEM.
Dans le cas des oomycètes (straménopiles) , un des groupes les plus divers et les plus répandues de parasites, avec des hôtes allant de microbes et de plantes pour les invertébrés et les vertébrés 37 - il y a des spores qui se développent et se développent dans un environnement humide. Cette condition représente un défi pour l'observation SEM parce que les spores ont besoin d'un substrat adéquat ne convient pas pour les protocoles SEM standard. Parmi les oomycètes, les espèces de Saprolegnia sont particulièrement intéressants parce qu'ils can provoquer de fortes réductions aquacultures, les pêcheries et les populations d' amphibiens 38. Caractéristiques micromorphologiques, telles que les épines crochues de kystes, ont été trouvés pour être utile pour identifier les espèces de Saprolegnia, ce qui est fondamental d'établir des contrôles d'infection et des traitements potentiels 39. Ici, il y a un protocole expérimental pour comparer les modèles de la croissance de la colonne vertébrale de kystes sur différents substrats et de manipuler l'échantillon critique sèche point (CPD) la préparation et l'observation SEM subséquente.
Dans un troisième cas, il y a des résultats intéressants qui sont venus après une inspection des spores de champignons Phellorinia herculanea f. f stellata. nova (Agaricales) 31. Ensemble avec les spores, un groupe de cellules maternelles inattendues a été identifié dans le cadre du SEM. Avec les protocoles traditionnels précédents et des matières non traitées, les cellules nourricières sont venus OÜt complètement effondré (figure 1c). D' autres inférences sur des tissus particuliers associés aux spores peuvent être faites avec les modifications simples mais cruciales pour les approches standard décrites ici (Figure 1d).
Dans cette revue, il existe des protocoles SEM détaillées qui peuvent être utilisés pour faire face aux différents problèmes liés à l'observation SEM chez les angiospermes, oomycètes et Agaricales, tels que l'effondrement de la cellule et le rétrécissement du tissu méristématique, une croissance non optimale des épines de kystes, et la destruction des tissus éphémères, respectivement.

Figure 1: Comparaison des échantillons traités sans (a, c) et (b, d) le protocole FAA-éthanol-CPD. (A - b) Les boutons floraux de Anacyclus clavatus, mi-développement. Bud traité avec le tétroxyde d' osmium 46 </ sup> (a) et le bourgeon traité avec le protocole FAA-CPD (b). (C - d) les cellules de l' infirmière avec des spores de Phellorinia herculanea f. stellata. On sèche les échantillons sans aucun traitement (c) et le protocole décrit ici pour Agaricales (d). Spores en orange. Échelles: (ab) 100 um, (cd) 50 um. Les photos ont été prises par Y. Ruiz-León. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Protocole
NOTE: Ce protocole comprend six sections principales, dont trois consacrées à des organismes spécifiques (sections 1-3), et trois décrivant les procédures communes à tous (4-6). Les astérisques (*) indiquent les étapes modifiées par les expérimentateurs.
1. Études de développement et des structures végétales entièrement constituées
- Collecte et fixation
- Si le matériel végétal est recueilli dans un endroit sans accès à une hotte, introduire et immerger le matériel dans 70% d'éthanol dans des tubes de centrifugation. Idéalement, immerger le matériau après 48 h dans la FAA (étapes 1.1.1-1.1.3) pour éviter la déshydratation excessive dans l'éthanol. Si une hotte est accessible à la matière végétale, ignorez cette étape et continuer avec 1.1.1.
- Préparer le fixateur formaline-acétique-alcool (FAA) dans une hotte équipée d'un filtre d'aldéhyde. Ajouter 85 parties de 70% d'éthanol dénaturé, 10 parties d'une solution de formaldéhyde à 60%, et 5 parties d'acide acétique glacial. Préparer la FAAjuste avant la fixation de la matière, comme son stockage à long terme ne sont pas recommandés 40.
- Sous la hotte, verser le stock de la FAA en grande bouche individuelle et bouteilles en plastique étanches. Utilisez autant de bouteilles comme il y a des échantillons disponibles, et créer des étiquettes pour l'identification des échantillons.
- Sélectionnez les méristèmes floraux ou végétatives de fixer, veiller à ce qu'ils ne soient pas endommagés par des insectes, des champignons ou des conditions météorologiques extrêmes. Couper les branches, en supprimant les matières indésirables, et déposer l'échantillon immédiatement dans la solution de la FAA.
- Après 72-96 h, verser la FAA dans un récipient en plastique pour l'élimination des produits chimiques. Immédiatement, laver les échantillons trois fois avec frais de 70% d'éthanol pour éliminer toute FAA résiduelle. matériel fixe peut être stocké indéfiniment dans 70% d'éthanol.
- Curage et de déshydratation
- Disséquer le matériau fixé à 70% d'éthanol sous le stéréomicroscope en utilisant des pinces ultra fines, needles, pinces, brosses, et les micro-scalpels (la taille maximale du tissu devrait être d' environ 1 cm 3, ou 2 cm pour matériau plat). Disséquer les échantillons dans une boîte de Pétri couverte avec de l'éthanol pour empêcher les tissus de séchage. Utilisez une boîte de Pétri avec la base recouverte de silicone noir sec pour mieux voir les tissus blancs contrastés.
- Mettre le matériau disséqués dans des récipients d'échantillons pour la sécheuse critique du point (CPD, Figure 2a). À ce stade, immerger les récipients dans la boîte de Pétri avec 70% d'éthanol, et inclure les étiquettes d'identification de l'échantillon (faite avec du papier et un crayon). Pour le séchage plus efficace pour une autre manipulation, éviter de mélanger les échantillons jeunes et matures dans le même conteneur. *
- Mettez les couvercles sur les récipients et les déposer dans des tubes de centrifugeuse en plastique avec beaucoup d'éthanol à 70%. Conserver les tubes pendant la nuit si la matière ne sont pas traitées immédiatement.
- Transférer le matériel disséqués par la série suivante éthanols dans des récipients hermétiques ou des tubes de centrifugation: 70%, 90%, 100% et 100%. Laissez les échantillons dans chaque solution pendant 1 h au moins. Conserver les échantillons pendant une nuit dans une solution d'éthanol à 100%.
- Transférer les récipients avec le matériau à la DPC (section 4).
- Montage et la préparation des tissus végétaux pour l' observation SEM
- Notez le numéro d'identification de l' échantillon sous les porte-échantillons SEM (c. -à talons en aluminium). Couvrez le dessus du moignons avec du ruban adhésif double face. Placer les ergots dans un porte-échantillon (figure 2b).
- En vertu d'un stéréomicroscope, ouvrez soigneusement les conteneurs transportant les échantillons jeunes et délicates déjà séchées dans la CPD. Gardez à l'esprit que, après le traitement CPD, les échantillons deviennent plus légers et sensibles à l'électrostatique. Fermez les conteneurs, une fois les échantillons ont été prélevés sur pour éviter la poussière ou des impuretés.
- Mettez les échantillons sur la surface collante des talons, la planification désiréla position (une fois que les échantillons touchent la surface, il est très difficile de les enlever). Ne pas essayer d'effectuer une dissection majeure à ce stade; il suffit de retirer les tissus indésirables qui est facile à ramasser. Pour les études palynologiques, disséquer les anthères et les ouvrir pour exposer le pollen sur les talons.
- Longs échantillons mis (par exemple, de 2 cm de longueur) , tels que des inflorescences en position horizontale. Lorsque cela est possible, des échantillons d'orienter de la même structure pour polaire, côté, et des vues de dessous. Laissez suffisamment d'espace entre les échantillons sur le talon.
- Si les échantillons ne peuvent pas être traitées immédiatement, gardez - les protégés pendant la nuit dans un récipient hermétique avec du gel de silice pour éviter la réhydratation (figure 2c) *. Enduire les échantillons en utilisant la coucheuse de pulvérisation et de les transférer à la SEM (articles 5 et 6).

Figure 2: Outils pour manipulati d'échantillonle traitement et avant l'observation SEM. (A) conteneur d'échantillon en acier fabriqués avec des murs troués pour l'éthanol / CO 2 échange dans la chambre CPD. (B) les moignons d' acier à l' intérieur d' un porte-échantillon en matière plastique. Récipient (c) du verre utilisé pour conserver les échantillons à l' abri de l' humidité et de la poussière. A la base, il existe un compartiment pour le gel de silice. (D) des points critiques Sèche - linge. A l'avant, il existe (de gauche à droite), le manomètre, l'interrupteur d'alimentation, le système de contrôle de température, et l'affichage de la température. Pression de service habituelle pour le CO 2 -éthanol échange est de 60 bars (800 psi). En haut, il y a quatre soupapes (contrôles d'entrée, de drain, de ventilation et d'échappement) flanquant la chambre d'échantillon central. Les photos ont été prises par Y. Ruiz-León et MA Bello. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
- Grandir et fixant les kystes
- Préparer peptone et glucose (PG-l) 41 médias à l' aide de D - (+) - glucose (6 g) et de peptone mycologique (3 g) *. Ajouter à 900 ml d'eau du robinet et l'autoclave 40 min à 121 ° C. Verser 50 ml de la solution préalablement autoclavées A (NaH 2 PO 4, 0,13 M) et 50 ml de solution B (Na 2 HPO 4 0,13 M).
- De cultures mères de souches de Saprolegnia parasitica maintenus sur peptone, glucose, gélose (PGA, qui est préparé comme PG-l , mais en ajoutant 10 g d'agar bactériologique européen au glucose et la peptone avant autoclave), développer les colonies de mycélium dans 0,5 ml de PG-l gouttelettes pour 24-48 h à 20 ° C dans des boîtes de Pétri. Provoquer sporulation par lavage du mycélium avec de l'eau du robinet autoclavée trois fois et en les incubant pendant 15 h à 20 ° C= "xref"> 42, 43.
- Recueillir les zoospores secondaires libérés par pipetage la partie supérieure de la suspension et de les regrouper en portions de 1 ml. Agiter vigoureusement les zoospores pour 30 s par tourbillonnement pour produire des kystes secondaires 44.
- Pour tester la croissance différentielle des épines des kystes, sur séparés Petri plats (p60), mettre 0,5 ml de la suspension de kyste secondaire sur différentes surfaces (c. -à- carbone, grilles d' or et de cuivre TEM; écailles de saumon et de poissons du merlu (auparavant blanchies) et couverture en verre glisse) *. Incuber les kystes à 20 ° C pendant 70 min, ce qui favorise la fixation des kystes à la surface.
- Éliminer le liquide et ajouter 0,5 ml de glutaraldéhyde à 2% à chaque surface pour la fixation des kystes. Gardez les échantillons à température ambiante sous une hotte pendant 1 h.
- Retirer le glutaraldéhyde et déshydrater l'échantillon à travers une série d'éthanol (30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% et 100%), en ajoutant 5 ml de chaque solution d'éthanol pendant 15 min. Une fois dans la dernière solution d'éthanol à 100%, l'échantillon peut être stocké pendant jusqu'à un mois dans une boîte de Pétri scellée. A ce stade, les échantillons sont prêts à être séché dans la DPC.
- transférer soigneusement les grilles et les échelles de la boîte de Pétri à un support approprié pour la CPD (section 4). Pour cette étape, en utilisant un support de grille de DPC ou d'un porte-échantillon d'empilage, qui maintiennent les échantillons séparés les uns des autres. Prenez les grilles et les échelles avec des pincettes, en gardant à l'esprit que les kystes doivent être orientés vers le haut sur les grilles tout le temps. *
- Montage et la préparation des échantillons de kyste pour l' observation SEM
- Monter les grilles et les échelles sur les talons d'aluminium qui étaient auparavant recouverts de ruban adhésif double face carbone et étiquetés en dessous.
- Transférer les échantillons à la coucheuse de pulvérisation (section 5).
- Observer les échantillons sous la SEM (section 6).
3. Etude des Herbier Fungal Spores de Phellorinia herculanea sous SEM
- La déshydratation et la réhydratation des spores
- Envelopper chaque échantillon soigneusement avec du papier filtre, formant des enveloppes de crayon marqué ~ 0,5-1 cm 2, en prenant soin de ne pas les écraser. Sceller le papier filtre avec des trombones. Transférer les échantillons emballés dans une boîte de Pétri et les plonger dans 10 ml d'eau pour réhydrater les tissus autour des spores.
- Mettre immédiatement les échantillons dans un four micro-ondes (600 W pendant environ 20 s). Retirer le matériau une fois que l'eau commence à s'évaporer, et le laisser refroidir à la température ambiante.
- Transmettre les échantillons à travers la série d'éthanol ce qui suit: 30%, 50%, 70%, 80%, 90%, 95%, 100% et 100%. En fonction de la quantité d'échantillons, utilisez un bécher ou centrifuger tubes pour cette étape. Laisser les échantillons pendant 15 minutes dans chaque solution.
- Placer les échantillons à la CPD (section 4).
- Le montage et le preparing spores pour l'observation SEM
- Ouvrez les enveloppes. Verser les spores sur un stub préalablement préparé avec du ruban adhésif double face. Vous pouvez également recueillir les spores avec la surface collante du moignons, en prenant soin de ne pas les écraser *.
- Si les échantillons contiennent peu de spores, en plus de l'étape précédente, couper un petit morceau de l'enveloppe (~ 1 mm 2) et le placer sur un nouveau talon *.
- Placez les tissus dans la coucheuse de pulvérisation (section 5).
- Observez à la SEM (section 6).
4. Le séchage du matériau à l'aide d'un point critique Sèche (CPD, figure 2d)
- Utilisez la CPD dans un endroit aéré et vérifier que toutes les vannes de la machine sont fermées. Vérifiez si la chambre d'échantillon est vide et propre.
- Allumer la machine et vérifier que le test du système de contrôle de la température se fait automatiquement. Si la DPC a un système de bain de réfrigération externe, vérifiez les niveaux d'eau avant que je commutationtonne.
- Suivez les instructions de la DPC spécifique utilisé pour l'éthanol et le CO 2 échange du fabricant. Pour la sécurité, mener à bien cette étape sous la supervision d'une personne formée à l'utilisation de la machine. Rappelez-vous qu'il est exposé à des changements rapides de pression, il pourrait souffler violemment.
- Sortez les échantillons et passez à l'étape 1.3 si l'on travaille avec des tissus de la plante, l'étape 2.2 si l'on travaille avec des oomycètes kystes, et les étapes 3.2 si l'on travaille avec des spores de champignons.
5. Le revêtement des échantillons avec de l'or Utilisation du Pulvérisateur cathodique (Figure 3a)
- Vérifiez la coucheuse de pulvérisation. Vérifiez que la cible de cathode d'or est en bon état. Utilisez un chiffon non pelucheux trempé avec 90% d'éthanol pour nettoyer les parois de la chambre à vide et le couvercle de la chambre si nécessaire.
- Marquez le support de pulvérisation avec des numéros à côté de chaque trou de stub pour une identification plus poussée des échantillons au microscope. Soigneusement, placer les talons chargé avec le samples et les fixer. Utilisez un porte-échantillon rotatif planétaire pour assurer un revêtement uniforme sur des échantillons avec des surfaces irrégulières.
- Suivez les instructions du fabricant pour régler les paramètres tels que la distance de travail, la pression du gaz de fonctionnement (par exemple, 5 x 10 -1 à 7 x 10 -1 mbar) (par exemple, 30 mm.), Le temps de pulvérisation (par exemple, 50 s), épaisseur de la couche d'or (par exemple 12 nm) , le courant (par exemple, 15 mA) et l'alimentation en tension (par exemple 600 V) 45.
- Retirer les talons et les emmener à la SEM (article 6). Sinon, placez les talons dans un récipient scellé avec du gel de silice (figure 2c).

Figure 3: coucheuse par pulvérisation cathodique (a) et au microscope électronique à balayage (b). (A) Vue de face de la chambre à vide ( à gauche), valv de gaze, minuterie, vide, et les contrôles actuels. (B) Vue de côté des principaux composants SEM (de gauche à droite): la colonne sous vide avec la chambre de l' échantillon, l'écran d'ordinateur avec les commandes et l'écran de la chambre. Les photos ont été prises par Y. Ruiz-León. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
6. L'observation au microscope électronique à balayage (MEB, Figure 3b)
- SEM démarrage
- Suivez les instructions du fabricant pour démarrer et régler le SEM, le réglage de la hauteur de l' échantillon de l'ouverture diamètre de l' objectif (par exemple, pour les plantes 2 pm et pour les champignons et oomycètes 4 pm), la tension de fonctionnement (par exemple, 15 kV).
- Vérifiez l'alignement correct du système de faisceau d'électrons et définir l'alignement axial et les stigmateurs selon les fabricants indications. Régler tdistance qu'il travaille afin d'obtenir une profondeur suffisante de champ.
- Capture d'image
- Obtenez une image focalisée de l'échantillon et l'utiliser comme un point de départ. Augmenter le grossissement proche du niveau maximum et de se concentrer à nouveau l'image. Choisissez les zones avec des irrégularités de surface telles que des trous. astigmatisme correct et régler le contraste optimal et de la luminosité.
- Capturer l'image SEM avec la haute résolution. Utilisez le détecteur ESB si l'image montre que les échantillons sont facturés. Sinon, réglez le détecteur SE. Modifiez les détecteurs en suivant les instructions du fabricant.
Résultats
Développement Floral et fixation du développement et de structures végétales entièrement constituées
En utilisant le protocole FAA-CPD décrit ici, les tissus jeunes et matures plantes sont parfaitement fixes et déshydratés destinés à l'imagerie SEM. Des procédés tels que le développement floral peuvent être reconstruites en raison de la topographie et de la forme des bourgeons ne sont pas faussés par le rétrécissement cellulaire (figures 1b, 1d, 4a-f). Des structures de forme complexe peuvent être recouverts avec succès d'une couche uniforme de matériau conducteur (le métal de la machine à enduire par pulvérisation cathodique), ce qui permet la récupération des informations autrement inaccessibles (figures 4 g-I, 5e). Bonnes images de qualité des échantillons provenant de microenvironnements humides qui servent à être appesantis par le courant d'électrons si mal déshydraté et revêtu, peut être réalisé (figures 4f, 5a, 5b). Des détails importants tels que la surface du mur de pollen (Figure 5b, 5c) et différents types de indumenta (Figures 5d-g) peuvent être étudiés en profondeur sans particules artificielles ou indésirables ou des formes déformées.
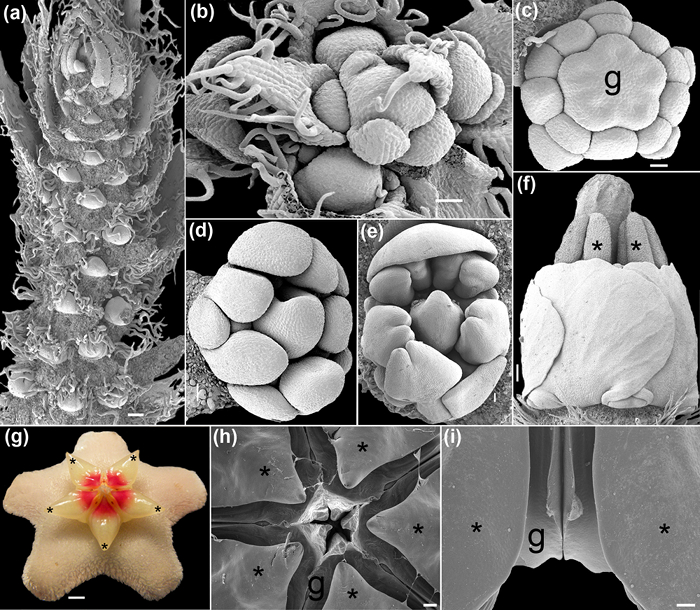
Figure 4: Early (a, b), mi (e c-), et à la fin (fi) le développement floral capturé sous la SEM. (A) Racème de Caesalpinia spinosa (Molina) Kuntze avec plusieurs méristèmes floraux. (B) Vue de dessus d'une jeune raceme Polygala violacea Aubl. (C) bourgeon floral de Krameria ixine Loefl. lors de la différenciation de gynécée. (D - e) Bourgeons de Erythrina sp. (F) Vue de côté d'une fleur de Krameria ixine. Les anthères et le style font saillie. (G - i) Hoya carnosa (L.) R. Brown. ( g) Fleur à l' anthèse (image numérique prise avec un Olympus SP-590UZ 26X). (H) Vue de dessus des étamines et carpelles fendues. (I) Vue de côté d'une paire d'étamines flanquant deux carpelles. Les astérisques indiquent étamines. g = gynécée. Échelles: (a, i) 1 mm, (b, d) 400 um, (c) 200 um, (e) 500 um, (f, h) et 2 mm, (g) de 0,25 cm. Les photos ont été prises par MA Bello. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 5: micrographies MEB de sporanges et de pollen (a, b), des surfaces détaillées (c- e) et (f indumenta - g). (A) Les sporanges de Dryopteris sp. (B) Pollen de Prunus dulcis DA Webb atterrissage sur la stigmatisation. (C) Pollen de Nepenthes alata Blanco. (D) Vue de côté d'une inflorescence de Erigeron karvinskianus DC. Photo prise avec l'option de détection de l'ESB. (E) Vue de côté de la bryophytes péristome sp. (F) et glandulaires trichomes no-glandulaires sur la surface abaxiale d'une feuille de Rosmarinus officinalis L. (G) Vue de dessus les feuilles écailles plates de Olea europaea L. Échelles: (a) 400 um, (b) de 60 um, (c) 5 um, (d) de 4 mm, (e) 600 um, (f) 200 um, (g) de 600 pm. Les photos ont été prises par Y. Ruiz-León. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Effet de différents substrats sur la croissance Spine du secondaire Cysts Saprolegnia parasitica
Le modèle de croissance de la colonne vertébrale était différente sur différents substrats. Sur le verre, les épines sont allongées et ont montré des boucles à leurs extrémités (tableau 1, figure 6a). Sur le carbone et l' or des grilles les épines sont plus courts, frisés et poussent plus abondamment autour des kystes sans former de boucles (figures 6b, 6d). Bien que sur des grilles de cuivre, les épines ont tendance à se courber sans boucle, certains d'entre eux allongé (Figure 6c). Sur des écailles de poisson, les épines étaient bouclés, abondante autour de la surface et parfois formés extrémités en boucle (Figure 6E-f).

Figure 6: modèles de croissance différentielle des épines de Saprolegnia parasitica dans les kystes immergés dans des milieux liquides. (A) Glass. (B) de carbone. (C) du cuivre. (D) Or. (E) Merlu échelle. (F) l' échelle du saumon. épines droites ont été développées sur le verre et le cuivre, tandis que les épines recourbées ont été formées sur des échelles de carbone, de l'or, et les poissons. Les conseils crochues (flèches blanches) des épines sont observables dans toutes les épines qui poussent sur le verre et dans quelques épines sur des écailles de poisson. Les parois des kystes sont en jaune. Echelle: 20 pm. Les photos ont été prises par Y. Ruiz-León et S. Rezinciuc. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
| Surface | Spine morphologie | |
| Élongation | Boucle à la pointe | |
| Couvercle en verre | Bonne élongation, épines facile de compter | Présent |
| Des écailles de poisson | Épines avec la forme bouclés pas facile de compter | Présent |
| les grilles de MET | épines courtes et bouclés pas facile de compter | Absent |
Tableau 1: morphologie de la colonne vertébrale à l' aide de différents types de substrat.
Observations inattendues dans Phellorinia herculanea f. stellata
Outre la découverte inattendue d'hyphes laticifères sur la exoperidium de P. herculanea, Calonge et al. 31 trouvé globuleuses et des cellules nourricières lisses (8-13 um) mélangées avec des spores dans la matière déshydratée avec du DPC grâce à l'étape de réhydratation effectuée dans le four micro - ondes. (Figure 1d). La structure et les détails des parois de til cellules nourricières et les spores sont bien conservés malgré leur composition différentielle (figures 1c-d).
Discussion
En ce qui concerne les protocoles SEM standard, les procédures présentées ici sont relativement rapide, facile à suivre, et les méthodes à faible coût. En fonction de la quantité d'échantillons et de la facilité de traitement, il faut compter de quatre à cinq jours pour obtenir des images de bonne qualité. Y compris les mesures de sécurité adéquates pour la CPD et le fonctionnement SEM, les procédures sont faciles à manipuler. Une attention particulière doit être prise avec de la formaline et le glutaraldéhyde (voir les étapes 1.1.1 à 1.1.3 et 2.1.5 du protocole). Il y a certaines étapes où, si nécessaire, le processus peut être arrêté pendant une longue période sans endommager les échantillons ou de ruiner les étapes précédentes (par exemple, les étapes 1.1.5, 1.2.3 et 1.3.5). En termes de coût, une grande partie de l'équipement peut être réutilisé pour plusieurs préparations (par exemple, des conteneurs CPD en aluminium et les détenteurs de stub), et les réactifs sont des produits chimiques non-coûteux disponibles auprès de tous les fournisseurs commerciaux.
Inconvénients de ces procédures sontla nécessité d'une bonne élimination des déchets de produits chimiques pour les aldéhydes et l'éthanol et le manque de fournitures essentielles et les limites de la technique. Des matériaux tels que le disque d'or pour la coucheuse par pulvérisation cathodique et le cylindre de CO 2 pour la CPD doivent être bien contrôlés à l' avance. Si elles sont en utilisation continue, le laboratoire exigera des stocks multiples d'entre eux, qui élève éventuellement les coûts. Parce que les chercheurs individuels ne peuvent souvent pas justifier les frais découlant de l'entretien de ces types de fournitures, ou tout simplement ils ne ont pas besoin d'utiliser le SEM en continu, ces procédures ont tendance aujourd'hui à effectuer dans les laboratoires des services de microscopie électronique externes.
La technique d'observation de la SEM est limitée à une étude à fort grossissement des surfaces. Si les tissus internes doivent être observées, les échantillons doivent être coupés de la bonne façon d'explorer l'aspect extérieur des tissus internes. Pour explorer les aspects internes des cellules à haute magnification, un microscope électronique à transmission (MET) est nécessaire. Les étapes critiques au sein du protocole sont la fixation correcte et la déshydratation des échantillons avant le traitement de DPC, où il est essentiel de garder les tissus à l'abri des changements choquants et contact direct avec l'air. En outre, une gestion prudente du changement de pression dans la chambre d'échantillon de DPC et la quantité de revêtement déposé sur différents types d'échantillons est importante.
En dépit de ces limitations et manipulations spéciales, l'étude d'échantillons biologiques avec SEM suivant les protocoles décrits ici permet la résolution de certains problèmes communs, tels que la paroi cellulaire et la distorsion d'organes (figures 1, 4 5,), les restrictions sur l'observation et la croissance des structures provenant d'environnements humides et liquides (figures 5, 6), et la destruction des cellules sensibles (figures 1c, 1d).
Les protocoles présentés ici ont allowed la réinterprétation et l' interrogatoire des caractéristiques taxonomiques traditionnelles, telles que la structure de la colonne vertébrale dans les kystes de Saprolegnia 47. Le motif des épines Saprolegnia sur différentes surfaces de croissance différentielle met en évidence la labilité de cette fonctionnalité et ses limites pour le diagnostic de l' espèce. En plus de la capture des caractéristiques pertinentes pour les études taxonomiques, les stades de développement des organes et les maladies infectieuses, les fonctions des tissus jamais observés avant ont été explorées grâce à ces techniques. Maintenant, ce protocole peut être étendu à des milliers d'études de cas en attente d'être examinées 33. Selon la base de données de littérature scientifique Scopus, dans la dernière des cinq dernières années, il y a eu 7.425 publications de documents traitant de SEM imagerie des plantes (4914), oomycètes (21) et les champignons (2490). Ce fait suggère que la recherche dans les oomycètes en utilisant l'imagerie SEM est encore très rares en comparaison avecles plantes et les champignons. Avec ESEM, les chiffres sont encore plus bas. Il y a 588 manuscrits dans le même laps de temps: 337 dans les plantes, 1 en oomycètes et 250 dans les champignons.
Déclarations de divulgation
The authors have nothing to disclose.
Remerciements
Ce projet a été financé par Horizon 2020 du programme de recherche et d'innovation de l'Union européenne en vertu de la convention de subvention n ° 634429. Cette publication reflète uniquement les opinions de l'auteur, et la Commission européenne ne peut pas être tenu pour responsable de l'usage qui pourrait être fait des informations qui s'y trouvent. Nous reconnaissons également la contribution financière faite par le Real Jardín Botánico, CSIC. SR est reconnaissant à l'Union européenne [ITN-SAPRO-238550] pour le soutien de ses recherches dans le Saprolegnia. Nous tenons également à remercier Francisco Calonge pour bien vouloir fournir les images de herculanea Phellorinia et B. Pueyo pour le traitement des échantillons (figure 5). Toutes les images ont été prises par le service SEM au Real Jardín Botánico-CSIC à Madrid.
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | No specific supplier | Skin irritation, eye irritation | |
| aluminium stubs | Ted Pella, Inc. | 16221 | www.tedpella.com |
| Centrifuge tubes | No specific supplier | ||
| Critical Point Dryer | Polaron Quatum Technologies | CPD7501 | |
| D-(+)-Glucose | Merck | 1,083,421,000 | |
| Double sided sellotape | No specific supplier | ||
| Ethanol absolute | No specific supplier | Flammable | |
| European bacteriological agar | Conda | 1800.00 | www.condalab.com |
| Filter paper | No specific supplier | ||
| Forceps | No specific supplier | ||
| Formalin 4% | No specific supplier | Harmful, acute toxicity, skin sensitisation, carcinogenicity. Flammable | |
| Glass cover slips | No specific supplier | ||
| Glass hermetic container | No specific supplier | ||
| Glutaraldehyde 25% DC 253857.1611 (L) | Dismadel S.L. | 3336 | www.dismadel.com |
| Mycological peptone | Conda | 1922.00 | www.condalab.com |
| needles | No specific supplier | ||
| Petri dishes | No specific supplier | ||
| Plastic containers | No specific supplier | ||
| Sample holder with lid for the critical point dryer | Ted Pella, Inc. | 4591 | www.tedpella.com |
| scalpels | No specific supplier | ||
| Scanning Electron Microscope | Hitachi | S3000N | |
| Software for SEM | |||
| Solution A: NaH2PO4 | |||
| Solution B: Na2HPO4 | |||
| Specimen holders | No specific supplier | ||
| Sputter coater | Balzers | SCD 004 | |
| Stereomicroscope | No specific supplier | ||
| Transmission Electron Microscope (TEM) grids | Electron Microscopy Sciences | G200 (Square Mesh) | www.emsdiassum.com |
| Tweezers | No specific supplier |
Références
- Endress, P. K., Baas, P., Gregory, M. Systematic plant morphology and anatomy: 50 years of progress. Taxon. 49 (3), 401-434 (2000).
- Falk, R. H., Gifford, E. M., Cutter, E. G. Scanning electron microscopy of developing plant organs. Science. 168 (3938), 1471-1474 (1970).
- Damblon, F. Sputtering, a new method of coating pollen grains in scanning electron microscopy. Grana. 15 (3), 137-144 (1975).
- Everhart, T. E., Thornley, R. F. M. Wide-band detector for micro-microampere low-energy electron currents. J. Sci. Instrum. 37 (7), 37246-37248 (1960).
- Collins, S. P., et al. Advantages of environmental scanning electron microscopy in studies of microorganisms. Microsc. Res. Techniq. 25 (5-6), 398-405 (1993).
- Fannes, W., Vanhove, M. P. M., Huyse, T., Paladini, G. A scanning electron microscope technique for studying the sclerites of Cichlidogyrus. Parasitol. Res. 114 (5), 2031-2034 (2015).
- Erbar, C., Leins, P. Portioned pollen release and the syndromes of secondary pollen presentation in the Campanulales-Asterales complex. Flora. 190 (4), 323-338 (1995).
- Jansen, S., Smets, E., Baas, P. Vestures in woody plants: a review. IAWA Journal. 19 (4), 347-382 (1998).
- Bortolin Costa, M. F., et al. Stigma diversity in tropical legumes with considerations on stigma classification. Bot. Rev. 80 (1), 1-29 (2014).
- Almeida, O. J. G., Cota-Sánchez, J. H., Paoli, A. A. S. The systematic significance of floral morphology, nectaries, and nectar concentration in epiphytic cacti of tribes Hylocereeae and Rhipsalideae (Cactaceae). Perspect. Plant Ecol. 15 (5), 255-268 (2013).
- Konarska, A. Comparison of the structure of floral nectaries in two Euonymus L. species (Celastraceae). Protoplasma. 252 (3), 901-910 (2015).
- Giuliani, C., Maleci Bini, L. Insight into the structure and chemistry of glandular trichomes of Labiatae, with emphasis on subfamily Lamioideae. Plant Syst. Evol. 276 (3-4), 199-208 (2008).
- Li, K., Zheng, B., Wang, Y., Zhou, L. L.Breeding system and pollination biology of Paeonia delavayi (Paeoniaceae), an endangered plant in the Southwest of China. Pak. J. Bot. 46 (5), 1631-1642 (2014).
- García, L., Rivero, M., Droppelmann, F. Descripción morfológica y viabilidad del polen de Nothofagus nervosa (Nothofagaceae). Bosque. 36 (3), 487-496 (2015).
- Prenner, G., Klitgaard, B. B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae). Am. J. Bot. 95 (11), 1349-1365 (2008).
- Ratnayake, K., Joyce, D. C., Webb, R. I. A convenient sample preparation protocol for scanning electron microscope examination of xylem-occluding bacterial biofilm on cut flowers and foliage. Sci. Hortic-Amsterdam. 140 (1), 12-18 (2012).
- Çolak, G., Celalettin Baykul, M., Gürler, R., Çatak, E., Caner, N. Investigation of the effects of aluminium stress on some macro and micro-nutrient contents of the seedlings of Lycopersicon esculentum Mill. by using scanning electron microscope. Pak. J. Bot. 46 (1), 147-160 (2014).
- Arafa, S. Z. Scanning electron microscope observations on the monogenean parasite Paraquadriacanthus nasalis from the nasal cavities of the freshwater fish Clarias gariepinus in Egypt with a note on some surface features of its microhabitat. Parasitol. Res. 110 (5), 1687-1693 (2012).
- Uppalapatia, S. R., Kerwinb, J. L., Fujitac, Y. Epifluorescence and scanning electron microscopy of host-pathogen interactions between Pythium porphyrae (Peronosporales, Oomycota)and Porphyra yezoensis (Bangiales, Rhodophyta). Bot. Mar. 44 (2), 139-145 (2001).
- Meaney, M., Haughey, S., Brennan, G. P., Fairweather, I. A scanning electron microscope study on the route of entry of clorsulon into the liver fluke, Fasciola hepatica. Parasitol. Res. 95 (2), 117-128 (2005).
- Sundarasekar, J., Sahgal, G., Subramaniam, S. Anti-candida activity by Hymenocallis littoralis extracts for opportunistic oral and genital infection Candida albicans. Bangladesh J. Pharmacol. 7 (3), 211-216 (2012).
- Benhamou, N., Rey, P., Picard, K., Tirilly, Y. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens. Phytopathology. 89 (6), 506-517 (1999).
- Singh, A., et al. First evidence of putrescine involvement in mitigating the floral malformation in mangoes: A scanning electron microscope study. Protoplasma. 251 (5), 1255-1261 (2014).
- Xiang, C., et al. Fine mapping of a palea defective 1 (pd1), a locus associated with palea and stamen development in rice. Plant Cell Rep. 34 (12), 2151-2159 (2015).
- Mendoza, L., Hernandez, F., Ajello, L. Life cycle of the human and animal oomycete pathogen Pythium insidiosum. J. Clin. Microbiol. 31 (11), 2967-2973 (1993).
- Bello, M. A., Rudall, P. J., González, F., Fernández, J. L. Floral morphology and development in Aragoa (Plantaginaceae) andrelated members of the order Lamiales. Int. J. Plant Sci. 165 (5), 723-738 (2004).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral morphology and development in Quillajaceae and Surianaceae (Fabales), the species-poor relatives of Leguminosae and Polygalaceae. Ann. Bot. 100 (4), 1491-1505 (2007).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral ontogeny in Polygalaceae and its bearing on the homologies of keeled flowers in Fabales. Int. J. Plant Sci. 171 (5), 482-498 (2010).
- Bello, M. A., Alvarez, I., Torices, R., Fuertes-Aguilar, J. Floral development and evolution of capitulum structure in Anacyclus (Anthemideae, Asteraceae). Ann. Bot. 112 (8), 1597-1612 (2013).
- Bello, M. A., Martínez-Asperilla, A., Fuertes-Aguilar, J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance. Bot. J. Linn. Soc. 181 (1), 84-98 (2016).
- Calonge, F. D., Martínez, A. J., Falcó, I., Samper, L. E. Phellorinia herculanea f. stellata f. nova encontrada en España. Bol. Soc. Micol.Madrid. 35 (1), 65-70 (2011).
- Liu, Y., et al. Deciphering microbial landscapes of fish eggs to mitigate emerging diseases. ISME J. 8 (10), 2002-2014 (2014).
- Sandoval-Sierra, J. V., Diéguez-Uribeondo, J. A comprehensive protocol for improving the description of Saprolegniales (Oomycota): two practical examples (Saprolegnia aenigmatica sp. nov. and Saprolegnia racemosa sp. nov.). PLOS one. , (2015).
- Endress, P. K. Zur vergleichenden Entwicklungsmorphologie, Embryologie und Systematik bei Laurales. Bot. Jahrb. Syst. 92 (2), 331-428 (1972).
- Tucker, S. Floral development in Saururus cernuus (Saururaceae):1. Floral initiation and stamen development. Am. J. Bot. 62 (3), 993-1005 (1975).
- Endress, P. K., Matthews, M. L. Progress and problems in the assessment of flower morphology in higher-level systematics. Plant Syst. Evol. 298 (2), 257-276 (2012).
- Beakes, G. W., Glockling, S. L., Sekimoto, S. The evolutionary phylogeny of the oomycete "fungi". Protoplasma. 249 (1), 3-19 (2012).
- Romansic, J. M., et al. Effects of the pathogenic water mold Saprolegnia ferax on survival of amphibian larvae. Dis. Aquat. Organ. 83 (3), 187-193 (2009).
- van West, P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: new challengues for an old problem. Mycologist. 20 (3), 99-104 (2006).
- Johansen, D. A. Plant microtechnique. , McGrow-Hill. New York. (1940).
- Unestam, T. Studies on the crayfish plague fungus Aphanomyces astaci. Some factors affecting growth in vitro. Physiol. Plantarum. 18 (2), 483-505 (1965).
- Cerenius, L., Söderhäll, K. Repeated zoospore emergence from isolated spore cysts of Aphanomyces astaci. Exp. Mycol. 8 (4), 370-377 (1984).
- Diéguez-Uribeondo, J., Cerenius, L., Söderhäll, K. Repeated zoospore emergence in Saprolegnia parasitica. Mycol. Res. 98 (7), 810-815 (1994).
- Söderhäll, K., Svensson, E., Unestam, T. Chitinase and protease activities in germinating zoospore cysts of a parasitic fungus, Aphanomyces astaci, Oomycetes. Mycopathologia. 64 (1), 9-11 (1978).
- Echlin, P. Handbook of sample preparation for scanning electron microscopy and X-Ray Microanalysis. , Springer Science + Business Media, LLC. NY. (2009).
- Osumi, M., et al. Preparation for observation of fine structure of biological specimens by high-resolution SEM. Microscopy. 32 (4), 321-330 (1983).
- Rezinciuc, S. The Saprolegniales morpho-molecular puzzle: an insight into markers identifying specific and subspecific levels in main parasites. , Universidad Internacional Menéndez Pelayo. Doctoral Thesis (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon