Method Article
Escaneado de Protocolos de Microscopía Electrónica (SEM) para la Problemática de la planta, Oomycete, y muestras de hongos
En este artículo
Resumen
Problems in the processing of biological samples for scanning electron microscopy observation include cell collapse, treatment of samples from wet microenvironments and cell destruction. Low-cost and relatively rapid protocols suited for preparing challenging samples such as floral meristems, oomycete cysts, and fungi (Agaricales) are compiled and detailed here.
Resumen
Los problemas más comunes en el procesamiento de muestras biológicas para observaciones con el microscopio electrónico de barrido (SEM) incluyen colapso celular, el tratamiento de muestras de microambientes húmedos y destrucción de las células. El uso de tejidos florales jóvenes, quistes oomycete y esporas de hongos (Agaricales) como ejemplos, los protocolos específicos para procesar las muestras delicadas están descritos aquí que superan algunos de los principales desafíos en el tratamiento de la muestra para la captura de imágenes bajo el SEM.
meristemos florales fijos con la FAA (formalina-acético-alcohol) y se procesa con el Punto Crítico Secadora (CPD) no mostraron colapsaron paredes celulares u órganos distorsionadas. Estos resultados son cruciales para la reconstrucción del desarrollo floral. Un tratamiento basado en la CPD similar de muestras de microambientes húmedos, como los quistes oomycete fijados con glutaraldehído, es óptimo para poner a prueba el crecimiento diferencial de las características de diagnóstico (por ejemplo, las espinas del quiste) en diferentes tipos de Dobstrates. La destrucción de células de la enfermera adjunta a esporas de hongos se evitó después de la rehidratación, la deshidratación y el tratamiento de CPD, un paso importante para los estudios más funcionales de estas células.
Los protocolos detallados aquí representan bajo costo y alternativas rápidas para la adquisición de imágenes de buena calidad para reconstruir los procesos de crecimiento y estudiar sus características de diagnóstico.
Introducción
En biología, el uso de la microscopía electrónica de barrido (SEM) se ha extendido a los estudios de la evolución estructural, la morfología comparativa, el desarrollo de órganos, y la caracterización de las poblaciones o especies 1. Con su vista bidimensional de estructuras microscópicas, áreas como la micromorfología y sistemática se beneficiaron de los avances de la técnica SEM desde la segunda mitad del siglo 20. Por ejemplo, la introducción de la metodología de revestimiento por bombardeo iónico en la década de 1970 hizo posibles observaciones de materiales delicados, como los brotes apicales y flores que potencien la capacidad de formación de imágenes de los tejidos no conductores 2, 3. SEM utiliza electrones expulsados de la superficie de la muestra para reproducir la topografía en un entorno de alto vacío 4.
Los estudios que implican SEM se centran tanto en la inferencia de caracteres estructurales y la reconstrucción de growtprocesos h. caracteres estructurales nuevos relevantes a la taxonomía y sistemática de una amplia gama de organismos se han descubierto a partir de observaciones de SEM. Por ejemplo, características de las plantas utilizadas para el diagnóstico de las especies o las clasificaciones supraespecíficas, tales como las punteaduras de madera 5, la diversidad estigma 6, morfología nectario y florales 7, 8, detalles de tricomas 9, y los granos de polen de 10, 11, no puede visualizarse de forma adecuada y sin SEM. Observaciones exitosas con SEM convencional también se han logrado para los organismos fijados en formalina 12 desde hace mucho tiempo y especímenes de herbario de plantas 13.
Por otra parte, los estudios de reconstrucción de los procesos de crecimiento utilizando SEM implican una amplia gama de temas, tales como el desarrollo de órganos 14, infecciones inducidos por las bacterias 15, planta de raíz fisiología 16, mecanismos de fijación parásito-hospedador 17, 18, efectos de medicamentos en los parásitos 19, micoparasitismo y antibiosis 20, 21, malformación crecimiento del 22, de desarrollo comparativo de individuos salvajes y mutantes 23, y ciclos de vida completos 24. Aunque los microscopios electrónicos de barrido ambiental (ESEM) 25 pueden tener ventajas importantes para la observación de muestras biológicas húmedas en los procesos de crecimiento, material delicado todavía podrá verse comprometido incluso en la condición de bajo vacío del ESEM), y necesitan ser procesados adecuadamente para evitar la pérdida de valiosa observación morfológica.
En este trabajo, una revisión de los protocolos específicos para la observación SEM de tres diffSe presenta Erent tipos de muestras: meristemos florales, oomicetos (Saprolegnia), y material fúngico. Estos protocolos compilar la experiencia de nuestros estudios anteriores basados en SEM 26, 27, 28, 29, 30, 31, 32, 33, donde se han encontrado dificultades específicas y soluciones alternativas. En el caso de la planta comparada estudios estructurales y de desarrollo, el uso de SEM se inició en la década de 1970 34, 35, y desde entonces, los investigadores descubrieron que ciertas características florales son más lábil que se pensaba anteriormente 36. Reconstrucción del desarrollo floral implica la captura de todas las etapas entre los meristemos florales jóvenes y antesis. Para alcanzar este objetivo, es essential que la topografía de la muestra y la integridad de la pared celular no se vean comprometidos después de la fijación y la subsiguiente deshidratación. Meristemos florales jóvenes son particularmente vulnerables al colapso de la pared celular (Figuras 1a, 1b). Del mismo modo, las estructuras delicadas como nectarios, pétalos, estigma y esporangios requieren protocolos eficaces y no perjudiquen. Esta revisión resume un protocolo óptimo para mantener los tejidos jóvenes y delicadas intactas para obtener imágenes de SEM.
En el caso de los oomicetos (stramenopiles), uno de los grupos más diversos y generalizadas de los parásitos, con anfitriones que van desde los microbios y plantas de invertebrados y vertebrados 37 - hay esporas que crecen y se desarrollan en un ambiente húmedo. Esta condición representa un desafío para la observación SEM porque las esporas necesitan un sustrato adecuado no es adecuado para protocolos estándar SEM. Entre los oomicetos, especies de Saprolegnia son de particular interés debido a que can causar reducciones severas en la acuicultura, la pesca y las poblaciones de anfibios 38. Características micromorfológicos, tales como las espinas de gancho de los quistes, se han encontrado para ser útil para identificar especies de Saprolegnia, que es fundamental para establecer los controles de infección y los tratamientos potenciales 39. Aquí, hay un protocolo experimental para comparar los patrones de crecimiento de la columna vertebral de los quistes en diferentes sustratos y manipular la muestra para la preparación de los Puntos Críticos de secador (CPD) y la posterior observación SEM.
En un tercer caso, hay hallazgos más interesantes que surgieron después de una inspección de las esporas de los hongos Phellorinia Herculanea f. f stellata. nova (Agaricales) 31. Junto con las esporas, un grupo de células de vivero inesperados se identificó bajo el SEM. Con los protocolos tradicionales anteriores y material sin tratar, las células enfermera entró out se derrumbó por completo (Figura 1c). Más inferencias sobre tejidos particulares asociados a las esporas se pueden hacer con las modificaciones simples pero cruciales a los enfoques estándar descritos aquí (Figura 1D).
En esta revisión, hay protocolos detallados SEM que se pueden utilizar para hacer frente a diferentes problemas asociados con la observación SEM en las angiospermas, oomicetos, y Agaricales, tales como el colapso celular y la contracción del tejido meristemático, el crecimiento no óptima de las espinas del quiste, y la destrucción de tejidos efímeras, respectivamente.

Figura 1: Comparación de las muestras tratadas y sin (a, c) y con (b, d) el protocolo de la FAA-etanol-CPD. (A - b) yemas florales de Anacyclus clavatus, a mitad de desarrollo. Bud tratada con tetróxido de osmio 46 </ sup> (a) y Bud tratados con el protocolo de la FAA-CPD (b). (C - d) las células de la enfermera con esporas de Phellorinia Herculanea f. stellata. Secado muestras sin ningún tratamiento (c) y con el protocolo aquí descrito para Agaricales (d). Las esporas de color naranja. Escalas: (ab) 100 m, (cd) 50 micras. Las fotografías fueron tomadas por Y. Ruiz-León. Haga clic aquí para ver una versión más grande de esta figura.
Protocolo
NOTA: Este protocolo incluye seis secciones principales, tres dedicadas a organismos específicos (secciones 1-3), y tres que describen los procedimientos comunes a todos (4-6). Asteriscos (*) indican los pasos modificados por los experimentadores.
1. Estudios de Desarrollo y Estructuras de las Plantas completamente formado
- Colección y fijación
- Si el material vegetal se recoge en un lugar sin acceso a una campana extractora de humos, introducir y sumergir el material en el 70% de etanol en tubos de centrífuga. Idealmente, sumergir el material después de 48 h en FAA (pasos 1.1.1-1.1.3) para evitar la deshidratación excesiva en el etanol. Si una campana de humos es accesible para el material vegetal, ignore este paso y continuar con 1.1.1.
- Preparar el fijador de formalina-ácido acético-alcohol (FAA) en una campana de gases equipado con un filtro de aldehído. Añadir 85 partes de 70% de etanol desnaturalizado, 10 partes de solución de formaldehído al 60%, y 5 partes de ácido acético glacial. Preparar la FAAjusto antes de la fijación del material, como su almacenamiento a largo plazo no se recomienda 40.
- En virtud de la campana extractora de humos, verter el stock de la FAA en boca ancha individual y botellas de plástico a prueba de fugas. Utilice tantas botellas, ya que hay muestras disponibles, y crear etiquetas para identificación de la muestra.
- Seleccionar los meristemos florales o vegetales para fijar, asegurando que no son dañados por insectos, hongos o las condiciones climáticas extremas. Cortar las ramas, la eliminación de material no deseado, y depositar la muestra inmediatamente en la solución de la FAA.
- Después de 72-96 h, se vierte la FAA en un recipiente de plástico para la eliminación de químicos. Inmediatamente, lavar las muestras tres veces con etanol fresco 70% para eliminar cualquier FAA residual. material fijado se puede almacenar indefinidamente en etanol al 70%.
- La disección y la deshidratación
- Diseccionar el material fijado en el 70% de etanol bajo el microscopio estereoscópico con unas pinzas ultra finas, needles, fórceps, cepillos y micro-escalpelos (el tamaño máximo del tejido debe estar alrededor de 1 cm 3, o 2 cm de material plano). Diseccionar las muestras en una placa de Petri cubierta con etanol para evitar que los tejidos de secado. Utilice una placa de Petri con la base cubierta de silicona negro seco para ver mejor los tejidos blanco contrastantes.
- Poner el material disecado en recipientes de muestras para el secador de punto crítico (CPD, la figura 2a). En este punto, se sumergen los recipientes en la placa de Petri con un 70% de etanol, e incluir las etiquetas de identificación de la muestra (hecho con papel y lápiz). Para un secado más eficaz para su posterior manipulación, evitar mezclar las muestras de jóvenes y adultos en el mismo contenedor. *
- Ponga las tapas de los envases y depositarlos en tubos de centrífuga de plástico con un montón de etanol al 70%. Guarde los tubos durante la noche si el material no se procesa inmediatamente.
- Transferir el material diseccionado a través de la siguiente serie de etanols en frascos herméticos o tubos de centrífuga: 70%, 90%, 100%, y 100%. Deja las muestras en cada solución durante 1 h a menos. Mantener las muestras durante la noche en una solución de etanol 100%.
- La transferencia de los contenedores con el material a la CPD (sección 4).
- Montaje y preparación de tejidos vegetales para la observación SEM
- Escribe el número de identificación de la muestra por debajo de los soportes de muestra SEM (es decir, trozos de aluminio). Cubrir la parte superior de los talones con cinta de doble cara. Coloque los talones en un soporte de la muestra (Figura 2b).
- Bajo un microscopio estereoscópico, abra cuidadosamente los contenedores que transporten las muestras pequeños y delicados ya secas en el CPD. Tenga en cuenta que después del tratamiento CPD, las muestras se vuelven más ligeros y sensibles a la electrostática. Cierre los contenedores una vez que las muestras han sido tomadas a cabo para evitar el polvo o impurezas.
- Poner las muestras en la superficie pegajosa de los talones, la planificación anticipada de la deseadaposición (una vez que las muestras tocan la superficie, es muy difícil de eliminar de ellos). No trate de realizar una disección importante en este punto; acaba de eliminar el tejido no deseado que es fácil de recoger. Para los estudios palinológicos, diseccionar las anteras y abrirlos para exponer el polen en los talones.
- Muestras puesto de largo (por ejemplo, 2 cm de longitud), tales como inflorescencias en la posición horizontal. Cuando sea posible, las muestras de orientar la misma estructura para polar, lateral y vistas inferiores. Deje suficiente espacio entre las muestras en el talón.
- Si las muestras no pueden ser procesadas de inmediato, mantenerlos protegidos durante la noche en un contenedor hermético con gel de sílice para evitar la rehidratación (Figura 2c) *. Cubra las muestras utilizando el dispositivo de recubrimiento por pulverización catódica y transferirlos a la SEM (secciones 5 y 6).

Figura 2: Herramientas para la muestra manipulatien el procesamiento y antes de la observación SEM. (A) recipiente de la muestra, de acero, con paredes perforadas para el etanol / CO2 en la cámara de intercambio de CPD. (B) los trozos de acero dentro de un soporte de la muestra plástica. Contenedor (c) de vidrio utilizado para mantener las muestras protegidas de la humedad y el polvo. En la base, hay un compartimento para el gel de sílice. (D) Puntos Críticos de secadora. En la parte delantera, no son (de izquierda a derecha) el manómetro, el interruptor de encendido, el sistema de control de la temperatura, y el indicador de temperatura. Presión de trabajo habitual para el intercambio de CO2 etanol es de 60 bares (800 psi). En la parte superior, hay cuatro válvulas (controles de entrada, drenaje, ventilación y de escape) que flanquean la cámara de la muestra central. Las fotografías fueron tomadas por Y. Ruiz-León y MA Bello. Haga clic aquí para ver una versión más grande de esta figura.
- El cultivo y la fijación de los quistes
- Preparar peptona y glucosa (PG-l) medios de comunicación 41 por medio de D - (+) - glucosa (6 g) y peptona micológica (3 g) *. Añadir hasta 900 ml de agua del grifo y el autoclave 40 minutos a 121 ° C. Verter 50 ml de la solución A previamente tratado en autoclave (NaH 2 PO 4, 0,13 M) y 50 ml de solución B (Na 2 HPO 4, 0,13 M).
- De cultivos madre de cepas de Saprolegnia parasitica mantenidos en peptona, glucosa y medio de agar (PGA, que se prepara como PG-l pero la adición de 10 g de agar bacteriológico Europea a la glucosa y la peptona antes de autoclave), crecen colonias micelio en 0,5 ml de PG-l gotitas durante 24-48 horas a 20 ° C en placas de Petri. Inducir la esporulación mediante el lavado de los micelios con agua del grifo esterilizada en autoclave tres veces y su incubación durante 15 horas a 20 ° C= "xref"> 42, 43.
- Recoger las zoosporas secundarios liberados pipeteando suavemente la parte superior de la suspensión y los acumularse en porciones de 1 ml. Agitar enérgicamente las zoosporas durante 30 s por agitación para producir quistes secundarios 44.
- Para probar el crecimiento diferencial de los lomos de los quistes, por separado en cajas de Petri (p60), poner 0,5 ml de la suspensión de quiste secundario en diferentes superficies (es decir, carbono, rejillas de oro, y TEM cobre; escalas de salmón y merluza (anteriormente blanqueados); y cubreobjetos de vidrio) *. Incubar los quistes a 20 ° C durante 70 min, lo que favorece la fijación de los quistes a la superficie.
- Eliminar el líquido y añadir 0,5 ml de glutaraldehído al 2% a cada superficie para la fijación de los quistes. Mantener las muestras a temperatura ambiente en una campana de humos durante 1 h.
- Retire el glutaraldehído y deshidratar la muestra a través de una serie de etanol (30%, 40%, 50%, 60%, 70%, 80%, 90%, 100% y 100%), la adición de 5 ml de cada solución de etanol durante 15 min. Una vez en la última solución de etanol al 100%, la muestra se puede almacenar durante un máximo de un mes en una placa de Petri sellada. En esta etapa, las muestras están listas para ser secado en el CPD.
- Transferir cuidadosamente las rejillas y las escamas de la placa de Petri con un soporte adecuado para el CPD (Sección 4). Para este paso, utilizar un soporte de rejilla de CPD o un soporte de la muestra de apilamiento, que mantienen las muestras separadas una de otra. Tome las rejillas y escalas con pinzas, teniendo en cuenta que los quistes deben estar hacia arriba en las redes de todo el tiempo. *
- Montaje y preparación de muestras para la observación del quiste de la SEM
- Montar las rejillas y las escamas en los talones de aluminio, que previamente fueron cubiertos con cinta adhesiva de doble cara de carbono y etiquetados por debajo.
- Transferir las muestras al aparato de revestimiento por pulverización catódica (sección 5).
- Observar las muestras bajo la (sección 6) SEM.
3. Estudio de esporas de hongos del herbario de Herculanea Phellorinia bajo SEM
- La rehidratación y deshidratación de esporas
- Envolver cada muestra con cuidado con papel de filtro, formando sobres marcados con lápiz ~ 0,5-1 cm 2, teniendo cuidado de no aplastarlas. Sellar el papel de filtro con los clips de papel. La transferencia de las muestras envasadas en una placa de Petri y sumergirlos en 10 ml de agua para rehidratar los tejidos alrededor de las esporas.
- Inmediatamente poner las muestras en un horno de microondas (600 W durante aproximadamente 20 s). Retire el material una vez que el agua comienza a evaporarse, y deje que se enfríe a temperatura ambiente.
- Pasar las muestras a través de la siguiente serie de etanol: 30%, 50%, 70%, 80%, 90%, 95%, 100% y 100%. Dependiendo de la cantidad de muestras, utilice un vaso de precipitados o de centrifugación de tubos para este paso. Deja las muestras durante 15 minutos en cada solución.
- Colocar las muestras en el CPD (sección 4).
- El montaje y la preparing esporas para la observación SEM
- Abrir los sobres. Verter las esporas en un trozo previamente preparado con cinta de doble cara. Alternativamente, recoger las esporas con la superficie pegajosa de los talones, teniendo cuidado de no aplastarlas *.
- Si las muestras contienen pocas esporas, además del paso anterior, cortar un pequeño trozo de la envolvente (~ 1 mm 2) y colocarla en un nuevo trozo *.
- Coloque los tejidos en el dispositivo de recubrimiento por pulverización catódica (sección 5).
- Observe bajo la (sección 6) SEM.
4. El secado del material utilizando un secador de punto crítico (CPD, la figura 2d)
- Utilice la CPD en un área ventilada y verifique que todas las válvulas de la máquina están cerrados. Compruebe si la cámara de muestra está vacía y limpia.
- Conectar la máquina y verificar que la prueba del sistema de control de temperatura se lleva a cabo de forma automática. Si el DPC tiene un sistema de baño de refrigeración externo, compruebe los niveles de agua antes de cambiar iT el.
- Siga las instrucciones del fabricante de la DPC específico utilizado para el etanol y CO2 intercambio. Por razones de seguridad, llevar a cabo este paso bajo la supervisión de una persona capacitada para el uso de la máquina. Recuerde que está expuesta a cambios rápidos de presión, que podría estallar de forma violenta.
- Sacar las muestras y continuar con el paso 1.3 si se trabaja con tejidos de la planta, paso 2.2 si se trabaja con oomicetos quistes, y los pasos 3.2 si se trabaja con esporas de hongos.
5. El recubrimiento de las muestras con oro utilizando el Sputter Coater (Figura 3a)
- Compruebe el dispositivo de recubrimiento por pulverización catódica. Compruebe que el objetivo de cátodo de oro está en buenas condiciones. Utilice un paño sin pelusa empapado con etanol al 90% para limpiar las paredes de la cámara de vacío y la tapa de la cámara si es necesario.
- Marcar el titular de pulverización catódica con números al lado de cada agujero talón para una mejor identificación de las muestras bajo el microscopio. Con cuidado, colocar los talones cargado con el samplES y asegurarlos. Usa una etapa espécimen planetario giratorio para asegurar un revestimiento uniforme sobre especímenes con superficies irregulares.
- Siga las instrucciones del fabricante para ajustar la configuración como la distancia de trabajo, presión de gas operación (por ejemplo, 5 x 10 -1 - 7 x 10 -1 mbar) (por ejemplo, 30 mm.), El tiempo de pulverización catódica (por ejemplo, 50 s), espesor de la capa de oro (por ejemplo, 12 nm), la corriente (por ejemplo, 15 mA) y la tensión de alimentación (por ejemplo, 600 V) 45.
- Retire los talones y llevarlos a la (sección 6) SEM. Alternativamente, colocar los talones en un recipiente sellado con gel de sílice (Figura 2c).

Figura 3: recubridor por pulverización catódica (a) y microscopio electrónico de barrido (b). (A) Vista frontal de la cámara de vacío (izquierda), el gas VALVe, temporizador, de vacío, y los controles actuales. (B) Vista lateral de los componentes principales de SEM (de izquierda a derecha): la columna de vacío con la cámara de muestra, la pantalla del ordenador con los controles, y el monitor de la cámara. Las fotografías fueron tomadas por Y. Ruiz-León. Haga clic aquí para ver una versión más grande de esta figura.
6. Observación bajo el microscopio electrónico de barrido (SEM, Figura 3b)
- SEM puesta en marcha
- Siga las instrucciones del fabricante para iniciar y establecer el SEM, el ajuste de la altura de la muestra el diámetro de apertura objetivo (por ejemplo, para las plantas de 2 micras y para los hongos y oomicetos 4 micras), la tensión de servicio (por ejemplo, 15 kV).
- Comprobar la alineación correcta del sistema de haz de electrones y establecer el alineamiento axial y las estigmadores de acuerdo con las indicaciones del fabricante. Ajuste tque la distancia de trabajo con el fin de obtener una profundidad adecuada de campo.
- Captura de imagen
- Obtener una imagen enfocada de la muestra y utilizarla como punto de partida. Aumentar la ampliación cerca del nivel máximo y enfocar la imagen de nuevo. Elige zonas con irregularidades de la superficie tales como agujeros. corregir el astigmatismo y ajustar el contraste y el brillo óptimo.
- Capturar la imagen SEM con la alta resolución. Utilizar el detector de EEB si la imagen muestra que las muestras se cargan. De lo contrario, ajuste el detector de SE. Cambiar los detectores siguientes instrucciones del fabricante.
Resultados
Desarrollo floral y Fijación de Desarrollo y Estructuras de las Plantas completamente formado
Utilizando el protocolo FAA-CPD se describe aquí, tejidos de plantas jóvenes y maduras se fijan de manera óptima y se deshidrata para obtener imágenes de SEM. Procesos tales como el desarrollo floral se pueden reconstruir porque la topografía y la forma de las yemas no se ve distorsionada por las células contracción (Figuras 1b, 1d, 4a-f). Las estructuras con formas complejas se pueden cubrir con éxito con una capa uniforme de material conductor (el metal del revestidor de bombardeo iónico), lo que permite la recuperación de datos de otro modo inalcanzables (figuras 4G-I, 5e). Las imágenes de buena calidad de las muestras procedentes de microambientes húmedos, que antes no se carguen de la corriente de electrones si muy deshidratada y revestido, se puede lograr (Figuras 4f 5a, 5b). detalles importantes, como la superficie de la pared (polenLa figura 5b, 5c) y diferentes tipos de indumenta (Figuras 5d-g) pueden ser estudiados en profundidad sin partículas artificiales e indeseables o formas distorsionadas.
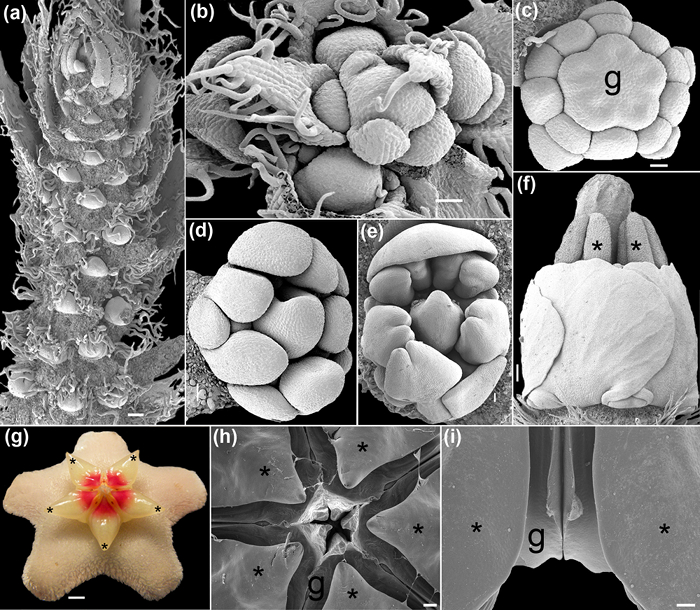
Figura 4: Temprano (a, b), MID (c-e) y tardía (fi) el desarrollo floral capturado bajo el SEM. (A) Raceme de Caesalpinia spinosa (Molina) Kuntze con varios meristemos florales. (B) Vista superior de un joven racimo Polygala violacea Aubl. (C) El botón floral de Krameria ixine Loefl. durante la diferenciación gineceo. (D - e) Brotes de Erythrina sp. (F) Vista lateral de una flor de Krameria ixine. Las anteras y el estilo sobresalen. (G - i) Hoya carnosa (L.) R. Brown. ( g) de la flor en la antesis (imagen digital tomada con una Olympus SP-590UZ 26X). (H) Vista superior de los estambres y carpelos divididas. (I) Vista lateral de un par de estambres que flanquean dos carpelos. Los asteriscos indican estambres. g = gineceo. Escalas: (a, i) 1 mm, (b, d) 400 micras, (c) 200 m, (e) 500 m, (f, h) 2 mm, (g) 0,25 cm. Las fotografías fueron tomadas por MA Bello. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: micrografías SEM de esporangios y el polen (a, b), las superficies detallados (c- e) y (f indumenta - g). (A) Los esporangios de Dryopteris sp. (B) El polen de Prunus dulcis DA Webb aterrizar en el estigma. (C) El polen de Nepenthes alata Blanco. (D) Vista lateral de una inflorescencia de Erigeron karvinskianus DC. Imagen tomada opción detector de BSE. (E) Vista lateral de la briofitas periestoma sp. (F) glandular y tricomas glandulares no-en la superficie abaxial de una hoja de Rosmarinus officinalis L. (G) Vista superior de las escalas planas de las hojas de Olea europaea L. Escalas: (a) 400 m, (b) 60 micras, (c) 5 micras, (d) 4 mm, (e) 600 m, (f) 200 m, (g) 600 micras. Las fotografías fueron tomadas por Y. Ruiz-León. Haga clic aquí para ver una versión más grande de esta figura.
Efecto de diferentes sustratos en el crecimiento de la espina dorsal de Secundaria quistes Saprolegnia parasitica
El patrón de crecimiento columna vertebral era diferente en diferentes sustratos. Sobre el vidrio, las espinas eran alargadas y mostraron bucles en las puntas (Tabla 1, Figura 6a). En el carbón y el oro rejillas de las espinas son más cortos, encrespado y crecen en abundancia alrededor de los quistes sin formar bucles (Figuras 6b, 6d). Aunque en rejillas de cobre, las espinas tendían a curvarse sin bucles, algunos de ellos alargado (Figura 6c). En las escalas de peces, las espinas eran rizado, abundante alrededor de la superficie y, a veces forman bucles extremos (Figura 6e-f).

Figura 6: patrones de crecimiento diferencial de los lomos de Saprolegnia parasitica en quistes inmersos en un medio líquido. (A) Glass. (B) de carbono. (C) El cobre. (D) de oro. (E) La merluza escala. (F) la escala de color salmón. espinas rectas se desarrollaron sobre vidrio y cobre, mientras que las espinas rizadas se formaron en las escalas de carbono, oro, y pescado. Las puntas en forma de gancho (flechas blancas) de las espinas son observables en todas las espinas que crecen en vidrio y en pocos espinas en escamas de pescado. Las paredes del quiste son de color amarillo. Escala: 20 micras. Las fotografías fueron tomadas por Y. Ruiz-León y S. Rezinciuc. Haga clic aquí para ver una versión más grande de esta figura.
| Superficie | morfología de la espina | |
| Alargamiento | Lazo en la punta | |
| Cubierta de vidrio | Buena elongación, espinas fácil de contar | Presente |
| Escamas de pescado | Espinas con forma rizado no es fácil de contar | Presente |
| rejillas TEM | espinas cortas rizadas y no es fácil de contar | Ausente |
Tabla 1: morfología de la espina utilizando diferentes tipos de sustrato.
Las observaciones inesperadas en Phellorinia Herculanea f. stellata
Aparte del hallazgo inesperado de hifas laticiferous en el exoperidium de P. Herculanea, Calonge et al. 31 conocer globosa y células de la enfermera lisas (8-13 micras) mezclado con esporas en el material deshidratado con CPD gracias a la etapa de rehidratación realizado en el microondas. (Figura 1d). La estructura y los detalles de las paredes de tél células de la enfermera y las esporas están bien conservados a pesar de su composición diferencial (Figuras 1c-d).
Discusión
Con respecto a los protocolos estándar SEM, los procedimientos que aquí se presentan son relativamente rápido, fácil de seguir, y metodologías de bajo costo. Dependiendo de la cantidad de muestras y en la facilidad de procesamiento, se tarda de cuatro a cinco días para adquirir imágenes de buena calidad. Incluidas las precauciones de seguridad adecuadas para el CPD y el funcionamiento SEM, los procedimientos son fáciles de manejar. Particular, se debe tener cuidado con formalina y el glutaraldehído (consulte los pasos 1.1.1 a 1.1.3 y 2.1.5 del protocolo). Hay ciertos pasos en los que, si es necesario, el proceso puede ser detenido por un largo tiempo sin dañar las muestras o arruinar pasos anteriores (por ejemplo, los pasos 1.1.5, 1.2.3, 1.3.5 y). En términos de coste, gran parte del equipo se puede reutilizar para varias preparaciones (por ejemplo, envases de aluminio CPD y los titulares de talón), y los reactivos son caros productos químicos no está disponible para todos los proveedores comerciales.
Las desventajas de estos procedimientos sonla necesidad de la eliminación de residuos químicos adecuados para los aldehídos y el etanol y la falta de suministros clave y las limitaciones de la técnica. Los materiales tales como el disco de oro para el revestidor de bombardeo iónico y el cilindro de CO 2 para el CPD se deben comprobar con mucha antelación. Si están en uso continuo, el laboratorio requiere múltiples poblaciones de ellas, lo que eventualmente eleva los costos. Dado que los investigadores individuales a menudo no pueden justificar los gastos derivados del mantenimiento de este tipo de materiales de construcción, o que simplemente no necesitan utilizar el SEM de forma continua, estos procedimientos hoy en día tienden a ser realizadas en los laboratorios de microscopía electrónica con los servicios externos.
La técnica de observación de la SEM se limita a un estudio de gran aumento de las superficies. Si los tejidos internos necesitan ser observados, las muestras se deben cortar en la forma adecuada para explorar la apariencia externa de los tejidos internos. Para explorar aspectos internos de las células con alto magnification, se requiere un microscopio electrónico de transmisión (TEM). Los pasos críticos en el protocolo son la fijación adecuada y la deshidratación de las muestras antes del tratamiento CPD, donde es crucial para mantener los tejidos a salvo de los cambios impactantes y contacto directo con el aire. También, una gestión cuidadosa de los cambios de presión en la cámara de muestra CPD y la cantidad de revestimiento depositada sobre diferentes tipos de muestras es importante.
A pesar de estas limitaciones y manipulaciones especiales, el estudio de muestras biológicas con SEM Siguiendo los protocolos descritos aquí permite la resolución de los problemas más comunes, tales como la pared celular y la distorsión de órganos (Figuras 1, 4, 5), las restricciones a la observación y el crecimiento de las estructuras procedentes de entornos húmedos y líquidos (figuras 5, 6), y la destrucción de células sensibles (figuras 1c, 1d).
Los protocolos que se presentan han allowed la reinterpretación y el cuestionamiento de las características taxonómicas tradicionales, tales como la estructura de la columna vertebral en los quistes de Saprolegnia 47. El patrón de crecimiento diferencial de las espinas Saprolegnia en diferentes superficies demuestra la labilidad de esta característica y sus limitaciones para el diagnóstico de especies. Además de la captura de las características relevantes para los estudios taxonómicos, etapas de desarrollo de los órganos y las enfermedades infecciosas, las funciones de los tejidos no observadas antes han sido exploradas gracias a estas técnicas. Ahora, este protocolo se puede extender a miles de casos de estudio a la espera de ser examinados 33. De acuerdo con la base de datos de la literatura revisada por pares Scopus, en el pasado los últimos cinco años se han realizado 7.425 publicaciones de artículos que tratan de imágenes SEM de las plantas (4914), oomicetos (21) y hongos (2.490). Este hecho sugiere que en la investigación oomicetos utilizando la imagen de SEM es todavía muy escasa en comparación conplantas y hongos. Con ESEM, los números son aún más bajas. Hay 588 manuscritos en el mismo lapso de tiempo: 337 en las plantas, en oomicetos 1 y 250 en los hongos.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
Este proyecto ha recibido financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea en el marco del acuerdo de subvención Nº 634429. Esta publicación es responsabilidad exclusiva de su autor, y la Comisión Europea no se hace responsable del uso que pueda hacerse de la información contenida en el mismo. También reconocemos la aportación económica realizada por el Real Jardín Botánico, CSIC. SR agradece a la Unión Europea [ITN-SAPRO-238550] por el apoyo de su investigación en Saprolegnia. También queremos dar las gracias a Francisco Calonge por la amabilidad de proporcionar las imágenes Herculanea Phellorinia y B. Pueyo para el procesamiento de muestras (Figura 5). Todas las imágenes fueron tomadas por el servicio de SEM en el Real Jardín Botánico-CSIC en Madrid.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | No specific supplier | Skin irritation, eye irritation | |
| aluminium stubs | Ted Pella, Inc. | 16221 | www.tedpella.com |
| Centrifuge tubes | No specific supplier | ||
| Critical Point Dryer | Polaron Quatum Technologies | CPD7501 | |
| D-(+)-Glucose | Merck | 1,083,421,000 | |
| Double sided sellotape | No specific supplier | ||
| Ethanol absolute | No specific supplier | Flammable | |
| European bacteriological agar | Conda | 1800.00 | www.condalab.com |
| Filter paper | No specific supplier | ||
| Forceps | No specific supplier | ||
| Formalin 4% | No specific supplier | Harmful, acute toxicity, skin sensitisation, carcinogenicity. Flammable | |
| Glass cover slips | No specific supplier | ||
| Glass hermetic container | No specific supplier | ||
| Glutaraldehyde 25% DC 253857.1611 (L) | Dismadel S.L. | 3336 | www.dismadel.com |
| Mycological peptone | Conda | 1922.00 | www.condalab.com |
| needles | No specific supplier | ||
| Petri dishes | No specific supplier | ||
| Plastic containers | No specific supplier | ||
| Sample holder with lid for the critical point dryer | Ted Pella, Inc. | 4591 | www.tedpella.com |
| scalpels | No specific supplier | ||
| Scanning Electron Microscope | Hitachi | S3000N | |
| Software for SEM | |||
| Solution A: NaH2PO4 | |||
| Solution B: Na2HPO4 | |||
| Specimen holders | No specific supplier | ||
| Sputter coater | Balzers | SCD 004 | |
| Stereomicroscope | No specific supplier | ||
| Transmission Electron Microscope (TEM) grids | Electron Microscopy Sciences | G200 (Square Mesh) | www.emsdiassum.com |
| Tweezers | No specific supplier |
Referencias
- Endress, P. K., Baas, P., Gregory, M. Systematic plant morphology and anatomy: 50 years of progress. Taxon. 49 (3), 401-434 (2000).
- Falk, R. H., Gifford, E. M., Cutter, E. G. Scanning electron microscopy of developing plant organs. Science. 168 (3938), 1471-1474 (1970).
- Damblon, F. Sputtering, a new method of coating pollen grains in scanning electron microscopy. Grana. 15 (3), 137-144 (1975).
- Everhart, T. E., Thornley, R. F. M. Wide-band detector for micro-microampere low-energy electron currents. J. Sci. Instrum. 37 (7), 37246-37248 (1960).
- Collins, S. P., et al. Advantages of environmental scanning electron microscopy in studies of microorganisms. Microsc. Res. Techniq. 25 (5-6), 398-405 (1993).
- Fannes, W., Vanhove, M. P. M., Huyse, T., Paladini, G. A scanning electron microscope technique for studying the sclerites of Cichlidogyrus. Parasitol. Res. 114 (5), 2031-2034 (2015).
- Erbar, C., Leins, P. Portioned pollen release and the syndromes of secondary pollen presentation in the Campanulales-Asterales complex. Flora. 190 (4), 323-338 (1995).
- Jansen, S., Smets, E., Baas, P. Vestures in woody plants: a review. IAWA Journal. 19 (4), 347-382 (1998).
- Bortolin Costa, M. F., et al. Stigma diversity in tropical legumes with considerations on stigma classification. Bot. Rev. 80 (1), 1-29 (2014).
- Almeida, O. J. G., Cota-Sánchez, J. H., Paoli, A. A. S. The systematic significance of floral morphology, nectaries, and nectar concentration in epiphytic cacti of tribes Hylocereeae and Rhipsalideae (Cactaceae). Perspect. Plant Ecol. 15 (5), 255-268 (2013).
- Konarska, A. Comparison of the structure of floral nectaries in two Euonymus L. species (Celastraceae). Protoplasma. 252 (3), 901-910 (2015).
- Giuliani, C., Maleci Bini, L. Insight into the structure and chemistry of glandular trichomes of Labiatae, with emphasis on subfamily Lamioideae. Plant Syst. Evol. 276 (3-4), 199-208 (2008).
- Li, K., Zheng, B., Wang, Y., Zhou, L. L.Breeding system and pollination biology of Paeonia delavayi (Paeoniaceae), an endangered plant in the Southwest of China. Pak. J. Bot. 46 (5), 1631-1642 (2014).
- García, L., Rivero, M., Droppelmann, F. Descripción morfológica y viabilidad del polen de Nothofagus nervosa (Nothofagaceae). Bosque. 36 (3), 487-496 (2015).
- Prenner, G., Klitgaard, B. B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae). Am. J. Bot. 95 (11), 1349-1365 (2008).
- Ratnayake, K., Joyce, D. C., Webb, R. I. A convenient sample preparation protocol for scanning electron microscope examination of xylem-occluding bacterial biofilm on cut flowers and foliage. Sci. Hortic-Amsterdam. 140 (1), 12-18 (2012).
- Çolak, G., Celalettin Baykul, M., Gürler, R., Çatak, E., Caner, N. Investigation of the effects of aluminium stress on some macro and micro-nutrient contents of the seedlings of Lycopersicon esculentum Mill. by using scanning electron microscope. Pak. J. Bot. 46 (1), 147-160 (2014).
- Arafa, S. Z. Scanning electron microscope observations on the monogenean parasite Paraquadriacanthus nasalis from the nasal cavities of the freshwater fish Clarias gariepinus in Egypt with a note on some surface features of its microhabitat. Parasitol. Res. 110 (5), 1687-1693 (2012).
- Uppalapatia, S. R., Kerwinb, J. L., Fujitac, Y. Epifluorescence and scanning electron microscopy of host-pathogen interactions between Pythium porphyrae (Peronosporales, Oomycota)and Porphyra yezoensis (Bangiales, Rhodophyta). Bot. Mar. 44 (2), 139-145 (2001).
- Meaney, M., Haughey, S., Brennan, G. P., Fairweather, I. A scanning electron microscope study on the route of entry of clorsulon into the liver fluke, Fasciola hepatica. Parasitol. Res. 95 (2), 117-128 (2005).
- Sundarasekar, J., Sahgal, G., Subramaniam, S. Anti-candida activity by Hymenocallis littoralis extracts for opportunistic oral and genital infection Candida albicans. Bangladesh J. Pharmacol. 7 (3), 211-216 (2012).
- Benhamou, N., Rey, P., Picard, K., Tirilly, Y. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens. Phytopathology. 89 (6), 506-517 (1999).
- Singh, A., et al. First evidence of putrescine involvement in mitigating the floral malformation in mangoes: A scanning electron microscope study. Protoplasma. 251 (5), 1255-1261 (2014).
- Xiang, C., et al. Fine mapping of a palea defective 1 (pd1), a locus associated with palea and stamen development in rice. Plant Cell Rep. 34 (12), 2151-2159 (2015).
- Mendoza, L., Hernandez, F., Ajello, L. Life cycle of the human and animal oomycete pathogen Pythium insidiosum. J. Clin. Microbiol. 31 (11), 2967-2973 (1993).
- Bello, M. A., Rudall, P. J., González, F., Fernández, J. L. Floral morphology and development in Aragoa (Plantaginaceae) andrelated members of the order Lamiales. Int. J. Plant Sci. 165 (5), 723-738 (2004).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral morphology and development in Quillajaceae and Surianaceae (Fabales), the species-poor relatives of Leguminosae and Polygalaceae. Ann. Bot. 100 (4), 1491-1505 (2007).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral ontogeny in Polygalaceae and its bearing on the homologies of keeled flowers in Fabales. Int. J. Plant Sci. 171 (5), 482-498 (2010).
- Bello, M. A., Alvarez, I., Torices, R., Fuertes-Aguilar, J. Floral development and evolution of capitulum structure in Anacyclus (Anthemideae, Asteraceae). Ann. Bot. 112 (8), 1597-1612 (2013).
- Bello, M. A., Martínez-Asperilla, A., Fuertes-Aguilar, J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance. Bot. J. Linn. Soc. 181 (1), 84-98 (2016).
- Calonge, F. D., Martínez, A. J., Falcó, I., Samper, L. E. Phellorinia herculanea f. stellata f. nova encontrada en España. Bol. Soc. Micol.Madrid. 35 (1), 65-70 (2011).
- Liu, Y., et al. Deciphering microbial landscapes of fish eggs to mitigate emerging diseases. ISME J. 8 (10), 2002-2014 (2014).
- Sandoval-Sierra, J. V., Diéguez-Uribeondo, J. A comprehensive protocol for improving the description of Saprolegniales (Oomycota): two practical examples (Saprolegnia aenigmatica sp. nov. and Saprolegnia racemosa sp. nov.). PLOS one. , (2015).
- Endress, P. K. Zur vergleichenden Entwicklungsmorphologie, Embryologie und Systematik bei Laurales. Bot. Jahrb. Syst. 92 (2), 331-428 (1972).
- Tucker, S. Floral development in Saururus cernuus (Saururaceae):1. Floral initiation and stamen development. Am. J. Bot. 62 (3), 993-1005 (1975).
- Endress, P. K., Matthews, M. L. Progress and problems in the assessment of flower morphology in higher-level systematics. Plant Syst. Evol. 298 (2), 257-276 (2012).
- Beakes, G. W., Glockling, S. L., Sekimoto, S. The evolutionary phylogeny of the oomycete "fungi". Protoplasma. 249 (1), 3-19 (2012).
- Romansic, J. M., et al. Effects of the pathogenic water mold Saprolegnia ferax on survival of amphibian larvae. Dis. Aquat. Organ. 83 (3), 187-193 (2009).
- van West, P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: new challengues for an old problem. Mycologist. 20 (3), 99-104 (2006).
- Johansen, D. A. Plant microtechnique. , McGrow-Hill. New York. (1940).
- Unestam, T. Studies on the crayfish plague fungus Aphanomyces astaci. Some factors affecting growth in vitro. Physiol. Plantarum. 18 (2), 483-505 (1965).
- Cerenius, L., Söderhäll, K. Repeated zoospore emergence from isolated spore cysts of Aphanomyces astaci. Exp. Mycol. 8 (4), 370-377 (1984).
- Diéguez-Uribeondo, J., Cerenius, L., Söderhäll, K. Repeated zoospore emergence in Saprolegnia parasitica. Mycol. Res. 98 (7), 810-815 (1994).
- Söderhäll, K., Svensson, E., Unestam, T. Chitinase and protease activities in germinating zoospore cysts of a parasitic fungus, Aphanomyces astaci, Oomycetes. Mycopathologia. 64 (1), 9-11 (1978).
- Echlin, P. Handbook of sample preparation for scanning electron microscopy and X-Ray Microanalysis. , Springer Science + Business Media, LLC. NY. (2009).
- Osumi, M., et al. Preparation for observation of fine structure of biological specimens by high-resolution SEM. Microscopy. 32 (4), 321-330 (1983).
- Rezinciuc, S. The Saprolegniales morpho-molecular puzzle: an insight into markers identifying specific and subspecific levels in main parasites. , Universidad Internacional Menéndez Pelayo. Doctoral Thesis (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados