Method Article
문제있는 공장, 난균 강 및 곰팡이 샘플에 대한 전자 현미경 (SEM) 프로토콜을 스캔
요약
Problems in the processing of biological samples for scanning electron microscopy observation include cell collapse, treatment of samples from wet microenvironments and cell destruction. Low-cost and relatively rapid protocols suited for preparing challenging samples such as floral meristems, oomycete cysts, and fungi (Agaricales) are compiled and detailed here.
초록
주사 전자 현미경 (SEM)으로 관찰 용 생물학적 시료를 처리 일반적인 문제는 세포 붕괴 습식 미세 환경과 세포 파괴로부터의 샘플의 처리를 포함한다. 주사 전자 현미경에서 이미지 캡처를위한 샘플 처리의 주요 과제 중 일부를 극복 여기에 설명되어 섬세한 샘플을 처리하기 위해 특정 프로토콜을 젊은 꽃 조직, 난균 강 낭종 및 예제 등의 곰팡이 포자 (주름 버섯 목) 사용.
FAA 고정 꽃 분열 조직은 (포르말린 - 기타 - 아세트산)과 중요 포인트 건조기 (CPD)으로 처리가 세포 벽이나 왜곡 기관을 축소 표시되지 않았습니다. 이러한 결과는 꽃 개발의 재건을 위해 중요하다. 예를 들면 글루 타르 알데하이드로 고정 난균 강 낭종 등의 습식 미세 환경에서 샘플 유사한 CPD 기반 치료, 스와의 다른 유형에 대한 진단 특성의 차이 성장 (예를 들어, 낭종 쪽)을 테스트하는 최적bstrates. 곰팡이 포자 부착 간호사 세포의 파괴는 재수, 탈수 및 CPD 처리, 이러한 세포의 추가 기능 연구를위한 중요한 단계 후 피해야한다.
여기에 설명 된 프로토콜은 저비용과 성장 과정을 재구성 및 진단 특성을 연구하기 위해 좋은 품질의 이미지의 취득을위한 급속 대안을 나타낸다.
서문
생물학에서, 주사 전자 현미경을 사용 (SEM)의 구조의 진화, 비교 형태, 장기 개발, 집단 또는 종 (1)의 특성에 관한 연구로 확장되었다. 미세 구조의 두 개의 차원보기와 같은 micromorphology 및 계통 등의 분야는 20 세기 후반 이후 SEM 기술의 발전에서 이익을. 예를 들어, 1970 년대에 스퍼터 코팅 방법의 도입 비 - 전도성 조직 (2) (3)의 영상을 향상 같은 촬영 정점 꽃과 같은 민감한 물질 가능 관찰했다. SEM은 고진공 환경 4 지형 재현 시험편의 표면으로부터 방출 된 전자를 사용한다.
SEM과 관련된 연구는 구조적인 문자의 추론과 growt의 재건에 모두 초점을 맞추고있다시간 처리합니다. 새로운 구조적 분류에 관련된 문자 나 유기체의 광범위한 계통은 SEM 관찰 결과로부터 발견되었다. 예를 들어, 식물의 특성은 10, 11, 제대로없이 시각화 할 수없는 나무 5, 오명 다양성 (6), 꿀샘과 꽃 형태 7, 8, trichome 정보 9, 꽃가루 입자의 옷을 입은 피트로, 종의 진단 또는 supraspecific 분류에 사용 SEM. 기존의 SEM 성공적인 관측도 오랜 포르말린 고정 생물 (12)에 대해 달성 된 식물 식물 표본 13 표본.
한편, SEM을 사용하여 성장 과정 재구성 연구는 장기 개발 14 infe 같은 주제의 다양한 참여박테리아 (15), 식물 뿌리의 생리 (16), 기생충 - 호스트 연결 메커니즘 (17), (18), 기생충 (19), mycoparasitism 및 항균 20, 21, 성장 기형 (22), 야생 및 돌연변이 개인 (23)의 비교 개발 및 전체 수명주기에 약물 효과에 의해 유도 ctions 24. 환경 주사 전자 현미경 (ESEM) (25)의 성장 공정에서 습식 생물학적 시료의 관찰 중요한 장점을 가질 수 있지만 섬세한 재료는 아직까지도 ESEM)의 저 진공 상태에서 손상 및 손실을 방지하기 위해 적절하게 처리 할 수있다 의 가치 형태 학적 관찰.
본 논문에서는 세 DIFF의 SEM 관찰을위한 특정 프로토콜의 리뷰샘플 erent 유형이 표시됩니다 : 꽃 분열 조직, oomycetes (Saprolegnia가 번식), 및 곰팡이 소재. 이러한 프로토콜은 특정한 어려움을 대체 해법이 발견 된 이전 SEM 기반 연구 26, 27, 28, 29, 30, 31, 32, 33, 경험을 컴파일한다. 비교 식물 발달 및 구조 연구의 경우, SEM의 사용은 1970 (34), (35)에 시작하고, 이후, 연구자들은 특정 꽃의 기능은 이전에 36 생각보다 불안정한 것을 발견했다. 꽃 개발의 재건 젊은 꽃 분열 조직과 개화 사이의 모든 단계의 캡처를 포함한다. 이 목적을 달성하기 위해, ESSE 인샘플 지형 세포벽 무결성 정착 이후의 탈수 후 손상되지 않도록 ntial. 젊은 꽃 분열 조직 세포 벽 붕괴에 특히 취약하다 (도 1A, 1B). 마찬가지로, nectaries에, 꽃잎, 암술과 sporangia와 같은 섬세한 구조는 효과적이고 undamaging 프로토콜을 필요로한다. 이 평가는 SEM 이미징 그대로 젊고 섬세한 조직을 유지하는 최적의 프로토콜을 요약 한 것입니다.
미생물과 식물에서 무척추 동물과 척추 동물 (37)에 이르기까지 호스트와 oomycetes (Stramenopiles) 기생충의 가장 다양하고 광범위한 그룹의 온의 경우, - 성장하고 젖은 환경에서 개발 포자가있다. 포자 표준 SEM 프로토콜에 적합하지 않은 적절한 기판을 필요로하기 때문에이 조건은 SEM 관찰에 대한 도전을 나타냅니다. oomycetes 중 Saprolegnia가 번식 종은 특히 관심있는 그들은 캘리포니아 때문에N aquacultures, 어업 및 수륙 양용 인구 38 심각한 감소를 야기한다. 예컨대 낭종 후크 등뼈 같은 Micromorphological 특성, 감염 제어 및 잠재적 치료 39 설정할 근본적인 Saprolegnia가 번식의 종류를 식별하는 것이 유용한 것으로 밝혀졌다. 여기서, 다른 기판에 낭종 척추 성장의 패턴과 비교하고 임계점 건조기 (CPD) 제조 이후의 SEM 관찰 용 시료를 조작하는 실험 프로토콜이있다.
세 번째 경우에, 버섯 Phellorinia의 herculanea (F)의 포자의 검사 후에 와서 흥미로운 연구 결과가있다. stellata 바. 노바 (주름 버섯 목) 31. 함께 포자로, 예상치 못한 보육 셀 그룹은 SEM에서 확인되었다. 이전의 전통적인 프로토콜 및 치료 재료, 간호사 세포 ou는왔다t 완전히 (그림 1C)을 축소. 포자에 관련된 특정 조직에 대한 자세한 추론은 여기서 설명 (그림 1D) 표준 방식으로 간단하지만 중요한 수정을 할 수있다.
이 리뷰에서의 SEM 관찰과 관련된 다양한 문제를 해결하는 데 사용할 수있는 상세한 SEM 프로토콜이있다 피자 식물, 휴대 붕괴와 분열 조직 축소, 낭종 쪽의 비 최적의 성장, 그리고 파괴 등 oomycetes 및 주름 버섯 목, 각각 임시 조직.

그림 1 : (A, C)과과 (B, D) 프로토콜 FAA-에탄올 CPD없이 처리 된 샘플의 비교. (A - B) Anacyclus의 clavatus, 중앙 개발의 꽃 봉오리. 버드 사 산화 오스뮴 46 <처리/ SUP> (a) 및 FAA-CPD 프로토콜 (b)로 처리 새싹. (C - D) Phellorinia의 herculanea (F)의 포자와 간호사 세포. stellata. 임의의 처리 (c)없이 여기 주름 버섯 목 (d)에 기술 된 프로토콜로 샘플을 건조. 오렌지 포자. 저울 : (AB) 100 μm의 (CD) 50 μm의. 사진은 Y. 루이즈 - 레온에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
참고 :이 프로토콜은 모든 (4-6)에 공통의 절차를 설명하는 특정 생물 (섹션 1-3)과 3-3 헌신 6 가지 주요 섹션이 포함되어 있습니다. 별표 (*)는 실험자에 의해 수정 단계를 나타냅니다.
1. 개발의 연구 및 완전 성형 공장 구조
- 수집 및 고정
- 식물 물질은 흄 후드없이 액세스 할 수있는 장소에 수집되면, 도입 원심 분리기 튜브에서 70 % 에탄올에 담가 재료. 이상적으로, 에탄올 과도한 탈수를 방지하기 위해 FAA에서 48 시간 (1.1.1-1.1.3 단계) 후 재료를 담가. 흄 찬장은 식물 재료에 액세스 할 수있는 경우,이 단계를 무시하고 1.1.1를 계속합니다.
- 알데히드 필터가 장착 된 연기 찬장에 포르말린 아세트산 알코올 (FAA) 정착액을 준비합니다. 70 % 변성 에탄올 85 부, 60 % 포름 알데히드 용액 10 부 및 빙초산 (5) 부분을 추가한다. 연방 항공국 준비단지 그것의 장기 보관으로, 재료를 고정하기 전에 40을 사용하지 않는 것이 좋습니다.
- 퓸 찬장에서 개인 넓은 입과 누수 방지 플라스틱 병에 FAA의 주식을 붓는다. 사용 가능한 샘플이있는만큼 병을 사용하여 샘플 식별 라벨을 만들 수 있습니다.
- 그들은 곤충, 곰팡이, 또는 극단적 인 기상 조건에 의해 손상되지 않도록 보장 해결하기 위해 꽃이나 식물 분열 조직을 선택합니다. , 가지를 잘라 불필요한 물질을 제거하고, FAA 용액에 즉시 샘플을 입금.
- 72-96 시간 후, 화학 폐기 플라스틱 용기에 FAA를 붓는다. 즉시, 잔여 FAA을 제거하기 위해 신선한 70 % 에탄올로 샘플을 세 번 씻는다. 고정 재료는 70 % 에탄올에 무기한 저장 될 수있다.
- 해부 및 탈수
- NE, 초 미세 핀셋을 이용하여 실체 현미경을 70 % 에탄올에 고정 재료를 해부edles, 집게, 브러쉬, 마이크로 메스은 (조직의 최대 크기는 약 1cm 3 또는 편평한 재료 2cm이어야 함). 건조되는 조직을 방지하기 위해 에탄올로 덮여 페트리 접시에 시료를 해부. 더 나은 대조 흰색 조직을 볼 수 건조 검은 색 실리콘으로 덮여베이스와 페트리 접시를 사용합니다.
- 임계점 건조기 (CPD, 그림 2a)에 대한 시료 용기의 해부 재료를 넣습니다. 이 시점에서, 70 % 에탄올과 페트리 접시에 용기를 체험하고, (종이와 연필로 만든) 샘플 식별 라벨을 포함한다. 추가 조작을위한보다 효과적인 건조를 들어, 동일한 용기에 젊고 성숙한 샘플을 혼합하지 마십시오. *
- 용기에 뚜껑을 넣고 70 % 에탄올을 듬뿍 플라스틱 원심 분리기 튜브에서 그들을 입금. 재료가 즉시 처리되지 않은 경우 하룻밤 튜브를 저장합니다.
- 다음 에탄올 시리즈를 통해 해부 자료를 전송70 %, 90 %, 100 %, 100 % 밀폐 항아리 또는 원심 분리기 튜브에서의. 적어도 1 시간 동안 각 솔루션의 샘플을 남겨주세요. 100 % 에탄올 용액 중에 하룻밤 샘플 유지.
- CPD (섹션 4)의 재료로 용기를 전송합니다.
- SEM 관찰에 대한 설치 및 준비 식물 조직
- 주사 전자 현미경 샘플 홀더 (즉, 알루미늄 스텁) 아래 샘플 식별 번호를 기입합니다. 양면 테이프로 스텁의 상단을 커버. 시편 홀더 (그림 2b)에 스텁을 놓습니다.
- 실체 현미경에서 신중하게 이미 CPD에서 건조 젊고 섬세한 샘플을 운반하는 컨테이너를 엽니 다. CPD 처리 후, 샘플은 정전기에 가볍고 민감한 될 수 있음을 명심하십시오. 샘플은 먼지 나 불순물을 피하기 위해 밖으로 촬영 한 후 컨테이너를 닫습니다.
- , 스텁의 접착 표면에 시료를 넣어 미리 계획 원하는위치 (샘플 표면을 터치하면, 그것을 제거하는 것은 매우 어렵다). 이 시점에서 주요 절개를 수행하지 마십시오; 그냥 선택하기 쉬운 불필요한 조직을 제거합니다. palynological 연구의 경우, 꽃밥을 해부하고 스텁에 꽃가루를 노출을 엽니 다.
- 이러한 수평 위치에 화서로 넣어 긴 샘플 (예를 들어, 2cm 길이). 가능하면, 극성, 측면에 대한 동일한 구조, 아래보기의 동양 샘플. 스텁에 샘플 사이에 충분한 공간을 둡니다.
- 샘플을 즉시 처리 할 수없는 경우, *들이 재수 화 (도 2C)을 방지하기 위해 실리카 겔과 함께 밀폐 용기에 하룻밤 보호 유지한다. 코트 스퍼터 코터를 사용하여 SEM로 전송 샘플 (섹션 5 및 6).

그림 2 : 샘플 manipulati 도구에 처리 SEM 관찰하기 전에. CPD 실에서 에탄올 / CO 2 교환을위한 전진 벽 (가) 철강 만든 시료 용기. (b) 플라스틱 시험편 홀더 내의 스틸 스텁. (c) 유리 용기는 습기와 먼지로부터 보호 샘플을 유지하기 위해 사용된다. 기본에서, 실리카 겔을위한 구획이있다. (d)에 중요한 포인트 건조기. 앞에서, 압력계, 전원 스위치, 온도 제어 장치 및 온도 표시 (왼쪽에서 오른쪽)이있다. CO 2 에탄올 교환에 대한 일반적인 작업 압력은 60 바 (800 PSI)입니다. 상부에서, 중앙 샘플 챔버의 측면에 네 개의 밸브 (입구, 드레인, 환기 및 배기 제어)이있다. 사진은 Y. 루이즈 - 레온과 MA 벨로에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 낭종 성장 고정
- (+) - - 포도당 (6g)과 균 학적 펩톤 (3g) * 펩톤과 포도당 (PG-1) D를 사용하여 미디어 (41)를 준비합니다. 수돗물 900 mL의 최대 추가, 121 ° C에서 40 분 압력솥. 이전에 멸균 용액 A의 50 ㎖ (의 NaH 2 PO 4, 0.13 M) 및 솔루션 B의 50 ㎖ (나 2 HPO 4, 0.13 M)을 따르십시오.
- 펩톤, 포도당, (PG-1으로하지만 포도당과 오토 클레이브 전에 펩톤에 유럽 세균 한천 10g을 추가 할 준비가되어 PGA) 한천 매체에 유지 Saprolegnia가 번식의 parasitica의 균주의 재고 문화, 0.5 mL에 균사의 식민지를 성장 배양 접시에 20 ° C에서 24 ~ 48 시간 동안 PG-1 방울의. 멸균 된 C를 수돗물로 3 회 균사체를 세척하고 20 ℃에서 15 시간 동안 이들을 배양하여 포자 형성을 유도= "외부 참조"> 42, 43.
- 부드럽게 정지의 상단 부분을 피펫 팅에 의해 방출 된 보조 zoospores를 수집하고 1 ML의 부분에서 그들을 풀. 보조 낭종 (44)을 생산하는 텍싱에 의해 적극적으로 30 초에 대한 zoospores를 선동.
- 이전에 (연어와 hake 물고기 비늘, 별도의 배양 접시 (P60)의 낭종의 등뼈의 차동 성장을 테스트하려면, 다른면 (즉, 탄소, 금, 구리 TEM 그리드에 보조 낭종 현탁액 0.5 mL를 넣어 표백)와 유리 커버 슬립) *. 표면에 낭종의 부착을 선호 70 분, 20 ° C에서 낭종을 품어.
- 액체를 제거하고 낭종의 고정 각면에 2 % 글루 타르 알데히드 0.5 mL를 넣어. 1 시간 동안 흄 후드하에 실온에서 시료를 유지한다.
- 글루 타르 알데하이드를 제거하고 에탄올 시리즈 (30 %, 40 %, 50 %, 60 %, 70 %, 80 %를 통해 샘플을 탈수15 분 동안 각각의 에탄올 용액 5 ㎖를 첨가 90 %, 100 %, 100 %). 마지막으로 100 % 에탄올 용액에 일단 샘플을 밀봉 된 배양 접시에서 개월까지 저장할 수있다. 이 단계에서, 샘플은 CPD 건조 될 준비가된다.
- 조심스럽게 CPD (4 절)에 적합한 홀더에 페트리 접시에서 그리드와 비늘을 전송합니다. 이 단계에서, 서로 분리 된 샘플을 보관할 때는 CPD 그리드 홀더 또는 적층 시편 홀더를 사용한다. 낭종은 항상 그리드에 위로 향하도록해야 함을 염두에두고, 핀셋 그리드와 비늘을 가져 가라. *
- SEM 관찰에 대한 설치 및 준비 낭종 샘플
- 이전에 양면 카본 테이프로 덮여 아래에 표시 한 알루미늄 스텁에 그리드와 규모를 탑재합니다.
- 스퍼터 코터 (섹션 5)에 샘플을 전송합니다.
- 주사 전자 현미경 (섹션 6)에서 샘플을 관찰한다.
3. SEM에서 Phellorinia의 herculanea의 식물 표본 상자 진균 포자의 연구
- 수분 보충과 포자의 탈수
- 그들에게 호감 않도록주의하면서 ~ 0.5 cm 2 연필 표지 봉투를 형성, 여과지로 조심스럽게 각각의 샘플 랩. 종이 클립 여과지를 밀봉합니다. 페트리 접시에 충전 샘플을 옮기고 포자 주위 조직을 재수 화하기 위해 물 10ml에 그들을 몰입.
- 즉시 전자 레인지 (약 20 초 600 W)에 샘플을 넣어. 물이 증발하기 시작하면 재료를 제거하고 실온에서 냉각되도록.
- 다음 에탄올 시리즈를 통해 샘플 합격 : 30 %, 50 %, 70 %, 80 %, 90 %, 95 %, 100 % 및 100 %. 시료의 양에 따라,이 단계 비이커 또는 원심 분리 튜브를 사용한다. 각각의 용액에서 15 분 동안 샘플을 남겨주세요.
- CPD (섹션 4)에 샘플을 놓습니다.
- 설치 및 PSEM 관찰을 위해 포자를 수리,
- 봉투를 엽니 다. 양면 테이프로 이전에 제조 된 스텁에 포자를 따르십시오. 또는, *을 분쇄 않도록주의하면서, 스텁의 접착면에 포자를 수집합니다.
- 샘플은 소수의 포자를 포함하는 경우, 이전 단계에 부가하여, 봉투 (~ 1mm 2)의 작은 조각을 잘라내어 새로운 스터브 *에 배치.
- 스퍼터 코터 (섹션 5)로 조직을 놓습니다.
- 주사 전자 현미경 (섹션 6)에서 관찰한다.
임계점 건조기를 사용하여 재료 4. 건조 (CPD, 그림 2D)
- 통풍이 지역의 CPD를 사용하여 시스템의 모든 밸브가 닫혀 있는지 확인합니다. 샘플 챔버가 비어하고 깨끗한 있는지 확인합니다.
- 기계에 스위치와 온도 제어 시스템 테스트가 자동으로 수행되는지 확인합니다. CPD는 외부 냉각 조 시스템을 가지고 있다면, 스위칭 전에 수위를 확인에 T.
- 에탄올과 이산화탄소의 교환을 위해서 일반적으로 사용되는 특정 CPD의 제조업체의 지침을 따르십시오. 안전을 위해, 기기의 사용을위한 훈련 사람의 감독 하에서이 단계를 수행한다. 이 급격한 압력 변화에 노출되어 있는지, 그것이 격렬하게 불어 있었다 기억하십시오.
- 샘플을 꺼내 식물 조직과 협력하는 경우 단계 1.3를 계속 oomycetes 낭종 작업하는 경우 2.2 단계, 곰팡이 포자로 작업하는 경우 3.2 단계를 반복합니다.
5. 스퍼터 코팅기 (그림 3a)를 사용하여 골드로 샘플을 코팅
- 스퍼터 코터를 확인합니다. 금 음극의 대상이 양호한 상태에 있는지 확인합니다. 필요한 경우 진공 챔버의 벽과 챔버 뚜껑을 청소하는 90 % 에탄올로 젖은 보풀이없는 천을 사용하십시오.
- 현미경 샘플의 추가 식별을 위해 각 스텁 구멍 옆에 숫자 스퍼터 홀더를 표시합니다. 조심스럽게 SAMPL로드 스텁을 배치와 ES를 고정합니다. 불규칙한 표면 시료에 균일 한 코팅을 보장하기 위해 회전 행성 표본 단계를 사용합니다.
- 이러한 작업 거리로 설정을 조정하는 제조업체의 지침에 따라, 운전 가스 압력 (예를 들어, × 10 -1 5-7 × 10 -1 밀리바) (예를 들어, 30mm.), 스퍼터링 시간 (예를 들어, 50의) 금 층 (예를 들어, 12 ㎚) 전류 (예를 들면, 15mA)와 전압 공급 (예를 들어, 600 V) (45)의 두께.
- 스텁을 제거하고 SEM (6 절)에게 가져 가라. 또한, 실리카 겔 (그림 2C)와 밀폐 용기에 스텁을 배치합니다.

도 3 : 스퍼터 코터 (a) 및 주사 전자 현미경 (b). (a)는 진공 챔버 (왼쪽) 전면보기, 가스 valv전자, 타이머, 진공, 전류 제어합니다. (에서 왼쪽에서 오른쪽으로)을 SEM 주요 구성 요소의 (b)는 측면보기 : 샘플 실, 컨트롤과 컴퓨터 화면, 챔버의 모니터로 진공 열입니다. 사진은 Y. 루이즈 - 레온에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
스캐닝 6. 관측 전자 현미경 (SEM, 그림 3b)
- SEM은 시작
- 시작 (식물 2 μm의과 곰팡이 oomycetes 4 μm의를 위해, 예를 들면), 동작 전압 (예를 들어, 15 kV의) 샘플의 높이를 목적 개구 직경 조정은 SEM을 설정하는 제조업체의 지침을 따르십시오.
- 전자 빔 시스템의 올바른 정렬을 확인하고 축 정렬 및 제조 업체의 지시에 따라 stigmators을 설정합니다. t를 조정그 필드의 적절한 깊이를 얻기 위해 작동 거리.
- 이미지 캡처
- 샘플의 집광 이미지를 얻고 출발점으로 사용. 최대 수준으로 확대 가까이 증가하고 다시 이미지에 초점을 맞 춥니 다. 같은 구멍으로 표면 요철 영역을 선택합니다. 정확한 난시 및 최적의 명암과 밝기를 조정합니다.
- 고해상도로 SEM 이미지를 캡처. 이미지가 샘플이 청구됩니다 보여줍니다 경우 BSE 검출기를 사용합니다. 그렇지 않으면, SE 감지기를 설정합니다. 제조업체의 지침에 따라 검출기를 변경합니다.
결과
꽃 개발 및 개발의 고정 및 완전 성형 공장 구조
여기에 설명 된 FAA-CPD 프로토콜을 사용하여, 젊고 성숙한 식물 조직은 최적의 고정 및 SEM 이미징 탈수 있습니다. 새싹의 지형과 모양이 축소 세포 (도 1B, 1D,도 4a-F)에 의해 왜곡되지 않기 때문에 이러한 꽃 개발과 같은 프로세스는 복원 할 수 있습니다. 복잡한 형상을 가진 구조물을 성공적으로 도달 달리 부품 (도 4g-I, 5E)의 회복을 가능하게 전도성 재료 (스퍼터 코팅기의 금속)의 균일 한 층으로 피복 될 수있다. 심하게 탈수 및 코팅, (그림 4 층, 5A를,도 5b)을 달성 할 수있는 경우에 사용하는 습식 미세 환경에서 오는 샘플 좋은 품질의 이미지는 전자 전류 과충전합니다. 이러한 꽃가루 벽면 중요한 세부 사항 (도 5b,도 5c) 및 indumenta (도 5D-g의 다른 유형) 인공 또는 바람직하지 않은 입자 또는 왜곡 된 모양없이 깊이 연구 할 수있다.
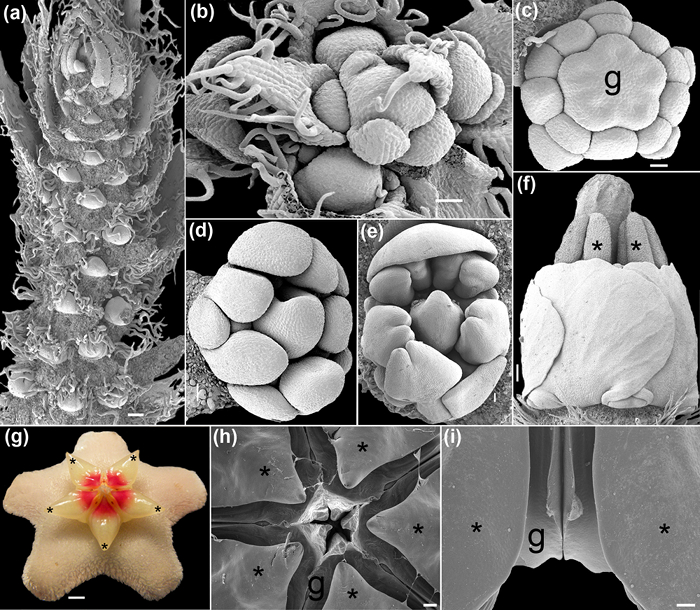
주사 전자 현미경 아래에서 촬영 초기 (A, B), 중간 (C-E)와 후기 (FI) 꽃 개발 : 그림 4. (가) 여러 꽃 분열 조직과 Caesalpinia의 spinosa (몰리나) Kuntze의 총상. (b)는 젊은 총상 Polygala violacea Aubl의 상위 뷰입니다. (다) 크라 메리아 속의 꽃 봉오리는 Loefl을 ixine. gynoecium 차별화 동안. (D - E)하는 Erythrina의 싹 SP. (f)에 크라 메리아 속에서 ixine의 꽃의 측면보기. 꽃밥과 스타일은 돌출. (g - 전) 호야 carnosa (L.) R. 브라운. ( g) 꽃 (A 올림푸스 SP-590UZ 26X로 촬영 한 디지털 이미지). (시간)이 수술과 분할 심피의 상위 뷰입니다. 두 개의 심피를 측면 수술 한 쌍의 (ⅰ) 측면보기. 별표 수술을 나타냅니다. g = gynoecium. 저울 (A, I) 1mm, (b, d) 400 μm의 (c) ~ 200㎛, (E)는 500㎛ (F, H) 2mm, (g) 0.25 cm. 사진은 MA 벨로에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 5 : sporangia와 꽃가루의 SEM 현미경 사진 (A, B), 상세한면 (C-E), 및 indumenta (F - g). (가) Dryopteris 특검팀의 Sporangia. 벚나무 dulcis입니다 DA 웹의 (b)에 화분B 오명에 착륙. (다) 벌레 잡이 통풀 속 alata는 블랑코의 꽃가루. 을 개의 꽃이 핌의 (d)에 측면보기 DC는 karvinskianus. 이미지는 BSE 검출기 옵션과 함께 찍은 사진. 선태 식물의 Peristoma 특검팀의 (전자) 측면보기. (f)의 선의와 Rosmarinus 화 officinalis (L)의 잎의 배축 표면에 노 선의 상체 (trichome). (g) Olea europaea의 (L)의 잎 평면 규모의 상위 뷰입니다. 저울 (A) 400 ㎛의 (b) 60 ㎛의 (C)이 5㎛, (d) 4mm, (E) 600 μm의 (F)를 200 ㎛의 (g) 600 μm의. 사진은 Y. 루이즈 - 레온에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보조 낭종 Saprolegnia가 번식 parasitica에서의 척추 성장에 다른 기판의 효과
척추의 성장 패턴은 다른 기판에 달랐다. 유리, 등뼈가 신장되었고 그들의 팁 (표 1,도 6a)에서 루프를 보였다. 탄소에와 골드는 쪽이 짧은, 웅크 리고 루프 (도 6B, 6D)을 형성하지 않고 낭종 주위에 더 풍부하게 성장입니다 그리드. 구리 그리드에 있지만, 등뼈는 반복하지 않고 그들 중 일부 연장 (도 6c)를 컬하는 경향이 있었다. 생선 비늘에서 등뼈는 곱슬 표면 주위에 풍부했고, 때때로 (그림 6E-f)의 끝을 루프 형성했다.

그림 6 : 액체 매질에 침지 낭종에 Saprolegnia가 번식 parasitica의의 등뼈의 차동 성장 패턴. (a) Glas에에스. (b) 탄소. (c) 구리. (d)에 골드. (마) 메르 루사 규모. (f)는 연어 규모. 컬링 쪽은 탄소, 금, 물고기 비늘에 형성되었다 반면에 직선 쪽은, 유리, 구리에 개발되었다. 등뼈의 후크 팁 (흰색 화살표) 유리에 성장하는 모든 등뼈와 물고기 비늘에 몇 쪽의 관측이다. 낭종의 벽은 노란색에 있습니다. 규모 : 20 μm의. 사진은 Y. 루이즈 - 레온과 S. Rezinciuc에 의해 촬영되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 표면 | 척추 형태 | |
| 연장 | 끝에서 루프 | |
| 유리 커버 | 좋은 신장, 쉬운 쪽은 계산하기 | 선물 |
| 물고기 비늘 | 둥근 모양 쉬운 일이 아닙니다와 등뼈는 계산합니다 | 선물 |
| TEM 그리드 | 계산에 짧은 곱슬 쪽이 쉽지 않다 | 없는 |
기판의 종류를 사용하여 척추 형태 : 표 1.
Phellorinia의 herculanea의 F에서 예기치 않은 관찰. stellata
이 외에 P.의 herculanea, 칼론 등의 exoperidium에 laticiferous 균사의 예기치 않은 발견에서. (31)는 구형과 전자 레인지에 수행 재수 단계에 CPD 감사와 탈수 재료의 포자와 혼합하여 부드러운 간호사 세포 (8-13 μm의)를 발견했다. (그림 1D). 구조와 t의 벽의 세부 사항간호사 세포와 포자 그는 물론 자신의 차동 구성 (도 1C-D)에도 불구하고 보존됩니다.
토론
표준 SEM 프로토콜에 대해, 여기에 제시된 절차는 비교적 빠른 따라하기 쉽고, 저렴한 방법 등이 있습니다. 샘플의 양 및 처리의 용이성에 따라, 양호한 품질의 이미지를 획득 4-5 일 걸린다. CPD 및 SEM 작업에 대한 적절한 안전주의 사항을 포함하는 절차는 취급이 용이하다. 특히주의 (1.1.3 및 프로토콜의 2.1.5에 단계 1.1.1 참조) 포르말린과 글루 타르 알데히드에주의해야한다. 샘플 손상 또는 이전 단계를 파괴하지 않고, 필요한 경우, 처리가 장시간 정지시킬 수 있으며, 특정 단계가 (예, 1.1.5, 1.2.3 및 1.3.5 단계)가있다. 비용면에서, 장치의 대부분은 몇 가지 제제 (예, CPD 알루미늄 스터브 용기 홀더)에 재사용 될 수 있고, 시약 비 비싼 화학 모든 상업적인 공급 업체에서 제공된다.
이 절차의 단점은알데히드 류 및 에탄올과 핵심 공급의 부족 및 기술의 제한에 대한 적절한 화학 폐기물의 필요성. 이러한 스퍼터 코팅기와 CPD 대한 CO 2 실린더 금 디스크와 같은 재료를 사전에 확인한다. 이들이 연속 사용하는 경우, 기관은 결국 비용을 끌어 올리고이를 여러 주식을 요구할 것이다. 개별 연구자들은 용품 이러한 유형의 유지 유래의 비용을 정당화 할 수 없기 때문에, 또는 단순히 연속적 SEM을 사용하지 않아도,이 과정은 현재 외부 전자 현미경 서비스 실험실에서 수행되는 경향이있다.
전자 현미경의 관찰 기술은 표면 고배율 연구에 제한되어있다. 내부 조직을 관찰 할 필요가있는 경우, 샘플은 내부 조직의 외관을 탐구하는 적절한 방법으로 절단한다. 높은 mA에서 세포의 내부 측면을 탐색하려면gnification, 투과형 전자 현미경 (TEM)이 요구된다. 프로토콜 내에서 중요한 단계는 충격의 변화와 공기와의 직접적인 접촉으로부터 안전 조직을 유지하는 것이 중요하다 CPD 처리 전에 샘플의 적절한 고정을 탈수한다. 또한, CPD 시료 챔버 내의 압력 변화와 시료의 종류에 증착 된 코팅의 양을 신중하게 관리는 중요하다.
이러한 한계 및 특수 조작에도 불구하고, SEM은 여기에 설명 된 프로토콜에 따라 생물학적 샘플의 연구는 세포벽 오르간 왜곡 (도 1, 4, 5)에서, 관찰에 대한 제한과 같은 일반적인 문제의 해결을 허용 및 구조물의 성장 (그림 5, 6) 습식 및 액체 환경에서 오는 민감한 세포 (도 1C, 1D)의 파괴.
여기에 제시된 프로토콜은 allowe있다이러한 Saprolegnia가 번식 (47)의 낭종의 척추 구조와 같은 전통적인 분류 학적 특성의 재 해석과 질문을 거라고. 다른면에 Saprolegnia가 번식 등뼈의 차동 성장 패턴은이 기능의 불안정성 종 진단에 대한 제한을 설명한다. 분류 학적 연구, 장기 개발의 단계 및 감염 질환, 이러한 기술 덕분에 탐구되기 전에 관찰되지 않았다 조직의 기능에 대한 관련 특성을 캡처뿐만 아니라. 자,이 프로토콜은 기다리고 사례 연구 수천 (33)를 검사하기로 확장 할 수 있습니다. 피어 검토 문학 데이터베이스 스코 푸스에 따르면, 지난 5 년 동안 마지막에 식물의 SEM 영상 (4914)을 다루는 논문의 7425 간행물, oomycetes (21)와 균류 (2490)가 있었다. 이 사실은 SEM 영상을 사용하여 oomycetes의 조사에 비해 여전히 매우 부족 제안식물과 균류. ESEM으로 숫자도 낮다. 곰팡이의 식물 (337), 1 oomycetes에서 250 : 동일한 시간 범위에서 588 사본이 있습니다.
공개
The authors have nothing to disclose.
감사의 말
이 프로젝트는 보조금 협정 제이 책은 저자의 의견을 반영 634429.에서 유럽 연합 (EU)의 호라이즌 (2020)의 연구 및 혁신 프로그램에서 자금을 받았고, 유럽위원회 (European Commission)가 정보로 만들어 질 수있는 사용에 대한 책임을지지 않습니다 거기에 포함. 우리는 또한 리얼 자르 딘 보타니 코, CSIC에 의한 재정 기여를 인정합니다. SR은 Saprolegnia가 번식 그녀의 연구 지원을위한 유럽 연합 (EU) [ITN-SAPRO-238550]에 감사합니다. 우리는 또한 친절에 대한 시스코 칼론 감사 샘플을 (그림 5)을 처리하기위한 Phellorinia의 herculanea 이미지와 B의 Pueyo을 제공하고자합니다. 모든 이미지는 마드리드에서 리얼 자르 딘 보타니-CSIC의 SEM 서비스에 의해 촬영되었다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid | No specific supplier | Skin irritation, eye irritation | |
| aluminium stubs | Ted Pella, Inc. | 16221 | www.tedpella.com |
| Centrifuge tubes | No specific supplier | ||
| Critical Point Dryer | Polaron Quatum Technologies | CPD7501 | |
| D-(+)-Glucose | Merck | 1,083,421,000 | |
| Double sided sellotape | No specific supplier | ||
| Ethanol absolute | No specific supplier | Flammable | |
| European bacteriological agar | Conda | 1800.00 | www.condalab.com |
| Filter paper | No specific supplier | ||
| Forceps | No specific supplier | ||
| Formalin 4% | No specific supplier | Harmful, acute toxicity, skin sensitisation, carcinogenicity. Flammable | |
| Glass cover slips | No specific supplier | ||
| Glass hermetic container | No specific supplier | ||
| Glutaraldehyde 25% DC 253857.1611 (L) | Dismadel S.L. | 3336 | www.dismadel.com |
| Mycological peptone | Conda | 1922.00 | www.condalab.com |
| needles | No specific supplier | ||
| Petri dishes | No specific supplier | ||
| Plastic containers | No specific supplier | ||
| Sample holder with lid for the critical point dryer | Ted Pella, Inc. | 4591 | www.tedpella.com |
| scalpels | No specific supplier | ||
| Scanning Electron Microscope | Hitachi | S3000N | |
| Software for SEM | |||
| Solution A: NaH2PO4 | |||
| Solution B: Na2HPO4 | |||
| Specimen holders | No specific supplier | ||
| Sputter coater | Balzers | SCD 004 | |
| Stereomicroscope | No specific supplier | ||
| Transmission Electron Microscope (TEM) grids | Electron Microscopy Sciences | G200 (Square Mesh) | www.emsdiassum.com |
| Tweezers | No specific supplier |
참고문헌
- Endress, P. K., Baas, P., Gregory, M. Systematic plant morphology and anatomy: 50 years of progress. Taxon. 49 (3), 401-434 (2000).
- Falk, R. H., Gifford, E. M., Cutter, E. G. Scanning electron microscopy of developing plant organs. Science. 168 (3938), 1471-1474 (1970).
- Damblon, F. Sputtering, a new method of coating pollen grains in scanning electron microscopy. Grana. 15 (3), 137-144 (1975).
- Everhart, T. E., Thornley, R. F. M. Wide-band detector for micro-microampere low-energy electron currents. J. Sci. Instrum. 37 (7), 37246-37248 (1960).
- Collins, S. P., et al. Advantages of environmental scanning electron microscopy in studies of microorganisms. Microsc. Res. Techniq. 25 (5-6), 398-405 (1993).
- Fannes, W., Vanhove, M. P. M., Huyse, T., Paladini, G. A scanning electron microscope technique for studying the sclerites of Cichlidogyrus. Parasitol. Res. 114 (5), 2031-2034 (2015).
- Erbar, C., Leins, P. Portioned pollen release and the syndromes of secondary pollen presentation in the Campanulales-Asterales complex. Flora. 190 (4), 323-338 (1995).
- Jansen, S., Smets, E., Baas, P. Vestures in woody plants: a review. IAWA Journal. 19 (4), 347-382 (1998).
- Bortolin Costa, M. F., et al. Stigma diversity in tropical legumes with considerations on stigma classification. Bot. Rev. 80 (1), 1-29 (2014).
- Almeida, O. J. G., Cota-Sánchez, J. H., Paoli, A. A. S. The systematic significance of floral morphology, nectaries, and nectar concentration in epiphytic cacti of tribes Hylocereeae and Rhipsalideae (Cactaceae). Perspect. Plant Ecol. 15 (5), 255-268 (2013).
- Konarska, A. Comparison of the structure of floral nectaries in two Euonymus L. species (Celastraceae). Protoplasma. 252 (3), 901-910 (2015).
- Giuliani, C., Maleci Bini, L. Insight into the structure and chemistry of glandular trichomes of Labiatae, with emphasis on subfamily Lamioideae. Plant Syst. Evol. 276 (3-4), 199-208 (2008).
- Li, K., Zheng, B., Wang, Y., Zhou, L. L.Breeding system and pollination biology of Paeonia delavayi (Paeoniaceae), an endangered plant in the Southwest of China. Pak. J. Bot. 46 (5), 1631-1642 (2014).
- García, L., Rivero, M., Droppelmann, F. Descripción morfológica y viabilidad del polen de Nothofagus nervosa (Nothofagaceae). Bosque. 36 (3), 487-496 (2015).
- Prenner, G., Klitgaard, B. B. Towards unlocking the deep nodes of Leguminosae: floral development and morphology of the enigmatic Duparquetia orchidacea (Leguminosae, Caesalpinioideae). Am. J. Bot. 95 (11), 1349-1365 (2008).
- Ratnayake, K., Joyce, D. C., Webb, R. I. A convenient sample preparation protocol for scanning electron microscope examination of xylem-occluding bacterial biofilm on cut flowers and foliage. Sci. Hortic-Amsterdam. 140 (1), 12-18 (2012).
- Çolak, G., Celalettin Baykul, M., Gürler, R., Çatak, E., Caner, N. Investigation of the effects of aluminium stress on some macro and micro-nutrient contents of the seedlings of Lycopersicon esculentum Mill. by using scanning electron microscope. Pak. J. Bot. 46 (1), 147-160 (2014).
- Arafa, S. Z. Scanning electron microscope observations on the monogenean parasite Paraquadriacanthus nasalis from the nasal cavities of the freshwater fish Clarias gariepinus in Egypt with a note on some surface features of its microhabitat. Parasitol. Res. 110 (5), 1687-1693 (2012).
- Uppalapatia, S. R., Kerwinb, J. L., Fujitac, Y. Epifluorescence and scanning electron microscopy of host-pathogen interactions between Pythium porphyrae (Peronosporales, Oomycota)and Porphyra yezoensis (Bangiales, Rhodophyta). Bot. Mar. 44 (2), 139-145 (2001).
- Meaney, M., Haughey, S., Brennan, G. P., Fairweather, I. A scanning electron microscope study on the route of entry of clorsulon into the liver fluke, Fasciola hepatica. Parasitol. Res. 95 (2), 117-128 (2005).
- Sundarasekar, J., Sahgal, G., Subramaniam, S. Anti-candida activity by Hymenocallis littoralis extracts for opportunistic oral and genital infection Candida albicans. Bangladesh J. Pharmacol. 7 (3), 211-216 (2012).
- Benhamou, N., Rey, P., Picard, K., Tirilly, Y. Ultrastructural and cytochemical aspects of the interaction between the mycoparasite Pythium oligandrum and soilborne plant pathogens. Phytopathology. 89 (6), 506-517 (1999).
- Singh, A., et al. First evidence of putrescine involvement in mitigating the floral malformation in mangoes: A scanning electron microscope study. Protoplasma. 251 (5), 1255-1261 (2014).
- Xiang, C., et al. Fine mapping of a palea defective 1 (pd1), a locus associated with palea and stamen development in rice. Plant Cell Rep. 34 (12), 2151-2159 (2015).
- Mendoza, L., Hernandez, F., Ajello, L. Life cycle of the human and animal oomycete pathogen Pythium insidiosum. J. Clin. Microbiol. 31 (11), 2967-2973 (1993).
- Bello, M. A., Rudall, P. J., González, F., Fernández, J. L. Floral morphology and development in Aragoa (Plantaginaceae) andrelated members of the order Lamiales. Int. J. Plant Sci. 165 (5), 723-738 (2004).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral morphology and development in Quillajaceae and Surianaceae (Fabales), the species-poor relatives of Leguminosae and Polygalaceae. Ann. Bot. 100 (4), 1491-1505 (2007).
- Bello, M. A., Hawkins, J. A., Rudall, P. J. Floral ontogeny in Polygalaceae and its bearing on the homologies of keeled flowers in Fabales. Int. J. Plant Sci. 171 (5), 482-498 (2010).
- Bello, M. A., Alvarez, I., Torices, R., Fuertes-Aguilar, J. Floral development and evolution of capitulum structure in Anacyclus (Anthemideae, Asteraceae). Ann. Bot. 112 (8), 1597-1612 (2013).
- Bello, M. A., Martínez-Asperilla, A., Fuertes-Aguilar, J. Floral development of Lavatera trimestris and Malva hispanica reveals the nature of the epicalyx in the Malva generic alliance. Bot. J. Linn. Soc. 181 (1), 84-98 (2016).
- Calonge, F. D., Martínez, A. J., Falcó, I., Samper, L. E. Phellorinia herculanea f. stellata f. nova encontrada en España. Bol. Soc. Micol.Madrid. 35 (1), 65-70 (2011).
- Liu, Y., et al. Deciphering microbial landscapes of fish eggs to mitigate emerging diseases. ISME J. 8 (10), 2002-2014 (2014).
- Sandoval-Sierra, J. V., Diéguez-Uribeondo, J. A comprehensive protocol for improving the description of Saprolegniales (Oomycota): two practical examples (Saprolegnia aenigmatica sp. nov. and Saprolegnia racemosa sp. nov.). PLOS one. , (2015).
- Endress, P. K. Zur vergleichenden Entwicklungsmorphologie, Embryologie und Systematik bei Laurales. Bot. Jahrb. Syst. 92 (2), 331-428 (1972).
- Tucker, S. Floral development in Saururus cernuus (Saururaceae):1. Floral initiation and stamen development. Am. J. Bot. 62 (3), 993-1005 (1975).
- Endress, P. K., Matthews, M. L. Progress and problems in the assessment of flower morphology in higher-level systematics. Plant Syst. Evol. 298 (2), 257-276 (2012).
- Beakes, G. W., Glockling, S. L., Sekimoto, S. The evolutionary phylogeny of the oomycete "fungi". Protoplasma. 249 (1), 3-19 (2012).
- Romansic, J. M., et al. Effects of the pathogenic water mold Saprolegnia ferax on survival of amphibian larvae. Dis. Aquat. Organ. 83 (3), 187-193 (2009).
- van West, P. Saprolegnia parasitica, an oomycete pathogen with a fishy appetite: new challengues for an old problem. Mycologist. 20 (3), 99-104 (2006).
- Johansen, D. A. Plant microtechnique. , McGrow-Hill. New York. (1940).
- Unestam, T. Studies on the crayfish plague fungus Aphanomyces astaci. Some factors affecting growth in vitro. Physiol. Plantarum. 18 (2), 483-505 (1965).
- Cerenius, L., Söderhäll, K. Repeated zoospore emergence from isolated spore cysts of Aphanomyces astaci. Exp. Mycol. 8 (4), 370-377 (1984).
- Diéguez-Uribeondo, J., Cerenius, L., Söderhäll, K. Repeated zoospore emergence in Saprolegnia parasitica. Mycol. Res. 98 (7), 810-815 (1994).
- Söderhäll, K., Svensson, E., Unestam, T. Chitinase and protease activities in germinating zoospore cysts of a parasitic fungus, Aphanomyces astaci, Oomycetes. Mycopathologia. 64 (1), 9-11 (1978).
- Echlin, P. Handbook of sample preparation for scanning electron microscopy and X-Ray Microanalysis. , Springer Science + Business Media, LLC. NY. (2009).
- Osumi, M., et al. Preparation for observation of fine structure of biological specimens by high-resolution SEM. Microscopy. 32 (4), 321-330 (1983).
- Rezinciuc, S. The Saprolegniales morpho-molecular puzzle: an insight into markers identifying specific and subspecific levels in main parasites. , Universidad Internacional Menéndez Pelayo. Doctoral Thesis (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유