Method Article
Adenofection: метод изучения роли молекулярных шаперонов в клеточных морфодинамики истощением-спасательных экспериментов
В этой статье
Резюме
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Аннотация
Клеточные процессы, такие как митоза и дифференциации клеток регулируется изменением формы клеток, которые в значительной степени полагаются на соответствующую ремоделирования клеточных структур цитоскелета. Это включает в себя монтаж-демонтаж макромолекулярных структур высшего порядка в данный момент времени и местоположения, процесс, который особенно чувствителен к возмущениям, вызванных избыточной экспрессии белков. Методы, которые могут сохранять белковый гомеостаз и поддерживать почти к нормальной клеточной морфологии весьма желательны для определения функционального вклада интересующего белка в широком диапазоне клеточных процессов. Переходные эксперименты истощения-спасательных работ, основанного на интерференции РНК являются мощными подходы для анализа функций белка и структурных требований. Тем не менее, повторное включение в состав белка-мишени с минимальным отклонением от его физиологического уровня является реальной проблемой. Здесь мы опишем метод называется adenofection, который был разработан, чтобы изучить роль молекулярных шапероновг партнеров в нормальной работе делящихся клеток и отношения с актина ремоделирования. HeLa клетки были истощены BAG3 с миРНК дуплексы ориентации на 3'UTR область. GFP-меченных белков BAG3 вновь были введены одновременно в> 75% клеток с использованием рекомбинантных аденовирусов, соединенных с реагентов трансфекции. позволило Adenofection выразить BAG3-GFP белки на близких физиологических уровнях в клетках HeLa, истощенных BAG3, при отсутствии ответа на стресс. Никакого эффекта не наблюдалось на уровни эндогенных белков теплового шока наставниками, основные стресс-индуцируемых регуляторов белка гомеостаза. Кроме того, путем добавления бакуловирусов вождения экспрессии флуоресцентных маркеров во время клеточной трансдукции трансфекции, мы могли бы рассекать динамику митотических клеток путем покадровой микроскопического анализа с минимальным возмущением нормальной прогрессии митоза. Adenofection применимо также к клеткам труднодоступных Infect мыши, и подходит для функциональных анализов миобластов Differentiation в мышечных трубках. Таким образом, adenofection обеспечивает универсальный метод для выполнения структуры-функции анализа белков, участвующих в чувствительных биологических процессов, которые опираются на динамику цитоскелета высшего порядка.
Введение
Функциональная инактивация экспрессии генов в клетках млекопитающих является золотым стандартом рассекать функции белка. Недавно разработанные технологии редактирования генома , основанные на использовании нуклеаз конкретных участков , таких как нуклеаз цинкового пальца и кластерные регулярно interspaced короткие палиндромные повторы (CRISPR) / cas9 теперь позволяют генерацию клеточных линий с целенаправленным делеции гена и мутации 1,2. Эти новые подходы должны революционизировать способ, которым мы изучаем функцию белка и наше понимание генетики заболеваний человека. В некоторых случаях, однако, долгосрочный или полный нокаут гена не является желательным и может спровоцировать вторичные компенсационные механизмы клеток. Генерирование генетически модифицированных клеточных линий также может быть ограничение при работе с первичными культурами клеток с ограниченной способностью пролиферации, или при скрининге большого множества мутаций в различных типах клеток ищется. Это часто требуется для определения зависимости ячейки Ьiological процесс структурных требований белка. С этой целью, обратимы нокдаун РНК интерференции , который позволяет переходных экспериментов истощения-спасательных работ в различных клеточных фонов по- прежнему остается простой и мощный подход для выполнения структуры-функции анализа интересующего белка 3. Тем не менее, основным недостатком такого подхода является трудность достижения эффективного глушителей и вновь ввести интересующий белок или его вариантов на вблизи физиологических уровней в большинстве клеточной популяции. Это очень важно для того, чтобы комплексные исследования, которые пытаются соотнести функциональные эффекты, наблюдаемые на уровне отдельных клеток (гипоморфными фенотип) с тем, которые наблюдаются в анализах населения на основе клеток, например, на белок-белковых взаимодействий.
Используя классические методы трансфекции, трудно добиться однородной и низкую экспрессию экзогенных белков в большой популяции клеток. Трансдукции клеток с рекомбинантными вирусамикак аденовирусы часто позволяет более нормализованное экспрессии экзогенных белков. Тем не менее, аденовирус поглощение ограничено рецептором CAR, который отсутствует в не-клетках человека или слабо выражены в некоторых типах клеток человека. Кроме того, клеточная запись аденовирусов активирует пути , которые регулируют формы клеток и адгезии 4-6 сигнализации. Это, очевидно, не желательно при изучении механизмов регуляции клеточных морфодинамики. Мы столкнулись с этой проблематикой, когда мы провели функциональный анализ шаперонного комплекса, BAG3-HSPB8, в делении клеток и динамики актина. Новаторская работа была описана роль этого комплекса в шаперонного контроля качества белка и аутофагии во время стресса 7,8. Большинство из этих исследований, однако, полагаться на белок избыточной экспрессии, предполагая, что наставники, как правило, усиливает свою активность во время стресса. Это остается открытым вопрос о том, BAG3, в комплексе с HSPB8, может способствовать нормальному функционированию делящихся клеток, экспрессирующих-еESE наставники , как и многие типы раковых клеток 9. В частности, способствует ли сопровождающий комплекс с перепланировкой актина на основе структур , которые контролируют митоза представляет большой интерес, учитывая возникающие связи между HSPB наставниками и динамики цитоскелета 10. Для решения этой проблемы, мы стремились разработать эффективный метод истощения-спасательных экспериментов, которые не будут мешать митоза или клеточной морфологии, и который позволит сохранить белка гомеостаза чтобы избежать вторичного возмущения динамики макромолекулярных комплексов регулирования изменения клеточного формы , Таким образом, в идеале, истощение-надстройку задней части представляющего интерес гена должны быть выполнены одновременно.
Использование комплексов аденовируса с катионным полимером или липидов было описано для содействия передаче генов в пробирке и в естественных условиях 11,12. Например, фосфат кальция (çapı), как представляется, с образованием осадка саденовирус , которые усиливают вируса связывающего запись через CAR-независимого пути 13. Действительно, мы обнаружили, что объединение на основе аденовирусов трансдукции клеток и трансфекцию с катионными соединениями может повысить эффективность экспериментов истощения-спасательных работ. Это позволило снизить количество вируса от 3- до 20-кратного, в зависимости от клеточной линии и представляющего интерес гена, и извлекают пользу из широкого окна для того, чтобы регулировать экспрессию экзогенных белков на близких эндогенных уровней в большинстве клеточной популяции, представляющей интерес с минимальным воздействием на клеточной морфологии. В таких условиях, мы могли бы также достичь высокой эффективности нокдаун экспрессии эндогенного белка (> 75%). Настоящим описывают шаг за шагом метод и предоставить доказательства того, что белок гомеостаз существенно не возмущенный, оцененной по неизменных уровней индуцированных стрессом шаперонов семейства белков теплового шока, что делает этот метод пригоден для функциональных анализов физиологической роле молекулярных шаперонов путем покадровой видео микроскопии. Протокол поддается процедур синхронизации клеток и с использованием коммерчески доступных бакуловирус для коэкспрессией низких уровней флуоресцентных маркеров, с минимальным вмешательством в нормальных актина основе и шпиндельных динамики во время митоза. Мы также показать универсальность метода, который применим к "трудно трансдукции" С2С12 клетки мыши, без существенного влияния на миобластов дифференцировки в мышечных трубках в пробирке.
протокол
1. Получение средних и растворов (все стерильно фильтруют)
- Клетки мыши мышцы C2C12 (дифференциация исследований)
- Приготовьте 500 мл питательной среды для С2С12 поддержания клеточной культуры: DMEM с высоким содержанием глюкозы с добавлением 10% FBS и 2 мМ L-глутамина.
- Приготовьте 100 мл Дифференциация среда (DM) для С2С12 дифференциации: DMEM с высоким содержанием глюкозы, дополненной 2% лошадиной сыворотки.
- HeLa клетки (исследования в митотических клетках)
- Приготовьте 500 мл αMEM для HeLa ЗП-Н2В технического обслуживания и экспериментов клеточной культуры: αMEM , дополненной 10% FBS и 2 мМ L-глутамина (αMEM 10%).
- Приготовьте 500 мл αMEM-минус (без деоксирибонуклеозидами / рибонуклеозидов) для синхронизации ЗП-Н2В клеток HeLa: αMEM-минус , дополненной 10% FBS и 2 мМ L-глутамина (αMEM-минус 10%).
- Приготовьте 20 мл αMEM без фенолового красного для HeLa-RFP-Н2В лАйв соте: αMEM без фенолового красного с добавлением 10% FBS и 2 мМ L-глутамина.
- Подготовьте 100 мМ тимидина: растворить 24,2 мг в 1 мл H 2 O при 37 ° С с помощью встряхивания. Фильтр стерилизовать и хранить при температуре 4 ° C.
- Общие решения
- Готовят 0,05% трипсин / ЭДТА: 0,05% трипсина, 0,625 мМ ЭДТА в 1X фосфатным буферным раствором (PBS). Фильтр стерилизовать и хранить аликвоты при -20 ° С. После оттаивания держать аликвоты при температуре 4 ° С.
- Приготовьте HBS2x: 280 мМ NaCl, 50 мМ HEPES, 1,5 мМ Na 2 HPO 4. Регулировка рН точно между 7,01-7,05 с помощью 10 N NaOH. Фильтр стерильными и хранить при температуре 4 ° С.
2. Покрытие клеточной культуры пластин с фибронектина и обшивке HeLa-RFP-Н2В клеток
Примечание: Перед началом эксперимента каждый манипулятор должен создать оптимальные условия ячейки обшивки для достижения надлежащей плотности клеток, так как изменения могут Остекущ между каждым манипулятором и каждой другой клеточной линией.
- За день до начала эксперимента, расширить HeLa-RFP-Н2В клетки, чтобы убедиться, что они находятся в экспоненциальной фазе роста в день посева. Сделайте 2 последовательных 1/3 разведений в 10 см пластинах, начиная с 80% сливающийся 1x10 см пластины.
Примечание: Планирование количества пластин для эксперимента. Рассчитать каждое условие как дублирующий, один для краткосрочных живых клеток изображений и один для белковых экстрактов, чтобы определить эффективность нокдауна и экзогенной экспрессии белка методом Вестерн-блот-анализа. План одну дополнительную пластину для определения количества клеток перед вирусной трансдукции. - До клеточной обшивки, пальто со стеклянным дном блюда с 10 мкг / мл фибронектина. Добавить 1 мл 1: 100 разбавлении 1 мг / мл фибронектина (разбавленного в стерильном 1x PBS) на 35 мм чашку , чтобы хорошо покрыть всю поверхность и инкубировать в течение 1 часа при температуре 37 ° С, 5% СО 2.
- Во время инкубации, предварительно теплой αMEM дополнена Wiй 10% FBS (αMEM 10%) и 0,05% трипсин / ЭДТА при 37 ° С.
- Через 45 мин инкубации начинают приготовления раствора клеток. В стерильных капот, аспирация среды от 10 см планшете, полоскание осторожно дважды 1,5 мл 0,05% трипсина / EDTA, и оставить 0,5 мл трипсин / ЭДТА в последнем аспирацией.
- Инкубируйте клетки в течение 2-3 мин при температуре 37 ° С, 5% СО 2. Прижав пластину и наблюдения под микроскопом, убедитесь, что все клетки были отделены. Добавьте 10 мл 10% αMEM и пипеток аккуратно несколько раз , чтобы отделить клетки. Количество образца 10 мкл суспензии клеток с использованием гемоцитометра.
- Отберите раствор фибронектина из стекла дна посуды. Не позволяйте фибронектин высохнуть перед клеточной обшивки.
- Пластина 1.5x10 5 клеток на 35 мм блюдо в 2 мл αMEM 10% и инкубируют при температуре 37 ° С, 5% СО 2. Проверка после 30-45 мин под микроскопом, что клетки хорошо SEPAспроектировано, поскольку они имеют тенденцию к накоплению в центре пластины.
- При необходимости, агитировать пластины аккуратно крест-накрест, чтобы перераспределить клетки. Пластина один 35 мм пластина дополнительно к числу условий для подсчета количества клеток перед вирусной трансдукции.
- растут клетки на следующий день, чтобы достичь плотности клеток, по крайней мере на 50%. Плотность клеток ниже, чем 50% приводит к значительному снижению эффективности вирусной трансдукции, увеличение вариаций экспрессии белка на клетку, и повышенной токсичности клеток.
Примечание: Покрытие стеклянной посуды с фибронектина улучшает клеточный рост и морфологию и способствует правильному прогрессию клеток путем митоза. Как правило, он может быть заменен на коммерчески доступного желатина, который дешевле.
3. аденовирус трансдукции и эндогенного белка Нокдаун от миРНК Трансфекция в HeLa-RFP-Н2В клеток с использованием чапи осаждается
Внимание! РаботаИНГ вирусами требует специальных мер предосторожности и надлежащей утилизации всех материалов, которые были в контакте с вирусом.
Внимание! В наших руках, чапи осаждается часто имеют более нежелательные эффекты, например , на биологических процессах , связанных с торговлей везикул (например, аутофагии). В соответствии с этим рекомендуется использовать катионный липидный реагент трансфекции (смотри ниже) и подождать, по крайней мере, 48 часов до анализа.
Примечание: Контрольный аденовирус , несущий ген , не связанный (т.е. LacZ) , либо оно ген используется для достижения минимального MOI во всех Adenofections (10-20 КОЕ / клетку) , используя наименьшее количество рекомбинантного аденовируса , несущего интересующий ген.
Примечание: Эта процедура, как было показано, чтобы помочь нормализующее экспрессию на клетку в большой популяции клеток.
- Однажды после того, как клетки обшивкой, подсчитывать количество клеток из дополнительных гальванопокрытием блюдо. Аспирируйте среды иполоскать один раз с 1 мл 0,05% трипсина / EDTA. Добавить снова 1 мл 0,05% трипсина / EDTA и инкубировать при 37 ° C, 5% CO 2 , пока все клетки не отсоединена. Отдельные клетки хорошо используя 1мл пипетку и подсчитывают количество клеток на мл с использованием гемоцитометра.
- Определить количество вируса , необходимого для трансдукции клеток при множественности инфекции (MOI) 2 бляшкообразующих единиц (PFU) белка интереса (POI) на клетку и 18 БОЕ на клетку пустого вектора (например, LacZ) иметь в общей сложности 20 БОЕ на клетку. В то же время трансдукции 4 БОЕ каждого бакуловируса (актин и αTubulin, GFP и RFP-меченый соответственно). Трансдукции клеток с использованием следующего протокола adenofection. Вирусы были использованы , как это описано в Fuchs и соавт. 14
- Подготовьте в стерильной капот пластиковой трубки 1,5 мл для каждого условия и добавить 400 мкл теплого αMEM-минус 10%.
- Растаяйте аликвоты вирусов медленно на льду и, при необходимости, разбавить тон вирусный, чтобы пипеткой объемом более 1 мкл, чтобы свести к минимуму ошибки пипетирования.
- Добавить расчетное количество вируса на состоянии каждого 1,5 мл пластиковую пробирку , содержащую 400 мкл αMEM-минус 10% и аккуратно перемешать с помощью пипетки. Поместите вирусный немедленно назад при -80 ° С, чтобы сохранить свою активность.
- Аспирируйте среду из клеток и осторожно пипеткой по каплям смесь вируса. Инкубируйте клетки при 37 ° С в атмосфере 5% СО 2 и тщательно перемешивать пластины под стерильным колпаком каждые 15 мин в течение 1 часа , чтобы хорошо покрыть клетки с вирусом. С помощью небольшого количества среды облегчает контакт вируса с клетками.
- После инкубации, осторожно пипеткой 1,6 мл αMEM-минус 10% к каждой пластине , чтобы получить общий объем 2 мл, начать синхронизацию клеток путем добавления 2 мМ тимидина и инкубировать клетки еще в течение 2 ч при температуре 37 ° С, 5% СО 2 ,
- В то же время, подготовить followi трансфекция микс миРНКнг метод трансфекции Капи (рисунок 1). Если нет миРНК нет необходимости заменить количество миРНК стерильной водой для выполнения пустой трансфекцию.
- Подсчитайте 200 мкл смеси для каждого из условий, что приводит к 400 мкл на дубликате. Следующий пример приведен для конечной концентрации киРНК 50 нМ и должен быть адаптирован для каждого интересующего белка. В пластиковой пробирке 1,5 мл, 50 мкл 1 М CaCl 2 и 11 мкл 20 мкМ миРНК в 139 мкл стерильной H 2 O и перемешать встряхиванием. После быстрого вращения, добавьте осторожно по каплям 200 мкл HBS2x (280 мМ NaCl, 50 мМ HEPES, 1,5 мМ Na 2 HPO 4, рН 7,01-7,05).
Примечание: Чем меньше капель тем меньше осадки, что приводит к лучшей эффективности трансфекции. Аккуратно перемешайте три раза путем инъекции воздуха с использованием 200 мкл-пипетки. - Выдержите смесь в течение 30 мин при комнатной температуре. Медленно добавляйте по каплям 200 мкл трансфекции смеси в каждую чашку иагитировать крест-накрест. Передача пластин при 37 ° С в атмосфере 5% СО 2 в течение 16 часов.
- На следующий день, ополосните клетки дважды 2 мл теплой HEPES (6,7 мМ KCl, 150 мМ NaCl, 10 мМ HEPES, рН 7,3) и добавляют 2 мл αMEM-минус 10%. Не продолжайте с более чем четырех клеточных пластин в то время, так как колебания температуры влияют на продолжительность клеточного цикла.
- Визуализируйте эффективность инфекции под инвертированным флуоресцентным микроскопом при увеличении 20-40x (воздуха) и получить три представительных изображений в состоянии в обоих флуоресцентных и передачи каналов для документации. Семь часов спустя, добавьте 2 мМ тимидина и инкубировать еще в течение 16 ч при 37 ° С, 5% СО 2.
- На следующий день, через 48 часов после того, как миРНК трансфекции и вирусной инфекции, промыть клетки дважды 2 мл теплого фосфатного буферного солевого раствора (PBS) и выпустить в течение 7 ч в 2 мл αMEM 10% вес / O феноловый красный для получения изображений живых клеток или с фенолом Красный для извлечения белка.
- Урожай клетки для каждого условия 48 ч после трансфекции для получения белковых экстрактов и Вестерн - блоттинга , чтобы определить эффективность нокдауна и экспрессию эндогенного белка 15.
Примечание: Используйте антитела против белка, представляющего интерес, а также соответствующих антител, выступающей в качестве контрольной нагрузки. Эффективность нокдаун должна определяться путем загрузки уменьшающиеся количества контроля клеточных лизатов (трансфицировали управления миРНК), чтобы обеспечить кривой титрования (т.е. 1, ½, ¼, ⅛).
4. аденовирусом трансдукция и эндогенного нокдаун белка с помощью миРНК трансфекции в HeLa клеток с использованием катионного липида Реагент для трансфекции
Примечание: Здесь мы приводим протокол, который был адаптирован для экспериментов, которые не связаны с синхронизацией клеток и / или когда миРНК трансфекции не может быть выполнена с помощью метода çapı, например, чтобы избежать нежелательных токсических эффектов в какой-то клетке линэс. Этот протокол также включает в себя этап ячейки replating после adenofection для того, чтобы работать при подходящей плотности клеток. Мы проверили только катионного липидного реагента трансфекции.
Внимание! Работа с вирусами требует специальных мер предосторожности и надлежащей утилизации всех материалов , которые были в контакте с вирусом.
- Пластина 1,75 х 10 5 клеток на 35 мм блюдо в 2,5 мл αMEM 10% и инкубируют при температуре 37 ° С, 5% СО 2. Пластина один 35 мм пластина дополнительно к числу условий для подсчета количества клеток перед вирусной трансдукции.
- растут клетки на следующий день, чтобы достичь плотности клеток, по крайней мере на 50%. Плотность клеток меньше, чем 50% приводит к значительному снижению эффективности вирусной трансдукции, увеличение вариаций экспрессии белка на клетку, и повышенной токсичности клеток.
- Однажды после того, как клетки обшивкой, подсчитывать количество клеток из дополнительных гальванопокрытием блюдо. придыхательныйсреда и прополоскать один раз с 1 мл 0,05% трипсина / EDTA. Добавить снова 1 мл 0,05% трипсина / EDTA и инкубировать при 37 ° C, 5% CO 2 , пока все клетки не отсоединена. Отдельные клетки хорошо с помощью 1 мл пипетки и подсчитывают количество клеток на мл.
- Определить количество вируса , необходимого для трансдукции множественности инфекции (MOI) 20-40 бляшкообразующих единиц (PFU) белка интереса (POI) на клетку и 0-20 БОЕ на клетку пустого вектора (например, LacZ), чтобы иметь в общей сложности 40 БОЕ на клетку.
- Готовят в стерильной капот пластиковой трубки 1,5 мл для каждого условия и добавить 400 мкл теплого αMEM 10%.
- Растаяйте аликвоты вирусов медленно на льду и, при необходимости, разбавить вирусный, чтобы пипетка объемом более 1 мкл, чтобы свести к минимуму ошибки пипетирования.
- Добавить расчетное количество вируса на состоянии каждого 1,5 мл пластиковую пробирку , содержащую 400 мкл αMEM 10% и аккуратно перемешать с помощью пипетки. Место йе вирусный немедленно назад при -80 ° С, чтобы сохранить свою активность.
- Аспирируйте среду из клеток и осторожно пипеткой по каплям смесь вируса. Инкубируйте клетки при 37 ° С в атмосфере 5% СО 2 и тщательно перемешивать пластины под стерильным колпаком каждые 15 мин в течение 1 часа , чтобы хорошо покрыть клетки с вирусом разведения. С помощью небольшого количества среды облегчает контакт вируса с клетками.
- В то же время, подготовить трансфекции смесь миРНК следуя методу трансфекции. Если нет миРНК нет необходимости заменить количество миРНК средой без сыворотки , чтобы выполнить пустую трансфекцию.
- Следующий пример приведен для конечной концентрации киРНК 50 нМ и должен быть адаптирован для каждого интересующего белка. Для каждого adenofection, подготовить один 1,5 мл пластиковую трубку , содержащую 416 нМ миРНК в 150 мкл среды без сыворотки (например, 6,25 мкл 20 мкМ миРНК + 144 мкл среды без сыворотки) и один containi пластиковая трубка 1,5 млнг 6,25 мкл катионного реагента липидная трансфекция + 144 мкл среды без сыворотки.
- Смешайте содержимое каждой пластиковой трубки с помощью пипетки вверх и вниз несколько раз с 200 мкл пипетки. Смешайте содержимое обеих трубок и перемешать с помощью пипетки вверх и вниз несколько раз с 200 мкл пипетки. Выдержите в течение 5 мин при комнатной температуре.
- После инкубации с вирусом, осторожно пипеткой 1,8 мл αMEM 10% к каждой пластине , чтобы получить общий объем 2,2 мл , и сразу же добавляют медленно по каплям смесь для трансфекции миРНК к каждой пластине и перемешивать крест-накрест. Передача пластин при 37 ° С в атмосфере 5% СО 2 в течение 24 часов.
- На следующий день, повторно пластины клеток из каждого 35 - мм пластины в четыре новых 35 - миллиметровых пластин в 2,5 мл αMEM по 10% , и инкубируют в течение еще 24 ч при температуре 37 ° С, 5% СО 2.
- На следующий день, 48 ч после трансфекции миРНК и вирусной инфекции, урожай клеток из одной пластины для каждого условия для подготовкибелковые экстракты и Вестерн - блот - анализ , чтобы определить эффективность нокдауна и экспрессию эндогенного белка 15.
Примечание: С помощью остальных пластин, продолжить фиксации клеток, используя протокол выбора и подвергнуть образцы для анализа иммунофлуоресценции с антителами , представляющих интерес 14.
5. Живая ячейки изображения делящихся клеток и анализа данных
- Выполните краткосрочные эксперименты визуализации живых клеток на митотических клеток с помощью инвертированного микроскопа , оснащенного / Термо регулируемой камере увлажняется / 5% CO 2.
Примечание: В данном исследовании использовался вращающийся диск конфокальной микроскопии (40X, 0,75 NA), снабженный EMCCD охлаждением с зарядовой связью камеру при температуре -50 ° C. - До приобретения, убедитесь, что камера достигла нужной температуры 37 ° C.
Примечание: Это может занять несколько часов в зависимости от микроскопической системы. - Поместите посуду культуры в MICRoscope камера 1 час до приобретения для обеспечения надлежащего равновесия среды и избежать фокуса дрейфует из-за изменений температуры. Монитор митотического состояния клеток. На данный момент, на 10-15% клеток должны быть на ранних стадиях митоза (профазы-прометафазе).
- Во время уравновешивания настроить параметры сбора данных, как определено в предыдущих экспериментах. Как правило, время экспозиции для обоих каналов (488 и 594) от .2-3 сек с интенсивностью лазерного 100% и чувствительностью 121-130 являются подходящими параметрами в наших руках.
Примечание: Первые тесты должны быть сделаны, чтобы определить минимальную интенсивность лазерного излучения и времени измерения / интервал, который приведет к соответствующей резолюции с минимальным фотообесцвечивания, который вызывает повреждения клеток и возмущению митоза. - Выбрать несколько полей на каждое условие, чтобы получить значительное количество клеток для анализа без превышения интервала оцифровки. Используя вращающийся диск конфокальной системы, типичная установка будет вчетыре различных заключить, условия, 7 полей для каждой пластины и 2 цветовых каналов (488 и 594) с интервалом 1,5-2 мин в течение 75 мин периода.
- Выберите ячейки, которые в митотической записи, повторно установить фокус были выбраны сразу все поля и начать приобретение как можно быстрее.
- Монитор стабильности системы, по крайней мере, три момента времени, и повторно установить фокус, если это необходимо.
- После первого кратковременного живой ячейки изображения 75 мин, новые области митотических клеток, могут быть выбраны, чтобы получить второе множество фильмов, чтобы увеличить количество клеток анализируемого.
- Определить четко определенные критерии для анализа митотические фенотипы клеток, которые будут зависеть от флуоресцентных маркеров используются. Дефекты в митоза могут включать в себя длительное время , проведенное в митоза (от ядерного распада до анафазы), хромосомные перекоса, покачиваясь шпинделя и коры блеббинга 14.
6. LifeAct-TagGFP2 аденовирус трансдукции в Differentiatinг C2C12 миобластов мышей
Примечание: Протокол adenofection также применим к труднодоступные Infect миобластов мыши С2С12 подвергаться дифференциации.
- Пластина 2 × 10 5 клеток в C2C12 культуральных чашках 35 мм в ростовой среде на пластике или на подложке из выбора.
Примечание: Дифференциация клеток улучшается на gelatine- или Матригель покрытием блюд. План одну дополнительную пластину для определения количества клеток перед вирусной трансдукции. - На следующий день клетки должны достигли 80% сплошности. Индуцируют миобластов дифференциацию путем промывки клеток дважды с теплым PBS и добавлением 2 мл дифференциации среды (DM).
- На следующий день, помечены как 1-й день (D1) дифференциации, трансдукции миоцитов с аденовирусной LifeAct-TagGFP2 для визуализации актина цитоскелета в живых клетках. Подсчитайте количество клеток с дополнительной пластины, как описано в разделе 3.2. Рассчитать 5 БОЕ / клетку LifeAct-TagGFP2 аденовируса и / клеток AdLacZ 45 PFU следующий экзаменаPLE описаны в таблице 1. Общее количество вируса составляет 50 КОЕ / клетку. Вирусы были использованы , как описано 14
- Готовят в стерильной капот пластиковой трубки 1,5 мл для каждого условия и добавить 400 мкл теплого DM.
- Растаяйте аликвоты вирусов медленно на льду и, при необходимости, разбавить вирусный, чтобы пипетка объемом более 1 мкл, чтобы свести к минимуму ошибки пипетирования.
- Добавьте соответствующее количество вирусных частиц на состоянии каждого 1,5 мл пластиковую пробирку, содержащую 400 мкл DM и осторожно перемешать с помощью пипетки. Поместите вирусный немедленно назад при -80 ° С, чтобы сохранить свою активность.
- Аспирируйте среду из блюд и осторожно пипеткой по каплям смесь вируса. Инкубируйте клетки при 37 ° С в атмосфере 5% СО 2 и тщательно перемешивать пластины под стерильным колпаком каждые 15 мин в течение в общей сложности 1 ч , чтобы хорошо покрыть клетки с вирусом.
- После инкубации, осторожно пипеткой 1,6 мл DM на каждую тарелку и продолжить Incubation еще в течение 2 ч при температуре 37 ° С, 5% СО 2.
- В то же время, подготовить пустой трансфекции смесь следующего метода трансфекции чапи. Вычислить 200 мкл смеси для каждого условия. Используйте следующий пример для общего объема 400 мкл смеси.
- В пластиковой пробирке 1,5 мл, 50 мкл 1 М CaCl 2 в 150 мкл стерильной H 2 O и перемешать встряхиванием. После быстрого вращения, добавьте осторожно по каплям 200 мкл HBS2x (280 мМ NaCl, 50 мМ HEPES, 1,5 мМ Na 2 HPO 4, рН 7,01-7,05). Осторожно перемешать с помощью нагнетания воздуха в три раза с помощью 200 мкл пипетки.
- Выдержите смесь в течение 30 мин при комнатной температуре. Добавить медленно по каплям 200 мкл трансфекции смеси в каждую тарелку и агитировать крест-накрест. Передача пластин при 37 ° С в атмосфере 5% СО 2 в течение 16 часов.
- На следующий день промыть клетки дважды с 2 мл теплой HEPES (6,7 мМ KCl, 150 мМ NaCl, 10 мМ HEPES, рН 7,3) и добавьте 2 мл DM. Визуализируйте инфеЭффективность фикция под инвертированным флуоресцентным микроскопом при увеличении 20-40X (воздуха) и получить три представительных изображений в состоянии в обоих флуоресцентных и передачи каналов для документации.
- В зависимости от желаемой настройки эксперимента, следовать дифференцировки в мышечные трубки в течение нескольких дней. Клетки могут быть зафиксированы и впоследствии подвергнуты анализу иммунофлуоресценции или исследований живых изображений клеток может быть выполнена.
Результаты
Трансфекция плазмидной ДНК BAG3-GFP с использованием катионных липидов было связано с гетерогенной экспрессии в клетках HeLa, некоторые клетки , показывающие едва детектируемые уровни белка и других несущих очень высокие уровни BAG3 (фиг.2А). В этих клетках, потеря белка гомеостаза свидетельствовало накопление BAG3-GFP в околоядерных агрегатов (рис 2А, стрелки). В отличие от клеток трансдукция с аденовирусов , несущих BAG3-GFP выставлены более однородную низкую экспрессию и точную локализацию BAG3-GFP (рис 2B, одна инфекция). Примечательно, что добавление катионных липидов в течение аденовирусной трансдукции (т.е., трансфекция частиц аденовируса) значительно увеличивает экспрессию BAG3-GFP на клетку при подобном MOI, в то время как оно позволило сохранить гомогенное выражение в большинстве клеток (Фигура 2В, Adenofection).
Adenofection позволили эффективно истощение эндогенных BAG3 и реинтродукции BAG3-GFP белков на близких эндогенных уровней, используя ли чапи выпадает в осадок или на основе липосом соединений с целью повышения эффективности трансдукции трансфекции в клетках HeLa. На рисунке 3 показан типичный эксперимент с диким типом BAG3 (WT) -GFP или BAG3 (ИПВ) -GFP вариант несущих мутации , которые отменяют связывание с одним из ее партнеры шаперонов HSPB8 (Фигура 3А, 3В). В соответствии с ролью BAG3 в стабилизации HSPB8 7, глушение BAG3 привело к снижению уровней HSPB8, которая была восстановлена до нормального уровня при реинтродукции BAG3 WT на ~ 50%, но не выражением аналогичных уровней мутанта из BAG3 (ИПВ) -GFP или GFP в одиночку. В этих условиях, BAG3-GFP белки были соответствующим образом локализованы в пределах ~ 75-90% клеток, обогащается на перинуклеарном-центросомной областей (рис 3С, 3D). Это suggЗаинтересованное что adenofection сохранил динамику BAG3 и на BAG3-HSPB8 комплекса в клетках.
HSPB8 и BAG3 позитивно регулируются различными Протеотоксический напряжений , которые также возмущают цитоскелета proteostasis 10. Поэтому сверхэкспрессия хаперонов потенциально может нарушить монтаж-демонтаж макромолекулярных структур, контролирующих клеточные морфодинамики. Для того чтобы оценить роль BAG3-HSPB8 при нерастягивающих затруднительных условиях, важно, чтобы убедиться, что белок гомеостаз минимально возмущенные процедурой adenofection. С этой целью мониторинга изменений в уровнях шаперонов семейства белков теплового шока является хорошим показателем состояния белкового гомеостаза. Как показано на рисунке 4, adenofection по чапи или липосом на основе методов существенно не увеличивают уровни эндогенных HSPB8 и BAG3, или что из основной системы шаперонного HSP70 / HSPA1. В противоположность этому, типичныйПротеотоксический лечения, как теплового шока или MG132, ингибитор протеасом, повышение уровней шаперонная-cochaperone белков в клетках HeLa.
Затем мы пытались определить, является ли процедура adenofection в сочетании с бакуловирус стимулировать экспрессию актина и тубулина флуоресцентных зондов (BacMam-ЗП-актина и GFP-αtubulin) подходит для отслеживания динамики митотических клеток. Как показано на рисунке 5, adenofection из HeLa клеток с контролем миРНК (siCTL) не нарушало динамику веретена (зеленый) или среднее время , проведенное в митоза (рис 5A, представитель конфокальной покадровой последовательности). Доля этих клеток с ненормальных митотических событий было в соответствии с уровнями митотических дефектов , как правило , наблюдаемых в линиях раковых клеток (~ 30% -40%, рис 5B). В противоположность этому, клетки adenofected с одним только BAG3 специфических миРНК (siBAG3) выставлены ~ 2-кратное увеличение Leveл митотических фенотипических дефектов, восстанавливалось до уровня в контрольных клетках BAG3-GFP (WT), но не в одиночку GFP. Это подтверждено пригодность adenofection для функционального анализа влияния BAG3 и связанных с наставниками на цитоскелета динамики , которые регулируют правильное развитие клеток в и из митоза, как показано Фукса и др 14.
Чтобы проверить универсальность метода adenofection, мы затем адаптируют протокол , чтобы включить визуализацию F-актина при дифференциации мыши С2С12 миоцитов, используя имеющийся в продаже аденовируса-LifeAct-GFP для обозначения F-актина 16. Клетки C2C12 были дифференцироваться за один день до Adenofection. Использование çapı на основе протокола adenofection, удивительно низкие количества аденовируса LifeAct-GFP было достаточно, чтобы выразить зонд на уровне, который был легко обнаружен с помощью флуоресцентной микроскопии в значительной части differe ntiating миоциты (~ 3-5 КОЕ / клетку; Рисунок 6). Это резко контрастирует с чрезвычайно высокой множественности инфекции , зарегистрированных в литературе для трансдукции клеток мыши С2С12 (в порядке 250-400 МВД) 17-19. Кроме того, путем мониторинга процесса дифференцировки в течение 7 дней, мы установили, что образование myotube существенно не нарушена процедурой. Это позволило предположить , что миоцит фьюжн, процесс , который опирается на тонко отлаженных динамики актина 20, не возмущается выражением низких уровней LifeAct-GFP (рисунок 6, 6 -й день и 7 -й день). Так как флуоресцентный маркер все еще можно обнаружить через несколько дней после того, как adenofection клеток С2С12, мы считаем, что этот метод будет пригоден для функционального анализа влияния наставниками на динамику актина на разных этапах С2С12 миогенезе.

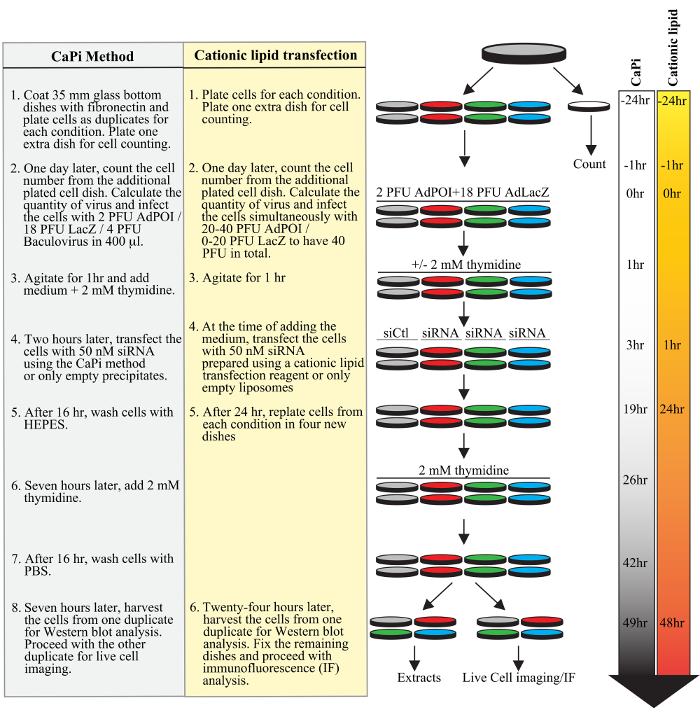
Рисунок 1. Планирование типичного протокола adenofection. Последовательные этапы типичного эксперимента показаны для протокола с использованием чапи преципитаты (подчеркнуты серым цветом) или протокола с использованием катионного липида трансфекции реагента (выделено желтым цветом), в том числе клеток обшивкой, трансдукции адено- и бакуловирусы, трансфекцию киРНК-дуплексов, и синхронизации ячейки с блоком двойной тимидина. Временные линии часов для обоих протоколов показаны на правой стороне фигуры.fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.
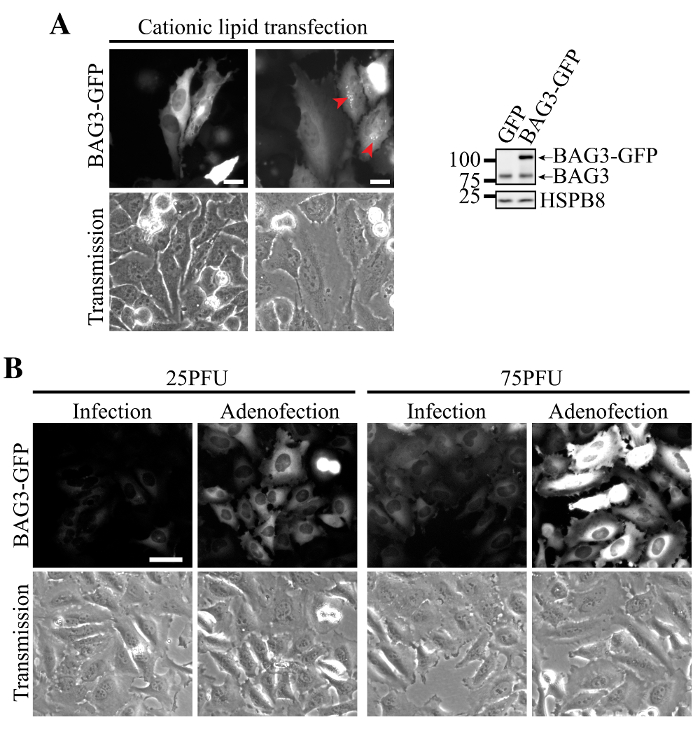
Рисунок 2. Однородная и эффективное выражение BAG3-GFP с использованием Adenofection. (A) Представитель эпифлуоресцентной изображения клеток HeLa которые были трансфицированы BAG3-GFP, плазмидной ДНК, показывая перинуклеарные агрегаты белка при высоких уровней экспрессии (обозначенных стрелками) и гетерогенный выражение в популяции клеток. Вестерн-блоты показывают более высокую экспрессию BAG3-GFP относительно эндогенных уровней BAG3 в общей популяции клеток, что свидетельствует о том, что белок в значительной степени избыточно экспрессируется в некоторых клетках. (Б) Представитель эпифлуоресцентной изображения клеток HeLa , которые были трансдуцированных или только adenofected с использованием возрастающих количеств вирусных частиц Ad-BAG3-GFP. Изображенийбыли приобретены с использованием идентичных параметров и были одинаково обработаны для вычитания фона и интенсивности; Бар:. 50 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 3. Эффективное нокдаун BAG3 и реинтродукции BAG3-GFP белков на близких эндогенных уровней. (AB) HeLa клетки , экспрессирующие RFP-H2B (А) или родительских клеток HeLa (В) adenofected с указанными киРНК и рекомбинантных аденовирусов с использованием çapı способ (А) , или на основе липосом соединения в качестве реагента для трансфекции (B). Клетки были синхронизированы с помощью метода двойного тимидина блока и общее количество экстракты клеток получали во время второго этапа выпуска. Weste р-н блоты показывают уровни BAG3 истощение (BAG3 эндогенные), уровни adenofected BAG3-GFP белков и эндогенные уровни HSPB8; Уровни GAPDH: контроль нагрузки. Истощение оценивался в> 75% при загрузке уменьшающиеся количества экстрактов управления (adenofected с контролем миРНК-siCtl и BAG3-GFP WT, т.е., ½, ¼). Обратите внимание, что отдельные белки BAG3-GFP были введены в вблизи эндогенного уровня BAG3 и дикого типа BAG3-GFP, но не BAG3 (ИПВ) -GFP или GFP один, восстановлены уровни HSPB8 в BAG3 обедненного клетки. (CD) Представитель эпифлуоресцентной изображения клеток HeLa , которые были adenofected с указанным рекомбинантным Ad-BAG3-GFP с использованием чапи или катионный реагент липидов трансфекции. Бары: 20 мкм. Типичные результаты , показанные в (А) и (С) модифицируются от Фукса и др., PLoS Жене. 23 октября 2015; 11 (10): e1005582, DOI: 10.1371 / journal.pgen.1005582 14.Iles / ftp_upload / 54557 / 54557fig3large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 4. Adenofection не индуцирует реакцию на стресс в клетках HeLa Вестерн - блоттинга от общего количества клеточных экстрактов , полученных из управления HeLa клеток. (NT: не подвергнутые дальнейшей обработке) или клетки HeLa , трансфицированные только контрольной миРНК (siCtl, нет аденовирус), или adenofected с siCtl и Ad-GFP с использованием либо чапи или катионный реагент трансфекции липидов, или из клеток HeLa, представленных типичных Протеотоксический лечения (HS: теплового шока на 44 ° С в течение 60 мин, после чего 16 восстановления ч при 37 ° С; MG132: ингибитор протеасом, 5 мкМ в течение 16 часов), показывающий уровни BAG3, HSPB8 и других стресс-индуцируемых наставниками, а именно HSP70 / HSPA / и Hsp27 / HSPB1; GAPDH: загрузка контроль. Следует отметить, что в то время как уровни всех прокроме GAPDH белки были увеличены на Протеотоксический лечения стресса, они остались неизменными по adenofection. Колебания уровня белка оценивали путем загрузки различных количеств экстрактов HS клеток , которые несут типичные увеличение HSPs. (HS: 1, ½, ¼, ⅛, например, HSP70 индуцируется более чем в 8 раз в ответ на Протеотоксический стресс) Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
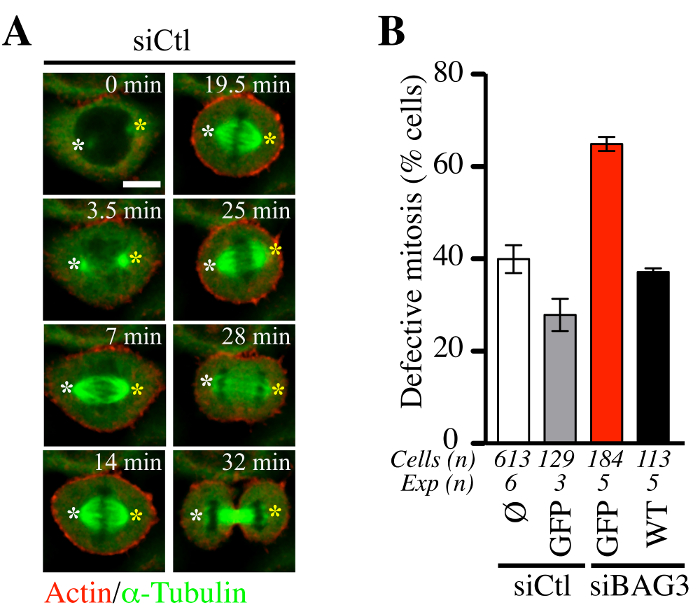
Рисунок 5. Прогрессирование HeLa клеток посредством митоза существенно не возмущается Adenofection. (А) Представитель конфокальной время покадровой последовательности из клеток HeLa , которые были adenofected с контрольной миРНК (siCtl) вместе с BacMam- GFP-альфа-тубулина и BacMam -RFP-актин и изображается на вращающийся диск конфокальной microscoPY в течение от 60 до 90 мин при ~ 1,5 минутными интервалами. Белые и желтые звездочки обозначают положение шпинделя полюсов, которые оставались относительно стабильными. Бар: 10 мкм. (В) Количественное клеток adenofected с siCtl или BAG3 конкретных миРНК, с или без указанных белков GFP (только GFP или дикого типа BAG3-GFP: WT). График показывает процентное содержание клеток с аномальным митоза определяется как покачивание шпинделя и застопорился в митозе +/- или хромосомной перекоса. Показаны средства +/- SE. Типичные результаты , показанные в (B) , были взяты из Fuchs и др., PLoS Жене. 23 октября 2015; 11 (10): e1005582, DOI: 10.1371 / journal.pgen.1005582 14. Пожалуйста , нажмите здесь , чтобы посмотреть большую версию этой цифры. Пожалуйста , нажмите сюда , чтобы посмотреть фильм , связанный с панелью (A).

Рисунок 6. Adenofection из С2С12 миоцитов с Ad-LifeAct-GFP и формирования myotube. Представительные эпифлуоресцентной изображения клеток С2С12 , которые были дифференцироваться и обработаны для adenofection 1 день позже , используя 5 БОЕ / клетку LifeAct-GFP и 45 КОЕ / клетку из LacZ. Изображения показывают экспрессию GFP маркера во время дифференциации процесса (День 2, 6-й день и 7-й день). Бары:. 20 мкм Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Здесь мы описали метод, позволяющий обеднение-спасательные эксперименты должны быть выполнены, который применим к функционального анализа клеточных биологических процессов, которые особенно чувствительны к избыточной экспрессии белков, влияющих на стехиометрии и динамику белковых комплексов и макромолекулярных структур. Митотическое деление клеток является крайним примером тонко отлаженных клеток морфодинамики, что включает в себя самые драматические и захватывающие изменения в общей структуре клетки. Использование adenofection в сочетании с коммерчески доступных реагентов BacMam ввести низкие, но обнаруживаемые количества актина и тубулина маркеров для визуализации клеток, вклад шаперонного комплекса BAG3-HSPB8 к надлежащему ремоделирования митотических клеток может быть четко продемонстрировано. В недавнем исследовании Фукса и др., Мы показали , что истощение BAG3 вызывает дефекты в ориентации шпинделя, которые связаны с невозможностью установить жесткую митотический актина коры головного мозга и собрать актин богатыхретракции волокна 14. Динамика Надлежащие шпинделя может быть восстановлена путем реинтродукции дикого типа BAG3-GFP, который также скорректированной снижение уровней видели в HSPB8 при BAG3 глушителей. Это означает, что adenofection делает возможным восстановление физиологически соответствующего шаперонного комплекса, который коррелирует с восстановлением функциональной динамики шпинделя.
Использование adenofection для обеднения-спасательных экспериментов дает преимущество над плазмиды трансфекции ДНК или nucleofection, что может привести к мощной индукции ответа на стресс в некоторых типах клеток (т.е. аутофагией) 21, что делает практически невозможным для анализа влияния отдельных учитывая шаперонная и его физиологическая роль. Действительно, в нашей руке, трансфекция BAG3 плазмидной ДНК связана с более высокой экспрессии в клетке, образование агрегатов, а также воздействие на апоптоза клеток / выживания в нескольких типах клеток (рисунок 2). BAG3 представляет собой модульную cochaperone с подмостей деятельности, которая мау играют несколько ролей в зависимости от своих партнеров белков 9. Следовательно, возмущения комплексной стехиометрии при избыточной экспрессии BAG3 может иметь нежелательные доминирующие негативные последствия и вызвать токсичность. Высокая производительность рекомбинантный аденовирус является идеальным средством для переходных и безопасности доставки крупных генов в обоих деления и не делящихся клеток в культуре, поскольку она не интегрируется в хост-геном клетки, в отличие от Лентивирус на основе векторов, для которых некоторые безопасности проблемы все еще остаются. Потенциальный недостаток использования аденовирусов для обеднения-спасательных экспериментов является то, что они требуют многократных повторений препарат, который может быть отнимающим много времени. Они также полагаются на тщательное титрование инфекционных частиц для воспроизводимой трансдукции эффективности.
Использование adenofection для скрининга вклад известных BAG3 функциональных областей, мы получили первые доказательства того, насколько нам известно, для существования HSPB8-зависимой функции BAG3 в нормальном режимеделящихся клеток, которые не требуют его взаимодействия с системой шаперона HSP70 / HSPA1. Adenofection должен быть применим для отслеживания F-актина в процессе дифференцировки кардиомиоцитов в мышечных трубках, как это было предложено данными, представленными здесь. Таким образом, наш метод обеспечивает универсальный и эффективный протокол для миРНК основе экспериментов истощения-спасательных с минимальным воздействием на клеточные морфодинамики, которые должны быть полезны в широком спектре проектов, где структура-функция анализа интересующего гена преследуется.
Эксплуатируя катионных соединений-липидов с целью достижения эффективной трансфекции-трансдукции клеток с наименьшим количеством вирусных частиц является ключом к этому методу. В то время как он обеспечивает большее окно для контроля уровня экзогенных белков в клетки, мы считаем, что она дополнительно позволяет свести к минимуму возможные побочные эффекты на пути передачи сигналов, которые являются результатом аденовирус связывание клеток-запись, которая должна смягчить воздействие арrotein процентов по морфогенетических путей.
Следует отметить, что различные реагенты для увеличения эффективности трансдукции аденовируса, являются коммерчески доступными, такие как бустер рецептора АВТОМОБИЛЯ. Такие реагенты являются дорогостоящими, однако, и, как ожидается, способствовать вируса связывания вхождения в клетки таким образом, что требует рецептор CAR, который, как указано выше, было показано, чтобы активировать пути, связанные с формой клеточной адгезии и сигнализации. В то время как чапи дешевле, чем катионных липосом в качестве средства потенцировать запись аденовируса через CAR-независимого пути, он также более токсичен для некоторых клеточных линий. Мы рекомендуем предварительное тестирование пустого adenofection сориентировать выбор между чапи против реагента катионного липида, в зависимости от клеточной линии, используемой и биологической считывания интерес.
Вместе с новыми биотехнологическими инструментами редактирования генома, РНК-интерференция на основе нокдаун-спасательные подходы, такие как описанный здесь предлагают арлуч мощных молекулярных инструментов , чтобы раскрыть функцию гена в клетках, которые теперь могут быть оптимально выбраны исследователями в зависимости от конкретных применений 3. Мы считаем, что adenofection обеспечивает относительно быструю и простую систему для создания гипоморфными нокдаунов для структуры-функции анализа вклада интересующего белка в нескольких клеточных слоев.
Раскрытие информации
The authors have nothing to disclose.
Благодарности
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Материалы
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
Ссылки
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462 (2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889 (2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141 (2011).
- Guilbert, S. M., Tanguay, R. M., Hightower, L. E., et al. . The Big Book of Small Heat Shock Proteins. , 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582 (2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294 (2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2 (2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены