Method Article
Adenofection: eine Methode zur Untersuchung der Rolle von molekularen Chaperonen in Cellular Morphodynamik von Depletion-Rettungs-Experimente
In diesem Artikel
Zusammenfassung
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Zusammenfassung
Zelluläre Prozesse, wie beispielsweise die Mitose und Zelldifferenzierung werden durch Änderungen in der Zellform bestimmt, die auf die richtige Remodellierung der Zell Zytoskelettstrukturen weitgehend verlassen. Dabei wird die Montage-Demontage von höherer Ordnung makromolekulare Strukturen zu einem bestimmten Zeitpunkt und Ort, ein Vorgang, der besonders empfindlich gegenüber Störungen durch die Überexpression von Proteinen verursacht wird. Methoden, die Protein-Homöostase und aufrechtzuerhalten in der Nähe zu normalen Zellmorphologie sind höchst wünschenswert, um zu bestimmen die funktionelle Beitrag eines Proteins von Interesse in einer Vielzahl von zellulären Prozessen erhalten kann. Transient Verarmungsrettungsversuche auf Basis von RNA-Interferenz sind leistungsfähige Ansätze Proteinfunktionen und strukturellen Anforderungen zu analysieren. Allerdings Wiedereinführung des Zielproteins mit minimalen Abweichung von seiner physiologischen Ebene ist eine echte Herausforderung. Hier beschreiben wir eine Methode genannt adenofection das entwickelt wurde, um die Rolle von molekularen Chaperonen zu studieren eind Partner in dem normalen Betrieb von sich teilenden Zellen und die Beziehung mit Aktin-Umbildung. HeLa-Zellen wurden von BAG3 verarmt mit siRNA-Duplexe die 3'UTR Region abzielt. unter Verwendung von rekombinanten Adenoviren gekoppelt Transfektionsreagenzien GFP-markierten BAG3 Proteine wurden gleichzeitig in> 75% der Zellen wieder eingeführt. Adenofection aktiviert BAG3-GFP-Proteine bei nahezu physiologischen Konzentrationen in HeLa-Zellen verarmt BAG3, in Abwesenheit eines Stressreaktion auszudrücken. Es wurde keine Wirkung auf den Ebenen der endogenen Heat Shock Protein Chaperone beobachtet, den Stress-induzierbaren Regulatoren der Protein-Homöostase. Weiterhin kann durch Baculoviren Antreiben der Expression von fluoreszierenden Markern zum Zeitpunkt der Zell Transduktion-Transfektion Zugabe konnten wir mitotischen Zelldynamik durch Zeitraffer mikroskopische Analysen sezieren mit minimaler Störung der normalen mitotischen Progression. Adenofection ist auch auf schwer zu Infect Mauszellen, und geeignet für die funktionelle Analyse von Myoblasten differenzierung in Myotuben. So bietet adenofection eine vielseitige Methode Struktur-Funktion in sensiblen biologischen Prozessen beteiligten Proteine Analysen durchzuführen, die auf höherer Ordnung Dynamik des Zytoskeletts verlassen.
Einleitung
Funktionelle Inaktivierung der Genexpression in Säugerzellen ist der Goldstandard Proteinfunktionen zu sezieren. Neu entwickelte Technologien der Genom Bearbeitung 1,2 kurz über die Verwendung von ortsspezifischen Nukleasen wie Zink-Finger - Nukleasen und gruppierten regelmäßig voneinander beabstandete Palindrom Wiederholungen (CRISPR) / CAS9 erlauben nun die Generierung von Zelllinien mit gezielten Gen - Deletion und Mutation basiert. Diese neuen Ansätze sollten revolutionieren die Art, wie wir die Proteinfunktion und unser Verständnis der Genetik von Krankheiten beim Menschen studieren. In einigen Fällen ist nicht wünschenswert, langfristige oder vollständige Gen-Knockout jedoch und kann Sekundärzelle Kompensationsmechanismen hervorrufen. Die Erzeugung von gentechnisch veränderten Zelllinien können auch Begrenzungs sein, wenn sie mit primären Zellkulturen mit begrenzter Proliferationskapazität handelt, oder wenn Screening einer großen Gruppe von Mutationen in verschiedenen Zelltypen gesucht wird. Dies wird oft zur Bestimmung der Abhängigkeit einer Zelle b erforderlicheiologische Prozess auf strukturellen Anforderungen eines Proteins. Zu diesem Zweck reversible Knockdown durch RNA - Interferenz , die noch transiente Depletion-Rettungsversuchen in verschiedenen zellulären Hintergründen ermöglicht weiterhin eine einfache und leistungsstarke Ansatz zur Durchführung Struktur-Funktion eines Proteins von Interesse 3 analysiert. Allerdings ist ein großer Nachteil bei diesem Ansatz die Schwierigkeit, effiziente Silencing zu erreichen, und das Protein von Interesse oder seine Varianten in der Nähe von physiologischen Konzentrationen in einer Mehrheit der Zellpopulation wieder einführen. Dies ist entscheidend, umfassende Studien zu ermöglichen, die funktionelle Effekte auf der Ebene einzelner Zellen (hypomorphen Phänotyp) mit denen in populationsbasierten Zellassays gesehen zu korrelieren versuchen, zum Beispiel auf Protein-Protein-Wechselwirkungen.
Mit klassischen Transfektionsverfahren, kann man kaum erreichen homogene und niedrige Expression von exogenen Proteinen in einer großen Population von Zellen. Transduktion von Zellen mit rekombinanten Virenwie Adenoviren können oft mehr normalisierte Expression von exogenen Proteinen. Doch Adenovirus Aufnahme wird durch den CAR-Rezeptor begrenzt, die in nicht-menschlichen Zellen fehlt oder nur schwach in einigen menschlichen Zelltypen exprimiert. Darüber hinaus aktiviert die Zelleintritt von Adenoviren Signalwege , die Zellform und Haftung 4-6 regulieren. Dies ist natürlich nicht wünschenswert, wenn regulatorische Mechanismen der Zell Morphodynamik studieren. Wir waren mit Blick auf diese Problematik, wenn wir funktionelle Analysen eines Chaperon-Komplex unternahm, BAG3-HSPB8, bei der Zellteilung und Aktindynamik. Pionierarbeit hatte eine Rolle für dieses Chaperon - Komplex in der Proteinqualitätskontrolle und Autophagie bei Stress 7,8 beschrieben. Die meisten dieser Studien stützte sich jedoch auf die Proteinexpression unter der Annahme, dass die Chaperone normalerweise während Stress aufreguliert werden. Dies hat die Frage offen gelassen, ob BAG3, im Komplex mit HSPB8 kann zum normalen Betrieb von sich teilenden Zellen beitragen th exprimierendenese Chaperone wie 9 viele Krebszelltypen. Insbesondere ob trägt das Chaperon - Komplex auf den Umbau des Aktin-basierten Strukturen , die mitotischen Progression von großem Interesse war kontrollieren, 10 die Schwellen Verbindungen zwischen HspB Chaperone und Zytoskelett Dynamik gegeben. Um dieses Problem zu beheben, suchten wir ein effizientes Verfahren zur Depletion-Rettungsversuche zu entwickeln, die nicht mit mitotischen Progression oder zelluläre Morphologie stören würde, und das würde Proteinhomöostase erhalten zur sekundären Störung der Dynamik makromolekularer Komplexe Regelzellformänderungen vermeiden . So ideal, Depletion-Add-Rückseite des Gens von Interesse sollte gleichzeitig ausgeführt werden.
Die Verwendung von Komplexen von Adenovirus mit einem kationischen Polymer oder Lipiden beschrieben wurde Gentransfer in vitro zu fördern , und in vivo 11,12. Beispielsweise Calciumphosphat (CaPi) erscheint, um einen Niederschlag zu bilden, mitAdenovirus , die Virusbindung-Eingabe über eine CAR-unabhängigen Weg 13 zu verbessern. Tatsächlich fanden wir, dass Adenovirus-basierten Kombination Zell Transduktion und Transfektion mit kationischen Verbindungen könnte die Effizienz der Verarmungsrettungsexperimente verbessern. Dies ermöglichte es uns, die Mengen an Virus durch 3- bis 20-fach niedriger, abhängig von der Zelllinie und dem Gen von Interesse, und profitieren von einem breiteren Fenster, um die Expression von exogenen Proteinen in der Nähe von endogenen Konzentrationen in den meisten einzustellen einer Zellpopulation von Interesse mit minimalen Auswirkungen auf die Zellmorphologie. Unter diesen Bedingungen konnten wir auch hohe Effizienz Knockdown endogener Proteinexpression (> 75%) erzielen. Wir beschreiben hiermit das Verfahren Schritt für Schritt und belegen , dass Proteinhomöostase nicht signifikant , wie durch den unveränderten Stress-induzierten Chaperone des Hitzeschockproteinfamilie beurteilt gestört wird, wodurch das Verfahren geeignet für die funktionelle Analyse des physiologischen role von molekularen Chaperonen durch Zeitraffervideomikroskopie. Das Protokoll ist zugänglich Zellensynchronisationsverfahren und die Verwendung von handelsüblichen Baculoviren für die Coexpression von geringen Mengen an Fluoreszenzmarkern, mit minimaler Beeinträchtigung der normalen Aktin-basierten und Spindeldynamik während der mitotischen Progression. Wir zeigen die Vielseitigkeit des Verfahrens, die anwendbar ist , Maus C2C12 - Zellen "schwer zu transduzieren", ohne erhebliche Auswirkungen auf die Myoblastendifferenzierung in Myotuben in vitro.
Protokoll
1. Herstellung von Medium und Lösungen (alle steril filtriert)
- C2C12 Maus Muskelzellen (Differenzierung Studien)
- Bereiten Sie 500 ml Wachstumsmedium für C2C12 Zellkulturpflege: DMEM Hohe Glucose, ergänzt mit 10% FBS und 2 mM L-Glutamin.
- Bereiten Sie 100 ml Differenzierungsmedium (DM) für C2C12 Differenzierung: DMEM mit hohem Glucose ergänzt mit 2% Pferdeserum.
- HeLa - Zellen (Studien in mitotischen Zellen)
- Bereiten 500 ml & agr; MEM für HeLa RFP-H2B Zellkulturerhaltungs und Experimente: & agr; MEM mit 10% FBS ergänzt und 2 mM L-Glutamin (& agr; MEM 10%).
- Bereiten Sie 500 ml & agr; MEM-Minus (ohne Desoxyribonukleoside / Ribonukleosiden) für HeLa - RFP-H2B Zellsynchronisation: & agr; MEM-Minus mit 10% FBS und 2 mM L-Glutamin (& agr; MEM-minus 10%).
- Es werden 20 ml & agr; MEM ohne Phenolrot für HeLa-RFP-H2B live Zelle Erwerb: & agr; MEM ohne Phenolrot mit 10% FBS und 2 mM L-Glutamin ergänzt.
- Herstellung von 100 mM Thymidin: Man löst 24,2 mg in 1 ml H 2 O bei 37 ° C durch Vortexen. Filter sterilisieren und halten bei 4 ° C.
- Gemeinsame Lösungen
- Bereiten 0,05% Trypsin / EDTA: 0,05% Trypsin, 0,625 mM EDTA in 1x phosphatgepufferter Kochsalzlösung (PBS). Filter zu sterilisieren und zu speichern Aliquots bei -20 ° C. Nach dem Auftauen halten aliquoten bei 4 ° C.
- Bereiten HBS2x: 280 mM NaCl, 50 mM HEPES, 1,5 mM Na 2 HPO 4. Der pH-Wert genau zwischen 7,01-7,05 mit 10 N NaOH. Filter steril und halten bei 4 ° C.
2. Beschichtung von Zellkulturplatten mit Fibronektin und Plating von HeLa-RFP-H2B Zellen
HINWEIS: Vor dem Experiment jeder Manipulator sollte die optimale Zellbeschichtungsbedingungen geschaffen, um eine angemessene Dichte der Zellen zu erreichen, da Variationen oc kanncur zwischen jedem Manipulator und jeder unterschiedlichen Zelllinie.
- Am Tag vor dem Experiment, erweitern HeLa-RFP-H2B Zellen sicher zu stellen, dass sie in der exponentiellen Wachstumsphase am Tag der Plattierung sind. Machen Sie zwei aufeinanderfolgende 1/3 Verdünnungen in 10 cm-Platten ausgehend von einer 80% konfluent 1x10 cm Platte.
HINWEIS: Planen Sie die Anzahl der Platten für das Experiment. Berechnen Sie jede Bedingung als Duplikate, eine für kurzfristige Live-Cell-Imaging und eine für Protein extrahiert die Wirksamkeit von Knockdown und exogenen Proteinexpression durch Western-Blot-Analyse zu bestimmen. Planen Sie eine zusätzliche Platte die Zellzahl vor der Virusübertragung zu bestimmen. - Vor der Zelle Beschichtung, Beschichtung von Glasbodenschalen mit 10 ug / ml Fibronektin. 1 ml einer 1: 100 - Verdünnung von 1 mg / ml Fibronektin (verdünnt in sterile 1x PBS) pro 35 mm - Schale zu gut die gesamte Oberfläche abzudecken und für 1 h bei 37 ° C, 5% CO 2 inkubieren.
- Während der Inkubation ergänzt vorwärmen & agr; MEM with 10% FBS (& agr; MEM 10%) und 0,05% Trypsin / EDTA bei 37 ° C.
- Nach 45 Minuten Inkubation, starten Sie die Zell-Lösung vor. In der sterilen Haube absaugen Medium aus einer 10 cm Platte, spülen Sie vorsichtig zweimal mit 1,5 ml 0,05% Trypsin / EDTA, und lassen Sie 0,5 ml Trypsin / EDTA bei der letzten Aspiration.
- Inkubieren der Zellen für 2-3 min bei 37 ° C, 5% CO 2. Durch sanftes die Platte und die Beobachtung unter dem Mikroskop tippen, stellen Sie sicher, dass alle Zellen abgelöst worden. 10 ml & agr; MEM 10% und Pipette vorsichtig mehrmals um die Zellen zu trennen. Zählen einer 10 ul-Probe der Zellsuspension unter Verwendung eines Hämocytometers.
- Absaugen Fibronektinlösung aus den Glasboden Gerichte. Fibronektin darf nicht vor der Zell Beschichtung zu trocknen.
- Platte 1,5x10 5 Zellen pro 35 mm - Schale in 2 ml 10% & agr; MEM und inkubieren bei 37 ° C, 5% CO 2. Stellen Sie sicher, nach 30-45 min unter dem Mikroskop, dass die Zellen gut sind sepabewertet, da sie die Tendenz haben, in der Mitte der Platte zu sammeln.
- Falls erforderlich, agitieren die Platten sanft kreuzweise um die Zellen zu verteilen. Platte eine 35-mm-Platte zusätzlich zur Anzahl der Bedingungen, um die Zellzahl vor der Virusübertragung zu zählen.
- Wachsen Zellen bis zum nächsten Tag eine Zelldichte von mindestens 50% zu erreichen. Eine Zelldichte von weniger als 50% führt zu einer signifikanten Abnahme der Virus Transduktionseffizienz erhöhte Schwankungen der Proteinexpression pro Zelle und eine erhöhte Zelltoxizität.
HINWEIS: Beschichtung von Glasschalen mit Fibronektin verbessert das Zellwachstum und die Morphologie und die richtige fördert Progression von Zellen durch Mitose. Es können im allgemeinen durch im Handel erhältliche Gelatine ersetzt werden, das billiger ist.
3. Adenovirus Transduction und endogenes Protein Knockdown von siRNA-Transfektion in HeLa-RFP-H2B Zellen unter Verwendung von CaPi Ausfällungen
Achtung! Arbeiting mit Viren erfordert besondere Vorsichtsmaßnahmen und eine ordnungsgemäße Entsorgung aller Materialien, die in Kontakt mit dem Virus gewesen ist.
Achtung! In unseren Händen fällt CaPi oft haben mehr unerwünschte Wirkungen, zum Beispiel auf biologische Prozesse Vesikeltransport beteiligt (zB Autophagie). Dementsprechend wird empfohlen, ein kationisches Lipid Transfektionsreagenz zu verwenden (siehe unten) und mindestens 48 Stunden vor der Analyse zu warten.
ANMERKUNG: Eine Kontroll - Adenovirus ein nicht verwandten Gen (dh LacZ) , oder kein Gen trägt , verwendet , um einen minimal MOI in allen Adenofections zu erreichen (10-20 PFU / Zelle) die geringste Menge an rekombinantem Adenovirus trägt das Gen von Interesse verwendet wird .
Hinweis: Dieses Verfahren hat sich gezeigt, Normalisieren Expression pro Zelle in einer großen Zellpopulation zu unterstützen.
- Einen Tag nach der Zell Plattieren, zählen die Anzahl der Zellen, die aus dem zusätzlichen plattierten Schale. Saugen Sie das Medium undSpülen Sie einmal mit 1 ml 0,05% Trypsin / EDTA. In wieder 1 ml 0,05% Trypsin / EDTA und Inkubation bei 37 ° C, 5% CO 2 , bis alle Zellen abgelöst haben. Trennen Sie die Zellen auch eine 1 ml-Pipette und die Anzahl der Zellen pro ml zählen unter Verwendung eines Hämozytometers.
- Bestimmung der Menge des Virus benötigt Zellen bei einer Multiplizität der Infektion (MOI) von 2 Plaque-bildenden Einheiten (PFU) des Proteins von Interesse (POI) pro Zelle und 18 pfu pro Zelle von einem leeren Vektor zu transduzieren (zB LacZ) insgesamt 20 PFU pro Zelle zu haben. Zugleich transduzieren 4 PFU von jeder Baculovirus (Actin und αTubulin, GFP und RFP-tagged respectively). Transduktion der Zellen folgendes adenofection Protokoll. Viren wurden wie in Fuchs et al. 14
- Bereiten Sie in einer sterilen Haube ein 1,5 - ml - Kunststoffröhrchen für jede Bedingung und fügen 400 ul warmen & agr; MEM-minus 10%.
- Auftauen ein Aliquot der Viren langsam auf Eis und, falls erforderlich, verdünnt ter Virus Lager, um ein Volumen von mehr als 1 & mgr; l zu pipettieren Pipettierfehler zu minimieren.
- Die berechnete Virus Menge pro Zustand zu jedem Röhrchen 1,5 ml Kunststoff , die 400 & mgr; l & agr; MEM-minus 10% und vorsichtig mischen durch Pipettieren. Legen Sie das Virus Lager sofort wieder bei -80 ° C seine Aktivität zu halten.
- Aspirieren das Medium von den Zellen und sanft das Virus Mischung tropfenweise pipettieren. Inkubieren der Zellen bei 37 ° C, 5% CO 2 und agitieren die Platten sorgfältig unter sterilen Haube jeweils 15 min für 1 h auf die Zellen auch mit dem Virus umfassen. eine geringe Menge an Medium erleichtert den Kontakt des Virus mit den Zellen.
- Nach der Inkubation Pipettieren vorsichtig 1,6 ml & agr; MEM-minus 10% auf jeder Platte ein Gesamtvolumen von 2 ml zu erhalten, durch Zugabe von 2 mM Thymidin Zellsynchronisation beginnen und die Zellen für weitere 2 Stunden bei 37 ° C, 5% CO 2 inkubieren .
- Inzwischen bereiten die siRNA-Transfektion Mix following , die capi Transfektionsverfahren (siehe Abbildung 1). Wenn keine siRNA erforderlich ist, ersetzen Sie die Menge von siRNA durch sterilem Wasser auf eine leere Transfektion durchzuführen.
- Berechnen 200 ul Mischung für jede Bedingung, die sich in 400 & mgr; l pro Duplikat. Das folgende Beispiel ist für eine endgültige siRNA Konzentration von 50 nM gegeben und wurde für jedes Protein von Interesse angepasst werden. In einem 1,5 ml Kunststoffröhrchen, Pipetten 50 & mgr; l 1 M CaCl 2 und 11 & mgr; l 20 & mgr; M siRNA in 139 ul sterilem H 2 O , und durch Verwirbeln gemischt. Nach einem schnellen Spin, fügen Sie vorsichtig tropfenweise 200 ul HBS2x (280 mM NaCl, 50 mM HEPES, 1,5 mM Na 2 HPO 4, pH - Wert von 7,01 bis 7,05).
HINWEIS: Je kleiner die Tropfen sind, umso kleiner die Niederschläge, was zu einer besseren Transfektionseffizienz. Vorsichtig mischen dreimal durch Luftinjektion mit einer 200 ul-Pipette. - Inkubieren der Mischung für 30 min bei RT. Fügen Sie langsam tropfenweise 200 ul Transfektionsgemisch zu jeder Platte undagitieren kreuzweise. Übertragen Sie die Platten bei 37 ° C, 5% CO 2 für 16 Stunden.
- Am nächsten Tag spülen Zellen zweimal mit 2 ml warmem HEPES (6,7 mM KCl, 150 mM NaCl, 10 mM HEPES, pH 7,3) und 2 ml & agr; MEM-minus 10%. Nicht mit mehr als vier Zellplatten zu einem Zeitpunkt gehen, da Variationen in der Temperatur über die Länge des Zellzyklus beeinflussen.
- Visualisieren Sie die Infektionseffizienz unter einem inversen Fluoreszenzmikroskop mit einer Vergrößerung von 20-40x (Luft) und erwerben drei repräsentative Bilder pro Zustand in den beiden fluoreszierenden und Übertragungskanäle für die Dokumentation. Sieben Stunden später, fügen Sie 2 mM Thymidin und Inkubation für weitere 16 Stunden bei 37 ° C, 5% CO 2.
- Am nächsten Tag, 48 Stunden nach der siRNA - Transfektion und Virus - Infektion, spülen Sie die Zellen zweimal mit 2 ml warmem Phosphatpuffer - Salzlösung (PBS) und Release 7 h in 2 ml & agr; MEM 10% w / o Phenolrot für Live - Cell - Imaging oder mit Phenol Rot für die Proteinextraktion.
- Ernte Zellen für jede Bedingung 48 h nach der Transfektion für die Herstellung von Proteinextrakten und Western - Blot - Analyse der Effizienz von Zuschlags und die Expression des endogenen Proteins 15 zu bestimmen.
HINWEIS: Verwenden Sie Antikörper gegen das Protein von Interesse sowie entsprechende Antikörper, die als Ladekontrollen dienen. Die Effizienz der Zuschlags sollte durch Laden abnehmenden Mengen von Steuer Zelllysaten (transfiziert mit Kontroll siRNA) bestimmt werden, um eine Titrationskurve zu liefern ( das heißt, 1, ½, ¼, ⅛).
4. Adenovirus Transduction und endogenes Protein Knockdown von siRNA-Transfektion in HeLa-Zellen unter Verwendung eines kationischen Lipids Transfektionsreagenz
HINWEIS: Hier präsentieren wir ein Protokoll, das für Experimente angepasst wurde, dass zum Beispiel keine Zellsynchronisation beinhalten und / oder wenn siRNA-Transfektion nicht von der CAPI-Verfahren durchgeführt werden können, unerwünschte toxische Wirkungen in irgendeiner Zelle lin zu vermeidenes. Dieses Protokoll umfasst auch eine Zelle replating Schritt nach adenofection um zu einer geeigneten Zelldichte zu arbeiten. Wir haben nur getestet das kationische Lipid Transfektionsreagenz.
Achtung! Arbeiten mit Viren erfordert besondere Vorsichtsmaßnahmen und eine ordnungsgemäße Entsorgung aller Materialien , die in Kontakt mit dem Virus gewesen ist.
- Platte 1,75 x 10 5 Zellen pro 35 mm - Schale in 2,5 ml & agr; MEM 10% und bei 37 ° C, 5% CO 2. Platte eine 35-mm-Platte zusätzlich zur Anzahl der Bedingungen, um die Zellzahl vor der Virusübertragung zu zählen.
- Wachsen Zellen bis zum nächsten Tag eine Zelldichte von mindestens 50% zu erreichen. Eine Zelldichte von weniger als 50% führt zu einer signifikanten Abnahme der Virus Transduktionseffizienz erhöhte Schwankungen der Proteinexpression pro Zelle und eine erhöhte Zelltoxizität.
- Einen Tag nach der Zell Plattieren, zählen die Anzahl der Zellen, die aus dem zusätzlichen plattierten Schale. Aspirierendas Medium und spülen einmal mit 1 ml 0,05% Trypsin / EDTA. In wieder 1 ml 0,05% Trypsin / EDTA und Inkubation bei 37 ° C, 5% CO 2 , bis alle Zellen abgelöst haben. Separate Zellen gut eine 1 ml-Pipette und die Anzahl der Zellen pro ml zählen.
- Bestimmen Sie die Menge des Virus benötigt , um eine Vielzahl der Infektion (MOI) von 20 bis 40 Plaque-bildenden Einheiten (PFU) des Proteins von Interesse (POI) pro Zelle und 0-20 PFU pro Zelle eines leeren Vektor zu transduzieren (zB LacZ) insgesamt 40 PFU pro Zelle zu haben.
- Bereiten Sie in einer sterilen Haube ein 1,5 - ml - Kunststoffröhrchen für jede Bedingung und fügen 400 ul warmen & agr; MEM 10%.
- Tauwetter ein Aliquot der Viren langsam auf Eis und, falls notwendig, das Virus Lager um verdünnen ein Volumen von mehr als 1 & mgr; l zu pipettieren Pipettierfehler zu minimieren.
- Die berechnete Virusmenge pro Zustand zu je 1,5 ml Kunststoffröhrchen 400 ul & agr; MEM , enthaltend 10% und sanft durch Pipettieren mischen. Platz the-Virus Lager bei -80 ° C sofort wieder seine Aktivität zu halten.
- Aspirieren das Medium von den Zellen und sanft das Virus Mischung tropfenweise pipettieren. Inkubieren der Zellen bei 37 ° C, 5% CO 2 und agitieren die Platten sorgfältig unter sterilen Haube jeweils 15 min für 1 Stunde auf gut die Zellen mit dem Virus Verdünnung bedecken. eine geringe Menge an Medium erleichtert den Kontakt des Virus mit den Zellen.
- Inzwischen bereiten nach der Transfektion Methode, um die siRNA-Transfektion Mix. Wenn keine siRNA erforderlich ist, ersetzen Sie die Menge von siRNA durch Medium ohne Serum eine leere Transfektion durchzuführen.
- Das folgende Beispiel ist für eine endgültige siRNA Konzentration von 50 nM gegeben und wurde für jedes Protein von Interesse angepasst werden. Für jede adenofection bereiten ein 1,5 - ml - Kunststoffröhrchen 416 nM siRNA in 150 ul Medium ohne Serum enthält (zB 6,25 ul 20 uM siRNA + 144 & mgr; l Medium ohne Serum) und ein 1,5 - ml - Kunststoffrohr haltendeng 6,25 ul kationische Lipid Transfektionsreagenz + 144 & mgr; l Medium ohne Serum.
- Mischen Sie den Inhalt jedes Kunststoffrohr durch Auf- und Abpipettieren mehrmals mit einer 200 ul Pipette. Kombinieren Sie den Inhalt der beiden Rohre und mischen durch Auf- und Abpipettieren mehrmals mit einer 200 ul Pipette. Inkubieren für 5 min bei RT.
- Nach der Inkubation mit dem Virus, Pipette vorsichtig 1,8 ml & agr; MEM 10% auf jeder Platte mit einem Gesamtvolumen von 2,2 ml zu erhalten , und sofort werden langsam tropfenweise zu jeder Platte die siRNA - Transfektion Mischung und rühren kreuzweise. Übertragen Sie die Platten bei 37 ° C, 5% CO 2 für 24 Std.
- Am nächsten Tag re-Platte die Zellen von jeder 35 mm - Platte in vier neue 35 - mm - Platten in 2,5 ml & agr; MEM je 10% und Inkubation für weitere 24 Stunden bei 37 ° C, 5% CO 2.
- Am nächsten Tag, 48 Stunden nach der siRNA-Transfektion und Virus-Infektion, Ernte-Zellen von einer Platte für jede Bedingung für die Herstellung vonProteinextrakte und Western - Blot - Analyse der Effizienz von Zuschlags und die Expression des endogenen Proteins 15 zu bestimmen.
HINWEIS: Bei den verbleibenden Platten, gehen mit Zellfixierung, das Protokoll der Wahl verwenden und die Proben zu Immunfluoreszenzanalyse mit den Antikörpern von 14 Interesse unterziehen.
5. Live Cell Imaging von mitotischen Zellen und Datenanalyse
- Führen Sie kurzfristige Live Cell Imaging Experimente an mitotischen Zellen mit einem inversen Mikroskop mit einem befeuchteten / 5% CO 2 / temperaturgeregelten Kammer ausgestattet.
HINWEIS: In dieser Studie wurde ein Spinnscheibe konfokalen Mikroskop (40X, 0,75 NA) verwendet wurde, ausgerüstet mit einem EMCCD gekühlten ladungsgekoppelten Kamera bei -50 ° C. - Vor dem Erwerb, stellen Sie sicher, dass die Kammer die geeignete Temperatur von 37 ° C erreicht hat.
HINWEIS: Dieser Vorgang kann mehrere Stunden dauern, abhängig von der mikroskopischen System. - Legen Sie die Kulturschalen in der MICROscope Kammer 1 Stunde vor dem Erwerb richtige Gleichgewicht des Mediums zu ermöglichen und den Fokus zu vermeiden aufgrund von Temperaturänderungen driften. Überwachung der mitotischen Zustand der Zellen. An diesem Punkt 10-15% der Zellen sollte in den frühen Stadien der Mitose (Prophase-Prometaphase) sein.
- Während der Ausgleichszeit, stellen Sie die Aufnahmeparameter wie in vorherigen Experimenten bestimmt. Typischerweise sind eine Belichtungszeit für beide Kanäle (488 und 594) von 0,2-3 sec mit einer Laserintensität von 100% und einer Empfindlichkeit von 121-130 geeignete Parameter in unseren Händen.
HINWEIS: Erste Tests mit den geringst möglichen Laserintensität und Erfassungszeit / Intervall, um zu bestimmen, die mit einem Minimum an Photobleichens in einer entsprechenden Auflösung zur Folge haben, die Zellschäden verursacht und stört mitotischen Progression. - Wählen mehrere Felder pro Bedingung eine signifikante Anzahl von Zellen zu erhalten, ohne den Erfassungsintervall zu analysieren. Mit einem Spinning Disk konfokales System, ein typisches Setup wird inClude vier verschiedenen Bedingungen, 7 Feldern pro Platte und zwei Farbkanäle (488 und 594) mit einem 1,5-2 min Intervall über einen 75 min-Periode.
- Wählen Sie Zellen, die bei der mitotischen Eintritt sind, erneut den Fokus, wenn alle Felder ausgewählt wurden, und den Erwerb beginnen so schnell wie möglich.
- Überwachen Sie die Stabilität des Systems für mindestens drei Zeitpunkten und wieder den Fokus, wenn nötig.
- Nach der ersten Bildgebungslebendzell kurzfristige von 75 min, können neue Felder mitotischer Zellen eines zweiten Satzes von Filmen zu erwerben werden gewählt, um die Anzahl der Zellen zu erhöhen, die analysiert wird.
- Bestimmen gut definierten Kriterien die mitotische Phänotypen von Zellen zu analysieren, die auf den Fluoreszenzmarker abhängen verwendet werden. Mängel in der Mitose können in der Mitose (von nuklearen Zusammenbruch bis anaphase), Chromosomenfehlausrichtung, Spindel wippen und Cortex blebbing 14 verlängert verbrachte Zeit umfassen.
6. LifeAct-TagGFP2 Adenoviren Transduction in Differentiating C2C12-Maus-Myoblasten
HINWEIS: Die adenofection Protokoll ist auch auf schwer zu Infect Myoblasten Maus C2C12 Differenzierung unterzogen.
- Platte 2 x 10 5 C2C12 - Zellen in 35 mm Kulturschalen in Wachstumsmedium auf Plastik oder auf einem Substrat der Wahl.
HINWEIS: Die Zelldifferenzierung auf Gelatine- oder Matrigel-beschichteten Schalen verbessert. Planen Sie eine zusätzliche Platte die Zellzahl vor der Virusübertragung zu bestimmen. - Am nächsten Tag sollten die Zellen 80% Konfluenz erreicht haben. Induzieren Differenzierung der Myoblasten, indem die Zellen zweimal mit warmem PBS gewaschen und Zugabe von 2 ml Differenzierungsmedium (DM).
- Am nächsten Tag, gekennzeichnet als Tag 1 (D1) der Differenzierung, transduzieren Myozyten mit Adenovirus LifeAct-TagGFP2 das Aktin-Zytoskelett in lebenden Zellen sichtbar zu machen. Zählen Sie die Zellenzahl von der zusätzlichen Platte wie unter 3.2 beschrieben. Berechnen 5 PFU / Zelle LifeAct-TagGFP2 Adenovirus und 45 PFU / Zelle AdLacZ im Anschluss an die PrüfungB. in Tabelle 1 beschrieben. Die Gesamtvirusmenge 50 PFU / Zelle ist. Viren wurden wie beschrieben 14 verwendet ,
- Bereiten Sie in einer sterilen Haube ein 1,5-ml-Kunststoffröhrchen für jede Bedingung und fügen 400 ul warmen DM.
- Tauwetter ein Aliquot der Viren langsam auf Eis und, falls notwendig, das Virus Lager um verdünnen ein Volumen von mehr als 1 & mgr; l zu pipettieren Pipettierfehler zu minimieren.
- Fügen Sie die entsprechende Menge von Viruspartikeln pro Zustand zu je 1,5 ml Kunststoffröhrchen mit 400 ul DM und vorsichtig mischen durch Pipettieren. Legen Sie das Virus Lager sofort wieder bei -80 ° C seine Aktivität zu halten.
- Saugen Sie das Medium von den Gerichten und sanft die Virusmischung tropfenweise pipettieren. Inkubieren der Zellen bei 37 ° C, 5% CO 2 und agitieren die Platten sorgfältig unter sterilen Haube jeweils 15 min für insgesamt 1 h bis gut die Zellen mit dem Virus umfassen.
- Nach der Inkubation Pipette vorsichtig 1,6 ml DM auf jede Platte und weiterhin die incubation für weitere 2 Stunden bei 37 ° C, 5% CO 2.
- Eine leere Transfektionsgemisch nach dem CaPi Transfektionsverfahren der Zwischenzeit bereiten. Berechnen 200 ul Mischung für jede Bedingung. Verwenden Sie das folgende Beispiel für ein Gesamtvolumen von 400 & mgr; l-Mix.
- In einem 1,5 ml Kunststoffröhrchen, Pipetten 50 ul 1 M CaCl & sub2 ; in 150 ul sterilem H 2 O , und durch Verwirbeln gemischt. Nach einem schnellen Spin, fügen Sie vorsichtig tropfenweise 200 ul HBS2x (280 mM NaCl, 50 mM HEPES, 1,5 mM Na 2 HPO 4, pH - Wert von 7,01 bis 7,05). mit einer 200 ul Pipette vorsichtig durch Luftinjektion dreimal mischen.
- Inkubieren der Mischung für 30 min bei RT. Fügen Sie langsam tropfenweise 200 ul der Transfektionsgemisch zu jeder Platte und agitieren kreuzweise. Übertragen Sie die Platten bei 37 ° C, 5% CO 2 für 16 Stunden.
- Am nächsten Tag, spülen Sie die Zellen zweimal mit 2 ml warmem HEPES (6,7 mM KCl, 150 mM NaCl, 10 mM HEPES, pH 7,3) und 2 ml DM. Visualisieren Sie die infection Effizienz unter einem inversen Fluoreszenzmikroskop mit einer Vergrößerung von 20-40X (Luft) und erwerben drei repräsentative Bilder pro Zustand in den beiden fluoreszierenden und Übertragungskanäle für die Dokumentation.
- Je nach Versuchsaufbau gewünscht wird, folgen die Differenzierung in Myotuben für mehrere Tage. Die Zellen können zur Immunfluoreszenzanalyse oder Live-Cell-Imaging-Studien fixiert und anschließend durchgeführt werden kann ausgesetzt werden.
Ergebnisse
Transfektion von BAG3-GFP - Plasmid - DNA unter Verwendung von kationischen Lipiden mit heterogenen Expression assoziiert in HeLa - Zellen einige Zellen zeigt kaum nachweisbaren Mengen des Proteins und andere Lager sehr hohe BAG3 Ebenen (2A). In diesen Zellen, Proteinverlust Homöostase wurde durch Akkumulation von BAG3-GFP nachgewiesen in perinukleären Aggregate (2A, Pfeile). Im Gegensatz dazu Zelltransduktion mit Adenoviren BAG3-GFP tragen zeigte homogener niedrige Expression und genaue Lokalisierung von BAG3-GFP (2B, Infektion allein). Bemerkenswert ist , die Zugabe von kationischen Lipiden bei der Adenovirus - Transduktion (dh Transfektion von Adenovirus - Partikel) signifikant erhöht BAG3-GFP - Expression pro Zelle bei ähnlichen MOI, während es in der Mehrzahl der Zellen homogenen Expression erlaubt halten (2B, Adenofection).
Adenofection erlaubt effiziente Abreicherung von endogenen BAG3 und Wiedereinführung von BAG3-GFP-Proteine in der Nähe von endogenen Spiegel, ob CAPI ausfällt oder Liposomen basierende Verbindungen , die die transduktionsfertige Transfektion in HeLa - Zellen zu erhöhen. 3 zeigt ein typisches Experiment mit dem Wildtyp BAG3 (WT) -GFP oder ein BAG3 (IPV) -GFP Variante Mutationen tragen , die Bindung an einem ihrer abschaffen Chaperon Partner HSPB8 (3A, 3B). Im Einklang mit einer Rolle für BAG3 in Stabilisierung HSPB8 7, Silencing BAG3 führte zu einem ~ 50% ige Abnahme in der Höhe der HSPB8, die auf ein normales Niveau bei Wiedereinführung von BAG3 WT wiederhergestellt wurde, aber nicht durch die Expression von ähnlichen Mengen des mutierten von BAG3 (IPV) -GFP oder allein von GFP. Unter diesen Bedingungen wurden BAG3-GFP - Proteine innerhalb von ~ 75-90% der Zellen in geeigneter Weise lokalisiert, an den perinukleären-zentrosomalen Regionen angereichert ist (3C, 3D). Diese suggsierte, dass adenofection die Dynamik der BAG3 und des BAG3-HSPB8 Komplexes in Zellen erhalten.
HSPB8 und BAG3 werden von verschiedenen proteotoxic Spannungen upregulated , die auch Zytoskelett Proteostase 10 stören. Daher die Überexpression der Chaperone kann möglicherweise die Montage-Demontage von hochmolekularen Strukturen steuern zelluläre Morphodynamik stören. Um die Rolle von BAG3-HSPB8 unter unbelasteten Bedingungen beurteilen zu können, war es wichtig, dass Proteinhomöostase zu überprüfen, wurde minimal von der adenofection Verfahren gestört. Zu diesem Zweck Überwachung Variationen in der Höhe der Chaperone des Hitzeschock-Protein-Familie ist ein guter Indikator für den Status der Proteinhomöostase. Wie in Figur 4 gezeigt, adenofection von der CAPI oder Liposomen-basierte Methoden haben System nicht signifikant die Konzentrationen von endogenem HSPB8 und BAG3 erhöhen, oder die des großen HSP70 / HSPA1 Chaperon. Im Gegensatz dazu ist typischproteotoxic Behandlungen wie Hitzeschock oder MG132, ein Proteasom-Inhibitor, erhöhte sich die Pegel der Chaperon-Cochaperon Proteine in HeLa-Zellen.
Wir versuchten dann, um zu bestimmen, ob die adenofection Verfahren mit Baculoviren Kombination von Actin und Tubulin Fluoreszenzsonden die Expression (BacMam-RFP-Actin und GFP-αtubulin) zur Nachführung mitotischen Zelldynamik geeignet war. Wie in 5 gezeigt, adenofection von HeLa - Zellen mit einer Kontroll - siRNA (siCTL) nicht gestört mitotischen Spindel Dynamik (grün) oder die durchschnittliche Zeit , in der Mitose verbrachte (5A, repräsentative konfokalen Zeitraffer - Sequenzen). Der Anteil dieser Zellen abnormale mitotische Ereignisse zeigt , war in Übereinstimmung mit den Pegeln der mitotischen Defekten im allgemeinen in Krebszelllinien beobachtet (~ 30% -40%, 5B). Im Gegensatz dazu mit BAG3-spezifische siRNA adenofected Zellen allein (siBAG3) zeigte eine ~ 2-fachen Anstieg in der level mitotischen phänotypische Defekte, die in der Nähe der Ebene in Kontrollzellen von BAG3-GFP (WT) wiederhergestellt wurde, aber nicht allein von GFP. Diese validierte die Eignung von adenofection für die funktionelle Analyse der Auswirkungen von BAG3 und die damit verbundenen Chaperone auf Zytoskelett Dynamik , die richtige Progression von Zellen in die und aus der Mitose regulieren, wie 14 von Fuchs et al.
Um die Vielseitigkeit des Verfahrens adenofection verifizieren, angepasst wir dann das Protokoll zu aktivieren Visualisierung von F-Aktin während der Differenzierung von Maus - C2C12 Myozyten, unter Verwendung des im Handel erhältlichen Adenovirus-GFP LifeAct-F-Aktin - 16 zu kennzeichnen. C2C12-Zellen induziert wurden für einen Tag vor Adenofection zu unterscheiden. Unter Verwendung der auf Basis von CAPI adenofection Protokoll, bemerkenswert geringe Mengen an Adenovirus-LifeAct-GFP genügte, um die Sonde auf einem Niveau auszudrücken, die leicht durch Fluoreszenzmikroskopie in einem signifikanten Anteil von differe erkannt wurde ntiating Myozyten (~ 3-5 PFU / Zelle; Figur 6). Dies war in deutlichem Gegensatz zu den extrem hohen Multiplizität der Infektion in der Literatur berichtet Maus C2C12 Zellen zu transduzieren (in der Größenordnung von 250-400 MOI) 17-19. Darüber hinaus wird durch den Differenzierungsprozess für 7 Tage Überwachung, haben wir, dass Myotube Bildung nicht wesentlich durch das Verfahren beeinträchtigt wurde. Dies legte nahe , dass Myozyten - Fusion, ein Prozess, der auf 20 fein abgestimmte Aktindynamik beruht, wurde nicht durch die Expression von geringen Mengen LifeAct-GFP gestört (Abbildung 6, Tag 6 und Tag 7). Da die Fluoreszenzmarker noch viele Tage nach adenofection von C2C12-Zellen nachgewiesen werden können, glauben wir, dass diese Methode für funktionelle Analysen der Auswirkungen von Chaperonen auf Aktindynamik in verschiedenen Stadien der C2C12 myogenesis geeignet.

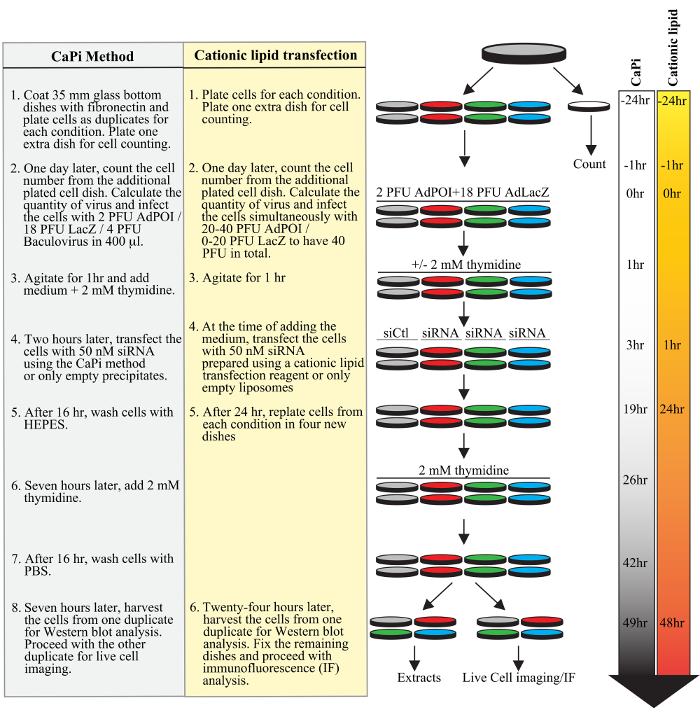
Figure 1. Planung eines typischen adenofection Protokoll. Aufeinanderfolgenden Stufen eines typischen Experiments sind für das Protokoll unter Verwendung CaPi Präzipitate gezeigt (in grau unterstrichen) oder das Protokoll ein kationisches Lipid Transfektionsreagenz (gelb markiert) verwendet, einschließlich Zell Plattieren, Transduktion Adeno- und Baculoviren, die Transfektion von siRNA-Duplexe und Zellsynchronisation mit einem doppelten Thymidin-Block. Zeitlinien in Stunden für beide Protokolle werden auf der rechten Seite der Figur gezeigt.fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.
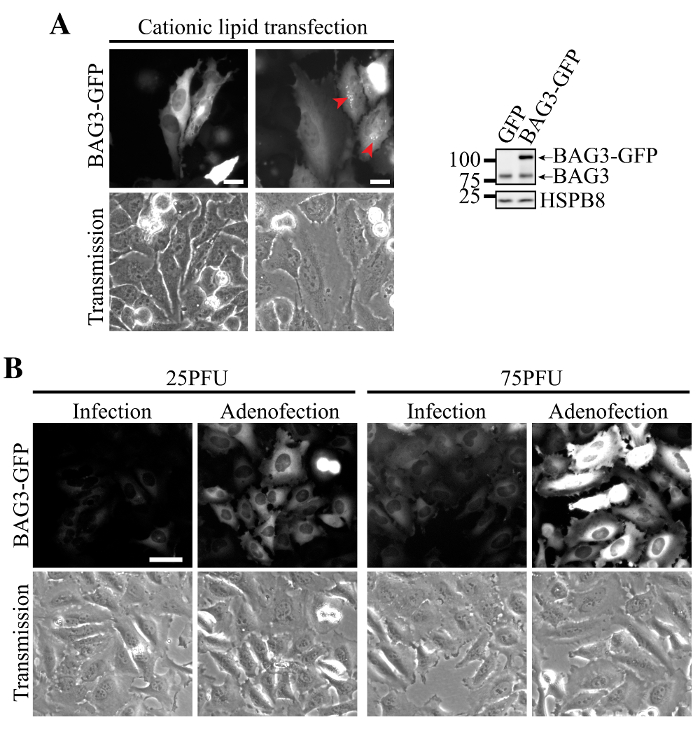
Abbildung 2. Homogene und effiziente Expression von BAG3-GFP unter Verwendung von Adenofection. (A) Repräsentative Epifluoreszenz- Bilder von HeLa - Zellen daß war mit BAG3-GFP-Plasmid-DNA transfiziert, perinukleären Aggregate des Proteins bei hohen Expressionsniveaus (bezeichnet durch Pfeile) und heterogene Expression innerhalb der Zellpopulation zeigt. Western-Blots zeigen eine höhere Expression von BAG3-GFP in Bezug auf endogene BAG3 Niveaus in der Gesamtzellpopulation, was darauf hinweist, dass das Protein weitgehend in einigen Zellen überexprimiert wird. (B) Repräsentative Epifluoreszenz- Bilder von HeLa - Zellen , die nur transduziert worden waren oder adenofected mit steigenden Mengen an Ad-BAG3-GFP Viruspartikel. BilderVerwendung identischer Parameter wurden erworben und wurden gleichermaßen für Untergrundsubtraktion und Intensität verarbeitet werden; Bar. 50 & mgr; m Bitte hier klicken , um eine größere Version dieser Figur zu sehen.

Abbildung 3. Effiziente Knockdown von BAG3 und die Wiedereinführung von BAG3-GFP - Proteine in der Nähe von endogenen Ebenen. (AB) HeLa - Zellen, die RFP-H2B (A) oder die elterliche HeLa - Zellen (B) wurden mit den angegebenen siRNAs und rekombinanten Adenoviren adenofected die CAPI Verfahren (A) oder auf Liposomen basierende Verbindungen als Transfektionsreagenz (B). Die Zellen wurden durch den doppelten Thymidin Block Methode synchronisiert und Gesamtzellextrakte wurden während der zweiten Phase der Veröffentlichung vorbereitet. Weste rn-Blots zeigen BAG3 Erschöpfungsgraden (BAG3 endogen), die Ebenen von adenofected BAG3-GFP-Proteine und endogenen HSPB8; GAPDH Ebenen: Ladekontrolle. Depletion wurde bei> 75% geschätzt , durch eine Verringerung der Mengen an Steuer Extrakte Laden (adenofected mit Kontroll - siRNA-siCtl und BAG3-GFP WT, das heißt, ½, ¼). Beachten Sie, dass einzelne BAG3-GFP-Proteine in der Nähe des endogenen Konzentration von BAG3 eingeführt wurden und dass Wildtyp BAG3-GFP, aber nicht BAG3 (IPV) -GFP oder GFP allein wiederhergestellt HSPB8 Ebenen in BAG3 verarmten Zellen. (CD) Repräsentative Epifluoreszenz- Bilder von HeLa - Zellen , die mit dem angegebenen rekombinanten Ad-BAG3-GFP unter Verwendung von CaPi oder kationischen Lipid Transfektionsreagenz adenofected worden war. Bars: 20 & mgr; m. Repräsentative Ergebnisse in (A) gezeigt , und (C) von Fuchs modifizierte et al., PLoS Genet. 2015 23. Oktober; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14.iles / ftp_upload / 54557 / 54557fig3large.jpg "target =" _ blank "> Bitte klicken Sie hier, um eine größere Version dieser Figur zu sehen.

. (: Nicht behandelt NT) oder HeLa - Zellen , die mit Kontroll - siRNA allein (siCtl, kein Adenovirus), oder adenofected mit siCtl Abbildung 4. Adenofection eine Stressreaktion in HeLa - Zellen Western - Blots von Gesamtzellextrakten nicht von der Kontrolle HeLa - Zellen hergestellt induzieren und Ad-GFP entweder CaPi oder kationischen Lipid Transfektionsreagenz oder aus HeLa-Zellen vorgelegt typische proteotoxic Behandlungen (HS: Hitzeschock bei 44 ° C für 60 min bei 37 ° C nach 16 h Erholung gefolgt; MG132: Proteasom-Inhibitor, 5 uM für 16 Stunden), die Ebenen von BAG3, HSPB8 und andere Stress-induzierbaren Chaperonen zeigt, nämlich HSP70 / HSPA / und HSP27 / HSPB1; GAPDH: Ladekontrolle. Beachten Sie, dass, während die Pegel aller ProProteine außer GAPDH wurden auf proteotoxic Stress-Behandlungen erhöht, blieben sie von adenofection unverändert. Protein Pegelschwankungen wurden durch Laden unterschiedliche Mengen an HS Zellextrakten ermittelt, die typische Anstieg der HSPs zu tragen. (HS: 1, ½, ¼, ⅛; zum Beispiel wurde HSP70 induziert durch mehr als 8-fach in Reaktion Stress proteotoxic) Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
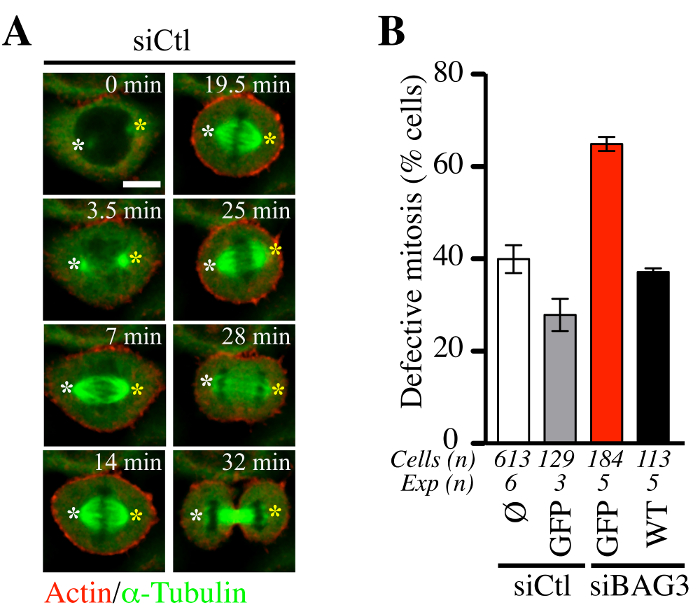
Abbildung 5. Progression von HeLa - Zellen durch Mitose nicht signifikant durch Adenofection gestört ist. (A) Repräsentative konfokalen Zeitraffer-Sequenzen aus HeLa - Zellen , die mit einem Kontroll - siRNA (siCtl) zusammen mit BacMam- GFP-α-Tubulin und BacMam adenofected worden war -RFP-Actin und abgebildet durch Scheibe konfokalen microsco Spinnenpy für 60 bis 90 min bei ~ 1,5 min Intervallen. Weiße und gelbe Sternchen bezeichnen die Position der Spindelpole, die relativ stabil geblieben. Bar: 10 & mgr; m. (B) Quantifizierung der Zellen adenofected mit siCtl oder BAG3-spezifische siRNA, mit oder ohne den angegebenen GFP - Proteine (GFP allein oder Wildtyp BAG3-GFP: WT). Die Grafik zeigt den Anteil der Zellen mit abnormen Mitose definiert als Spindel Wippen und ins Stocken geraten in die Mitose +/- oder Chromosomenfehlausrichtung. Dargestellt sind die Mittel +/- SE. Repräsentative Ergebnisse in (B) gezeigt sind, wurden von Fuchs et al genommen., PLoS Genet. 2015 23. Oktober; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14. Bitte hier klicken , um eine größere Version dieser Figur zu sehen. Bitte hier klicken , um den Film zu sehen mit Platte (A) zugeordnet ist .

Abbildung 6. Adenofection von C2C12 Myozyten mit Ad-LifeAct-GFP und Myotube Bildung. Repräsentative Epifluoreszenz- Bilder von C2C12 - Zellen , die für adenofection 1 Tag induziert worden war , später 5 PFU / Zelle LifeAct-GFP und 45 PFU / Zelle mit zu differenzieren und verarbeitet von LacZ. Bilder zeigen die Expression des GFP-Markierung während des Differenzierungsprozesses (Tag 2, Tag 6 und 7. Tag). Bars:. 20 & mgr; m Bitte klicken Sie hier um eine größere Version dieser Figur zu sehen.
Diskussion
Hier beschrieben wir ein Verfahren ermöglicht Verarmungsrettungsexperimente durchgeführt werden, die funktionelle Analyse von zellbiologischen Prozessen anwendbar ist, die besonders empfindlich auf eine Überexpression von Proteinen, die Stöchiometrie und die Dynamik von Proteinkomplexen und makromolekulare Strukturen zu beeinträchtigen. Mitotischen Zellteilung ist ein extremes Beispiel für fein abgestimmte Zelle Morphodynamik, die die dramatische und spektakuläre Veränderungen in der Gesamtstruktur einer Zelle beinhaltet. Mit adenofection kombiniert mit handelsüblichen BacMam Reagenzien niedrig, aber nachweisbare Mengen von Aktin und Tubulin-Marker für Cell Imaging einzuführen, der Beitrag des Chaperon-Komplex BAG3-HSPB8 zu Umbau richtige mitotischen Zelle eindeutig nachgewiesen werden konnte. In einer neueren Studie von Fuchs et al., Haben wir , dass Abreicherung von BAG3 verursacht Defekte in Spindel - Orientierung dargestellt, die auf eine Unfähigkeit verbunden sind mit einem starren mitotischen Aktin cortex herzustellen und zusammenzubauen Aktin-richRückzug Fasern 14. Die richtige Spindeldynamik könnte durch Wiedereinführung von Wildtyp BAG3-GFP wieder hergestellt werden, die auch die Abnahme der HSPB8 Ebenen auf BAG3 Silencing gesehen korrigiert. Dies bedeutet, dass adenofection die Wiederherstellung eines physiologisch relevanten Chaperon-Komplex ermöglicht, die mit funktionellen Erholung der Spindeldynamik korreliert.
Die Verwendung von adenofection zur Abreicherung-Rettungsversuche stellt einen Vorteil gegenüber Plasmid - DNA - Transfektion oder Nukleofektion, die in einem starken Induktion einer Stressreaktion in einigen Zelltypen (dh Autophagie) 21, so dass es praktisch unmöglich , zu analysieren , um die Auswirkungen eines zur Folge haben kann gegeben Chaperon und seine physiologische Rolle. Tatsächlich in der Hand, die Transfektion von BAG3 Plasmid - DNA wird mit einer höheren Expression assoziiert pro Zelle, die Aggregatbildung, und die Auswirkungen auf die Zellapoptose / Überleben in mehreren Zelltypen (Abbildung 2). BAG3 ist ein modulares Cochaperon mit Gerüst-Aktivität, die may mehrere Rollen in Abhängigkeit von seiner Partnerproteine 9 spielen. Daher Störungen komplexer Stöchiometrie auf die Überexpression von BAG3 können unerwünschte dominant negative Wirkungen und Toxizität induzieren. rekombinantes Adenovirus mit hoher Kapazität ist ein ideales Vehikel für die transiente und -sicherheitsanlieferung großer Gene sowohl Dividieren und Zellen in Kultur nicht teilende, da sie nicht in das Wirtszellengenom integriert sich im Gegensatz zu Lentivirus-basierte Vektoren für die einige Sicherheits Bedenken bleiben nach wie vor. Potential Nachteil der Verwendung von Adenoviren für Verarmungs-rescue Experimente ist, dass sie wiederholt Vorbereitung erfordern, was zeitraubend sein kann. Sie stützen sich auch auf eine sorgfältige Titration von infektiösen Partikeln für reproduzierbare Transduktion Wirksamkeit.
Verwendung adenofection den Beitrag der bekannten BAG3 funktionellen Domänen zu screenen, erhalten wir den ersten Beweis, unseres Wissens für die Existenz eines HSPB8 abhängigen BAG3 Funktion im Normalbetriebsich teilender Zellen, die nicht auf die Interaktion mit dem HSP70 / HSPA1 Chaperon-System benötigen. Adenofection sollte anwendbar F-Aktin während des Prozesses der Myozyten-Differenzierung zu Myotuben zu verfolgen, wie hier durch die Daten dargestellt vorgeschlagen. So ist unser Verfahren stellt ein vielseitiges und effizientes Protokoll für siRNA-basierte Verarmungsrettungsversuche mit minimalen Auswirkungen auf die Zelle Morphodynamik, die nützlich sein sollte in einem breiten Spektrum von Projekten, bei denen Struktur-Funktions-Analyse eines Gens von Interesse verfolgt wird.
Ausnutzen kationischen Verbindungen-Lipiden, um eine effiziente Transfektion-Transduktion von Zellen mit der geringsten Menge an Viruspartikeln zu erreichen, ist der Schlüssel zu dieser Methode. Während es für die Steuerung der Mengen an exogenen Proteine pro Zelle ein größeres Fenster bietet, glauben wir, dass es ermöglicht eine weitere mögliche Nebenwirkungen auf Signaltransduktionswege zu minimieren, die aus Adenovirus Zellbindung Eintritt führen, was die Auswirkungen der ap abzumildernrotein von Interesse auf morphogenetische Wege.
Es sollte beachtet werden, dass verschiedene Reagenzien Adenovirus Transduktionseffizienz zu erhöhen, im Handel erhältlich, wie beispielsweise die CAR-Rezeptor-Booster sind. Solche Reagenzien sind jedoch teuer und werden voraussichtlich Virus bindungs Eintritt in Zellen in einer Weise zu fördern, die die CAR-Rezeptor erfordert, die wie oben festgestellt worden ist Wege zu aktivieren gezeigt Signalisierung mit der Zellform und Adhäsion verbunden. Während CaPi billiger als kationische Liposomen als Mittel ist Adenovirus Eintrag über eine CAR-unabhängigen Weg zu potenzieren, ist es auch giftig für einige Zelllinien. Wir empfehlen vorherige Prüfung eines leeren adenofection die Wahl zwischen CaPi vs kationischen Lipid-Reagenz zu orientieren, in Abhängigkeit von der verwendeten Zelllinie und die biologische Auslese von Interesse.
Zusammen mit neuen biotechnologischen Werkzeugen der Genombearbeitung, RNA-Interferenz-basierten Knockdown-Rettungs Ansätze wie die hier beschriebene bieten array von leistungsfähigen molekularen Werkzeugen Genfunktionen in Zellen aufzudecken, die nun optimal von den Forschern gewählt werden können , auf spezifische Anwendungen je 3. Wir glauben, dass adenofection eine relativ schnelle und einfache System bietet hypomorphen Niederschlägen zu schaffen für Struktur-Funktion des Beitrags eines Proteins von Interesse in mehreren zellulären Hintergründe analysiert.
Offenlegungen
The authors have nothing to disclose.
Danksagungen
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Materialien
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
Referenzen
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462 (2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889 (2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141 (2011).
- Guilbert, S. M., Tanguay, R. M., Hightower, L. E., et al. . The Big Book of Small Heat Shock Proteins. , 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582 (2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294 (2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2 (2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten