Method Article
Adenofection: Un metodo per studiare il ruolo di chaperoni molecolari in Cellular Morfodinamica da esperimenti Depletion-Rescue
In questo articolo
Riepilogo
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Abstract
processi cellulari come la mitosi e la differenziazione cellulare sono regolate da cambiamenti nella forma delle cellule che in gran parte si basano su una corretta rimodellamento delle strutture del citoscheletro delle cellule. Questo prevede il montaggio-smontaggio di strutture macromolecolari ordine superiore in un dato momento e luogo, un processo che è particolarmente sensibile alle perturbazioni provocate da sovraespressione di proteine. Metodi che preservare dell'omeostasi proteica e mantenere la morfologia vicino a normale cellulare sono altamente desiderabili per determinare il contributo funzionale di una proteina di interesse in una vasta gamma di processi cellulari. Transitori esperimenti esaurimento-soccorso basate su RNA interference sono approcci potenti per analizzare le funzioni delle proteine e dei requisiti strutturali. Tuttavia, reintroduzione della proteina bersaglio con deviazione minima dal suo livello fisiologico è una vera sfida. Qui si descrive un metodo denominato adenofection che è stato sviluppato per studiare il ruolo di chaperon molecolari und partner nel normale funzionamento di cellule in divisione e il rapporto con l'actina rimodellamento. cellule HeLa sono state esaurite di BAG3 con duplex siRNA mira la regione 3'UTR. proteine BAG3 GFP-tagged sono stati reintrodotti simultaneamente in> 75% delle cellule utilizzando adenovirus ricombinanti accoppiati ai reagenti di trasfezione. Adenofection ha permesso di esprimere proteine BAG3-GFP a livelli fisiologici vicino in cellule HeLa impoverito di BAG3, in assenza di una risposta allo stress. Nessun effetto è stato osservato sui livelli di endogeni accompagnatori heat shock protein, i principali regolatori di stress-inducibile di omeostasi delle proteine. Inoltre, aggiungendo baculoviruses guida l'espressione di marcatori fluorescenti al momento della cella di trasduzione-trasfezione, potremmo sezionare dinamiche cellulari mitotiche da time-lapse microscopica analisi con perturbazione minima di progressione mitotica normale. Adenofection è applicabile anche alle cellule di topo difficili da infettare, e adatto per analisi funzionali di mioblasti differenziazione in miotubi. Così adenofection fornisce un metodo versatile per eseguire struttura-funzione analizza delle proteine coinvolte nei processi biologici sensibili che si basano sulla dinamica del citoscheletro di ordine superiore.
Introduzione
inattivazione funzionale di espressione genica in cellule di mammifero è il gold standard per sezionare le funzioni delle proteine. Tecnologie di editing del genoma basata sull'uso di nucleasi specifiche del sito, come nucleasi zinc-finger di nuova concezione e cluster regolarmente intervallati brevi ripetizioni palindromi (CRISPR) / CAS9 ora permettono la generazione di linee cellulari con mirata delezione del gene e la mutazione 1,2. Questi nuovi approcci dovrebbero rivoluzionare il modo in cui stiamo studiando la funzione delle proteine e la nostra comprensione della genetica delle malattie umane. In alcuni casi, tuttavia, a lungo termine o completa knockout gene non è auspicabile e possono provocare meccanismi di compensazione cellule secondarie. La generazione di linee cellulari geneticamente modificati può anche essere limitante quando si tratta di colture cellulari primarie con capacità proliferativa limitata, o quando è richiesta proiezione di un grande insieme di mutazioni in vari tipi cellulari. Questo è spesso necessario per determinare la dipendenza di una cella bprocesso iological sui requisiti strutturali di una proteina. A tal fine, atterramento reversibile da RNA interference che consente esperimenti di deplezione-salvataggio transitori in vari ambiti di cellulari rimane ancora un approccio semplice e potente per eseguire le analisi struttura-funzione di una proteina di interesse 3. Tuttavia, un grave inconveniente di questo approccio è la difficoltà di raggiungere silenziamento efficiente e reintrodurre la proteina di interesse o sue varianti a livelli fisiologici vicino nella maggior parte della popolazione cellulare. Ciò è essenziale per consentire studi approfonditi che tentano di correlare effetti funzionali osservati a livello delle singole cellule (fenotipo hypomorphic) con quelli osservati in saggi basati sulla popolazione di cellule, per esempio sulle interazioni proteina-proteina.
Utilizzando metodi di trasfezione classici, difficilmente si può ottenere espressione omogenea e bassa di proteine esogene in una vasta popolazione di cellule. Trasduzione di cellule con virus ricombinanticome adenovirus spesso permette un'espressione più normalizzata di proteine esogene. Tuttavia, l'assorbimento adenovirus è limitata dal recettore CAR, che è assente in cellule non-umane o solo debolmente espressa in alcuni tipi di cellule umane. Inoltre, l'entrata cellulare di adenovirus attiva percorsi che regolano la forma delle cellule e l'adesione 4-6 segnalazione. Questo ovviamente non è desiderabile quando si studiano meccanismi regolatori della morfodinamica cellulari. Siamo stati di fronte a questa problematica quando abbiamo intrapreso analisi funzionali di un complesso chaperone, BAG3-HSPB8, nella divisione cellulare e le dinamiche di actina. Lavoro pionieristico aveva descritto un ruolo per questo complesso di proteine chaperone controllo di qualità e l'autofagia durante lo stress 7,8. La maggior parte di questi studi, tuttavia, invocata iperespressione della proteina, partendo dal presupposto che le accompagnatori sono normalmente sovraregolati durante lo stress. Questo ha lasciato aperta la questione se BAG3, in complesso con HSPB8, può contribuire al normale funzionamento delle cellule in divisione che esprimono °accompagnatori ESE come molti tipi di cellule di cancro 9. In particolare, se il complesso chaperone contribuisce al rimodellamento delle strutture di actina-based che controllano la progressione mitotico è stato di grande interesse, date le connessioni emergenti tra accompagnatori HSPB e le dinamiche del citoscheletro 10. Per risolvere questo problema, abbiamo cercato di sviluppare un metodo efficiente per gli esperimenti esaurimento-soccorso che non interferire con la progressione mitotico o morfologia cellulare, e che sarebbe conservare l'omeostasi delle proteine al fine di evitare perturbazioni secondaria della dinamica dei complessi macromolecolari che regola i cambiamenti-forma delle cellule . Così idealmente, l'esaurimento-add-back del gene di interesse deve essere eseguita simultaneamente.
L'uso di complessi di adenovirus con un polimero cationico o lipidi è stata descritta per promuovere il trasferimento genico in vitro e in vivo 11,12. Per esempio, fosfato di calcio (CAPI) sembra formare un precipitato conadenovirus che migliorano il virus vincolante-ingresso attraverso un percorso CAR-indipendenti 13. Infatti, abbiamo scoperto che la combinazione di adenovirus-based trasduzione cellulare e trasfezione con composti cationici potrebbe migliorare l'efficienza degli esperimenti svuotamento soccorso. Ciò ha permesso di abbassare la quantità di virus da 3 a 20 volte, a seconda della linea cellulare e il gene di interesse, e beneficiare di una finestra più ampia al fine di regolare l'espressione di proteine esogene a livelli vicini endogeni nella maggioranza di una popolazione di cellule con un impatto minimo sulla morfologia cellulare. In tali condizioni, si potrebbe anche ottenere un'elevata efficienza knockdown dell'espressione della proteina endogena (> 75%). Con la presente descriviamo il passaggio Metodo passo e fornire la prova che l'omeostasi delle proteine non è significativamente perturbato come valutato dai livelli invariati di accompagnatori di stress-indotta della famiglia heat shock protein, rendendo il metodo adatto per le analisi funzionali della ro fisiologicoLe di chaperon molecolari per il video microscopia time-lapse. Il protocollo è suscettibile di procedure di sincronizzazione delle cellule e per l'utilizzo del baculoviruses disponibili in commercio per la co-espressione di bassi livelli di marcatori fluorescenti, con la minima interferenza con le normali dinamiche di actina-based e mandrino durante la progressione mitotico. Mostriamo ulteriormente la versatilità del metodo, applicabile a "duro" trasdurre cellule C2C12 mouse, senza alcun impatto significativo sulla differenziazione dei mioblasti in miotubi in vitro.
Protocollo
1. Preparazione del mezzo e soluzioni (tutto filtrata sterile)
- Le cellule muscolari del mouse C2C12 (studi di differenziazione)
- Preparare 500 ml di crescita medio per C2C12 manutenzione coltura cellulare: DMEM alto glucosio supplementato con 10% FBS e 2 mm L-glutammina.
- Preparare 100 ml di differenziazione Media (DM) per la differenziazione C2C12: DMEM alto glucosio integrato con il 2% siero di cavallo.
- Cellule HeLa (studi in cellule in mitosi)
- Preparare 500 ml αMEM per HeLa RFP-H2B manutenzione coltura cellulare ed esperimenti: αMEM supplementato con 10% FBS e 2 mM L-glutammina (αMEM 10%).
- Preparare 500 ml αMEM-minus (senza deoxyribonucleosides / ribonucleosides) per HeLa sincronizzazione cellule RFP-H2B: αMEM-minus supplementato con 10% FBS e 2 mM L-glutammina (αMEM-meno 10%).
- Preparare 20 ml αMEM senza rosso fenolo per HeLa-RFP-H2B lacquisizione delle cellule ive: αMEM senza rosso fenolo integrato con il 10% FBS e 2 mM L-glutammina.
- Preparare 100 mM timidina: sciogliere 24,2 mg in 1 ml di H 2 O a 37 ° C con il vortex. Filtro sterilizzare e conservare a 4 ° C.
- soluzioni comuni
- Preparare 0,05% tripsina / EDTA: 0.05% tripsina, 0,625 mM EDTA in 1x tampone fosfato (PBS). Filtro sterilizzare e aliquote conservare a -20 ° C. Una volta scongelato, tenere aliquota a 4 ° C.
- Preparare HBS2x: 280 mm NaCl, 50 mM HEPES, 1,5 mm Na 2 HPO 4. Regolare il pH esattamente tra 7,01-7,05 con 10 N NaOH. Filtro sterile e conservare a 4 ° C.
2. Rivestimento di piastre di coltura cellulare con fibronectina e placcatura di cellule HeLa-RFP-H2B
NOTA: Prima l'esperimento, ogni manipolatore dovrebbe creare le condizioni ottimali di placcatura cellulare per ottenere una corretta densità delle cellule in quanto variazioni possono OCcur tra ogni manipolatore ed ogni linea cellulare diverso.
- Il giorno prima dell'esperimento, espandere le cellule HeLa-RFP-H2B per assicurarsi che essi siano nella fase di crescita esponenziale nel giorno della placcatura. Fare 2 successive diluizioni 1/3 in 10 piatti cm a partire da una piastra di cm 1x10 confluenti 80%.
NOTA: Pianificare il numero di piastre per l'esperimento. Calcola ogni condizione di duplicati, uno per live-cell imaging a breve termine e una per le proteine estratti per determinare l'efficacia di atterramento e di espressione della proteina esogena da analisi Western Blot. Pianificare una piastra aggiuntiva per determinare il numero di cellule prima di trasduzione del virus. - Prima della cella di placcatura, piatti con fondo di vetro cappotto con 10 ug / ml fibronectina. Aggiungere 1 ml di una diluizione 1: 100 di 1 mg / ml fibronectina (diluito in PBS sterile 1x) a 35 millimetri piatto per ben coprire l'intera superficie e incubare per 1 ora a 37 ° C, 5% CO 2.
- Durante l'incubazione, αMEM pre-caldo integrata with 10% FBS (αMEM 10%) e 0,05% tripsina / EDTA a 37 ° C.
- Dopo 45 min di incubazione, iniziare a preparare la soluzione di cellule. Nella cappa sterile, aspirare il terreno da una piastra 10 cm lavare delicatamente due volte con 1,5 ml di 0,05% tripsina / EDTA, e lasciare 0,5 ml di tripsina / EDTA all'ultimo aspirazione.
- Incubare le cellule per 2-3 minuti a 37 ° C, 5% CO 2. Picchiettando delicatamente la piastra e l'osservazione al microscopio, verificare che tutte le cellule sono state staccate. Aggiungere 10 ml di αMEM 10% e pipette delicatamente più volte per separare le cellule. Contare un campione di 10 microlitri di sospensione cellulare utilizzando un emocitometro.
- soluzione fibronectina Aspirare dai piatti fondo di vetro. Non permettere che la fibronectina si asciughi prima di placcatura delle cellule.
- Piatto 1,5x10 5 cellule per piastra da 35 mm 2 ml αMEM 10% e incubare a 37 ° C, 5% CO 2. Verificare dopo 30-45 min al microscopio che le cellule sono ben sepavalutazione, poiché hanno la tendenza ad accumularsi nel centro della piastra.
- Se necessario, agitare i piatti delicatamente cross-saggio di ridistribuire le cellule. Piatto una piastra 35 mm Altre al numero di condizioni per contare il numero di cellule prima della trasduzione del virus.
- Crescere le cellule fino al giorno successivo per ottenere una densità cellulare di almeno il 50%. Una densità cellulare inferiore a 50% provoca una significativa diminuzione dell'efficienza virus trasduzione, aumentato variazioni di espressione della proteina per cellula, e aumentata tossicità cellulare.
NOTA: Rivestimento di piatti di vetro con fibronectina migliora la crescita cellulare e la morfologia e favorisce la corretta progressione delle cellule attraverso la mitosi. Si può generalmente essere sostituito da gelatina commercialmente disponibile che è più conveniente.
3. Adenovirus trasduzione e proteina endogena Knockdown da siRNA Transfection in cellule HeLa-RFP-H2B Utilizzando CAPI precipitati
Attenzione! Lavorore con i virus richiede precauzioni speciali e un corretto smaltimento di tutto il materiale che è stato in contatto con il virus.
Attenzione! Nelle nostre mani, CAPI precipita spesso hanno effetti più indesiderati, per esempio sui processi biologici che coinvolgono il traffico di vescicole (ad esempio, autofagia). Di conseguenza si consiglia di utilizzare un reagente cationico transfezione lipidi (vedi sotto) e di attendere almeno 48 ore prima che le analisi.
NOTA: Un adenovirus di controllo trasporta un gene estraneo (cioè, LacZ) o nessun gene è utilizzato per raggiungere un minimo MOI in tutte Adenofections (10-20 pfu / cell) utilizzando la minima quantità di adenovirus ricombinante portante il gene di interesse.
NOTA: Questa procedura è stato dimostrato per aiutare espressione normalizzazione per cella in una grande popolazione di cellule.
- Un giorno dopo la placcatura cellule, contare il numero di cellule dal piatto aggiuntivo placcato. Aspirare il medio elavare una volta con 1 ml di 0,05% tripsina / EDTA. Aggiungere nuovamente 1 ml di 0,05% tripsina / EDTA e incubare a 37 ° C, 5% CO 2 fino a quando tutte le celle sono indipendente. Separare le cellule pozzetto usando una pipetta 1 ml e contare il numero di cellule per ml utilizzando un emocitometro.
- Determinare la quantità di virus necessaria per trasdurre cellule ad una molteplicità di infezione (MOI) di 2 unità formanti placche (PFU) della proteina di interesse (POI) per cellula e 18 PFU per cellula di un vettore vuoto (ad esempio, LacZ) per un totale di 20 PFU per cellula. Allo stesso tempo, la trasduzione 4 PFU di ogni baculovirus (actina e αTubulin, GFP e RFP-tag, rispettivamente). Trasdurre le cellule utilizzando il seguente protocollo adenofection. I virus sono stati usati come descritto in Fuchs et al. 14
- Preparare in una cappa sterile un tubo di plastica da 1,5 ml per ogni condizione e aggiungere 400 ml di caldo αMEM-meno 10%.
- Scongelare una aliquota dei virus lentamente su ghiaccio e, se necessario, diluire tegli virus magazzino al fine di pipetta un volume superiore a 1 ml per ridurre al minimo gli errori di pipettamento.
- Aggiungere la quantità di virus calcolato per condizioni di ciascun tubo di plastica da 1,5 ml contenente 400 ml αMEM-meno 10% e mescolare delicatamente pipettando. Posizionare lo stock di virus subito di nuovo a -80 ° C per mantenere la sua attività.
- Aspirare il supporto dalle cellule e pipetta delicatamente goccia a goccia il mix di virus. Incubare le cellule a 37 ° C, 5% di CO 2 e agitare le piastre accuratamente sotto la cappa sterile ogni 15 min per 1 ora a coprire anche le cellule con il virus. Utilizzando una piccola quantità di mezzo facilita il contatto del virus con le cellule.
- Dopo l'incubazione, pipettare delicatamente 1,6 ml αMEM-meno 10% per ogni piastra per ottenere un volume totale di 2 ml, avviare la sincronizzazione cellule aggiungendo 2 mM di timidina e incubare le cellule per ulteriori 2 ore a 37 ° C, 5% CO 2 .
- Nel frattempo, preparare le followi mix transfezione siRNAng il metodo di trasfezione CAPI (vedi Figura 1). Se nessun siRNA è necessario sostituire la quantità di siRNA da acqua sterile per eseguire un trasfezione vuoto.
- Calcolare 200 microlitri della miscela per ogni condizione, con conseguente 400 microlitri per duplicato. Il seguente esempio è dato per una concentrazione siRNA finale di 50 Nm e deve essere adattato per ogni proteina di interesse. In un tubo di plastica da 1,5 ml, pipetta 50 ml 1 M CaCl 2 e 11 ml di 20 micron siRNA in 139 ml H 2 O sterile e mescolare nel vortex. Dopo un rapido giro, aggiungere con cautela goccia a goccia 200 ml HBS2x (280 mM NaCl, 50 mM HEPES, 1,5 mm Na 2 HPO 4, pH 7,01-7,05).
NOTA: Il più piccoli le gocce il più piccoli sono i precipitati, con conseguente migliore efficienza di trasfezione. Mescolare delicatamente per tre volte con iniezione di aria utilizzando un 200 pl-pipetta. - Incubare la miscela per 30 minuti a RT. Aggiungere lentamente goccia a goccia 200 ml di mix trasfezione per ogni piatto eagitare trasversalmente. Trasferire le piastre a 37 ° C, 5% CO 2 per 16 ore.
- Il giorno dopo, lavare le cellule due volte con 2 ml HEPES calde (6,7 mM KCl, 150 mM NaCl, 10 mM HEPES, pH 7.3) e aggiungere 2 ml αMEM-meno 10%. Non procedere con più di quattro piastre delle celle in un momento che le variazioni di temperatura influenzano la durata del ciclo cellulare.
- Visualizza l'efficienza infezione sotto un microscopio a fluorescenza invertito ad un ingrandimento di 20-40x (aria) e acquisire tre immagini rappresentative per condizione in entrambi i canali fluorescenti e trasmissione di documentazione. Sette ore dopo, aggiungere 2 mM di timidina e incubare per altri 16 ore a 37 ° C, 5% CO 2.
- Il giorno dopo, 48 ore dopo la trasfezione di siRNA e infezione da virus, lavare le cellule due volte con 2 ml calda salina tampone fosfato (PBS) e rilasciare per 7 ore in 2 ml αMEM 10% w / o rosso fenolo per l'imaging cellulare dal vivo o con fenolo Rosso per l'estrazione di proteine.
- Celle di raccolta per ciascuna condizione 48 ore dopo la trasfezione per la preparazione di estratti proteici e analisi Western blot per determinare l'efficienza del knockdown e l'espressione della proteina endogena 15.
NOTA: utilizzare gli anticorpi contro la proteina di interesse, così come gli anticorpi adeguati che servono come controlli di carico. L'efficienza di atterramento deve essere determinato caricando decrescenti quantità di lisati cellulari di controllo (trasfettate con il controllo siRNA), per fornire una curva di titolazione (ad esempio, 1, ½, ¼, ⅛).
4. Adenovirus trasduzione e proteina endogena Knockdown da siRNA Transfection in cellule HeLa Utilizzando un cationico Lipid Transfection Reagent
NOTA: Qui vi presentiamo un protocollo che è stato adattato per esperimenti che non comportano la sincronizzazione delle cellule e / o quando siRNA trasfezione non può essere eseguita con il metodo CAPI, ad esempio per evitare effetti tossici indesiderati in alcune cellule lines. Questo protocollo include anche una fase replating cella dopo adenofection per lavorare ad un'opportuna densità cellulare. Abbiamo testato solo il cationico reagente di trasfezione lipidi.
Attenzione! Lavorare con i virus richiede precauzioni speciali e un corretto smaltimento di tutto il materiale che è stato in contatto con il virus.
- Piatto 1,75 x 10 5 cellule per piastra da 35 mm di 2,5 ml αMEM 10% e incubare a 37 ° C, 5% CO 2. Piatto una piastra 35 mm Altre al numero di condizioni per contare il numero di cellule prima della trasduzione del virus.
- Crescere le cellule fino al giorno successivo per ottenere una densità cellulare di almeno il 50%. Una densità cellulare di meno di 50% risultati in una significativa diminuzione dell'efficienza virus trasduzione, aumentato variazioni di espressione della proteina per cellula, e aumentata tossicità cellulare.
- Un giorno dopo la placcatura cellule, contare il numero di cellule dal piatto aggiuntivo placcato. Aspiraremedio e lavare una volta con 1 ml di 0,05% tripsina / EDTA. Aggiungere nuovamente 1 ml di 0,05% tripsina / EDTA e incubare a 37 ° C, 5% CO 2 fino a quando tutte le celle sono indipendente. celle separate e con una pipetta 1 ml e contare il numero di cellule per ml.
- Determinare la quantità di virus necessaria per trasdurre una molteplicità di infezione (MOI) di 20-40 unità formanti placca (PFU) della proteina di interesse (POI) per cellula e 0-20 PFU per cellula di un vettore vuoto (ad esempio, LacZ) per avere un totale di 40 PFU per cellula.
- Preparare in una cappa sterile un tubo di plastica da 1,5 ml per ogni condizione e aggiungere 400 ml di αMEM calda 10%.
- Scongelare una aliquota dei virus lentamente su ghiaccio e, se necessario, diluire lo stock di virus per pipettare un volume maggiore di 1 ml per minimizzare errori di pipettamento.
- Aggiungere la quantità di virus calcolato per condizioni di ciascun tubo di plastica da 1,5 ml contenente 400 ml αMEM il 10% e mescolare delicatamente pipettando. ° postoe virus Stock immediatamente torna a -80 ° C per mantenere la sua attività.
- Aspirare il supporto dalle cellule e pipetta delicatamente goccia a goccia il mix di virus. Incubare le cellule a 37 ° C, 5% di CO 2 e agitare le piastre accuratamente sotto la cappa sterile ogni 15 min per 1 ora a coprire anche le cellule con la diluizione virus. Utilizzando una piccola quantità di mezzo facilita il contatto del virus con le cellule.
- Nel frattempo, preparare la miscela di trasfezione di siRNA seguendo il metodo di trasfezione. Se non siRNA è necessario, sostituire la quantità di siRNA per mezzo senza siero per eseguire un trasfezione vuoto.
- Il seguente esempio è dato per una concentrazione siRNA finale di 50 Nm e deve essere adattato per ogni proteina di interesse. Per ogni adenofection, preparare uno 1,5 ml tubo di plastica contenente 416 nM di siRNA in 150 ml di media senza siero (ad esempio, 6,25 ml di 20 mM siRNA + 144 ml di media senza siero) e uno 1,5 ml tubo di plastica containing 6.25 ml cationico reagente di lipidi trasfezione + 144 ml di media senza siero.
- Mescolare il contenuto di ogni tubo di plastica pipettando su e giù parecchie volte con una pipetta 200 microlitri. Combinare il contenuto di entrambe le provette e mescolare pipettando su e giù parecchie volte con una pipetta 200 microlitri. Incubare per 5 minuti a temperatura ambiente.
- Dopo incubazione con il virus, pipettare delicatamente 1,8 ml αMEM 10% di ciascuna piastra per ottenere un volume totale di 2,2 ml e aggiungere immediatamente lentamente goccia a goccia la miscela di trasfezione siRNA per ciascuna piastra e agitare trasversalmente. Trasferire le piastre a 37 ° C, 5% CO 2 per 24 ore.
- Il giorno dopo, ri-piatto le cellule di ogni piatto 35 millimetri in quattro nuove piastre da 35 mm a 2,5 ml αMEM il 10% ciascuno e incubare per altre 24 ore a 37 ° C, 5% di CO 2.
- Il giorno dopo, 48 ore dopo la trasfezione di siRNA e l'infezione del virus, le cellule raccolto da un piatto per ogni condizione per la preparazione diestratti proteici e analisi Western blot per determinare l'efficienza del knockdown e l'espressione della proteina endogena 15.
NOTA: Con i rimanenti piastre, procedere con la fissazione delle cellule, utilizzando il protocollo di scelta e di sottoporre i campioni per l'analisi di immunofluorescenza con gli anticorpi di interesse 14.
5. cellulare immagini dal vivo di cellule mitotiche e analisi dei dati
- Effettuare esperimenti di imaging cellulare dal vivo a breve termine su cellule in mitosi con un microscopio invertito dotato di un / camera di termoregolata umidificata / 5% di CO 2.
NOTA: In questo studio, un microscopio confocale disco rotante (40X, 0,75 NA) è stato utilizzato, dotato di EMCCD raffreddato fotocamera accoppiamento di carica a -50 ° C. - Prima di acquisizione, verificare che la camera ha raggiunto la temperatura appropriata di 37 ° C.
NOTA: Questa operazione potrebbe richiedere diverse ore a seconda del sistema microscopico. - Mettere i piatti della cultura nel MICRcamera di oscope 1 ora prima acquisizione per consentire il corretto equilibrio del mezzo ed evitare attenzione alla deriva a causa di variazioni di temperatura. Monitorare lo stato mitotico delle cellule. A questo punto, il 10-15% delle celle deve essere nelle prime fasi della mitosi (profase-prometafase).
- Durante il tempo di equilibrio, impostare i parametri di acquisizione come determinato in esperimenti precedenti. Tipicamente, un tempo di esposizione per entrambi i canali (488 e 594) di .2-3 sec con una intensità del laser di 100% e una sensibilità di 121-130 sono parametri adatti nelle nostre mani.
NOTA: In primo test dovrebbe essere fatto per determinare l'intensità del laser e l'acquisizione di tempo / intervallo minimo che si traducono in una risoluzione appropriata con photobleaching minima che provoca danni cellulari e perturba la progressione mitotico. - Scegliere diversi campi per condizione di ottenere un numero significativo di cellule per analizzare senza superare l'intervallo di acquisizione. Utilizzando un sistema confocale disco rotante, una configurazione tipica sarà include quattro condizioni differenti, 7 campi per piastra e 2 canali di colore (488 e 594), con un intervallo di 1,5-2 minuti nel corso di un periodo di min-75.
- Scegli cellule che sono al momento dell'ingresso mitotico, re-impostare la messa a fuoco una volta che tutti i campi sono stati scelti e avviare l'acquisizione il più velocemente possibile.
- Monitorare la stabilità del sistema per almeno tre punti di tempo e re-impostare la messa a fuoco, se necessario.
- Dopo il primo cellule vive breve termine di 75 min, nuovi campi di cellule mitotiche possono essere scelti per acquisire una seconda serie di film da aumentare il numero di cellule in corso di analisi.
- Stabilire criteri ben definiti per analizzare i fenotipi di cellule in mitosi, che dipenderanno i marcatori fluorescenti utilizzate. I difetti in mitosi possono includere prolungamento del tempo trascorso in mitosi (dalla ripartizione nucleare fino anaphase), cromosoma disallineamento, mandrino a dondolo, e la corteccia blebbing 14.
6. LifeAct-TagGFP2 Adenovirus di trasduzione in Differentiating C2C12 mioblasti mouse
NOTA: Il protocollo adenofection è applicabile anche ai mioblasti topo C2C12 difficili da infettare sottoposti differenziazione.
- Piastra 2 x 10 5 cellule C2C12 in coltura 35 mm in terreno di crescita in plastica o su un substrato di scelta.
NOTA: la differenziazione delle cellule è migliorata su piatti gelatine- o Matrigel rivestite. Pianificare una piastra aggiuntiva per determinare il numero di cellule prima di trasduzione del virus. - Il giorno seguente, le cellule dovrebbe aver raggiunto l'80% di confluenza. Indurre la differenziazione dei mioblasti lavando le cellule due volte con PBS calda e aggiungendo 2 ml di terreno di differenziamento (DM).
- Il giorno successivo, etichettato come il giorno 1 (D1) di differenziazione, la trasduzione miociti con adenovirus LifeAct-TagGFP2 per visualizzare il citoscheletro di actina in cellule vive. Contare il numero di cellule dalla piastra aggiuntiva come descritto al punto 3.2. Calcolare 5 PFU / cellula di LifeAct-TagGFP2 adenovirus e AdLacZ / cella 45 PFU dopo l'esameple descritto nella Tabella 1. La quantità di virus totale è 50 PFU / cellula. I virus sono stati usati come descritto 14
- Preparare in una cappa sterile, un tubo di plastica da 1,5 ml per ogni condizione e aggiungere 400 ml di DM caldo.
- Scongelare una aliquota dei virus lentamente su ghiaccio e, se necessario, diluire lo stock di virus per pipettare un volume maggiore di 1 ml per minimizzare errori di pipettamento.
- Aggiungere la giusta quantità di particelle virali per condizione di ciascun tubo di plastica da 1,5 ml contenente 400 ml di DM e mescolare delicatamente pipettando. Posizionare lo stock di virus subito di nuovo a -80 ° C per mantenere la sua attività.
- Aspirare il supporto dai piatti e pipetta delicatamente goccia a goccia il mix di virus. Incubare le cellule a 37 ° C, 5% di CO 2 e agitare le piastre accuratamente sotto la cappa sterile ogni 15 min per un totale di 1 ora a coprire anche le cellule con il virus.
- Dopo l'incubazione, pipettare delicatamente 1,6 ml di DM su ogni piatto e continuare l'incubation per un ulteriore 2 ore a 37 ° C, 5% di CO 2.
- Nel frattempo, preparare una miscela di trasfezione vuoto seguendo il metodo di trasfezione CAPI. Calcola 200 mix microlitri per ogni condizione. Utilizzare il seguente esempio per un volume totale di 400 ml mix.
- In un tubo di plastica da 1,5 ml, pipetta 50 ml 1 M CaCl 2 in 150 ml di H 2 O sterile e mescolare nel vortex. Dopo un rapido giro, aggiungere con cautela goccia a goccia 200 ml HBS2x (280 mM NaCl, 50 mM HEPES, 1,5 mm Na 2 HPO 4, pH 7,01-7,05). Mescolare delicatamente con iniezione di aria per tre volte con una pipetta 200 ml.
- Incubare la miscela per 30 minuti a RT. Aggiungere lentamente goccia a goccia 200 ml di mix trasfezione di ogni piatto e agitare trasversalmente. Trasferire le piastre a 37 ° C, 5% CO 2 per 16 ore.
- Il giorno dopo, lavare le cellule due volte con 2 ml HEPES calde (6,7 mM KCl, 150 mM NaCl, 10 mM HEPES, pH 7.3) e aggiungere 2 ml di DM. Visualizza la infeefficienza ction sotto un microscopio a fluorescenza invertito ad un ingrandimento di 20-40x (aria) e acquisire tre immagini rappresentative per condizione in entrambi i canali fluorescenti e trasmissione di documentazione.
- A seconda della configurazione dell'esperimento desiderato, seguire la differenziazione in miotubi per diversi giorni. Le cellule possono essere fissati e successivamente sottoposti ad analisi di immunofluorescenza o studi di imaging cellulare dal vivo può essere eseguita.
Risultati
Trasfezione di BAG3-GFP DNA plasmidico utilizzando lipidi cationici è stata associata con l'espressione eterogenea in cellule HeLa, alcune cellule mostrano livelli malapena rilevabili di proteine e altri cuscinetti livelli molto elevati BAG3 (Figura 2A). In queste cellule, perdita dell'omeostasi proteina è stata evidenziata da accumulo di BAG3-GFP in aggregati perinucleare (Figura 2A, frecce). Al contrario, la trasduzione delle cellule con adenovirus che trasportano BAG3-GFP esposto più omogenea bassa espressione e la localizzazione accurata di BAG3-GFP (Figura 2B, l'infezione da solo). Sorprendentemente, l'aggiunta di lipidi cationici durante adenovirus trasduzione (cioè, trasfezione di particelle di adenovirus) significativamente aumentato BAG3-GFP espressione per cella a simili MOI, mentre permesso mantenendo espressione omogenea nella maggior parte delle cellule (Figura 2B, Adenofection).
Adenofection permesso efficiente esaurimento delle BAG3 endogena e la reintroduzione delle proteine BAG3-GFP ai livelli endogeni vicino, sia utilizzando CAPI condensati o composti a base di liposomi per aumentare l'efficienza di trasduzione-trasfezione in cellule HeLa. La Figura 3 mostra un tipico esperimento con il tipo BAG3 selvatico (WT) GFP o BAG3 (IPV) GFP variante recanti mutazioni che abolire legame ad uno dei suoi partner chaperone HSPB8 (Figura 3A, 3B). Coerentemente con un ruolo per BAG3 nella stabilizzazione di HSPB8 7, silenziamento di BAG3 ha portato ad una diminuzione del ~ 50% dei livelli di HSPB8, che è stato restaurato a livelli normali dopo la reintroduzione di BAG3 WT, ma non da espressione di simili livelli di mutante di BAG3 (IPV)-GFP o di GFP da solo. In queste condizioni, proteine BAG3-GFP sono stati opportunamente localizzati all'interno ~ 75-90% delle cellule, essendo arricchite in corrispondenza delle zone perinucleare-centrosomica (Figura 3C, 3D). Questo Suggressata che adenofection conservato le dinamiche di BAG3 e del complesso BAG3-HSPB8 nelle cellule.
HSPB8 e BAG3 sono sovraregolati da varie sollecitazioni proteotoxic che perturbano anche proteostasis citoscheletro 10. Di qui l'iperespressione delle accompagnatori può potenzialmente disturbare la catena di montaggio smontaggio delle strutture macromolecolari controllo morfodinamica cellulari. Al fine di valutare il ruolo di BAG3-HSPB8 in condizioni di non-ha sottolineato, è stato importante verificare che l'omeostasi delle proteine è stata minimamente turbato dalla procedura adenofection. A tal fine, il monitoraggio variazioni dei livelli di chaperone della famiglia di proteine da shock termico è una buona indicazione dello stato di omeostasi proteine. Come mostrato in Figura 4, adenofection dal CAPI o metodi non ha aumentato in modo significativo i livelli di HSPB8 endogeno e BAG3, o quella del principale sistema chaperone HSP70 / HSPA1 liposomi-based. Al contrario, tipicotrattamenti proteotoxic come shock termico o MG132, un inibitore del proteasoma, un aumento dei livelli delle proteine chaperone-cochaperone in cellule HeLa.
Abbiamo quindi cercato di determinare se la procedura adenofection combinato con baculovirus espressione di sonde fluorescenti actina e tubulina (BacMam-RFP-actina e GFP-αtubulin) guida era adatto per il monitoraggio delle dinamiche cellulari mitotiche. Come mostrato in Figura 5, adenofection di cellule HeLa con un controllo siRNA (siCTL) non disturbare la dinamica mitotico mandrini (verde) o il tempo medio trascorso in mitosi (figura 5a, confocale rappresentante time-lapse sequenze). La proporzione di queste cellule mostrano anomale eventi mitotico era in linea con i livelli di difetti mitotici generalmente osservati in linee cellulari di cancro (~ 30% -40%, Figura 5B). Al contrario, le cellule adenofected con la sola specifici siRNA-BAG3 (siBAG3) espone una ~ aumento di 2 volte nel level di difetti fenotipici mitosi, che è stato restaurato per vicino al livello di cellule di controllo da BAG3-GFP (WT), ma non da sola GFP. Questo convalidato l'idoneità di adenofection per l'analisi funzionale dell'impatto delle BAG3 e dei suoi accompagnatori associati sulle dinamiche del citoscheletro che regolano la corretta progressione delle cellule dentro e fuori della mitosi, come mostrato da Fuchs et al 14.
Per verificare la versatilità del metodo adenofection, abbiamo poi adattato il protocollo per consentire la visualizzazione di F-actina durante la differenziazione dei miociti topo C2C12, usando l'commercialmente disponibile adenovirus-LifeAct-GFP per etichettare F-actina 16. cellule C2C12 sono state indotte a differenziarsi per un giorno prima Adenofection. Utilizzando il protocollo adenofection CAPI-based, notevolmente basse quantità di Adenovirus-LifeAct-GFP bastavano per esprimere la sonda ad un livello che è stato facilmente individuato mediante microscopia a fluorescenza in una percentuale significativa di differe ntiating miociti (~ 3-5 PFU / cellula; Figura 6). Ciò era in netto contrasto con l'altissimo molteplicità di infezione riportata in letteratura per trasdurre cellule di topo C2C12 (dell'ordine di 250-400 MOI) 17-19. Inoltre, attraverso il monitoraggio del processo di differenziazione per 7 giorni, abbiamo stabilito che myotube la formazione non era significativamente compromessa dalla procedura. Questo suggerisce che la fusione dei miociti, un processo che si basa su dinamiche di actina finemente sintonizzato 20, non è stato turbato da espressione di bassi livelli di LifeAct-GFP (Figura 6, Giorno 6 e 7 ° giorno). Dal momento che il marcatore fluorescente può ancora essere rilevato molti giorni dopo adenofection di cellule C2C12, riteniamo che questo metodo sarà adatto per le analisi funzionali della impatto di accompagnatori sulle dinamiche di actina in diverse fasi della C2C12 miogenesi.

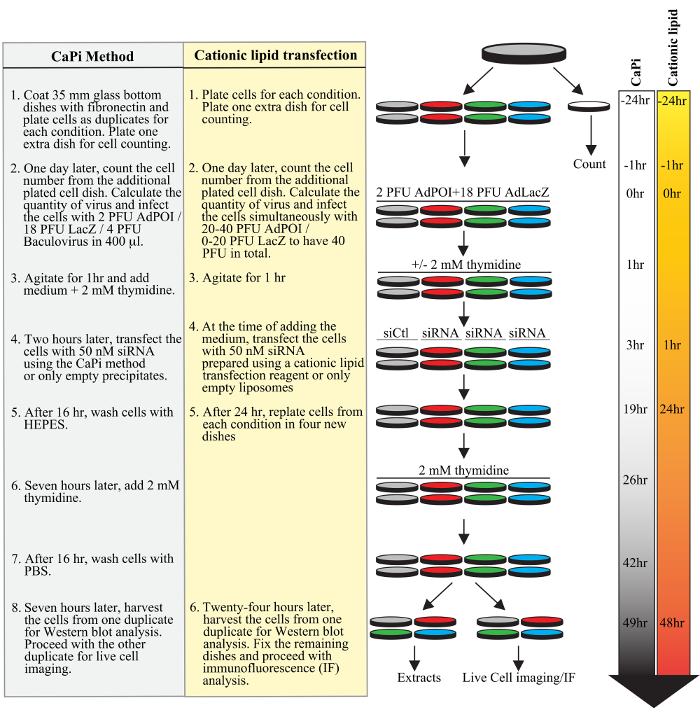
Figura 1. Progettazione di un tipico protocollo adenofection. Fasi successive di un tipico esperimento sono mostrati per il protocollo utilizzando precipitati CAPI (sottolineato in grigio) o il protocollo utilizzando un reagente cationico lipidi trasfezione (evidenziato in giallo), compresa la placcatura cellulare, la trasduzione di trasfezione adeno e baculoviruses, di duplex siRNA, e la sincronizzazione delle cellule con un blocco doppio timidina. linee orario a ore per entrambi i protocolli vengono mostrati sul lato destro della figura.fig1large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
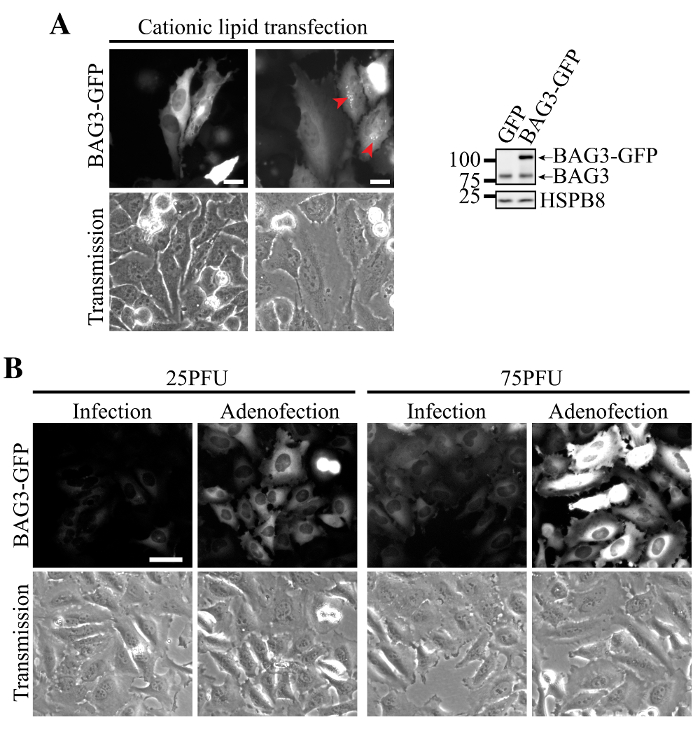
Figura 2. espressione omogenea ed efficiente di BAG3-GFP usando Adenofection. (A) immagini epifluorescenza rappresentativi di cellule HeLa che era stato trasfettate con il DNA plasmide BAG3-GFP, mostrando aggregati perinucleari della proteina ad alti livelli di espressione (designati dalle frecce) e l'espressione eterogenea all'interno della popolazione di cellule. Western blot mostrano più alta espressione di BAG3-GFP rispetto ai livelli endogeni BAG3 nella popolazione complessiva di cellule, indicando che la proteina è in gran parte sovraespressa in alcune cellule. (B) le immagini epifluorescenza rappresentativi di cellule HeLa che erano state trasdotte solo o adenofected usando crescenti quantità di particelle del virus Ad-BAG3-GFP. immaginisono stati acquisiti utilizzando parametri identici e sono stati ugualmente trattati per sottrazione dello sfondo e l'intensità; Bar:. 50 micron Clicca qui per vedere una versione più grande di questa figura.

Figura 3. atterramento efficiente di BAG3 e la reintroduzione delle proteine BAG3-GFP ai livelli endogeni vicino. Cellule (AB) HeLa che esprimono RFP-H2B (A) o cellule HeLa parentali (B) sono stati adenofected con i siRNA indicati e adenovirus ricombinanti utilizzando il CAPI metodo (A) o composti a base di liposomi come trasfezione reagente (B). Le cellule sono state sincronizzate con il metodo doppio blocco timidina e estratti cellulari totali sono stati preparati durante la seconda fase di rilascio. Weste Macchie rn mostrano livelli di BAG3 esaurimento (BAG3 endogeni), i livelli di proteine BAG3-GFP adenofected, e livelli endogeni di HSPB8; livelli GAPDH: controllo di carico. L'esaurimento è stato stimato a> 75% caricando decrescenti quantità di estratti di controllo (adenofected con il controllo siRNA-siCtl e BAG3-GFP WT, vale a dire, ½, ¼). Si noti che le singole proteine BAG3-GFP sono stati introdotti in prossimità del livello endogeno di BAG3 e che wild type BAG3-GFP, ma non BAG3 (IPV)-GFP o GFP da solo, ripristinati i livelli HSPB8 nelle cellule BAG3-impoverito. (CD) immagini epifluorescenza rappresentativi di cellule HeLa che erano stati adenofected con l'indicato ricombinante Ad-BAG3-GFP utilizzando CAPI o cationico reagente lipidi trasfezione. Bar: 20 micron. Risultati rappresentativi mostrati in (A) e (C) vengono modificati da Fuchs et al., PLoS Genet. 23 ottobre 2015; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14.iles / ftp_upload / 54557 / 54557fig3large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 4. Adenofection non induce una risposta allo stress in cellule HeLa Western blot di estratti cellulari totali ottenuti da cellule HeLa controllo. (NT: non trattata) o cellule HeLa trasfettate con il solo siRNA di controllo (siCtl, senza adenovirus), o adenofected con siCtl e ad-GFP utilizzando CAPI o cationico lipidi del reagente di trasfezione, o da cellule HeLa sottoposte a trattamenti proteotoxic tipici (HS: shock termico a 44 ° C per 60 min seguita da 16 recupero hr a 37 ° C; MG132: inibitore del proteasoma, 5 mM per 16 ore), che mostra i livelli di BAG3, HSPB8 e di altri accompagnatori di stress-inducibile, vale a dire HSP70 / HSPA / e HSP27 / HSPB1; GAPDH: Controllo delle sollecitazioni. Si noti che mentre i livelli di tutte proproteine tranne GAPDH sono stati aumentati su trattamenti di stress proteotoxic, sono rimasti invariati per adenofection. Variazioni di livello di proteina sono stati valutati caricando quantità variabili di estratti cellulari SA che portano gli aumenti tipici di HSP. (HS: 1, ½, ¼, ⅛, per esempio, HSP70 è stata indotta da più di 8 volte in risposta a proteotoxic stress) Si prega di clicca qui per vedere una versione più grande di questa figura.
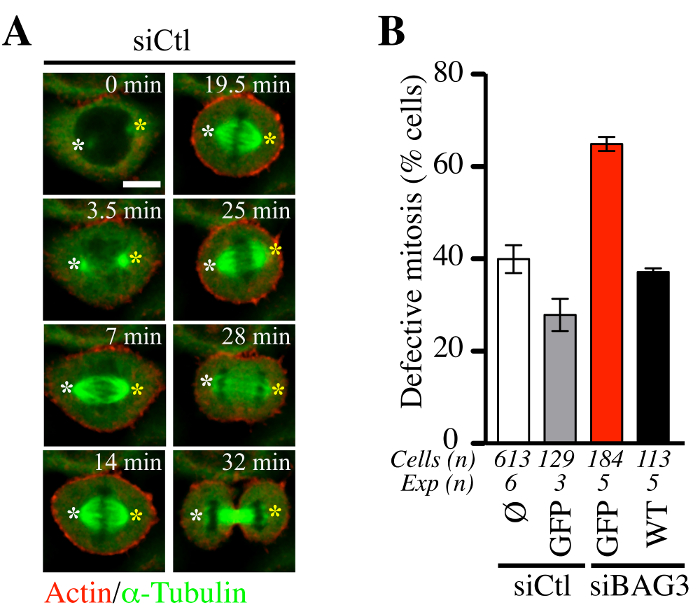
Figura 5. La progressione della HeLa cellule attraverso mitosi non è significativamente disturbati dalla Adenofection. (A) Rappresentante confocale sequenze time-lapse da cellule HeLa che era stato adenofected con un controllo siRNA (siCtl) insieme a BacMam- GFP-α-tubulina e BacMam -RFP-actina e ripreso dal disco rotante microsco confocalepy per 60 a 90 min a ~ 1,5 min intervalli. Bianco e giallo asterischi indicano la posizione dei poli del fuso che è rimasto relativamente stabile. Bar: 10 micron. (B) Quantificazione delle cellule adenofected con siCtl o specifici siRNA-BAG3, con o senza le proteine GFP indicati (GFP da solo o wild type BAG3-GFP: WT). Il grafico indica la percentuale di cellule con mitosi anomale definito come mandrino a dondolo e in fase di stallo in mitosi +/- o cromosoma disallineamento. Indicato sono i mezzi +/- SE. Risultati rappresentativi mostrati in (B) sono state prese da Fuchs et al., PLoS Genet. 23 ottobre 2015; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14. Cliccate qui per vedere una versione più grande di questa figura. Clicca qui per visualizzare il filmato associato con pannello (A).

Figura 6. Adenofection dei miociti C2C12 con Ad-LifeAct-GFP e la formazione myotube. Immagini epifluorescenza rappresentativi di cellule C2C12 che erano state indotte a differenziare e trattati per adenofection 1 giorno dopo usando 5 PFU / cellula di LifeAct-GFP e 45 PFU / cellula di LacZ. Le immagini mostrano l'espressione del marcatore GFP durante il processo di differenziazione (Day 2, Day 6 e 7 ° giorno). Bar:. 20 micron Clicca qui per vedere una versione più grande di questa figura.
Discussione
Qui, abbiamo descritto un metodo che consenta esperimenti svuotamento soccorso da eseguire, che è applicabile ad analisi funzionali dei processi cellulari biologici che sono particolarmente sensibili alla sovraespressione di proteine che interessano la stechiometria e la dinamica di complessi proteici e strutture macromolecolari. la divisione cellulare mitotico è un esempio estremo di morfodinamica cellulari finemente sintonizzato che coinvolge i cambiamenti più drammatici e spettacolari nella struttura generale di una cella. Utilizzando adenofection combinato con reagenti BacMam disponibili in commercio per introdurre piccole quantità, ma rilevabili di marker di actina e tubulina per l'imaging cellulare, il contributo del chaperone complesso BAG3-HSPB8 alla corretta rimodellamento cellulare mitotico potrebbe essere chiaramente dimostrata. In un recente studio condotto da Fuchs et al., Abbiamo dimostrato che la deplezione di BAG3 provoca difetti di orientamento del mandrino che sono legati a una incapacità di stabilire una rigida corteccia mitotico actina ei montaggi ricchi di actinafibre di retrazione 14. dinamiche mandrino adeguate potrebbero essere ripristinati per la reintroduzione di tipo selvaggio BAG3-GFP, che ha anche corretto il calo visto in livelli HSPB8 su BAG3 silenziamento. Ciò implica che adenofection consente il recupero di un complesso chaperone fisiologicamente rilevanti che si correla con recupero funzionale del mandrino dinamiche.
Uso di adenofection per esperimenti svuotamento salvataggio fornisce un vantaggio rispetto plasmide trasfezione DNA o nucleofection, che può provocare un'induzione potente di una risposta allo stress in alcuni tipi di cellule (ad esempio, autofagia) 21, rendendo praticamente impossibile analizzare l'impatto di un data chaperone e il suo ruolo fisiologico. Infatti, nella nostra mano, trasfezione di DNA plasmidico BAG3 è associata con alta espressione per cella, la formazione di aggregati ed effetti su di apoptosi / sopravvivenza in diversi tipi di cellule (Figura 2). BAG3 è un cochaperone modulare con l'attività impalcatura, che may giocare più ruoli a seconda delle sue proteine partner 9. Quindi, perturbazioni di stechiometria complesso dal sovraespressione di BAG3 possono avere indesiderati effetti negativi dominanti e indurre tossicità. Alta capacità adenovirus ricombinante è un veicolo ideale per la consegna transitoria e la sicurezza dei grandi geni sia divisione e non dividendo le cellule in coltura in quanto non si integra nel genoma della cellula ospite, in contrasto con vettori lentivirali-based per cui alcuni sicurezza le preoccupazioni restano. Potenziale svantaggio dell'uso di adenovirus per esperimenti svuotamento salvataggio è che essi richiedono ripetute preparazione, che può richiedere molto tempo. Essi si basano anche su un'attenta titolazione di particelle infettive per l'efficacia di trasduzione riproducibile.
Utilizzando adenofection per schermare il contributo del noto BAG3 domini funzionali, abbiamo ottenuto la prima prova, a nostra conoscenza, per l'esistenza di una funzione di BAG3 HSPB8-dipendente per il normale funzionamentodi divisione delle cellule che non richiede la sua interazione con il sistema chaperone HSP70 / HSPA1. Adenofection dovrebbe essere applicabile per monitorare F-actina durante il processo di differenziazione dei miociti in miotubi, come suggerito dai dati qui presentati. Così il nostro metodo fornisce un protocollo versatile ed efficiente per gli esperimenti di deplezione-salvataggio siRNA-based con il minimo impatto sulla morfodinamica cellulari che dovrebbero essere utili in una vasta gamma di progetti in cui si persegue l'analisi struttura-funzione di un gene di interesse.
Sfruttando cationici composti-lipidi per conseguire efficienza trasfezione-trasduzione di cellule con la minima quantità di particelle virali è la chiave di questo metodo. Mentre fornisce una finestra più grande per il controllo dei livelli di proteine esogene per cella, riteniamo che permette ulteriormente riducendo al minimo i potenziali effetti collaterali sulla trasduzione del segnale che derivano da cellule adenovirus vincolante-entry, che dovrebbe mitigare l'impatto di aprotein di interesse sui percorsi morfogenetici.
Va notato che i diversi reagenti per aumentare l'efficienza di trasduzione adenovirus sono disponibili in commercio, come il booster recettore CAR. Tali reagenti sono costosi, tuttavia, e dovrebbero promuovere virus vincolante-entrata in cellule in un modo che richiede il recettore CAR, che, come detto sopra è stato dimostrato per attivare percorsi associati forma delle cellule e l'adesione segnalazione. Mentre CAPI è conveniente che i liposomi cationici come mezzo per potenziare entrata adenovirus attraverso una via CAR indipendente, è anche più tossico per alcune linee cellulari. Si consiglia di effettuare una prova di una adenofection vuoto per orientare la scelta tra CAPI vs reagente cationico lipidi, a seconda della linea cellulare utilizzata e la lettura biologica di interesse.
approcci atterramento-salvataggio insieme a nuovi strumenti biotecnologici di editing del genoma, basati su RNA interference, come quello descritto qui offrono un array di potenti strumenti molecolari per scoprire la funzione del gene nelle cellule, che ora possono essere scelti in modo ottimale dagli investigatori a seconda delle applicazioni specifiche 3. Riteniamo che adenofection fornisce un sistema relativamente semplice e veloce per creare abbattimenti hypomorphic per la struttura-funzione analizza il contributo di una proteina di interesse in diversi ambiti cellulari.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Materiali
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
Riferimenti
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462(2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889(2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141(2011).
- Guilbert, S. M., et al. The Big Book of Small Heat Shock Proteins. Tanguay, R. M., Hightower, L. E. , Springer International Publishing AG. 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582(2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294(2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2(2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon