Method Article
Adenofection: Un método para estudiar el papel de las chaperonas moleculares en Morfodinámica celular mediante experimentos de reducción-Rescate
En este artículo
Resumen
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Resumen
Los procesos celulares tales como la mitosis y la diferenciación celular se rigen por los cambios en la forma celular que en gran parte dependen de la remodelación correcta de las estructuras del citoesqueleto celular. Esto implica el ensamblaje de desmontaje de estructuras macromoleculares de orden superior en un momento y lugar determinado, un proceso que es particularmente sensible a las perturbaciones causadas por la sobreexpresión de proteínas. Métodos que pueden preservar la homeostasis de proteína y mantener la morfología celular-near-a la normalidad son altamente deseables para determinar la contribución funcional de una proteína de interés en una amplia gama de procesos celulares. agotamiento de los experimentos de rescate transitorios en base a la interferencia de ARN son poderosos enfoques para analizar funciones de las proteínas y los requisitos estructurales. Sin embargo, la reintroducción de la proteína diana con una desviación mínima respecto a su nivel fisiológico es un verdadero reto. Aquí se describe un método denominado adenofection que fue desarrollado para estudiar el papel de las chaperonas moleculares de unasocios d en el funcionamiento normal de las células en división y la relación con la remodelación de la actina. Las células HeLa se agotan de BAG3 con dúplex siRNA dirigidos a la región 3'UTR. proteínas BAG3 GFP-etiquetados se volvieron a introducir simultáneamente en> 75% de las células utilizando adenovirus recombinantes acoplados a los reactivos de transfección. Adenofection permitió expresar proteínas BAG3-GFP en niveles fisiológicos cerca en células HeLa agotado de BAG3, en ausencia de una respuesta de estrés. No se observó efecto sobre los niveles de proteína de choque térmico chaperones endógenos, los principales reguladores inducibles por estrés de la homeostasis de la proteína. Además, mediante la adición de baculovirus que determinan la expresión de los marcadores fluorescentes en el momento de la transducción de células de la transfección, se podría disecar la dinámica celular mitótico por microscópico de lapso de tiempo analiza con perturbación mínima de la progresión mitótica normal. Adenofection es aplicable también a las células de ratón difíciles de infectar, y adecuado para el análisis funcional de diff de mioblastoserentiation en miotubos. Por lo tanto adenofection proporciona un método versátil para llevar a cabo análisis de estructura-función de las proteínas implicadas en los procesos biológicos sensibles que dependen de la dinámica del citoesqueleto de orden superior.
Introducción
inactivación funcional de la expresión génica en células de mamífero es el estándar de oro para diseccionar funciones de la proteína. Tecnologías de edición genoma basado en el uso de nucleasas específicas de sitio, tales como nucleasas de dedos de zinc recién desarrollados y agrupados espaciadas regularmente repeticiones palindrómicas cortas (de CRISPR) / CAS9 permiten ahora la generación de líneas celulares con deleción génica dirigida y la mutación 1,2. Estos nuevos enfoques deben revolucionar la forma en que estamos estudiando la función de proteínas y nuestra comprensión de la genética de las enfermedades humanas. En algunos casos, sin embargo, a largo plazo o completa eliminación de genes no es deseable y puede provocar mecanismos de compensación de células secundarias. La generación de líneas celulares modificadas genéticamente también puede ser limitante cuando se trata de cultivos de células primarias con capacidad de proliferación limitada, o cuando se solicita la proyección de un gran conjunto de mutaciones en diversos tipos de células. Esto a menudo se requiere para la determinación de la dependencia de una célula bproceso iológica en los requisitos estructurales de una proteína. A tal fin, desmontables reversible por la interferencia de ARN que permite experimentos de reducción de rescate transitorios de diversos orígenes celulares sigue siendo un enfoque sencillo y de gran alcance para realizar análisis de estructura-función de una proteína de interés 3. Sin embargo, un importante inconveniente de este enfoque es la dificultad para conseguir el silenciamiento eficiente y de volver a introducir la proteína de interés o sus variantes a niveles fisiológicos cerca en una mayoría de la población celular. Esto es crucial para permitir estudios exhaustivos que intento de correlacionar los efectos funcionales observados a nivel de células individuales (fenotipo hypomorphic) con los observados en los ensayos basados en la población de células, por ejemplo en las interacciones proteína-proteína.
El uso de métodos de transfección clásicos, difícilmente se puede lograr la expresión homogénea y baja de proteínas exógenas en una gran población de células. Transducción de células con virus recombinantescomo adenovirus menudo permite la expresión más normalizada de proteínas exógenas. Sin embargo, la absorción de adenovirus está limitada por el receptor CAR, que está ausente en células no humanas o sólo se expresa débilmente en algunos tipos de células humanas. Además, la entrada celular de adenovirus activa las vías que regulan la forma celular y la adhesión 4-6 señalización. Esto obviamente no es deseable cuando el estudio de los mecanismos de regulación de la morfodinámica de células. Estábamos frente a esta problemática cuando se realizó el análisis funcional de un complejo chaperona, BAG3-HSPB8, en la división celular y la dinámica de la actina. Los trabajos pioneros había descrito un papel de este complejo chaperona en el control de calidad de las proteínas y la autofagia durante el estrés 7,8. La mayoría de estos estudios, sin embargo, se basó en sobreexpresión de la proteína, en el supuesto de que las chaperonas normalmente están regulados por incremento durante el estrés. Esto ha dejado abierta la cuestión de si BAG3, en complejo con HSPB8, puede contribuir al funcionamiento normal de las células en división que expresan THchaperones ESE como muchos tipos de células cancerosas 9. En particular, si el complejo chaperona contribuye a la remodelación de las estructuras basadas en actina que controlan la progresión mitótico fue de gran interés, dadas las conexiones emergentes entre las chaperonas hspB y la dinámica del citoesqueleto 10. Para hacer frente a este problema, que estábamos buscando para desarrollar un método eficiente para los experimentos de depleción de rescate que no interfiera con la progresión mitótico o la morfología celular, y que preserve la homeostasis de proteínas para evitar la perturbación secundaria de la dinámica de complejos macromoleculares regular los cambios de células con forma de . Por lo tanto idealmente, el agotamiento-complemento posterior de el gen de interés se debe realizar de forma simultánea.
El uso de complejos de adenovirus con un polímero catiónico o lípidos se ha descrito para promover la transferencia de genes in vitro e in vivo 11,12. Por ejemplo, fosfato de calcio (CAPI) aparece para formar un precipitado conadenovirus que mejoran la unión del virus a entrar a través de una vía independiente CAR-13. De hecho, encontramos que la combinación de la transducción de células a base de adenovirus y la transfección con compuestos catiónicos podría mejorar la eficiencia de los experimentos de reducción de rescate. Esto nos permitió bajar las cantidades de virus por de 3 a 20 veces, dependiendo de la línea celular y el gen de interés, y se benefician de una ventana más amplia con el fin de ajustar la expresión de proteínas exógenas en los niveles endógenos en cerca de la mayoría de una población celular de interés con el mínimo impacto en la morfología celular. Bajo tales condiciones, también podríamos lograr una alta caída eficacia de la expresión endógena de proteínas (> 75%). Por la presente se describe el método paso a paso y aportar pruebas de que la homeostasis de proteínas no es perturbado significativamente según la evaluación de los niveles constantes de los chaperones inducidos por el estrés de la familia de proteínas de choque térmico, por lo que el método adecuado para el análisis funcional de la ro fisiológicol de chaperonas moleculares mediante microscopía de vídeo de lapso de tiempo. El protocolo es susceptible de procedimientos de sincronización celular y a la utilización de baculovirus disponibles en el mercado para la co-expresión de los bajos niveles de los marcadores fluorescentes, con un mínimo de interferencia con la dinámica basada en actina y normal del huso durante la progresión mitótica. Además, muestran la versatilidad del método, que es aplicable a "duro" para la transducción de células C2C12 de ratón, sin impacto significativo sobre la diferenciación de mioblastos en miotubos in vitro.
Protocolo
1. Preparación del medio y las soluciones (todo esterilizada por filtración)
- Células de músculo de ratón C2C12 (estudios de diferenciación)
- Preparar 500 ml de medio de crecimiento para C2C12 mantenimiento de cultivo celular: DMEM de alta glucosa suplementado con 10% FBS y 2 mM de L-glutamina.
- Preparar 100 ml medio de diferenciación (DM) para la diferenciación de C2C12: DMEM de alta glucosa suplementado con 2% de suero de caballo.
- Células HeLa (estudios en células mitóticas)
- Preparar 500 ml aMEM para HeLa RFP-H2B mantenimiento y experimentos de cultivo de células: aMEM suplementado con FBS 10% y 2 mM L-glutamina (aMEM 10%).
- Preparar 500 ml aMEM-menos (sin desoxirribonucleósidos / ribonucleósidos) para HeLa sincronización celular RFP-H2B: aMEM-menos suplementado con 10% FBS y 2 mM L-glutamina (aMEM-menos 10%).
- Preparar 20 ml aMEM sin rojo fenol para HeLa-RFP-H2B live adquisición celular: aMEM sin rojo fenol suplementado con FBS 10% y 2 mM L-glutamina.
- Preparar timidina 100 mM: disolver 24,2 mg en 1 ml de H2O a 37 ° C por agitación. Filtro de esterilizar y mantener a 4 ° C.
- Las soluciones comunes
- Preparar 0,05% de tripsina / EDTA: 0,05% de tripsina, EDTA 0,625 mM en solución salina tamponada con fosfato 1x (PBS). Filtro de esterilizar y almacenar alícuotas a -20 ° C. Una vez descongelado, mantenga alícuota a 4 ° C.
- Preparar HBS2x: NaCl 280 mM, HEPES 50 mM, 1,5 mM Na 2 HPO 4. Ajustar el pH entre 7.1 a 7.5 exactamente con NaOH 10 N. Filtro estéril y mantener a 4 ° C.
2. Recubrimiento de las placas de cultivo celular con fibronectina y Chapado de células HeLa-RFP-H2B
NOTA: Antes del experimento, cada manipulador debe establecer las condiciones óptimas de chapado de células para conseguir una densidad adecuada de las células ya que las variaciones pueden OCcur entre cada manipulador y cada línea celular diferente.
- El día antes del experimento, las células HeLa expanda-RFP-H2B para asegurarse de que están dentro de la fase exponencial de crecimiento en el día de la siembra. Hacer 2 1/3 sucesivas diluciones en placas de 10 cm a partir de una placa de 1x10 cm confluente 80%.
NOTA: Planificar el número de placas para el experimento. Calcula cada condición como duplicados, uno para formación de imágenes en vivo de células a corto plazo y uno para la proteína de los extractos para determinar la eficacia de la caída y expresión de la proteína exógena mediante análisis de transferencia Western. Planificar una placa adicional para determinar el número de células antes de la transducción de virus. - Antes de la célula de recubrimiento, platos de fondo de cristal abrigo con 10 mg / ml de fibronectina. Añadir 1 ml de una dilución 1: 100 de 1 mg / ml de fibronectina (diluido en PBS estéril 1x) por 35 mm plato para así cubrir toda la superficie y se incuba durante 1 hora a 37 ° C, 5% de CO 2.
- Durante la incubación, aMEM pre-calentamiento complementado wiTH 10% de FBS (aMEM 10%) y 0,05% de tripsina / EDTA a 37 ° C.
- Después de 45 min de incubación, comenzar a preparar la solución de células. En la campana estéril, aspirar el medio de una placa de 10 cm, lavar suavemente dos veces con 1,5 ml de tripsina al 0,05% / EDTA, y dejar 0,5 ml de tripsina / EDTA a la última aspiración.
- Se incuban las células durante 2-3 min a 37 ° C, 5% de CO 2. Golpeando suavemente la placa y la observación bajo el microscopio, verifique que todas las células se hayan separado. Añadir 10 ml de aMEM 10% y de pipeta suavemente varias veces para separar las células. Contar una muestra de 10 l de la suspensión celular utilizando un hemocitómetro.
- solución de fibronectina aspirado de las placas de fondo de cristal. No permita que la fibronectina se seque antes de chapado celular.
- Plate 1.5x10 5 células por placa de 35 mm en 2 ml aMEM 10% y se incuba a 37 ° C, 5% de CO 2. Verificar después de 30 a 45 minutos bajo el microscopio que las células son bien SEPAclasificar, ya que tienen la tendencia a acumularse en el centro de la placa.
- Si fuera necesario, agitando suavemente las placas en sentido transversal para redistribuir las células. Plate uno 35 mm placa adicional para el número de condiciones con el fin de contar el número de células antes de la transducción de virus.
- Se cultivan las células hasta el día siguiente para lograr una densidad de células de al menos 50%. A menor densidad celular de 50% resulta en una disminución significativa de la eficiencia de transducción de virus, el aumento de las variaciones de la expresión de proteína por célula, y el aumento de la toxicidad celular.
NOTA: El recubrimiento de los platos de cristal con fibronectina mejora el crecimiento celular y la morfología y promueve la progresión adecuada de células a través de la mitosis. Por lo general, se puede sustituir por gelatina comercialmente disponible que es más barato.
3. Adenovirus Transducción y proteína endógena Knockdown de siRNA transfección en células HeLa-RFP-H2B Usando CAPI precipitados
¡Precaución! Trabajoción con los virus requiere precauciones especiales y una disposición adecuada de todo el material que ha estado en contacto con el virus.
¡Atención! En nuestras manos, CAPI precipita a menudo tienen efectos más indeseables, por ejemplo, en los procesos biológicos relacionados con el tráfico de vesículas (por ejemplo, la autofagia). Por consiguiente, se recomienda el uso de un reactivo de transfección de lípidos catiónicos (ver abajo) y esperar al menos 48 horas antes de los análisis.
NOTA: Un adenovirus de control que lleva un gen no relacionado (es decir, LacZ) o ningún gen se utiliza para llegar a un MOI mínimas en todos los Adenofections (10-20 pfu / célula), utilizando la menor cantidad de adenovirus recombinante que lleva el gen de interés.
NOTA: Este procedimiento se ha demostrado que ayuda a normalizar la expresión por célula en una población de células grandes.
- Un día después de la siembra de células, contar el número de células de la placa de chapado adicional. Aspirar el medio yenjuagar una vez con 1 ml 0,05% de tripsina / EDTA. Añadir de nuevo 1 ml de 0,05% de tripsina / EDTA y se incuba a 37 ° C, 5% de CO 2 hasta que todas las células se han separado. Se separan las células bien con una pipeta de 1 ml y contar el número de células por ml utilizando un hemocitómetro.
- Determinar la cantidad de virus necesaria para la transducción de células a una multiplicidad de infección (MOI) de 2 unidades formadoras de placa (UFP) de la proteína de interés (POI) por célula y 18 PFU por célula de un vector vacío (por ejemplo, LacZ) para tener un total de 20 PFU por célula. Al mismo tiempo transducir 4 PFU de cada uno de baculovirus (actina y αTubulin, GFP y RFP-etiquetados respectivamente). Transducir las células utilizando el siguiente protocolo adenofection. Se utilizaron los virus como se describe en Fuchs et al. 14
- Preparar en una campana estéril un tubo de plástico 1,5 ml para cada condición y añadir 400 l de tibia aMEM-menos 10%.
- Descongelar una alícuota de los virus lentamente en hielo y, si es necesario, diluir tél stock de virus con el fin de pipeta un volumen superior a 1 l de reducir al mínimo los errores de pipeteo.
- Añadir la cantidad de virus calculado por condición a cada tubo de plástico de 1,5 ml que contenía 400 aMEM-menos l 10% y mezclar suavemente con la pipeta. Coloque la solución madre de virus inmediatamente de nuevo a -80 ° C para mantener su actividad.
- Aspirar el medio de las células y pipetear suavemente la mezcla de virus gota a gota. Se incuban las células a 37 ° C, 5% de CO 2 y agitar las placas cuidadosamente bajo la campana estéril cada 15 min durante 1 hora para cubrir así las células con el virus. El uso de una pequeña cantidad de medio facilita el contacto del virus con las células.
- Después de la incubación, pipetear suavemente 1,6 ml aMEM-menos 10% a cada placa para obtener un volumen total de 2 ml, iniciar la sincronización de células mediante la adición de timidina 2 mM y se incuban las células durante un 2 hr a 37 ° C, 5% de CO 2 .
- Mientras tanto, preparar las followi mezcla de transfección siRNAng el método de transfección CAPI (véase la Figura 1). Si hay siRNA es necesario, reemplazar la cantidad de siRNA de agua estéril para realizar una transfección vacía.
- Calcular 200 l de mezcla para cada condición, resultando en 400 l por duplicado. El siguiente ejemplo se da para una concentración de siRNA final de 50 nM y tiene que ser adaptado para cada proteína de interés. En un tubo de plástico de 1,5 ml, pipeta de 50 l 1 M CaCl 2 y 11 l de 20 mM de siRNA en 139 l de H 2 O estéril y mezclar mediante agitación. Después de una vuelta rápida, añadir con cuidado gota a gota 200 l HBS2x (NaCl 280 mM, HEPES 50 mM, 1,5 mM Na 2 HPO 4, pH 7.1 a 7.5).
NOTA: El menor tamaño de las gotas más pequeñas son el los precipitados, lo que resulta en una mejor eficiencia de transfección. Mezclar suavemente tres veces por inyección de aire usando una pipeta de l-200. - Incubar la mezcla durante 30 min a RT. Agregar lentamente gota a gota 200 l de mezcla de transfección a cada placa yagitar en sentido transversal. La transferencia de las placas a 37 ° C, 5% de CO2 durante 16 horas.
- El día siguiente, enjuagar las células dos veces con 2 ml de HEPES cálidos (KCl 6,7 mM, NaCl 150 mM, HEPES 10 mM, pH 7,3) y se añade 2 ml aMEM-menos 10%. No continúe con más de cuatro placas de las células en un momento dado que las variaciones en la temperatura afectan a la longitud del ciclo celular.
- Visualizar la eficiencia de infección con un microscopio fluorescente invertido con un aumento de 20-40x (aire) y adquirir tres imágenes representativas por condición en ambos canales fluorescentes y de transmisión para la documentación. Siete horas después, añadir timidina 2 mM y se incuba durante otras 16 horas a 37 ° C, 5% de CO 2.
- Al día siguiente, 48 horas después de siRNA transfección e infección por el virus, lavar las células dos veces con 2 ml de solución salina tampón fosfato caliente (PBS) y la liberación durante 7 horas en 2 ml aMEM 10% w / o rojo de fenol para imágenes de células vivas o con fenol rojo para la extracción de proteínas.
- Células de cosecha para cada condición de 48 horas después de la transfección para la preparación de extractos de proteína y análisis de transferencia Western para determinar la eficiencia de la precipitación y la expresión de la proteína endógena 15.
NOTA: Utilice anticuerpos contra la proteína de interés, así como los anticuerpos apropiados que sirven como controles de carga. La eficiencia de la precipitación debe ser determinada por la carga de cantidades decrecientes de los lisados de células de control (transfectadas con ARNsi de control), para proporcionar una curva de valoración (es decir, 1, ½, ¼, ⅛).
4. La transducción de adenovirus y la proteína endógena Knockdown de siRNA transfección en células HeLa El uso de un reactivo de transfección lípido catiónico
NOTA: Aquí se presenta un protocolo que fue adaptado para experimentos que no implican la sincronización de células y / o cuando siRNA transfección no se puede realizar por el método CAPI, por ejemplo para evitar efectos tóxicos indeseables en algunas células linES. Este protocolo también incluye una etapa replating celular después de adenofection el fin de trabajar a una densidad celular adecuada. Sólo hemos probado el reactivo de transfección lípido catiónico.
¡Atención! El trabajo con los virus requiere precauciones especiales y una disposición adecuada de todo el material que ha estado en contacto con el virus.
- Placa de 1,75 x 10 5 células por placa de 35 mm en 2,5 ml aMEM 10% y se incuba a 37 ° C, 5% de CO 2. Plate uno 35 mm placa adicional para el número de condiciones con el fin de contar el número de células antes de la transducción de virus.
- Se cultivan las células hasta el día siguiente para lograr una densidad de células de al menos 50%. Una densidad celular de menos de 50% resulta en una disminución significativa de la eficiencia de transducción de virus, el aumento de las variaciones de la expresión de proteína por célula, y el aumento de la toxicidad celular.
- Un día después de la siembra de células, contar el número de células de la placa de chapado adicional. Aspirarel medio y enjuague una vez con 1 ml 0,05% de tripsina / EDTA. Añadir de nuevo 1 ml de 0,05% de tripsina / EDTA y se incuba a 37 ° C, 5% de CO 2 hasta que todas las células se han separado. células separadas pocillo usando una pipeta de 1 ml y contar el número de células por ml.
- Determinar la cantidad de virus necesaria para la transducción de una multiplicidad de infección (MOI) de 20-40 unidades formadoras de placas (UFP) de la proteína de interés (POI) por célula y 0-20 PFU por célula de un vector vacío (por ejemplo, LacZ) que tiene un total de 40 PFU por célula.
- Preparar en una campana estéril un tubo de plástico de 1,5 ml para cada condición y añadir 400 l de aMEM tibia 10%.
- Descongelar una alícuota de los virus lentamente en hielo y, si es necesario, diluir la solución madre de virus con el fin de pipeta un volumen superior a 1 l para minimizar los errores de pipeteado.
- Añadir la cantidad de virus calculada por condición a cada tubo de plástico de 1,5 ml que contenía 400 l aMEM 10% y mezclar suavemente con la pipeta. º lugare stock de virus inmediatamente de nuevo a -80 ° C para mantener su actividad.
- Aspirar el medio de las células y pipetear suavemente la mezcla de virus gota a gota. Se incuban las células a 37 ° C, 5% de CO 2 y agitar las placas cuidadosamente bajo la campana estéril cada 15 min durante 1 hora para cubrir así las células con la dilución de virus. El uso de una pequeña cantidad de medio facilita el contacto del virus con las células.
- Mientras tanto, preparar la mezcla de transfección siRNA siguiendo el método de transfección. Si hay siRNA es necesario, reemplazar la cantidad de ARNsi por medio sin suero para realizar una transfección vacía.
- El siguiente ejemplo se da para una concentración de siRNA final de 50 nM y tiene que ser adaptado para cada proteína de interés. Para cada adenofection, preparar uno 1,5 ml tubo de plástico que contiene 416 nM siRNA en 150 l de medio sin suero (por ejemplo, 6,25 l 20 siRNA mu M + 144 l de medio sin suero) y uno containi tubo de plástico de 1,5 mlng reactivo de transfección de lípidos 6,25 l catiónico + 144 l de medio sin suero.
- Mezclar el contenido de cada tubo de plástico pipeteando arriba y abajo varias veces con una pipeta de 200 l. Combinar el contenido de ambos tubos y mezclar pipeteando arriba y abajo varias veces con una pipeta de 200 l. Incubar durante 5 min a TA.
- Después de la incubación con el virus, una pipeta suavemente 1,8 ml aMEM 10% a cada placa para obtener un volumen total de 2,2 ml e inmediatamente se añade lentamente gota a gota la mezcla de transfección de siRNA a cada placa y agitar en sentido transversal. La transferencia de las placas a 37 ° C, 5% de CO2 durante 24 horas.
- El siguiente día, re-placa de las células de cada placa de 35 mm en cuatro nuevas placas de 35 mm en 2,5 ml aMEM 10% cada uno y se incuba durante otras 24 horas adicionales a 37 ° C, 5% de CO 2.
- El día siguiente, 48 horas después de la transfección de ARNsi y la infección por virus, células de la cosecha de una placa para cada condición para la preparación deextractos de proteína y análisis de transferencia Western para determinar la eficiencia de la precipitación y la expresión de la proteína endógena 15.
NOTA: Con las placas restantes, proceder a la fijación de células, utilizando el protocolo de elección y someter las muestras a análisis de inmunofluorescencia con los anticuerpos de interés 14.
5. Imágenes de células vivas de células mitóticas y Análisis de Datos
- Realizar experimentos de imágenes de células vivas a corto plazo sobre las células mitóticas con un microscopio invertido equipado con una cámara húmeda / 5% de CO 2 / termo-regulada.
NOTA: En este estudio, se utilizó un microscopio confocal de disco giratorio (40X, 0,75 NA), equipado con un EMCCD enfrió la cámara de carga acoplada a -50 ° C. - Antes de la adquisición, compruebe que la cámara ha alcanzado la temperatura adecuada de 37 ° C.
NOTA: Este proceso puede tardar varias horas dependiendo del sistema microscópico. - Colocar las placas de cultivo en el micrcámara oscope 1 hr antes de la adquisición para permitir el equilibrio adecuado de el medio y evitar la deriva de enfoque debido a cambios de temperatura. Supervisar el estado mitótico de las células. En este punto, el 10-15% de las células deben estar en las primeras fases de la mitosis (profase-prometaphase).
- Durante el tiempo de equilibrio, configurar los parámetros de adquisición según lo determinado en los experimentos anteriores. Típicamente, un tiempo de exposición para ambos canales (488 y 594) de 0,2 a 3 segundos con una intensidad de láser de 100% y una sensibilidad de 121 a 130 son parámetros adecuados en nuestras manos.
En primer lugar se deben hacer pruebas para determinar la intensidad del láser y la adquisición de tiempo / intervalo mínimo que se traducen en una resolución apropiada con photobleaching mínimo que provoca daños celulares y perturba la progresión mitótico: NOTA. - Elija varios campos por condición para obtener un número significativo de células para analizar sin exceder el intervalo de adquisición. El uso de un sistema confocal disco giratorio, una configuración típica enCLUDE cuatro condiciones diferentes campos, 7 por placa y 2 canales de color (488 y 594) con un intervalo de 1,5-2 min durante un período de 75 min-.
- Elija las células que se encuentran en la entrada mitótico, vuelva a ajustar el foco una vez que todos los campos han sido elegidos y comenzar la adquisición lo más rápido posible.
- Monitorear la estabilidad del sistema por al menos tres puntos de tiempo y volver a ajustar el enfoque si es necesario.
- Después de la primera imagen de células vivas a corto plazo de 75 min, nuevos campos de las células mitóticas pueden ser elegidos para adquirir una segunda serie de películas para aumentar el número de células que se analizan.
- Determinar criterios bien definidos para analizar los fenotipos de la mitosis de las células, lo cual dependerá de los marcadores fluorescentes se utilizan. Los defectos en la mitosis pueden incluir el tiempo pasado en la mitosis prolongada (de la descomposición nuclear hasta la anafase), desalineación cromosoma, oscilación del eje, y la corteza formación de ampollas en el 14.
6. LifeAct-TagGFP2 Adenovirus Transducción en Differentiating ratón C2C12 mioblastos
NOTA: El protocolo adenofection es también aplicable a los mioblastos C2C12 de ratón difíciles de infectar sometidos a la diferenciación.
- Plate 2 x 10 5 C2C12 células en placas de cultivo de 35 mm en medio de crecimiento en plástico o en un sustrato de elección.
NOTA: La diferenciación celular se mejora en los platos gelatine- o matrigel recubierto. Planificar una placa adicional para determinar el número de células antes de la transducción de virus. - El día siguiente, las células debería haber alcanzado 80% de confluencia. Inducir la diferenciación de mioblastos por lavado de las células dos veces con PBS caliente y la adición de 2 ml de medio de diferenciación (DM).
- El día siguiente, etiquetado como día 1 (D1) de la diferenciación, transducir miocitos con adenovirus LifeAct-TagGFP2 para visualizar el citoesqueleto de actina en células vivas. Contar el número de células de la placa adicional como se describe en el punto 3.2. Calcular 5 UFP / célula de adenovirus LifeAct-TagGFP2 y 45 UFP AdLacZ / celular tras el examenPLE describe en la Tabla 1. La cantidad total de virus es 50 PFU / célula. Se utilizaron los virus como se ha descrito 14
- Preparar en una campana estéril un tubo de plástico de 1,5 ml para cada condición y añadir 400 l de tibia DM.
- Descongelar una alícuota de los virus lentamente en hielo y, si es necesario, diluir la solución madre de virus con el fin de pipeta un volumen superior a 1 l para minimizar los errores de pipeteado.
- Añadir la cantidad apropiada de partículas de virus por condición a cada tubo de plástico 1,5 ml que contiene 400 l DM y mezclar suavemente pipeteando. Coloque la solución madre de virus inmediatamente de nuevo a -80 ° C para mantener su actividad.
- Aspirar el medio de las placas y la pipeta suavemente la mezcla de virus gota a gota. Se incuban las células a 37 ° C, 5% de CO 2 y agitar las placas cuidadosamente bajo la campana estéril cada 15 min durante un total de 1 hr para cubrir así las células con el virus.
- Después de la incubación, la pipeta suavemente 1,6 ml DM en cada plato y continuar con la incubation para un 2 h más a 37 ° C, 5% de CO 2.
- Mientras tanto, preparar una mezcla de transfección vacía siguiendo el método de transfección CAPI. Calcular 200 l de mezcla para cada condición. Utilice el ejemplo siguiente para un volumen total de 400 l de mezcla.
- En un tubo de plástico de 1,5 ml, pipeta de 50 l 1 M de CaCl2 en 150 l de H 2 O estéril y mezclar mediante agitación. Después de una vuelta rápida, añadir con cuidado gota a gota 200 l HBS2x (NaCl 280 mM, HEPES 50 mM, 1,5 mM Na 2 HPO 4, pH 7.1 a 7.5). Mezclar suavemente por inyección de aire tres veces con una pipeta de 200 l.
- Incubar la mezcla durante 30 min a RT. Añadir lentamente gota a gota 200 l de la mezcla de transfección a cada placa y agitar en sentido transversal. La transferencia de las placas a 37 ° C, 5% de CO2 durante 16 horas.
- Al día siguiente, lavar las células dos veces con 2 ml de HEPES cálidos (KCl 6,7 mM, NaCl 150 mM, HEPES 10 mM, pH 7,3) y añadir 2 ml DM. Visualizar el infeeficiencia cción bajo un microscopio de fluorescencia invertida con un aumento de 20-40X (aire) y adquirir tres imágenes representativas por condición en ambos canales fluorescentes y de transmisión para la documentación.
- Dependiendo de la configuración de la prueba deseada, siga la diferenciación en miotubos durante varios días. Las células pueden ser fijos y posteriormente sometidos a análisis de inmunofluorescencia o estudios de imágenes de células vivas se puede realizar.
Resultados
La transfección de BAG3-GFP ADN plásmido utilizando lípidos catiónicos se asoció con la expresión heterogénea en células HeLa, algunas células que muestran niveles apenas detectables de la proteína y otros que llevan niveles muy altos BAG3 (Figura 2A). En estas células, la pérdida de la homeostasis de proteínas se evidencia por la acumulación de BAG3-GFP en agregados perinuclear (Figura 2A, flechas). En contraste, la transducción de células con adenovirus que llevan BAG3-GFP presentaba baja expresión más homogénea y la localización precisa de BAG3-GFP (Figura 2B, la infección solo). Sorprendentemente, la adición de lípidos catiónicos durante la transducción de adenovirus (es decir, la transfección de partículas de adenovirus) aumentó significativamente la expresión BAG3-GFP por célula a MOI similar, mientras que permitía mantener la expresión homogénea en la mayoría de las células (Figura 2B, Adenofection).
Adenofection permitió el agotamiento eficiente de BAG3 endógena y la reintroducción de las proteínas BAG3-GFP en los niveles endógenos de cerca, ya sea utilizando el CAPI precipitados o compuestos a base de liposomas para aumentar la eficiencia de la transducción de la transfección en células HeLa. La figura 3 muestra un experimento típico con BAG3 tipo salvaje (WT)-GFP o una BAG3 (IPV)-GFP mutaciones teniendo variantes que suprimen la unión a uno de sus socios chaperonas HSPB8 (Figura 3A, 3B). En consonancia con el papel de BAG3 en la estabilización de HSPB8 7, el silenciamiento de BAG3 condujo a una disminución de ~ 50% en los niveles de HSPB8, que fue restaurada a los niveles normales tras la reintroducción de BAG3 WT, pero no por la expresión de niveles similares de los mutantes BAG3 de GFP (IPV) o de GFP sola. En estas condiciones, las proteínas BAG3-GFP fueron localizados apropiadamente dentro de ~ 75-90% de las células, que se enriquecen en las regiones perinuclear-centrosomal (Figura 3C, 3D). este Suggsados que adenofection conserva la dinámica de BAG3 y del complejo BAG3-HSPB8 en las células.
HSPB8 y BAG3 son upregulated por diversas tensiones proteotoxic que también perturban Proteostasis citoesqueleto 10. De ahí que la sobreexpresión de las chaperonas puede potencialmente alterar el ensamblaje y desensamblaje de estructuras macromoleculares que controlan Morfodinámica celulares. Con el fin de evaluar el papel de BAG3-HSPB8 en condiciones no estresadas, fue importante verificar que la homeostasis de proteína fue mínimamente perturbado por el procedimiento adenofection. A tal fin, vigilar las variaciones en los niveles de chaperones de la familia de proteínas de choque térmico es una buena indicación del estado de la homeostasis de la proteína. Como se muestra en la Figura 4, adenofection por el CAPI o métodos no aumentó significativamente los niveles de HSPB8 endógeno y BAG3, o la del sistema de chaperona HSP70 / HSPA1 importante liposomas base. Por el contrario, típicotratamientos proteotoxic como choque térmico o MG132, un inhibidor del proteasoma, el aumento de los niveles de las proteínas chaperonas cochaperone en células HeLa.
Luego trató de determinar si el procedimiento adenofection combinado con baculovirus expresión de sondas fluorescentes de actina y tubulina (BacMam-RFP-actina y GFP-αtubulin) de conducción era adecuado para el seguimiento de la dinámica celular mitótico. Como se muestra en la Figura 5, adenofection de células HeLa con un control de siRNA (siCTL) no perturba la dinámica del huso mitótico (verde) o el tiempo medio de permanencia en la mitosis (Figura 5A, confocal representante secuencias de lapsos de tiempo). La proporción de estas células que muestran eventos mitóticos anormales estaba en línea con los niveles de mitótico defectos observados generalmente en líneas celulares de cáncer (~ 30% -40%, Figura 5B). En contraste, las células adenofected con siRNA-BAG3 específica solo (siBAG3) exhibió un aumento de ~ 2 veces en la level de defectos fenotípicos mitótico, que fue restaurado a cerca del nivel en las células control por BAG3-GFP (WT), pero no por GFP sola. Esto valida la idoneidad de adenofection para el análisis funcional de los efectos de BAG3 y sus chaperones asociados en la dinámica del citoesqueleto que regulan la progresión adecuada de células de entrada y salida de la mitosis, como se muestra por Fuchs et al 14.
Para verificar la versatilidad del método adenofection, que luego se adapta el protocolo para permitir la visualización de la F-actina durante la diferenciación de los miocitos C2C12 de ratón, usando el disponible comercialmente adenovirus-LifeAct-GFP para etiquetar F-actina 16. Se indujeron las células C2C12 diferenciar por un día antes de Adenofection. Utilizando el protocolo adenofection basado en CAPI, notablemente bajas cantidades de Adenovirus-LifeAct-GFP fueron suficientes para expresar la sonda a un nivel que fue fácilmente detectado por microscopía de fluorescencia en una proporción significativa de differe miocitos ntiating (~ 3-5 PFU / célula; Figura 6). Esto estaba en marcado contraste con la extremadamente alta multiplicidad de infección reportados en la literatura para transducir células de ratón C2C12 (en el orden de 250 a 400 MOI) 17-19. Por otra parte, mediante la supervisión del proceso de diferenciación durante 7 días, se estableció que la formación de miotubos no se vio afectada significativamente por el procedimiento. Esto sugiere que la fusión de los miocitos, un proceso que se basa en la dinámica de actina finamente sintonizados 20, no fue perturbado por la expresión de los niveles bajos de LifeAct-GFP (Figura 6, los días 6 y 7). Dado que el marcador fluorescente puede ser detectado muchos días después de adenofection de las células C2C12, creemos que este método será adecuado para el análisis funcional de los efectos de las chaperonas en la dinámica de actina en diferentes etapas de C2C12 miogénesis.

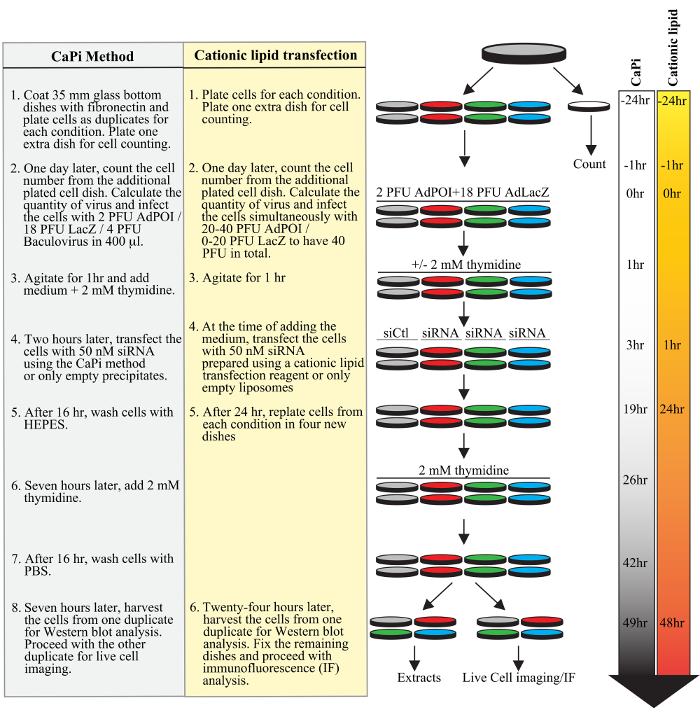
Figura 1. Planificación de un protocolo típico adenofection. Etapas sucesivas de un experimento típico se muestra para el protocolo usando precipitados CAPI (subrayado en gris) o el protocolo usando un reactivo de transfección de lípidos catiónicos (resaltado en amarillo), incluyendo chapado celular, la transducción de transfección adeno y baculovirus, de ARNsi dúplex, y la sincronización de células con un bloque doble timidina. Líneas de tiempo en horas para ambos protocolos se muestran en el lado derecho de la figura.fig1large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.
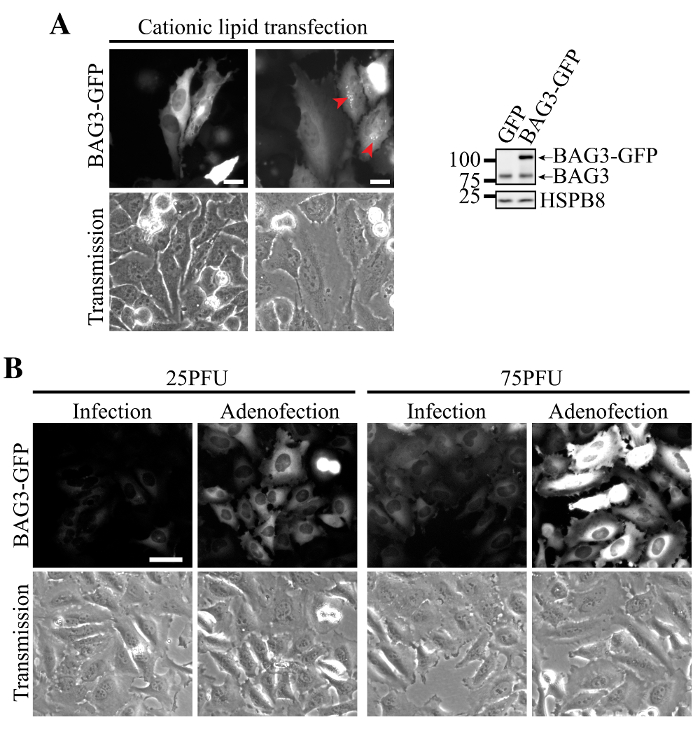
Figura 2. Expresión homogénea y eficiente de BAG3-GFP usando Adenofection. (A) imágenes de epifluorescencia representativos de células HeLa que habían sido transfectadas con ADN de plásmido BAG3-GFP, que muestra agregados perinuclear de la proteína en los altos niveles de expresión (designadas por las flechas) y la expresión heterogénea dentro de la población celular. Las transferencias Western muestran una mayor expresión de BAG3-GFP con relación a los niveles de BAG3 endógenos en la población general de la célula, lo que indica que la proteína se sobreexpresa en gran medida en algunas células. (B) Las imágenes de epifluorescencia representativos de células HeLa que habían sido transducidas única o adenofected utilizando cantidades crecientes de partículas de virus Ad-BAG3-GFP. imágenesfueron adquiridos utilizando parámetros idénticos y fueron igualmente procesado por sustracción de fondo y la intensidad; Bar:. 50 micras Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. desmontables eficiente de BAG3 y la reintroducción de las proteínas BAG3-GFP en los niveles endógenos cerca. Células (AB) HeLa que expresan RFP-H2B (A) o células HeLa parentales (B) se adenofected con los siRNAs indicados y adenovirus recombinantes utilizando el CAPI método (A) o compuestos a base de liposomas como reactivo de transfección (B). Las células se sincronizan mediante el método de timidina bloque doble y se prepararon extractos celulares totales durante la segunda fase de liberación. Weste borrones rn muestran niveles BAG3 agotamiento (BAG3 endógenos), los niveles de proteínas BAG3-GFP adenofected, y niveles endógenos de HSPB8; niveles de GAPDH: control de carga. El agotamiento se estimó en> 75% mediante la carga de cantidades decrecientes de los extractos de control (adenofected con el control de siRNA-siCtl y BAG3-GFP WT, es decir, ½, ¼). Tenga en cuenta que las proteínas GFP-BAG3 individuales se introdujeron en cerca del nivel endógeno de BAG3 y que tipo salvaje BAG3-GFP, pero no BAG3 (IPV)-GFP o GFP sola, restauran los niveles en las células HSPB8 BAG3-agotado. (CD) de epifluorescencia imágenes representativas de las células HeLa que habían sido adenofected a lo indicado Ad-BAG3-GFP recombinante utilizando CAPI o reactivo de transfección lípido catiónico. Bares: 20 micras. Los resultados representativos se muestran en (A) y (C) son modificados a Fuchs et al., PLoS Genet. 2015 Oct 23; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14.iles / ftp_upload / 54557 / 54557fig3large.jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta figura.

Figura 4. Adenofection no induce una respuesta de estrés en células HeLa transferencias Western de extractos celulares totales preparados a partir de células de control HeLa. (NT: no tratado) o células HeLa transfectadas con ARNsi de control solo (siCtl, no adenovirus), o adenofected con siCtl y Ad-GFP usando CAPI o reactivo de transfección lípido catiónico, o de células HeLa sometidas a los tratamientos típicos proteotoxic (SA: choque térmico a 44 ° C durante 60 minutos seguido de la recuperación de 16 horas a 37 ° C; MG132: inhibidor del proteasoma, 5 mM durante 16 horas), que muestra los niveles de BAG3, HSPB8 y de otros chaperones inducibles por estrés, es decir, HSP70 / HSPA / y HSP27 / HSPB1; GAPDH: control de carga. Tenga en cuenta que, si bien los niveles de todos los proproteínas, excepto GAPDH se incrementaron en tratamientos de estrés proteotoxic, permanecieron sin cambios por adenofection. Las variaciones del nivel de proteínas se evaluaron mediante la carga de cantidades variables de extractos de células HS que llevan aumentos típicos en HSPs. (HS: 1, ½, ¼, ⅛; por ejemplo, HSP70 fue inducida por más de 8 veces en respuesta a proteotoxic estrés) Por favor clic aquí para ver una versión más grande de esta figura.
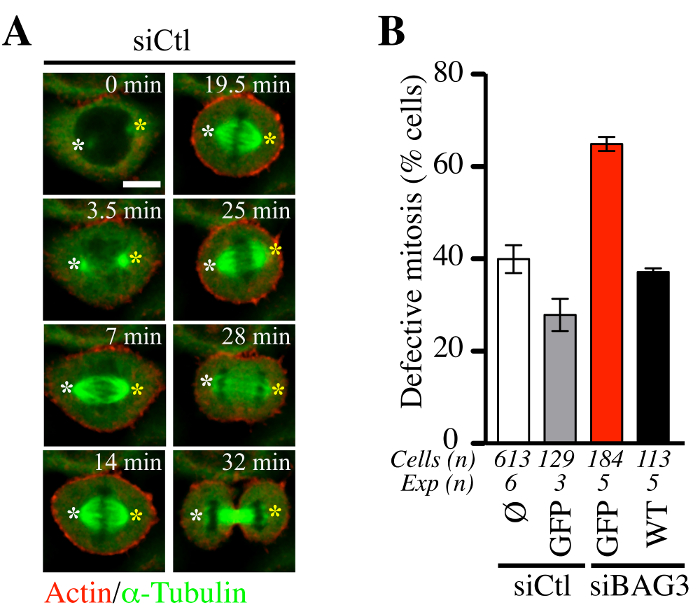
Figura 5. La progresión de las células HeLa a través de la mitosis no sea perturbado de manera significativa por Adenofection. (A) secuencias de lapso de tiempo confocal Representante de células HeLa que se habían adenofected con un control de siRNA (siCtl) junto con BacMam- GFP-α-tubulina y BacMam -RFP-actina y reflejada por el disco giratorio confocal microscopy de 60 a 90 min a ~ intervalos de 1,5 min. Blanco y amarillo asteriscos designan la posición de los polos del huso que se mantuvo relativamente estable. Bar: 10 micras. (B) Cuantificación de las células adenofected con siCtl o siRNA-BAG3 específica, con o sin las proteínas GFP indicados (GFP solo o de tipo salvaje BAG3-GFP: WT). El gráfico indica los porcentajes de células con mitosis anormal definida como balanceo husillo y se estancó en mitosis +/- o desalineación cromosoma. Se muestran los medios +/- SE. Los resultados representativos se muestran en (B) se tomaron de Fuchs et al., PLoS Genet. 2015 Oct 23; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14. Haga clic aquí para ver una versión más grande de esta figura. Haga clic aquí para ver la película asociada con el panel (A).

Figura 6. Adenofection de los miocitos C2C12 con Ad-LifeAct-GFP y la formación de miotubos. Epifluorescencia imágenes representativas de las células C2C12 que habían sido inducidas a diferenciarse y procesados para adenofection menos 1 día después usando 5 UFP / célula de LifeAct-GFP y 45 UFP / célula de LacZ. Las imágenes muestran la expresión del marcador GFP durante el proceso de diferenciación (Día 2, Día 6 Día 7). Bares:. 20 micras Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Aquí, describimos un método que permite experimentos de reducción de rescate a realizar, que es aplicable a los análisis funcionales de los procesos celulares biológicas que son particularmente sensibles a la sobreexpresión de proteínas que afectan a la estequiometría y la dinámica de los complejos de proteínas y estructuras macromoleculares. la división celular mitótico es un ejemplo extremo de la morfodinámica celulares finamente sintonizados que involucra los cambios más dramáticos y espectaculares en la estructura general de una célula. Usando adenofection combinada con reactivos BacMam disponibles comercialmente para introducir cantidades bajas pero detectables de actina y tubulina marcadores de imágenes de células, la contribución de la chaperona complejo BAG3-HSPB8 a la remodelación celular mitótico adecuada podría ser claramente demostrada. En un estudio reciente realizado por Fuchs et al., Hemos demostrado que el agotamiento de BAG3 provoca defectos en la orientación del cabezal que están relacionados con una incapacidad para establecer una corteza rígida mitótico actina y actina se reúnen ricosfibras de retracción 14. dinámica propia del huso podría ser restaurado por la reintroducción de tipo salvaje BAG3-GFP, que también corrige la disminución observada en los niveles HSPB8 sobre silenciamiento BAG3. Esto implica que adenofection permite la recuperación de un complejo chaperona fisiológicamente relevante que se correlaciona con la recuperación funcional de la dinámica del huso.
El uso de adenofection para los experimentos de depleción de rescate proporciona una ventaja sobre la transfección del plásmido de ADN o nucleofection, que puede dar lugar a una potente inducción de una respuesta de estrés en algunos tipos de células (es decir, la autofagia) 21, lo que hace prácticamente imposible analizar el impacto de una dado chaperona y su papel fisiológico. De hecho, en la mano, la transfección de ADN de plásmido BAG3 se asocia con una mayor expresión por célula, la formación de agregados, y efectos sobre la apoptosis de las células / supervivencia en varios tipos de células (Figura 2). BAG3 es un cochaperone modular con la actividad de andamio, que may desempeñar múltiples funciones dependiendo de sus proteínas asociadas 9. Por lo tanto, las perturbaciones de la estequiometría complejo a la sobreexpresión de BAG3 pueden tener efectos negativos dominantes indeseables e inducir toxicidad. Alta capacidad de adenovirus recombinante es un vehículo ideal para la entrega transitoria y la seguridad de grandes genes, tanto en división y las células en cultivo que no se dividen, ya que no se integra en el genoma de la célula huésped, a diferencia de vectores basados en lentivirus para el que algunos de seguridad aún persisten algunas preocupaciones. desventaja potencial del uso de adenovirus para los experimentos de depleción de rescate es que requieren preparación, lo que puede llevar mucho tiempo repiten. También dependen de una cuidadosa titulación de partículas infecciosas para la eficacia de transducción reproducible.
Usando adenofection para defender la contribución de los dominios funcionales BAG3 conocido, se obtuvo la primera evidencia, a nuestro entender, por la existencia de una función BAG3 HSPB8 dependiente en el funcionamiento normalde las células en división que no requiere su interacción con el sistema chaperona HSP70 / HSPA1. Adenofection debe ser aplicable a un seguimiento de F-actina durante el proceso de diferenciación de los miocitos en miotubos, como se sugiere por los datos presentados aquí. Así, nuestro método proporciona un protocolo versátil y eficiente para los experimentos de depleción de rescate a base de siRNA con mínimo impacto sobre morfodinámica de células que deberían ser útiles en una amplia gama de proyectos en los que se sigue una análisis de estructura-función de un gen de interés.
Explotación catiónicos compuestos lípidos con el fin de lograr la transfección eficiente de transducción de las células con la menor cantidad de partículas de virus es la clave para este método. Aunque proporciona una ventana más grande para el control de los niveles de proteínas exógenas por célula, creemos que permite además minimizar los efectos secundarios potenciales en las vías de transducción de señales que resultan de la célula adenovirus de unión-entrada, que debe mitigar el impacto de aprotein de interés sobre las vías morfogenéticos.
Cabe señalar que los diferentes reactivos para aumentar la eficiencia de transducción de adenovirus están disponibles comercialmente, tales como el refuerzo receptor CAR. Tales reactivos son caros, sin embargo, y se espera que la promoción de la unión del virus-entrada en las células de una manera que requiere que el receptor CAR, que como se ha indicado anteriormente se ha demostrado que activar las vías asociadas con la forma de la célula y la adhesión de señalización. Mientras CAPI es más barato que los liposomas catiónicos como medio para potenciar la entrada de adenovirus a través de una vía de CAR-independiente, sino que también es más tóxico para algunas líneas celulares. Recomendamos la prueba previa de un adenofection vacío para orientar la elección entre CAPI vs reactivo lípido catiónico, dependiendo de la línea celular utilizada y la lectura biológica de interés.
enfoques caída de rescate junto con las nuevas herramientas biotecnológicas de la edición genoma, basadas en la interferencia de ARN, como el que se describe aquí ofrecen un ARrayo de herramientas moleculares poderosas para descubrir la función de genes en células, que ahora se pueden elegir de manera óptima por los investigadores en función de las aplicaciones específicas 3. Creemos que adenofection proporciona un sistema relativamente rápido y sencillo para crear caídas hypomorphic para los análisis de estructura-función de la contribución de una proteína de interés en múltiples entornos celulares.
Divulgaciones
The authors have nothing to disclose.
Agradecimientos
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Materiales
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
Referencias
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462(2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889(2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141(2011).
- Guilbert, S. M., et al. The Big Book of Small Heat Shock Proteins. Tanguay, R. M., Hightower, L. E. , Springer International Publishing AG. 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582(2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294(2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2(2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados