Method Article
Adenofection: Um método para estudar o papel de chaperones moleculares em Cellular Morfodinâmica por experimentos depleção de resgate
Neste Artigo
Resumo
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Resumo
Os processos celulares tais como a mitose e diferenciação das células são regulados por mudanças na forma das células que largamente dependem da remodelação adequada das estruturas do citoesqueleto celular. Isto envolve a montagem-desmontagem de estruturas macromoleculares de ordem superior num dado momento e localização, um processo que é particularmente sensível a perturbações provocadas pela expressão excessiva de proteínas. Métodos que podem preservar a homeostase da proteína e manter a morfologia celular perto-para-normal, são altamente desejáveis para determinar a contribuição funcional de uma proteína de interesse em uma ampla gama de processos celulares. Transitórios experimentos depleção de resgate com base na interferência de RNA são abordagens poderosa para analisar as funções das proteínas e requisitos estruturais. No entanto, a reintrodução da proteína alvo com desvio mínimo a partir do seu nível fisiológico é um verdadeiro desafio. Descrevemos aqui um método denominado adenofection que foi desenvolvido para estudar o papel de um chaperonas molecularesparceiros d no funcionamento normal das células em divisão e a relação com a remodelação da actina. As células HeLa foram esgotados de BAG3 com duplex de siRNA segmentação região 3'UTR. BAG3 proteínas GFP foram reintroduzidos simultaneamente em> 75% das células utilizando adenovírus recombinantes acoplados a reagentes de transfecção. Adenofection activado para expressar proteínas BAG3-GFP em níveis fisiológicos próximos em células HeLa depletados de BAG3, na ausência de uma resposta de stress. Não se observou qualquer efeito sobre os níveis de proteína de choque térmico chaperonas endógenos, os principais reguladores de stress-indutível da proteína homeostase. Além disso, por adição de baculovirus conduz a expressão de marcadores fluorescentes no momento da transdução de células-transfecção, que poderia dissecar dinâmica de células mitóticas por microscopia de lapso de tempo analisa com perturbação mínima de progressão mitótica normal. Adenofection é aplicável também para células de difícil infectar rato, e adequado para análises funcionais de diff mioblastoserentiation em miotubos. Assim adenofection proporciona um método versátil para efectuar análises de estrutura-função de proteínas envolvidas em processos biológicos sensíveis que dependem da dinâmica do citoesqueleto de ordem superior.
Introdução
inactivação funcional da expressão do gene em células de mamífero é o padrão de ouro para dissecar as funções das proteínas. Recém-desenvolvidas tecnologias de edição genoma com base no uso de nucleases específicas do local, tais como nucleases de dedos de zinco e agrupados regularmente intercaladas repete palindr�icas curtas (CRISPR) / CAS9 agora permitem a geração de linhagens celulares com deleção do gene alvejado e mutação 1,2. Estas novas abordagens devem revolucionar a forma como estamos a estudar a função da proteína e da nossa compreensão da genética de doenças humanas. Em alguns casos, no entanto, a longo prazo ou nocaute do gene completo não é desejável e pode provocar mecanismos de compensação de células secundárias. A geração de linhas de células geneticamente modificadas, podem também ser limitante quando se lida com as culturas de células primárias com capacidade de proliferação limitada, ou quando o rastreio de um grande conjunto de mutações em vários tipos de células é procurado. Este é muitas vezes necessária para determinar a dependência de uma célula bprocesso iological sobre os requisitos estruturais de uma proteína. Para o efeito, knockdown reversíveis por interferência de RNA que permite experiências de depleção de resgate transitórios em várias origens celulares continua a ser uma abordagem simples e poderoso para efectuar análises de estrutura-função de uma proteína de interesse 3. No entanto, uma grande desvantagem com esta abordagem é a dificuldade de atingir e silenciamento eficiente para reintroduzir a proteína de interesse ou suas variantes em níveis fisiológicos próximos na maioria da população de células. Este aspecto é crucial para permitir estudos exaustivos que tentativa de correlacionar os efeitos funcionais observadas no nível de células individuais (fenótipo hipomórfico) com aqueles observados em ensaios baseados em população de células, por exemplo, em interacções proteína-proteína.
Usando métodos de transfecção clássicos, dificilmente se pode conseguir a expressão homogênea e baixa de proteínas exógenas em uma grande população de células. A transdução de células com vírus recombinantescomo adenovírus muitas vezes permite a expressão mais normalizado de proteínas exógenas. No entanto, a absorção de adenovírus é limitado pelo receptor de carro, que está ausente em células não-humanos ou apenas fracamente expresso em alguns tipos de células humanas. Além disso, a entrada celular de adenovírus activa as vias que regulam a forma da célula e adesão 4-6 sinalização. Isso obviamente não é desejável quando se estuda mecanismos reguladores da morfodinâmica celulares. Nós voltado para esta problemática quando realizamos análises funcionais de um complexo acompanhante, BAG3-HSPB8, na divisão celular e da dinâmica de actina. Trabalho pioneiro havia descrito um papel para este complexo acompanhante no controle de qualidade de proteínas e autofagia durante o estresse 7,8. A maioria destes estudos, no entanto, a sobre-expressão da proteína invocado, assumindo que as chaperonas são normalmente regulada positivamente durante o stress. Isso deixou em aberto a questão de saber se BAG3, em complexo com HSPB8, pode contribuir para o normal funcionamento das células em divisão expressando thchaperones ese como muitos tipos de células cancerígenas 9. Em particular, se o complexo acompanhante contribui para a remodelação das estruturas de actina que controlam a progressão mitótico foi de grande interesse, dadas as conexões emergentes entre chaperones HSPB e dinâmica do citoesqueleto 10. Para abordar esta questão, estávamos buscando desenvolver um método eficiente para experimentos depleção de resgate que não iria interferir com a progressão da mitose ou morfologia celular, e que preservar a homeostase da proteína para evitar a perturbação secundária da dinâmica dos complexos macromoleculares regulação celular em forma de mudanças . Assim, idealmente, a depleção de complemento de trás do gene de interesse sejam realizadas simultaneamente.
O uso de complexos de adenovírus com um polímero catiónico ou lípidos tem sido descrito para promover a transferência de genes in vitro e in vivo 11,12. Por exemplo, fosfato de cálcio (CAPI) aparece para formar um precipitado comadenovírus que melhoram a ligação do vírus-entrada através de uma via independente de CAR 13. Com efeito, verificou-se que a combinação de transdução de células com base em adenovírus e transfecção com compostos catiónicos podem melhorar a eficiência dos experimentos depleção de salvamento. Isto permitiu-nos reduzir as quantidades de vírus por de 3 a 20 vezes, dependendo da linha de células e o gene de interesse, e beneficiar de uma janela mais larga de modo a ajustar a expressão de proteínas exógenas com níveis próximos endógenas na maioria de uma população de células de interesse com o mínimo impacto sobre a morfologia celular. Sob tais condições, que também pode alcançar uma elevada eficiência de knockdown da expressão da proteína endógena (> 75%). Pela presente, descrevem o método de passo a passo e fornecem evidências de que a homeostase da proteína não é significativamente perturbados como avaliado pelos níveis inalterados de chaperonas induzidas pelo stress da família de proteínas de choque de calor, tornando o método apropriado para análises funcionais do ro fisiológicole de chaperones moleculares por microscopia de lapso de tempo vídeo. O protocolo é passível de procedimentos de sincronização de células e para a utilização de baculovírus disponíveis comercialmente para a co-expressão de baixos níveis de marcadores fluorescentes, com uma interferência mínima com a dinâmica de actina e do fuso mitótico durante a progressão normais. Mostramos ainda mais a versatilidade do método, que é aplicável a "duro" para transduzir células C2C12 de rato, sem qualquer impacto significativo sobre a diferenciação de mioblastos em miotubos in vitro.
Protocolo
1. Preparação de meios e soluções (todas esterilizada por filtração)
- Células de músculo de rato C2C12 (estudos de diferenciação)
- Preparar 500 ml de Meio de Crescimento para manutenção de cultura de células C2C12: Glicose alta DMEM suplementado com 10% de FBS e 2 mM de L-Glutamina.
- Preparação de 100 ml de Diferenciação médio (DM) para a diferenciação C2C12: Glicose alta DMEM suplementado com 2% de Soro de Cavalo.
- Células HeLa (estudos em células mitóticas)
- Preparar 500 ml de aMEM HeLa RFP-H2B manutenção de cultura de células e experimentos: aMEM suplementado com 10% de FBS e 2 mM de L-glutamina (aMEM 10%).
- Preparar 500 ml aMEM-menos (sem Desoxirribonucleosídeos / ribonucleósidos) para a sincronização de células HeLa RFP-H2B: aMEM-minus suplementado com 10% de FBS e 2 mM de L-glutamina (aMEM-menos 10%).
- Prepare 20 ml aMEM sem vermelho de fenol para HeLa-RFP-H2B laquisição de células ive: aMEM sem vermelho de fenol suplementado com 10% de FBS e 2 mM de L-Glutamina.
- Prepare timidina 100 mM: dissolver 24,2 mg em 1 ml de H2O a 37 ° C por agitação em vórtex. Filtro de esterilizar e manter a 4 ° C.
- soluções comuns
- Prepare a 0,05% de tripsina / EDTA: 0,05% de tripsina, EDTA a 0,625 mM em solução salina de fosfato tamponada 1x (PBS). Filtro de esterilizar e alíquotas armazenar a -20 ° C. Uma vez descongelado, manter a alíquota a 4 ° C.
- Prepare HBS2x: NaCl 280 mM, HEPES 50 mM, 1,5 mM de Na 2 HPO 4. Ajustar o pH exactamente entre 7,01-7,05 com NaOH 10 N. Filtrar em condições estéreis e manter a 4 ° C.
2. Revestimento de placas de cultura celular com fibronectina e chapeamento de células HeLa-RFP-H2B
NOTA: Antes do experimento, cada manipulador deve definir-se as condições óptimas de revestimento de células para atingir uma densidade de células adequada desde variações podem oCcur entre cada manipulador e cada linha celular diferente.
- O dia antes da experiência, expandir as células de HeLa-RFP-H2B para se certificar de que eles estão dentro da fase exponencial de crescimento no dia de plaqueamento. Faça 2 sucessivas diluições de 1/3 em placas de 10 cm a partir de um confluente 1x10 cm placa de 80%.
NOTA: Planejar o número de placas para o experimento. Calcular cada condição como duplicados, um para processamento de imagem de células vivas de curto prazo e um para a proteína extrai para determinar a eficácia de knockdown e expressão de proteína exógena por análise de Western blot. Planejar uma placa adicional para determinar o número de células antes da transdução de vírus. - Antes da célula de galvanização, revestimento de vidro de fundo pratos com 10 ug / ml de fibronectina. Adicionar 1 ml de uma diluição 1: 100 de 1 mg / mL de fibronectina (estéril diluído em PBS 1x) por 35 milímetros prato para assim cobrir toda a superfície e incuba-se durante 1 hora a 37 ° C, 5% de CO 2.
- Durante a incubação, aMEM pré-quente suplementado with 10% de FBS (aMEM 10%) e 0,05% de tripsina / EDTA a 37 ° C.
- Após 45 min de incubação, começar a preparação da solução de células. Na capa estéril, aspirar o meio a partir de uma placa de 10 cm, lavar cuidadosamente duas vezes com 1,5 ml de 0,05% de tripsina / EDTA, e deixar 0,5 ml de tripsina / EDTA a última aspiração.
- Incubam-se as células durante 2-3 minutos a 37 ° C, 5% de CO 2. Ao tocar suavemente a placa e observação ao microscópio, verifique se todas as células foram removidas. Adicionar 10 ml de aMEM 10% e pipeta suavemente várias vezes para separar as células. Contagem de uma amostra de 10 uL da suspensão de células utilizando um hemocitómetro.
- solução de fibronectina aspirado dos pratos com fundo de vidro. Não permita que a fibronectina para secar antes do plaqueamento celular.
- Placa 5 1,5x10 células por placa de 35 mm em 2 ml de aMEM 10% e incubar a 37 ° C, 5% de CO 2. Verifique após 30-45 min ao microscópio as células que são bem SEPAnominal, uma vez que têm a tendência a acumular-se no centro da placa.
- Se necessário, agitar as placas suavemente transversalmente para redistribuir as células. Placa de uma placa 35 milímetros adicional para o número de condições, a fim de contar o número de células antes da transdução de vírus.
- Crescer as células até ao dia seguinte para alcançar uma densidade celular de pelo menos 50%. Uma densidade celular inferior a 50% resulta em uma diminuição significativa da eficiência de transdução de vírus, aumentou variações de expressão da proteína por célula, e um aumento da toxicidade celular.
NOTA: Revestimento de pratos de vidro com fibronectina melhora o crescimento e morfologia celular e promove a progressão adequada de células através de mitose. Geralmente pode ser substituído por gelatina disponíveis comercialmente que é mais barato.
3. Adenovirus Transdução e proteína endógena Knockdown por siRNA transfecção em células HeLa-RFP-H2B Usando Capi precipitados
Cuidado! Trabalhoing com vírus exige precauções especiais e uma eliminação adequada de todo o material que tem estado em contacto com o vírus.
Cuidado! Em nossas mãos, Capi precipita muitas vezes têm mais efeitos indesejáveis, por exemplo, em processos biológicos que envolvem tráfico de vesículas (por exemplo, a autofagia). Por conseguinte, recomenda-se usar um reagente de transfecção lípido catiónico (ver abaixo) e para esperar, pelo menos, 48 horas antes das análises.
NOTA: Um adenovirus de controlo que transporta um gene relacionado (ou seja, LacZ) ou nenhum gene é usado para chegar a uma MOI mínima em todas as Adenofections (10-20 pfu / célula) usando a menor quantidade de adenovírus recombinante que transporta o gene de interesse.
NOTA: Este procedimento tem sido mostrado para ajudar a expressão normalizando por célula em uma população de grandes células.
- Um dia após o plaqueamento de células, contar o número de células a partir do prato plaqueadas adicional. Aspirar o meio elavar uma vez com 1 ml de 0,05% de tripsina / EDTA. Adicionar novamente 1 ml de 0,05% de tripsina / EDTA e incubar a 37 ° C, 5% de CO2 até que todas as células têm destacado. Separaram-se as células de poços utilizando uma pipeta de 1 ml e contar o número de células por ml, utilizando um hemocitómetro.
- Determinar a quantidade de vírus necessária para transduzir as células com uma multiplicidade de infecção (MOI) de 2 unidades formadoras de placas (PFU) de a proteína de interesse (POI) por célula e 18 PFU por célula de um vector vazio (por exemplo, LacZ) para ter um total de 20 PFU por célula. Ao mesmo tempo transduzir 4 UFP de cada baculovírus (actina e αTubulin, respectivamente GFP e marcaram-RFP). Transduzir as células utilizando o seguinte protocolo adenofection. Os vírus foram utilizados como descrito em Fuchs et al 14.
- Prepare em uma capa estéril um tubo de plástico de 1,5 ml para cada condição e adicionar 400 mL de aMEM-menos quente de 10%.
- Descongelar uma aliquota dos vírus lentamente sobre gelo e, se necessário, diluir tEle estoque de vírus, a fim de pipetar um volume superior a 1 ml para minimizar erros de pipetagem.
- Adicionar a quantidade calculada de vírus por condição a cada tubo de plástico de 1,5 ml contendo 400 aMEM-minus ul 10% e misture delicadamente por pipetagem. Colocar o stock de virus imediatamente de volta a -80 ° C para manter a sua actividade.
- Aspirar o meio das células e gentilmente pipeta a mistura gota a gota ao vírus. Incubar as células a 37 ° C, 5% de CO 2 e agita-se cuidadosamente as placas sob o capô estéril a cada 15 minutos durante 1 hora para assim cobrir as células com o vírus. Utilizando uma pequena quantidade de meio facilita o contacto do vírus com as células.
- Após a incubação, gentilmente pipeta 1,6 ml de aMEM-menos 10% para cada uma das placas para obter um volume total de 2 mL, iniciar a sincronização de células por adição de timidina de 2 mM e incuba-se as células durante mais 2 h a 37 ° C, 5% de CO 2 .
- Enquanto isso, prepare as followi transfecção mistura siRNAng o método de transfecção Capi (veja a Figura 1). Se não siARN é necessário, substituir a quantidade de ARNsi por água esterilizada para executar uma transfecção vazio.
- Calcular 200 ul de mistura para cada condição, resultando em 400 ul por duplicado. O exemplo seguinte é dado para uma concentração final de 50 siARN nM e tem de ser adaptada a cada uma das proteínas de interesse. Em um tubo de plástico de 1,5 ml, pipeta de 50 mL 1 M CaCl 2 e 11 ul 20 mM siRNA em 139 mL H 2 O estéril e misturar em vortex. Depois de um giro rápido, adicione cuidadosamente gota a gota 200 mL HBS2x (NaCl 280 mM, HEPES 50 mM, 1,5 mM Na 2 HPO 4, pH 7,01-7,05).
NOTA: Quanto menor as gotas do mais pequenos são os precipitados, resultando em melhor eficiência de transfecção. Misture suavemente três vezes por injeção de ar usando um ul-pipeta 200. - Incubar a mistura durante 30 min à TA. Lentamente, adicionar gota a gota 200 mL de mistura de transfecção a cada placa eagite cross-wise. Transferir as placas a 37 ° C, 5% de CO 2 durante 16 horas.
- No dia seguinte, lavar as células duas vezes com 2 ml de HEPES quentes (KCl 6,7 mM, NaCl 150 mM, HEPES 10 mM, pH 7,3) e adiciona-se 2 ml de aMEM-menos 10%. Não prossiga com mais de quatro placas da célula de cada vez porque as variações na temperatura afectar a duração do ciclo celular.
- Visualize a eficiência de infecção sob um microscópio de fluorescência invertido com uma ampliação de 20-40x (ar) e adquirir três imagens representativas por condição em ambos os canais fluorescentes e transmissão de documentação. Sete horas depois, adicionar timidina 2 mM e incuba-se durante mais 16 h a 37 ° C, 5% de CO 2.
- No dia seguinte, 48 h após siARN transfecção e infecção por vírus, lavar as células duas vezes com 2 ml quente solução salina de tampão fosfato (PBS) e solte durante 7 horas em 2 ml de aMEM 10% w / o Vermelho de Fenol para imagens de células vivas ou com fenol vermelho para extração de proteínas.
- Células colheita para cada condição de 48 horas pós-transfecção para a preparação de extractos de proteína e a análise de transferência de Western para determinar a eficiência de knockdown e a expressão da proteína endógena 15.
NOTA: Use anticorpos contra a proteína de interesse, bem como anticorpos apropriados que servem como controle de carga. A eficiência de knockdown deve ser determinada pelo carregamento de quantidades decrescentes de lisados de células de controlo (transfectadas com ARNsi de controlo), para proporcionar uma curva de titulação (ou seja, 1, ½, ¼, ⅛).
4. Adenovirus Transdução e proteína endógena Knockdown por siRNA transfecção em células HeLa Usando um catiônico Lipid Transfection Reagent
NOTA: Aqui nós apresentamos um protocolo que foi adaptado para experiências que não envolvem a sincronização das células e / ou quando o siARN transfecção não pode ser realizada pelo método Capi, por exemplo, para evitar efeitos tóxicos indesejáveis em algumas células Lines. Este protocolo também inclui um passo replating celular após adenofection a fim de trabalhar com uma densidade celular adequada. Nós só ter testado o reagente de transfecção lipídica catiônica.
Cuidado! Trabalhando com vírus exige precauções especiais e uma eliminação adequada de todo o material que tem estado em contacto com o vírus.
- Placa de 1,75 x 10 5 células por 35 milímetros prato em 2,5 ml de aMEM 10% e incubar a 37 ° C, 5% de CO 2. Placa de uma placa 35 milímetros adicional para o número de condições, a fim de contar o número de células antes da transdução de vírus.
- Crescer as células até ao dia seguinte para alcançar uma densidade celular de pelo menos 50%. Uma densidade celular de menos do que 50% resulta em uma diminuição significativa da eficiência de transdução de vírus, aumentou variações de expressão da proteína por célula, e um aumento da toxicidade celular.
- Um dia após o plaqueamento de células, contar o número de células a partir do prato plaqueadas adicional. Aspirara forma e lavar uma vez com 1 ml de 0,05% de tripsina / EDTA. Adicionar novamente 1 ml de 0,05% de tripsina / EDTA e incubar a 37 ° C, 5% de CO2 até que todas as células têm destacado. células separadas poço utilizando uma pipeta de 1 ml e contar o número de células por ml.
- Determinar a quantidade de vírus necessária para transduzir uma multiplicidade de infecção (MOI) de 20-40 unidades formadoras de placas (PFU) de a proteína de interesse (POI) por célula e 0-20 pfu por célula de um vector vazio (por exemplo, LacZ) para ter um total de 40 PFU por célula.
- Prepare em uma capa estéril um tubo de plástico de 1,5 ml para cada condição e adicionar 400 mL de aMEM quente de 10%.
- Descongelar uma aliquota dos vírus lentamente sobre gelo e, se necessário, diluir a reserva de vírus, de modo a pipetar um volume maior do que 1 ml para minimizar erros de pipetagem.
- Adicionar a quantidade de vírus calculada por condição a cada tubo de plástico de 1,5 ml contendo 400 ul aMEM 10% e misture delicadamente por pipetagem. º lugare vírus da imediatamente de volta a -80 ° C para manter a sua actividade.
- Aspirar o meio das células e gentilmente pipeta a mistura gota a gota ao vírus. Incubar as células a 37 ° C, 5% de CO 2 e agita-se cuidadosamente as placas sob o capô estéril a cada 15 minutos durante 1 hora para assim cobrir as células com a diluição do vírus. Utilizando uma pequena quantidade de meio facilita o contacto do vírus com as células.
- Ao mesmo tempo, preparar a mistura de transfecção siRNA seguindo o método de transfecção. Se não siARN é necessário, substituir a quantidade de ARNsi por meio sem soro para executar uma transfecção vazio.
- O exemplo seguinte é dado para uma concentração final de 50 siARN nM e tem de ser adaptada a cada uma das proteínas de interesse. Para cada adenofection, preparar um tubo de plástico de 1,5 ml contendo 416 nM de ARNsi em 150 ul de meio sem soro (por exemplo, 6,25 mL de 20 um siRNA + 144 ul de meio sem soro) e um tubo de 1,5 ml containi plástico6,25 ng ul reagente de transfecção catiónico lípido + 144 ul de meio sem soro.
- Misturar o conteúdo de cada tubo de plástico por pipetagem para cima e para baixo várias vezes com uma pipeta de 200 uL. Combine o conteúdo de ambos os tubos e misture pipetando cima e para baixo várias vezes com uma pipeta de 200 mL. Incubar durante 5 min à TA.
- Após a incubação com o virus, gentilmente pipeta 1,8 ml de aMEM 10% a cada placa para obter um volume total de 2,2 ml e imediatamente adicionar lentamente gota a gota, a mistura de transfecção a cada placa de siRNA e agita-se transversalmente. Transferir as placas a 37 ° C, 5% de CO 2 durante 24 horas.
- No dia seguinte, re-placa das células de cada placa de 35 milímetros em quatro novas placas de 35 mm em 2,5 ml de aMEM 10% cada um e incubar durante 24 horas adicionais a 37 ° C, 5% de CO 2.
- No dia seguinte, 48 h após a transfecção siRNA e infecção por vírus, células de colheita a partir de uma placa para cada uma das condições para a preparação deextractos de proteína e a análise de transferência de Western para determinar a eficiência de knockdown e a expressão da proteína endógena 15.
NOTA: Com as placas restantes, continue com a fixação das células, utilizando o protocolo de escolha e submeter as amostras para análise de imunofluorescência com os anticorpos de interesse 14.
5. Imagens de células vivas das células mitóticas e Análise de Dados
- Realizar experimentos com imagens de células vivas de curto prazo sobre células mitóticas com um microscópio invertido equipado com uma câmara úmida / 5% de CO 2 / regulada por termo.
Nota: Neste estudo, foi utilizado um microscópio confocal de disco giratório (40X, 0,75 NA), equipado com um EMCCD arrefecida câmara de carga acoplada à temperatura de -50 ° C. - Antes da aquisição, verificar que a câmara tenha atingido a temperatura apropriada de 37 ° C.
NOTA: Este processo pode demorar várias horas, dependendo do sistema microscópico. - Coloque as placas de cultura no micrcâmara oscope 1 h antes de aquisição para permitir o equilíbrio adequado do meio e evitar deriva foco devido a mudanças de temperatura. Monitorizar o estado mitótico das células. Neste ponto, 10-15% das células devem ser nas fases iniciais da mitose (profase-prometáfase).
- Durante o tempo de equilíbrio, configurar os parâmetros de aquisição, conforme determinado em experiências anteriores. Tipicamente, um tempo de exposição para os dois canais (488 e 594) de 0,2-3 seg com uma intensidade do laser de 100% e uma sensibilidade de 121-130 são parâmetros apropriados nas nossas mãos.
NOTA: primeiros testes devem ser feitos para determinar a mínima intensidade do laser e na aquisição de tempo / intervalo que resultam em uma resolução apropriada com fotobranqueamento mínimo que provoca danos celulares e perturba a progressão mitótico. - Escolha vários campos por condição para obter um número significativo de células a analisar, sem exceder o intervalo de aquisição. Usando um sistema confocal disco giratório, uma configuração típica será nocluir quatro condições diferentes, 7 campos por placa e 2 canais de cor (488 e 594) com um intervalo de 1,5-2 min durante um min-período 75.
- Escolha as células que estão na entrada mitótico, re-definir o foco de uma vez todos os campos foram escolhidos e começar a aquisição o mais rápido possível.
- Monitorar a estabilidade do sistema para, pelo menos, três pontos de tempo e re-ajustou-se o foco se necessário.
- Após a primeira imagem de células vivas de curto prazo de 75 min, os novos campos de células mitóticas pode ser escolhido para adquirir um segundo conjunto de filmes para aumentar o número de células a ser analisadas.
- Determinar critérios bem definidos para analisar os fenótipos de células mitóticas, o que dependerá dos marcadores fluorescentes sendo usado. Defeitos na mitose podem incluir o tempo gasto na mitose prolongada (de colapso nuclear até anaphase), o desalinhamento cromossomo, balanço do eixo, e no córtex formação de bolhas 14.
6. LifeAct-TagGFP2 Adenovirus Transdução em Differentiating C2C12 mouse mioblastos
NOTA: O protocolo adenofection também é aplicável a mioblastos de rato C2C12 difíceis de infectar submetidos a diferenciação.
- Placa de 2 x 10 5 células C2C12 em placas de cultura de 35 mm em meio de crescimento sobre plástico ou sobre um substrato de escolha.
NOTA: a diferenciação celular é melhorada em pratos gelatine- ou revestidos por Matrigel. Planejar uma placa adicional para determinar o número de células antes da transdução de vírus. - No dia seguinte, as células atingiram 80% de confluência. Induzir a diferenciação de mioblastos de lavagem das células duas vezes com PBS morno e adição de 2 ml de meio de diferenciação (DM).
- No dia seguinte, marcado como o dia 1 (D1) da diferenciação, transduzir miócitos com adenovírus LifeAct-TagGFP2 para visualizar o citoesqueleto de actina em células vivas. Contar o número de células a partir da placa adicional, tal como descrito em 3.2. Calcular 5 UFP / célula de adenovirus LifeAct-TagGFP2 AdLacZ e / célula 45 PFU após o examePLE descrito na Tabela 1. A quantidade de vírus total é de 50 UFP / célula. Os vírus foram utilizados como descrito 14
- Prepare em uma capa estéril um tubo de plástico de 1,5 ml para cada condição e adicionar 400 mL de DM quente.
- Descongelar uma aliquota dos vírus lentamente sobre gelo e, se necessário, diluir a reserva de vírus, de modo a pipetar um volume maior do que 1 ml para minimizar erros de pipetagem.
- Adicionar a quantidade apropriada de partículas de vírus por condição a cada tubo de plástico de 1,5 mL contendo 400 uL de DM e misturar suavemente por pipetagem. Colocar o stock de virus imediatamente de volta a -80 ° C para manter a sua actividade.
- Aspirar o meio dos pratos e gentilmente pipeta a mistura de vírus gota a gota. Incubar as células a 37 ° C, 5% de CO 2 e agita-se cuidadosamente as placas sob o capô estéril a cada 15 min durante um total de 1 h, para assim cobrir as células com o vírus.
- Após a incubação, gentilmente pipeta 1,6 ml de DM em cada prato e continuar a incubation durante mais 2 horas adicionais a 37 ° C, 5% de CO 2.
- Enquanto isso, prepare uma mistura de transfecção vazio seguindo o método de transfecção Capi. Calcular 200 uL de mistura para cada condição. Utilizar o seguinte exemplo, para um volume total de 400 uL de mistura.
- Em um tubo de plástico de 1,5 ml, pipeta de 50 mL 1 M de CaCl2 em 150 ml de H 2 O estéril e misturar em vortex. Depois de um giro rápido, adicione cuidadosamente gota a gota 200 mL HBS2x (NaCl 280 mM, HEPES 50 mM, 1,5 mM Na 2 HPO 4, pH 7,01-7,05). Misture delicadamente por injeção de ar três vezes com uma pipeta de 200 mL.
- Incubar a mistura durante 30 min à TA. Adicione lentamente gota a gota 200 ul da mistura de transfecção a cada placa e agite cross-wise. Transferir as placas a 37 ° C, 5% de CO 2 durante 16 horas.
- No dia seguinte, lavar as células duas vezes com 2 ml de HEPES quentes (KCl 6,7 mM, NaCl 150 mM, HEPES 10 mM, pH 7,3) e adiciona-se 2 mL de DM. Visualize a INFEeficiência ction sob um microscópio de fluorescência invertido com uma ampliação de 20-40X (ar) e adquirir três imagens representativas por condição em ambos os canais fluorescentes e transmissão de documentação.
- Dependendo da configuração da experiência desejada, siga diferenciação em miotubos por vários dias. As células podem ser fixadas e, posteriormente, submetidos a uma análise de imunofluorescência ou estudos de imagem de células vivas pode ser realizada.
Resultados
A transfecção de ADN do plasmídeo BAG3-GFP usando lípidos catiónicos foi associado com expressão heterogénea em células HeLa, células que apresentam alguns níveis quase indetectáveis da proteína e outras com níveis muito elevados BAG3 (Figura 2A). Nestas células, a perda da homeostase proteína foi evidenciado pela acumulação de BAG3-GFP em agregados perinuclear (Figura 2A, setas). Em contraste, a transdução de células com adenovírus que transportam BAG3-GFP exibiu baixa expressão mais homogênea e localização precisa da BAG3-GFP (Figura 2B, a infecção por si só). Notavelmente, a adição de lípidos catiónicos durante a transdução de adenovírus (por exemplo, transfecção de partículas de adenovírus) aumentou significativamente a expressão BAG3-GFP por célula a MOI semelhante, ao mesmo tempo que permitiu manter expressão homogénea na maioria das células (Figura 2B, Adenofection).
Adenofection permitido o esgotamento eficiente dos BAG3 endógeno e reintrodução de proteínas BAG3-GFP nos níveis endógenos perto, seja através de Capi precipita ou compostos à base de lipossomas para aumentar a eficácia de transdução-transfecção em células HeLa. A Figura 3 mostra uma experiência típica com o tipo selvagem BAG3 (WT) -GFP ou uma BAG3 (IPV) -GFP mutações variantes rolamento que suprime a ligação a um dos seus parceiros chaperonas HSPB8 (Figura 3A, 3B). Consistente com um papel para BAG3 na estabilização de HSPB8 7, silenciamento de BAG3 levou a uma diminuição ~ 50% nos níveis de HSPB8, que foi restaurado para níveis normais após reintrodução de BAG3 WT, mas não através da expressão de níveis semelhantes de o mutante de BAG3 (IPV) -GFP ou de GFP sozinho. Sob estas condições, as proteínas BAG3-GFP foram adequadamente localizada dentro de ~ 75-90% das células, sendo enriquecidas as regiões perinucleares-centrosomal (Figura 3C, 3D). este suggsados que adenofection preservada a dinâmica de BAG3 e do complexo BAG3-HSPB8 em células.
HSPB8 e BAG3 são regulados positivamente por vários stresses que proteotoxic também perturbam Proteostase 10 do citoesqueleto. Daí a superexpressão das chaperones pode potencialmente perturbar a montagem de desmontagem de estruturas macromoleculares controladores morfodinâmica celulares. De modo a avaliar o papel de BAG3-HSPB8 sob condições não-tensionada, era importante verificar que a homeostase de proteína foi minimamente perturbado pelo procedimento adenofection. Para esse fim, o acompanhamento variações nos níveis de chaperonas da família de proteínas de choque térmico é uma boa indicação do estado de homeostase de proteína. Como mostrado na Figura 4, adenofection pelo Capi ou métodos não aumentou significativamente os níveis de HSPB8 endógena e BAG3, ou a do sistema principal chaperona HSP70 / HSPA1 lipossoma à base de. Em contraste, típicotratamentos proteotoxic como choque térmico ou MG132, um inibidor de proteassoma, aumentou os níveis das proteínas de chaperona cochaperone em células HeLa.
Em seguida, procurou determinar se o procedimento adenofection combinado com baculovírus expressão de sondas fluorescentes de actina e tubulina (BacMam-RFP-actina e GFP-αtubulin) de condução era apropriada para seguir a dinâmica das células mitóticas. Como mostrado na Figura 5, adenofection de células HeLa com um ARNsi de controlo (siCTL) não perturbe a dinâmica do fuso mitótico (verde) ou o tempo médio gasto na mitose (Figura 5A, confocal representante sequências de lapso de tempo). A proporção de células que mostram estes eventos mitóticos anormais estava em conformidade com os níveis de defeitos mitóticos geralmente observados em linhas de células de cancro (~ 30% -40%, Figura 5B). Em contraste, as células adenofected apenas com ARNsi específico BAG3-(siBAG3) exibiu um aumento de ~ 2 vezes no níl de defeitos fenotípicas mitose, o que foi restaurado para perto do nível em células de controlo por BAG3-GFP (WT), mas não por GFP sozinho. Este validada a adequação de adenofection para análise funcional do impacto de BAG3 e seus acompanhantes associadas na dinâmica do citoesqueleto que regulam a progressão adequada das células dentro e fora da mitose, como mostrado por Fuchs et al 14.
Para verificar a versatilidade do método adenofection, que, em seguida, o protocolo adaptado para permitir a visualização de F-actina durante a diferenciação de miócitos rato C2C12, usando o disponível comercialmente adenovírus-LifeAct-GFP para marcar F-actina 16. células C2C12 foram induzidas para se diferenciarem por um dia antes Adenofection. Usando o protocolo à base de adenofection Capi, notavelmente baixas quantidades de Adenovírus-LifeAct-GFP foi suficiente para expressar a sonda a um nível que foi facilmente detectada por microscopia de fluorescência em uma proporção significativa de difere ntiating miócitos (/ ~ 3-5 células PFU; Figura 6). Isto estava em contraste acentuado com a extremamente alta multiplicidade de infecção relatado na literatura para transduzir as células de rato C2C12 (na ordem de 250-400 MOI) 17-19. Além disso, através da monitorização do processo de diferenciação por 7 dias, foi estabelecido que miotubos formação não foi significativamente prejudicada pelo procedimento. Isto sugeriu que a fusão dos miócitos, um processo que se baseia na dinâmica de actina afinado 20, não foi perturbado por expressão de baixos níveis de LifeAct-GFP (Figura 6, dia 6 e no dia 7). Uma vez que o marcador fluorescente pode ainda ser detectada por muitos dias depois de adenofection de células C2C12, nós acreditamos que este método será adequado para análises funcionais do impacto de chaperones sobre a dinâmica de actina em diferentes fases de C2C12 miogénese.

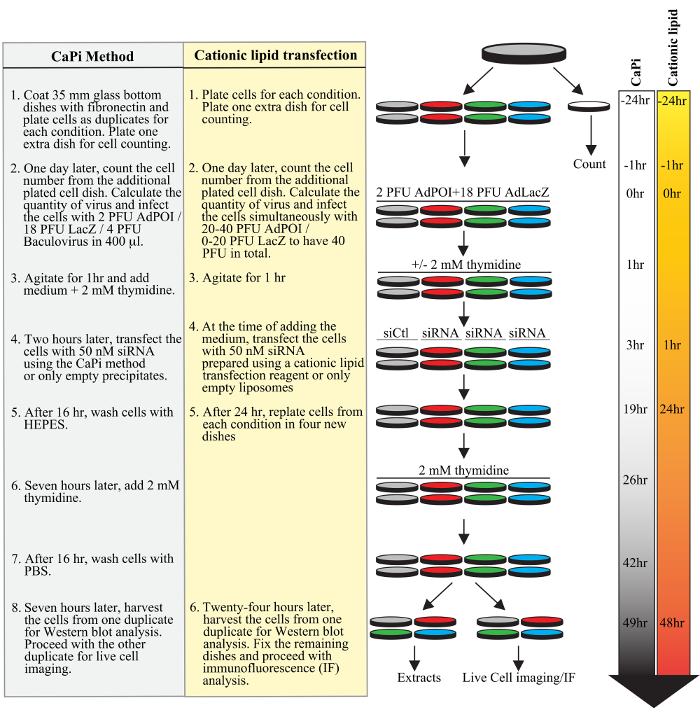
Figura 1. Planejamento de um protocolo adenofection típico. Etapas sucessivas de uma experiência típica são mostrados no protocolo com precipitados Capi (sublinhado em cinza) ou o protocolo usando um reagente de transfecção catiónico lipídico (em amarelo), incluindo chapeamento celular, transdução de transfecção adeno- e baculovírus, de ARNic em cadeia dupla, e sincronização celular com um bloco timidina duplo. linhas de tempo em horas para ambos os protocolos são mostrados no lado direito da figura.fig1large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
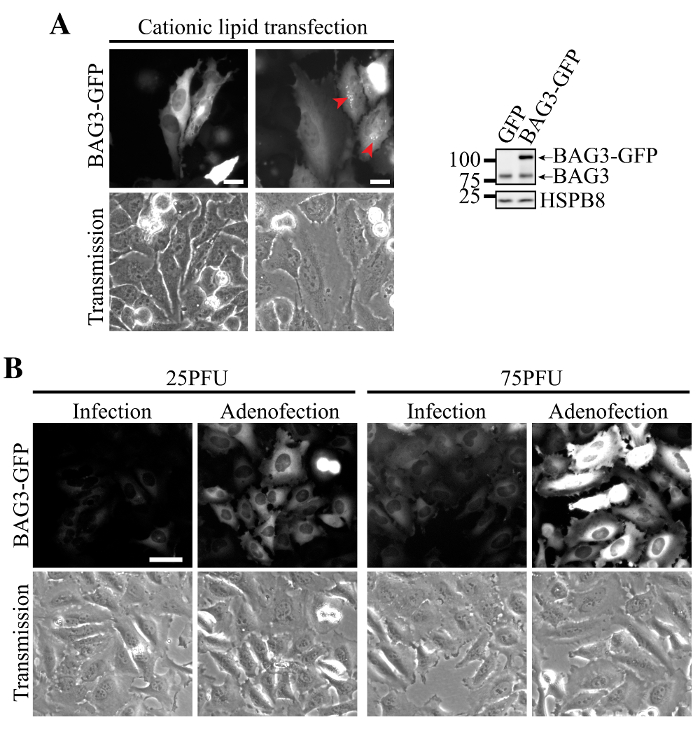
Figura 2. expressão homogénea e eficiente de BAG3-GFP utilizando Adenofection. (A) imagens de epifluorescência representativos de células HeLa que tinham sido transfectadas com ADN de plasmídeo BAG3-GFP, que mostra agregados perinuclear da proteína em níveis de expressão elevados (designadas pelas setas) e expressão heterogénea dentro da população de células. Western blots mostram maior expressão de BAG3-GFP em relação aos níveis endógenos BAG3 na população celular total, o que indica que a proteína é em grande parte sobre-expressos em algumas células. (B) as imagens de epifluorescência representativos de células HeLa que tinham sido transduzidas única ou adenofected utilizando quantidades crescentes de partículas de vírus Ad-BAG3-GFP. imagensforam adquiridos usando parâmetros idênticos e foram igualmente processados para a subtracção de fundo e intensidade; Bar:. 50 mm Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. knockdown eficiente da BAG3 e reintrodução de proteínas BAG3-GFP em níveis endógenos próximos. Células (ab) HeLa que expressam RFP-H2B (A) ou as células HeLa progenitoras (B) foram adenofected com os ARNsi indicados e adenovírus recombinantes utilizando o Capi método (A) ou os compostos à base de lipossomas como reagente de transfecção (B). As células foram sincronizadas pelo método bloco timidina casal e extractos celulares totais foram preparados durante a segunda fase de lançamento. Weste rn blots mostram níveis BAG3 depleção BAG3 (endógenas), os níveis de proteínas BAG3-GFP adenofected, e os níveis endógenos de HSPB8; níveis de GAPDH: controle de carga. A depleção foi estimado em> 75% por carregamento de quantidades decrescentes de extractos de controlo (adenofected com ARNsi de controlo-siCtl e BAG3 WT-GFP, ou seja, ½, ¼). Note-se que as proteínas BAG3-GFP individuais foram introduzidas perto do nível endógeno do BAG3 e que tipo selvagem BAG3-GFP, mas não BAG3 (IPV) -GFP ou GFP sozinho, restaurado níveis HSPB8 em células com depleção de BAG3. (CD) imagens de epifluorescência representativos de células HeLa que tinham sido adenofected com o indicado recombinante Ad-BAG3-GFP utilizando o reagente de transfecção Capi ou lípido catiónico. Barras: 20 uM. Os resultados representativos mostrados em (A) e (C) são modificados de Fuchs et al., PLoS Genet. 2015 23 de outubro; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14.iles / ftp_upload / 54557 / 54557fig3large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 4. Adenofection não induz uma resposta ao estresse em células HeLa Western blot de extratos totais de células preparadas a partir de células HeLa controle. (NT: não tratados) ou células HeLa transfectadas com controle siRNA sozinho (siCtl, não adenovirus) ou adenofected com siCtl e Ad-GFP usando Capi ou reagente de transfecção lipídica catiônica, ou a partir de células HeLa submetidas a tratamentos proteotoxic típicos (HS: choque térmico a 44 ° C durante 60 minutos, seguido de 16 horas de recuperação, a 37 ° C; MG132: inibidor do proteassoma, 5 mM durante 16 horas), mostrando os níveis de BAG3, HSPB8 e de outras chaperones de stress-inducible, nomeadamente HSP70 / HSPA / e HSP27 / HSPB1; GAPDH: carregamento de controle. Note-se que enquanto que os níveis de todos os proteínas exceto GAPDH foram aumentados mediante tratamentos de estresse proteotoxic, eles permaneceram inalterados por adenofection. Variações do nível de proteína foram avaliadas através do carregamento de quantidades variadas de extractos de células SH que suportará aumentos típicos em HSPs. (HS: 1, ½, ¼, ⅛; por exemplo, HSP70 foi induzida por mais do que oito vezes em resposta a proteotoxic stress) Por favor clique aqui para ver uma versão maior desta figura.
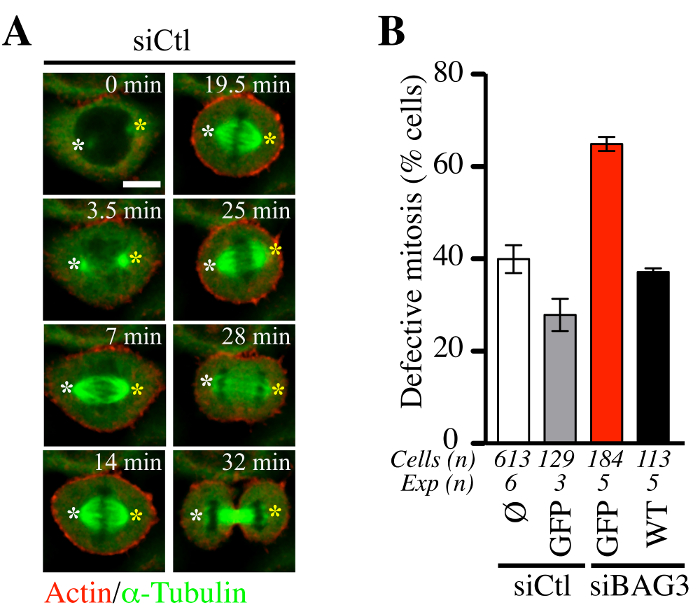
Figura 5. A progressão de células HeLa através de mitose não é significativamente perturbados por Adenofection. (A) sequências de lapso de tempo confocal representativas de células HeLa que tinham sido adenofected com um ARNsi de controlo (siCtl) em conjunto com BacMam- GFP-α-tubulina e BacMam -RFP-actina e fotografada por fiação disco microsco confocalaa para 60 a 90 minutos em intervalos de ~ 1,5 min. Branco e amarelo asteriscos designar a posição de pólos do fuso que permaneceram relativamente estáveis. Barra: 10 um. (B) Quantificação de células adenofected com siCtl ou ARNsi específicos de BAG3, com ou sem as proteínas GFP indicados (GFP sozinho ou tipo selvagem BAG3-GFP: WT). O gráfico mostra as percentagens de células com mitose anormal definido como oscilação do fuso e parado na mitose +/- ou desalinhamento cromossoma. São mostrados os meios +/- SE. Os resultados representativos mostrados em (B) foram tomados a partir de Fuchs et al., PLoS Genet. 2015 23 de outubro; 11 (10): e1005582, doi: 10.1371 / journal.pgen.1005582 14. Por favor clique aqui para ver uma versão maior desta figura. Por favor clique aqui para ver o filme associado com o painel (A).

Figura 6. Adenofection de miócitos C2C12 com Ad-LifeAct-GFP e formação de miotubos. Imagens de epifluorescência representativos de células C2C12 que tinham sido induzidos a diferenciar e processados para adenofection 1 dia mais tarde usando 5 UFP / célula de LifeAct-GFP e 45 UFP / célula de LacZ. Imagens de mostrar a expressão do marcador de GFP durante o processo de diferenciação (dia 2, dia 6 e no dia 7). Bares:. 20 mm Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Aqui, foi descrito um método que permite técnicas de depleção de resgate a ser executada, o que é aplicável para análises funcionais dos processos celulares biológicas que são particularmente sensíveis à sobre-expressão de proteínas que afectam a estequiometria e a dinâmica de complexos de proteínas e estruturas macromoleculares. divisão celular mitótico é um exemplo extremo de morfodinâmica celulares afinado que envolve os mais dramáticos e espetaculares mudanças na estrutura global de uma célula. Usando adenofection combinado com os reagentes comercialmente disponíveis BacMam para introduzir valores baixos mas detectáveis de marcadores de actina e tubulina para imagens de células, a contribuição da chaperona complexo BAG3-HSPB8 a remodelação de células mitóticas adequada pode ser claramente demonstrado. Em um estudo recente realizado por Fuchs et al., Temos demonstrado que a depleção de BAG3 provoca defeitos na orientação do fuso que estão relacionados com a incapacidade de estabelecer um córtex mitótico actina rígida e montar ricos em actinafibras de retracção 14. dinâmica do fuso adequadas poderia ser restaurado por reintrodução do tipo selvagem BAG3-GFP, que também corrigiu a diminuição observada nos níveis de HSPB8 sobre silenciamento BAG3. Isto implica que adenofection permite a recuperação de um complexo de chaperona fisiologicamente relevante que se correlaciona com a recuperação funcional da dinâmica do fuso.
Uso de adenofection para experiências de depleção de salvamento proporciona uma vantagem sobre a transfecção de ADN de plasmídeo ou nucleofection, o que pode resultar numa indução potente de uma resposta ao stress, em alguns tipos de células (isto é, autophagy) 21, o que torna praticamente impossível de analisar o impacto de um dada chaperona e o seu papel fisiológico. Com efeito, no nosso lado, transfecção de ADN do plasmídeo BAG3 está associado a uma maior expressão por célula, a formação de agregados, e os efeitos sobre a apoptose de células / sobrevivência em vários tipos de células (Figura 2). BAG3 é um cochaperone modular com actividade de andaime, que may desempenhar múltiplos papéis, dependendo suas proteínas parceiras 9. Assim, perturbações de estequiometria complexo, a superexpressão de BAG3 pode ter efeitos negativos dominantes indesejáveis e induzir toxicidade. Alta capacidade de adenovírus recombinante é um veículo ideal para o fornecimento transiente e segurança de grandes genes em ambos dividindo e células em cultura que não se dividem, uma vez que não se integram no genoma da célula hospedeira, em contraste com os vectores baseados em lentivírus para que alguma segurança continuam a existir preocupações. potencial desvantagem da utilização de adenovírus para experiências de depleção de salvamento é que eles exigem repetido preparação, o que pode ser demorado. Eles também contam com titulação cuidadosa de partículas infecciosas para a eficácia de transdução reprodutível.
Usando adenofection para rastrear a contribuição de domínios funcionais BAG3 conhecido, obtivemos a primeira evidência, ao nosso conhecimento, para a existência de uma função BAG3-dependente HSPB8 no funcionamento normalde células, que não requerem a sua interacção com o sistema de chaperona HSP70 / HSPA1 dividindo. Adenofection deve ser aplicável para rastrear F-actina durante o processo de diferenciação de miócitos em miotubos, tal como sugerido pelos dados aqui apresentados. Assim, o nosso método fornece um protocolo versátil e eficiente para experimentos depleção de resgate com base em siRNA com impacto mínimo na morfodinâmica celulares que deve ser úteis em uma ampla gama de projectos em que a análise estrutura-função de um gene de interesse está a ser prosseguidos.
Explorando catiónicos Compostos de lípidos a fim de alcançar a transfecção eficiente-transdução de células com a menor quantidade de partículas de vírus é a chave para este método. Enquanto ele fornece uma janela maior para controlar os níveis de proteínas exógenas por célula, acreditamos que ele permite ainda minimizando efeitos colaterais potenciais sobre vias de transdução de sinal que resultam de células adenovírus vinculativo-entrada, que deve mitigar o impacto de aprotein de interesse nas vias morfogenéticas.
Deve notar-se que os reagentes diferentes para aumentar a eficácia de transdução de adenovírus estão disponíveis comercialmente, tais como o receptor de reforço CARRO. Tais reagentes são caros, no entanto, e espera-se para promover a ligação do vírus-entrada nas células de uma forma que exige que o receptor de carro, que tal como acima referido tem sido demonstrado que activam as vias associados com a forma da célula e adesão de sinalização. Enquanto Capi é mais barato do que os lipossomas catiónicos como um meio para potenciar a entrada de adenovírus através de uma via independente do carro, ele também é mais tóxico para algumas linhas celulares. Recomendamos ensaio prévio de um adenofection vazio para orientar a escolha entre Capi vs reagente de lípido catiónico, dependendo da linha celular utilizada e a leitura biológico de interesse.
abordagens knockdown de resgate, juntamente com novas ferramentas biotecnológicas de edição genoma, baseados no RNA de interferência, tais como a descrita aqui, oferecem um array de ferramentas moleculares poderosas para descobrir a função do gene em células, que agora podem ser perfeitamente escolhidos pelos investigadores dependendo aplicações específicas 3. Acreditamos que adenofection fornece um sistema relativamente simples e rápido para criar knockdowns hipomórfico para análises estrutura-função da contribuição de uma proteína de interesse em vários fundos celulares.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Materiais
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
Referências
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462 (2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889 (2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141 (2011).
- Guilbert, S. M., Tanguay, R. M., Hightower, L. E., et al. . The Big Book of Small Heat Shock Proteins. , 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582 (2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294 (2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2 (2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados