Method Article
Adenofection: منهج في دراسة دور الجزيئية الوصيفات في الخلوي Morphodynamics من التجارب استنفاد الانقاذ
In This Article
Summary
We describe a method for depletion-rescue experiments that preserves cellular integrity and protein homeostasis. Adenofection enables functional analyses of proteins within biological processes that rely on finely tuned actin-based dynamics, such as mitotic cell division and myogenesis, at the single-cell level.
Abstract
تخضع العمليات الخلوية مثل الانقسام وتمايز الخلايا عن طريق التغييرات في شكل الخلية التي تعتمد إلى حد كبير على إعادة السليم للهياكل الخلية هيكل الخلية. وهذا ينطوي على التجميع تفكيك العليا الهياكل الجزيئات في وقت معين، والمكان، وهي عملية حساسة بشكل خاص للاضطرابات الناجمة عن overexpression من البروتينات. الأساليب التي يمكن الحفاظ على توازن بروتين والحفاظ على القصير وطبيعي التشكل الخلوي هي مرغوب فيه للغاية لتحديد مساهمة الوظيفية للبروتين من الفائدة في مجموعة واسعة من العمليات الخلوية. عابرة التجارب استنزاف الانقاذ بناء على تدخل الحمض النووي الريبي هي نهج قوية لتحليل وظائف البروتين والمتطلبات الهيكلية. ومع ذلك، إعادة إدخال البروتين الهدف مع الحد الأدنى من الانحراف عن مستواه الفسيولوجية هو التحدي الحقيقي. نحن هنا وصف طريقة تسميته adenofection التي وضعت لدراسة دور الجزيئات المصاحبة لشركاء التطوير في التشغيل العادي للتقسيم الخلايا والعلاقة مع إعادة الأكتين. تم استنفاد خلايا هيلا من BAG3 مع الدوبلكس سيرنا تستهدف المنطقة 3'UTR. ويعيد البروتينات BAG3 الموسومة GFP في وقت واحد في> 75٪ من الخلايا باستخدام الفيروسات الغدية المؤتلف بالإضافة إلى الكواشف ترنسفكأيشن. Adenofection سكريبت لتتمكن من التعبير عن البروتينات BAG3-GFP في المستويات الفسيولوجية تقريبا في خلايا هيلا المنضب من BAG3، في ظل عدم وجود استجابة التوتر. لم يلاحظ أي تأثير على مستويات مرافقين بروتين الصدمة الحرارية الذاتية، المنظمين من الإجهاد محرض الرئيسية للتوازن البروتين. وعلاوة على ذلك، وذلك بإضافة baculoviruses القيادة التعبير عن علامات الفلورسنت في وقت خلية التنبيغ ترنسفكأيشن، يمكننا أن تشريح ديناميات الخلايا الإنقسامية التي كتبها المجهرية الوقت الفاصل بين يحلل مع الحد الأدنى من اضطراب التقدم الإنقسامية العادي. Adenofection ينطبق أيضا على خلايا فأر التي يصعب تصيب، ومناسبة للتحليلات وظيفية فرق بالخلايا العضلية الجذعيةerentiation إلى myotubes. وهكذا يوفر adenofection طريقة تنوعا لأداء هيكل الوظائف تحلل البروتينات المشاركة في العمليات البيولوجية الحساسة التي تعتمد على العليا ديناميات هيكل الخلية.
Introduction
تعطيل وظيفي في التعبير الجيني في خلايا الثدييات هو معيار الذهب لتشريح وظائف البروتين. وضعت حديثا تقنيات التحرير الجينوم على أساس استخدام nucleases مواقع محددة مثل nucleases الزنك الاصبع وتتجمع interspaced بانتظام يكرر المتناوب قصيرة (كريسبر) / CAS9 تسمح الآن جيل من خطوط الخلايا مع حذف الجينات المستهدفة وطفرة 1،2. وينبغي لهذه المناهج الجديدة ثورة في الطريقة التي ندرسها وظيفة البروتين وفهمنا لعلم الوراثة من الأمراض التي تصيب الإنسان. في بعض الحالات، ومع ذلك، على المدى الطويل أو بالضربة القاضية جين كامل غير مرغوب فيه وربما يثير آليات التعويض خلية الثانوية. جيل من خطوط الخلايا المعدلة وراثيا ويمكن أيضا أن يكون الحد عند التعامل مع الثقافات الخلية الأولية مع قدرة انتشار محدودة، أو عندما يطلب فحص مجموعة كبيرة من الطفرات في مختلف أنواع الخلايا. وغالبا ما تطلب الأمر ذلك لتحديد تبعية خلية بعملية iological على متطلبات الهيكلية للبروتين. تحقيقا لهذه الغاية، ضربة قاضية عكسها عن طريق تدخل الحمض النووي الريبي التي تمكن التجارب استنزاف الانقاذ عابرة في مختلف الخلفيات الخلوية لا تزال مقاربة بسيطة وقوية لأداء هيكل الوظائف تحلل بروتين من الفائدة 3. ومع ذلك، فإن العيب الرئيسي لهذا النهج هو صعوبة لتحقيق إسكات كفاءة ولإعادة البروتين من الفائدة أو مشتقاته في مستويات الفسيولوجية تقريبا في غالبية السكان الخلية. هذا أمر بالغ الأهمية لتمكين الدراسات الشاملة التي تحاول ربط آثار وظيفية ينظر على مستوى الخلايا واحد (النمط الظاهري hypomorphic) مع تلك التي ظهرت في المقايسات القائمة على السكان الخلية، على سبيل المثال على تفاعلات البروتين البروتين.
باستخدام أساليب ترنسفكأيشن الكلاسيكية، يمكن للمرء أن من الصعب تحقيق التعبير متجانسة وانخفاض البروتينات الخارجية في عدد كبير من الخلايا. تنبيغ من الخلايا التي تحتوي على فيروسات المؤتلفمثل الفيروسات الغدية في كثير من الأحيان يمكن التعبير أكثر طبيعية من البروتينات الخارجية. ومع ذلك فإن امتصاص اتش محدودة من قبل مستقبلات CAR، الذي هو غائب في خلايا غير بشرية أو فقط أعرب ضعيف في بعض أنواع الخلايا البشرية. وعلاوة على ذلك، فإن دخول الخلوي من الفيروسات الغدية ينشط مسارات الإشارات التي تنظم شكل الخلية والتصاق 4-6. ومن الواضح أن هذا غير مرغوب فيه عند دراسة الآليات التنظيمية morphodynamics الخلية. كنا في مواجهة هذه الإشكالية عندما قمنا بها تحليلات وظيفية مجمع كوصي، BAG3-HSPB8، في انقسام الخلايا وديناميات الأكتين. وكان العمل الرائد وصفت دور لهذا المجمع كوصي في مراقبة الجودة البروتين والالتهام الذاتي أثناء الإجهاد 7،8. معظم هذه الدراسات، ومع ذلك، تعتمد على overexpression البروتين، على افتراض أن المحرمين وupregulated عادة أثناء الإجهاد. وقد ترك هذا الباب مفتوحا أمام مسألة ما إذا كان BAG3، في مجمع مع HSPB8، يمكن أن تسهم في التشغيل العادي للتقسيم الخلايا معربا عن عشرمرافقين جنوب شرقي مثل العديد من أنواع الخلايا السرطانية 9. على وجه الخصوص، ما إذا كان مجمع كوصي يساهم في إعادة بناء الهياكل القائمة على الأكتين التي تتحكم في تطور الإنقسامية كانت ذات أهمية كبيرة، نظرا للصلات الناشئة بين المحرمين HSPB وديناميات هيكل الخلية 10. لمعالجة هذه المسألة، كنا نسعى إلى تطوير وسيلة فعالة للتجارب استنفاد الإنقاذ التي لن تتداخل مع تطور الإنقسامية أو التشكل الخلوي، والتي من شأنها الحفاظ على توازن البروتين لتجنب اضطراب ثانوي لديناميات المجمعات الجزيئات تنظيم التغييرات خلية الشكل . وبالتالي من الناحية المثالية، يجب أن يتم تنفيذ استنفاد إضافة الخلفي من الجينات في المصالح في وقت واحد.
وقد وصفت استخدام المجمعات من اتش مع البوليمر الموجبة أو الدهون لتعزيز نقل الجينات في المختبر والمجراة 11،12. على سبيل المثال، يظهر فوسفات الكالسيوم (التعريب) لتشكيل يعجل معاتش التي تعزز فيروس ملزم دخول عبر مستقلة CAR المسار 13. في الواقع، وجدنا أن الجمع بين القائم اتش تنبيغ الخلية وترنسفكأيشن مع المركبات الموجبة يمكن أن تعزز كفاءة التجارب استنزاف الانقاذ. وهذا ما سمح لنا لخفض كميات الفيروس عن طريق 3- إلى 20 أضعاف، اعتمادا على خط الخلية والجينات في المصالح، والاستفادة من نافذة أوسع من أجل ضبط التعبير عن البروتينات الخارجية في المستويات الخفية تقريبا في غالبية من سكان الخلية في المصالح مع الحد الأدنى من التأثير على التشكل الخلوي. في ظل هذه الظروف، يمكننا أيضا تحقيق درجة عالية من الكفاءة ضربة قاضية للتعبير البروتين الذاتية (> 75٪). وصفنا بهذا الخطوة طريقة خطوة، وتقديم أدلة على أن توازن البروتين ليست منزعجة بشكل كبير وفقا لتقييم مستويات دون تغيير من المحرمين التوتر الناجم عن الأسرة البروتين الحرارة صدمة، مما يجعل طريقة مناسبة للتحليلات وظيفية رو الفسيولوجيةلو من الجزيئات المصاحبة التي كتبها الوقت الفاصل بين المجهري الفيديو. البروتوكول هو قابل للإجراءات تزامن انقسام الخلية واستخدام baculoviruses المتاحة تجاريا للمشاركة في التعبير عن مستويات منخفضة من علامات الفلورسنت، مع الحد الأدنى من التدخل في ديناميات القائم على الأكتين والمغزل العادية خلال التقدم الإنقسامية. وتبين لنا كذلك براعة الأسلوب، والتي تنطبق على "من الصعب تنبيغ" خلايا C2C12 الماوس، مع عدم وجود تأثير كبير على التمايز بالخلايا العضلية الجذعية في myotubes في المختبر.
Protocol
1. إعداد المتوسطة وحلول (كل العقيمة التي تمت تصفيتها)
- C2C12 خلايا العضلات الماوس (دراسات التمايز)
- إعداد 500 مل من النمو المتوسطة لC2C12 صيانة زراعة الخلايا: DMEM الجلوكوز عالية تستكمل مع 10٪ FBS و2mm و L-الجلوتامين.
- إعداد 100 مل متوسطة التمايز (DM) للتمايز C2C12: DMEM الجلوكوز عالية تستكمل مع 2٪ الحصان المصل.
- خلايا هيلا (دراسات في الخلايا الإنقسامية)
- إعداد 500 مل αMEM لهيلا طلب تقديم العروض، H2B صيانة زراعة الخلايا والتجارب: αMEM تستكمل مع FBS 10٪ و 2 مم L-الجلوتامين (αMEM 10٪).
- إعداد 500 مل αMEM ناقص (بدون deoxyribonucleosides / ribonucleosides) لمزامنة خلية طلب تقديم العروض، H2B هيلا: αMEM ناقص تستكمل مع FBS 10٪ و 2 مم L-الجلوتامين (αMEM-ناقص 10٪).
- إعداد 20 مل αMEM دون الفينول الأحمر لهيلا-RFP-H2B لإيف خلية الاستحواذ: αMEM دون الفينول الأحمر تستكمل مع FBS 10٪ و 2 مم L-الجلوتامين.
- إعداد 100 ملي الثيميدين: حل 24.2 ملغ في 1 مل H 2 O عند 37 درجة مئوية قبل vortexing. فلتر تعقيم والحفاظ على 4 درجات مئوية.
- حلول مشتركة
- إعداد 0.05٪ التربسين / EDTA: 0.05٪ التربسين، 0.625 ملي EDTA في 1X الفوسفات مخزنة المالحة (PBS). فلتر تعقيم وقسامات مخزن في -20 درجة مئوية. إذابة مرة واحدة، والحفاظ على قسامة في 4 درجات مئوية.
- إعداد HBS2x: 280 مم كلوريد الصوديوم، و 50 ملي HEPES، 1.5 ملي نا 2 هبو 4. ضبط درجة الحموضة تماما بين 7،01-7،05 مع 10 N هيدروكسيد الصوديوم. تصفية العقيمة والحفاظ على 4 درجات مئوية.
2. طلاء لوحات ثقافة الخليوي مع [فيبرونكتين وطلاء من خلايا هيلا-RFP-H2B
ملاحظة: قبل التجربة، يجب على كل متلاعب اقامة الظروف خلية الطلاء المثلى لتحقيق الكثافة المناسبة الخلايا منذ الاختلافات قد OCالوغد بين كل متلاعب وكل سطر مختلفة من الخلايا.
- قبل يوم من التجربة، وتوسيع خلايا هيلا-RFP-H2B للتأكد من أنها ضمن المرحلة الأسي النمو في يوم من الطلاء. جعل 2 المتعاقبة 1/3 التخفيفات في 10 سم لوحات تبدأ من 80٪ متموجة 1X10 سم لوحة.
ملاحظة: خطط عدد من لوحات للتجربة. حساب كل حالة كما التكرارات، واحدة للتصوير الخلايا الحية على المدى القصير واحد من البروتين مقتطفات لتحديد مدى فعالية من ضربة قاضية وبروتين تعبير خارجي عن طريق تحليل لطخة غربية. تخطيط لوحة إضافية واحدة لتحديد عدد الخلايا قبل تنبيغ الفيروس. - قبل الخلية والطلاء، ومعطف الزجاج أطباق أسفل مع 10 ميكروغرام / مل فبرونيكتين. إضافة 1 مل من 1: 100 التخفيف من 1 ملغ / مل فبرونيكتين (المخفف في العقيمة برنامج تلفزيوني 1X) لكل 35 مم طبق لتغطية جيدا السطح كله واحتضان لمدة 1 ساعة على 37 درجة مئوية، و 5٪ CO 2.
- أثناء الحضانة، على أن تستكمل αMEM قبل الحارة وايال 10٪ FBS (αMEM 10٪) و 0.05٪ التربسين / EDTA عند 37 درجة مئوية.
- بعد 45 دقيقة من الحضانة، والبدء في التحضير حل الخلية. في غطاء العقيمة، نضح المتوسطة من لوحة 10 سم، وشطف بلطف مرتين مع 1.5 مل 0.05٪ التربسين / EDTA، وترك 0.5 مل من التربسين / EDTA في التطلع الماضي.
- احتضان الخلايا لمدة 2-3 دقائق عند 37 درجة مئوية، و 5٪ CO 2. من خلال استغلال بلطف لوحة والمراقبة تحت المجهر، تحقق من أن كل الخلايا تم فصل. إضافة 10 مل من αMEM 10٪ وماصة بلطف عدة مرات لفصل الخلايا. عدد عينة 10 ميكرولتر من تعليق الخلية باستخدام عداد خلايا الدم.
- نضح الحل فبرونيكتين من الأطباق أسفل الزجاج. لا تسمح الفيبرونكتين لتجف قبل الطلاء الخلية.
- لوحة 1.5x10 5 خلايا لكل 35 طبق مم في 2 مل αMEM 10٪ واحتضان عند 37 درجة مئوية، و 5٪ CO 2. تحقق بعد 30-45 دقيقة تحت المجهر أن الخلايا هي سيبا جيدمصنفة، لأن لديهم الميل إلى تراكم في وسط اللوحة.
- إذا لزم الأمر، تستنهض الهمم لوحات بلطف عبر الحكيمة لإعادة توزيع الخلايا. لوحة واحدة لوحة 35 ملم إضافية لعدد من الشروط من أجل إحصاء عدد الخلايا قبل تنبيغ الفيروس.
- تنمو الخلايا حتى اليوم التالي لتحقيق كثافة الخلية لا يقل عن 50٪. وكثافة الخلايا أقل من 50٪ النتائج إلى انخفاض كبير في كفاءة تنبيغ فيروس، زادت الاختلافات في التعبير البروتين في الخلايا، وزيادة سمية الخلية.
ملاحظة: طلاء من أطباق الزجاج مع فبرونيكتين يحسن نمو الخلايا والتشكل ويعزز التقدم السليم للخلايا من خلال الانقسام. ويمكن بشكل عام أن تحل محلها الجيلاتين المتاحة تجاريا التي هي أرخص.
3. اتش تنبيغ والبروتين الذاتية ضربة قاضية من قبل سيرنا ترنسفكأيشن في خلايا هيلا-RFP-H2B عن طريق كابي رواسب
الحذر! العملجي مع الفيروسات يتطلب احتياطات خاصة والتخلص السليم من جميع المواد التي كانت في تماس مع الفيروس.
الحذر! في أيدينا، كابي يترسب في كثير من الأحيان يكون لها آثار غير مرغوب فيها أكثر، على سبيل المثال على العمليات الحيوية المتعلقة بالاتجار الحويصلة (على سبيل المثال، الالتهام الذاتي). وفقا لذلك فمن المستحسن استخدام الموجبة الدهون كاشف ترنسفكأيشن (انظر أدناه)، والانتظار على الأقل 48 ساعة قبل التحليل.
ملاحظة: اتش السيطرة يحمل الجين لا علاقة لها (أي LacZ) أو أي الجينات يستخدم للوصول إلى وزارة الداخلية الحد الأدنى في جميع Adenofections (10-20 PFU / خلية) باستخدام أقل كمية من اتش المؤتلف يحمل الجين.
ملاحظة: وقد تبين أن هذا الإجراء للمساعدة في التعبير تطبيع لكل خلية في عدد السكان خلية كبيرة.
- بعد يوم واحد من الطلاء خلية، والاعتماد على عدد من الخلايا من الطبق مطلي إضافية. نضح المتوسطة وشطف مرة واحدة مع 1 مل 0.05٪ التربسين / EDTA. إضافة مرة أخرى 1 مل من 0.05٪ التربسين / EDTA واحتضان عند 37 درجة مئوية، و 5٪ CO 2 حتى يكون فصل كل الخلايا. فصل الخلايا جيدا باستخدام ماصة 1ML وحساب عدد الخلايا لكل مل باستخدام عداد خلايا الدم.
- تحديد كمية الفيروس اللازمة لتنبيغ الخلايا في عدد وافر من العدوى (وزارة الداخلية) من وحدات 2-تشكيل لوحة (PFU) من البروتين ذات الاهتمام (POI) في كل خلية و 18 PFU في كل خلية من ناقلات فارغة (على سبيل المثال، LacZ) لدينا ما مجموعه 20 PFU لكل خلية. في نفس الوقت تنبيغ 4 PFU من كل الفيروسة العصوية (الأكتين وαTubulin، GFP و على التوالي الموسومة RFP). تنبيغ الخلايا باستخدام بروتوكول adenofection التالية. واستخدمت الفيروسات كما هو موضح في فوكس وآخرون (14).
- إعداد في غطاء العقيمة أنبوب بلاستيكي 1.5 مل لكل حالة وإضافة 400 ميكرولتر من αMEM ناقص دافىء 10٪.
- ذوبان الجليد قسامة من الفيروسات ببطء على الجليد، وإذا لزم الأمر، وتمييع رانه الأسهم الفيروس من أجل الماصة حجم أكبر من 1 ميكرولتر للحد من الأخطاء pipetting ل.
- إضافة كمية الفيروس محسوبة في حالة أن كل أنبوب من البلاستيك 1.5 مل تحتوي على 400 αMEM ناقص ميكرولتر 10٪ وتخلط بلطف قبل pipetting. وضع الأسهم فيروس العودة فورا في -80 درجة مئوية للحفاظ على نشاطها.
- نضح المتوسطة من الخلايا وماصة بلطف مزيج فيروس قطرة من الحكمة. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 وتستنهض الهمم لوحات بعناية تحت غطاء العقيمة كل 15 دقيقة لمدة 1 ساعة لتغطية جيدا الخلايا مع فيروس. باستخدام كمية صغيرة من متوسطة يسهل الاتصال من الفيروس مع الخلايا.
- بعد الحضانة، ماصة بلطف 1.6 مل αMEM-ناقص 10٪ على كل لوحة للحصول على الحجم الكلي لل2 مل، بدء المزامنة خلية بإضافة 2 مم الثيميدين واحتضان الخلايا لمدة 2 ساعة إضافية عند 37 درجة مئوية، و 5٪ CO 2 .
- وفي الوقت نفسه، وإعداد سيرنا followi مزيج ترنسفكأيشننانوغرام طريقة ترنسفكأيشن كابي (انظر الشكل 1). إذا لا سيرنا هو ضروري، واستبدال كمية من سيرنا من الماء المعقم لإجراء ترنسفكأيشن فارغة.
- حساب 200 مزيج ميكرولتر لكل حالة، مما أدى في 400 ميكرولتر في مكررة. يتم إعطاء المثال التالي لتركيز سيرنا النهائي من 50 نانومتر على أن تكون تكييفها مع كل بروتين من الفائدة. في أنبوب بلاستيكي 1.5 مل، ماصة 50 ميكرولتر 1 م CaCl 2 و 11 ميكرولتر 20 ميكرومتر سيرنا إلى 139 ميكرولتر H 2 O معقمة ومزيج من قبل vortexing. بعد دوران سريع، إضافة بعناية قطرة من الحكمة 200 ميكرولتر HBS2x (280 ملي مول كلوريد الصوديوم، و 50 ملي HEPES، 1.5 ملي نا 2 هبو 4، ودرجة الحموضة 7،01-7،05).
ملاحظة: أصغر قطرات أصغر هي رواسب، مما يؤدي إلى تحسين كفاءة ترنسفكأيشن. المزيج بلطف ثلاث مرات عن طريق الحقن الهواء باستخدام 200 ميكرولتر ماصة. - احتضان هذا المزيج لمدة 30 دقيقة في RT. إضافة قطرة من الحكمة ببطء 200 ميكرولتر من مزيج ترنسفكأيشن إلى كل لوحة وتستنهض الهمم عبر الحكمة. نقل لوحات عند 37 درجة مئوية، و 5٪ CO 2 لمدة 16 ساعة.
- في اليوم التالي، شطف الخلايا مرتين مع 2 مل HEPES الدافئة (6.7 ملي بوكل، 150 مم كلوريد الصوديوم، و 10 ملي HEPES، ودرجة الحموضة 7.3) وإضافة 2 مل αMEM-ناقص 10٪. لا تمضي مع أكثر من أربعة ألواح الخلايا في وقت حيث أن اختلاف درجة الحرارة تؤثر على طول دورة الخلية.
- تصور كفاءة العدوى تحت مجهر فلوري مقلوب في التكبير من 20-40x (الهواء) والحصول على ثلاث صور تمثيلية في حالة في كل القنوات الفلورسنت ونقل عن الوثائق. بعد سبع ساعات، إضافة 2 ملي الثيميدين واحتضان لمدة 16 ساعة إضافية عند 37 درجة مئوية، و 5٪ CO 2.
- في اليوم التالي، 48 ساعة بعد سيرنا ترنسفكأيشن وعدوى فيروس، شطف الخلايا مرتين مع 2 مل الدافئة المالحة العازلة الفوسفات (PBS) والافراج عن 7 ساعات في 2 مل αMEM 10٪ ث / س الفينول الأحمر لتصوير الخلايا الحية أو مع الفينول الأحمر لاستخراج البروتين.
- حصاد الخلايا لكل حالة 48 ساعة بعد ترنسفكأيشن لإعداد مستخلصات البروتين وتحليل لطخة غربية لتحديد كفاءة ضربة قاضية والتعبير عن بروتين الذاتية (15).
ملاحظة: استخدام أجسام مضادة ضد بروتين من الفائدة وكذلك الأجسام المضادة المناسبة بمثابة الضوابط التحميل. وينبغي أن تحدد كفاءة ضربة قاضية عن طريق تحميل كميات متناقصة من خلية مراقبة لست] (transfected مع تحكم سيرنا)، لتوفير منحنى المعايرة (أي 1، ½، ¼، ⅛).
4. اتش تنبيغ والبروتين الذاتية ضربة قاضية من قبل سيرنا ترنسفكأيشن في خلايا هيلا باستخدام الموجبة الدهن ترنسفكأيشن الكاشف
ملاحظة: هنا نقدم البروتوكول الذي تم تكييفها للتجارب التي لا تنطوي على تزامن انقسام الخلية و / أو عند سيرنا ترنسفكأيشن لا يمكن أن يقوم بها طريقة التعريب، على سبيل المثال لتجنب الآثار السامة غير مرغوب فيها في بعض الخلايا لينوفاق. ويشمل هذا البروتوكول أيضا خطوة خلية replating بعد adenofection من أجل العمل في مناطق ذات كثافة الخلية المناسبة. لقد اختبرنا فقط الموجبة الدهون كاشف ترنسفكأيشن.
الحذر! التعامل مع الفيروسات يتطلب احتياطات خاصة والتخلص السليم من جميع المواد التي كانت في تماس مع الفيروس.
- لوحة 1.75 × 10 5 خلايا في طبق 35 ملم في 2.5 مل αMEM 10٪ واحتضان عند 37 درجة مئوية، و 5٪ CO 2. لوحة واحدة لوحة 35 ملم إضافية لعدد من الشروط من أجل إحصاء عدد الخلايا قبل تنبيغ الفيروس.
- تنمو الخلايا حتى اليوم التالي لتحقيق كثافة الخلية لا يقل عن 50٪. وكثافة الخلايا أقل من 50٪ النتائج إلى انخفاض كبير في كفاءة تنبيغ فيروس، زادت الاختلافات في التعبير البروتين في الخلايا، وزيادة سمية الخلية.
- بعد يوم واحد من الطلاء خلية، والاعتماد على عدد من الخلايا من الطبق مطلي إضافية. نضحعلى المدى المتوسط وشطف مرة واحدة مع 1 مل 0.05٪ التربسين / EDTA. إضافة مرة أخرى 1 مل من 0.05٪ التربسين / EDTA واحتضان عند 37 درجة مئوية، و 5٪ CO 2 حتى يكون فصل كل الخلايا. خلايا منفصلة جيدا باستخدام ماصة 1 مل وحساب عدد الخلايا لكل مل.
- تحديد كمية الفيروس اللازمة لتنبيغ وافر من العدوى (وزارة الداخلية) من 20-40 وحدة تشكيل اللويحات (PFU) من البروتين ذات الاهتمام (POI) في كل خلية و0-20 PFU في كل خلية من ناقلات فارغة (على سبيل المثال، LacZ) لدينا ما مجموعه 40 PFU لكل خلية.
- إعداد في غطاء العقيمة أنبوب بلاستيكي 1.5 مل لكل حالة وإضافة 400 ميكرولتر من αMEM دافىء 10٪.
- ذوبان الجليد قسامة من الفيروسات ببطء على الجليد، وإذا لزم الأمر، يخفف من الأسهم الفيروس من أجل الماصة حجم أكبر من 1 ميكرولتر للحد من الأخطاء pipetting ل.
- إضافة كمية الفيروس يحسب لكل حالة لكل 1.5 مل أنبوب بلاستيكي يحتوي على 400 ميكرولتر αMEM 10٪ وتخلط بلطف قبل pipetting. المركز الرابعالبريد الأسهم فيروس العودة فورا في -80 درجة مئوية للحفاظ على نشاطها.
- نضح المتوسطة من الخلايا وماصة بلطف مزيج فيروس قطرة من الحكمة. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 وتستنهض الهمم لوحات بعناية تحت غطاء العقيمة كل 15 دقيقة لمدة 1 ساعة لتغطية جيدا الخلايا مع تخفيف الفيروس. باستخدام كمية صغيرة من متوسطة يسهل الاتصال من الفيروس مع الخلايا.
- وفي الوقت نفسه، وإعداد مزيج ترنسفكأيشن سيرنا وفقا للطريقة ترنسفكأيشن. إذا لا سيرنا هو ضروري، واستبدال كمية من سيرنا بواسطة وسيط وبدون المصل لإجراء ترنسفكأيشن فارغة.
- يتم إعطاء المثال التالي لتركيز سيرنا النهائي من 50 نانومتر على أن تكون تكييفها مع كل بروتين من الفائدة. لكل adenofection، وإعداد واحد 1.5 مل أنبوب بلاستيكي يحتوي على 416 نانومتر سيرنا في 150 المتوسطة ميكرولتر من دون المصل (على سبيل المثال، 6.25 ميكرولتر 20 ميكرومتر سيرنا + 144 المتوسطة ميكرولتر من دون المصل) واحد 1.5 مل أنبوب بلاستيكي containiنانوغرام 6.25 ميكرولتر الموجبة الدهون ترنسفكأيشن الكاشف + 144 المتوسطة ميكرولتر من دون المصل.
- خلط محتويات كل أنبوب بلاستيكي قبل pipetting صعودا وهبوطا عدة مرات مع ماصة 200 ميكرولتر. الجمع بين المحتوى من كلا الأنابيب ومزيج من قبل pipetting صعودا وهبوطا عدة مرات مع ماصة 200 ميكرولتر. احتضان لمدة 5 دقائق على RT.
- بعد الحضانة مع الفيروس، ماصة بلطف 1.8 مل αMEM 10٪ على كل لوحة للحصول على الحجم الكلي 2.2 مل وعلى الفور إضافة ببطء إسقاط الحكيم مزيج ترنسفكأيشن سيرنا إلى كل لوحة وتستنهض الهمم عبر الحكمة. نقل لوحات عند 37 درجة مئوية، و 5٪ CO 2 لمدة 24 ساعة.
- في اليوم التالي، إعادة لوحة الخلايا من كل لوحة 35 ملم إلى أربع لوحات 35MM الجديدة في 2.5 مل αMEM 10٪ لكل منهما، واحتضان ل24 ساعة إضافية عند 37 درجة مئوية، و 5٪ CO 2.
- في اليوم التالي، 48 ساعة بعد سيرنا ترنسفكأيشن وعدوى فيروس، خلايا الحصاد من لوحة واحدة لكل حالة لإعدادمقتطفات من البروتين وتحليل لطخة غربية لتحديد كفاءة ضربة قاضية والتعبير عن بروتين الذاتية (15).
ملاحظة: مع لوحات المتبقية، والمضي قدما مع تثبيت الخلية، وذلك باستخدام بروتوكول الاختيار وإخضاع العينات للتحليل المناعي مع الأجسام المضادة من الفائدة 14.
5. يعيش التصوير خلية من خلايا الميتوزى وتحليل البيانات
- إجراء تجارب التصوير الخلية الحية على المدى القصير على الخلايا الإنقسامية مع مجهر مقلوب مجهزة مرطب / 5٪ CO 2 / غرفة التنظيم الحراري.
ملاحظة: في هذه الدراسة، تم استخدام المجهر القرص الغزل مبائر (40X، 0.75 NA)، مجهزة EMCCD تبريد الكاميرا إلى جانب المسؤول في -50 درجة مئوية. - قبل الشراء، تأكد من أن الغرفة قد وصلت درجة الحرارة المناسبة من 37 درجة مئوية.
ملاحظة: هذا قد يستغرق عدة ساعات اعتمادا على نظام المجهري. - ضع الأطباق الثقافة في ميكرغرفة oscope 1 ساعة قبل شراء لتمكين التوازن السليم على المدى المتوسط وتجنب التركيز الانجراف بسبب التغيرات في درجات الحرارة. مراقبة حالة الإنقسامية من الخلايا. عند هذه النقطة، يجب أن يكون 10-15٪ من الخلايا في المراحل المبكرة من الانقسام (الطور-طليعة الطور التالي).
- خلال فترة موازنة، إعداد المعلمات الاستحواذ على النحو الذي تحدده في التجارب السابقة. عادة، ومدة التعرض لكل من القنوات (488 و 594) من 0،2-3 ثانية مع كثافة الليزر من 100٪ وحساسية 121-130 معلمات مناسبة في أيدينا.
ينبغي أن يكون أول اختبارات لتحديد الحد الأدنى للكثافة الليزر واكتساب الوقت / الفاصل الزمني الذي يؤدي إلى الحل المناسب مع الحد الأدنى photobleaching من أن يسبب الأضرار الخلية ويشوش التقدم الإنقسامية: ملاحظة. - اختيار عدة حقول في حالة الحصول على عدد كبير من الخلايا لتحليلها دون تجاوز فترة التملك. باستخدام نظام متحد البؤر القرص الغزل، سوف إعداد نموذجي فيواستعمل أربعة شروط مختلفة، 7 الحقول في لوحة و 2 قنوات اللون (488 و 594) مع فاصل زمني 1.5-2 دقيقة على مين فترة 75.
- اختيار الخلايا التي هي في دخول الإنقسامية، إعادة تعيين التركيز وقد تم اختيار مرة واحدة كل المجالات والبدء في عملية الاستحواذ في أسرع وقت ممكن.
- مراقبة استقرار النظام لا يقل عن ثلاث نقاط الوقت وإعادة ضبط التركيز إذا لزم الأمر.
- بعد أول تصوير الخلايا الحية على المدى القصير من 75 دقيقة، ويمكن اختيار مجالات جديدة للخلايا الإنقسامية للحصول على المجموعة الثانية من الأفلام لزيادة عدد الخلايا التي يجري تحليلها.
- تحديد معايير واضحة المعالم لتحليل الظواهر الإنقسامية من الخلايا، والتي سوف تعتمد على علامات الفلورسنت المستخدمة. عيوب في الانقسام قد تشمل الوقت الذي يقضيه في الانقسام لفترات طويلة (من انهيار النووي حتى طور الصعود)، اختلال الكروموسومات، هزاز المغزل، والقشرة blebbing 14.
6. LifeAct-TagGFP2 اتش تنبيغ في Differentiatinز C2C12 Myoblasts ماوس
ملاحظة: بروتوكول adenofection ينطبق أيضا على myoblasts الماوس C2C12 التي يصعب تصيب تمر التمايز.
- لوحة 2 × 10 5 C2C12 الخلايا في أطباق ثقافة 35 ملم في المتوسط النمو على البلاستيك أو على ركيزة من الاختيار.
تم تحسين تمايز الخلايا على أطباق gelatine- أو Matrigel المغلفة: ملاحظة. تخطيط لوحة إضافية واحدة لتحديد عدد الخلايا قبل تنبيغ الفيروس. - في اليوم التالي، كان ينبغي أن بلغ الخلايا 80٪ من confluency. حمل بالخلايا العضلية الجذعية التمايز عن طريق غسل الخلايا مرتين مع برنامج تلفزيوني الدافئ وإضافة 2 مل من المتوسط التمايز (DM).
- في اليوم التالي، وصفت بأنها يوم 1 (D1) من التمايز، تنبيغ myocytes مع اتش LifeAct-TagGFP2 لتصور الهيكل الخلوي الأكتين في الخلايا الحية. حساب عدد الخلايا من لوحة إضافية كما هو موضح تحت 3.2. احسب 5 PFU / خلية من اتش LifeAct-TagGFP2 و 45 PFU AdLacZ / خلية بعد الامتحانوصف سبيل في الجدول 1. وتبلغ كمية الفيروس هو 50 PFU / الخلية. واستخدمت الفيروسات كما هو موضح 14
- إعداد في غطاء العقيمة أنبوب بلاستيكي 1.5 مل لكل حالة وإضافة 400 ميكرولتر من DM الدافئ.
- ذوبان الجليد قسامة من الفيروسات ببطء على الجليد، وإذا لزم الأمر، يخفف من الأسهم الفيروس من أجل الماصة حجم أكبر من 1 ميكرولتر للحد من الأخطاء pipetting ل.
- إضافة كمية مناسبة من جزيئات الفيروس في حالة أن كل أنبوب من البلاستيك 1.5 مل تحتوي على 400 ميكرولتر DM وتخلط بلطف قبل pipetting. وضع الأسهم فيروس العودة فورا في -80 درجة مئوية للحفاظ على نشاطها.
- نضح في المتوسط من أطباق وماصة بلطف مزيج فيروس قطرة من الحكمة. احتضان الخلايا عند 37 درجة مئوية، و 5٪ CO 2 وتستنهض الهمم لوحات بعناية تحت غطاء العقيمة كل 15 دقيقة ليصبح المجموع 1 ساعة لتغطية جيدا الخلايا مع فيروس.
- بعد الحضانة، ماصة بلطف 1.6 مل DM على كل لوحة ومواصلة طncubation ل2 ساعة إضافية عند 37 درجة مئوية، و 5٪ CO 2.
- وفي الوقت نفسه، وإعداد مزيج ترنسفكأيشن فارغة وفقا للطريقة ترنسفكأيشن كابي. حساب 200 مزيج ميكرولتر لكل حالة. استخدام المثال التالي لإجمالي حجم 400 مزيج ميكرولتر.
- في أنبوب بلاستيكي 1.5 مل، ماصة 50 ميكرولتر 1 م CaCl 2 إلى 150 ميكرولتر العقيمة H 2 O ومزيج من قبل vortexing. بعد دوران سريع، إضافة بعناية قطرة من الحكمة 200 ميكرولتر HBS2x (280 ملي مول كلوريد الصوديوم، و 50 ملي HEPES، 1.5 ملي نا 2 هبو 4، ودرجة الحموضة 7،01-7،05). المزيج بلطف عن طريق الحقن الهواء ثلاث مرات باستخدام ماصة 200 ميكرولتر.
- احتضان هذا المزيج لمدة 30 دقيقة في RT. إضافة ببطء قطرة من الحكمة 200 ميكرولتر من مزيج ترنسفكأيشن إلى كل لوحة وتستنهض الهمم عبر الحكمة. نقل لوحات عند 37 درجة مئوية، و 5٪ CO 2 لمدة 16 ساعة.
- في اليوم التالي، شطف الخلايا مرتين مع 2 مل HEPES الدافئة (6.7 ملي بوكل، 150 مم كلوريد الصوديوم، و 10 ملي HEPES، ودرجة الحموضة 7.3) وإضافة 2 مل مارك ألماني. تصور infeكفاءة ction تحت مجهر فلوري مقلوب في التكبير من 20-40X (الهواء) والحصول على ثلاث صور تمثيلية في حالة في كل القنوات الفلورسنت ونقل عن الوثائق.
- وفقا لإعداد التجربة المطلوبة، اتبع التمايز في myotubes لعدة أيام. الخلايا يمكن أن تكون ثابتة وتعرض بعد ذلك إلى تحليل المناعي أو دراسات التصوير الخلية الحية لا يمكن أن يؤديها.
النتائج
وارتبط ترنسفكأيشن البلازميد الحمض النووي BAG3-GFP باستخدام الدهون الموجبة مع التعبير غير متجانسة في خلايا هيلا، بعض الخلايا التي تبين مستويات يصعب رصدها بسهولة من البروتين وغيرها تحمل مستويات عالية جدا من BAG3 (الشكل 2A). في هذه الخلايا، ودل على فقدان التوازن البروتين عن طريق تراكم BAG3-GFP في المجاميع محيط بالنواة (الشكل 2A، السهام). في المقابل، تنبيغ الخلايا الغدية مع تحمل BAG3-GFP أظهرت انخفاض التعبير أكثر تجانسا ودقة الترجمة من BAG3-GFP (الشكل 2B، والعدوى وحدها). بشكل ملحوظ، بالإضافة إلى الدهون الموجبة خلال تنبيغ اتش (أي ترنسفكأيشن من الجسيمات اتش) زيادة كبيرة في التعبير BAG3-GFP لكل خلية في وزارة الداخلية مماثلة، في حين أنه يسمح حفظ التعبير متجانس في معظم الخلايا (الشكل 2B، Adenofection).
ether.within الصفحات = "1"> يسمح Adenofection نضوب كفاءة BAG3 الذاتية وإعادة البروتينات BAG3-GFP على المستويات المحلية القريب، سواء باستخدام كابي يترسب أو المركبات على أساس الحويصلية لزيادة كفاءة ترنسدوكأيشن ترنسفكأيشن في خلايا هيلا. ويبين الشكل 3 تجربة نموذجية مع نوع BAG3 البرية (WT) -GFP أو BAG3 (IPV) -GFP البديل تحمل الطفرات التي إلغاء ملزمة لأحد ل شركاء كوصي HSPB8 (الشكل 3A، 3B). وانسجاما مع دور للBAG3 في استقرار HSPB8 7، أدى إسكات BAG3 إلى انخفاض ~ 50٪ في مستويات HSPB8، الذي تم ترميمه إلى المستويات العادية على إعادة العمل BAG3 WT، ولكن ليس عن طريق التعبير عن مستويات مماثلة من متحولة من BAG3 (IPV) -GFP أو من GFP وحدها. في ظل هذه الظروف، والبروتينات BAG3-GFP المترجمة بشكل مناسب داخل ~ 75-90٪ من الخلايا، ويجري التخصيب في مناطق محيط بالنواة-centrosomal (الشكل 3C، 3D). هذا سوجested أن adenofection الحفاظ على ديناميكية BAG3 ومجمع BAG3-HSPB8 في الخلايا.
وupregulated HSPB8 وBAG3 من قبل مختلف الضغوط proteotoxic أن التشويش أيضا استتباب بروتيني هيكل الخلية 10. وبالتالي overexpression من المحرمين يحتمل أن تزعج التجميع تفكيك هياكل الجزيئات السيطرة morphodynamics الخلوية. من أجل تقييم دور BAG3-HSPB8 في ظل ظروف غير شدد على أنه من المهم للتحقق من أن توازن البروتين منزعجة نحد من الإجراء adenofection. تحقيقا لهذه الغاية، ورصد التغيرات في مستويات مرافقين من عائلة بروتين الصدمة الحرارية يعتبر مؤشرا جيدا لحالة التوازن البروتين. كما هو مبين في الشكل (4)، adenofection من قبل التعريب أو أساليب لم تزيد بشكل كبير من مستويات HSPB8 الذاتية وBAG3، أو أن النظام كوصي HSP70 / HSPA1 كبير الحويصلية المستندة. في المقابل، نموذجيالعلاجات proteotoxic مثل الصدمة الحرارية أو MG132، مثبط proteasome و، زادت مستويات البروتينات كوصي-cochaperone في خلايا هيلا.
ثم سعينا لتحديد ما إذا كان الإجراء adenofection جنبا إلى جنب مع baculoviruses تعبير عن الأكتين وتويولين تحقيقات الفلورسنت (BacMam-طلب تقديم العروض الأكتين وGFP-αtubulin) القيادة مناسبة لتتبع ديناميات الخلايا الإنقسامية. كما هو مبين في الشكل (5)، لم adenofection من خلايا هيلا مع عنصر تحكم سيرنا (siCTL) لا تخل ديناميات الإنقسامية المغزل (الأخضر) أو متوسط الوقت الذي يقضيه في الانقسام (الشكل 5A، متحد البؤر ممثل الوقت الفاصل بين متواليات). وكانت نسبة هذه الخلايا تظهر أحداث الإنقسامية غير طبيعية تتماشى مع مستويات العيوب الإنقسامية لوحظ عموما في خطوط الخلايا السرطانية (~ 30٪ -40٪، الشكل 5B). في المقابل، خلايا adenofected مع سيرنا BAG3 محددة وحدها (siBAG3) معارضها ~ زيادة بنسبة 2 أضعاف في المستوىلتر من العيوب المظهرية الإنقسامية، الذي تم ترميمه إلى قرب مستوى التحكم في الخلايا التي BAG3-GFP (WT)، ولكن ليس عن طريق GFP وحدها. مما يؤكد مدى ملاءمة adenofection للتحليل الوظيفي للتأثير BAG3 ومرافقين يرتبط بها على ديناميات هيكل الخلية التي تنظم تطور السليم للخلايا داخل وخارج الانقسام، كما هو مبين من قبل فوكس وآخرون (14).
للتحقق من براعة الأسلوب adenofection، فإننا ثم تكييفها بروتوكول لتمكين التصور من F-الأكتين خلال التفريق بين myocytes الماوس C2C12، وذلك باستخدام ما هو متاح تجاريا اتش-LifeAct-GFP لتسمية F-الأكتين 16. وقد حثت خلايا C2C12 للتمييز ليوم واحد قبل Adenofection. باستخدام القائمة على بروتوكول كابي adenofection، تكف كميات منخفضة بشكل ملحوظ من اتش-LifeAct-GFP للتعبير عن التحقيق في المستوى الذي تم الكشف بسهولة عن طريق الفحص المجهري مضان في نسبة كبيرة من اح ntiating myocytes (~ 3-5 PFU / الخلية؛ الشكل 6). كان هذا في تناقض ملحوظ مع تعدد مرتفعة للغاية الإصابة المبلغ عنها في الأدب لتنبيغ خلايا فأر C2C12 (بالترتيب من 250-400 وزارة الداخلية) 17-19. وعلاوة على ذلك، من خلال رصد عملية التمايز لمدة 7 أيام، أنشأنا أن myotube مركزيا تشكيل وغير منخفضة القيمة بشكل كبير من قبل الإجراء. وهذا يشير إلى العضلية الانصهار، وهي العملية التي تعتمد على ديناميات الأكتين دقيقا 20، لم يستسلم من قبل التعبير عن مستويات منخفضة من LifeAct-GFP (الشكل 6، يوم 6 ويوم 7). منذ لا يزال من الممكن الكشف عن علامة فلوري بعد عدة أيام adenofection الخلايا C2C12، ونحن نعتقد أن هذا الأسلوب سوف تكون مناسبة للتحليلات وظيفية تأثير المحرمين على ديناميات الأكتين في مراحل مختلفة من C2C12 تكون العضل.

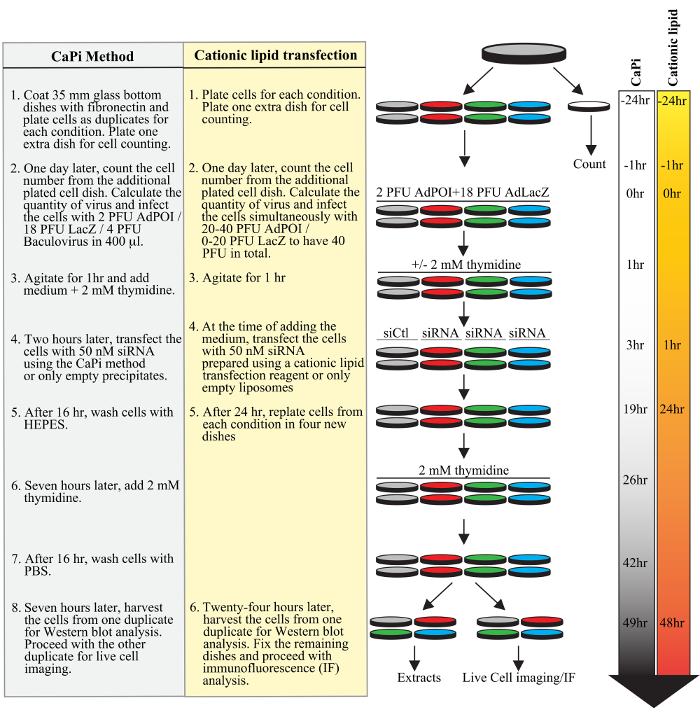
ويبين الشكل 1. التخطيط بروتوكول adenofection نموذجي. خطوات متتالية من تجربة نموذجية لبروتوكول استخدام رواسب كابي (مسطرة باللون الرمادي) أو بروتوكول باستخدام كاشف الموجبة الدهون ترنسفكأيشن (باللون الأصفر)، بما في ذلك الطلاء الخلية، تنبيغ ترنسفكأيشن adeno- وbaculoviruses، من الدوبلكس سيرنا، وتزامن انقسام الخلية مع كتلة الثيميدين مزدوج. وتظهر الجداول الزمنية في ساعات لكلا البروتوكولين على الجانب الأيمن من هذا الرقم.fig1large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
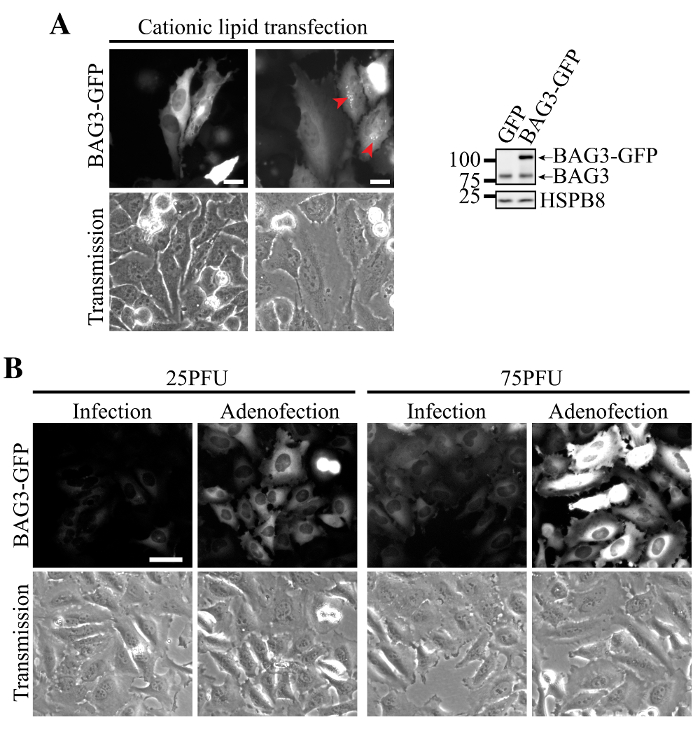
الشكل 2. التعبير متجانسة وفعالة من BAG3-GFP باستخدام Adenofection. (A) صور epifluorescence التمثيلية للخلايا هيلا التي تم transfected مع BAG3 GFP DNA البلازميد، والتي تبين المجاميع محيط بالنواة من البروتين في مستويات التعبير العالية (المعين من قبل السهام) والتعبير غير متجانسة بين السكان الخلية. تظهر البقع الغربية التعبير أعلى من BAG3-GFP مقارنة بمستويات BAG3 الذاتية في خلية السكان الإجمالي، مشيرا إلى أن البروتين هى overexpressed إلى حد كبير في بعض الخلايا. (ب) التمثيلية صور epifluorescence من خلايا هيلا التي تم transduced فقط أو adenofected باستخدام كميات متزايدة من جزيئات الفيروس الإعلان، BAG3-GFP. صورتم الحصول عليها باستخدام معلمات متطابقة وتم معالجتها على قدم المساواة لخلفية الطرح وشدة. شريط: 50 ميكرومتر الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

تم adenofected الشكل 3. ضربة قاضية كفاءة من BAG3 وإعادة البروتينات BAG3-GFP على المستويات المحلية بالقرب من الخلايا (AB) هيلا معربا عن طلب تقديم العروض، H2B (A) أو خلايا هيلا الأبوية (ب) مع الرناوات siRNAs المشار إليها والفيروسات الغدية المؤتلف باستخدام كابي طريقة (A) أو المركبات على أساس الحويصلية كما كاشف ترنسفكأيشن (B). وقد تزامن الخلايا عن طريق مزدوج طريقة كتلة الثيميدين وأعدت الكلية مقتطفات الخلية خلال المرحلة الثانية للإفراج عنهم. نمط غربي آسي تظهر البقع آكانيوز مستويات BAG3 نضوب (BAG3 الذاتية)، ومستويات البروتينات BAG3-GFP adenofected، والمستويات الخفية HSPB8. مستويات GAPDH: التحكم في التحميل. وقدرت نضوب في> 75٪ عن طريق تحميل كميات خفض مقتطفات التحكم (adenofected مع تحكم سيرنا siCtl وBAG3-GFP WT، أي نصف، ¼). لاحظ أن البروتينات BAG3-GFP الفردية وأدخلت في بالقرب من مستوى الذاتية من BAG3 وهذا النوع البري BAG3-GFP، ولكن ليس BAG3 (IPV) -GFP أو GFP وحدها، استعادة مستويات HSPB8 في الخلايا المنضب BAG3. (CD) التمثيلية صور epifluorescence من خلايا هيلا التي تم adenofected مع أشارت المؤتلف الإعلان، BAG3-GFP باستخدام كابي أو الموجبة كاشف الدهون ترنسفكأيشن. القضبان: 20 ميكرون. يتم تعديل ممثل النتائج هو مبين في (أ) و (ج) من فوكس وآخرون، بلوس جينيه. 2015 23 أكتوبر، 11 (10): e1005582، دوى: 10.1371 / journal.pgen.1005582 14.ديزيل / ftp_upload / 54557 / 54557fig3large.jpg "الهدف =" _ فارغة "> الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4. Adenofection لا لحث على الاستجابة للضغط النفسي في خلايا هيلا البقع الغربية من إجمالي مقتطفات خلية أعدت من الخلايا السيطرة هيلا. (NT: غير المعالجة) أو خلايا هيلا transfected مع سيرنا السيطرة وحدها (siCtl، لا اتش)، أو adenofected مع siCtl والإعلان، وGFP باستخدام كابي أو الموجبة الدهون ترنسفكأيشن الكاشف، أو من خلايا هيلا المقدمة للعلاجات proteotoxic نموذجية (HS: الصدمة الحرارية في 44 درجة مئوية لمدة 60 دقيقة تليها 16 الانتعاش ساعة على 37 درجة مئوية. MG132: proteasome والمانع، 5 ميكرومتر لمدة 16 ساعة)، والتي تبين مستويات BAG3، HSPB8 والمحرمين من الإجهاد محرض الآخرين، وهي HSP70 / HSPA / وHSP27 / HSPB1. GAPDH: تحميل السيطرة. لاحظ أنه في حين أن مستويات كل المواليةوزادت البروتينات إلا GAPDH على علاجات الضغط proteotoxic، فإنها ظلت دون تغيير عن طريق adenofection. تم تقييم الاختلافات مستوى البروتين عن طريق تحميل كميات متفاوتة من مقتطفات خلية HS التي تحمل زيادات نموذجية في شركائنا HSPs. (HS: 1، ½، ¼، ⅛، على سبيل المثال، كان المستحث HSP70 من قبل أكثر من 8 أضعاف ردا على proteotoxic الإجهاد) الرجاء انقر هنا لمشاهدة نسخة أكبر من هذا الرقم.
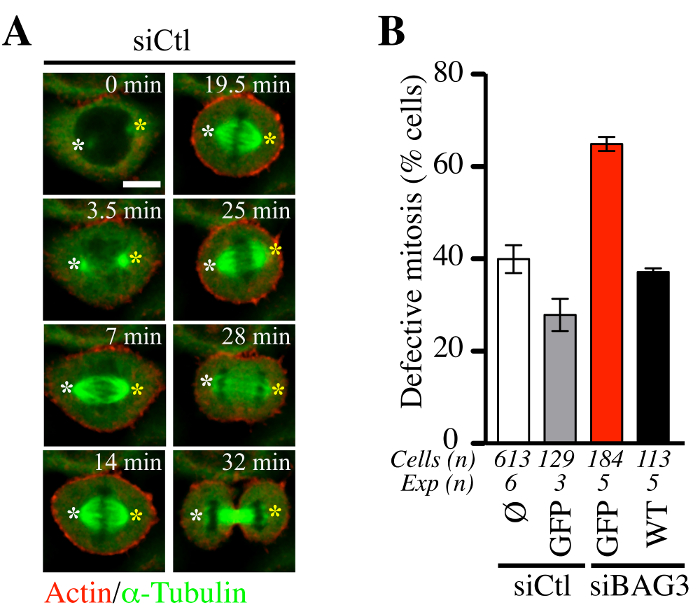
الرقم 5. التقدم من هيلا الخلايا من خلال الانقسام ليست منزعجة بشكل كبير من قبل Adenofection. (A) الممثل متحد البؤر تسلسل الوقت الفاصل بين من خلايا هيلا التي تم adenofected مع عنصر تحكم سيرنا (siCtl) جنبا إلى جنب مع BacMam- GFP-α تويولين وBacMam -RFP الأكتين وتصويرها من قبل الغزل القرص microsco متحد البؤر الحمر بين 60 و 90 دقيقة في ~ فترات 1.5 دقيقة. الأبيض والنجمة الصفراء يعين موقف أقطاب المغزل التي ظلت مستقرة نسبيا. شريط: 10 ميكرون. (ب) الكمي لخلايا adenofected مع siCtl أو سيرنا BAG3 محددة، مع أو بدون البروتينات GFP أشار (GFP وحدها أو النوع البري BAG3-GFP: WT). الرسم البياني يشير إلى النسبة المئوية للخلايا مع الانقسام الشاذ الذي يعرف بأنه هزاز المغزل والمتوقفة في الانقسام +/- أو اختلال الكروموسومات. أظهرت هي وسائل +/- SE. اتخذت ممثل النتائج هو مبين في (ب) من فوكس وآخرون، بلوس جينيه. 2015 23 أكتوبر، 11 (10): e1005582، دوى: 10.1371 / journal.pgen.1005582 14. يرجى النقر هنا لمشاهدة نسخة أكبر من هذا الرقم. الرجاء انقر هنا لمشاهدة الفيلم يرتبط مع لوحة (A).
الطبقة = "jove_content" FO: المحافظة على together.within الصفحات = "1"> 
الشكل 6. Adenofection من myocytes C2C12 مع الإعلان، LifeAct-GFP وتشكيل myotube مركزيا. صور epifluorescence التمثيلية للخلايا C2C12 التي كانت قد يسببها للتمييز وتجهيزها لadenofection 1 اليوم في وقت لاحق باستخدام 5 PFU / خلية من LifeAct-GFP و 45 PFU / خلية من LacZ. تظهر الصور تعبير عن علامة GFP خلال عملية التمايز (يوم 2، يوم 6 ويوم 7). القضبان: 20 ميكرون الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Discussion
هنا، وصفنا طريقة تمكين التجارب استنزاف الانقاذ التي يتعين القيام بها، والتي تنطبق على تحليلات وظيفية عمليات الخلية البيولوجية التي هي حساسة بشكل خاص للoverexpression من البروتينات التي تؤثر على العناصر المتفاعلة وديناميات البروتين المجمعات والمنشآت الجزيئات. انقسام الخلية الإنقسامية هو مثالا صارخا على morphodynamics خلية دقيقا ينطوي على تغييرات دراماتيكية ومثيرة في الهيكل العام للخلية. باستخدام adenofection جنبا إلى جنب مع الكواشف BacMam المتاحة تجاريا لإدخال كميات قليلة ولكن يمكن اكتشافها من الأكتين وتويولين علامات لتصوير الخلايا، يمكن إثبات مساهمة كوصي مجمع BAG3-HSPB8 لمناسبة إعادة الخلية الإنقسامية بوضوح. في دراسة أجريت مؤخرا من قبل فوكس وآخرون، لقد أظهرنا أن استنزاف BAG3 يسبب عيوب في التوجه المغزل التي ترتبط إلى عدم القدرة على إنشاء جامدة القشرة الإنقسامية الأكتين وتجميع الأكتين الغنيةالألياف تراجع 14. يمكن استعادة ديناميات المغزل السليم من إعادة إدخال النوع البري BAG3-GFP، الذي صحح أيضا انخفاض ينظر في مستويات HSPB8 على إسكات BAG3. وهذا يعني أن adenofection تمكن من التعافي من مجمع كوصي ذات الصلة من الناحية الفسيولوجية الذي يرتبط مع الانتعاش وظيفية للديناميات المغزل.
استخدام adenofection للتجارب استنزاف الانقاذ يوفر ميزة على البلازميد ترنسفكأيشن الحمض النووي أو nucleofection، الذي يمكن أن يؤدي إلى تحريض قوية من الاستجابة للضغط النفسي في بعض أنواع الخلايا (أي الالتهام الذاتي) 21، مما يجعل من المستحيل تقريبا لتحليل تأثير كوصي معين ودورها الفسيولوجي. في الواقع، في يدنا، ويرتبط ترنسفكأيشن من BAG3 DNA البلازميد مع ارتفاع التعبير في كل خلية، وتشكيل الكلي، والآثار المترتبة على خلية موت الخلايا المبرمج / البقاء على قيد الحياة في العديد من أنواع الخلايا (الشكل 2). BAG3 هو cochaperone حدات مع النشاط سقالة، التي معبد المنعم يوسف تلعب أدوارا متعددة اعتمادا على البروتينات شريك 9 منه. وبالتالي، اضطرابات من رياضيات الكيمياء المعقدة على overexpression من BAG3 قد يكون لها آثار سلبية المهيمنة غير المرغوب فيها وتحفز سمية. قدرة عالية اتش المؤتلف هو وسيلة مثالية لتقديم عابرة وسلامة الجينات كبيرة في كل من الانقسام وعدم تقسيم الخلايا في الثقافة لأنها لا تندمج في جينوم المضيف الخلية، وعلى النقيض من ناقلات القائم على الفيروسة البطيئة التي بعض سلامة لا تزال المخاوف. العيب المحتمل لاستخدام الفيروسات الغدية للتجارب نضوب الإنقاذ هو أنها تتطلب إعداد، والتي قد تكون مضيعة للوقت المتكررة. أنها تعتمد أيضا على معايرة دقيقة للجزيئات معدية لفعالية التنبيغ استنساخه.
باستخدام adenofection لفحص مساهمة المجالات الوظيفية BAG3 معروف، حصلنا على أول دليل، على حد علمنا، عن وجود وظيفة BAG3 تعتمد-HSPB8 في التشغيل العاديتقسيم الخلايا التي لا تتطلب تفاعلها مع النظام كوصي HSP70 / HSPA1. وينبغي أن يكون Adenofection ينطبق على تتبع F-الأكتين خلال عملية التمايز العضلية في myotubes، على النحو الذي اقترحه البيانات المقدمة هنا. وبالتالي يوفر طريقة لدينا بروتوكول تنوعا وفعالية للتجارب استنزاف الانقاذ القائم على سيرنا مع الحد الأدنى من التأثير على morphodynamics الخلية التي ينبغي أن تكون مفيدة في مجموعة واسعة من المشاريع التي يجري العمل تحليل هيكل وظيفة الجين من الفائدة.
استغلال الموجبة مركبات الدهون من أجل تحقيق كفاءة ترنسفكأيشن-تنبيغ الخلايا التي تحتوي على أقل كمية من جزيئات الفيروس هو المفتاح إلى هذا الأسلوب. في حين أنه يوفر نافذة أكبر للسيطرة على مستويات البروتينات الخارجية لكل خلية، ونحن نعتقد أنه يسمح كذلك التقليل من الآثار الجانبية المحتملة على مسارات نقل الإشارة التي تنتج عن خلية اتش ملزم دخول، التي ينبغي أن تخفف من تأثير ا ف بrotein الفائدة على مسارات التخلق.
وتجدر الإشارة إلى أن المواد الكيميائية المختلفة لزيادة كفاءة اتش تنبيغ متاحة تجاريا، مثل الصاروخ سيارة المستقبل. هذه الكواشف غالية الثمن، ومع ذلك، ويتوقع أن تعزز فيروس ملزم دخول الخلايا في الطريقة التي تتطلب مستقبلات الوسطى، والتي كما ذكر أعلاه فقد تبين لتنشيط مسارات الإشارات المرتبطة شكل الخلية والتصاق. في حين كابي أرخص من الجسيمات الشحمية الموجبة كوسيلة لتحفيز دخول اتش عن طريق المسار مستقلة سيارة، كما أنها أكثر سمية لبعض خطوط الخلايا. نحن ننصح بإجراء اختبار مسبق لadenofection فارغة لتوجيه الاختيار بين كابي مقابل كاشف الموجبة الدهون، اعتمادا على خط الخلية المستخدمة وقراءات البيولوجية من الفائدة.
النهج ضربة قاضية الإنقاذ جنبا إلى جنب مع أدوات التكنولوجيا الحيوية الجديدة للتحرير الجينوم، استنادا التدخل RNA مثل واحد هو موضح هنا نقدم عشعاع من الأدوات الجزيئية قوية للكشف عن وظيفة الجين في الخلايا، والتي يمكن الآن أن يتم اختيار الأمثل من قبل المحققين اعتمادا على تطبيقات محددة 3. ونحن نعتقد أن adenofection يوفر نظام سريع نسبيا وبسيطة لإنشاء knockdowns hypomorphic لتحليل هيكل وظيفة للمساهمة بروتين من الفائدة في الخلفيات الخلوية متعددة.
Disclosures
The authors have nothing to disclose.
Acknowledgements
This work was supported by the Canadian Institutes of Health Research (Grant no 7077), and by the Bellini Foundation and Roby Fondazione.
Materials
| Name | Company | Catalog Number | Comments |
| C2C12 Mouse Myoblasts | ATCC | CRL-1772 | |
| Adenovirus custom design | Welgen | Custom design | |
| Calcium Chloride | Fisher Scientific | C79-500 | |
| CellLight® Actin-GFP, BacMam 2.0 | Thermo Fisher | C10582 | |
| CellLight® Tubulin-RFP, BacMam 2.0 | Thermo Fisher | C10614 | |
| Dulbecco’s modified Eagle’s medium (DMEM), High Glucose | Thermo Fisher | 11965-092 | |
| EDTA | Sigma | E5134 | |
| Fetal Bovine Serum (FBS) | Thermo Fisher | 12483-020 | |
| Fibronectin | Sigma | F1141 | |
| Glass bottom dishes, 35 mm | MatTek Corperation | P35G-1.5-20-C Case | |
| HeLa-RFP-H2B | Kind gift of Dr Sabine Elowe, Québec, Canada | Klebig C et al. 2009 | |
| HEPES | Fisher Scientific | BP310-1 | |
| Horse Serum, New Zealand | Thermo Fisher | 16050-122 | |
| KCl | Fisher Scientific | BP366-500 | |
| L-Glutamine | Thermo Fisher | 25030081 | |
| Lipofectamine® RNAiMAX Transfection Reagent | Thermo Fisher | 13778-150 | |
| Minimal Essential Medium (MEM) Alpha | Wisent | 310-101-CL | |
| Minimal Essential Medium (MEM) Alpha without Desoxyribonuleosides/Ribonucleosides | Thermo Fisher | 12000-022 | |
| Minimal Essential Medium (MEM) Alpha without Phenol Red | Thermo Fisher | 41061-029 | |
| Na2HPO4 | Biobasic | S0404 | |
| NaCl | Fisher Scientific | BP358-10 | |
| OptiMEM | Thermo Fisher | 11058-021 | |
| rAVCMV-LifeAct-TagGFP2 | IBIDI | 60121 | |
| siRNA duplexes | Dharmacon | Custom design | |
| Thymidine | Sigma | T9250 | |
| Trypsine 2.5% | Thermo Fisher | 15090-046 |
References
- Urnov, F. D., Rebar, E. J., Holmes, M. C., Zhang, H. S., Gregory, P. D. Genome editing with engineered zinc finger nucleases. Nat Rev Genet. 11 (9), 636-646 (2010).
- Hsu, P. D., Lander, E. S., Zhang, F. Development and applications of CRISPR-Cas9 for genome engineering. Cell. 157 (6), 1262-1278 (2014).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Mol Cell. 58 (4), 575-585 (2015).
- Natarajan, K., Rajala, M. S., Chodosh, J. Corneal IL-8 expression following adenovirus infection is mediated by c-Src activation in human corneal fibroblasts. J Immunol. 170 (12), 6234-6243 (2003).
- Yousuf, M. A., et al. Caveolin-1 associated adenovirus entry into human corneal cells. PLoS One. 8 (10), e77462 (2013).
- Morton, P. E., Hicks, A., Nastos, T., Santis, G., Parsons, M. CAR regulates epithelial cell junction stability through control of E-cadherin trafficking. Sci Rep. 3, 2889 (2013).
- Carra, S., Seguin, S. J., Lambert, H., Landry, J. HspB8 chaperone activity toward poly(Q)-containing proteins depends on its association with Bag3, a stimulator of macroautophagy. J Biol Chem. 283 (3), 1437-1444 (2008).
- Fuchs, M., et al. Identification of the key structural motifs involved in HspB8/HspB6-Bag3 interaction. Biochem J. 425 (1), 245-255 (2010).
- Rosati, A., Graziano, V., De Laurenzi, V., Pascale, M., Turco, M. C. BAG3: a multifaceted protein that regulates major cell pathways. Cell Death Dis. 2, e141 (2011).
- Guilbert, S. M., Tanguay, R. M., Hightower, L. E., et al. . The Big Book of Small Heat Shock Proteins. , 435-456 (2015).
- Fasbender, A., et al. Complexes of adenovirus with polycationic polymers and cationic lipids increase the efficiency of gene transfer in vitro and in vivo. J Biol Chem. 272 (10), 6479-6489 (1997).
- Toyoda, K., et al. Cationic polymer and lipids enhance adenovirus-mediated gene transfer to rabbit carotid artery. Stroke. 29 (10), 2181-2188 (1998).
- Fasbender, A., et al. Incorporation of adenovirus in calcium phosphate precipitates enhances gene transfer to airway epithelia in vitro and in vivo. J Clin Invest. 102 (1), 184-193 (1998).
- Fuchs, M., et al. A Role for the Chaperone Complex BAG3-HSPB8 in Actin Dynamics, Spindle Orientation and Proper Chromosome Segregation during Mitosis. PLoS Genetics. 11 (10), e1005582 (2015).
- Champagne, C., Landry, M. C., Gingras, M. C., Lavoie, J. N. Activation of adenovirus type 2 early region 4 ORF4 cytoplasmic death function by direct binding to Src kinase domain. J Biol Chem. 279 (24), 25905-25915 (2004).
- Riedl, J., et al. Lifeact: a versatile marker to visualize F-actin. Nat Methods. 5 (7), 605-607 (2008).
- Takahashi, A., et al. Myogenic Akt signaling regulates blood vessel recruitment during myofiber growth. Mol Cell Biol. 22 (13), 4803-4814 (2002).
- Murray, T. V., et al. A non-apoptotic role for caspase-9 in muscle differentiation. J Cell Sci. 121 (Pt 22), 3786-3793 (2008).
- Terada, K., Misao, S., Katase, N., Nishimatsu, S., Nohno, T. Interaction of Wnt Signaling with BMP/Smad Signaling during the Transition from Cell Proliferation to Myogenic Differentiation in Mouse Myoblast-Derived Cells). Int J Cell Biol. 2013, 616294 (2013).
- Hindi, S. M., Tajrishi, M. M., Kumar, A. Signaling mechanisms in mammalian myoblast fusion. Sci Signal. 6 (272), re2 (2013).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy (3rd edition). Autophagy. 12 (1), 1-222 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved