Method Article
Разработка альфа-синуклеина основе Rat модели для лечения болезни Паркинсона с помощью стереотаксической инъекции рекомбинантного аденосателлитные вирусного вектора
В этой статье
Резюме
This manuscript describes how viral vector-mediated local gene delivery provides an attractive way to express transgenes in the central nervous system. The protocol outlines all crucial steps to perform a viral vector injection in the substantia nigra of the rat to develop a viral vector-based animal model for Parkinson's disease.
Аннотация
Для изучения молекулярных путей, болезни Паркинсона (PD) и разработки новых терапевтических стратегий, научные исследователи полагаются на животных моделях. Идентификация PD-ассоциированных генов привело к разработке генетических моделей PD. Наиболее трансгенные модели α-SYN мыши развивать постепенное α-SYN патологии, но не могут отображать четкую потерю дофаминергическая клеток и допамин зависит от поведенческих проблем. Этот барьер был преодолен путем прямого нацеливания черной субстанции с вирусными векторами избыточно экспрессирующих PD-ассоциированных генов. Локальная доставка гена с использованием вирусных векторов обеспечивает привлекательный способ выразить трансгенов в центральной нервной системе. Конкретные области мозга могут быть ориентированы (например , черной субстанции), экспрессия может быть индуцирована в обстановке взрослых и высокие уровни экспрессии могут быть достигнуты. Кроме того, можно использовать различные векторные системы на основе различных вирусов. Протокол описывает все важные шаги для выполнения вирусного вектораинъекции в черной субстанции у крысы разработать вирусный вектор на основе альфа-синуклеина животной модели болезни Паркинсона.
Введение
Для изучения патофизиологии PD и для разработки новых терапевтических стратегий, существует настоятельная потребность в животных моделях, которые близко напоминают невропатологии, физиологии и двигательных симптомов человека PD. Чем выше прогностическая ценность, тем лучше мы можем перевести новые методы лечения от животных моделей для пациентов.
Обнаружение альфа-синуклеина (α-SYN) в качестве первого гена парк в 1997 году привело к разработке первых генетических моделей PD. Многие трансгенные мыши сверхэкспрессией человека дикого типа (WT) или мутантного (A30P, A53T) α-SYN были получены за последнее десятилетие. Уровни α-син сверхэкспрессии оказались решающими в развитии патологии. Кроме того , штамм мыши, наличие или отсутствие эндогенного альфа-син и будет ли полная длина или укороченная форма выражается, играет определенную роль (подробный обзор Маген и Chesselet 1). Сверхэкспрессия как WT и нескольких клинических мутантов человека &# 945; -SYN у трансгенных мышей вызывает патологическое накопление альфа-син и нейронной дисфункции 2-6. Тем не менее, до сих пор наиболее трансгенные модели α-син мышь не удалось отобразить четкие потери дофаминергическая клеток и допамин-зависимых поведенческих дефицитов.
Этот барьер был преодолен путем прямого нацеливания черной субстанции (SN) с вирусными векторами избыточно экспрессирующих альфа-син. Вирусные векторы являются производными от вирусов, которые могут легко инфицировать клетки, вводят генетический материал в их геном хозяина и заставить клетки-хозяина для репликации вирусного генома с целью получения новых вирусных частиц. Вирусы могут быть сконструированы для не-тиражирование вирусных векторов, которые сохраняют свою способность проникать в клетки и ввести гены. При удалении части вирусного генома, и заменяя их генами, представляющие интерес, применение вектора приведет к одной круглой инфекции без репликации в клетке-хозяине, в целом обозначенный как '' трансдукции. Вирусные векторы сиспользоваться как для избыточной экспрессии и молчанием генов. Выраженная трансген может быть репортером белок (например , зеленый флуоресцентный белок или люциферазы светляков) 7, терапевтический белок для генной терапии приложений 8-10 или, как мы сосредоточимся в этой статье, это болезнь , связанных с белком , используемым для моделирования заболевания 11 -14.
Вирусный вектор-опосредованной доставки генов обеспечивает альтернативный способ выразить трансгенов в ЦНС с несколькими преимуществами. Использование локальной доставки трансгена, специфические области мозга могут быть направлены. Кроме того, экспрессия трансгенов может быть вызван во взрослую жизнь уменьшая риск появления компенсаторных механизмов в процессе развития. Кроме того, модели могут быть созданы в различных видов и штаммов. И, наконец, различные трансгены могут быть легко объединены. С помощью вирусных векторов, уровни экспрессии высокого трансгенные может быть достигнуто, что может иметь решающее значение, так как начало заболевания и тяжесть часто зависит от уровня Переэксression.
Было разработано несколько векторных систем, основанных на различных вирусов. Выбор векторной системы зависит от размера представляющего интерес гена, необходимого продолжительности экспрессии гена, клетки-мишени и вопросы биологической безопасности. Для получения стабильного переноса генов в головном мозге, лентивирусов (LV) и рекомбинантный адено-ассоциированный Viral (Раав) векторов в настоящее время считаются векторные системы выбора, так как они приводят к эффективному и долгосрочному экспрессии генов в мозге грызунов. Для конкретного нацеливания дофаминергических нейронов (DN) в SN, Раав векторы постепенно outcompeted векторы ЛЖ из-за их более высоких титрах и эффективности трансдукции DN.
Лучшие модели , основанные на грызунах α-SYN , доступные в настоящее время были разработаны на основе комбинированного подхода с использованием более новых AAV серотипов (Раав 1, 5, 6, 7, 8) и оптимизированы векторные конструкции, титры и чистота 15,16. Вектор титра, а также чистота вектор непосредственно влияетфенотипический результат модели. Чрезмерные векторные титры или недостаточно очищенные векторные партии могут приводить к неспецифической токсичностью. Поэтому соответствующие управляющие векторы являются обязательными. Значительные инвестиции время в вирусный вектор производства, укрупнения и процедуры очистки также доказали важное значение для получения воспроизводимых и высококачественные векторные партии.
протокол
Все эксперименты на животных проводятся в соответствии с директивой Европейского сообщества Совета от 24 ноября 1986 года (86/609 / EEC) и утверждено биоэтическом комитетом университета Левена (Бельгия) по.
1. Рекомбинантный AAV Получение и очистка
Примечание: вектор производства и очистки Раав проводили Левен вирусный вектор сердечника (LVVC) , как описано выше 17.
- В кратком изложении, субконфлюентные низкий трансфекции (<50) проход прилипшие НЕК 293T клеток с использованием 25 кД линейный полиэтиленимин 150 раствор NaCl, трансфекция нмоль и три различных плазмид в соотношении 1: 1: 1 Добавление к среде 2% фетальной телячьей сыворотки. После 24 ч инкубации при 37 ° С в 5% CO 2, замените носитель свежей DMEM , среда 2% фетальной телячьей сыворотки.
Примечание: Плазмиды включают конструкции для серотипа AAV7, передача ААВ плазмидой, кодирующей человеческий A53T мутант α-син под контролем CMVie усиливается SYNAPSin1 промотор и pAdvDeltaF6 аденовирусная плазмиды - хелпера 17. - Заготавливают среда через 5 дней после кратковременной трансфекции и концентрируют с помощью фильтрации 17 с тангенциальным потоком.
- Очищают векторных частиц Раав из концентрированной среды с использованием Иодиксанол ступенчатый градиент 17.
- Использование стандартных методов ПЦР в реальном времени для определения геномных копий (GC). В этом протоколе, вектора титром 3,0 E11 GC / мл использовали для разработки модели крысы на основе α-SYN для PD 17.
2. стереотаксической инъекции Раав альфа-SYN Вектор в SN Крысы (Рисунок 2)
- Дом восемь недель самок крыс линии Вистар весом 200-250 г при нормальном 12 ч цикле свет / темнота со свободным доступом к гранулированной пище и водопроводной воде.
- Submit крысе внутрибрюшинного (IP) анестезия, содержащий смесь кетамина (60 мг / кг) и медетомидин (0,4 мг / кг). После того, как крыса под наркозом и не реагируеткогда сдавливая различные лапами, администрировать микро-транспондера подкожно на спине крысы для дальнейшего распознавания с помощью микро-транспондера имплантер. Проверьте, если микро-транспондера правильно установлен и может быть считан считывающим устройством.
- Вырезать волосы на верхней части головы. Нанесите местный анестетик как на кожу головы и ушей. Выполните остальную часть хирургической процедуры в соответствии с ламинарным потоком с использованием асептических методов.
- Поместите крыс в стереотаксической рамы головки, используя два уха бара, рот и нос бар. Накройте тело крысы с бумажным одеялом, чтобы избежать снижения температуры тела. Нанести глазную смазку, чтобы предотвратить глаз от высыхания.
- Лечить кожи головы с jodium 1% в изопропаноле 70% и сделайте небольшой надрез по средней линии головы. Аккуратно соскрести мембраны на черепе и промыть физиологическим раствором. Пусть череп высохнуть в течение нескольких минут. Соблюдайте черепных швов и две опорные точки: темени и лямбда.
- Для того, чтобы впрыснуть Раав вектор в SN, определяют координаты в направлении брегмы (переднезаднем: 5,3 мм; медиолатеральной: 2,0 мм и дорсовентральный: 7.2 мм, рассчитанные из ТМО).
Примечание: Трехмерные координаты для каждой интересующей области можно вычислить с помощью стереотаксической атлас мозга крысы, применяя брегма в качестве анатомической точки отсчета. - Заполните 10 мкл микроинъекции шприц (30 калибр 20 мм) с Раав вектором и поместить его в стереотаксической инструмент, связанный с моторизованным микроинъекции насосом. Регулировка громкости, выпуская каплю вектора и устранить в поливалентной моющего средства рН 9 (например , RBS).
- Визуально проверьте, если головка крепится прямо в раме головки и оценить лево-правой оси. Тщательно визуально определить переднезадней и медиолатеральной координаты брегмы и Lambda и измерить их высоту с помощью иглы 30 мм калибра 20 в дорсовентральной руку стереотаксической рамы.
- Разрешить утраaximum разница 0,3 мм в высоте между брегмы и Lambda. Поместите иглу обратно на брегмы и применять переднезаднем и медиолатеральной координаты, перемещая переднезаднем и медиолатеральной руку стереотаксической рамы.
- На месте инъекции, измеряют высоту черепа и убедитесь, что она не отличается более чем на 0,3 мм от высоты брегмы. Просверлите отверстие в черепе диаметром около 2 мм. Измерьте высоту Дура, это будет служить ориентиром для применения дорсовентральной координат. В качестве альтернативы вычитать фиксированную толщину для черепа (0,9 мм).
- Проникнуть твердую мозговую оболочку с использованием 26 иглы калибра и поглощать кровь с стерильной салфеткой. Подождите, пока все кровотечение не остановилось, прежде чем продолжить.
- Медленно вставьте 10 мкл микроинъекции шприц предварительно загруженным с вектором раствора в мозг к заранее определенной глубины (дорсовентральный координат). Подождите 1 мин с иглой в месте. Вводят 3 мклвекторного раствора (3,0 E11 геномных копий / мл (средний вектор доза) или 1,0 Е12 GC / мл (высокий вектор доза) rAAV2 / 7 & alpha; SYN или EGFP управления вектором) с использованием моторизованных микроинъекции насос с пропускной способностью 0,25 мкл / минимум
- После инъекции держать иглу на месте в течение еще 5 мин, а затем медленно удалить его. Вышивание кожу головы при помощи покрытого плетеного полиэфира 3.0, дезинфицируют 1% jodium в 70% изопропилового спирта и осторожно удалить животное от стереотаксической инструмента. Сначала ослабьте бар нос и рот, а затем два уха бара.
- Для обратного анестезии, инъекции крысе внутрибрюшинно 0,5 мг / кг атипамезола и помещают крысу в чистую клетку на нагревательной пластине 38 ° С, пока он не просыпается. Накройте крыса с бумажным одеялом, чтобы предотвратить падение температуры тела.
- Обеспечить легкий доступ к пище и воде в течение первых часов. Монитор крысы в течение первых нескольких дней. При необходимости применять обезболивание.
Примечание: Там нет необходимости удалять стежки из тон череп. Через 1-2 недели череп полностью отремонтированы и stiches отсоединился.
3. Оценка rAAV2 / 7 α-SYN Введенные Крысы с использованием неинвазивных ПЭТ, поведенческие тесты и иммуногистохимического анализа
- Для того, чтобы следить за кинетики нигростриатальных дофаминергической нейродегенеративные неинвазивным с течением времени в отдельных животных, количественно переносчика дофамина (DAT) связывания с использованием малых животных позитронно - эмиссионной томографии (ПЭТ) и трассирующими ПДР Transporter , например , [18 F] -FECT 16 ,
- Чтобы проверить, является ли достаточным уровень дофаминергической нейродегенерации, чтобы побудить двигательных нарушений у крыс, крыс подвергают испытанию цилиндра для оценки спонтанного использования передних конечностей.
- Поместите крысу в 20 см шириной ясно стеклянный цилиндр и видеокассета поведение во время вертикальных движений вдоль стены и посадки после тыла. Оценка количества контактов, сделанных каждой лапой в общей сложности 20контакты. Для получения подробного описания критериев подсчета очков см Schallert и др. 18 Экспресс количество обесцененных передних конечностей контактов (например , левая передняя лапа) в процентах от общего числа контактов (передних конечностей левый плюс правый лапой).
Примечание: Не имеет поражений у контрольных крыс с использованием обеих лап в равной степени должны набрать около 50% в этом испытании.
- Поместите крысу в 20 см шириной ясно стеклянный цилиндр и видеокассета поведение во время вертикальных движений вдоль стены и посадки после тыла. Оценка количества контактов, сделанных каждой лапой в общей сложности 20контакты. Для получения подробного описания критериев подсчета очков см Schallert и др. 18 Экспресс количество обесцененных передних конечностей контактов (например , левая передняя лапа) в процентах от общего числа контактов (передних конечностей левый плюс правый лапой).
- Выполните иммуногистохимического (IHC) анализа для оценки уровня экспрессии трансгена и потери дофаминергическая клеток.
- На разных конце стадии, жертвуют крыс с передозировкой пентобарбитала натрия (60 мг / кг, внутрибрюшинно) и выполнить внутрисердечной перфузию с холодным физиологическим раствором с последующей обработкой 4% параформальдегида в PBS 19. Сосредоточение мозг в течение ночи при температуре 4 ° С и разрезают толщиной 50 мкм Коронарные срезы мозга с помощью вибрирующий микротом.
- Выполнение IHC окрашивания на свободно плавающих участках с использованием антител против альфа-син и тирозингидроксилазе анализировать уровни экспрессии α-син и ЛеVel нейродегенерации 16.
Результаты
Общая схема эксперимента изображена на рисунке 1
Раав 2/7-опосредованной избыточная экспрессия A53T альфа-SYN индуцирует допамина-зависимого дефициты двигателя.
Чтобы проверить , является ли достаточным , чтобы вызвать двигательные нарушения у крыс уровень α-SYN оверэкспрессии, мы подвергли крыс испытанию цилиндра для оценки спонтанного использования передних конечностей (рис 3А). От 3-х недель после инъекции, значительное ухудшение двигателя наблюдалось у крыс, получавших дозу 3,0 E11 GC / мл A53T альфа-син rAAV2 / 7 вектора. Через 4 недели после инъекции наблюдалось уменьшение спонтанной контралатеральной (слева) использования передней лапы 50%, в то время как контроль EGFP rAAV2 / 7 закачиваемой животных не показали асимметрии в использовании передней лапы (рис 3B). Крысы, которые получили более высокую A53T альфа-SYN rAAV2 / 7 вектор дозы показали более выраженный impairmлор использования передней лапы (70%) на 29 дней после инъекции (фиг.3С). Для того, чтобы доказать, что нарушение наблюдаемый двигатель был дофамин-зависимой, мы вводили разовую дозу L-ДОФА (6 мг / кг, внутрибрюшинно) крысам вводили с высоким вектором дозы. Когда мы повторили тест блока цилиндров 45 мин после обработки L-ДОФА, полное восстановление использования передней лапы в A53T α-SYN rAAV2 / 7 закачиваемой животных наблюдалось (рис 3C).
ПЭТ позволяет неинвазивной визуализации α-SYN индуцированной прогрессивной нейродегенерации.
Для того, чтобы следить за кинетики нигростриатальных дофаминергической нейродегенеративные неинвазивным с течением времени в отдельных животных, мы количественно переносчика дофамина (DAT) связывание с использованием небольших животных позитронно - эмиссионной томографии (ПЭТ) с [18 F] -FECT как радиолиганда. ДАТ связывание значительно уменьшились в ипсилатеральных хвостатых-скорлупе из A53T альфа-SYN rAAV2 / 7 INJECTed крыс в течение долгого времени , но оставались стабильными в контрольных животных EGFP (рис 4A - 4B). Количественное ДАТ связывание A53T α-SYN rAAV2 / 7 закачиваемой животных показали максимальную скорость нигростриатной дофаминергической дегенерации между 7-й день и 21 после инъекции. Через 32 дней, уменьшение ДАТ связывания до 85% наблюдалось (рис 4C). В качестве положительного контроля, Инъекции нейротоксина 6-OHDA в SN индуцированной потере 90% ДАТ связывания в течение 7 дней (фиг.4В - 4c).
Стереотактическая инъекция rAAV2 / 7 A53T альфа-син в SN крысы вызывает гибель нигральных дофаминергическая клеток и образование нерастворимых α-син положительных агрегатов.
Для анализа уровня α-син потери клеток сверхэкспрессии и дофаминергической мы животных умерщвляли в различные моменты времени. IHC проводили на свободно плавающих участках с использованием антител AGainst α-синуклеина (кроличьи поликлональные 1: 5000). Это антитело может обнаружить как человека и крысы α-синуклеина, но эндогенные уровни крысиной альфа-синуклеина были ниже предела обнаружения в пределах нигральных клеток somata, вследствие ее преимущественной локализацией в синаптических мембран. Для потери клеток ослов мы использовали антитела против TH (кролик поликлональных 1: 1000).
Через четыре дня после инъекции вектора Раав, α-SYN или экспрессии EGFP был обнаружен в SN (рис 5A - 5С) крыс. Большинство (> 90%) от DN был эффективно трансдуцированных и оба трансгенные белки были локализованы в клеточных тел и аксонов. На 29 дней наблюдалась после инъекции (р) существенное снижение экспрессии α-SYN в SNPC, в то время как это было до сих пор обнаруживается в районах , прилегающих к SN (рис 5B - 5C). Далее, мы проанализировали уровень нигральных потери клеток. Быстрое и прогрессирующая потеря Oе до 80% от TH-положительных нейронов был обнаружен в течение 29 дней у крыс , которым вводили A53T α-син rAAV2 / 7 (рис 5D - 5H). Следует отметить, что избыточная экспрессия дикого типа вместо A53T α-SYN, в результате подобной дофаминергической нейродегенерации (данные не показаны). Потеря DN в SN сопровождался прочном снижением TH-позитивных нервных окончаний в стриатуме (STR) (Рисунок 5F). Чтобы исключить конкретные вектор партии эффекты, различные векторные препараты α-SYN были испытаны в SN с аналогичными результатами. Нет снижение TH окрашивания не наблюдалось в SN или STR из EGFP rAAV2 / 7 впрыскивается контрольных животных (рис 5E-5H). Рядом с дофаминергической нейродегенерации, присутствие альфа-synucleinopathy является вторым важным признаком PD. Несмотря на короткое время хода нашей модели (четыре недели), мы наблюдали , как α-SYN-положительных цитоплазматических агрегатов в SN и дистрофические невриты в STR (Рисунок 5I Онг>). Ubiquitin иммунореактивности является отличительной чертой патологии тела тельцами Леви в мозге человека 20-22. Мы наблюдали совместной локализации альфа-син и убиквитин на 29 дней пи во фракции (± 20%) альфа-син , выражающей нигральных нейронов (рис 5J). Фибриллярная характер агрегатов α-син оценивали с помощью Тиофлавин S (тио S) окрашивание 23. Тио S положительные клетки были обнаружены в SN от 17 дней и далее (рис 5J).
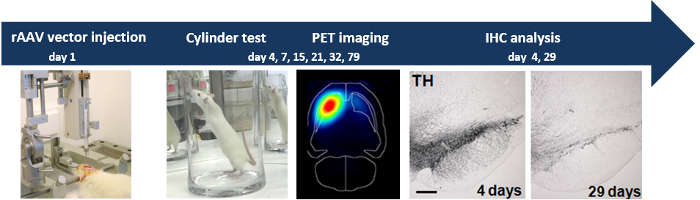
Рисунок 1:. Стереотаксической инъекции rAAV2 / 7 векторных результатов α-SYN в прогрессивной нейродегенерации стереотаксической инъекции rAAV2 / 7 α-SYN вектора в SN крысы индуцирует дофаминергические нейродегенера- , измеренный с помощью анализа поведения (тест - цилиндр), неинвазивной ПЭТ визуализация и анализ IHC.d / 53670 / 53670fig1large.jpg "целевых =" _blank "> Пожалуйста, нажмите здесь, чтобы посмотреть увеличенную версию этой фигуры.

Рисунок 2: стереотаксической инъекции rAAV2 / 7 вектора , кодирующего альфа-син в SN крысы. (А, В, Е) черепных швов на черепе крысы, определяющие две опорные точки: темени и лямбда. (С) стереотаксической атлас мозга крысы , представляющего область инъекции , а именно SN. (D) Вистар крысы расположенный в стереотаксической рамы головки , используя два уха бара, рот и нос бар. (F) 30 калибра иглы заполнены вектор помещается в положение для черной субстанции. (G) Небольшое целое просверлено в месте инъекции и игла находится в положении. (H) После инъекции кожа головы STItched и дезинфицировать. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
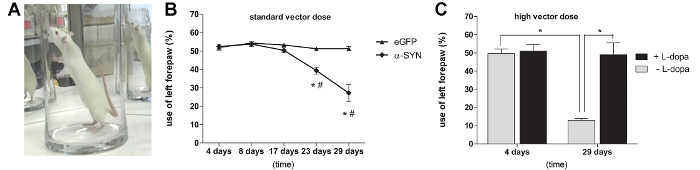
Рисунок 3: Раав 2/7 опосредованную избыточная экспрессия A53T альфа-SYN вызывает допамин-зависимого дефициты двигателя (А, В) Испытание цилиндра в различные моменты времени после инъекции rAAV2 / 7 A53T альфа-син.. (Среднее ± стандартное отклонение, * р <0,05 в сравнении с 17 дней, # р <0,05 управления EGFP по ANOVA и Тьюки постфактум тест, п = 5). (C) , тест цилиндра в различные моменты времени после инъекции rAAV2 / 7 A53T альфа-син (высокая доза) вектор. (Среднее ± стандартное отклонение, * р <0,05 4 дня против 29 дней по ANOVA и Тьюки постфактум тест, п = 5). Испытание проводили с использованием или без введения леводопы (L-ДОФА). (Среднее ± стандартное отклонение, * р <0.05 необработанным по сравнению с обработанными животными с помощью ANOVA и Тьюки постфактум тест, п = 5). Перепечатано из нейробиологии старения, Vol. 36, Ван дер Перрен и др., Продольная наблюдения и характеристика надежной крысиной модели болезни Паркинсона на основе избыточной экспрессии альфа-синуклеина с аденосателлитные вирусных векторов, 1543-1558, (2015), с разрешения Elsevier. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.

Рис . 4: Неинвазивная визуализация A53T альфа-SYN смерть индуцированных дофаминергическая клеток с использованием DAT ПЭТ (A - B) серии горизонтальных и корональных срезов , изображающие среднее полосатой ДАТ связывание (А) rAAV2 / 7 A53T α-SYN вводили животным в дифферемоменты времени T после инъекции (п = 7) и (B) rAAV2 / 7 EGFP впрыскивается (п = 1) или 6-OHDA лечение контрольных животных (n = 1), 79 дней после инъекции. Цветные полосы указывают на обязательные потенциалы для DAT. (С) Количественное определение ДАТ связывание rAAV2 / 7 A53T альфа-син, rAAV2 / 7 EGFP и 6-OHDA вводили животным , измеренные в различные моменты времени (Данные представляют собой среднее ± стандартное отклонение). Перепечатано из нейробиологии старения, Vol. 36, Ван дер Перрен и др., Продольная наблюдения и характеристика надежной крысиной модели болезни Паркинсона на основе избыточной экспрессии альфа-синуклеина с аденосателлитные вирусных векторов, 1543-1558, (2015), с разрешения Elsevier. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
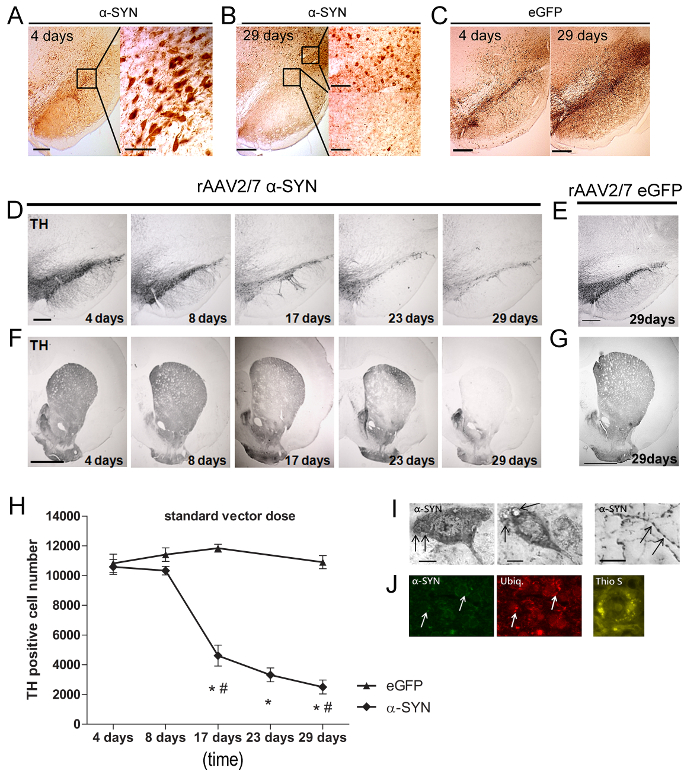
Рисунок 5: Раав 2/7 опосредованную избыточная экспрессия A53T альфа-SYN индуцирует гибель дофаминергическая клеток и образование нерастворимых α-син положительных агрегатов. (А - В) IHC Окрашивание демонстрирует α-SYN суперэкспрессия 4 дней и 29 дней после того, как Раав опосредованного переноса в крыса SN. Вставки показывают увеличениях выбранной области. Шкала бар = 400 мкм (обзор изображение слева), 70 мкм и 200 мкм (вставка справа). (C) IHC окрашивание демонстрирует EGFP ГИПЕРЭКСПРЕССИЯ 4 дней и через 29 дней после Раав опосредованного переноса в SN крыс. Шкала бар = 400 мкм. (D - G) , IHC Окрашивание для TH в SN и STR в различные моменты времени после инъекции (D, F) rAAV2 / 7 a-SYN или через 29 дней после инъекции (E, G) rAAV2 / 7 EGFP в SN , Шкала бар а, с = 400 мкм, б, d = 1000 мкм. (H) Стереологический квантификация NumbЭВ TH-позитивных нейронов в SN в течение долгого времени после того, как rAAV2 / 7 A53T α-SYN инъекции или rAAV2 / 7 вектора управления EGFP (среднее ± стандартное отклонение, * р <0,05 в сравнении с 8 дней, # р <0,05 в сравнении с контролем EGFP с помощью ANOVA и Таки после теста на специальной, п = 5). (I) IHC окрашивание демонстрирует альфа-SYN патологии, в том числе цитоплазматических агрегатов в SN и дистрофических и выпученными невриты в СТО, после того, как intranigral rAAV2 / 7 A53T α-SYN инъекции. (J) Представитель конфокальной изображения флуоресцентных двойных immunostainings для альфа-SYN (зеленый) и убиквитин (красный) показывают увеличение совместной локализации с течением времени (стрелки). Шкала бар с = 50 мкм. Тиофлавин S окрашивание SN через 29 дней после инъекции rAAV2 / 7 A53T альфа-SYN. Шкала бар D = 30 мкм. Перепечатано из нейробиологии старения, Vol. 36, Ван дер Перрен и др., Продольная наблюдения и характеристика надежной крысиной модели болезни Паркинсона на основе избыточной экспрессии альфа-синуклеина с объявлениемENO-ассоциированные вирусные векторы, 1543-1558, (2015), с разрешения Elsevier. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Обсуждение
Есть несколько важных шагов в рамках протокола. Вектор титра, а также чистота вектор непосредственно влияет на фенотипическое исход модели. Чрезмерные векторные титры или недостаточно очищенные векторные партии могут приводить к неспецифической токсичностью. Таким образом, использование высококачественных векторных партий и соответствующих контрольных векторов является необходимым условием. Кроме того, точное позиционирование головы крысы в стереотаксической рамы и точное определение координат имеет важное значение для ориентации черной субстанции. После сверления отверстия в черепе на месте инъекции, важно, чтобы вставить иглу прямо в мозг крысы, не касаясь каких-либо полей. Игла должна быть медленно удалены после инъекции вирусного вектора, чтобы предотвратить утечку вектор. И наконец, после того, как шить, кожа головы должна быть дезинфицируют 1% jodium в 70% изопропилового спирта, чтобы избежать укусов комаров из stiches другими животными. В качестве альтернативы другие антисептические реагентыможет быть использован.
Описанный метод также может быть использован для разработки rAAV2 / 7 α-SYN на основе модели мышей для болезни Паркинсона 24. У мышей мы вводим объем Раав вектора 2 мкл в SN. По сравнению с крысами, у мышей DN-видимому, несколько менее чувствительны к альфа-син гиперэкспрессия, что приводит к отсроченной проявления нейродегенерации. Кроме того, в других регионах в головном мозге (например , стриатуме, гиппокампе, кора головного мозга и т.д.) могут быть направлены. Координаты для различных областей мозга, могут быть найдены в стереотаксической атласе. Оптимизация координат может быть сделано с помощью тушью или с использованием вирусного вектора , кодирующего ген - репортер (например , EGFP). Различные векторы системы (Раав, LV и т.д.) могут быть использованы в зависимости от применения.
Этот метод имеет ограничение, что каждое животное должно быть введено индивидуально. Поэтому обученный человек должен выполнять инъекции с целью минвариации imize между различными животными. Другим ограничением является то, что метод требует больших затрат времени (когда он выполняется обученным человеком она занимает около 45 мин на одно животное). Только от восьми до десяти животных могут быть введены в один день.
Вирусный вектор-опосредованной доставки генов позволяет специфическое нацеливание областей головного мозга. С помощью вирусных векторов, уровни экспрессии высокого трансгенные может быть достигнуто, что имеет решающее значение, так как начало заболевания и тяжесть зависит от уровня экспрессии α-син. Кроме того, различные дозы могут быть применены, которые будут приводить к животной модели отображения медленнее или быстрее кинетики нейродегенерации. И, наконец, этот метод может быть использован для создания моделей у разных видов животных и штаммов, использующих тот же препарат вектор.
Эта процедура может быть использована для доставки вирусных векторов, а также токсины (например , 6-OHDA) в различных регионах трансгена brain.The , кодируемого вектором может быть репортером белок, терапевтический рrotein для применения генной терапии 8-10 или белка с заболеванием , используемого для моделирования заболевания 11-14. Этот метод может быть использован для разработки новых моделей животных, которые позволяют доклинических испытаний лекарственных средств и может быть полезным при изучении молекулярного механизма болезни Паркинсона, а также многих других нейродегенеративных расстройств.
Раскрытие информации
Авторы заявляют, что не существует никакого фактического или потенциального конфликта интересов.
Благодарности
Авторы благодарят Йорис Ван Asselberghs и Энн Ван Santvoort за отличную техническую помощь. Исследование финансировалось ИВТ-Vlaanderen (ИВТ SBO / 80020), в FWO Фландрии (G.0768.10), программой EC-FP6 'Dimi' (LSHB-CT-2005-512146), проект MEFOPA FP7 RTD (Health -2009-241791), программа FP7 "InMind" (ЗДОРОВЬЕ-F2-2011-278850), Ку-Лёвен (IOF-KP / 07/001, OT / 08 / 052A, IMIR PF / 10/017), а также MJFox Foundation (Целевая проверка 2010). А. Ван дер Перрен и С. Casteels являются постдокторской фламандского фонда научно-исследовательских работ. К. Ван Laere является старшим клинический сотрудник фламандского фонда научных исследований.
Материалы
| Name | Company | Catalog Number | Comments |
| Female 8 weeks old Wistar rats | Janvier | / | 200-250 g |
| Ketamine (Nimatek) | Eurovet animal health | 804132 | |
| Medetomidine (Dormitor) | Orion-Pharma/ Janssen Animal Health | 1070-499 | |
| Local anesthetic for scalp and ears: Xylocaïne 2% gel | Astrazeneca | 0137-547 | |
| Terramycine | Pfizer | 0132-472 | |
| Buprénorphine (Vetergesic) | Ecuphar | 2623-627 | |
| Jodium 1% isopropanol | VWR | 0484-0100 | |
| stereotactic head frame | Stoeling | / | |
| Hamilton Syringe (30 gauge -20 mm -pst 2) | Hamilton/ Filter Service | 7803-07 | |
| atipamezole (Antisedan) | Orion-Pharma/Elanco | 1300-185 | |
| rAAV A53T α-SYN vector | LVVC, KU Leuven | / | https://gbiomed.kuleuven.be/english/research/50000715/laboratory-of-molecular-virology-and-gene-therapy/lvvc/ |
| sodium pentobarbital (Nembutal) | Ceva Santé | 0059-444 | |
| microtome | Microm | HM650 | |
| rabbit polyclonal synuclein Ab | Chemicon | 5038 | 1:5,000 |
| rabbit polyclonal TH Ab | Chemicon | 152 | 1:1,000 |
| Lutetium oxyorthosilicate detector-based FOCUS 220 tomograph | Siemens/ Concorde Microsystems | / | |
| radioligand: 18F-FECT | In house | / | |
| L-dopa: Prolopa 125 | Roche | 6 mg/kg i.p. | |
| DMEM, Glutamax | Life Technologies | N° 31331-093 | |
| Foetal bovine serum | Life Technologies | N° 10270-106 | |
| 25 kD linear polyethylenimine (PEI) | Polysciences | / | |
| OptiPrep Density Gradient Medium: Iodixanol | Sigma | D1556-250ML | |
| Optimen | Life Technologies | N° 51985-026 | |
| Paxinos 1 watston steretactic atlas, fourth Edition | Elsevier | / |
Ссылки
- Magen, I., Chesselet, M. F. Genetic mouse models of Parkinson's disease The state of the art. Prog Brain Res. 183, 53-87 (2010).
- Masliah, E., et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders. Science. 287, 1265-1269 (2000).
- Freichel, C., et al. Age-dependent cognitive decline and amygdala pathology in alpha-synuclein transgenic mice. Neurobiol Aging. 28, 1421-1435 (2007).
- Fleming, S. M., Fernagut, P. O., Chesselet, M. F. Genetic mouse models of parkinsonism: strengths and limitations. NeuroRx. 2, 495-503 (2005).
- Kahle, P. J., et al. Selective insolubility of alpha-synuclein in human Lewy body diseases is recapitulated in a transgenic mouse model. Am J Pathol. 159, 2215-2225 (2001).
- Chesselet, M. F., Richter, F. Modelling of Parkinson's disease in mice. Lancet Neurol. 10, 1108-1118 (2011).
- Deroose, C. M., Reumers, V., Debyser, Z., Baekelandt, V. Seeing genes at work in the living brain with non-invasive molecular imaging. Curr Gene Ther. 9, 212-238 (2009).
- Manfredsson, F. P., et al. rAAV-mediated nigral human parkin over-expression partially ameliorates motor deficits via enhanced dopamine neurotransmission in a rat model of Parkinson's disease. Exp Neurol. 207, 289-301 (2007).
- Vercammen, L., et al. Parkin protects against neurotoxicity in the 6-hydroxydopamine rat model for Parkinson's disease. Mol Ther. 14, 716-723 (2006).
- Winklhofer, K. F. The parkin protein as a therapeutic target in Parkinson's disease. Expert opinion on therapeutic targets. 11, 1543-1552 (2007).
- Kirik, D., et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci. 22, 2780-2791 (2002).
- Kirik, D., et al. Nigrostriatal alpha-synucleinopathy induced by viral vector-mediated overexpression of human alpha-synuclein: a new primate model of Parkinson's disease. Proc Natl Acad Sci U S A. 100, 2884-2889 (2003).
- Lauwers, E., et al. Neuropathology and neurodegeneration in rodent brain induced by lentiviral vector-mediated overexpression of alpha-synuclein. Brain pathology. 13, 364-372 (2003).
- Klein, R. L., King, M. A., Hamby, M. E., Meyer, E. M. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther. 13, 605-612 (2002).
- Vander Perren, A., Van den Haute, C., Baekelandt, V. Viral Vector-Based Models of Parkinson's Disease. Curr Top Beh Neurosci. , (2014).
- Van der Perren, A., et al. Longitudinal follow-up and characterization of a robust rat model for Parkinson's disease based on overexpression of alpha-synuclein with adeno-associated viral vectors. Neurobiol Aging. , (2014).
- Van der Perren, A., et al. Efficient and stable transduction of dopaminergic neurons in rat substantia nigra by rAAV 2/1, 2/2, 2/5, 2/6.2, 2/7, 2/8 and 2/9. Gene Ther. , (2011).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Soueid, J., Nokkari, A., Makoukji, J. Techniques and Methods of Animal Brain Surgery: Perfusion, Brain Removal, and Histological Techniques. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Dale, G. E., et al. Relationships between Lewy bodies and pale bodies in Parkinson's disease. Acta Neuropathol. 83, 525-529 (1992).
- Dawson, V. L. Neurobiology of flies and mice. Science. 288, 631-632 (2000).
- Dawson, T., Mandir, A., Lee, M. Animal models of PD: pieces of the same puzzle?. Neuron. 35, 219-222 (2002).
- LeVine, H. Quantification of beta-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274-284 (1999).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Mol Neurodegener. 8, (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены