Method Article
組換えアデノ随伴ウイルスベクターの定位注射を介して、パーキンソン病のα-シヌクレインベースのラットモデルの開発
要約
This manuscript describes how viral vector-mediated local gene delivery provides an attractive way to express transgenes in the central nervous system. The protocol outlines all crucial steps to perform a viral vector injection in the substantia nigra of the rat to develop a viral vector-based animal model for Parkinson's disease.
要約
パーキンソン病(PD)の分子経路を研究し、新規治療戦略を開発するために、科学的な研究者は、動物モデルに依存しています。 PD関連遺伝子の同定は、遺伝的PDモデルの開発につながっています。ほとんどのトランスジェニックα-SYNのマウスモデルは、緩やかなα-SYNの病理を発症するが明確なドーパミン作動性細胞損失およびドーパミン依存性の行動障害を表示することができません。このハードルはPD関連遺伝子を過剰発現するウイルスベクターによる黒質の直接の標的にすることによって克服されました。ウイルスベクターを使用してローカル遺伝子送達は、中枢神経系に導入遺伝子を発現するための魅力的な方法を提供します。特定の脳領域( 例えば、黒質)標的化することができる、発現は、成人設定において誘導することができ、高い発現レベルを達成することができます。さらに、様々なウイルスに基づく別のベクター系を使用することができます。プロトコルは、ウイルスベクターを実行するために、すべての重要なステップの概要を説明しますラットの黒質内注入は、パーキンソン病のためのウイルスベクターベースのα-シヌクレインの動物モデルを開発します。
概要
PDの病態生理を研究し、新たな治療戦略を開発するために、密接にヒトPDの神経病理学、生理学や運動症状に似ている動物モデルのための緊急の必要性があります。予測値が高いほど、より良い私たちは、患者に、動物モデルからの新たな治療法を翻訳することができます。
1997年の最初のPARK遺伝子としてα-シヌクレイン(α-SYN)の発見は、最初の遺伝的PDモデルの開発につながりました。ヒト野生型(WT)または変異(A30P、A53T)α-SYNを過剰発現する多くのトランスジェニックマウスは、過去10年間に生成されています。 α-SYN過剰発現のレベルは、病理の発達において重要であることが証明されています。また、マウス系統、内因性α-SYNの全長または切断型を発現しているかどうか有無が、(MagenとChesselet 1による詳細なレビュー)役割を果たしています。 WTと人間のいくつかの臨床変異体の両方の過剰発現αトランスジェニックマウスにおける-SYNは、α-SYNと神経機能障害2-6の病理学的蓄積を誘導します。しかし、今までほとんどのトランスジェニックα-SYNのマウスモデルは、明確なドーパミン作動性細胞損失およびドーパミン依存性の行動障害を表示することができませんでした。
このハードルは、α-SYNを過剰発現するウイルスベクターによる黒質(SN)の直接の標的にすることによって克服されました。ウイルスベクターは容易に、細胞に感染し、その宿主ゲノムに遺伝物質を導入し、新たなウイルス粒子を生成するためにウイルスゲノムを複製する宿主細胞を強制することができ、ウイルスに由来します。ウイルスが細胞に侵入し、遺伝子を導入する能力を保持する非複製ウイルスベクターを操作することができます。ウイルスゲノムの一部を削除し、目的の遺伝子によってそれらを置換することにより、ベクトルの適用は、一般に、「形質導入」と指定された宿主細胞中で複製することなく、単一のラウンド感染をもたらします。ウイルスベクターC過剰発現および遺伝子サイレンシングの両方のために使用されます。表現導入遺伝子は、レポータータンパク質( 例えば 、緑色蛍光タンパク質またはホタルルシフェラーゼ)7、我々はこの論文に焦点を当てるように遺伝子治療用途8-10や、ために治療用タンパク質、疾患モデル11に使用される疾患関連タンパク質であることができます-14。
ウイルスベクター媒介遺伝子送達は、いくつかの利点とCNSにおける導入遺伝子を発現するための代替方法を提供します。ローカル導入遺伝子送達を使用して、特定の脳領域を標的にすることができます。さらに、導入遺伝子の発現は、発達中の代償機構のリスクを減少させる成人期に誘導することができます。また、モデルは、異なる種及び株で作成することができます。そして最後に、異なる導入遺伝子を容易に組み合わせることができます。ウイルスベクターを用いて、高い導入遺伝子発現レベルは、疾患の発症および重症度が頻繁overexpのレベルに依存するので、重要である可能性がある、達成することができますression。
様々なウイルスに基づくいくつかのベクター系が開発されています。ベクター系の選択は、目的の遺伝子、遺伝子発現、標的細胞及び生物学的安全性の問題の必要な持続時間の大きさに依存します。彼らは齧歯類の脳における効率的かつ長期的な遺伝子発現につながるので、脳内の安定した遺伝子導入のために、レンチウイルス(LV)および組換えアデノ随伴ウイルス(rAAVの)ベクターは、現在選択されたベクターシステムを考えています。 SNのドーパミン作動性ニューロン(DN)の特異的標的のために、rAAVベクターは、徐々に、それらのより高い力価およびDNの導入効率のLVベクトルをoutcompetedています。
現在利用可能な最良のα-SYNベースのげっ歯類モデルは、新しいAAV血清型(rAAVの1、5、6、7、8)と最適化されたベクター構築物、力価、および純度15,16を使用して合成アプローチから開発されてきました。ベクター力価と同様にベクトル純度が直接影響を与えますモデルの表現型の結果。過度のベクター力価または不十分に精製されたベクターのバッチは、非特異的な毒性をもたらし得ます。したがって、適切な制御ベクトルが不可欠です。ウイルスベクターの生産、スケールアップ、及び精製手順にかなりの時間を投資も再現可能で、高品質のベクトルバッチを得ることが不可欠であることが証明されています。
プロトコル
全ての動物実験は、1986年11月24日の欧州共同体理事会指令(609分の86 / EEC)に従って行われ、ルーベン大学(ベルギー)の生命倫理委員会によって承認されています。
1.組換えAAV産生および精製
注意:以前に17を説明したようにrAAVベクターの産生および精製は、ルーヴェンウイルスベクターコア(LVVC)によって行いました。
- 1:DMEM培地中で1〜2%ウシ胎児血清1の割合で25kDリニアポリエチレン150 nMのNaClのトランスフェクション溶液を3つの異なるプラスミドを使用して(<50)の通路付着HEK 293T細胞簡潔に述べると、トランスフェクトサブコンフルエント低いです。 5%CO 2中37℃でのインキュベーションの24時間後に、新鮮なDMEM培地を2%ウシ胎児血清を含む培地を交換します。
注:プラスミドはAAV7血清型のための構築物を含む、CMVIEの制御下で、人間A53T変異体α-SYNをコードするAAVトランスファープラスミドはsynapsを強化しましたin1のプロモーターとpAdvDeltaF6アデノウイルスヘルパープラスミド17。 - 5日一過性トランスフェクション後に培地を回収し、接線流濾過17を使用して集中します。
- イオジキサノール段階勾配17を使用して濃縮された媒体からのrAAVベクター粒子を精製します。
- ゲノムコピー(GC)決意のためのリアルタイムPCRの標準的な技術を使用してください。このプロトコルでは、3.0 E11 GCのベクター力価は、/ mlのPD 17のためのα-SYNベースのラットモデルを開発するために使用されました。
ラットのSNでのrAAVα-SYNベクター(図2)の2定位注射
- ペレット化し、食品や水道水に自由にアクセスで通常の12時間の明/暗サイクル下で約200〜250gのハウス8週齢の雌Wistarラット。
- 腹腔内にラットを提出ケタミンの混合物(60 mgの/ kg)およびメデトミジン(0.4ミリグラム/キログラム)を含む(IP)麻酔。ラットを麻酔して、反応しないいったん別の足を圧迫するとき、マイクロトランスポンダ注入装置を使用してさらに認識のためのラットの背面にマイクロトランスポンダを皮下に投与します。マイクロトランスポンダが正しく配置され、読取装置によって読み出すことができるかどうかをチェックします。
- 頭皮の上に髪をカットします。頭皮と耳の両方に局所麻酔薬を適用します。無菌技術を用いて、層流の下で外科手術手順の残りを実行します。
- 2耳バー、口と鼻のバーを使用して、定位ヘッドフレームにラットを置きます。体温の低下を回避するために、紙ブランケットラットの体を覆います。乾燥から目を防ぐために、眼の潤滑剤を塗布します。
- イソプロパノール70%でjodium 1%と頭皮を消毒し、頭皮の正中線に小さな切開を行います。静かに頭蓋骨上の膜を削り取ると、生理食塩水で洗い流してください。数分間頭蓋骨乾かします。ブレグマとラムダ:頭蓋縫合と2つの基準点を守ってください。
- SNにrAAVベクターを注入するために、ブレグマに向かって(:;:2.0ミリメートルと背腹:硬膜から計算さ7.2ミリメートル内外5.3ミリメートル前後)の座標を定義します。
注:関心のある各領域の三次元座標は、解剖学的基準点としてブレグマを適用し、ラット脳の定位アトラスを用いて計算することができます。 - rAAVベクターを用いて10μlのマイクロインジェクションのシリンジ(30ゲージ20ミリメートル)を記入し、電動式マイクロインジェクションポンプに接続された定位固定装置に入れてください。ベクトルの滴を放出することによって、ボリュームを制御し、多価のクリーニング洗剤のpH 9( 例えば RBS)に排除します。
- 視覚的にヘッドがストレートヘッドフレームに固定されているかどうかを確認し、左右軸を評価します。慎重に視覚的にブレグマとラムダのための前後および内外側の座標を定義し、定位フレームの背腹腕に30ゲージ20ミリメートルの針を使用して、その高さを測定。
- 午前を許可しますブレグマとラムダとの高さの0.3ミリメートル差のaximum。ブレグマに戻って針を置き、前後と定位フレームの内外側アームを移動させることにより、前後および内外側の座標を適用します。
- 注射の場所で、頭蓋骨の高さを測定し、それはブレグマの高さから0.3mm以下が異ならないことを確認してください。約2ミリメートルの直径を有する頭蓋骨に穴を開けます。硬膜の高さを測定し、これは背腹座標を適用するための基準として機能します。あるいは、頭蓋骨(0.9ミリメートル)のために一定の厚さを引きます。
- 26ゲージの針を使用して硬膜を貫通し、無菌の組織と血液を吸収します。すべての出血が進む前に、停止するまで待ちます。
- ゆっくりと(背腹座標)予め定められた深さまで脳内に10μlのマイクロインジェクションのシリンジは、ベクター溶液を事前にロードされて挿入します。代わりに針で1分待ちます。 3μLを注入します0.25μlの/のスループットを持つ電動式マイクロインジェクションポンプを用いて、ベクター溶液(3.0 E11ゲノムコピー/ ml(培地ベクター用量)またはrAAV2を/ 7α-SYNまたはeGFPのコントロールベクターの1.0 E12 GC /ミリリットル(高ベクター用量))の分。
- 注入後、ゆっくりとそれを削除する前に別の5分間の場所に針を保ちます。コーティングされた編組ポリエステル3.0を使用して頭皮をステッチ、70%イソプロパノール中の1%jodiumで消毒し、穏やかに定位装置から動物を削除します。まず鼻と口バーを緩め、2つの耳のバー。
- 麻酔を逆にするには、0.5ミリグラム/キログラムアチパメゾールを腹腔内にラットを注入し、それが目を覚ますまで、38℃の加熱板上にきれいなケージにラットを置きます。体温の低下を防止するために、紙ブランケットでラットを覆います。
- 最初の数時間のために食料と水への容易なアクセスを提供します。最初の数日間、ラットを監視します。必要に応じて鎮痛を適用します。
注:トンからステッチを削除する必要はありません彼は頭蓋骨。 1-2週間後頭骨が完全に修復され、stichesが緩みます。
非侵襲性PETイメージング、行動試験および免疫組織化学的解析を用いた3 rAAV2をの評価/ 7α-SYN注射したラット
- 、個々の動物で時間をかけて非侵襲的に黒質線条体ドーパミン作動性神経変性の動態をフォローアップ小動物陽電子放射断層撮影(PET)とDAトランスポーターなどのトレーサーを使用して結合ドーパミントランスポーター(DAT)を定量化するために、[18 F] -FECT 16 。
- ドーパミン作動性神経変性のレベルはラットにおける運動障害を誘導するのに十分であるかどうかを調べるために、自発的な前肢の使用を評価するために、シリンダテストをラットに施します。
- 後部後壁と着陸に沿って上下移動中20センチメートルワイドクリアガラスシリンダーとビデオテープに行動をラットを置きます。 20の合計のために各前肢によって行われた連絡先の数をスコア連絡先。採点基準の詳細についてはSchallert らを参照してください。18は 、総前肢の連絡先(左プラス右前足)の割合として損なわ前肢の連絡先( 例えば左前足)の数を表現します。
注:両方の足を使用して、非傷害対照ラットも同様に、この試験では50%前後を獲得する必要があります。
- 後部後壁と着陸に沿って上下移動中20センチメートルワイドクリアガラスシリンダーとビデオテープに行動をラットを置きます。 20の合計のために各前肢によって行われた連絡先の数をスコア連絡先。採点基準の詳細についてはSchallert らを参照してください。18は 、総前肢の連絡先(左プラス右前足)の割合として損なわ前肢の連絡先( 例えば左前足)の数を表現します。
- 導入遺伝子の発現とドーパミン作動性細胞損失のレベルを評価するための免疫組織化学(IHC)分析を実行します。
- 異なるエンド段階では、ペントバルビタールナトリウム(60mg / kg、腹腔内)の過剰投与によりラットを犠牲にし、PBS 19中の4%パラホルムアルデヒドに続いて冷生理食塩水で心臓内灌流を行います。 4℃で一晩脳を固定し、振動ミクロトームを用いて厚さ50μmの冠状脳切片を切りました。
- α-SYNの発現レベルを分析するためにα-SYNおよびチロシンヒドロキシラーゼに対する抗体を用いて、自由浮遊切片でIHC染色を行い、ル神経変性16のVEL。
結果
実験の全体的なスキームは、図1に示されています
A53Tα-SYNのrAAVの2月7日媒介過剰発現はドーパミン依存性の運動障害を誘発します。
α-SYN過剰発現のレベルは、ラットにおける運動障害を誘導するのに十分であるかどうかを調べるために、我々は、自発的な前肢の使用( 図3A)を評価するために、シリンダー試験をラットに行きました。注射後3週間で、かなりの運動障害は、A53Tのα-SYNたrAAV2 / 7ベクターの用量3.0 E11 GC /ミリリットルを受けたラットで見られました。注射後4週目に自発的な対側(左)前肢の使用の50%の減少がeGFPのrAAV2を/ 7は、動物を注射した対照に対し、前足の使用( 図3B)には非対称性を示さなかった、観察されました。高いA53Tα-SYNたrAAV2 / 7ベクター用量を受けたラットは、より顕著impairmを示しました前肢の使用のENT(70%)、注射後29日目( 図3C)において。観測された運動障害は、ドーパミン依存性であったことを証明するために、我々は高ベクター用量を注射したラットにL-DOPA(6ミリグラム/ kg、腹腔内)の単回投与を投与しました。私たちは、L-DOPAの治療後にシリンダーテスト45分を繰り返した場合、A53Tのα-SYNで前足の使用の完全な回復は、rAAV2を/ 7は、動物を注射した ( 図3C)が観察されました。
PET画像化は、α-SYN誘導される進行性の神経変性の非侵襲的イメージングを可能にします。
非侵襲的に個々の動物で時間をかけて黒質線条体ドーパミン作動性神経変性の動態をフォローアップするために、我々は、放射性リガンドとして[18 F] -FECTで小動物陽電子放射断層撮影法(PET)を使用して結合ドーパミントランスポーター(DAT)を定量化しました。 DATは大幅A53Tのα-SYNたrAAV2 / 7 injecの同側尾状核、被殻で減少した結合しますテッド時間にわたってラットが、eGFPをコントロール動物( 図4A - 4B)で安定していました。 DATはrAAV2を/ 7は、動物を注射しα-SYN A53Tの結合の定量は、注射後7日目と21の間の黒質線条体のドーパミン作動性変性の最大速度を示しました。 32日後、85%までの結合DATの減少は、( 図4C)が観察されました。陽性対照として、神経毒SNにおける6-OHDAの注射は、7日( - 4C 図4B)内に結合DATの90%の損失を誘導しました。
ラットのSNでrAAV2を/ 7 A53Tα-SYNの定位注射は、黒質ドーパミン作動性細胞死および不溶性α-SYN陽性の凝集体の形成を誘導します。
α-SYNの過剰発現とドーパミン作動性細胞損失のレベルを分析するために、我々は、異なる時点で動物を犠牲にしました。 IHCは、抗体AGを使用して、自由浮遊切片上で実施しましたainstαシヌクレイン(ウサギポリクローナル1:5000)。この抗体は、ヒトおよびラットの両方αシヌクレインを検出することができますが、ラットαシヌクレインの内因性レベルは、シナプス膜で、その支配的な局在化のために、黒質細胞の細胞体の中に検出限界以下でした。ロバ細胞の喪失に我々はTH(:1,000ウサギポリクローナル1)に対する抗体を使用します。
ラットの-四日rAAVベクター注射後、α-SYNまたはeGFP発現は、SN(5C 図5A)で検出されました。 DNの大部分(> 90%)を効率よく形質導入されたとの両方のトランスジェニックタンパク質は、細胞体と軸索に局在していました。それはまだSN( - 5C 図5B)の周辺地域で検出可能であった29日目にポスト噴射(π)α-SYN発現の実質的な減少は、SNpcで観察されました。次に、我々は、黒質細胞損失のレベルを分析しました。迅速かつ進行性の損失OTH陽性ニューロンの80%までfをA53Tのα-SYNたrAAV2 / 7( - 5H 図5D)を注射したラットに29日間にわたって検出されました。注目すべきは、野生型の代わりに、A53Tのα-SYNの過剰発現(データは示されていない)類似のドーパミン作動性神経変性をもたらしました。 SNにおけるDNの損失は、線条体(STR)( 図5F)におけるTH陽性神経終末の堅牢な減少と平行しました。特定のベクターバッチ効果を除外するために、異なるα-SYNベクター調製物は、同様の結果をSNで試験しました。 TH染色の減少は、SNでは観察されなかったかのeGFPたrAAV2 / 7のSTRは、対照動物( 図5E-5H)を注入しました。ドーパミン作動性神経変性の次に、α-シヌクレイノパチーの存在は、PDの第二の重要な特徴です。我々のモデル(4週間)の短い時間経過にもかかわらず、我々はSTR( 図5Iにα-SYN陽性SNにおける細胞質凝集体およびジストロフィー神経突起の両方を観察しましたオング>)。ユビキチン免疫反応性は、人間の脳20-22でレビー小体病理学の明確な特徴です。私たちは、黒質の神経細胞( 図5J)を発現する α-SYNの割合(±20%)で29日のパイでα-SYNとユビキチンの共局在を観察しました。 α-SYN凝集の線維性は23染色チオフラビンS(チオS)により評価しました。チオ陽性細胞は以降17日( 図5J)からSNで検出されたS。
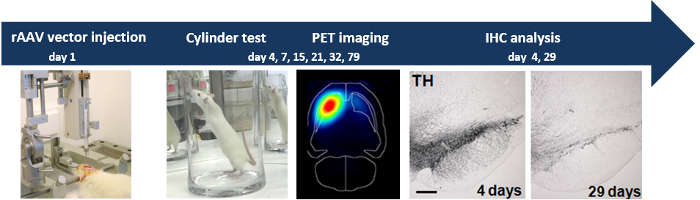
図1:プログレッシブ神経変性におけるrAAV2を/ 7α-SYNベクトル結果の定位注入ラットのSNでrAAV2を/ 7α-SYNベクターの定位注射は、行動分析(円筒試験)、非侵襲性PETを介して測定ドーパミン作動性神経変性を誘発しますイメージングおよびIHC分析。D / 53670 / 53670fig1large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図2:ラットのSNにおけるα-SYNたrAAV2 / 7をコードするベクターの定位注射 。 (A、B、E)2つの基準点を定義したラットの頭蓋骨上の頭蓋縫合、:ブレグマとラムダ。 (C)すなわちSN注入領域を提示ラット脳の定位アトラス。 (D)は、2つの耳バー、口と鼻のバーを使用して定位ヘッドフレーム内に配置ウィスター系ラット。 (F)ベクターを充填した30ゲージ針は黒質のための位置に配置されます。 (G)が小さく全体が注射部位に穿孔され、針は位置に配置されています。 (H)注入後頭皮は、STIでありますtched、消毒。 この図の拡大版をご覧になるにはこちらをクリックしてください。
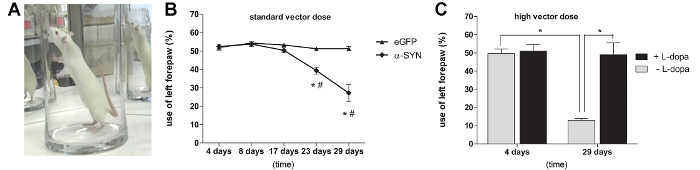
図3:A53Tのα-SYNのrAAVの2月7日媒介過剰発現はドーパミン依存性の運動障害を誘発する異なる時点(A、B)シリンダテストα-SYNたrAAV2 / 7 A53Tの注射後。 (平均±SD、* p <0.05の17対日、#pの(C)シリンダテスト。 (ANOVAおよびTukeyの事後検定によって29日対0.05 4日*はp <、平均値±SD、n = 5)でした。試験は、またはレボドパ(L-DOPA)を投与せずに行きました。 (平均±SD、*はp <0。05 ANOVAおよびTukeyの事後検定によって処置した動物対非処理、N = 5)。老化の神経生物学、巻より転載。 36、ファンデペレンら 、エルゼビアからの許可を得てアデノ随伴ウイルスベクター、1543年から1558年、(2015)、とα-シヌクレインの過剰発現に基づいて、パーキンソン病のための堅牢なラットモデルの縦フォローアップとキャラクタリゼーション。 この図の拡大版をご覧になるにはこちらをクリックしてください。

図4:DAT PETイメージングを使用して、A53Tのα-SYN誘発されるドーパミン作動性細胞死の非侵襲的イメージング ( - B)、水平および冠状スライスのシリーズ(A)rAAV2を/ 7 A53Tα-SYNの結合平均線条体のDATを描いた動物を注入しましたdifferenでT時間注入後の点(N = 7)及び(B)rAAV2を/ 7のeGFP注入(N = 1)、6-OHDAは、コントロール処置動物(N = 1)79日注射後。カラーバーは、DATの結合可能性を示しています。 (C)DATの定量は、α-SYNたrAAV2 / 7 A53Tの結合は、rAAV2を/ 7 EGFPおよび6-OHDAは異なる時点で測定された動物を注射した(データは平均±標準偏差表します)。老化の神経生物学、巻より転載。 36、ファンデペレンら 、エルゼビアからの許可を得てアデノ随伴ウイルスベクター、1543年から1558年、(2015)、とα-シヌクレインの過剰発現に基づいて、パーキンソン病のための堅牢なラットモデルの縦フォローアップとキャラクタリゼーション。 この図の拡大版をご覧になるにはこちらをクリックしてください。
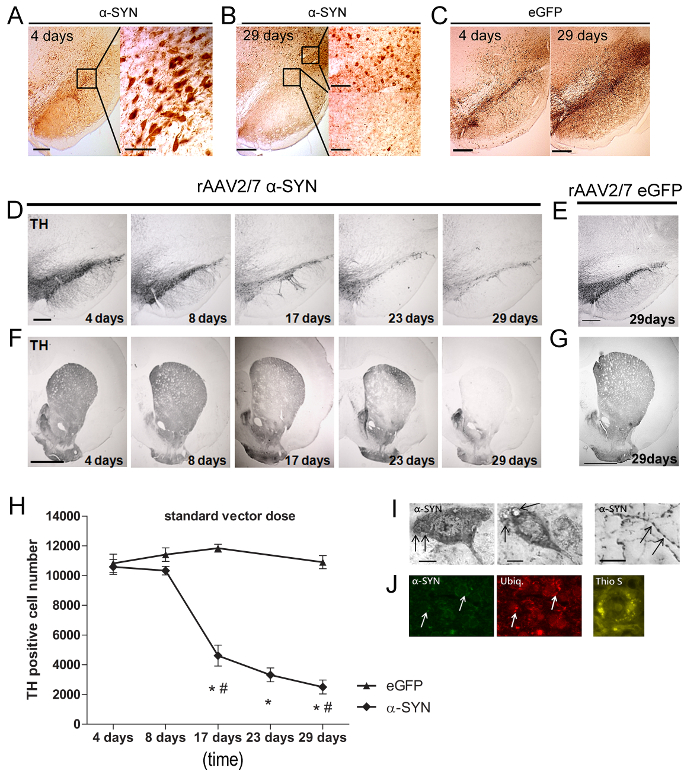
図5: のrAAV A53Tのの2月7日媒介過剰発現α-SYNはドーパミン作動性細胞死および不溶性α-SYN陽性の凝集体の形成を誘導する。(A - B)IHC染色実証α-SYN過剰発現4日と29日でのrAAV媒介導入後ラットのSN。挿入は、選択した領域の倍率を示しています。スケールバー= 400μmの(概要写真左)、70および200μm(インサート右)。 (C)IHC染色は、4日間のeGFPの過剰発現を実証し、29日のラットのSNでのrAAV媒介転送後。スケールバー=400μmの。 (D - G)SN中の(E、G)rAAV2をは/ 7のeGFPの注射後(D、F)rAAV2を/ 7α-SYNまたは29日間の注射後の異なる時点でのSNとSTRにおけるTHのためのIHC染色。スケールバーA、C = 400μmであり、B、D =1000μmで。 (H)麻痺の立体定量時間をかけてSNにおけるTH陽性ニューロンの小胞体たrAAV2 / 7 A53Tのα-SYNの注射またはrAAV2を/ 7のeGFPコントロールベクター(平均±SD後、* P <0.05対8日、#pの(I)IHC染色は黒質内のrAAV2を/ 7 A53Tα-SYN注射後、細胞質SNにおける凝集体およびジストロフィーとSTRで膨らんだ神経突起を含む、α-SYNの病理を実証しています。 (J)α-SYN(緑)、ユビキチン(赤)用の蛍光二重免疫染色の代表的な共焦点画像は、時間(矢印)を超える共局在の増加を示します。スケールバーC =50μmです。 29日α-SYNたrAAV2 / 7 A53Tの注入後のSNのチオフラビンS染色。スケールバーD =30μmです。老化の神経生物学、巻より転載。広告とα-シヌクレインの過剰発現に基づいて、パーキンソン病のための堅牢なモデルラットの36、ファン・デル・ペレンら 、縦フォローアップとキャラクタリゼーションENO-関連ウイルスベクター、1543-1558、(2015)、エルゼビアからの許可を得て。 この図の拡大版をご覧になるにはこちらをクリックしてください。
ディスカッション
プロトコル内のいくつかの重要なステップがあります。ベクター力価と同様にベクトル純度は直接モデルの表現型の結果に影響を与えます。過度のベクター力価または不十分に精製されたベクターのバッチは、非特異的な毒性をもたらし得ます。したがって、高品質のベクトルバッチおよび適切な制御ベクトルの使用が不可欠です。また、定位フレームにおけるラットの頭の正確な位置決めと座標の正確な決意は、黒質を標的化するのに不可欠です。注射部位での頭蓋骨に穴を開けた後、任意の余白に触れることなく真っ直ぐラットの脳に注射針を挿入することが重要です。針をゆっくりベクトル漏れを防止するために、ウイルスベクターを注入した後に除去されるべきです。最後に、ステッチの後、頭皮は他の動物によってstichesの痛烈を回避するために、70%のイソプロパノール中の1%jodiumで消毒する必要があります。あるいは、他の防腐剤に使える。
記載の方法はまた、パーキンソン病24 rAAV2を/ 7α-SYNベースのマウスモデルを開発するために使用することができます。マウスでは、SN 2μlのrAAVベクターの量を注入します。ラット、マウスDNと比較すると、α-SYNのために過剰発現を、神経変性の遅延現れ、その結果幾分敏感であるように見えます。さらに、脳の他の領域( 例えば、線条体、海馬、皮質、 等)を標的とすることができます。異なる脳領域の座標は定位アトラスで見つけることができます。座標の最適化は、墨によって、または( 例えば 、EGFP)レポーター遺伝子をコードするウイルスベクターを使用することによって行うことができます。異なるベクターシステム(rAAVの、LV など)は、アプリケーションに応じて使用することができます。
この技術は、各動物を個別に注入しなければならない限界があります。したがって、訓練を受けた人は分に順番に注射を行う必要があります異なる動物間マイズバリエーション。別の制限は、この方法は時間がかかり(訓練を受けた人によって実行されたとき、それは動物当たり約45分かかります)であることです。わずか8〜10匹の動物は、1日に注入することができます。
ウイルスベクター媒介遺伝子送達は、脳領域の特定の標的化を可能にします。ウイルスベクターを用いて、高い導入遺伝子発現レベルは、疾患の発症および重症度がα-SYN発現レベルに依存するため、非常に重要である、達成することができます。また、異なる用量は神経変性のより遅いまたはより速い反応速度を表示する動物モデルをもたらすれる適用することができます。最後に、この技術は、同一のベクター調製物を使用して、異なる動物種及び株でモデルを作成するために使用することができます。
レポータータンパク質、治療用のpすることができます。この手順では、ベクターによりコードbrain.The導入遺伝子の異なる領域へのウイルスベクター、ならびに毒素( 例えば、6-OHDA)を送達するために使用することができます遺伝子治療用途8-10または疾患モデル11-14のために使用される疾患関連タンパク質のためのrotein。この技術は、前臨床薬物試験を可能にする新規の動物モデルを開発するために使用することができ、パーキンソン病だけでなく、他の多くの神経変性疾患の分子機構を研究するのに有益であることができます。
開示事項
著者らは、利害の実際のまたは潜在的な競合が存在しないことを宣言します。
謝辞
著者は、その優れた技術支援のためのヨリス・ヴァンAsselberghsとアンヴァンSantvoortに感謝します。研究は、IWT-ブラーンデレン(IWT SBO / 80020)、FWOブラーンデレン(G.0768.10)、EC-FP6プログラムには 'DiMI'(LSHB-CT-2005から512146)、FP7 RTDプロジェクトMEFOPA(HEALTHによって賄われていました-2009-241791)、FP7プログラム」INMiND '(HEALTH-F2-2011-278850)、KUルーベン(IOF-KP / 07/001、OT / 08 / 052A、IMIR PF / 10/017)、およびMJFox財団(ターゲットの検証2010)。 A.ファンデペレンとC. Casteelsは、科学研究のフランドル基金のポスドクです。 K.ヴァンLaereは、科学研究のフランドル基金のシニア臨床フェローです。
資料
| Name | Company | Catalog Number | Comments |
| Female 8 weeks old Wistar rats | Janvier | / | 200-250 g |
| Ketamine (Nimatek) | Eurovet animal health | 804132 | |
| Medetomidine (Dormitor) | Orion-Pharma/ Janssen Animal Health | 1070-499 | |
| Local anesthetic for scalp and ears: Xylocaïne 2% gel | Astrazeneca | 0137-547 | |
| Terramycine | Pfizer | 0132-472 | |
| Buprénorphine (Vetergesic) | Ecuphar | 2623-627 | |
| Jodium 1% isopropanol | VWR | 0484-0100 | |
| stereotactic head frame | Stoeling | / | |
| Hamilton Syringe (30 gauge -20 mm -pst 2) | Hamilton/ Filter Service | 7803-07 | |
| atipamezole (Antisedan) | Orion-Pharma/Elanco | 1300-185 | |
| rAAV A53T α-SYN vector | LVVC, KU Leuven | / | https://gbiomed.kuleuven.be/english/research/50000715/laboratory-of-molecular-virology-and-gene-therapy/lvvc/ |
| sodium pentobarbital (Nembutal) | Ceva Santé | 0059-444 | |
| microtome | Microm | HM650 | |
| rabbit polyclonal synuclein Ab | Chemicon | 5038 | 1:5,000 |
| rabbit polyclonal TH Ab | Chemicon | 152 | 1:1,000 |
| Lutetium oxyorthosilicate detector-based FOCUS 220 tomograph | Siemens/ Concorde Microsystems | / | |
| radioligand: 18F-FECT | In house | / | |
| L-dopa: Prolopa 125 | Roche | 6 mg/kg i.p. | |
| DMEM, Glutamax | Life Technologies | N° 31331-093 | |
| Foetal bovine serum | Life Technologies | N° 10270-106 | |
| 25 kD linear polyethylenimine (PEI) | Polysciences | / | |
| OptiPrep Density Gradient Medium: Iodixanol | Sigma | D1556-250ML | |
| Optimen | Life Technologies | N° 51985-026 | |
| Paxinos 1 watston steretactic atlas, fourth Edition | Elsevier | / |
参考文献
- Magen, I., Chesselet, M. F. Genetic mouse models of Parkinson's disease The state of the art. Prog Brain Res. 183, 53-87 (2010).
- Masliah, E., et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders. Science. 287, 1265-1269 (2000).
- Freichel, C., et al. Age-dependent cognitive decline and amygdala pathology in alpha-synuclein transgenic mice. Neurobiol Aging. 28, 1421-1435 (2007).
- Fleming, S. M., Fernagut, P. O., Chesselet, M. F. Genetic mouse models of parkinsonism: strengths and limitations. NeuroRx. 2, 495-503 (2005).
- Kahle, P. J., et al. Selective insolubility of alpha-synuclein in human Lewy body diseases is recapitulated in a transgenic mouse model. Am J Pathol. 159, 2215-2225 (2001).
- Chesselet, M. F., Richter, F. Modelling of Parkinson's disease in mice. Lancet Neurol. 10, 1108-1118 (2011).
- Deroose, C. M., Reumers, V., Debyser, Z., Baekelandt, V. Seeing genes at work in the living brain with non-invasive molecular imaging. Curr Gene Ther. 9, 212-238 (2009).
- Manfredsson, F. P., et al. rAAV-mediated nigral human parkin over-expression partially ameliorates motor deficits via enhanced dopamine neurotransmission in a rat model of Parkinson's disease. Exp Neurol. 207, 289-301 (2007).
- Vercammen, L., et al. Parkin protects against neurotoxicity in the 6-hydroxydopamine rat model for Parkinson's disease. Mol Ther. 14, 716-723 (2006).
- Winklhofer, K. F. The parkin protein as a therapeutic target in Parkinson's disease. Expert opinion on therapeutic targets. 11, 1543-1552 (2007).
- Kirik, D., et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci. 22, 2780-2791 (2002).
- Kirik, D., et al. Nigrostriatal alpha-synucleinopathy induced by viral vector-mediated overexpression of human alpha-synuclein: a new primate model of Parkinson's disease. Proc Natl Acad Sci U S A. 100, 2884-2889 (2003).
- Lauwers, E., et al. Neuropathology and neurodegeneration in rodent brain induced by lentiviral vector-mediated overexpression of alpha-synuclein. Brain pathology. 13, 364-372 (2003).
- Klein, R. L., King, M. A., Hamby, M. E., Meyer, E. M. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther. 13, 605-612 (2002).
- Vander Perren, A., Van den Haute, C., Baekelandt, V. Viral Vector-Based Models of Parkinson's Disease. Curr Top Beh Neurosci. , (2014).
- Van der Perren, A., et al. Longitudinal follow-up and characterization of a robust rat model for Parkinson's disease based on overexpression of alpha-synuclein with adeno-associated viral vectors. Neurobiol Aging. , (2014).
- Van der Perren, A., et al. Efficient and stable transduction of dopaminergic neurons in rat substantia nigra by rAAV 2/1, 2/2, 2/5, 2/6.2, 2/7, 2/8 and 2/9. Gene Ther. , (2011).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Soueid, J., Nokkari, A., Makoukji, J. Techniques and Methods of Animal Brain Surgery: Perfusion, Brain Removal, and Histological Techniques. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Dale, G. E., et al. Relationships between Lewy bodies and pale bodies in Parkinson's disease. Acta Neuropathol. 83, 525-529 (1992).
- Dawson, V. L. Neurobiology of flies and mice. Science. 288, 631-632 (2000).
- Dawson, T., Mandir, A., Lee, M. Animal models of PD: pieces of the same puzzle?. Neuron. 35, 219-222 (2002).
- LeVine, H. Quantification of beta-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274-284 (1999).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Mol Neurodegener. 8, (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved