Method Article
Desenvolvimento de um modelo de rato baseada alfa-sinucleína para a doença de Parkinson por meio de injecção estereotáxica de um vector viral recombinante adeno-associado
Neste Artigo
Resumo
This manuscript describes how viral vector-mediated local gene delivery provides an attractive way to express transgenes in the central nervous system. The protocol outlines all crucial steps to perform a viral vector injection in the substantia nigra of the rat to develop a viral vector-based animal model for Parkinson's disease.
Resumo
A fim de estudar as vias moleculares de doença de Parkinson (DP) e para desenvolver novas estratégias terapêuticas, os investigadores científicos confiar em modelos animais. A identificação dos genes associados com a DP tem levado ao desenvolvimento de modelos genéticos PD. mouse modelos α-SYN mais transgênicas desenvolver gradual patologia α-SYN, mas não conseguem exibir perda de células dopaminérgicas clara e déficits comportamentais dependentes da dopamina. Este obstáculo foi superado pela segmentação direta da substância negra com vetores virais que superexpressam genes associados à DP. a entrega do gene local usando vetores virais fornece uma maneira atraente para expressar transgenes no sistema nervoso central. Regiões específicas do cérebro podem ser alvo (por exemplo, a substância negra), a expressão pode ser induzida na configuração adulto e elevados níveis de expressão pode ser alcançada. Além disso, podem ser utilizados diferentes sistemas de vectores à base de vírus diferentes. O protocolo descreve todos os passos cruciais para realizar um vetor viralinjecção na substantia nigra do rato para desenvolver um modelo animal baseados em vírus vector alfa-sinucleína para a doença de Parkinson.
Introdução
Para estudar a fisiopatologia da DP e para desenvolver novas estratégias terapêuticas, há uma necessidade urgente de modelos animais que se assemelham os sintomas neuropatologia, fisiologia e motores da DP humano. Quanto maior o valor preditivo, melhor podemos traduzir novas terapias de modelos animais para os pacientes.
A descoberta de alfa-sinucleína (α-SYN) como o primeiro gene PARK em 1997, levou ao desenvolvimento dos primeiros modelos PD genéticos. Muitos ratos transgênicos com superexpressão humano de tipo selvagem (WT) ou mutante (A30P, A53T) α-SYN foram gerados ao longo da última década. Os níveis de sobreexpressão α-SYN provaram ser crucial no desenvolvimento da patologia. Além disso, a estirpe de ratinho, a presença ou ausência de endógena α-SYN e se o comprimento completo ou uma forma truncada é expresso, desempenha um papel (revisão detalhada pela magem e Chesselet 1). A sobre-expressão de ambos WT e vários mutantes clínicos de humano &# 945; -SYN em ratinhos transgénicos induz a acumulação patológica de α-SYN e disfunção neuronal 2-6. No entanto, até modelos de rato α-SYN agora a maioria transgênicas não conseguiu exibir perda de células dopaminérgicas clara e déficits comportamentais dependentes da dopamina.
Este obstáculo foi superado pela segmentação direta da substantia nigra (SN) com vetores virais com superexpressão α-SYN. Os vectores virais são derivados a partir de vírus que infectam as células podem facilmente, introduzir material genético no seu genoma hospedeiro e forçar a célula hospedeira para replicar o genoma viral, de modo a produzir novas partículas virais. Os vírus podem ser manipuladas para vectores virais não replicantes que conservam a sua capacidade de entrar nas células e introduzir genes. Por eliminação de partes do genoma viral e substituindo-os pelos genes de interesse, o vector de aplicação vai resultar em uma única infecção rodada sem replicação na célula hospedeira, geralmente designado como "transdução". Os vectores virais cum ser usado tanto para a sobre-expressão e silenciamento do gene. O transgene expressa pode ser uma proteína repórter (por exemplo, proteína verde fluorescente ou luciferase de pirilampo) 7, uma proteína terapêutica para aplicações de terapia genética 8-10 ou, como vamos focar neste trabalho, uma proteína relacionada com a doença usados para modelagem doença 11 -14.
entrega de genes mediada por vectores virais fornece uma forma alternativa de expressar os transgenes no SNC com várias vantagens. Usando entrega transgene local, regiões específicas do cérebro podem ser alvo. Além disso, a expressão do transgene pode ser induzido durante a vida adulta diminuindo o risco de mecanismos de compensação durante o desenvolvimento. Além disso, os modelos podem ser criados em diferentes espécies e estirpes. E, finalmente, diferentes transgenes podem ser facilmente combinados. Utilizando vectores virais, os níveis de expressão elevado do transgene pode ser alcançada, que pode ser crucial uma vez que o aparecimento e gravidade da doença frequentemente depender do nível de OVEREXPression.
Vários sistemas de vectores à base de vírus diferentes foram desenvolvidos. A escolha do sistema de vector depende do tamanho do gene de interesse, a duração necessária da expressão de genes, a célula alvo e questões de biosegurança. Para a transferência de genes estável no cérebro, Lentivirus (LV) e virais adeno-associado recombinante (rAAV) vectores são agora considerados os sistemas de vector de escolha, uma vez que conduzem a expressão do gene eficiente e a longo prazo no cérebro de roedores. Para segmentação específica dos neurônios dopaminérgicos (DN) do SN, vectores de rAAV foram gradualmente outcompeted vetores LV por causa de seus títulos mais elevados e eficiência de transdução de DN.
Os melhores modelos de roedores com base α-SYN disponíveis atualmente foram desenvolvidos a partir de uma abordagem combinada usando sorotipos AAV mais recentes (rAAV 1, 5, 6, 7, 8) e otimizado construções de vector, títulos e pureza 15,16. A título de vector, bem como a pureza do vetor influencia directamenteo resultado fenotípica do modelo. Os títulos de vetor excessivas ou lotes vetor insuficientemente purificadas pode resultar em toxicidade não específica. Portanto, vetores de controlo adequados são indispensáveis. investimento de tempo considerável na produção vetor, upscaling e procedimentos de purificação virais também tem se mostrado essencial para obter lotes vetor reprodutíveis e de alta qualidade.
Protocolo
Todos os experimentos com animais são realizadas em conformidade com a directiva de 24 de Novembro de 1986 (86/609 / CEE) Comunidades Europeias e aprovado pelo Comitê de Bioética da Universidade de Leuven (Bélgica).
1. AAV recombinante Produção e Purificação
Nota: A produção do vector de rAAV e a purificação foi realizada pela Leuven Vector viral núcleo (LVVC) como previamente descrito 17.
- Resumidamente, transfectar subconfluentes baixo (<50) de passagem células HEK 293T aderentes utilizando uma polietilenimina linear 25 kD solução de transfecção 150 nM de NaCl e três plasmídeos diferentes numa proporção de 1: 1: 1 em meio DMEM soro bovino fetal a 2%. Após 24 h de incubação a 37 ° C em 5% de CO 2, substituir o meio com meio fresco de DMEM soro bovino fetal a 2%.
Nota: Os plasmídeos incluem os construtos para o serotipo AAV7, o plasmídeo de transferência de AAV que codifica o mutante humano A53T α-SYN sob o controlo do CMVie reforçada synapsin1 promotor e o pAdvDeltaF6 adenoviral plasmídeo auxiliar 17. - Colher as médias de 5 dias após a transfecção transiente e se concentrar utilizando filtração de fluxo tangencial 17.
- Purifica-se as partículas de vector de rAAV a partir do meio concentrado utilizando um gradiente por passos de 17 iodixanol.
- Utilize as técnicas padrão de PCR em tempo real para a cópia genômica (GC) determinação. Neste protocolo, a título de vector de 3,0 E11 GC / ml foi utilizado para desenvolver um modelo de rato com base α-SYN para PD 17.
2. injecção estereotáxica de α-SYN vector de rAAV no SN do rato (Figura 2)
- Casa oito semanas de idade ratas Wistar pesando cerca de 200-250 g sob 12 h ciclo claro / escuro normal com livre acesso a ração peletizada e água da torneira.
- Submeta o rato para administração intraperitoneal (ip) a anestesia que contém uma mistura de cetamina (60 mg / kg) e medetomidina (0,4 mg / kg). Uma vez que o rato é anestesiado e não reagequando apertando as diferentes patas, subcutaneamente administrar um micro-transponder na parte traseira do rato para reconhecimento ulterior usando um dispositivo de implantação de micro-respondedor. Verificar se o micro-respondedor está posicionada correctamente e pode ser lida pelo dispositivo de leitura.
- Cortar o cabelo no topo do couro cabeludo. Aplicar um anestésico local, tanto o couro cabeludo e as orelhas. Executar o restante do procedimento cirúrgico sob um fluxo laminar utilizando técnicas assépticas.
- Coloque os ratos em um quadro estereotáxico cabeça utilizando duas barras de ouvido, uma boca e um bar nariz. Cobrir o corpo do rato com uma manta de papel a fim de evitar uma queda na temperatura corporal. Aplicar um lubrificante ocular para evitar que os olhos de secagem.
- Desinfectar o couro cabeludo com jodium 1% em isopropanol a 70% e fazer uma pequena incisão na linha média do couro cabeludo. Raspe fora as membranas no crânio e enxaguar com soro fisiológico. Deixe o crânio seco durante vários minutos. Observe as suturas cranianas e os dois pontos de referência: bregma e lambda.
- Para injectar o vector de rAAV para o SN, definir as coordenadas no sentido bregma (anteroposterior: 5,3 milímetros; mediolateral: 2,0 mm e dorso-ventral: 7,2 mm contados a partir da dura-máter).
Nota: As coordenadas tridimensionais para cada região de interesse pode ser calculado usando um atlas estereotáxica do cérebro do rato, aplicando bregma como ponto de referência anatômica. - Encher uma seringa de micro-injecção de 10 ul (30 calibre 20 mm) com o vector de rAAV e colocá-lo no instrumento estereotáxico ligado com uma bomba de micro-injecção motorizada. Controlar o volume, liberando uma gota de vector e eliminar em um detergente de limpeza polivalente pH 9 (por exemplo RBS).
- Visualmente verificar se a cabeça é fixa em linha reta no quadro de cabeça e avaliar o eixo esquerda-direita. Cuidadosamente definir visualmente os ântero-posterior e médio-lateral coordenadas para bregma e lambda e medir a sua altura usando uma agulha de calibre 30 20 milímetros no braço dorsoventral do quadro estereotáxico.
- permitir amaximum de diferença de 0,3 mm de altura entre bregma e lambda. Coloque a agulha de volta no bregma e aplicar o ântero-posterior e coordenadas mediolaterais movendo o ântero-posterior e médio-lateral do braço do quadro estereotáxico.
- No local de injeção, medir a altura do crânio e garantir que ele não difere mais de 0,3 mm a partir da altura da bregma. Perfurar um orifício no crânio com um diâmetro de aproximadamente 2 mm. Medir a altura da dura-máter, isto servirá como uma referência para aplicar o dorsoventral de coordenadas. Alternativamente subtrair uma espessura fixo para o crânio (0,9 mm).
- Penetre a dura-máter, utilizando uma agulha de calibre 26 e absorver o sangue com um tecido estéril. Espere até que todos sangramento parou antes de prosseguir.
- inserir lentamente a microinjecção seringa de 10 mL, pré-carregadas com uma solução de vector no cérebro para a profundidade pré-determinada (dorsoventral de coordenadas). Espere 1 min com a agulha no lugar. Injectar 3 ulde solução de vetor (3,0 E11 genoma cópias / ml (dose vector médio) ou 1,0 E12 GC / ml (dose alta vector) de rAAV2 / 7 α-SYN ou eGFP vector de controlo) utilizando a bomba de microinjecção motorizado com um caudal de 0,25 mL / min.
- Após a injeção, manter a agulha no lugar por mais 5 min antes de removê-lo lentamente. Costurar o couro cabeludo com revestido de poliéster trançado 3.0, desinfectar com 1% jodium em 70% isopropanol e remova cuidadosamente o animal do instrumento estereotáxico. Primeiro solte a barra de nariz e da boca, então as duas barras de ouvido.
- Para reverter a anestesia, injectar o rato por via intraperitoneal com 0,5 mg / kg atipamezol e coloque o rato em uma gaiola limpa em uma placa de aquecimento de 38 ° C até que ele acorda. Cobrir o rato com uma manta de papel, para evitar uma queda na temperatura corporal.
- Proporcionar um acesso fácil a alimentos e água para as primeiras horas. Monitorar o rato para os primeiros dias. Se necessário, aplicar a analgesia.
Nota: Não há necessidade de remover os pontos de tele crânio. Depois de 1-2 semanas, o crânio é completamente reparado e os stiches fique solta.
3. Avaliação da rAAV2 / 7 α-SYN ratos injectados Usando Non-invasive PET Imaging, testes comportamentais e Análise imuno-histoquímica
- Para acompanhar a cinética de neurodegeneração dopaminérgica nigroestriatal não invasiva ao longo do tempo em animais individuais, quantificar transportador de dopamina (DAT) de ligação utilizando pequenos animais tomografia por emissão de positrões (PET) e um marcador da DA Transporter por exemplo [18F] -FECT 16 .
- Para examinar se o nível de neurodegeneração dopaminérgica é suficiente para induzir deficiências motoras nos ratos, submeter os ratos para o teste do cilindro para avaliar o uso forelimb espontânea.
- Coloque o rato em um 20 cm cilindro de vidro e fita de vídeo o comportamento de largura claro durante movimentos verticais ao longo da parede e aterragem depois de um traseiro. Marque o número de contatos feitos por cada pata dianteira para um total de 20contatos. Para uma descrição detalhada dos critérios de pontuação ver Schallert et al. 18 Expresse o número de contatos forelimb prejudicada (por exemplo, das patas dianteiras esquerda) como uma porcentagem do total de contatos forelimb (da esquerda mais pata dianteira direita).
Nota: ratos controle não-lesionados usando as duas patas igualmente devem marcar em torno de 50% neste teste.
- Coloque o rato em um 20 cm cilindro de vidro e fita de vídeo o comportamento de largura claro durante movimentos verticais ao longo da parede e aterragem depois de um traseiro. Marque o número de contatos feitos por cada pata dianteira para um total de 20contatos. Para uma descrição detalhada dos critérios de pontuação ver Schallert et al. 18 Expresse o número de contatos forelimb prejudicada (por exemplo, das patas dianteiras esquerda) como uma porcentagem do total de contatos forelimb (da esquerda mais pata dianteira direita).
- Realizar a análise imuno-histoquímica (IHQ) para avaliar o nível de expressão do transgene e perda de células dopaminérgicas.
- Em diferentes estágios finais, sacrificar os ratos com uma overdose de pentobarbital de sódio (60 mg / kg, ip) e realizar uma perfusão intracardíaca com solução salina fria, seguido por paraformaldeído a 4% em PBS 19. Fixar os cérebros durante a noite a 4 ° C e 50 um corte secções cerebrais coronais de espessura utilizando um micrótomo de vibração.
- Execute coloração IHC em secções de flutuação livre usando anticorpos contra α-SYN e tirosina hidroxilase para analisar os níveis de expressão α-SYN e da level da neurodegeneração 16.
Resultados
O esquema geral da experiência está ilustrada na Figura 1
a sobre-expressão de rAAV 07/02-mediada de A53T α-SYN induz défices motores dependentes de dopamina.
Para examinar se o nível de α-SYN superexpressão é suficiente para induzir deficiências motoras nos ratos, que submeteram os ratos ao teste do cilindro para avaliar o uso forelimb espontânea (Figura 3A). A partir de 3 semanas após a injecção, uma deficiência motora significativa foi observada em ratos que receberam uma dose de 3.0 E11 GC / ml de α-SYN A53T rAAV2 / 7 vetor. Ao fim de 4 semanas após a injecção foi observada uma diminuição de 50% no contralateral (esquerda) utilização pata dianteira espontânea, enquanto que o controlo eGFP rAAV2 / 7 injectado animais não apresentavam qualquer assimetria na utilização das patas dianteiras (Figura 3B). Os ratos que receberam uma rAAV2 / 7 dose de vector maior A53T α-SYN mostrou um impairm mais pronunciadaent de utilização das patas dianteiras (70%) aos 29 dias após a injecção (Figura 3C). Para provar que a deficiência motora observada era dependente de dopamina, administrou-se uma única dose de L-DOPA (6 mg / kg, ip) aos ratos injectados com uma dose elevada do vetor. Quando se repetiu o teste de cilindro 45 min após o tratamento com L-DOPA, uma recuperação completa da pata uso no A53T α-SYN rAAV2 / 7 animais injectados foi observado (Figura 3C).
Imagiologia de PET permite imagem não invasiva de α-SYN induzida neurodegeneração progressiva.
Para acompanhar a cinética de neurodegeneração dopaminérgica nigroestriatal não invasiva ao longo do tempo em animais individuais, quantificamos transportador de dopamina (DAT) de ligação utilizando pequenos animais tomografia por emissão de positrões (PET) com [18F] -FECT como radioligando. DAT ligação diminuiu significativamente nos ipsilaterais caudado-putâmen de A53T α-SYN rAAV2 / 7 INJECratos ted ao longo do tempo, mas manteve-se estável no animal controle eGFP (Figura 4A - 4B). Quantificação de ligação DAT de A53T α-SYN rAAV2 / 7 injetado animais apresentaram uma taxa máxima de degeneração dopaminérgica nigroestriatal entre os dias 7 e 21 após a injecção. Após 32 dias, uma diminuição na ligação de DAT-se a 85% foi observado (Figura 4C). Como controlo positivo, a injecção da neurotoxina 6-OHDA na SN induzida perda de 90% da ligação de DAT no prazo de 7 dias (Figura 4B - 4C).
Injecção estereotáxica de rAAV2 / 7 A53T α-SYN no SN do rato induz a morte das células dopaminérgicas nigral e formação de agregados insolúveis α-SYN positivos.
Para analisar o nível de perda de células superexpressão e dopaminérgico α-SYN sacrificamos os animais em momentos diferentes. IHC foi realizada em secções de flutuação livre usando um anticorpo against α-sinucleina (anticorpo policlonal de coelho 1: 5000). α-sinucleína Este anticorpo pode detectar tanto humanos e de rato, mas os níveis endógenos de rato α-sinucleína foram abaixo do limite de detecção no âmbito somata célula nigral, devido à sua localização predominante na membrana sináptica. Para a perda de células jumentos foi utilizado um anticorpo contra TH (coelho policlonal 1: 1.000).
Quatro dias após a injecção do vector de rAAV, α-SYN ou expressão EGFP foi detectada no SN (Figura 5A - 5C) dos ratos. A maioria (> 90%) do DN foi eficientemente transduzidas e ambas as proteínas transgénicas estavam localizados nos corpos celulares e axónios. No dia 29 foi observada após a injecção (pi) uma redução substancial na expressão α-syn em SNPC, ao mesmo tempo que ainda era detectável em áreas que rodeiam o SN (Figura 5B - 5C). Em seguida, analisamos o nível de perda de células nigral. A rápida e progressiva perda de of até 80% de neurónios TH-positivas foi detectada ao longo de 29 dias em ratos injectados com A53T α-SYN rAAV2 / 7 (Figura 5D - 5H). De nota, a sobre-expressão do tipo selvagem, em vez de A53T α-SYN resultou na neurodegeneração dopaminérgica semelhante (dados não mostrados). A perda do DN no SN foi acompanhada por uma diminuição robusta de terminais nervosos TH-positivos no corpo estriado (STR) (Figura 5F). Para excluir efeitos específicos de lote vector, preparações de vector α-SYN diferentes foram testados no SN com resultados semelhantes. Nenhuma redução na coloração de TH foi observada no SN ou STR de eGFP rAAV2 / 7 injectado os animais de controlo (Figura 5E-5H). Em seguida a neurodegeneração dopaminérgica, a presença de α-sinucleinopatia é uma segunda característica importante da DP. Apesar do curso de tempo curto do nosso modelo (quatro semanas), observou-se ambos os agregados citoplasmáticos α-SYN-positivas no SN e as neurites distróficas na STR (figura 5I ong>). Imunorreactividade ubiquitina é uma característica distinta de Lewy patologia do corpo no cérebro humano 20-22. Observou-se a co-localização de α-SYN e ubiquitina aos 29 dias pi em uma fracção de (± 20%) do α-SYN expressando neurónios da substância negra (Figura 5J). A natureza dos agregados fibrilares α-SYN foi avaliada por Tioflavina S (Thio S) 23 coloração. S tio células positivas foram detectadas no SN a partir de 17 dias em diante (Figura 5J).
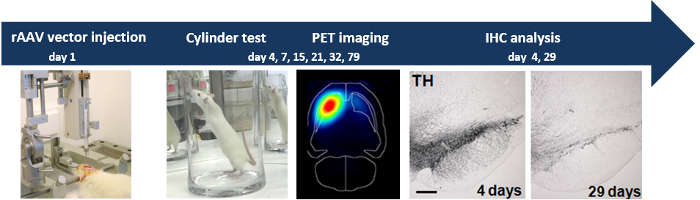
Figura 1:. Injecção estereotáxica de rAAV2 / 7 α-SYN vector resulta na neurodegeneração progressiva injecção estereotáxica de rAAV2 / 7 α-SYN vetor na SN do rato induz neurodegeneração dopaminérgica medido através de análise de comportamento (teste do cilindro), PET não-invasivo imagiologia e análise IHC.d 53670 / 53670fig1large.jpg "target =" / _ blank "> Clique aqui para ver uma versão maior desta figura.

Figura 2: injecção estereotáxica de rAAV2 / 7 vector que codifica α-SYN no SN do rato. (A, B, E) As suturas cranianas no crânio de ratos, que definem os dois pontos de referência: bregma e lambda. (C) um atlas estereotáxica de cérebro de rato que apresenta a região da injecção isto é, a SN. (D) Um rato Wistar posicionado em um quadro estereotáxico cabeça usando duas barras de ouvido, uma boca e um bar nariz. (F) A agulha de calibre 30 preenchido com o vector está colocado na posição para a substantia nigra. (G) Um pequeno conjunto é perfurado no local de injecção e a agulha é colocada em posição. (H) Após a injeção do couro cabeludo é stitched e desinfectados. Por favor clique aqui para ver uma versão maior desta figura.
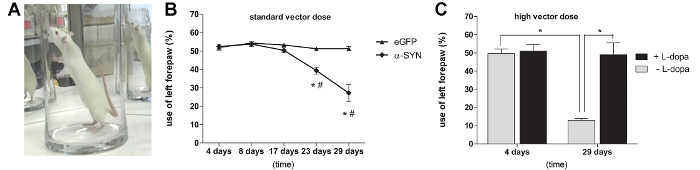
Figura 3: a sobre-expressão de rAAV 07/02-mediada de A53T α-SYN induz défices motores dependentes de dopamina (A, B) Cilindro de teste em diferentes pontos de tempo após a injecção de rAAV2 / 7 α-SYN A53T.. (Média ± sd, * p <0,05 em comparação com 17 dias, # p <0,05 controles eGFP por análise de variância e teste de Tukey post hoc, n = 5). (C) Ensaio de cilindro em diferentes pontos de tempo após a injecção de rAAV2 / 7 α-SYN A53T (dose alta) do vetor. (Média ± sd, * p <0,05 4 dias versus 29 dias por ANOVA e teste de Tukey post hoc teste, n = 5). O teste foi realizado com ou sem a administração de levodopa (L-DOPA). (Média ± sd, * p <0.05 não-tratado versus animais tratados por análise de variância e teste de Tukey post hoc, n = 5). Reproduzido de Neurobiology of Aging, Vol. 36, Van der Perren et al., O acompanhamento longitudinal e caracterização de um modelo de rato robusta para a doença de Parkinson baseado na sobre-expressão de alfa-sinucleína com vectores virais adeno-associados, 1543-1558, (2015), com a permissão da Elsevier. por favor clique aqui para ver uma versão maior desta figura.

Figura 4:. Imagiologia não invasiva de A53T α-SYN morte celular dopaminérgica induzida usando DAT PET de imagem (A - B) Série de fatias horizontais e coronal que descrevem a ligação média estriado DAT de (A) rAAV2 / 7 A53T α-SYN injetado animais a diferent pontos de tempo após a injecção (n = 7) e (B) rAAV2 / 7 eGFP injectados (n = 1) ou 6-OHDA animais de controlo tratados (n = 1) 79 dias após a injecção. barras coloridas indicam potenciais de ligação para o DAT. (C) A quantificação da ligação de DAT rAAV2 / 7 A53T α-SYN, rAAV2 / 7 eGFP e 6-OHDA injectados animais medidos em diferentes pontos de tempo (dados representam a média ± SD). Reproduzido de Neurobiology of Aging, Vol. 36, Van der Perren et al., O acompanhamento longitudinal e caracterização de um modelo de rato robusta para a doença de Parkinson baseado na sobre-expressão de alfa-sinucleína com vectores virais adeno-associados, 1543-1558, (2015), com a permissão da Elsevier. por favor clique aqui para ver uma versão maior desta figura.
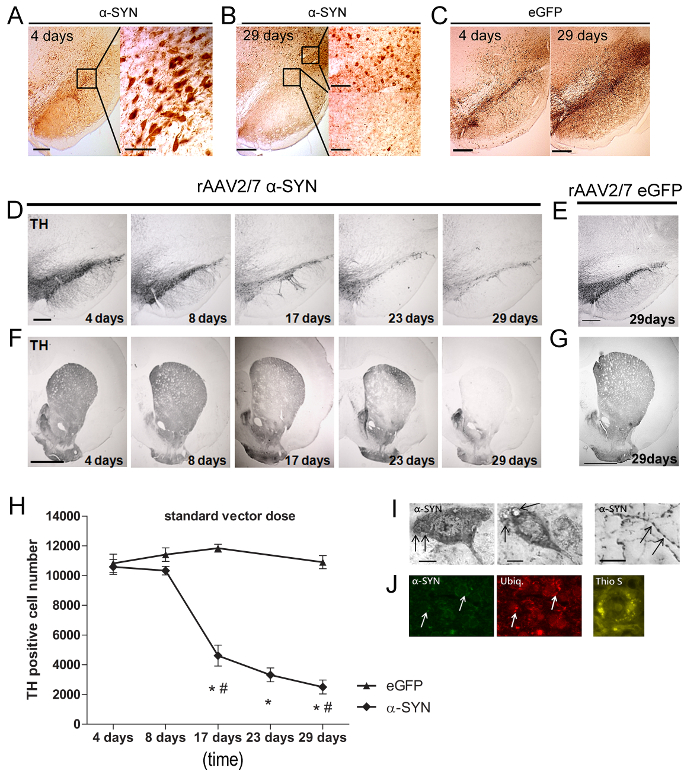
Figura 5: rAAV 2/7 mediada por sobre-expressão de A53T α-SYN induz a morte das células dopaminérgicas e formação de insolúveis agregados α-SYN positivos. (A - B) coloração IHC demonstrando α-SYN superexpressão 4 dias e 29 dias após a transferência de rAAV mediada em SN rato. Inserções mostram ampliações da área selecionada. Barra de escala = 400 mm (visão geral imagem à esquerda), 70 um e 200 um (inserções direita). (C) IHC coloração demonstrando eGFP superexpressão 4 dias e 29 dias após a transferência rAAV mediada em SN rato. Barra de escala = 400 pm. (D - L) coloração IHC para TH no SN e STR em diferentes pontos de tempo após a injecção de (D, F) rAAV2 / 7 α-SYN ou 29 dias após a injecção de (E, G) rAAV2 / 7 eGFP no SN . Barra de escala a, c = 400 mm, b, d = 1,000 uM. (H) quantificação estereológica do dormenteer de neurónios TH-positivas no SN ao longo do tempo após a injeção rAAV2 / 7 A53T α-SYN ou rAAV2 / 7 eGFP vetor de controle (média ± sd, * p <0,05 versus 8 dias, a # p <0,05 versus controlos eGFP por análise de variância e teste post hoc de Tukey, n = 5). (I) IHC coloração demonstrando α-SYN patologia, incluindo agregados citoplasmáticos no SN e distrófica e neurites abaulamento no STR, depois de intranigral injecção rAAV2 / 7 A53T α-SYN. (J) imagens confocais representativos de imunomarcações duplos fluorescentes para α-SYN (verde) e de ubiquitina (vermelho) mostram um aumento na co-localização com o tempo (setas). Barra de escala = C 50 | im. Tioflavina S coloração de SN 29 dias após a injecção de rAAV2 / 7 A53T α-SYN. Barra de escala D = 30 mm. Reproduzido de Neurobiology of Aging, Vol. 36, Van der Perren et al., O acompanhamento longitudinal e caracterização de um modelo de rato robusta para a doença de Parkinson baseado na sobre-expressão de alfa-sinucleína com anúncioeno-associado vectores virais, 1543-1558, (2015), com a permissão da Elsevier. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Há vários passos críticos no âmbito do protocolo. A título de vector, bem como a pureza do vetor influencia directamente o resultado fenotípica do modelo. Os títulos de vetor excessivas ou lotes vetor insuficientemente purificadas pode resultar em toxicidade não específica. Portanto, o uso de lotes de vectores de alta qualidade e vectores de controlo apropriados é indispensável. Além disso, o posicionamento exacto da cabeça do rato na moldura estereotáxica e a determinação precisa das coordenadas é essencial no direccionamento da substantia nigra. Após a perfuração do orifício no crânio no local da injecção, é importante para inserir a agulha directamente no cérebro do rato, sem tocar em quaisquer margens. A agulha deve ser removido lentamente após a injecção do vector viral, para evitar fugas do vetor. Por último, após a costura, o couro cabeludo deve ser desinfectado com 1% jodium em isopropanol a 70% para evitar morder dos stiches por outros animais. Alternativamente outros reagentes anti-sépticaspode ser usado.
O método descrito pode também ser usado para desenvolver um α-SYN modelo de ratos com base rAAV2 / 7 para a doença de Parkinson 24. Em ratos que injetar um volume de 2 mL rAAV vetor na SN. Em comparação com ratos, ratinhos DN parecem ser um pouco menos sensível a ácido a-SYN sobre-expressão, resultando numa manifestação retardada de neurodegeneração. Além disso, outras regiões do cérebro (por exemplo, corpo estriado, hipocampo, córtex, etc.) pode ser alvejado. As coordenadas para as diferentes regiões do cérebro pode ser encontrado no atlas estereotáxicas. Optimização das coordenadas pode ser realizado por a tinta da China ou através da utilização de um vector virai que codifica um gene repórter (por exemplo EGFP). Diferentes sistemas de vetores (rAAV, LV, etc.) podem ser usados, dependendo da aplicação.
Esta técnica tem a limitação de que cada animal tem que ser injectados individualmente. Por conseguinte, uma pessoa treinada deve executar as injecções, a fim de mínimize variações entre diferentes animais. Outra limitação é que o método é demorado (quando executadas por uma pessoa treinada que leva cerca de 45 minutos por animal). Apenas oito a dez animais podem ser injectados em um dia.
entrega de genes virais mediada por vector permite a orientação mais precisa das regiões cerebrais. Utilizando vectores virais, os níveis de expressão elevado do transgene pode ser alcançado, o que é crucial uma vez que o início da doença e da gravidade depende do nível de expressão α-SYN. Além disso, diferentes doses pode ser aplicada, o que vai resultar num modelo animal exibindo cinética mais lenta ou mais rápida de neurodegeneração. Por último, esta técnica pode ser utilizada para criar modelos animais de diferentes espécies e estirpes que utilizam a mesma preparação de vector.
Este procedimento pode ser utilizado para entregar os vectores virais, bem como toxinas (por exemplo, 6-OHDA) em diferentes regiões do transgene brain.The codificado pelo vector pode ser uma proteína repórter, um p terapêuticorotein para aplicações de terapia génica 8-10 ou de uma proteína relacionada com a doença usado para modelar doenças 11-14. Esta técnica pode ser usada para desenvolver novos modelos animais que permitem para testes pré-clínicos de drogas e podem ser benéficos em estudar o mecanismo molecular da doença de Parkinson, assim como muitos outros distúrbios neurodegenerativos.
Divulgações
Os autores declaram que não há conflito real ou potencial de interesse.
Agradecimentos
Os autores agradecem Joris van Asselberghs e Ann Van Santvoort por sua excelente assistência técnica. A pesquisa foi financiada pelo IWT-Vlaanderen (IWT SBO / 80020), a FWO Vlaanderen (G.0768.10), pelo programa CE-FP6 'Dimi' (LSHB-CT-2005-512146), o projeto MEFOPA FP7 RTD (SAÚDE -2.009-241.791), o programa FP7 'inmind' (HEALTH-F2-2011-278850), a KU Leuven (IOF-KP / 07/001, OT / 08 / 052A, Imir PF / 10/017), ea Fundação MJFox (validação Meta 2010). A. Van der Perren e C. Casteels estão pós-bolseiros do Fundo Flamengo de Investigação Científica. K. Van Laere é um companheiro clínico sênior do Fundo Flamengo de Investigação Científica.
Materiais
| Name | Company | Catalog Number | Comments |
| Female 8 weeks old Wistar rats | Janvier | / | 200-250 g |
| Ketamine (Nimatek) | Eurovet animal health | 804132 | |
| Medetomidine (Dormitor) | Orion-Pharma/ Janssen Animal Health | 1070-499 | |
| Local anesthetic for scalp and ears: Xylocaïne 2% gel | Astrazeneca | 0137-547 | |
| Terramycine | Pfizer | 0132-472 | |
| Buprénorphine (Vetergesic) | Ecuphar | 2623-627 | |
| Jodium 1% isopropanol | VWR | 0484-0100 | |
| stereotactic head frame | Stoeling | / | |
| Hamilton Syringe (30 gauge -20 mm -pst 2) | Hamilton/ Filter Service | 7803-07 | |
| atipamezole (Antisedan) | Orion-Pharma/Elanco | 1300-185 | |
| rAAV A53T α-SYN vector | LVVC, KU Leuven | / | https://gbiomed.kuleuven.be/english/research/50000715/laboratory-of-molecular-virology-and-gene-therapy/lvvc/ |
| sodium pentobarbital (Nembutal) | Ceva Santé | 0059-444 | |
| microtome | Microm | HM650 | |
| rabbit polyclonal synuclein Ab | Chemicon | 5038 | 1:5,000 |
| rabbit polyclonal TH Ab | Chemicon | 152 | 1:1,000 |
| Lutetium oxyorthosilicate detector-based FOCUS 220 tomograph | Siemens/ Concorde Microsystems | / | |
| radioligand: 18F-FECT | In house | / | |
| L-dopa: Prolopa 125 | Roche | 6 mg/kg i.p. | |
| DMEM, Glutamax | Life Technologies | N° 31331-093 | |
| Foetal bovine serum | Life Technologies | N° 10270-106 | |
| 25 kD linear polyethylenimine (PEI) | Polysciences | / | |
| OptiPrep Density Gradient Medium: Iodixanol | Sigma | D1556-250ML | |
| Optimen | Life Technologies | N° 51985-026 | |
| Paxinos 1 watston steretactic atlas, fourth Edition | Elsevier | / |
Referências
- Magen, I., Chesselet, M. F. Genetic mouse models of Parkinson's disease The state of the art. Prog Brain Res. 183, 53-87 (2010).
- Masliah, E., et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders. Science. 287, 1265-1269 (2000).
- Freichel, C., et al. Age-dependent cognitive decline and amygdala pathology in alpha-synuclein transgenic mice. Neurobiol Aging. 28, 1421-1435 (2007).
- Fleming, S. M., Fernagut, P. O., Chesselet, M. F. Genetic mouse models of parkinsonism: strengths and limitations. NeuroRx. 2, 495-503 (2005).
- Kahle, P. J., et al. Selective insolubility of alpha-synuclein in human Lewy body diseases is recapitulated in a transgenic mouse model. Am J Pathol. 159, 2215-2225 (2001).
- Chesselet, M. F., Richter, F. Modelling of Parkinson's disease in mice. Lancet Neurol. 10, 1108-1118 (2011).
- Deroose, C. M., Reumers, V., Debyser, Z., Baekelandt, V. Seeing genes at work in the living brain with non-invasive molecular imaging. Curr Gene Ther. 9, 212-238 (2009).
- Manfredsson, F. P., et al. rAAV-mediated nigral human parkin over-expression partially ameliorates motor deficits via enhanced dopamine neurotransmission in a rat model of Parkinson's disease. Exp Neurol. 207, 289-301 (2007).
- Vercammen, L., et al. Parkin protects against neurotoxicity in the 6-hydroxydopamine rat model for Parkinson's disease. Mol Ther. 14, 716-723 (2006).
- Winklhofer, K. F. The parkin protein as a therapeutic target in Parkinson's disease. Expert opinion on therapeutic targets. 11, 1543-1552 (2007).
- Kirik, D., et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci. 22, 2780-2791 (2002).
- Kirik, D., et al. Nigrostriatal alpha-synucleinopathy induced by viral vector-mediated overexpression of human alpha-synuclein: a new primate model of Parkinson's disease. Proc Natl Acad Sci U S A. 100, 2884-2889 (2003).
- Lauwers, E., et al. Neuropathology and neurodegeneration in rodent brain induced by lentiviral vector-mediated overexpression of alpha-synuclein. Brain pathology. 13, 364-372 (2003).
- Klein, R. L., King, M. A., Hamby, M. E., Meyer, E. M. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther. 13, 605-612 (2002).
- Vander Perren, A., Van den Haute, C., Baekelandt, V. Viral Vector-Based Models of Parkinson's Disease. Curr Top Beh Neurosci. , (2014).
- Van der Perren, A., et al. Longitudinal follow-up and characterization of a robust rat model for Parkinson's disease based on overexpression of alpha-synuclein with adeno-associated viral vectors. Neurobiol Aging. , (2014).
- Van der Perren, A., et al. Efficient and stable transduction of dopaminergic neurons in rat substantia nigra by rAAV 2/1, 2/2, 2/5, 2/6.2, 2/7, 2/8 and 2/9. Gene Ther. , (2011).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Soueid, J., Nokkari, A., Makoukji, J. Techniques and Methods of Animal Brain Surgery: Perfusion, Brain Removal, and Histological Techniques. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Dale, G. E., et al. Relationships between Lewy bodies and pale bodies in Parkinson's disease. Acta Neuropathol. 83, 525-529 (1992).
- Dawson, V. L. Neurobiology of flies and mice. Science. 288, 631-632 (2000).
- Dawson, T., Mandir, A., Lee, M. Animal models of PD: pieces of the same puzzle?. Neuron. 35, 219-222 (2002).
- LeVine, H. Quantification of beta-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274-284 (1999).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Mol Neurodegener. 8, (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados