Method Article
Élaboration d'un modèle de rat à base alpha-synucléine pour la maladie de Parkinson par injection stéréotaxique d'un vecteur viral adéno-associé recombinant
Dans cet article
Résumé
This manuscript describes how viral vector-mediated local gene delivery provides an attractive way to express transgenes in the central nervous system. The protocol outlines all crucial steps to perform a viral vector injection in the substantia nigra of the rat to develop a viral vector-based animal model for Parkinson's disease.
Résumé
Afin d'étudier les voies moléculaires de la maladie de Parkinson (PD) et de développer de nouvelles stratégies thérapeutiques, les chercheurs scientifiques reposent sur des modèles animaux. L'identification des gènes PD-associé a conduit à l'élaboration de modèles PD génétiques. La plupart des modèles transgéniques de souris α-SYN développer progressivement la pathologie α-SYN, mais ne parviennent pas à afficher une perte de cellules dopaminergiques claire et des déficits comportementaux dopamine-dépendante. Cet obstacle a été surmonté par le ciblage direct de la substantia nigra avec des vecteurs viraux surexprimant les gènes PD-associés. la livraison de gènes local en utilisant des vecteurs viraux fournit un moyen attrayant pour exprimer des transgènes dans le système nerveux central. Des régions cérébrales spécifiques peuvent être ciblés (par exemple , le locus niger), l' expression peut être induite dans le cadre des adultes et des niveaux d'expression élevés peuvent être atteints. En outre, des systèmes de vecteurs différents en fonction de différents virus peuvent être utilisés. Le protocole décrit toutes les étapes cruciales pour effectuer un vecteur virall'injection dans la substance noire de rat pour développer un modèle animal vecteur viral à base d'alpha-synucléine dans la maladie de Parkinson.
Introduction
Pour étudier la physiopathologie de PD et de développer de nouvelles stratégies thérapeutiques, il y a un besoin urgent de modèles animaux qui ressemblent étroitement les symptômes neuropathologie, physiologie et moteur de PD humaine. La valeur prédictive plus élevée, mieux nous pouvons traduire de nouvelles thérapies de modèles animaux pour les patients.
La découverte de l'alpha-synucléine (α-SYN) comme premier gène PARK en 1997 a conduit au développement des premiers modèles pharmacodynamiques génétiques. Beaucoup de souris transgéniques surexprimant humain de type sauvage (WT) ou mutant (A30P, A53T) α-SYN ont été générés au cours de la dernière décennie. Les niveaux d'α-SYN surexpression se sont révélés être crucial dans le développement de la pathologie. Aussi la souche de souris, la présence ou l' absence de endogène α-SYN et si la longueur totale ou une forme tronquée est exprimée, joue un rôle (examen détaillé par Magen et Chesselet 1). La surexpression à la fois de type sauvage et des mutants de plusieurs cliniques humains et# 945; SYN chez des souris transgéniques induit l' accumulation pathologique de α-SYN et un dysfonctionnement neuronal 2-6. Cependant, jusqu'à ce que les modèles les plus maintenant transgéniques de souris α-SYN échoué à afficher une perte de cellules dopaminergiques claire et des déficits comportementaux dopamine-dépendante.
Cet obstacle a été surmonté par le ciblage direct de la substantia nigra (SN) avec des vecteurs viraux surexprimant α-SYN. Les vecteurs viraux sont dérivés de virus qui peuvent infecter des cellules facilement, d'introduire du matériel génétique dans leur génome hôte et la force de la cellule hôte de répliquer le génome viral afin de produire de nouvelles particules virales. Les virus peuvent être modifiés pour des vecteurs non répliquants viraux qui conservent leur capacité à pénétrer dans les cellules et introduire des gènes. En supprimant des parties du génome viral et de les remplacer par des gènes d'intérêt, l'application du vecteur résultera en une seule infection ronde sans se répliquer dans la cellule hôte, désigné comme «transduction». vecteurs viraux cun être utilisé pour les deux surexpression et le silençage génique. Le transgène exprimé peut être une protéine rapporteur (par exemple des protéines vert fluorescent ou la luciférase de luciole) 7, une protéine thérapeutique pour des applications de thérapie génique 8-10 ou, comme nous allons nous concentrer dans ce papier, une protéine liée à la maladie utilisé pour la modélisation de la maladie 11 -14.
la livraison de gènes médiée par un vecteur viral constitue un autre moyen d'exprimer des transgènes dans le SNC avec plusieurs avantages. Utilisation de la prestation de transgène locale, des régions cérébrales spécifiques peuvent être ciblés. En outre, l'expression du transgène peut être induite à l'âge adulte pour diminuer le risque de mécanismes de compensation au cours du développement. En outre, les modèles peuvent être créés en différentes espèces et souches. Et enfin, les différents transgènes peuvent facilement être combinés. En utilisant des vecteurs viraux, des niveaux élevés d'expression du transgène peut être atteint, ce qui peut être crucial puisque l'apparition et la gravité de la maladie dépendent souvent du niveau de OVEREXPression.
Plusieurs systèmes de vecteurs à base de virus ont été développés. Le choix du système de vecteur dépend de la taille du gène d'intérêt, la durée requise de l'expression génique, la cellule cible et des problèmes de biosécurité. Pour un transfert de gène stable dans le cerveau, lentivirus (LV) et du virus adéno-associé recombinant (rAAV) des vecteurs sont maintenant considérés comme des systèmes de vecteurs de choix car ils conduisent à une expression de gène efficace et à long terme dans le cerveau des rongeurs. Pour le ciblage spécifique des neurones dopaminergiques (DN) de la SN, vecteurs rAAV ont progressivement surpassés vecteurs LV en raison de leurs titres plus élevés et l'efficacité de transduction de DN.
Les modèles de rongeurs à base meilleures α-SYN actuellement disponibles ont été élaborées à partir d' une approche combinée en utilisant les nouveaux sérotypes d'AAV (rAAV 1, 5, 6, 7, 8) et optimisé des constructions de vecteur, des titres, et la pureté 15,16. Le titre du vecteur, ainsi que la pureté du vecteur influence directementle résultat phénotypique du modèle. Les titres de vecteur excessifs ou lots de vecteurs insuffisamment purifiés peuvent entraîner une toxicité non spécifique. Par conséquent, les vecteurs de contrôle appropriés sont indispensables. investissement de temps considérable dans la production de vecteur, upscaling, et les procédures de purification virale ont également révélé essentiel pour obtenir des lots de vecteurs reproductibles et de qualité.
Protocole
Toutes les expériences sur les animaux sont effectuées conformément aux Communautés européennes Directive du Conseil du 24 Novembre 1986 (86/609 / CEE) et approuvés par le Comité de bioéthique de l'Université de Louvain (Belgique).
1. AAV recombinant Production et purification
Remarque: la production du vecteur rAAV et la purification a été effectuée par le Leuven vecteur viral de base (LVVC) comme décrit précédemment 17.
- En bref, transfecter subconfluent faible (<50), le passage des cellules HEK 293T adhérentes au moyen d'un 25kD linéaire polyéthylènimine 150 de solution de transfection nM de NaCl et trois plasmides différents dans un rapport de 1: 1: 1 dans du milieu DMEM 2% de sérum bovin foetal. Après 24 heures d'incubation à 37 ° C dans 5% de CO 2, remplacer le milieu par du milieu DMEM frais 2% de sérum de fœtus bovin.
Nota: Les plasmides comprennent les produits d'assemblage pour le sérotype VAA7, le plasmide de transfert de l'AAV codant pour le mutant A53T humain α SYN sous le contrôle de l'CMVIE renforcée synapspromoteur in1 et pAdvDeltaF6 adénoviral plasmide auxiliaire 17. - Récolter les 5 moyennes jours après transfection transitoire et on concentre en utilisant une filtration à flux tangentiel 17.
- Purifier le vecteur rAAV particules du milieu concentré en utilisant un iodixanol étape gradient 17.
- Utilisez des techniques standard de PCR en temps réel pour la copie génomique (GC) détermination. Dans ce protocole, un titre de vecteur de 3,0 E11 GC / ml a été utilisée pour développer un modèle de rat en fonction α-SYN pour PD 17.
2. Injection stéréotactique de rAAV α-SYN dans le vecteur SN du rat (figure 2)
- Maison huit semaines vieux rats Wistar femelles pesant environ 200-250 g sous 12 h cycle lumière / obscurité normale avec un accès libre à la nourriture et à granulés l'eau du robinet.
- Soumettre le rat par voie intrapéritonéale (ip) une anesthésie contenant un mélange de kétamine (60 mg / kg) et de médétomidine (0,4 mg / kg). Une fois que le rat est anesthésié et ne réagit pasquand serrant les différentes pattes, administrer une voie sous-cutanée micro-transpondeur sur le dos du rat pour une reconnaissance supplémentaire en utilisant un implanteur micro-transpondeur. Vérifiez si le micro-transpondeur est positionné correctement et peut être lu par le dispositif de lecture.
- Couper les cheveux sur le dessus du cuir chevelu. Appliquer un anesthésique local à la fois sur le cuir chevelu et les oreilles. Effectuer le reste de la procédure chirurgicale sous un flux laminaire en utilisant des techniques aseptiques.
- Placez les rats dans un cadre de tête stéréotaxique utilisant deux barres d'oreilles, une bouche et une barre de nez. Recouvrir le corps du rat avec une couverture en papier pour éviter une baisse de la température corporelle. Appliquer un lubrifiant oculaire pour empêcher les yeux de sécher.
- Désinfecter le cuir chevelu avec jodium 1% dans de l'isopropanol 70% et faire une petite incision sur la ligne médiane du cuir chevelu. racler délicatement pour enlever les membranes sur le crâne et rincer avec une solution saline. Laissez le crâne sec pendant plusieurs minutes. Observer les sutures crâniennes et les deux points de référence: bregma et Lambda.
- Pour injecter le vecteur rAAV dans le SN, définir les coordonnées vers bregma (antéropostérieur: 5,3 mm; mediolateral: 2,0 mm et dorso-ventral: 7,2 mm calculées à partir de la dure-mère).
Remarque: Les coordonnées tridimensionnelles pour chaque région d'intérêt peuvent être calculées à l'aide d'un atlas stéréotaxiques du cerveau de rat, en appliquant Bregma comme point de référence anatomique. - Remplir une seringue de microinjection 10 ul (30 gauge 20 mm) avec un vecteur de rAAV et le placer dans l'instrument stéréotaxique relié à une pompe à micro-injection motorisée. Contrôlez le volume en libérant une goutte de vecteur et d' éliminer dans un détergent de nettoyage polyvalent pH 9 (par exemple RBS).
- vérifier visuellement si la tête est fixée directement dans le cadre de la tête et d'évaluer l'axe gauche-droite. Soigneusement définir visuellement les coordonnées antéropostérieur et médio pour bregma et Lambda et mesurer leur hauteur à l'aide d'une aiguille de calibre 30 à 20 mm dans le bras dorso-ventral du cadre stéréotaxique.
- Autoriser amaximum de 0,3 mm de différence de hauteur entre bregma et Lambda. Placez l'aiguille sur bregma et appliquer la face et coordonnées médio en déplaçant le antéropostérieur et le bras mediolateral du cadre stéréotaxique.
- A l'endroit de l'injection, mesurer la hauteur du crâne et veiller à ce qu'elle ne diffère pas de plus de 0,3 mm de la hauteur du bregma. Percer un trou dans le crâne avec un diamètre d'environ 2 mm. Mesurer la hauteur de la dure, cela va servir de référence pour appliquer la dorso-ventral de coordonnées. Vous pouvez soustraire une épaisseur fixe pour le crâne (0,9 mm).
- Pénétrer la dure en utilisant une aiguille de calibre 26 et d'absorber le sang avec un tissu stérile. Attendre jusqu'à ce que tout saignement a cessé avant de poursuivre.
- Insérez lentement la microinjection seringue de 10 ul pré-chargé avec une solution de vecteur dans le cerveau à la profondeur prédéterminée (dorso-ventral de coordonnées). Attendre 1 min avec l'aiguille en place. Injecter 3 pide la solution de vecteur (3,0 E11 génome copies / ml (dose de vecteur moyen) ou 1,0 E12 GC / ml (dose élevée de vecteur) de rAAV2 / 7 α-SYN ou eGFP vecteur de contrôle) en utilisant la pompe de microinjection motorisé avec un débit de 0,25 ul / min.
- Après l'injection, maintenir l'aiguille en place pendant 5 min avant de le retirer lentement. Piquez le cuir chevelu en utilisant enduit polyester tressé 3.0, désinfecter avec 1% jodium dans 70% d'isopropanol et retirez délicatement l'animal de l'instrument stéréotaxique. Tout d'abord desserrer la barre de nez et la bouche, puis les deux barres d'oreilles.
- Pour inverser l'anesthésie, injecter le rat par voie intrapéritonéale avec 0,5 mg / kg atipamezole et placer le rat dans une cage propre sur une plaque de chauffage de 38 ° C jusqu'à ce qu'il se réveille. Couvrir le rat avec une couverture en papier pour empêcher une chute de la température corporelle.
- Fournir un accès facile à la nourriture et de l'eau pendant les premières heures. Surveiller le rat pendant les premiers jours. Si nécessaire, appliquer une analgésie.
Remarque: Il n'y a pas besoin d'enlever les points de suture de til crâne. Après 1-2 semaines, le crâne est complètement réparé et les stiches se détacher.
3. Évaluation des rAAV2 / 7 α-SYN Rats injecté à l'aide non-invasive PET Imaging, Tests du comportement et de l'analyse immunohistochimique
- Pour faire suite à la cinétique de dopaminergique nigro neurodégénérescence effractive non au fil du temps chez les animaux individuels, quantifier transporteur de la dopamine (DAT) de liaison utilisant la tomographie petits animaux tomographie par émission (PET) et un traceur de DA Transporter par exemple [18 F] -Fect 16 .
- Pour examiner si le niveau de dopaminergique neurodégénérescence est suffisante pour induire une déficience motrice chez les rats, les rats soumettre à l'épreuve de la bouteille pour évaluer l'utilisation de forelimb spontanée.
- Placez le rat dans une largeur de 20 cm clair cylindre de verre et de filmer le comportement lors des mouvements verticaux le long du mur et à l'atterrissage après une arrière. Note le nombre de contacts établis par chaque patte pour un total de 20Contacts. Pour une description détaillée des critères de notation voir Schallert et al. 18 exprimer le nombre de contacts forelimb avec facultés affaiblies (par exemple des pattes avant gauche) en pourcentage de contacts de forelimb totaux ( de gauche , plus forepaw droite).
Remarque: les rats témoins non lésés à l'aide de deux pattes aussi devraient marquer environ 50% dans ce test.
- Placez le rat dans une largeur de 20 cm clair cylindre de verre et de filmer le comportement lors des mouvements verticaux le long du mur et à l'atterrissage après une arrière. Note le nombre de contacts établis par chaque patte pour un total de 20Contacts. Pour une description détaillée des critères de notation voir Schallert et al. 18 exprimer le nombre de contacts forelimb avec facultés affaiblies (par exemple des pattes avant gauche) en pourcentage de contacts de forelimb totaux ( de gauche , plus forepaw droite).
- Effectuer histochimie (IHC), une analyse immunohistochimique pour évaluer le niveau d'expression du transgène et la perte de cellules dopaminergiques.
- A différents stades finaux, sacrifiez les rats avec une dose excessive de pentobarbital sodique (60 mg / kg, ip) et effectuer une perfusion intracardiaque avec du sérum physiologique froid suivi de 4% de paraformaldehyde dans du PBS 19. Fixer les cerveaux nuit à 4 ° C et couper 50 um sections coronales de cerveau épais en utilisant un microtome vibrant.
- Effectuer la coloration IHC sur les sections flottantes utilisant des anticorps contre α-SYN et de la tyrosine hydroxylase pour analyser les niveaux d'expression α-SYN et le chiervel de neurodégénérescence 16.
Résultats
Le schéma d' ensemble de l'expérience est représenté sur la figure 1
surexpression de rAAV 07/02 à médiation A53T α-SYN induit des déficits moteurs dopamine-dépendante.
Pour examiner si le niveau d'α-SYN surexpression est suffisante pour induire une déficience motrice chez les rats, nous avons soumis les rats à l'épreuve du cylindre pour évaluer l' utilisation de forelimb spontanée (figure 3A). A partir de 3 semaines après l'injection, une déficience motrice significative a été observée chez les rats ayant reçu une dose 3.0 E11 GC / ml de A53T α-SYN rAAV2 / 7 vecteur. A 4 semaines après l' injection d' une diminution de 50% en controlatéral ( à gauche) l' utilisation spontanée de forepaw a été observée, alors que le contrôle eGFP rAAV2 / 7 injecté animaux n'a montré aucune asymétrie dans forepaw utilisation (figure 3B). Les rats ayant reçu une dose de vecteur A53T supérieur α-SYN rAAV2 / 7 ont montré une impairm plus prononcéeent de l' utilisation de patte (70%) à 29 jours après l' injection (figure 3C). Pour prouver que la déficience motrice observée était la dopamine-dépendante, nous avons administré une dose unique de L-DOPA (6 mg / kg ip) pour les rats injectés avec une dose élevée de vecteur. Lorsque nous avons répété le cylindre essai 45 min après le traitement L-DOPA, un rétablissement complet de l'utilisation de forepaw dans le A53T α-SYN rAAV2 / 7 injecté animaux a été observé (figure 3C).
L' imagerie TEP permet l' imagerie non invasive d'α-SYN une neurodégénérescence progressive induite.
Pour faire suite à la cinétique de dopaminergique nigro neurodégénérescence effractive non au fil du temps chez les animaux individuels, nous avons quantifié transporteur de la dopamine (DAT) de liaison utilisant la tomographie par émission de positons petits animaux (PET) avec [18 F] -Fect comme radioligand. DAT liaison significativement diminuée dans les caudé-putamen ipsilatérales de A53T α-SYN rAAV2 / 7 injecrats ted au fil du temps , mais est resté stable dans le contrôle des animaux eGFP (figure 4A - 4B). Quantification de liaison DAT de A53T α-SYN rAAV2 / 7 injecté animaux a montré un taux maximal de nigro dégénérescence dopaminergique entre le jour 7 et 21 après l'injection. Après 32 jours, une diminution de la liaison de DAT à 85% a été observée (figure 4C). Comme témoin positif, l' injection de la neurotoxine 6-OHDA dans le SN a induit une perte de DAT 90% de la liaison dans les 7 jours (figure 4b - 4c).
L' injection stéréotaxique de rAAV2 / 7 A53T α-SYN dans le SN du rat induit la mort des cellules du locus niger dopaminergiques et la formation d'agrégats positifs α-SYN insolubles.
D'analyser le niveau d'α-SYN surexpression et la perte de cellules dopaminergiques nous avons sacrifié les animaux à différents moments. IHC a été effectuée sur des coupes flottantes en utilisant un anticorps against α-synucléine (lapin polyclonaux 1: 5000). Cet anticorps peut détecter à la fois humain et de rat α-synucléine, mais les niveaux endogènes de rat α-synucléine sont en dessous des limites de détection au sein de soma des cellules du locus niger, en raison de sa localisation prédominante au niveau des membranes synaptiques. Pour ânes perte de cellules, nous avons utilisé un anticorps contre TH (polyclonaux de lapin 1: 1000).
Quatre jours après l' injection du vecteur rAAV, α-SYN ou l' expression eGFP a été détectée dans le SN (Figure 5A - 5C) des rats. La majorité (> 90%) du DN est efficacement transduites et les deux protéines transgéniques ont été localisés dans les corps cellulaires et des axones. A 29 jours après l' injection (pi) une réduction substantielle de l'expression α-SYN a été observée dans le SNpc, alors qu'il était encore détectable dans les zones entourant la SN (figure 5B - 5C). Ensuite, nous avons analysé le taux de perte de cellules du locus niger. Un rapide et une perte progressive of jusqu'à 80% des neurones TH-positifs n'a été détecté au cours de 29 jours chez les rats injectés avec A53T α-syn rAAV2 / 7 (figure 5D - 5H). À noter, la surexpression de type sauvage au lieu de A53T α-SYN abouti à dopaminergique similaire neurodégénérescence (données non présentées). La perte de la DN dans le SN a été parallèle à une diminution robuste des terminaisons nerveuses TH-positifs dans le striatum (STR) (figure 5F). Pour exclure des effets spécifiques vecteur de lots, différentes préparations de vecteur α-SYN ont été testés dans le SN avec des résultats similaires. Aucune réduction de la TH coloration n'a été observée dans le SN ou STR de la EGFP rAAV2 / 7 injecté animaux témoins (figure 5E-5H). À côté de la neurodégénérescence dopaminergique, la présence d'α-synucléinopathie est une deuxième caractéristique importante de la maladie de Parkinson. Malgré le cours de courte durée de notre modèle (quatre semaines), nous avons observé les deux agrégats cytoplasmiques α-SYN-positifs dans le SN et neurites dystrophiques dans le STR (Figure 5I ong>). Immunoréactivité ubiquitine est une caractéristique distincte de corps de Lewy pathologie dans le cerveau humain 20-22. Nous avons observé une co-localisation de l' α-SYN et de l' ubiquitine à 29 jours pi en une fraction (± 20%) de l'α-SYN exprimant les neurones de la substance noire (figure 5J). La nature fibrillaire des agrégats α-SYN a été évaluée par la thioflavine S (Thio S) coloration 23. Thio S cellules positives ont été détectées dans le SN à partir de 17 jours et suivants (Figure 5J).
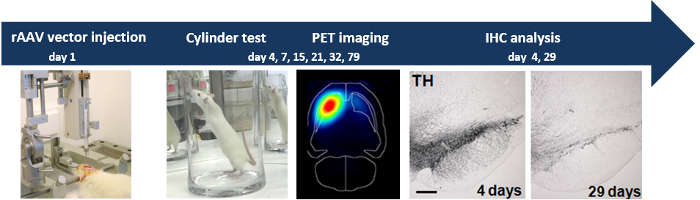
Figure 1:. Injection stéréotaxique de rAAV2 / 7 α-SYN vecteur conduit à la neurodégénérescence progressive injection stéréotaxique de rAAV2 / 7 α-SYN vecteur dans le SN du rat induit dopaminergique neurodégénérescence mesurée par l' analyse du comportement (essai de cylindre), PET non-invasive l'imagerie et l'analyse IHC.d / 53670 / 53670fig1large.jpg "target =" _ blank "> S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 2: L' injection stéréotaxique de codage rAAV2 / 7 vecteur α-SYN dans le SN du rat. (A, B, E) Les sutures crâniennes sur le crâne de rat, définissant les deux points de référence: bregma et Lambda. (C) un atlas stéréotaxique du cerveau de rat présentant la région d'injection à savoir la SN. (D) Un rat Wistar positionné dans un cadre de tête stéréotaxique utilisant deux barres d'oreilles, une bouche et une barre de nez. (F) La aiguille de calibre 30 remplie de vecteur est mis en place pour la substantia nigra. (G) Un petit ensemble est percé au niveau du site d'injection et l'aiguille est placée en position. (H) Après l' injection du cuir chevelu est stitched et désinfectés. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
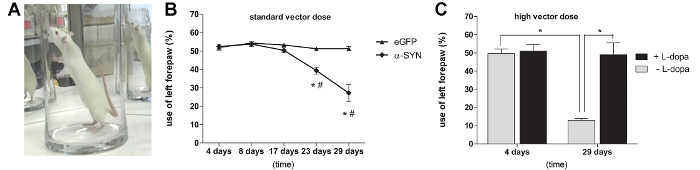
Figure 3: rAAV surexpression 2/7 à médiation A53T α-SYN induit des déficits moteurs dopamine dépendant (A, B) test du cylindre à différents points de temps après l' injection de rAAV2 / 7 A53T α-syn.. (Moyenne ± sd, * p <0,05 par rapport à 17 jours, # p <0,05 contrôles de eGFP par ANOVA et Tukey test post hoc, n = 5). (C) Test de cylindre à différents points de temps après l' injection de rAAV2 / 7 A53T α-SYN (dose élevée de vecteur). (Moyenne ± sd, * p <0,05 4 jours contre 29 jours par ANOVA et Tukey post hoc test, n = 5). Le test a été effectué avec ou sans administration de lévodopa (L-dopa). (Moyenne ± sd, * p <0.05 non-traités par rapport à des animaux traités par ANOVA et Tukey test post hoc, n = 5). Reproduit de neurobiologie du vieillissement, vol. 36, Van der Perren et al., Suivi longitudinal et la caractérisation d'un modèle de rat robuste pour la maladie de Parkinson sur la base de la surexpression de l' alpha-synucléine avec des vecteurs viraux adéno-associés, 1543-1558, (2015), avec la permission d'Elsevier. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.

Figure 4:. Imagerie non-invasive de A53T α-SYN mort des cellules dopaminergiques induite en utilisant DAT imagerie TEP (A - B) Série de tranches horizontales et coronales représentant la liaison moyenne du striatum DAT de (A) rAAV2 / 7 A53T α-SYN injecté animaux à différenT points de temps après l'injection (n = 7) et (B) rAAV2 / 7 eGFP injection (n = 1) ou 6-OHDA animaux témoins traités (n = 1) 79 jours après l'injection. Les barres de couleur indiquent les potentiels de liaison pour le DAT. (C) Quantification de la DAT liaison de rAAV2 / 7 A53T α-SYN, rAAV2 / 7 eGFP et 6-OHDA injecté animaux mesurés à différents points de temps ( les données représentent la moyenne ± sd). Reproduit de neurobiologie du vieillissement, vol. 36, Van der Perren et al., Suivi longitudinal et la caractérisation d'un modèle de rat robuste pour la maladie de Parkinson sur la base de la surexpression de l' alpha-synucléine avec des vecteurs viraux adéno-associés, 1543-1558, (2015), avec la permission d'Elsevier. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
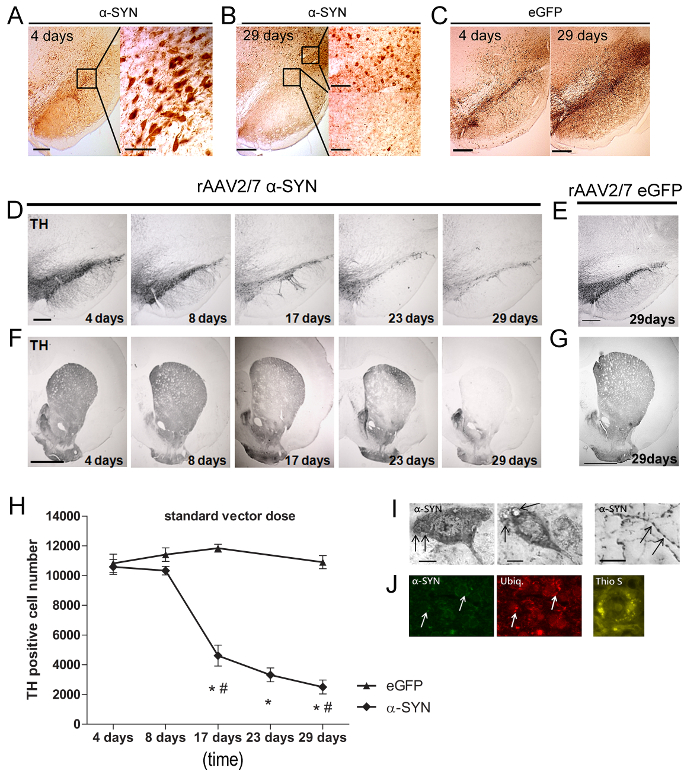
Figure 5: rAAV 07/02 à médiation par la surexpression de A53T α-SYN induit la mort des cellules dopaminergiques et la formation d'agrégats positifs α-SYN insolubles. (A - B) , la coloration IHC démontrant α-SYN surexpression 4 jours et 29 jours après le transfert de rAAV médiation par SN rat. Inserts montrent des grossissements de la zone sélectionnée. Barre d'échelle = 400 um (aperçu photo à gauche), 70 um et 200 um (inserts à droite). (C) coloration IHC démontrant eGFP surexpression 4 jours et 29 jours après le transfert de rAAV médiation dans SN rat. Barre d'échelle = 400 um. (D - G) coloration IHC TH dans la SN et STR à différents points de temps après l' injection de (D, F) rAAV2 / 7 α-SYN ou 29 jours après l' injection de (E, G) rAAV2 / 7 eGFP dans le SN . Barre d'échelle a, c = 400 um, b, d = 1000 um. (H) de quantification stéréologique du engourdieer des neurones TH-positifs dans le SN au fil du temps après l'injection rAAV2 / 7 A53T α-SYN ou rAAV2 / 7 vecteur de commande eGFP (moyenne ± sd, * p <0,05 par rapport à 8 jours, # p <0,05 par rapport aux témoins eGFP par ANOVA et test hoc après Tukey, n = 5). (I) coloration IHC démontrant α-SYN pathologie, y compris les agrégats cytoplasmiques dans le SN et dystrophique et neurites exorbités dans le STR, après intranigral injection rAAV2 / 7 A53T α-SYN. (J) images confocales représentatifs de doubles immunomarquages fluorescentes pour α-SYN (vert) et ubiquitine (rouge) montrent une augmentation de la co-localisation dans le temps (flèches). Barre d'échelle c = 50 pm. Thioflavine S coloration des SN 29 jours après l'injection de rAAV2 / 7 A53T α-SYN. Barre d'échelle D = 30 pm. Reproduit de neurobiologie du vieillissement, vol. 36 Van der Perren et al., Suivi longitudinal et la caractérisation d'un modèle de rat solide pour la maladie de Parkinson basé sur la surexpression de l' alpha-synucléine avec l' annonceeno-associé des vecteurs viraux, 1543-1558, (2015), avec la permission d'Elsevier. S'il vous plaît cliquer ici pour voir une version plus grande de cette figure.
Discussion
Il y a plusieurs étapes critiques dans le protocole. Le titre du vecteur, ainsi que la pureté du vecteur influence directement le résultat phénotypique du modèle. Les titres de vecteur excessifs ou lots de vecteurs insuffisamment purifiés peuvent entraîner une toxicité non spécifique. Par conséquent, l'utilisation de lots de vecteurs de haute qualité et des vecteurs de contrôle appropriés est indispensable. En outre, le positionnement exact de la tête du rat dans le cadre stéréotaxique et une détermination précise des coordonnées sont essentielles pour cibler la substantia nigra. Après avoir percé le trou dans le crâne au niveau du site d'injection, il est important d'insérer l'aiguille directement dans le cerveau du rat sans toucher aucune marge. L'aiguille doit être retirée lentement après l'injection du vecteur viral, pour éviter les fuites de vecteur. Enfin, après la couture, le cuir chevelu doit être désinfectée avec 1% jodium dans 70% d'isopropanol pour éviter de mordre des stiches par d'autres animaux. Alternativement d'autres réactifs antiseptiquespeut être utilisé.
Le procédé décrit peut également être utilisé pour développer un modèle α-SYN rAAV2 / 7 souris sur la base de la maladie de Parkinson 24. Chez la souris on injecte un volume de vecteur rAAV 2 pl dans le SN. Par rapport à des rats, des souris DN semble être quelque peu moins sensible à l'a-SYN surexpression, ce qui entraîne une manifestation tardive de la neurodégénérescence. En outre, d' autres régions du cerveau (par exemple , le striatum, l' hippocampe, le cortex, etc.) peuvent être ciblés. Les coordonnées pour les différentes régions du cerveau peuvent être trouvées dans l'atlas stéréotaxique. L' optimisation des coordonnées peut être effectuée par l' encre de Chine ou en utilisant un vecteur viral codant pour un gène rapporteur (par exemple eGFP). Vecteurs différents systèmes (rAAV, LV, etc.) peuvent être utilisés en fonction de l'application.
Cette technique a la limitation que chaque animal doit être injecté individuellement. Par conséquent, une personne qualifiée doit effectuer les injections afin de minvariations de imize entre les différents animaux. Une autre limitation est que la méthode prend du temps (lorsqu'elles sont exécutées par une personne formée il faut environ 45 minutes par animal). Seulement huit à dix animaux peuvent être injectées en une seule journée.
délivrance de gène médiée par un vecteur viral permet un ciblage spécifique des régions du cerveau. En utilisant des vecteurs viraux, des niveaux élevés d'expression du transgène peut être atteint, ce qui est crucial puisque l'apparition et la gravité de la maladie dépend du niveau d'expression α-syn. De plus, différentes doses peuvent être appliquées qui se traduira par un modèle animal affichant une cinétique plus lente ou plus rapide de la neurodégénérescence. Enfin, cette technique peut être utilisée pour créer des modèles de différentes espèces animales et des souches en utilisant la même préparation de vecteur.
Cette procédure peut être utilisée pour délivrer des vecteurs viraux ainsi que les toxines (par exemple la 6-OHDA) dans différentes régions du transgène cerveau.Utilisation codé par le vecteur peut être une protéine reporter, un groupe p thérapeutiquerotein pour applications de thérapie génique 8-10 ou une protéine liée à la maladie utilisé pour la modélisation de la maladie 11-14. Cette technique peut être utilisée pour développer de nouveaux modèles animaux qui permettent le dépistage de drogues pré-clinique et peut être bénéfique pour étudier le mécanisme moléculaire de la maladie de Parkinson, ainsi que de nombreux autres troubles neurodégénératifs.
Déclarations de divulgation
Les auteurs déclarent qu'il n'y a pas de conflit réel ou potentiel d'intérêt.
Remerciements
Les auteurs remercient Joris Van Asselberghs et Ann Van Santvoort pour leur excellente assistance technique. La recherche a été financée par l'IWT-Vlaanderen (IWT SBO / 80020), le FWO Vlaanderen (G.0768.10), par le programme CE-FP6 'DiMI' (LSHB-CT-2005-512146), le projet FP7 MEFOPA RTD (SANTÉ -2009 à 241791), le programme FP7 'inmind' (SANTÉ-F2-2011-278850), la KU Leuven (IOF-KP / 07/001, OT / 08 / 052A, IMIR PF / 10/017), et le Fondation MJFox (validation Cible 2010). A. Van der Perren et C. Casteels sont un des boursiers postdoctoraux du Fonds flamand de la recherche scientifique. K. Van Laere est un compagnon clinique principal du Fonds flamand de la recherche scientifique.
matériels
| Name | Company | Catalog Number | Comments |
| Female 8 weeks old Wistar rats | Janvier | / | 200-250 g |
| Ketamine (Nimatek) | Eurovet animal health | 804132 | |
| Medetomidine (Dormitor) | Orion-Pharma/ Janssen Animal Health | 1070-499 | |
| Local anesthetic for scalp and ears: Xylocaïne 2% gel | Astrazeneca | 0137-547 | |
| Terramycine | Pfizer | 0132-472 | |
| Buprénorphine (Vetergesic) | Ecuphar | 2623-627 | |
| Jodium 1% isopropanol | VWR | 0484-0100 | |
| stereotactic head frame | Stoeling | / | |
| Hamilton Syringe (30 gauge -20 mm -pst 2) | Hamilton/ Filter Service | 7803-07 | |
| atipamezole (Antisedan) | Orion-Pharma/Elanco | 1300-185 | |
| rAAV A53T α-SYN vector | LVVC, KU Leuven | / | https://gbiomed.kuleuven.be/english/research/50000715/laboratory-of-molecular-virology-and-gene-therapy/lvvc/ |
| sodium pentobarbital (Nembutal) | Ceva Santé | 0059-444 | |
| microtome | Microm | HM650 | |
| rabbit polyclonal synuclein Ab | Chemicon | 5038 | 1:5,000 |
| rabbit polyclonal TH Ab | Chemicon | 152 | 1:1,000 |
| Lutetium oxyorthosilicate detector-based FOCUS 220 tomograph | Siemens/ Concorde Microsystems | / | |
| radioligand: 18F-FECT | In house | / | |
| L-dopa: Prolopa 125 | Roche | 6 mg/kg i.p. | |
| DMEM, Glutamax | Life Technologies | N° 31331-093 | |
| Foetal bovine serum | Life Technologies | N° 10270-106 | |
| 25 kD linear polyethylenimine (PEI) | Polysciences | / | |
| OptiPrep Density Gradient Medium: Iodixanol | Sigma | D1556-250ML | |
| Optimen | Life Technologies | N° 51985-026 | |
| Paxinos 1 watston steretactic atlas, fourth Edition | Elsevier | / |
Références
- Magen, I., Chesselet, M. F. Genetic mouse models of Parkinson's disease The state of the art. Prog Brain Res. 183, 53-87 (2010).
- Masliah, E., et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders. Science. 287, 1265-1269 (2000).
- Freichel, C., et al. Age-dependent cognitive decline and amygdala pathology in alpha-synuclein transgenic mice. Neurobiol Aging. 28, 1421-1435 (2007).
- Fleming, S. M., Fernagut, P. O., Chesselet, M. F. Genetic mouse models of parkinsonism: strengths and limitations. NeuroRx. 2, 495-503 (2005).
- Kahle, P. J., et al. Selective insolubility of alpha-synuclein in human Lewy body diseases is recapitulated in a transgenic mouse model. Am J Pathol. 159, 2215-2225 (2001).
- Chesselet, M. F., Richter, F. Modelling of Parkinson's disease in mice. Lancet Neurol. 10, 1108-1118 (2011).
- Deroose, C. M., Reumers, V., Debyser, Z., Baekelandt, V. Seeing genes at work in the living brain with non-invasive molecular imaging. Curr Gene Ther. 9, 212-238 (2009).
- Manfredsson, F. P., et al. rAAV-mediated nigral human parkin over-expression partially ameliorates motor deficits via enhanced dopamine neurotransmission in a rat model of Parkinson's disease. Exp Neurol. 207, 289-301 (2007).
- Vercammen, L., et al. Parkin protects against neurotoxicity in the 6-hydroxydopamine rat model for Parkinson's disease. Mol Ther. 14, 716-723 (2006).
- Winklhofer, K. F. The parkin protein as a therapeutic target in Parkinson's disease. Expert opinion on therapeutic targets. 11, 1543-1552 (2007).
- Kirik, D., et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci. 22, 2780-2791 (2002).
- Kirik, D., et al. Nigrostriatal alpha-synucleinopathy induced by viral vector-mediated overexpression of human alpha-synuclein: a new primate model of Parkinson's disease. Proc Natl Acad Sci U S A. 100, 2884-2889 (2003).
- Lauwers, E., et al. Neuropathology and neurodegeneration in rodent brain induced by lentiviral vector-mediated overexpression of alpha-synuclein. Brain pathology. 13, 364-372 (2003).
- Klein, R. L., King, M. A., Hamby, M. E., Meyer, E. M. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther. 13, 605-612 (2002).
- Vander Perren, A., Van den Haute, C., Baekelandt, V. Viral Vector-Based Models of Parkinson's Disease. Curr Top Beh Neurosci. , (2014).
- Van der Perren, A., et al. Longitudinal follow-up and characterization of a robust rat model for Parkinson's disease based on overexpression of alpha-synuclein with adeno-associated viral vectors. Neurobiol Aging. , (2014).
- Van der Perren, A., et al. Efficient and stable transduction of dopaminergic neurons in rat substantia nigra by rAAV 2/1, 2/2, 2/5, 2/6.2, 2/7, 2/8 and 2/9. Gene Ther. , (2011).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Soueid, J., Nokkari, A., Makoukji, J. Techniques and Methods of Animal Brain Surgery: Perfusion, Brain Removal, and Histological Techniques. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Dale, G. E., et al. Relationships between Lewy bodies and pale bodies in Parkinson's disease. Acta Neuropathol. 83, 525-529 (1992).
- Dawson, V. L. Neurobiology of flies and mice. Science. 288, 631-632 (2000).
- Dawson, T., Mandir, A., Lee, M. Animal models of PD: pieces of the same puzzle? Neuron. 35, 219-222 (2002).
- LeVine, H. 3rd Quantification of beta-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274-284 (1999).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Mol Neurodegener. 8, (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon