Method Article
Entwicklung eines Alpha-Synuklein Based Rattenmodell für Parkinson-Krankheit durch stereotaktische Injektion eines rekombinanten Adeno-assoziierten viralen Vektor,
In diesem Artikel
Zusammenfassung
This manuscript describes how viral vector-mediated local gene delivery provides an attractive way to express transgenes in the central nervous system. The protocol outlines all crucial steps to perform a viral vector injection in the substantia nigra of the rat to develop a viral vector-based animal model for Parkinson's disease.
Zusammenfassung
Um die molekularen Mechanismen der Parkinson-Krankheit (PD) und die Entwicklung neuer therapeutischer Strategien zu untersuchen, setzen wissenschaftliche Forscher an Tiermodellen. Die Identifizierung von PD-assoziierten Genen hat zu der Entwicklung von genetischen PD Modelle geführt. Die meisten transgenen α-SYN Mausmodelle entwickeln schrittweise α-SYN Pathologie aber nicht klar dopaminergen Zellverlust und Dopamin-abhängige Verhaltensdefiziten anzuzeigen. Diese Hürde wurde durch direkte Ausrichtung der Substantia nigra mit viralen Vektoren überexprimiert, PD-assoziierten Gene zu überwinden. Lokale Genübertragung mittels viraler Vektoren bietet eine attraktive Möglichkeit, Transgene in das zentrale Nervensystem zu exprimieren. Spezifischen Hirnregionen ausgerichtet werden können (zB der Substantia nigra), kann die Expression im adulten Einstellung und hohe Expressionsniveaus erreicht werden kann induziert werden. Ferner können verschiedene Vektor-Systeme auf der Basis verschiedener Viren verwendet werden. Das Protokoll legt alle entscheidenden Schritte, um einen viralen Vektor auszuführenInjektion in der Substantia nigra der Ratte einen viralen Vektor-basierte alpha-Synuclein-Tiermodell für die Parkinson-Krankheit zu entwickeln.
Einleitung
Um die Pathophysiologie von PD studieren und neue therapeutische Strategien zu entwickeln, besteht ein dringender Bedarf an Tiermodellen, die eng an die Neuropathologie ähneln, Physiologie und motorischen Symptome der menschlichen PD. Je höher der prädiktive Wert ist, desto besser können wir neue Therapien von Tiermodellen für die Patienten zu übersetzen.
Die Entdeckung von alpha-Synuclein (α-SYN) als erstes PARK-Gen 1997 führte zu der Entwicklung der ersten genetischen PD-Modellen. Viele transgene Mäuse, die menschliche Wildtyp (WT) oder eine Mutante (A30P, A53T) α-SYN wurden in den letzten zehn Jahren erzeugt überexprimieren. Die Gehalte an α-SYN-Überexpression haben sich bei der Entwicklung der Pathologie von entscheidender Bedeutung zu sein. Auch die Mausstamm, das Vorhandensein oder Fehlen von endogenem α-SYN und ob die in voller Länge oder eine verkürzte Form exprimiert wird , spielt eine Rolle (detaillierte Überprüfung durch Magen und Chesselet 1). Die Überexpression von sowohl WT und mehreren klinischen Mutanten des menschlichen &# 945; -syn in transgenen Mäusen induziert pathologischen Akkumulation von α-SYN und neuronale Dysfunktion 2-6. Doch bis jetzt sind die meisten transgenen α-SYN Maus-Modellen keine klaren dopaminergen Zellverlust und Dopamin-abhängige Verhaltensdefiziten anzuzeigen.
Diese Hürde wurde durch direkte Ausrichtung der Substantia nigra (SN) mit viralen Vektoren überexprimiert, α-SYN überwinden. Virale Vektoren sind aus Viren stammen, die Zellen leicht infizieren können, stellen genetischem Material in ihren Wirtsgenom und zwingen die Wirtszelle das virale Genom, um zu replizieren, um neue Viruspartikel produzieren. Viren können zu nicht-replizierenden viralen Vektoren konstruiert werden, die ihre Fähigkeit behalten, in Zellen einzudringen und Gene einzuführen. Durch Teile des viralen Genoms zu löschen und sie durch die Gene von Interesse ersetzt, die Anwendung des Vektors in einer einzigen Runde Infektion ohne Replikation in der Wirtszelle führen, die allgemein als "Transduktion" bezeichnet. Virale Vektoren cein sowohl für die Überexpression und gene silencing verwendet werden. Das exprimierte Transgen ein Reporterprotein (zB grün fluoreszierende Protein oder Glühwürmchen - Luciferase) 7, ein therapeutisches Protein für Gentherapie - Anwendungen sein können 8-10 oder, wie wir in diesem Papier konzentrieren wird, um ein krankheitsbedingtes Protein für Krankheitsmodelle verwendet 11 -14.
Virusvektor-vermittelte Genabgabe bietet eine alternative Möglichkeit Transgenen im ZNS mit mehreren Vorteilen auszudrücken. Mit lokalen Transgen Lieferung, können bestimmte Hirnregionen ausgerichtet sein. Ferner kann die Transgenexpression im Erwachsenenalter die Gefahr der Kompensationsmechanismen während der Entwicklung abnimmt induziert werden. Außerdem können Modelle in unterschiedlichen Arten und Stämme erstellt werden. Und schließlich können verschiedene Transgene leicht kombiniert werden. Verwendung von viralen Vektoren können hohe Transgen-Expressionsniveaus erreicht werden, was wichtig sein könnte, da der Beginn der Erkrankung und der Schwere auf der Ebene der ÜBERBEL häufig abhängigression.
Mehrere Vektorsysteme basieren auf verschiedenen Viren entwickelt worden. Die Wahl des Vektorsystems hängt von der Größe des Gens von Interesse, die erforderliche Dauer der Genexpression, die Zielzelle und die biologische Sicherheit Probleme. Zur stabilen Gentransfer in das Gehirn, lentivirale (LV) und rekombinantem adeno-assoziierter viraler (rAAV) -Vektoren sind nun die Vektorsysteme der Wahl angesehen, da sie auf effiziente und langfristige Genexpression im Nagetier Gehirn führen. Für spezifische Targeting der dopaminergen Neuronen (DN) des SN, rAAV Vektoren sind Vektoren LV allmählich outcompeted wegen ihrer höheren Titern und Transduktionseffizienz von DN.
Die besten α-SYN Basis Nagetiermodellen derzeit haben aus einem kombinierten Einsatz mit neueren AAV - Serotypen (rAAV 1, 5, 6, 7, 8) und optimierte Vektorkonstrukte, Titer und Reinheit 15,16 entwickelt. Der Vektor-Titer sowie der Vektor Reinheit direkt beeinflusstdas phänotypische Ergebnis des Modells. Übermäßige Vektor-Titer oder unzureichend gereinigte Vektor Chargen können in nicht-spezifische Toxizität führen. Daher sind geeignete Kontrollvektoren unverzichtbar. Erhebliche Zeitinvestitionen in den viralen Vektor Produktion, Upscaling und Reinigungsverfahren wurden ebenfalls als wesentlich erwiesen reproduzierbare und qualitativ hochwertige Vektor-Chargen zu erhalten.
Protokoll
Alle Tierversuche sind in Übereinstimmung mit der Europäischen Gemeinschaften Richtlinie des Rates vom 24. November 1986 (86/609 / EWG) und genehmigt durch das Bioethical Komitee der Universität Leuven (Belgien) durchgeführt.
1. Rekombinante AAV Herstellung und Reinigung
Hinweis: rAAV - Vektor Produktion und Reinigung wurde durchgeführt von der Leuven viraler Vektor Core (LVVC) , wie zuvor 17 beschrieben.
- Kurz gesagt, transfizieren subkonfluenten niedrig (<50) Passage anhaftenden HEK 293T-Zellen ein 25 kD Lineares Polyethylenimin 150 nM NaCl Transfektionslösung und drei verschiedene Plasmide in einem Verhältnis von 1: 1: 1 in DMEM-Medium, 2% fötales Rinderserum. Nach 24 Stunden Inkubation bei 37 ° C in einem 5% CO 2, ersetzen Sie das Medium durch frisches DMEM - Medium 2% fötales Rinderserum.
Hinweis: Die Plasmide, die die Konstrukte für die AAV7 Serotyp enthalten, verbesserte das AAV-Transfer-Plasmid die menschliche A53T Mutante α-SYN unter der Kontrolle des CMVie kodieren synapsin1 - Promotor und der pAdvDeltaF6 adenoviralen Helferplasmid 17. - Ernten Sie das Medium 5 Tage nach der transienten Transfektion und konzentrieren sich mit Tangentialstromfiltration 17.
- Reinige die rAAV - Vektorpartikel aus dem konzentrierten Medium eine Iodixanol Stufengradienten mit 17.
- Verwenden von Standardtechniken der Echtzeit-PCR für die genomische Kopie (GC) Bestimmung. In diesem Protokoll wurde ein Vektor - Titer von 3,0 E11 GC / ml verwendet , um ein α-SYN basierend Rattenmodell für 17 PD zu entwickeln.
2. Stereotactic Injektion von rAAV α-SYN Vektor in der SN der Ratte (Figur 2)
- Haus acht Wochen alt weiblichen Wistar-Ratten, die etwa 200 bis 250 g unter einem normalen 12 Stunden Licht / Dunkel-Zyklus mit freiem Zugang zu pelle Nahrung und Leitungswasser mit einem Gewicht.
- Werfen die Ratte intraperitoneal (ip) Narkose eine Mischung von Ketamin enthält (60 mg / kg) und Medetomidin (0,4 mg / kg). Sobald die Ratte betäubt und nicht reagiertwenn die verschiedenen Pfoten quetschen, zu verwalten für die weitere Anerkennung einen Mikrotransponder subkutan der Ratte auf der Rückseite einen Mikrotransponder implanter verwenden. Prüfen, ob der Mikrotransponder richtig positioniert ist und durch das Lesegerät ausgelesen werden.
- Schneiden Sie die Haare auf der Oberseite der Kopfhaut. Tragen Sie eine lokale Betäubung sowohl auf der Kopfhaut und den Ohren. Führen Sie den Rest des chirurgischen Eingriffs unter einer laminaren Strömung unter aseptischen Bedingungen.
- Legen Sie die Ratten in einem stereotaktischen Kopfrahmen mit zwei Ohr Bars, einen Mund und eine Nase bar. Bedecken Sie den Körper der Ratte mit einem Papiertuch einen Abfall der Körpertemperatur zu vermeiden. Anwenden eines okularen Gleitmittel, die Augen vor dem Austrocknen zu verhindern.
- Desinfizieren Sie die Kopfhaut mit jodium 1% in Isopropanol 70% und machen einen kleinen Schnitt in der Mittellinie der Kopfhaut. Kratzen Sie vorsichtig die Membranen auf dem Schädel entfernt und Spülen mit Kochsalzlösung. Lassen Sie den Schädel trocken für einige Minuten. Beachten Sie die Schädelnähte und die beiden Bezugspunkte: Bregma und Lambda.
- Um den rAAV-Vektor in den SN injizieren, definieren die Koordinaten in Richtung Bregma (von vorne nach hinten: 5,3 mm; mediolateral: 2,0 mm und dorsoventrale: 7,2 mm von der Dura berechnet).
Hinweis: Die dreidimensionalen Koordinaten für jede Region von Interesse berechnet werden kann, eine stereotaktischen Atlas des Rattengehirns mit, Bregma als anatomischen Bezugspunkt der Anwendung. - Füllen Sie eine 10 & mgr; l Mikroinjektionsspritze (30 Gauge 20 mm) mit rAAV-Vektor und legen Sie sie in der stereotaktischen Instrument mit einem motorisierten Mikroinjektionspumpe angeschlossen. Kontrollieren Sie die Lautstärke , indem Sie einen Tropfen Vektor Freigabe und in einem polyvalenten Reinigungsmittel pH 9 (zB RBS) zu beseitigen.
- Optisch prüfen, ob der Kopf gerade in der Kopfrahmen befestigt ist und die Links-Rechts-Achse zu bewerten. Sorgfältig visuell die von vorne nach hinten und mediolateral Koordinaten für Bregma und Lambda definieren und deren Höhe eine 30-Gauge-20 mm-Nadel in dorsoventraler Arm des stereotaktischen Rahmen mit messen.
- Erlauben Uhraximale von 0,3 mm Höhenunterschied zwischen Bregma und Lambda. Legen Sie die Nadel wieder auf Bregma und wenden die von vorne nach hinten und mediolateral Koordinaten durch die von vorne nach hinten und die mediolateral Arm des stereotaktischen Rahmen bewegen.
- Am Ort der Injektion, messen die Höhe des Schädels und sicherzustellen, dass er nicht mehr als 0,3 mm von der Höhe des Bregma unterscheidet. Bohren Sie ein Loch in den Schädel mit einem Durchmesser von etwa 2 mm. Messen Sie die Höhe der Dura, dies dient als Referenz der dorsoventrale anzuwenden koordinieren. Alternativ subtrahieren für den Schädel einer festen Dicke (0,9 mm).
- Dringen die Dura eine 26-Gauge-Nadel und das Blut mit einem sterilen Gewebe absorbieren. Warten Sie, bis alle Blutungen, bevor Sie fortfahren gestoppt hat.
- einfügen langsam die 10 & mgr; l Mikroinjektionsspritze mit Vektor-Lösung in das Gehirn auf die vorgegebene Tiefe vorbelastet (dorsoventrale Koordinate). Warten Sie 1 min mit der Nadel an Ort und Stelle. Injizieren 3 ulder Vektorlösung (3,0 E11 Genomkopien / ml (mittlerer Vektor Dosis) oder 1,0 E12 GC / ml (high Vektor Dosis) von rAAV2 / 7 α-SYN oder eGFP Kontrollvektor) des motorisierten Mikroinjektionspumpe mit einem Durchsatz von 0,25 & mgr; l unter Verwendung von / Minute
- Nach der Injektion, halten Sie die Nadel an Ort und Stelle für eine weitere min 5, bevor es langsam zu entfernen. Nähen Sie die Kopfhaut mit beschichteten geflochtenen Polyester 3.0, desinfizieren mit 1% jodium in 70% Isopropanol und sanft das Tier aus dem Gerät zu entfernen Stereotaxie. Lösen Sie zuerst die Nase und den Mund Bar, dann die beiden Ohr Bars.
- Um die Anästhesie umkehren, injizieren die Ratte intraperitoneal mit 0,5 mg / kg Atipamezol und legen Sie die Ratte in einen sauberen Käfig auf einer Heizplatte von 38 ° C, bis er aufwacht. Decken Sie die Ratte mit einem Papiertuch einen Abfall der Körpertemperatur zu verhindern.
- Bieten Sie einfachen Zugang zu Nahrung und Wasser für die ersten Stunden. Überwachen Sie die Ratte für die ersten paar Tage. Bei Bedarf anwenden Analgesie.
Hinweis: Es gibt keine Notwendigkeit, die Maschen von t zu entfernen,er Schädel. Nach 1-2 Wochen wird der Schädel vollständig repariert und die Stiche lösen.
3. Bewertung der rAAV2 / 7 α-SYN injizierten Ratten mit nicht-invasiven PET-Bildgebung, Verhaltenstests und immunhistochemischen Analyse
- Um die Kinetik der nigrostriatale dopaminergen Neurodegeneration nicht-invasiv im Laufe der Zeit in den einzelnen Tieren verfolgen, zu quantifizieren Dopamin - Transporter (DAT) Bindung unter Verwendung von Kleintier - Positronen - Emissions - Tomographie (PET) und einen Tracer des DA - Transporter zB [18 F] -Fect 16 .
- Um zu untersuchen, ob die Höhe der dopaminergen Neurodegeneration ausreicht motorischen Beeinträchtigungen bei den Ratten zu induzieren, die Ratten zu dem Zylinder Test unterziehen, um spontane forelimb Gebrauch zu bewerten.
- Legen Sie die Ratte in einer Breite von 20 cm Klarglaszylinder und Video das Verhalten bei vertikalen Bewegungen entlang der Wand und der Landung nach einem hinten. Ergebnis die Anzahl der Kontakte von jedem forepaw für insgesamt 20 gemachtKontakte. Ausführliche Beschreibung der Bewertungskriterien siehe Schallert et al. 18 Express die Anzahl der beeinträchtigten forelimb Kontakte (zB linke forepaw) als Prozentsatz der gesamten forelimb Kontakte (links und rechts forepaw).
Hinweis: Nicht-lädierten Kontrollratten beide Pfoten mit ebenso sollte etwa 50% in diesem Test punkten.
- Legen Sie die Ratte in einer Breite von 20 cm Klarglaszylinder und Video das Verhalten bei vertikalen Bewegungen entlang der Wand und der Landung nach einem hinten. Ergebnis die Anzahl der Kontakte von jedem forepaw für insgesamt 20 gemachtKontakte. Ausführliche Beschreibung der Bewertungskriterien siehe Schallert et al. 18 Express die Anzahl der beeinträchtigten forelimb Kontakte (zB linke forepaw) als Prozentsatz der gesamten forelimb Kontakte (links und rechts forepaw).
- Führen Sie immunhistochemischen (IHC) Analyse der Ebene der Transgen-Expression und dopaminergen Zellverlust zu bewerten.
- Zu verschiedenen Endstadien opfern die Ratten mit einer Überdosis von Natriumpentobarbital (60 mg / kg, ip) und eine intrakardiale Perfusion mit kalter Kochsalzlösung mit 4% Paraformaldehyd in PBS 19 gefolgt zuführen. Fixieren Sie die Gehirne über Nacht bei 4 ° C und schnitt 50 um dicke koronale Hirnschnitten einen vibrierenden Mikrotom.
- Führen Sie IHC-Färbung auf frei schwebenden Abschnitte Antikörper gegen α-SYN und Tyrosin-Hydroxylase unter Verwendung des Ausdrucks α-SYN Ebenen zu analysieren und die level der Neurodegeneration 16.
Ergebnisse
Das Gesamtkonzept des Experiments ist in Abbildung 1 dargestellt
2 rAAV / 7-vermittelte Überexpression von A53T α-SYN induziert Dopamin-abhängige motorische Defizite.
Um zu untersuchen , ob die Höhe der α-SYN - Überexpression ausreichend ist , motorischen Beeinträchtigungen bei Ratten zu induzieren, wir die Ratten zur Zylindertest unterzogen , um spontane forelimb Verwendung (3A) auszuwerten. 3 Wochen nach der Injektion wurde eine signifikante motorischen Beeinträchtigungen bei Ratten, die eine Dosis 3,0 E11 GC / ml A53T α-SYN rAAV2 / 7-Vektor erhalten. Nach 4 Wochen nach der Injektion eine 50% ige Abnahme der spontanen Gegenseite (links) forepaw Verwendung wurde beobachtet, während die Steuer eGFP rAAV2 / 7 injizierten Tiere zeigten keine Asymmetrie in forepaw Verwendung (3B). Die Ratten, die eine höhere A53T α-SYN rAAV2 / 7 Vektordosis zeigte eine ausgeprägtere impairm erhaltenent von forepaw Einsatz (70%) 29 Tage nach der Injektion (Figur 3C). Um zu beweisen, dass die beobachtete motorischen Beeinträchtigung war Dopamin abhängig, wir eine Einzeldosis von L-DOPA (6 mg / kg ip) an die Ratten mit einer hohen Dosis injiziert Vektor verabreicht. Wenn wir wiederholt den Zylinder Test 45 Minuten nach der L-DOPA - Behandlung, eine vollständige Genesung der forepaw Verwendung in der A53T α-SYN rAAV2 / 7 Tiere injiziert wurde beobachtet (Abbildung 3C).
PET - Bildgebung ermöglicht nicht-invasive Bildgebung von α-SYN induzierte progressive Neurodegeneration.
Um die Kinetik der nigrostriatale dopaminergen Neurodegeneration nicht-invasiv im Laufe der Zeit in den einzelnen Tieren verfolgen, quantifiziert wir Dopamin - Transporter (DAT) Bindung unter Verwendung von Kleintier - Positronen - Emissions - Tomographie (PET) mit [18 F] -Fect als Radioligand. DAT Bindung deutlich zurückgegangen in den ipsilateralen Nucleus caudatus-Putamen A53T α-SYN rAAV2 / 7 INJECted Ratten im Laufe der Zeit aber blieb stabil in der eGFP Kontrolltier (4A - 4B). Die Quantifizierung der DAT Bindung von A53T α-SYN rAAV2 / 7 Tiere injiziert zeigten eine maximale Rate von nigrostriatale dopaminergen Degeneration zwischen Tag 7 und 21 nach der Injektion. Nach 32 Tagen wurde eine Abnahme der DAT Bindung von bis zu 85% beobachtet (4C). Als positive Kontrolle, Injektion des Neurotoxins 6-OHDA in das SN induzierte 90% Verlust der DAT Bindung innerhalb von 7 Tagen (4B - 4C).
Stereotaktische Injektion von rAAV2 / 7 A53T α-SYN in der SN der Ratte induziert nigralen dopaminergen Zelltod und Bildung unlöslicher α-SYN positive Aggregate.
Um zu analysieren, den Grad der α-SYN-Überexpression und dopaminerge Zellverlust geopfert wir die Tiere zu verschiedenen Zeitpunkten. IHC wurde auf frei schwebenden Abschnitte durchgeführt, einen Antikörper ag mitainst α-Synuclein (polyklonalen Kaninchen-1: 5000). Dieser Antikörper kann sowohl erkennen Menschen und Ratten α-Synuclein, aber die endogenen Spiegel von Ratten α-Synuclein waren unter den Nachweisgrenzen innerhalb nigral Zelle somata, an synaptischen Membranen seiner vorherrschenden Lokalisation zurückzuführen ist. Um Esel Zellverlust haben wir einen Antikörper gegen TH (polyklonalen Kaninchen-1: 1000).
Der Ratten - vier Tage nach der rAAV - Vektor Injektion, α-SYN oder eGFP - Expression wurde in der SN (5A 5C) nachgewiesen. Der Großteil (> 90%) der DN wurde effizient transduziert und beide transgene Proteine wurden in den Zellkörper und Axone lokalisiert. Mit 29 Tage nach der Injektion (pi) eine deutliche Reduzierung der α-SYN - Expression wurde in der SNpc beobachtet, während es noch nachweisbar in Bereichen war rund um das SN (5B - 5C). Als nächstes untersuchten wir das Niveau der nigral Zellverlust. Eine schnelle und fortschreitenden Verlust of bis zu 80% der TH-positiven Neuronen wurde über 29 Tage bei Ratten nachgewiesen injiziert A53T α-SYN rAAV2 / 7 (Figur 5D - 5H). Zu beachten ist, eine Überexpression von Wildtyp anstelle von A53T α-SYN in ähnlichen dopaminergen Neurodegeneration führte (Daten nicht gezeigt). Der Verlust der DN in der SN wurde durch eine stabile Abnahme des TH-positive Nervenendigungen im Striatum (STR) (5F) parallel geschaltet. Um bestimmte Vektor Batch-Effekte auszuschließen, verschiedene α-SYN-Vektor-Präparate wurden in den SN mit ähnlichen Ergebnissen getestet. Keine Reduzierung der TH - Färbung wurde in der SN oder STR von eGFP rAAV2 / 7 injizierte Kontrolltiere (5E-5H) beobachtet. Neben dopaminerge Neurodegeneration ist die Anwesenheit von α-synucleinopathy ein zweites wichtiges Merkmal der PD. Trotz der kurzen Zeit Verlauf unseres Modells (vier Wochen), beobachteten wir sowohl α-SYN-positive zytoplasmatische Aggregate in der SN und dystrophischen Neuriten in der STR (Abbildung 5I Ong>). Ubiquitin Immunreaktivität ist ein besonderes Merkmal der Lewy - Körperchen - Pathologie im menschlichen Gehirn 20-22. Wir beobachteten Kolokalisation von α-SYN und Ubiquitin an 29 Tage pi in einer Fraktion (± 20%) des α-SYN exprimierenden nigralen Neuronen (5J). Die fibrillären Natur der α-SYN - Aggregate wurde durch Thioflavin S (Thio S) Anfärben 23 ausgewertet. Thio S - positiven Zellen in der SN von 17 Tage nachgewiesen wurden an (5J).
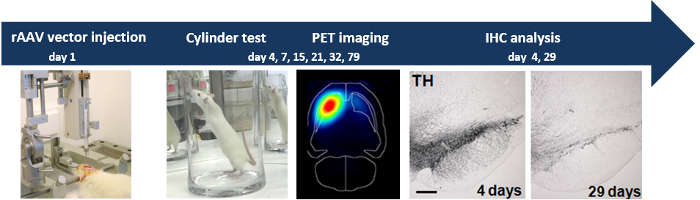
Abb . 1: Stereotactic Injektion von rAAV2 / 7 α-SYN Vektors in progressive Neurodegeneration Stereotactic Injektion von rAAV2 / 7 α-SYN - Vektor in der SN der Ratte induziert die dopaminerge Neurodegeneration durch Verhaltensanalyse gemessen (Zylinder - Test), nicht-invasive PET Bildgebung und IHC-Analyse.d / 53670 / 53670fig1large.jpg "target =" _ blank "> Bitte hier klicken, um eine größere Version dieser Figur zu sehen.

Abbildung 2: Stereotactic Injektion von rAAV2 / 7 - Codierung Vektor α-SYN in der SN der Ratte. (A, B, E) Die Schädelnähte an der Ratte Schädel, definieren die beiden Bezugspunkte: Bregma und Lambda. (C) Ein stereotaxische Atlas des Rattengehirns präsentiert die Region Injektion nämlich die SN. (D) Eine Wistar - Ratte in einem stereotaktischen Kopfrahmen positioniert mit zwei Ohr Bars, einen Mund und eine Nase bar. (F) Der 30 - Gauge - Nadel mit Vektor gefüllt ist in der Position für die Substantia nigra gelegt. (G) Eine kleine ganze ist an der Injektionsstelle gebohrt und die Nadel in Position gebracht. (H) Nach der Injektion der Kopfhaut sti isttched und desinfiziert werden . Bitte hier klicken , um eine größere Version dieser Figur zu sehen.
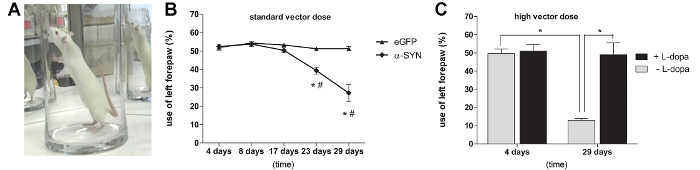
Abbildung 3: rAAV 2/7-vermittelte Überexpression von A53T α-SYN induziert Dopamin-abhängige motorische Defizite (A, B) Cylinder Test zu verschiedenen Zeitpunkten nach der Injektion von rAAV2 / 7 A53T α-syn.. (Mittelwert ± sd, * p <0,05 gegenüber 17 Tagen # p <0,05 eGFP Kontrollen durch ANOVA und Tukey post hoc-Test, n = 5). (C) Cylinder Test zu verschiedenen Zeitpunkten nach der Injektion von rAAV2 / 7 A53T α-SYN (high Vektor Dosis). (Mittelwert ± sd, * p <0.05 4 Tage im Vergleich zu 29 Tage ANOVA und Tukey post hoc-Test, n = 5). Der Test wurde mit oder ohne Verabreichung von Levodopa (L-DOPA) durchgeführt. (Mittelwert ± sd, * p <0.05 nicht-behandelten im Vergleich zu den behandelten Tieren durch ANOVA und Tukey post hoc-Test, n = 5). Nachdruck aus Neurobiologie des Alterns, Vol. 36, Van der Perren et al., Longitudinal Follow-up und Charakterisierung eines robusten Rattenmodell für die Parkinson-Krankheit auf Basis von Überexpression von alpha-Synuclein mit Adeno-assoziierte virale Vektoren, 1543-1558, (2015), mit Genehmigung von Elsevier. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.

Abb . 4: Non-invasive Abbildung von A53T α-SYN induzierte dopaminerge Zelltod Bildgebung DAT PET (A - B) Reihe von horizontalen und coronal slices darstellend mittleren striatalen DAT Bindung von (A) rAAV2 / 7 A53T α-SYN injizierten Tiere bei different Zeitpunkten nach der Injektion (n = 7) und (B) rAAV2 / 7 eGFP injiziert (n = 1) oder 6-OHDA behandelten Kontrolltieren (n = 1) 79 Tage nach der Injektion. Farbbalken zeigen Bindungspotentiale für die DAT. (C) Quantifizierung der DAT Bindung von rAAV2 / 7 A53T α-SYN, rAAV2 / 7 eGFP und 6-OHDA injizierten Tiere zu verschiedenen Zeitpunkten gemessen (Daten Mittelwert ± SD dar). Nachdruck aus Neurobiologie des Alterns, Vol. 36, Van der Perren et al., Longitudinal Follow-up und Charakterisierung eines robusten Rattenmodell für die Parkinson-Krankheit auf Basis von Überexpression von alpha-Synuclein mit Adeno-assoziierte virale Vektoren, 1543-1558, (2015), mit Genehmigung von Elsevier. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
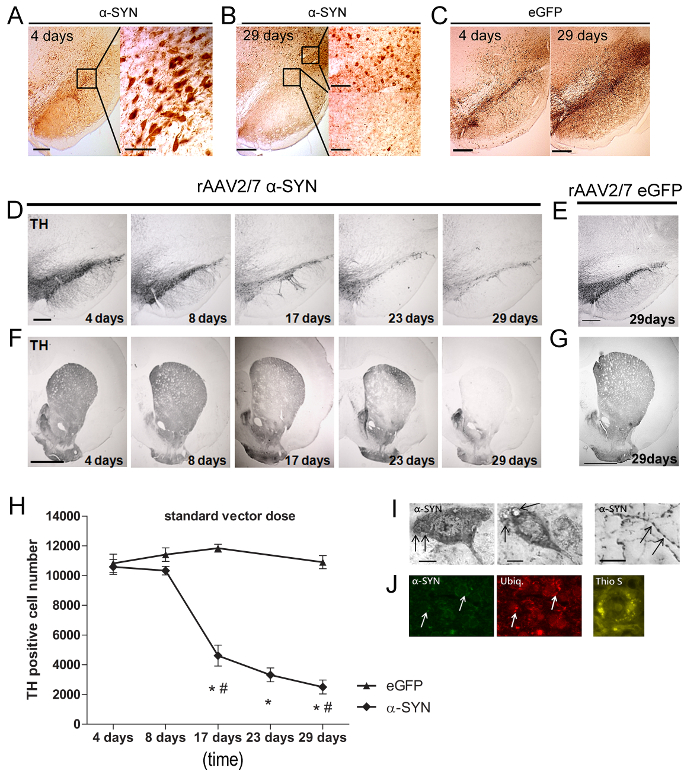
Abbildung 5: rAAV g> 2/7-vermittelte Überexpression von A53T α-SYN induziert dopaminergen Zelltod und Bildung unlöslicher α-SYN positive Aggregate. (A - B) IHC - Färbung zeigen , α-SYN - Überexpression 4 Tage und 29 Tage nach rAAV vermittelten Transfer in Ratte SN. Einsätze zeigen Vergrößerungen des ausgewählten Bereichs. Maßstabsbalken = 400 & mgr; m (Übersicht Bild links), 70 & mgr; m und 200 & mgr; m (Einsätze rechts). (C) IHC - Färbung zeigen eGFP Überexpression 4 Tage und 29 Tage nach rAAV vermittelten Transfer in Ratte SN. Maßstabsbalken = 400 & mgr; m. (D - G) IHC Färbung für TH in der SN und STR zu verschiedenen Zeitpunkten nach der Injektion von (D, F) rAAV2 / 7 α-SYN oder 29 Tage nach der Injektion von (E, G) rAAV2 / 7 eGFP in der SN . Maßstabsbalken a, c = 400 & mgr; m, b, d = 1000 & mgr; m. (H) stereo Quantifizierung der taubener von TH-positiven Neuronen in der SN im Laufe der Zeit nach rAAV2 / 7 A53T α-SYN-Injektion oder rAAV2 / 7 eGFP Steuervektor (Mittelwert ± sd, * p <0,05 im Vergleich zu 8 Tage, # p <0,05 im Vergleich zu eGFP Kontrollen durch ANOVA und Tukey post hoc-Test, n = 5). (I) IHC - Färbung zeigen α-SYN Pathologie, einschließlich zytoplasmatischen Aggregate in der SN und dystrophischen und prall Neuriten in den STR nach intranigral rAAV2 / 7 A53T α-SYN - Injektion. (J) Repräsentative konfokale Bilder von Fluoreszenzdoppelimmunfärbungen für α-SYN (grün) und Ubiquitin (rot) zeigen einen Anstieg der Co-Lokalisation im Laufe der Zeit (Pfeile). Maßstabsbalken c = 50 & mgr; m. Thioflavin S-Färbung von SN 29 Tage nach Injektion von rAAV2 / 7 A53T α-syn. Maßstabsbalken D = 30 & mgr; m. Nachdruck aus Neurobiologie des Alterns, Vol. 36, Van der Perren et al., Longitudinal Follow-up und Charakterisierung eines robusten Rattenmodell für die Parkinson-Krankheit auf Basis von Überexpression von alpha-Synuclein mit Anzeigeeno-assoziierte virale Vektoren, 1543-1558, (2015), mit Genehmigung von Elsevier. Bitte klicken Sie hier , um eine größere Version dieser Figur zu sehen.
Diskussion
Es gibt mehrere wichtige Schritte innerhalb des Protokolls. Der Vektor-Titer sowie der Vektor Reinheit beeinflusst direkt die phänotypische Ergebnis des Modells. Übermäßige Vektor-Titer oder unzureichend gereinigte Vektor Chargen können in nicht-spezifische Toxizität führen. Daher ist die Verwendung von hochwertigen Vektor Chargen und geeignete Kontrollvektoren unverzichtbar. Ferner wird die genaue Positionierung des Kopfes der Ratte in den stereotaktischen Rahmen und die genaue Bestimmung der Koordinaten essentiell in der Substantia nigra Targeting. das Loch in den Schädel an der Stelle der Injektion Nach dem Bohren ist es wichtig, dass die Nadel gerade in der Ratte Gehirn einzusetzen, ohne Ränder zu berühren. Die Nadel sollte langsam entfernt werden, nachdem der virale Vektor Injizieren Vektor Auslaufen zu verhindern. Schließlich nach dem Heften, sollte die Kopfhaut mit 1% jodium in 70% Isopropanol desinfizieren beißende der Stiches von anderen Tieren zu vermeiden. Alternativ können auch andere antiseptisch Reagenzienkann verwendet werden.
Das beschriebene Verfahren kann auch eine rAAV2 / 7 α-SYN-Mäuse - Modell für die Parkinson-Krankheit 24 zu entwickeln , verwendet werden. In Mäusen injiziert man ein Volumen von 2 ul rAAV-Vektor in der SN. Im Vergleich zu Ratten, Mäuse DN scheint etwas weniger empfindlich zu sein, die Überexpression zu & agr; SYN, was zu einer verzögerten Manifestation von Neurodegeneration. Darüber hinaus werden andere Regionen im Gehirn (zB Striatum, Hippocampus, Cortex, etc.) ausgerichtet sein. Die Koordinaten für die verschiedenen Hirnregionen in den stereotaktischen Atlas finden. Optimierung der Koordinaten kann durch chinesischen Tinte oder durch die Verwendung eines viralen Vektors , codierend ein Reportergens (zB eGFP) durchgeführt werden. Verschiedene Vektoren Systeme (rAAV, LV, etc.) kann in Abhängigkeit von der Anwendung verwendet werden.
Diese Technik hat die Einschränkung, dass jedes Tier einzeln injiziert werden muss. Daher ist eine ausgebildete Person sollte die Injektionen durchführen, um zu minimize Variationen zwischen verschiedenen Tieren. Eine weitere Einschränkung besteht darin, dass das Verfahren zeitaufwendig ist (wenn von einer ausgebildeten Person ausgeführt dauert es etwa 45 Minuten pro Tier). Nur acht bis zehn Tieren kann an einem Tag injiziert werden.
Viraler Vektor-vermittelte Genübertragung ermöglicht spezifisches Targeting von Hirnregionen. Verwendung von viralen Vektoren können hohe Transgen-Expressionsniveaus erreicht werden, die seit Erkrankung entscheidend Auftreten und die Schwere auf der Ebene von α-SYN Ausdruck abhängt. Außerdem können verschiedene Dosen angewendet werden, die in einem Tiermodell führt die Anzeige langsamer oder schneller Kinetik der Neurodegeneration. unter Verwendung des gleichen Vektorpräparation Schließlich kann diese Technik verwendet werden, um Modelle in verschiedenen Tierarten und Stämme zu erzeugen.
Dieses Verfahren verwendet werden können virale Vektoren als auch Toxine (zB 6-OHDA) in unterschiedlichen Regionen des brain.The Transgen durch den Vektor kodiert zu liefern kann ein Reporterprotein, ein therapeutisches p seinrotein für Gentherapie - Anwendungen 8-10 oder eine Krankheit verwandtes Protein für Krankheitsmodelle verwendet 11-14. Diese Technik kann verwendet werden, um neue Tiermodelle zu entwickeln, die für die präklinische Drogentests ermöglichen und kann bei der Untersuchung der molekularen Mechanismen der Parkinson-Krankheit sowie viele andere neurodegenerative Erkrankungen von Vorteil sein.
Offenlegungen
Die Autoren erklären, dass es keine tatsächlichen oder potenziellen Interessenkonflikt.
Danksagungen
Die Autoren danken Joris Van Asselberghs und Ann Van Santvoort für ihre hervorragende technische Hilfe. Forschung wurde von der IWT-Vlaanderen (IWT SBO / 80020), der FWO Vlaanderen (G.0768.10), von der EG-FP6 Programm "DiMI '(LSHB-CT-2005-512146), das RP7 FTE-Projekt MEFOPA (Health finanziert -2.009-241.791), das RP7-Programm "inMind" (HEALTH-F2-2011-278850), die KU Leuven (IOF-KP / 07/001, OT / 08 / 052A, IMIR PF / 10/017), und die MJFox Foundation (Targetvalidierung 2010). A. Van der Perren und C. Casteels sind ein Postdoc-Stipendiaten des Flämischen Fonds für wissenschaftliche Forschung. K. Van Laere ist ein leitender klinischer Fellow des Flämischen Fonds für wissenschaftliche Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| Female 8 weeks old Wistar rats | Janvier | / | 200-250 g |
| Ketamine (Nimatek) | Eurovet animal health | 804132 | |
| Medetomidine (Dormitor) | Orion-Pharma/ Janssen Animal Health | 1070-499 | |
| Local anesthetic for scalp and ears: Xylocaïne 2% gel | Astrazeneca | 0137-547 | |
| Terramycine | Pfizer | 0132-472 | |
| Buprénorphine (Vetergesic) | Ecuphar | 2623-627 | |
| Jodium 1% isopropanol | VWR | 0484-0100 | |
| stereotactic head frame | Stoeling | / | |
| Hamilton Syringe (30 gauge -20 mm -pst 2) | Hamilton/ Filter Service | 7803-07 | |
| atipamezole (Antisedan) | Orion-Pharma/Elanco | 1300-185 | |
| rAAV A53T α-SYN vector | LVVC, KU Leuven | / | https://gbiomed.kuleuven.be/english/research/50000715/laboratory-of-molecular-virology-and-gene-therapy/lvvc/ |
| sodium pentobarbital (Nembutal) | Ceva Santé | 0059-444 | |
| microtome | Microm | HM650 | |
| rabbit polyclonal synuclein Ab | Chemicon | 5038 | 1:5,000 |
| rabbit polyclonal TH Ab | Chemicon | 152 | 1:1,000 |
| Lutetium oxyorthosilicate detector-based FOCUS 220 tomograph | Siemens/ Concorde Microsystems | / | |
| radioligand: 18F-FECT | In house | / | |
| L-dopa: Prolopa 125 | Roche | 6 mg/kg i.p. | |
| DMEM, Glutamax | Life Technologies | N° 31331-093 | |
| Foetal bovine serum | Life Technologies | N° 10270-106 | |
| 25 kD linear polyethylenimine (PEI) | Polysciences | / | |
| OptiPrep Density Gradient Medium: Iodixanol | Sigma | D1556-250ML | |
| Optimen | Life Technologies | N° 51985-026 | |
| Paxinos 1 watston steretactic atlas, fourth Edition | Elsevier | / |
Referenzen
- Magen, I., Chesselet, M. F. Genetic mouse models of Parkinson's disease The state of the art. Prog Brain Res. 183, 53-87 (2010).
- Masliah, E., et al. Dopaminergic loss and inclusion body formation in alpha-synuclein mice: implications for neurodegenerative disorders. Science. 287, 1265-1269 (2000).
- Freichel, C., et al. Age-dependent cognitive decline and amygdala pathology in alpha-synuclein transgenic mice. Neurobiol Aging. 28, 1421-1435 (2007).
- Fleming, S. M., Fernagut, P. O., Chesselet, M. F. Genetic mouse models of parkinsonism: strengths and limitations. NeuroRx. 2, 495-503 (2005).
- Kahle, P. J., et al. Selective insolubility of alpha-synuclein in human Lewy body diseases is recapitulated in a transgenic mouse model. Am J Pathol. 159, 2215-2225 (2001).
- Chesselet, M. F., Richter, F. Modelling of Parkinson's disease in mice. Lancet Neurol. 10, 1108-1118 (2011).
- Deroose, C. M., Reumers, V., Debyser, Z., Baekelandt, V. Seeing genes at work in the living brain with non-invasive molecular imaging. Curr Gene Ther. 9, 212-238 (2009).
- Manfredsson, F. P., et al. rAAV-mediated nigral human parkin over-expression partially ameliorates motor deficits via enhanced dopamine neurotransmission in a rat model of Parkinson's disease. Exp Neurol. 207, 289-301 (2007).
- Vercammen, L., et al. Parkin protects against neurotoxicity in the 6-hydroxydopamine rat model for Parkinson's disease. Mol Ther. 14, 716-723 (2006).
- Winklhofer, K. F. The parkin protein as a therapeutic target in Parkinson's disease. Expert opinion on therapeutic targets. 11, 1543-1552 (2007).
- Kirik, D., et al. Parkinson-like neurodegeneration induced by targeted overexpression of alpha-synuclein in the nigrostriatal system. J Neurosci. 22, 2780-2791 (2002).
- Kirik, D., et al. Nigrostriatal alpha-synucleinopathy induced by viral vector-mediated overexpression of human alpha-synuclein: a new primate model of Parkinson's disease. Proc Natl Acad Sci U S A. 100, 2884-2889 (2003).
- Lauwers, E., et al. Neuropathology and neurodegeneration in rodent brain induced by lentiviral vector-mediated overexpression of alpha-synuclein. Brain pathology. 13, 364-372 (2003).
- Klein, R. L., King, M. A., Hamby, M. E., Meyer, E. M. Dopaminergic cell loss induced by human A30P alpha-synuclein gene transfer to the rat substantia nigra. Hum Gene Ther. 13, 605-612 (2002).
- Vander Perren, A., Van den Haute, C., Baekelandt, V. Viral Vector-Based Models of Parkinson's Disease. Curr Top Beh Neurosci. , (2014).
- Van der Perren, A., et al. Longitudinal follow-up and characterization of a robust rat model for Parkinson's disease based on overexpression of alpha-synuclein with adeno-associated viral vectors. Neurobiol Aging. , (2014).
- Van der Perren, A., et al. Efficient and stable transduction of dopaminergic neurons in rat substantia nigra by rAAV 2/1, 2/2, 2/5, 2/6.2, 2/7, 2/8 and 2/9. Gene Ther. , (2011).
- Schallert, T., Fleming, S. M., Leasure, J. L., Tillerson, J. L., Bland, S. T. CNS plasticity and assessment of forelimb sensorimotor outcome in unilateral rat models of stroke, cortical ablation, parkinsonism and spinal cord injury. Neuropharmacology. 39, 777-787 (2000).
- Soueid, J., Nokkari, A., Makoukji, J. Techniques and Methods of Animal Brain Surgery: Perfusion, Brain Removal, and Histological Techniques. Brain Neurotrauma: Molecular, Neuropsychological, and Rehabilitation Aspects. Frontiers in Neuroengineering. , (2015).
- Dale, G. E., et al. Relationships between Lewy bodies and pale bodies in Parkinson's disease. Acta Neuropathol. 83, 525-529 (1992).
- Dawson, V. L. Neurobiology of flies and mice. Science. 288, 631-632 (2000).
- Dawson, T., Mandir, A., Lee, M. Animal models of PD: pieces of the same puzzle?. Neuron. 35, 219-222 (2002).
- LeVine, H. Quantification of beta-sheet amyloid fibril structures with thioflavin T. Methods Enzymol. 309, 274-284 (1999).
- Oliveras-Salva, M., et al. rAAV2/7 vector-mediated overexpression of alpha-synuclein in mouse substantia nigra induces protein aggregation and progressive dose-dependent neurodegeneration. Mol Neurodegener. 8, (2013).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten