Method Article
Используя цифровой капли ПЦР для обнаружения гена BRAF V600E Мутации в формалине фиксированной в парафин Ссылка на стандарт клеточных линиях
В этой статье
Резюме
Цель этого видео, чтобы продемонстрировать, как выполнить автоматизированное извлечение ДНК из фиксированных формалином парафиновых срезах (FFPE) эталонных стандартных клеточных линий и анализа цифровых капель ПЦР (ddPCR) для обнаружения редких мутаций в клинических условиях. Обнаружение мутаций в образцах FFPE демонстрирует клиническую полезность ddPCR в образцах FFPE.
Аннотация
ddPCR is a highly sensitive PCR method that utilizes a water-oil emulsion system. Using a droplet generator, an extracted nucleic acid sample is partitioned into ~20,000 nano-sized, water-in-oil droplets, and PCR amplification occurs in individual droplets. The ddPCR approach is in identifying sequence mutations, copy number alterations, and select structural rearrangements involving targeted genes. Here, we demonstrate the use of ddPCR as a powerful technique for precisely quantitating rare BRAF V600E mutations in FFPE reference standard cell lines, which is helpful in identifying individuals with cancer. In conclusion, ddPCR technique offers the potential to precisely profile the specific rare mutations in different genes in various types of FFPE samples.
Введение
Накопление генетических мутаций в ключевых регуляторных генов изменяет нормальную клеточную программирования как клеточной пролиферации, дифференцировки и выживания, ведущие к раку 1. РАН-РАФ-МАР-киназы пути посредником клеточные ответы на сигналы роста. Онкогенный BRAF мутации могут привести мутаций водитель в гене BRAF, которая может привести к BRAF онкобелок чтобы стать гиперактивными 2. Мутации в гене BRAF также привести к гиперактивного передачи сигнала через МЕК и ERK 3, который, в свою очередь, приводит к чрезмерному росту и пролиферации клеток, независимо от фактора роста-опосредованной регуляции 4-6.
Некоторые инструменты доступны для мутаций ДНК профилирования, таких как количественных реального времени BRAF V600E мутаций в фиксированных формалином, парафин (FFPE) эталонных стандартных клеточных линий по ddPCR. ddPCR является метод ПЦР на основе количественного абсолютнойпредлагая более высокую точность по сравнению с обычной количественной ПЦР в реальном времени (КПЦР) 7,8. ddPCR также обеспечивает более высокую разрешающую способность и точность для обнаружения редких мутаций в ДНК-матриц, что позволяет более информативный исследования рака и диагноз 9. Дополнительные преимущества по сравнению с обычными ddPCR кПЦР включают его повышенную чувствительность и точность при изучении низко шаблонов числа копий 10-12. При этом протокол для автоматического извлечения ДНК из опорных FFPE стандартных клеточных линий, за которыми следуют определения наличия или отсутствия BRAF V600E мутаций ddPCR продемонстрирована. Использование программного обеспечения для анализа данных и графического представления результатов также описаны. Вся процедура относительно проста и полностью зависит от количества образцов для профилирования и количества обычных машинах ПЦР и ddPCR доступной.
Ниже описаны стандартные протокол процедуры BR Ф. V600E-позитивных FFPE Ссылка на стандарт клеточные линии (HD598, HD593, HD617, HD273 и дикого типа (WT)) выполняется в полностью автоматическом приборе с помощью подготовки системы (ТПС) протокол тканей. Впоследствии, образцы изолированных ДНК анализировали на наличие BRAF V600E мутаций с использованием системы ddPCR. Целевой анализ мутации выполняется после всех образцов были профилированные и данные были загружены в программное обеспечение для анализа данных. В зависимости от количества образцов / исследуемых группах, анализ данных может потребовать от одного до нескольких часов. Экспериментальный компонент методологии требует точности в обработке ДНК иrological Пипетки и пипетки, видео Юпитер Наука Образование объясняя больше о о контексте пипетки "> пипетки в 96-луночных планшетах, в то время как анализ данных осуществляется с использованием программного обеспечения.
протокол
1. ДНК Извлечение из FFPE Ссылка на стандарт клеточных линиях
Примечание: Для этой процедуры, выделения ДНК проводили из FFPE справочных стандартных клеточных линий (HD598 HD593, HD617, HD273, и дикого типа (WT)) с использованием тканей ДНК комплект изоляции FFPE, как описано ниже в протоколе. Автоматизированное извлечение ДНК было достигнуто в соответствии с инструкциями изготовителя для полного выделения ДНК.
- Использование микротома и исходный блок FFPE, вручную приготовить свежие секции до экстракции и анализа ДНК, в соответствии с установленными процедурами. Убедитесь, что входная выборка для раздела (ов) ткани анализировали, не превышает в общей сложности толщиной 10 мкм, а площадь поверхности не превышает 600 мм 2 для одной секции.
1.2 Протокол TPS
Примечание: Объемы, представленные в таблице 1, соответствуют минимума, необходимого для обработки 48 образцов, а также порядокПоказано, в соответствии с руководящими принципами, TPS. Перед началом эксперимента успокоиться образцы FFPE в электронной трубки путем центрифугирования при 600 мкг, чтобы избежать потери образцов при автоматизированной программы.
- Включите автоматизированной инструмента выделения ДНК и компьютером. Откройте программное обеспечение управления Выполнить и вставьте лоток автоматической загрузки в TPS палубы грузового пространства.
- Разлить реагентов в соответствующие прогибов, как показано на рисунке 1.
- Поместите 4 образцы (BRAF WT, BRAF V600E 50%, 5% и 1%) в стойках образец носителя.
- Поместите кончик коробки в желобах в колонках 2 и 3, и проверить советы на наличие более чем одного фильтра на кончике, который прервет перспективе.
- Обеспечить надлежащее смешивание буфера для лизиса и промывочного буфера путем обращения их в 3-5 раз и загрузите их в соответствующих прогибов в колонке 4 (рисунок 1).
- После обращения в течение нескольких раз или мягким Vortexing, загружать элюирующего буфера, магнитные шарики, и FFPE буфера в небольших впадин в колонке 5, в результате чего 1 слот пустым, если не указано (Рисунок 1, таблица 1).
- Загрузите 2 мл глубокое лунками (DWP) на носитель плиты (рисунок 1).
- Выполните следующие заключительные шаги перед началом запуска:
- Открывать все трубы и желоба реагентов. Убедитесь, что достаточный потенциал имеется в бутылке жидких отходов. Убедитесь, что бутылка твердых отходов пуст и выстроились с биологической мешок. Убедитесь, что наконечник извлечения пластины по центру сборки мусора.
- Закройте переднюю крышку.
- Запустите программу. Откройте файл NA_Prep_Main_MLSTARlet.med.
- Нажмите кнопку "Пуск". Статус прибор перейти от холостого хода до запуска.
- Введите число образцов для этого пробега. Выберите нужный метод для этого пробега (ДНК = 0). Введите позицию первого высокой обумэ наконечник, выбрав "1", если все лотки полны. Введите позицию первого стандартным наконечником громкости, выбора "1", если все лотки полны.
Примечание: Прибор будет работать с помощью автоматизированных шагов без вмешательства пользователя. Подробное рабочий процесс показан на рисунке 2. После того, как эксперимент закончен, отходы реагента и советы вводят в сборке мусора. - Количественно очищенной геномной ДНК с помощью флуорометрического метод.
Примечание: образцы ДНК, которые содержат минимальную концентрацию 3,3 нг / мкл, подвергают ddPCR анализа (Раздел 2).
2. ДНК Мутация профилирования: ddPCR протокол
Примечание: Протокол мутаций ДНК профилирования состоит из 3 основных этапов: 1) капли поколения, 2) усиления обычной ПЦР, 3) чтения капли и 4) мутации ДНК профилирования.
2.1. Капли поколение
Примечание: ddPCR СУПЕРМИКС являетсярекомендуется для ddPCR, как это смесь содержит реагенты, необходимые для капель поколения.
- Чтобы избежать загрязнения, следуйте стандартные меры предосторожности, такие, как в перчатках, с использованием чистой ПЦР капот, чистые пипец, и низким содержанием белка привязки трубы.
- Убедитесь, что минимальная концентрация образца геномной ДНК человека составляет 3,3 нг / мкл. Примечание: количество очищенного концентрации образца ДНК будет варьироваться в зависимости от анализа обнаружения частоты% мутаций.
- Соберите реакционных смесей в ПЦР 96-а. Разморозить и уравновешивают компоненты реакции до комнатной температуры. Подготовка ПЦР реакции путем объединения 2X ddPCR Supermix (10 мкл) и 20 праймеров (вперед и назад, 900 нм) и зонда (250 нм) с каждого очищенного образца ДНК (66ng / 2 мкл) составит до 20 мкл дистиллированной воды (в в соответствии с протоколом генератора капель)
- Вихря тщательно перемешать, чтобы обеспечить однородность и кратко центрифуги для сбора содержимого в нижней части трубки перед нанесением. Нагрузка 20 & #181; л на картридж для формирования капель.
- Работа генератора капель, за рекомендованной производителем протоколом
- Вставьте картридж в держатель с выемкой в патроне, расположенной на верхней левой стороне держателя. Добавьте 20 мкл реакционной смеси, содержащей образцы в середине, и 70 мкл генератора нефти в донных скважин.
- Приложить прокладку в верхней части картриджа. Убедитесь, что прокладка надежно подключили на обоих концах держателя; в противном случае, давление, достаточное для генерации капелек не будут достигнуты.
- Откройте генератор капель, нажав зеленую кнопку на верхней части прибора и вставьте картридж. Когда держатель находится в правильном положении, и власть (левый и правый) и держатель (средний правый) горит зеленым цветом.
- Нажмите верхнюю кнопку на приборе, чтобы закрыть дверь и начать поколение капель. Примечание: После нажатия бutton, многообразие позиционирует себя более выпускных скважин, рисунок масло и образцы по микроканалов, где создаются капли. Капли текут в капле хорошо, где они накапливаются. Индикатор капли света (справа) мигает зеленым после 10 сек, чтобы указать, что капля поколения продолжается.
- Когда поколение капель завершена, все 3 загорается индикатор изменится на непрерывный зеленый; открыть дверь нажатием кнопки, и снимите держатель с устройства. Удалить одноразовый прокладку от держателя и выбросьте его. Примечание: Верхние скважины картриджа содержат капельки, и в среднем и нижнем скважин почти пуст, с небольшим количеством остаточной нефти.
2.2. Подготовка к ПЦР
- Для каждого образца, пипетки из 40 мкл содержимого капель сверху а патронов в одной скважине рекомендуемого 96-луночный ПЦР пластины, как указано в протоколе прибора производителя. НетTe: с помощью пипетки многоканальный идеально подходит для передачи капель эмульсии. Медленно и нежно стремление капель рекомендуется свести к минимуму капель сдвиг во время передачи.
- Уплотнение ПЦР пластины с фольгой сразу после передачи капельки, чтобы избежать испарения. Использование прокалыванию плиты фольги уплотнения, которые совместимы с планшетов ПЦР и игл в считывающем капель. Следуйте инструкциям в руководстве по ПЦР пластины герметик руководства.
- Установка температуры планшетов до 180 ° С и времени на 5 сек.
- Нажмите на стрелку, чтобы открыть дверь в трее. Расположите опорный блок на лоток стороной 96-а вверх. Поместите 96-луночного планшета на опорном блоке и обеспечить, чтобы все планшетов совмещен с опорным блоком.
- Обложка 96-луночного планшета с 1 листе прокалываемого печатью фольги. После того, как 96-луночный планшет закреплен на опорном блоке и покрыта прокалываемого закупоривающего фольги, нажмите кнопку уплотнения. Лоток закроетсяи заварены будет инициировать.
- Когда заварены завершена, дверь открывается автоматически; удалить пластину из теплового блока для термоциклирования, а затем удалить нагревательный блок.
- Убедитесь, что все скважины в пластине запечатаны, проверяя, углубления в фольге очевидны друг хорошо. После запечатаны, пластина готова для термоциклирования.
- После того, как капли удаляются, нажмите на защелки на держателе картриджа, чтобы открыть его. Удалить пустой картридж и выбросить его.
- Выполните обычную ПЦР-амплификации, следуя параметры, описанные в таблице 2.
2.3 капли чтение (в соответствии с рекомендованной производителем протоколом)
Примечание: После ПЦР-амплификации нуклеиновой кислоты-мишени в каплях, капли читатель инструментом анализа каждой капли по отдельности с помощью системы обнаружения 2-цветной 13. Мы, как правило, устанавливается для обнаружения FAM апд VIC репортер флуорофоры.
- Нажмите кнопку "Флеш систему", чтобы премьер-читателя капель и сделать его готовым для анализа ddPCR.
- Загрузите пластину в считывающее капель и нажмите "начать". Читатель капель всасывает каждую пробу, singulates капли и потоки их в одном файле мимо детектора 2-цвета. Детектор считывает капель перечислять положительные и отрицательные образцы.
- Когда капля чтение будет завершена, откройте дверь и снимите держатель пластин от блока. Удалить 96-луночного ПЦР планшета с держателя и выбросить его.
- Для поддержания, заменить капли чтения масло и опорожнить емкость отходов по мере необходимости. Добавьте 50 мл 10% хлорной к бутылке отходов, чтобы предотвратить рост микробов.
2.4 ДНК мутация профилирование (как в рекомендованной протокола производителя)
Примечание: ПЦР-положительные и отрицательные ПЦР-капли подсчитываются обеспечить абсолютную quantificвания целевых мутаций BRAF V600E ДНК в цифровой форме, с использованием программного обеспечения для анализа данных.
- Нажмите Setup, чтобы ввести информацию о образцов, проб, и экспериментов.
- В окне Настройка, загрузите тарелку (filename.qlp), затем нажмите кнопку Анализ, чтобы открыть и анализировать данные. Интерфейс анализ данных разделены на три окна: Результаты Таблица, Ну Selector и обработанных данных / графический дисплей.
- В обработанном окне данных, данные о концентрации для каждого целевого появляются в лунках в пластине карте и приведены в таблице результатов. Нажмите Концентрация визуализировать данные в концентрационных участков.
Результаты
Для нашего анализа ddPCR, мы изучали опорные мутация FFPE стандартных клеточных линий BRAF V600E. Читатель капель подключается к программное обеспечение для анализа данных компьютера под управлением ноутбук. Каждый капель определяется на основе флуоресцентного амплитудой, будучи положительным или отрицательным. Программное обеспечение, производителем также позволяет определяемым пользователем отсечки, который необходимо ввести, чтобы определить порог между положительным и отрицательным капель. Число положительных и отрицательных капель в образце используется для расчета концентрации целевого точки зрения копий / мкл.
Флуоресценции и обрабатываются в двумерной точечной дисплее участка, программного обеспечения на заказ был использован, чтобы привлечь соответствующие ворота для каждой капли конечной кластера, а количество капель в пределах каждого ворот подсчитывали. Как показано на рисунке 3А, капли представлена синими точками (FAM флуоресценции сигнала) над светотеневой границы для всех SAMPLES (розовая линия) оказались положительными на мутантного гена BRAF V600E. Капли, представленные синих точек в BRAF WT (NTC; дорожка 2) образец может быть связано с неспецифическим сигнала (ложный положительный). Ложные положительные сигналы (BRAF WT) были нормализованы с другими образцами мутации. Как показано на фиг.3В, капли WT BRAF представлены зеленых точек (ВИК сигнала флуоресценции). В обоих участках, серые точки на нижней рассматриваются в качестве фона флуоресценции. Общие мутантные частот аллелей были рассчитаны с использованием данных, показанных на рисунке 3C, на основе относительных процентах WT BRAF и шаблонов BRAF V600E обнаруженных. Полученные результаты ddPCR содержать счетчики капель событий и рассчитывается дикого типа и мутанта молекула ДНК рассчитывает на BRAF V600E (50%, 10%, 5%, 1%, 0,5%, 0,1% и 0,05%) образцы, рассчитанные с помощью ниже выше формуле.
% Мутантного частоты = (Мутанткопия / (дикого типа + Мутант копия)) х 100
Соответственно, BRAF V600E мутации были идентифицированы и проверены с эталоном (BRAF WT). Определено мутация BRAF V600E аллельные частоты 50%, 10%, 5%, 1%, 0,5%, 0,1% и 0,05% были использованы для тестирования чувствительность и воспроизводимость системы ddPCR. Из нашего анализа с известными концентрациями образцов, мы подтвердили, что ddPCR способен обнаружить цене как 0,05% от мутации BRAF V600E. Обнаружение ложных срабатываний мутанта Количество в НТК или WT может возможно быть связано с неспецифическим зонда гидролиза, как сообщалось ранее 14. Обнаружение более двух копий в образце была считается положительным в опухолевой ткани 15.

Рисунок 1. Схематическое представление описания реагента и пробы нагрузку в подготовке для автомат omated выделения ДНК инструмент. Поместите образцы в носителе стоек и дозировать реагенты в соответствующих прогибов, как упоминалось. Используя автоматизированную протокол TPS, который поддерживает несколько типов образцов, обеспечивает точное и надежные результаты с максимальной производительностью. Re-печатается с разрешения Siemens Healthcare Diagnostics. (любезность Siemens Healthcare Diagnostics).

Рисунок 2. Схематическое представление ткани Подготовка системы Workflow для автоматизированного выделения ДНК. Полностью автоматизированная процедура выделения ДНК для FFPE тканей разделов, включая негативные шаги отбора парафина, ткани вывоза мусора и позитивных шагов выбора связывания и элюирования показаны. Re-печатается с разрешения Siemens Healthcare Diagnostics. (любезность Siemens Healthcare Diagnostics).
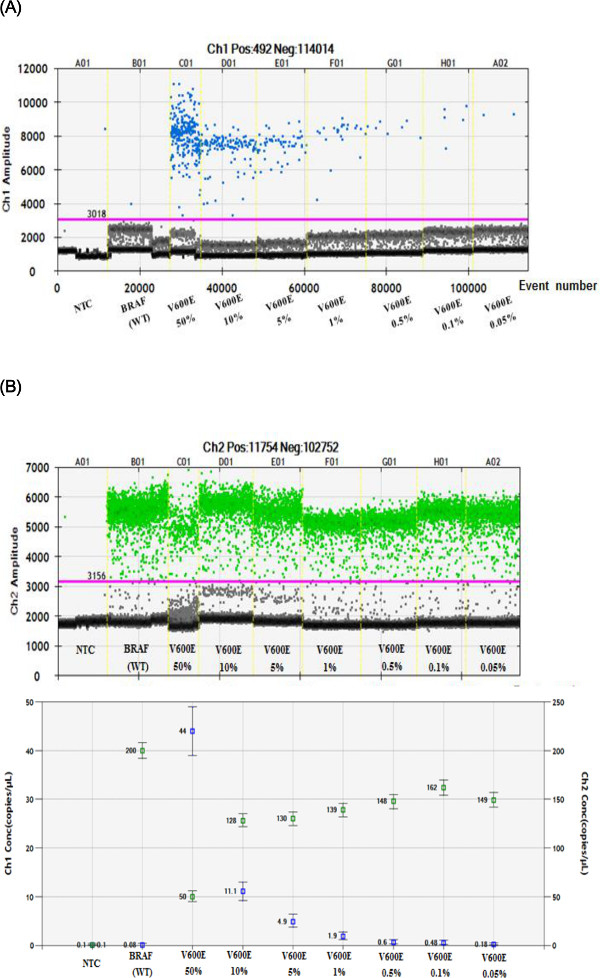
Рисунок 3. Использование системы ddPCR для точного количественного определения BRAF V600E Мутация в FFPE эталонных образцов стандарт клеточной линии. (A, B) Визуализация положительных амплитуд флуоресценции в 1D участков (1dot -1droplet). Синие точки (А, FAM положительный) представляют мутантные V600E-позитивных капельки BRAF, а зеленые точки (B, VIC положительный) представляют -позитивных капельки WT BRAF. Это определение дает возможность точного количественного мутации в FFPE справочных стандартных клеточных линий. Розовый линия порог дискриминации между положительными и отрицательными сигналами капель. (С) Дробная обилие график показывает синие маркеры, указывающие на концентрацию (копий / мкл) мутации BRAF V600E, изеленые маркеры указывают на концентрацию (копий / мкл) BRAF (WT). Все бары ошибках, генерируемые программным обеспечением для анализа данных представляют собой 95% доверительный интервал.
| Реагенты | Объем (мл) |
| Буфер для лизиса | 106 мл |
| Промывочный буфер 1 | 101 мл |
| Промывочный буфер 2 | 72 мл |
| Промывочный буфер 3 | 106 мл |
| Буфера для элюции | 19 мл |
| Магнитные шарики | 8 мл |
| FFPE буфер | 15 мл |
| К Протеиназа | 3,3 мл |
Таблица 1. Общий объем реагентов (TPS комплект) требуется для экстракции ДНК с 48 образцов.
| Велоспорт Шаг | Температура | Время | # Циклы |
| Фермент активации | 95 ° С | 10 мин | 1 |
| Денатурация | 94 ° С | 30 сек | 40 |
| Отжиг / расширение | 60 ° С | 1 мин * | |
| Держать | 98 ° С | 10 мин | 1 |
| Держать | 4 ° С | Навсегда | 1 |
| * Настройка параметров скорости разгона до 2-2,5 ° C / сек. Используйте подогревом крышку установить до 105 ° C и установить объем пробы 40 мкл для | |||
Таблица 2. Обычные условия ПЦР термоциклирования
Обсуждение
Здесь мы выделяем применимость ddPCR и изоляцию ДНК из FFPE справочных стандартных образцов клеточных линий для конкретной оценки мутаций гена. В этом исследовании, TPS автоматизированный метод выделения ДНК используется, которые могут быть легко адаптированы, автоматизированная, и может вместить до 48 различных образцов одновременно, что позволяет более крупных экспериментов и нижней изменчивости. Одним из ограничений выделения ДНК в данной работе является то, что каждый образец FFPE уникальна, и будет меняться друг с другом в поверхностных загрязнений, микробной флоры, и / или генетических фонов человека. В целом, экстрагируют качество и количество ДНК и успех всей геномной амплификации ДНК зависят от различных параметров, до, во время и после экстракции. Они включают, тип и количество ткани, тип фиксатора, используемого для сохранения ткани, продолжительность фиксации, возраст парафинового блока и хранения, а также длину требуемого отрезка подлежащей анализу ДНК 16. Удаление парафина из ткани является наиболее важным шагом для успешного извлечения, как нерастворенным парафин приводит к ухудшению качества выборки. Во капли поколения, необходимо позаботиться, чтобы предотвратить образование пузырьков - это еще один важный шаг для успешного обнаружения мутаций. Учитывая образца к образцу изменения, которые могли бы возникнуть между популяциями образца и на основе мотива эксперимента, некоторые изменения в процедуре может потребоваться для получения желаемого результата.
Еще одним преимуществом является то, что выделение ДНК и ddPCR проводится с использованием автоматизированных систем в данном протоколе, и, следовательно, можно пренебречь ошибок и вмешательства пользователя является минимальным. Разделительный целого генома-амплифицированной ДНК из парафиновых срезах ткани / клеток получали с использованием системы TPS. Одним из недостатков при помощи автоматизированной системы выделения ДНК является то, что она не является экономически эффективно использовать небольшое количество образцов. Вместо этого автоматизированной стер, другие стандартные процедуры выделения ДНК может быть также выполнена для небольших образцов
Недавнее исследование указано, что с помощью капель цифровой ПЦР (ddPCR) способен определить относительное количество копий определенной локусов генома даже в присутствии перемешаны нормальной ткани, полученной из тканей FFPE. С помощью серии разбавления управления, Nadauld, Л. и др. Определены пределы обнаружения (LOD) для анализа ddPCR и сообщил его улучшенную чувствительность по минимальным количеством ДНК по сравнению с стандартной ПЦР в реальном времени 17. Здесь FFPE Ссылка на стандарт клеточные линии используются для демонстрации возможности обнаружения мутации системы ddPCR. Результаты системы ddPCR указал на возможность обнаружить редкие мутации частоты аллелей до 0,05% мутаций. В совокупности эти данные указывают на то, что система ddPCR также позволяет количественный анализ процентах различных мутантных аллелей и относительных различий в гетерозиготном клиническом образце опухолис. Большое количество образцов FFPE могут быть проанализированы для конкретных генных мутаций одновременно, и это является оптимальным методом для населения широких генетических исследований.
Наконец, следует учитывать, что мутации частоты представлены здесь абсолютные количественную и не должны рассматриваться как относительное значение частоты мутаций или частоты. ddPCR дисплей обеспечивает абсолютную количественную мутации ДНК-мишени. Эти значения могут быть использованы для проверки мутации частоты образцов, полученных в таких же условиях, и секвенировали в одном регионе. Тем не менее, эти абсолютные значения являются воспроизводимыми и могут быть использованы для количественного сравнения распределения мутаций и частоты, когда оптимальные параметры контролируются. В заключение, ddPCR недавно стала надежной инструмент, который дает абсолютную количественную оценку нуклеиновых кислот, в FFPE и биоптатов, а также может быть дуплексной с эталонными анализов для определения либо нетrmalized концентрации транскриптов или количество копий ДНК.
Раскрытие информации
Мен Ryuri О, Si Юн Ким, Янг и DEUG Ким являются сотрудниками ABION CRO.
Благодарности
Это исследование было поддержано R & D программы для общества Национального исследовательского фонда (ПЗФ), финансируемого Министерством науки, ИКТ и планирование будущего (грант № 2013M3C8A1075908).
Материалы
| Name | Company | Catalog Number | Comments |
| Hamilton MICROLAB STARlet IVD instrument | Siemens | 10701001 | Automated DNA isolation instrument |
| QX200 Droplet Generator | Bio-Rad | 772BR1119 | |
| QX200 Droplet Reader | Bio-Rad | 771BR1497 | |
| Conventional PCR machine capable of ramp-time adjustment | 621BR17718 | ||
| PX1 PCR plate sealer | Bio-Rad | 770BR1575 | |
| QuantaSoft software | Bio-Rad | ||
| DNA isolation kit | |||
| VERSANT Tissue Preparation Reagents Box 1 | Siemens | 10632398 | |
| VERSANT Tissue Preparation Reagents Box 1 | Siemens | 10632399 | |
| CO-RE tips | Siemens | ||
| ddPCR mutation analysis | |||
| ddPCR Supermix | Bio-Rad | BR186-3010 | 2X concentration |
| DG8 cartridge | Bio-Rad | BR186-4008 | |
| Droplet Generator oil | Bio-Rad | BR-186-3005 | |
| Gasket | Bio-Rad | BR186-3006 | |
| Droplet reader oil | Bio-Rad | BR-186-3004 |
Ссылки
- Vogelstein, B., et al. Genetic alterations during colorectal-tumor development. The New England journal of medicine. 319, 525-532 (1988).
- Davies, H., et al. Mutations of the BRAF gene in human cancer. Nature. 417, 949-954 (2002).
- Solit, D. B., et al. BRAF mutation predicts sensitivity to MEK inhibition. Nature. 439, 358-362 (2006).
- Wong, K. K. Recent developments in anti-cancer agents targeting the Ras/Raf/ MEK/ERK pathway. Recent patents on anti-cancer drug discovery. 4, 28-35 (2009).
- Brose, M. S., et al. BRAF and RAS mutations in human lung cancer and melanoma. Cancer research. 62, 6997-7000 (2002).
- Wang, L., et al. BRAF mutations in colon cancer are not likely attributable to defective DNA mismatch repair. Cancer research. 63, 5209-5212 (2003).
- Hindson, B. J., et al. High-Throughput Droplet Digital PCR System for Absolute Quantitation of DNA Copy Number. Anal Chem. 83, 8604-8610 (1021).
- Pinheiro, L. B., et al. Evaluation of a Droplet Digital Polymerase Chain Reaction Format for DNA Copy Number Quantification. Anal Chem. 84, 1003-1011 (1021).
- Jones, M., et al. Low copy target detection by Droplet Digital PCR through application of a novel open access bioinformatic pipeline, 'definetherain'. Journal of virological methods. 202, 46-53 (2014).
- Strain, M. C., et al. Highly precise measurement of HIV DNA by droplet digital PCR. PloS one. 8, e55943(2013).
- Miotke, L., Lau, B. T., Rumma, R. T., Ji, H. P. High sensitivity detection and quantitation of DNA copy number and single nucleotide variants with single color droplet digital PCR. Anal Chem. 86, 2618-2624 (2014).
- Bizouarn, F. Clinical applications using digital PCR. Methods in molecular biology. 1160, 189-214 (2014).
- McDermott, G. P., et al. Multiplexed target detection using DNA-binding dye chemistry in droplet digital PCR. Anal Chem. 85, 11619-11627 (2013).
- Milbury, C. A., et al. Determining lower limits of detection of digital PCR assays for cancer-related gene mutations. Biomolecular detection and quantification. 1, 8-22 (2014).
- Zhu, G., et al. Highly Sensitive Droplet Digital PCR Method for Detection of EGFR Activating Mutations in Plasma Cell-Free DNA from Patients with Advanced Non-Small Cell Lung Cancer. The Journal of molecular diagnostics: JMD. , (2015).
- Fan, H., Gulley, M. L. DNA extraction from paraffin-embedded tissues. Methods in molecular medicine. 49, 1-4 (2001).
- Nadauld, L., et al. Quantitative and Sensitive Detection of Cancer Genome Amplifications from Formalin Fixed Paraffin Embedded Tumors with Droplet Digital PCR. Translational medicine. 2, (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены