Method Article
Создание Анатомически точного и воспроизводимого внутричерепного Ксенотрансплантаты человека опухолей головного мозга
В этой статье
Резюме
Мозг представляет собой уникальное место с качествами, которые не очень хорошо, представленных в пробирке или внематочной анализов. Ортотопическая мышиные модели с воспроизводимыми местоположения и роста характеристик может быть надежно создан с внутричерепных инъекций с использованием стереотаксической фиксации инструмента и шприцевой насос низкого давления.
Аннотация
Ортотопическая моделях опухолей в настоящее время лучший способ изучить характеристики типа опухоли, с и без вмешательства, в контексте живого животного - особенно в местах с уникальными физиологическими и архитектурных качеств, таких как мозг в пробирке и внематочная модели не могу. приходится функций, таких как сосудистой, гематоэнцефалический барьер, обмена веществ, доставки лекарств и токсичности, и множество других факторов. Ортотопическая модели тоже есть свои ограничения, но при надлежащем опухолевые техника клетки интерес может быть точно привиты в ткани, которые наиболее близко имитирует условия в человеческом мозге. Используя методы, которые обеспечивают очень точно отмеренные объемы точно определены места с постоянной скоростью и давлением, мышиных моделях опухолей головного мозга человека с предсказуемыми темпами роста может быть воспроизводимо созданной и подходят для надежного анализа различных мероприятий. Протокол, описанный здесь фокусируется на тэchnical детали проектирования и подготовки к внутричерепной инъекции, выполняя операцию, и обеспечение успешной и воспроизводимый рост опухоли и обеспечивает отправные точки для различных условий, которые могут быть настроены для целого ряда различных моделях опухолей головного мозга.
Введение
В пробирке исследования мозговых клеток опухоли имеют неоценимое значение для рассечения молекулярные механизмы, стимулирующие рост, выживание, миграцию и инвазию раковых клеток; культивированный эксперименты клеток могут определить сигнальные пути, предложить потенциальные терапевтические мишени, и охарактеризовать клеточный ответ к лечению наркозависимости. Но в пробирке системы слишком упрощенным предсказать организменном ответ на фармацевтических препаратов; они не имеют физиологические реакции, иммунные реакции, сотовый микросреду и общую неоднородность живых систем животных. Генно-инженерные модели могут иметь неоценимое значение, если таковой имеется, но существуют молекулярные различия между видами и мышиных клеток не может резюмировать события в человека процессов, что приводит к значительным расхождениям при сравнении моделей животных с клиническими наблюдениями 1. Мышиные модели ксенотрансплантата, включающие подкожного (SQ) инъекции опухолевых линий клеток головного мозга человека под кожу фланг легко выполнитьи измерения; они могут быть использованы для решения последствий генной модификации и медикаментов / доставки, обмена веществ и токсичности. Значительные недостатки, однако, ограничить полезность моделей SQ. Микросреда не резюмировать, что из природной опухоли головного мозга: взаимодействия различных типов клеток и тканей; местный сосудистую, и множество других факторов уникальным для мозга не могут быть воспроизведены. Чтобы более точно воспроизвести уникальную среду из природной опухоли головного мозга и проверить эффекты фармацевтических мер, мыши ортотопическая модель следует использовать. Кроме того, ортотопической способы могут быть использованы как часть генной инженерии подхода, в котором первичные не-раковых клеток человека (дифференцированного или клетки-предшественники) являются генетически модифицированными и вводят в соответствующем месте мыши, с или без стромальных клетках человека, в результате чего опухолей аналогично тому, которое наблюдалось в организме человека 1.
В этой статье описываетсяМетодология точно и воспроизводимо создавать опухолей головного мозга у мышей. Используя эту технику, пользователь может точно вводить Небольшую аликвоту клеток, взвешенных в указанное место в лобно-теменно-височной области коры головного мозга мыши. Смертность мышей крайне низка; в наших руках, не мыши не умерли от хирургических осложнений после 185 процедур. Характеристики полученного опухоли можно сравнить с тем из типичных клинических опухолей человека; Например: скоростью роста, степень некроза, степени инвазии, неоднородностью типа клеток, наличие митотических клеток, маркеры пролиферации и апоптоза, и т.д. клеточных линий или с разбивкой ткани или образцы опухолевых человека может быть оценена на основе их способности моделировать реальную клиническую картину. Фармацевтика, выбирается на основе их деятельности в культуре клеток, могут быть проверены в контексте функционирующей метаболизма, сердечно-сосудистой системы, и гематоэнцефалический барьер, как они существуют в животной обременены остроумияха опухоли, все в соответствующем архитектурном контексте. Кроме того, клетки, выбранные для инъекций могут быть генетически модифицированы с целью изучения воздействия конкретных нокдаунов, делеции, стучать модули, мутации и т.д. на рост опухоли и выживания.
Ряд публикаций документу опухоли исследования, используя разнообразные внутричерепных методов. Ямада и др. Сделал детальное изучение инъекции красителя и от U87 клеток и обнаружили, что минимизация объема и впрыска скорость производится лучшее опухоль 2. . Брукс др нашли превосходную воспроизводимость и эффективность, используя микропроцессорным управлением инжектор, а не ручной метод для доставки вирусных векторов; их выводы относительно оптимальных параметров впрыска применимы к поставке клеток 3. Shankavaram и соавт. Показали, что глиобластомы (GBM) вводили клеточные линии ортотопически (с использованием ручной метод) в мозг обобщены профиля экспрессии генов в клinical опухоли более тесно, чем либо в пробирке или SQ ксенотрансплантатах, поддерживая использование внутричерепных моделей для доклинических исследований 4. Джаннини и др. Вводили клетки от хирургических образцов человека, который был выдержан в флангах голых мышей по серийному пассажей в мозги дополнительных мышей, и показали, что этот подход сохранился пациента гена опухоли изменения в модели 5. Подобные результаты были получены Yi соавт 6. Использование стереотаксической установки, тщательно определенный участок инъекции, и медленный и стабильный коэффициент инжекции, они получили воспроизводимые опухолей головного мозга с последовательными темпами роста и высокой (100%) скорости приживления. Справедливость этой техники, поэтому были хорошо известна; Поиск литературы показывает, что применение этого метода весьма обширны. Карти и др. Используется внутричерепные инъекции успешно доставить вирусные векторы, выражающие терапевтических генов в лобной коре transgeniС моделью болезни Альцгеймера 7. Тачи и соавт. Описали использование внутричерепных инъекций для доставки терапевтических онколитического аденовируса, в нейронной носитель на основе стволовых клеток в голых мышей, несущих уже ортотопически инъекционные GBM опухоли 8. Очевидно, внутричерепные инъекции универсальный и эффективный инструмент для доклинических исследований. Ранее публикации в журнале визуализированных экспериментов описывают фундаментальные подходы 9-11, но мы возьмем понятие внутричерепного инъекции опухоли и ортотопического моделирования на более высокий уровень точности, используя простое в мастера технологии.
протокол
Все описанные процедуры были рассмотрены и одобрены нашим институциональной уходу и использованию животных комитета.
1 План Эксперимент
- Выберите ячейки, которые будут введены. Клетки из различных источников являются кандидатами для инъекций: прилипшие линии культур клеток, генетически модифицированные клоны, нейросфера клетки, первичные культуры, или с разбивкой опухоли. Тип модели желаемого определит наиболее подходящий места введения.
- Определение количества клеток для инъекций. Необходимых для формирования опухоли количество клеток меняется в зависимости от клеточной линии и должно быть определено эмпирически; скорость роста опухоли в значительной степени зависит от типа клеток, количества клеток и тканевой культуры числом пассажей. Количество клеток в пределах от 1 х 10 4 до 2 × 10 5 или более на инъекцию дали опухолей различной темпов роста.
- Ограничьте объем для инъекции. Клетки должны быть приостановлены в самом маленьком объеме свободных средств массовой информации в сыворотке или фосфатный буферный сАлина (PBS), что позволяет плавно, легко прохождения через иглу 26 G. Чем меньше объем фактически доставлен в мозг, тем точнее и определяется в результате опухоль; Оптимальные результаты достигаются при инъекционных объемом от 3 до 6 мкл. План подготовить окончательный суммарный объем по крайней мере, 50 мкл суспендированных клеток, независимо от количества инъекций планируемых, чтобы точное измерение, смешивания и отбора проб.
- Выберите подходящий мышей для модели. Мышиные модели опухолей человека обычно используют молодые мышей скомпрометировано иммунной избежать иммунной опосредованного отторжения трансплантата. Это не является необходимым для работы состоится в кабинете биологической безопасности, если соответствующие меры предосторожности, в том числе дезактивации, дезинфекции и стерилизации материалов и оборудования. Работа показано здесь было сделано в бестимусным голых мышей, мужчин и женщин, от 6 до 12-недельного возраста. Мыши, которые весят менее 20 г может быть трудно позиционировать в качествеtereotaxic кадров и могут быть более восприимчивы к гипотермии.
2 Соберите оборудование
- Получите и обеззараживания мышкой стереотаксической рамы, выравнивание консоли и мыши газ анестезии держатель головки, микрошприца насос, тепловой площадку, наркозный аппарат, оптоволоконного работы лампы, и переменной скоростью вращательного бурения. Очистки и обеззараживания все оборудование.
- Программирование параметры впрыска (в том числе объемом впрыска, скорость, единицы измерения скорости, введите шприц течь) и другие переменные, необходимые для работы шприца. Оптимизация настроек для каждого конкретного модели.
ПРИМЕЧАНИЕ: В этих инъекций настройки были 3000 NL образцы в размере 400 Нл / мин (единицы измерения расхода "М") с использованием 25 мкл шприц (Device Type "E") режим в Non-сгруппированы ("N"). - Очистить точности микрошприца с иглой 26 G с нескольких промывок стерильной деионизированной воды (Dih 2 O) и 70% этанола (EtOH), делает окончательный RINSE с DIH 2 O. Некоторые, но не все модели предназначены для стерилизации в автоклаве. Убедитесь, что движение поршень гладкая и бесплатно.
- Получить анестезии доставки оборудования. Изофлюран является предпочтительным анестетик, как это легко регулировать глубину и продолжительность анестезии. Убедитесь, что стереотаксическая Аппарат оснащен приложением мыши анестезии газа и что необходимо трубки и разъемы, чтобы доставить газовую смесь из наркозного аппарата к мыши.
- Автоклав хирургические инструменты, в том числе тонким наконечником ножницы, два пинцета / кровоостанавливающих (с зубами) для наложения швов, средних ножницы, средних и острым концом пинцета, и по крайней мере двух 1 мм стоматологических сверлами. Держите инструменты в чистоте во время процедуры с 70% этанола, дезинфицирующее, или шаровой стерилизатор.
- Получить изофлурана, обезболивающим, глазной мази / смазку, мазь с антибиотиком, физиологический раствор, 30% перекиси водорода (H 2 O 2), антисептическим и кости воск (по желанию) ответеринарный или медицинского снабжения. Подготовьте стерильную DIH 2 O и 70% этанола. Одноразовые такие как марлевые тампоны, стерильные повязки, швов, этанол тампоны, хлопок тампоны, стерильные хирургические перчатки, хирургические инструменты и более числятся в списке материалов. Прекрасный совет перманентный маркер для маркировки череп следует обеззаразить и предназначен для применения в хирургии.
3 Подготовьте клетки для инъекций
- В экспериментах показано здесь, выберите иммортализованной клеточной линии GBM человека. Определить количество клеток (2 х 10 5) и объем суспензии, который будет введен (3 мкл) эмпирически; Детали могут варьироваться в зависимости от типа клеток. Используйте объем не менее 50 мкл для обеспечения точного измерения, смешивание, и инъекции.
- Trypsinize клетки и ресуспендируют в средствах массовой информации или PBS. Выполните следующие действия только перед инъекцией клеток:
- Удалить СМИ из клеток путем аспирации и промыть 10 мл PBS на 100 мм пластины; удалить PBS.
- ОбъявлениеD 1 мл трипсина к каждой пластине 100 мм и инкубируют при комнатной температуре достаточно долго, чтобы дать суспензии отдельных клеток.
- Остановка активности трипсина с 5 мл Дульбекко в модификации Дульбекко (DMEM) + 10% фетальной бычьей сыворотки (FBS), на 100 мм пластины.
- Гранул клетки центрифугированием при 450 мкг в и ресуспендируют в ~ 5 мл сыворотки бесплатно DMEM (SF-DMEM) на 100 мм пластины.
- Количество жизнеспособных клеток с использованием гемацитометра или автоматизированный счетчик клеток.
- Отрегулируйте живой плотность клеток в 2 х 10 5 клеток / 3 мкл (или как определено экспериментальным путем) по гранулирования клетки и ресуспендированием в SF-DMEM.
- Держите клетки охлаждали на льду или чилл упаковке (не позволяют клеткам заморозить). Осторожно перемешать с пальца стряхивая.
4 Обезболить и Подготовьте мышь для хирургии
- Вызвать анестезии с использованием ~ 5% изофлуран (кислород поток ~ 2 л / мин) или в соответствии с указаниями ветеринара. Индукционная займет от 2 до 3 мин. Поддержание мышь на должном глубинеанестезии с ~ 3% изофлуран.
- Проверьте глубину анестезии пальца щепоткой, настроить изофлурана если указано и продолжать следить дыхания и ног ответ щепотку всей процедуры. Обложка мышь с марлевые тампоны для тепла и контролировать мышь регулярно на протяжении всей процедуры, которая может занять 45 минут до 1 часа, в зависимости от скорости введения.
- Поместите мышь в стереотаксической рамы, аккуратно сняв планку нёбо по языку и в рот. Крюк передние резцы в отверстие зуба. Используйте уха баров стабилизировать голову, с поверхности от уха к глазу, как рядом по горизонтали, как это возможно. Не заставляйте баров в ушной канал. Очень важно, чтобы надежно положение головы: проверить движение из стороны в сторону и вверх-вниз мягко подушечками пальцев. Используйте регулируемые элементы управления стереотаксической блока для оптимизации нужным.
- Смажьте глаза глазной мази. Очистите кожу между ушами и глазами в два раза с чередующимися применения в повидон-iodinэ антисептическим и 70% этанола.
- Введите выбранный обезболивающее подкожно (SQ) в фланг (или по указанию).
5 осуществляет литье
- Определите место инъекции. Место инъекции может меняться в зависимости от размера и мышах, и типа клетки. Клетки вводили слишком близко к желудочков могут привести к черепно-мозговой распространение болезни. Клетки вводили слишком мелко может вырасти через траекторией иглы.
Примечание: В экспериментах, показанных здесь, цель была определена как лобной области коры головного мозга на сайт 2,5 мм сбоку (справа), 1,5 мм передней и 3,5 мм вентрально относительно брегмы был выбран (фиг.1), производство средний мозг опухоли у мышей в пределах от 20 до 30 г. - Сделать небольшой надрез длиной (~ 8 мм) с использованием стерильной техники через кожу головы, чтобы обнажить брегмы и места введения. Диагонали вырезать, с точки между осью средней линии и правого глаза в сторону правого уха ( Рисунок 2) позволяет получить доступ как к темени и в месте инъекции.
- Уберите кожу и использовать стерильный ватный тампон, чтобы высушить поверхность черепа. Промокните кость с другой тампоном, смоченным H 2 O 2 визуализировать брегмы. H 2 O 2 будет производить пузырьки кислорода, оставив тонкие линии белой пены вдоль фронтальной и сагиттальной швов, которые пересекаются под брегмы.
- Блокировка пустой шприц с иглой на микронасосу и маневрировать кончик иглы непосредственно над брегмы; набор координат на консоли выравнивания до 0,0 мм бокового, 0.0 мм передней / задней, и 0,0 мм вентральной / спинной.
- Перемещение иглы 2,5 мм бокового (справа) и 1,5 мм передней по отношению к темени (или нужное место), используя ручки управления на стереотаксической блока. Поднимите шприц немного и отметьте точное местоположение на черепе с выделенным фломастером. Если наружная поверхность черепа не находится на уровне плоскости с темени (I.э., спинной / вентральной координат больше не читает нулю), сбросить вентральный / спинной читать на 0,0, чтобы обеспечить, что глубина инъекции не сдвигается.
- Просверлить маленькое отверстие в черепе с помощью ручного роторного бурения, оснащенного стерильной зубной наконечника на соответствующем сайте, отмеченные пера на этапе 5.5. Держите дрель под углом к черепу и очень нежно коснитесь наконечником кости. При необходимости повторите. Бурение почти, но не полностью через кости, в результате чего игла проникает на самом деле этот слой черепа, приводит к чистым инъекции.
- Удалить кости пыль с ватным тампоном, смоченным в PBS или физиологический раствор. Вернуться шприц с насосом и опустить иглу прямо вниз к заусенцев отверстие для подтверждения расположения. Если заусенцев отверстие находится не по центру с иглой, использовать дрель, чтобы увеличить отверстие.
- Аккуратно перемешайте клеточной суспензии и привлечь клетки в шприц, используя контроллер насоса. Избегайте пузырей и комки и вытереть иглы остроумиеч спиртовым тампоном, чтобы удалить загр зн ющих клеток на внешней поверхности. Если шприц / иглу засорен или заморожены, удалить и быстро чистой стерильной водой и 70% этанола.
- Опустите иглу до уровня поверхности черепа (0,0 мм вентральной / спинные). Затем медленно (в течение примерно 1 мин) опустить иглу, чтобы проколоть через всю толщину черепа и проникать в мозг на глубину 4 мм ventrall. Извлеките иглу медленно до 3,5 мм вентральной. Если голова мыши надежно удерживается в стереотаксической блока, не должно быть практически никакого движения черепа.
- Убедитесь, что правильные параметры вводятся в контроллер насоса (раздел 2.2) и нажмите "RUN / STOP" (или по указанию руководства продукта), чтобы autoinject клетки. Монитор мыши и настроить изофлурана если указано. Смотреть шприц и убедитесь, что поршень движется в стволе. Замороженные или забит движение может привести к изогнутой / нарушенной плунжера.
- Подождите 1 до 2 мин с иглой в бдождь, то очень медленно (в течение 3 до 4 мин) вывести иглу из ткани. Общее время, чтобы удалить иглу после инъекции завершается 5 мин. Используйте ватный тампон, чтобы смыть область вокруг заусенцев отверстие; оставить края кожи открытой, чтобы позволить высохнуть кости.
- Удалить шприц из насоса и быстро промыть 3 раза стерильной H 2 O, 3 раза с 70% этанола, и 3x стерильной H 2 O (или по указанию производителя). Протрите иглу этанолом и отложите в сторону.
- Применить стерильный кости воск (эквивалент 1 или 2 мкл) к заусенцев отверстие и использовать деревянную конец стерильной ватной палочкой, чтобы набить воск на и в кости. Если поверхность сушат надлежащим образом, она должна придерживаться.
- Спрэд стерильную салфетку на мыши и окрестностей работы и сшивать разрез; три стежки должны быть достаточными. Кроме того, могут быть использованы хирургические клей. Применить актуальные антибиотик.
- Уменьшите изофлурана до 0% и удалить мышь от стереотаксической блока, составляет сareful защитить зубы. Проверьте уши, рот и язык.
- Монитор мыши тесно следующий инъекции. Место мыши на площадку для термической от 5 до 10 мин; затем передать в клетке (по тепловой площадку) и наблюдать, пока мышь не просыпается и амбулаторно. Не оставляйте без присмотра мыши, пока не восстановил достаточно сознание поддерживать грудины отдохновение. Не вернуться мышь, чтобы компании других животных, пока полностью не восстановился. Рассмотрите возможность использования дополнительного анальгетика, если признаки боли замечены.
6 Отделка и монитор Восстановление & развития опухоли
- Очистите все инструменты и оборудование, использующие 70% этанола, шарик стерилизатор или дезинфицирующее между мышей.
- Контролируйте вводили мышам в течение двух дней после процедуры на наличие признаков боли, инфекции или других осложнений. Введите анальгетик при 24 и 48 ч (или не указано иное) после процедуры. Удалить швов от 7 до 10 дней, при необходимости.
- Оценивать мышей для клинических признаков заболевания, paralysiс, снижение активности, потеря веса, судороги, или общее заболевание.
- Следить за развитие опухоли по соответствующей методике [магнитно-резонансная томография (МРТ), в естественных условиях Imaging Systems (ИВИС), и т.д.].
Результаты
Надежные внутричерепные ксенотрансплантаты могут быть созданы с этой описанной методике. Выявление критических структур черепа мыши (рисунок 1) позволит признания брегмы и направлять следователю точного и воспроизводимого месте инъекции. В этих исследованиях родительскую линию U251, U251 клетки, трансфицированные люциферазы (Luc-U251), или U87 иммортализованные человеческие GBM тканевой культуры клетки суспендировали в 4 до 6 мкл SF-DMEM и вводили 2,5 мм бокового (справа), 1,5 мм кпереди и 3,5 мм вентрально относительно брегмы (рисунок 2).
Полученные опухоли могут быть визуализированы и проанализированы при магнитно-резонансной томографии (МРТ, Рисунок 3), в естественных условиях люминесцентного изображений (ИВИС, рисунок 4), или рутинных грубых методов патологии (H & E окрашивания, рисунок 5). Особое внимание должно быть принято и оптимизация выполняется для определения appropriaт.е клетки и расположение инъекции представлять сроки, темпы роста, и модель опухоли лучшего.

Рис.1 Череп анатомия. Анатомические особенности головы мыши и черепа проиллюстрированы. Брегма, который находится на оси средней линии между глазами и ушами на пересечении короны и сагиттальной швов, используется для воспроизводимо найти координаты инъекций.
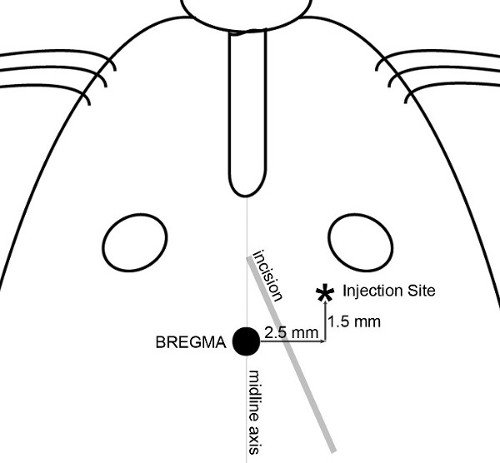
Рисунок 2 Разрез и карты впрыска. Особенности, используемые для определения разрез кожи и точно определить место инъекции проиллюстрированы. Диагонали надрез, чтобы разрешить доступ к темени как и в месте инъекции. Применение 30% H 2 O 2на поверхности черепа позволяет визуализировать черепа швов. Расположите шприц с иглой на микронасосу и маневрировать кончик иглы непосредственно над брегмы. Набор координаты на выравнивание консоли к нулю; все измерения черепа затем воспроизводимо сделал по отношению к темени.
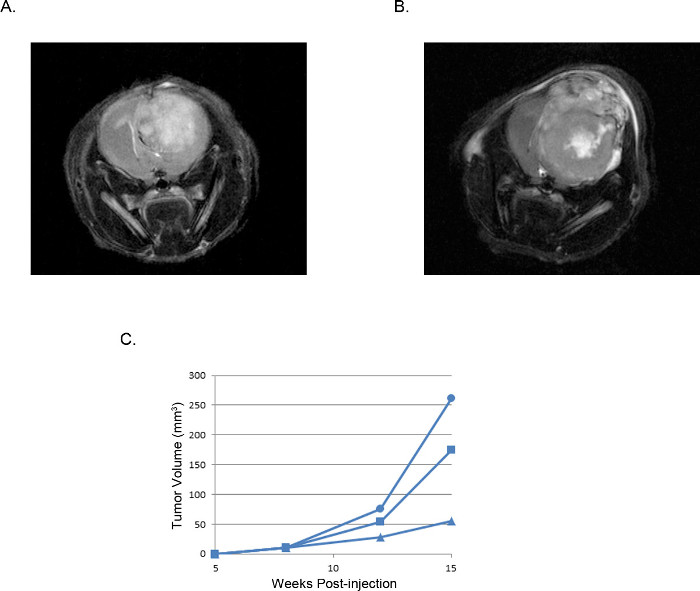
Рисунок 3 Представительства внутричерепные опухоли ксенотрансплантатов: МРТ МРТ T2 взвешенных изображениях из опухоли, полученной из (А) 2 х 10 5 U87 клеток по сравнению с опухолью, полученной из (B) 2 х 10 5 U251 клеток.. Объемы (С) опухоли, рассчитанным с МРТ изображений трех отдельных мышей, которым вводили клетки U251, построенных с течением времени показывает, воспроизводимый окно развитию опухоли и роста, который соответствует во всех экспериментах.
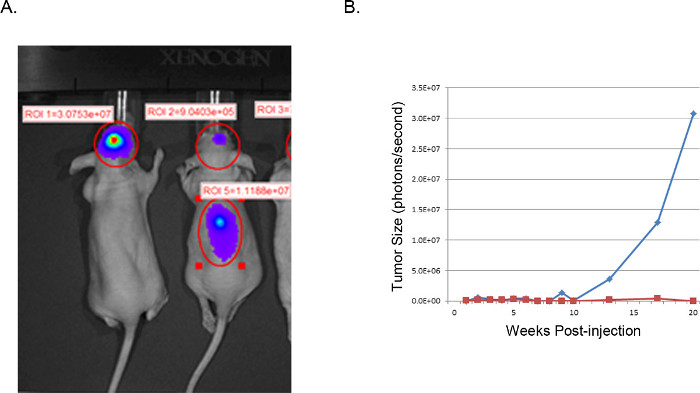
Рисунок 4 Представительства ксенотрансплантатов опухоли: ИВИС изображения. IVIS образ U251-люциферазы трансдуцировали GBM клетки инъекционные интракраниально в голых мышей (A). Мышь слева успешно вводили, как описано с U251-Luc клеток и показывает очень сильную сконцентрированные сигнала (фотон / с) в нужное место. Мышь справа демонстрирует неудачную результат с неправильным расположением впрыска. Н & Е исследование позвоночника показала рост опухолевых клеток в позвоночнике в результате инъекции слишком близко к средней линии с распространением желудочка. (В) Размер опухоли оценивают по активности люциферазы (фотон / второй) в области головного мозга, представляющего интерес, построенные с течением времени. Синяя линия соответствует мыши с успешной внутричерепного инъекции, в то время как красная линия соответствует мыши с опухолевых клеток смещения к позвоночнику.
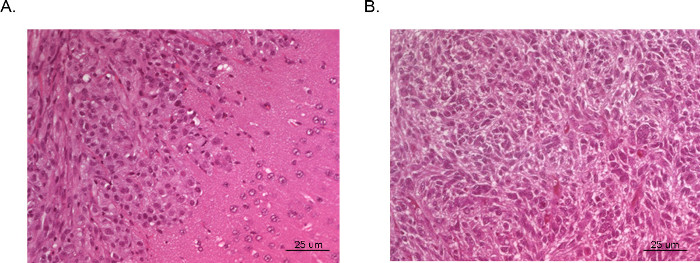
Рисунок 5 H & E внутричерепного ксенотрансплантатных опухолей. Целые мозги были собраны из мышей размещать жертву и фиксировали в формалине, установленный в парафин, срезы и окрашивали H & E. Опухоль () была получена из U87 GBM клеток и иллюстрирует область плотного опухолевого роста (левый верхний угол) и с нормальной мозговой ткани с микроскопической вторжения злокачественных клеток (правый нижний угол). Опухоль (B) был взят из секции центре опухоли, полученной из U251 GBM клеток. Раздел очень тесно повторяет странное гистопатологию с многоядерными злокачественных клеток видели в типичной человеческой GBM.
Обсуждение
Ортотопическая мышиные модели человеческого рака мозга может стать отличным инструментом для оценки эффективности клинической терапии, но необходимо позаботиться, чтобы оптимизировать размещение клеток в ткани головного мозга. Исследования показали, что избыток объема аликвотные, неоптимальным техника инъекций и поспешные скорости закачки может привести к негерметичности и появлением опухолевых клеток в нежелательных местах (желудочки, спинного мозга, экстрадуральных регионах, и т.д..) И высокой изменчивости размера опухоли 2 (личные наблюдения ). Анализ микропроцессорным приводом доставки Неклеточные образцов показало, что использование микронасосу производится более сконцентрированные доставку, меньше образца рефлюкса и меньше изменчивость, чем ручные методы инъекции, приписываемых гладкой, однородной доставки и последовательных давления 3. Хотя это может быть сложным для конденсации необходимое количество клеток в объеме только 2 или 4 мкл, использование стереотаксической приборной и выравнивание консоли эквuipped с программируемой микро-насос может дать воспроизводимые и надежные опухоли с аналогичными темпами роста. Модель ксенотрансплантат никогда не может по-настоящему дублировать микросреду, возникновение и развитие в природе опухоли, особенно с иммунодефицитных хозяев, но хорошо разработаны и реализованы ортотопическая модель является лучшей альтернативой и намного превосходит внематочной модели.
Основным преимуществом этого протокола является установление обнаруживаемых опухолей в согласованном времени. Выбор времени появления опухоли зависит от типа клеток и количество клеток, инъецированных, но достаточно предсказуемыми, и большинство опухолей устанавливаются в пределах узкого окна времени по отношению к длительности роста опухоли (т.е., время до конечной точки). Это позволяет исследователю определить временные точки для сбора данных (например, МРТ или ИВИС) или вмешательства (такие как медикаментозное лечение). Темпы роста опухоли зависит от типа клеток, число клеток вводили, и фром мышь для мыши (сколько они делают у больных людей), но согласуются от эксперимента к эксперименту.
Хотя этот протокол использует технику, которая может потребовать больше средств и времени, чем менее точных ручных методов инъекции и не могут быть применимы к крупномасштабным исследований, методы внутричерепных инъекций, позволяющих пропускной большого числа животных (например, что описанные Ивами и др. 12) по определению связаны быстрый, впрыска высокого давления и часто связаны с ручной приборов и ручное измерение, которые подлежат неустойчивости и неопределенности. Эти факторы могут быть связаны с утечки и за пределами целевой доставки 2,3. Точность, воспроизводимость и низкая смертность от этой процедуры позволит следователь проектировать эксперименты по лечению с использованием меньшего количества мышей, чтобы получить статистически значимые результаты - чистые сбережения.
Один шаг имеет решающее значение дляУспех имплантации опухоли: точное местоположение инъекции. Клетки вводили слишком близко к желудочков могут привести к CSF распространение болезни через желудочковой системы или в экстракраниального регионах. Клетки вводили слишком мелко может вырасти через траекторией иглы. Заранее координаты имеют мало значения, если размещение иглы неаккуратно. Найдите время, чтобы надежно положение головы мыши в стереотаксической блока. Используйте стереотаксические возможности настройки и уха бары, чтобы соответствовать оборудование для мыши, и убедитесь, что голова стабильно позиционируется и не будет качать или поворот во время процедуры. Изменения или изменения, если место инъекции может повлиять характеристики опухоли, в том числе взять опухоли, роста, инвазии, и доступ к доставки лекарств и подачи кислорода.
Другие параметры, которые имеют огромное влияние на полученной опухоли включают скорость впрыска, количество клеток и объем; все они должны быть определены эмпирически. Сведите к минимуму объем для количесR клеток, необходимых для роста опухоли; использовать самый низкий показатель впрыска практическую. Число клеток и число отрывок также оказывают значительное воздействие на дубля опухоли и скорости роста. Специальное оборудование используется здесь, обеспечивают более совершенный контроль, но понятия минимального объема, точного нацеливания, минимальной и последовательной скорости впрыска, и медленного вывода иглы могут быть применены к различным методам (в том числе ручной инъекции) и различных инструментов.
Эта процедура является открытым для различных модификаций: Место инъекции может быть настроен, чтобы резюмировать конкретные типы опухолей. Приверженец культуры тканей клетки, генетически модифицированные клоны, нейросферы, с разбивкой опухоли мыши, или фрагменты ткани человека могут быть привиты в мозг мыши. Эта техника может даже быть адаптированы для неклеточного исследований, в том числе вирусных генов передачи 3. После того, как метод надежно производить опухоли желаемых характеристик установлено, эксперименты сравнения Эффитивность лечения, медикаментозного лечения и комбинаций, и другие варианты, такие как перенос генов может быть выполнена.
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Доктор Китинг финансируется DOD грант CA100335 и Фонд Академия Святого Baldrick в.
Материалы
| Name | Company | Catalog Number | Comments |
| Name of Reagent/ Equipment | Company | Catalog Number | Comments/Description |
| Equipment | |||
| Small Animal Stereotaxic Instrument with Digital Display Console. | Kopf | Model 940 | |
| Mouse Gas Anesthesia Head Holder | Kopf | Model 923-B | |
| Mouse Ear Bars | Kopf | Medel 922 | |
| Fiber Optic Illuminator | Fisher | 12-562-36 | |
| UltraMicroPump III | WPI | UMP3 | |
| Micro4 microprocessor | WPI | UMC4 | |
| Variable speed hand-held rotary drill | Dremel | Model 300 | |
| Dental drill bit, 1.0 mm | Spoelting | 514554 | |
| Adaptor for dental drill bit: 3/32 inch collet | Dremel | 481 | |
| Heating pad | for mice | ||
| Isoflurane vaporizer system | for mice | ||
| Medical tubing and connectors | to connect isoflurane vaporizer with stereotaxic frame | ||
| Instruments | |||
| Precision 25 ul micro syringe | Hamilton | 7636-01 | Model 702, without needle |
| Microsyringe needles, 26s gauge | Hamilton | 7804-04 | RN, 25 mm point style 2 |
| Fine-tipped scissors (straight, sharp/sharp) | |||
| Medium-sized standard scissors | |||
| Standard serrated forceps | |||
| Serrated hemostats (2) | |||
| Fine-tipped forceps | |||
| Supplies | |||
| Sutures 5-0 vicryl P-3 13 mm (Ethicon) | MWI | J463G | |
| Surgical blades #10, stainless (Feather) | Fisher | 296#10 | |
| Isoflurane (Fluriso) | VetOne | NDC 13985-528-60 | Item #502017. Liquid inhalation anesthetic. federal law restricts this drug to use by or on the order of a licensed veterinarian. |
| Carprofen (Rimadyl Injectable 50 mg/mL) | Pfizer | NDC 61106-8507-01 | dilute in saline |
| Ophthalmic ointment (artificial tears) | Rugby | NDC 0536-6550-91 | |
| Topical antibiotic (AK-Poly-Bac ) | Akorn | NDC 17478-238-35 | |
| Povidone-iodine topical antiseptic, 10% (Betadine) | Betadine | NDC 67618-150-04 | |
| Hydrogen Peroxide, 30% | Fisher | H325-100 | for visualizing skull landmarks |
| Sterile saline | VetOne | NDC 13985-807-25 | for diluting solutions, cleaning tissue |
| Bone wax | WPI | Item #501771 | |
| Sterile drapes | McKesson | 25-517 | |
| Sterile surgical gloves | McKesson | (to fit) | |
| Sterile gauze pads, 2 x 2 | Fisherbrand | 22028556 | |
| Sterile gauze pads, 4 x 4 | Fisherbrand | 22-415-469 | |
| Alcohol prep pads (medium) | PDI | B603 | |
| Sterile cotton-tipped applicators | Fisherbrand | 23-400-114 | |
| Sterile 0.5 ml screw cap tube with caps for cells | USA Scientific | 1405-4700 | for cells |
| Individually wrapped sterile dispo pipettes | Fisher | BD 357575 | for needle cleaning solutions |
| BD insulin syringes with needles | Fisher | 329461 | for analgesic |
| 70% ethanol | for cleaning | ||
| Sterile di H2O | for cleaning | ||
| Microfuge tubes for cleaning solutions | for needle cleaning solutions | ||
| Felt tip pen (dedicated) | for marking skull |
Ссылки
- Heyer, J., Kwong, L. N., Lowe, S. W., Chin, L. Non-germline genetically engineered mouse models for translational cancer research. Nature reviews. Cancer. 10, 470-480 (2010).
- Yamada, S., et al. A method to accurately inject tumor cells into the caudate/putamen nuclei of the mouse brain. The Tokai journal of experimental and clinical medicine. 29, 167-173 (2004).
- Brooks, A. I., et al. Reproducible and efficient murine CNS gene delivery using a microprocessor-controlled injector. Journal of neuroscience. 80, 137-147 (1998).
- Shankavaram, U. T., et al. Molecular profiling indicates orthotopic xenograft of glioma cell lines simulate a subclass of human glioblastoma. Journal of cellular and molecular medicine. 16, 545-554 (2012).
- Giannini, C., et al. Patient tumor EGFR and PDGFRA gene amplifications retained in an invasive intracranial xenograft model of glioblastoma multiforme. Neuro-oncology. 7, 164-176 (2005).
- Yi, D., Hua, T. X., Lin, H. Y. EGFR gene overexpression retained in an invasive xenograft model by solid orthotopic transplantation of human glioblastoma multiforme into nude mice. Cancer investigation. 29, 229-239 (2011).
- Carty, N., et al. Intracranial injection of AAV expressing NEP but not IDE reduces amyloid pathology in APP+PS1 transgenic mice. PLos ONE. 8, e59626 (2013).
- Thaci, B., et al. Pharmacokinetic study of neural stem cell-based cell carrier for oncolytic virotherapy: targeted delivery of the therapeutic payload in an orthotopic brain tumor model. Cancer gene therapy. 19, 431-442 (2012).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. J. Vis. Exp. (41), (2010).
- Valadez, J. G., Sarangi, A., Lundberg, C. J., Cooper, M. K. Primary orthotopic glioma xenografts recapitulate infiltrative growth and isocitrate dehydrogenase I mutation. J. Vis. Exp. (83), (2014).
- Baumann, B. C., Dorsey, J. F., Benci, J. L., Joh, D. Y., Kao, G. D. Stereotactic intracranial implantation and in vivo bioluminescent imaging of tumor xenografts in a mouse model system of glioblastoma multiforme. J. Vis. Exp. (67), (2012).
- Iwami, K., et al. A novel method of intracranial injection via the postglenoid foramen for brain tumor mouse models. Journal of neurosurgery. 116, 630-635 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены